1.本发明属于固定化领域及酶工程技术领域,具体涉及一种醇脱氢酶-无机杂化纳米花及其制备方法和应用。
背景技术:
2.氧化还原酶广泛应用于催化制备手性醇、羟基酸、氨基酸等方面。大多数的氧化还原酶催化反应都需要辅酶,在其所需辅酶中,nad(p)
-nad(p)h体系占90%左右。但这些辅酶价格昂贵,推高了这类氧化还原反应的成本,限制了其实际应用,因此除了要有合适的氧化还原酶和反应工程技术外,还必须提供高效、低成本的辅酶再生系统。
3.解决辅酶再生的方法有化学法、电化学法、光化学法和酶法。其中酶法再生系统由于具有反应速率快、选择性高、再生体系与合成体系兼容性好等优点,受到了广泛重视.在酶法再生系统中用的最多的酶是脱氢酶,其次有氧化酶、氢化酶等。醇脱氢酶(alcohol dehydrogenase,adhs;ec 1.1.1.2)是一种以还原型烟酰胺腺嘌呤二核苷酸(磷酸)nad(p)h为辅酶,并可逆催化伯醇或仲醇发生氧化反应生成相应的醛或酮化合物,具有广泛的底物特异性。该酶的来源十分广泛,其中来源于金黄色杆菌(chryseobacterium sp.ca49)的醇脱氢酶/酮还原酶chkred20,以价格低廉的异丙醇作为共底物进行反应时,具有良好的活性和立体选择性,且在有机溶剂(异丙醇、乙腈、丙酮、苯乙酮)中均具有良好的适应性。利用该醇脱氢酶活性高、底物谱宽、耐有机溶剂性强、对nad
和nadp
活性高等优点,可将其作为构建辅酶再生体系和高价值醇或其它化合物酶法生物转化的理想候选生物催化剂。
4.游离的醇脱氢酶在反应过程中具有稳定性差,与产物难分离,无法回收复用等缺点,使得酶法辅酶再生系统在应用时受到一定限制。传统的商用有机树脂可以用来固定化醇脱氢酶,但在有醇或酮类的反应体系中,有机树脂存在稳定性差,易降解,从而导致固定化酶稳定性差的问题,限制了其应用范围。
技术实现要素:
5.本发明的目的在于提供一种醇脱氢酶-无机杂化纳米花及其制备方法和应用,克服酶法辅酶再生中的醇脱氢酶在醇或酮体系中储存稳定性差、与反应物不易分离,重复利用性差等不足。
6.为达到上述目的,提出以下技术方案:
7.一种醇脱氢酶-无机杂化纳米花的制备方法,包括如下步骤:
8.1)将醇脱氢酶溶液与磷酸缓冲溶液混合;
9.2)加入金属离子无机盐溶液;
10.3)放置在一定温度下孵育;
11.4)收集沉淀后用水洗涤1-3次。
12.进一步地,步骤2)中的金属离子为钙离子、镍离子或锰离子,优选为钙离子。
13.进一步地,步骤1)中醇脱氢酶在磷酸缓冲液中的含量为40-80μg/ml,磷酸缓冲液
的ph值为6.5-8.5。
14.进一步地,步骤2)中金属离子的终浓度为8-12mm。
15.进一步地,步骤3)中的孵育温度为20~30℃,孵育时间为5-24h。
16.进一步地,步骤4)所述的收集沉淀的方法为离心法或过滤法。
17.一种采用上述制备方法制备得到的醇脱氢酶-无机杂化纳米花,所述纳米花以磷酸盐为无机载体,以醇脱氢酶为有机组分。
18.一种醇脱氢酶-无机杂化纳米花的应用,所述应用为醇脱氢酶-无机杂化纳米花在氧化还原反应的辅酶再生系统中的应用,醇脱氢酶-磷酸钙纳米花可以将异丙醇氧化成丙酮,同时催化nad
还原成nadh,或将nadp
还原成nadph,将醇脱氢酶-无机杂化纳米花(adh-hnfs)加入含有异丙醇和nad
的溶液中,然后在温度30-65℃、ph值为8-10的条件下反应。
19.本发明的有益效果如下:
20.1)本发明提供的纳米花固定化酶制备工艺简便,在温和环境中合成,不需要高温、高压和有毒化学试剂等苛刻的制备条件,对设备也无特殊要求,且分离操作简单,成本较低;
21.2)本发明提供的纳米花固定化酶大大提升了醇脱氢酶的反应稳定性,在常用反应温度37℃下,游离酶的活性在9h后急剧下降,21h接近失活,而纳米花固定化酶在24h内活性仅下降了21.4%。
22.3)本发明提供的纳米花固定化酶使醇脱氢酶的储存稳定性显著提升,游离酶在室温(25℃)下贮藏6天后完全失活,而adh-hnfs在相同条件下储存21天后,仍保存62.53%的相对酶活。
23.4)本发明提供的纳米花固定化酶具有较好的循环利用能力,在重复使用第四次时活性才开始降低,在第七次使用后仍有65%的相对酶活。
24.5)本发明提供的纳米花固定化酶提高了醇脱氢酶的利用效率,在37℃条件下,24小时内固定化酶的总酶活力比游离酶高19.8%,在实际应用中,能够在获得高产率的同时减少反应体系中酶的用量,降低成本,更适应工业化生产。
附图说明
25.图1为用不同金属离子制备纳米花的相对酶活和包埋率;
26.图2为不同酶浓度制备adh-hnfs测得的相对酶活和包埋率;
27.图3为不同孵育温度及时间条件下得到的adh-hnfs的相对酶活和包埋率;
28.图4为不同反应ph值对游离醇脱氢酶和adh-hnfs酶活的影响;
29.图5为游离酶和adh-hnfs的ph稳定性验证结果;
30.图6为不同反应温度对游离酶和adh-hnfs酶活的影响;
31.图7为游离酶和adh-hnfs的温度稳定性验证结果;
32.图8为游离酶和adh-hnfs的储存稳定性验证结果;
33.图9为游离酶和adh-hnfs的重复使用稳定性验证结果。
具体实施方式
34.下面结合具体实施例对本发明做进一步详细地说明,但本发明并不限于以下实施
例。所使用的实验方法如无特殊说明,均为常规方法。
35.实施例1:醇脱氢酶的纯化
36.(1)醇脱氢酶的获取:
37.a.将异源表达金黄杆菌醇脱氢酶chkred20的大肠杆菌菌体收集到离心管中,每1g菌体用5ml磷酸缓冲溶液(50mm,ph=7.4)悬浮,在4℃条件下用低温超高压细胞破碎仪裂解细胞,在4℃、12000rpm离心20分钟,上清即为粗酶液。
38.b.在粗酶液中加入一定量饱和硫酸铵溶液,使溶液中硫酸铵饱和度为50%,4℃放置3h,10000rpm离心5min,上清即为经过沉淀法初步纯化的醇脱氢酶液。
39.c.取初步纯化的酶液过0.45μm滤膜,使用葡聚糖凝胶柱对其进行再次纯化。将事先配制好的于4℃保存的磷酸缓冲溶液(ph 7.4,50mm),抽滤后超声去除气泡作为洗脱液。连接葡聚糖凝胶柱、蠕动泵和紫外检测仪(核酸蛋白分析仪),先用大约三倍柱体积的超纯水清洗葡聚糖凝胶柱,再用大约两个柱体积的洗脱液平衡凝胶柱。然后进行蛋白样品上柱,样品上样量为凝胶柱体积的3%,使用紫外检测仪在a280nm下监测洗脱过程。将蠕动泵调至压力0.13mpa,流速0.5ml/min,接目的蛋白洗脱峰,即为醇脱氢酶溶液。
40.d.使用改良型bradford蛋白浓度测定试剂盒按照说明书配制标准蛋白浓度试剂和处理纯化的蛋白样品,然后用酶标仪测定a
595
吸光值,绘制蛋白浓度标准曲线并计算相应的蛋白浓度。
41.包埋率测定方法:
42.包埋率的测定使用bradford法,纳米花固定化完成后,离心取上清20μl加入到酶标条中,再加200μl考马斯亮蓝溶液混匀,室温下静置5分钟后,在波长595nm下测量吸光值,通过代入在相同方法及条件下测得的牛血清蛋白标准曲线可得到上清蛋白浓度,进而计算出固定化酶的包埋率。
43.包埋率计算公式:
44.式中e-包埋率
45.c
r-总蛋白浓度
46.c
s-上清蛋白浓度
47.酶活测定方法:
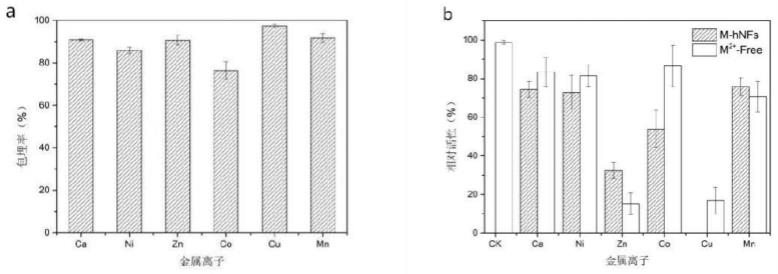
48.在参与反应的物质中,nadh在波长340nm处有强吸收峰,而在该波长下,反应体系中的其他物质都是没有吸收。因此可以通过检测反应体系中产物nadh的变化量来确定醇脱氢酶的酶活。
49.将nad
和异丙醇在甘氨酸-氢氧化钠缓冲溶液(50mm,ph=10)中充分混匀,配制成终浓度8mm nad
和10%异丙醇的底物预混溶液。将底物预混溶液在37℃的酶标仪中预热3分钟后,加入适量酶进行反应,保持反应温度为37℃,检测反应5min内a
340nm
吸光值的变化,每组实验做三组平行。将吸光值变化值代入nadh标准曲线中就可得到产物nadh的浓度。
50.比活力计算公式:
51.式中s-比活力(u/g)
52.c-产物浓度(mol/l)
53.v-反应体系体积(l)
54.m-酶量(g)
55.t-反应时间(min)
56.实施例2:
57.1)所用试剂的配制:
58.a.取2.22g无水氯化钙加水定容至100ml,配制出浓度为200mm的钙离子溶液。
59.b.称量8g的nacl、0.2g的kcl、1.44g的na2hpo4、0.28g的kh2po4,溶于800ml水中,调节ph为7.4后,定容至1l,配制出浓度为10mm的磷酸缓冲溶液。
60.2)固定化酶的初步制备
61.先将100μl酶溶液(0.12mg/ml)溶于1.85ml磷酸缓冲液中,再滴加50μl金属离子溶液,摇匀,孵育3小时后离心,收集沉淀,加去离子水洗涤后再次离心得醇脱氢酶-磷酸盐杂化纳米花。
62.醇脱氢酶-磷酸钙杂化纳米花制备过程技术条件的筛选
63.实施例3:磷酸盐晶体的种类对杂化纳米花的活性及包埋率的影响
64.将实施例2步骤1)中的钙离子依次替换为如下五种金属离子(ni
2
、zn
2
、co
2
、cu
2
、mn
2
),分别按上述相同条件制备出不同载体附载的醇脱氢酶杂化纳米花,按包埋率及酶活测定方法,测定并考察其活性及包埋率,以寻求最佳载体,包埋率如图1a所示,各金属磷酸盐载体的包埋能力cu-hnfs>ca-hnfs=zn-hnfs=mn-hnfs>ni-hnfs>co-hnfs,在该制备条件下铜、钙、锌及锰纳米花的包埋率均达到90%以上,活性如图1b所示,对照组为含有等浓度金属离子的游离酶活性,ck为游离酶原始活性,各金属离子对醇脱氢酶都有不同程度的活性抑制,不同金属纳米花之间活性mn-hnfs>ca-hnfs>ni-hnfs>co-hnfs>zn-hnfs。综合包埋率及活性,ca-hnfs、mn-hnfs、ni-hnfs都是合适的选择,但mn-hnfs和ni-hnfs在洗涤过程中,使用bradford法检测到洗涤液中有部分游离酶从载体上逸出,说明mn-hnfs和ni-hnfs对酶的附载不够牢固,优选地,hnfs-api的最佳载体为磷酸钙。
65.实施例4:醇脱氢酶酶浓度对制备出的杂化纳米花的影响
66.按照实施例2的操作,控制其他条件不变,考察制备固定化酶时酶浓度不同对所得纳米花的酶活及包埋率的影响。将醇脱氢酶溶于磷酸缓冲溶液中(10mm,ph=7.4),调节酶量,使醇脱氢酶在制备体系中的终浓度分别为40μg/ml、60μg/ml、80μg/ml、100μg/ml、120μg/ml,混匀后滴加氯化钙(终浓度为10mm),在25℃条件下孵育5h后,在9000rpm下离心2分钟,取上清按包埋率测定方法测定包埋率,结果如图2a,收集沉淀用去离子水洗涤后即为纳米花固定化酶,分别取等酶量上述固定化酶,按测活方法测定酶活力,结果如图2b,从图2中可以看出,各条件下包埋率均趋于百分之百,酶活随酶浓度上升有下降趋势,因此,本发明选择的适合浓度为40-80μg/ml,优选地,hnfs-api的最佳浓度为40μg/ml。
67.实施例5:孵育温度及时间对杂化纳米花合成的影响
68.按照实施例2的操作,控制其他条件不变,考察制备固定化酶时不同温度及制备时间对所得纳米花的酶活及包埋率的影响,将醇脱氢酶溶于磷酸缓冲溶液中(10mm,ph=7.4),调节酶量使醇脱氢酶在制备体系中的终浓度为60μg/ml,混匀后滴加氯化钙(终浓度为10mm),分别在4℃和25℃条件下孵育1h、2h、3h、5h、9h、16h、24h后,在9000rpm下离心2分钟,取上清按包埋率测定方法测定包埋率,结果如图3a,收集沉淀用去离子水洗涤后即为纳
米花固定化酶,分别取等酶量上述固定化酶,按测活方法测定酶活力,结果如图3b,定义最高酶活为100%,从图3可得,孵育三小时以后包埋率均趋于百分百;酶活随孵育时间增加而提高,5h以后活性趋于稳定;25℃孵育活性高于4℃,因此,本发明选择的适合孵育时间为5h-24h,孵育温度为25℃。
69.实施例6:醇脱氢酶-磷酸钙杂化纳米花制备
70.取50μl醇脱氢酶(1.2mg/ml)加入900μl磷酸缓冲溶液中(pbs,10mm,ph=7.4),混匀后加入50μl氯化钙溶液(200mm),将该混合溶液在25℃条件下孵育5h后,在9000rpm下离心2分钟,收集沉淀用去离子水洗涤,去除上清所得沉淀即为醇脱氢酶-无机杂化纳米花,实施例7中用于各项酶学性质研究的hnfs-api,均使用本实施例的方法制备。
71.实施例7:醇脱氢酶-磷酸钙杂化纳米花酶学性质的研究
72.(1)反应ph值对adh-hnfs酶活的影响
73.本实例以游离状态的醇脱氢酶为对照,研究在不同反应ph值下纳米花的相对活性,配制ph值分别为6、7、8、9、10、11的缓冲溶液(ph6-8:50mm的tris-hcl缓冲溶液、ph9-11:50mm的甘氨酸-naoh缓冲溶液),将nad
和异丙醇在各ph缓冲溶液中充分混匀,配制成含终浓度8mm nad
和10%异丙醇的梯度ph底物预混溶液,取等量蛋白的游离酶与固定化酶,在37℃下分别与ph梯度底物预混液反应5min,检测a
340nm
吸光值的变化,每个实验做三组平行,计算酶活力,结果如图4所示,二者在不同ph反应体系中,活性变化趋势一致,在ph6-10范围内,均能维持较好的活性,ph值为10时,游离酶与固定化酶均呈现最佳的活性。
74.(2)adh-hnfs的ph稳定性
75.通过将游离酶和纳米花在不同ph缓冲溶液中孵育,评估它们的ph稳定性。在37℃下,将等量游离态酶与adh-hnfs分别置于ph为6、7、8、9、10、11的缓冲液中孵育10小时,配制底物预混溶液(8mmnad
,10%异丙醇,50mm甘氨酸-naoh缓冲溶液,ph=10),取等量蛋白的游离酶与固定化酶,加入底物预混溶液,保持反应温度为37℃,检测反应5min内a
340nm
吸光值的变化。每个实验做三组平行,计算酶活力,定义酶活最高组为100%,以相对酶活做出酶活曲线,结果如图5所示,不同ph值对游离酶和固定化酶的影响不大,但游离酶的稳定性低于纳米花固定化酶。
76.(3)反应温度对adh-hnfs酶活的影响
77.本实施例探讨了反应温度25-65℃对杂化纳米花和游离酶的相对活性的影响情况。配制底物预混溶液(8mmnad
,10%异丙醇,50mm甘氨酸-naoh缓冲溶液,ph=10),分别在25℃、35℃、45℃、55℃、60℃、65℃下预热3分钟后,取等量蛋白的游离酶和固定化酶分别在相应温度下与底物预混液充分混合进行反应,检测反应5min内a
340nm
吸光值的变化,每个实验做三组平行,计算酶活力,结果如图6所示,纳米花和游离酶的活性均随温度的升高而升高,在高温条件下两者活性差距较小。
78.(4)adh-hnfs的温度稳定性
79.本实例以游离态酶为对照,评估adh-hnfs的温度稳定性。将等量纳米花固定化酶和游离态酶分别置于磷酸缓冲溶液(10mm,ph=7.4)中,37℃下孵育24小时,每隔3小时取出等量蛋白的游离酶与固定化酶加入底物预混溶液(8mmnad
,10%异丙醇,50mm甘氨酸-naoh缓冲溶液,ph=10)在37℃下进行反应,检测5分钟内a
340nm
吸光值的变化,每个实验做三组平行,测定酶活,定义最高酶活为100%,做酶活曲线,结果如图7所示,游离酶活性在9小时后
急剧下降,21小时接近失活,而纳米花固定化酶在24小时内活性仅下降了21.4%。在该条件下,24小时内游离态醇脱氢酶的总比活力为82792.163u/g,纳米花固定化酶的总比活力为103245.69u/g,相较于游离态酶的总比活力,固定化酶要高出19.8%。
80.(5)adh-hnfs的储存稳定性
81.本实例以游离态酶为对照,评估adh-hnfs的储存稳定性,将游离酶和纳米花在室温(25℃)条件下储存21天,每隔3天各取等量蛋白的游离酶与固定化酶按测活方法测定酶活,定义最高酶活为100%,做酶活曲线,结果如图8所示,游离酶在储存五天后活性仅剩23.3%,第六天完全失活,而纳米花在经过21天的储存后,活性仅由最初的80%降至62.53%。因此,纳米花固定化酶显著提高了醇脱氢酶的储存稳定性。
82.(6)adh-hnfs的重复使用性
83.良好的循环利用性能够显著降低固定化酶在实际使用过程中的成本。本实例对催化反应完成后的纳米花固定化酶进行多次回收利用,通过考察其活性变化评估固定化酶的重复使用性,分别取等量游离酶和纳米花固定化酶,与底物预混液在37℃反应5min后离心,回收沉淀部分,将上清在a
340nm
测量吸光度,试验做三组平行,计算酶活。沉淀部分为固定化酶,用去离子水洗涤除去残留产物及底物后,再次加入底物预混液,在相同条件下再次进行反应,重复上述步骤7次。结果如图9所示,纳米花在重复使用第四次时活性开始降低,在第七次使用后仍有65%的相对酶活,该结果说明了adh-hnfs具有较好的循环利用能力。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。