1.本发明涉及生物技术领域,具体涉及一种葡萄糖脱氢酶突变体、其制备方法及其应用。
背景技术:
2.葡萄糖脱氢酶(glucose dehydrogenase,gdh)是一类能催化葡萄糖转化为葡萄糖酸内酯的氧化还原酶。该反应中葡萄糖失去电子,传递给了gdh的辅酶或辅基。在其它电子受体存在的情况下,电子可以继续进行传递,以实现gdh的再生gdh来源广泛,种类繁多,根据其辅基的不同可分为三类:1、烟酰胺腺嘌呤二核苷酸依赖的葡萄糖脱氢酶,简称nad-gdh;2、吡咯喹啉醌依赖的葡萄糖脱氢酶,简称pqq-gdh;3、黄素腺嘌呤二核苷酸依赖的葡萄糖脱氢酶,简称fad-gdh。
3.对于糖尿病患者来说日常的血糖检测工作非常重要。目前血糖检测用酶主要有葡萄糖氧化酶(glucose oxidase,god)、己糖激酶(hexokinase,hk)和gdh等多种。普遍采用god来检查血糖,其电子受体是氧气,产生过氧化氢。这使该检测方法受空气中氧分压的影响较大,往往会产生较大的测量误差,副产物过氧化氢也对溶液稳定性有影响。另一种检测方法是hk法,但该法需要与葡萄糖-6-磷酸脱氢酶联用,需要消耗nadp,由于试剂稳定性较差、价格昂贵,因而限制了hk法在临床上的普及。gdh则不存在上述问题,因此被认为是一种优良的血糖监测用酶。
4.在三种gdh中,spqq-gdh底物专一性很差,底物谱太宽;nad-gdh由于辅基结合不牢固,需要不断添加辅基来维持其活性,也不利于血糖检测;而fad-gdh辅基结合紧密不易脱落,因此不管是检测的准确性还是保存的长久性都优其他辅基依赖性gdh。
5.不同来源的野生型的fad-gdh底物专一性有区别,但大都存在有多种底物活性,比如土曲霉来源的fad-gdh除了对d-葡萄糖有催化活性外,对麦芽糖和木糖也有一定的催化活性,如果血液中存在有此类成分,在检测时就会出现假性血糖。
技术实现要素:
6.本发明的目的在于提供一种能提高底物专一性且最大反应速率良好的葡萄糖脱氢酶突变体,具体技术方案如下:
7.一种葡萄糖脱氢酶突变体,该葡萄糖脱氢酶突变体的氨基酸序列如seq id no.4所示。
8.优选的,该葡萄糖脱氢酶突变体的碱基序列如seq id no.3所示。
9.本发明还提供一种上述葡萄糖脱氢酶突变体的制备方法,具体是:将海枣曲霉中位于362位和/或位于428位的酪氨酸进行突变得到。
10.优选的,所述海枣曲霉的genebank编号为:lc307132.1。
11.优选的,将位于362位和/或位于428位的酪氨酸突变为苯丙氨酸。
12.优选的,将位于362位的酪氨酸进行突变过程中采用的引物包括如seq id no.5所
示的正向引物a1以及如seq id no.6所示的反向引物a1。
13.优选的,将位于428位的酪氨酸进行突变过程中采用的引物包括如seq id no.7所示的正向引物b1以及如seq id no.8所示的反向引物b1。
14.本发明还提供一种用于葡萄糖测定的组合物,该组合物包括如上述的葡萄糖脱氢酶突变体。
15.本发明还公开了一种如上述的葡萄糖脱氢酶突变体在血糖检测中的应用。
16.除了上面所描述的目的、特征和优点之外,本发明还有其它的目的、特征和优点。下面将参照图,对本发明作进一步详细的说明。
附图说明
17.构成本技术的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
18.图1是本发明优选实施例1中葡萄糖脱氢酶突变体的sds-page蛋白电泳图。
具体实施方式
19.以下结合附图对本发明的实施例进行详细说明,但是本发明可以根据权利要求限定和覆盖的多种不同方式实施。
20.实施例1:
21.一种葡萄糖脱氢酶突变体,来自于海枣曲霉aspergillus phoenicis且其genebank编号为lc307132.1,其碱基序列如seq id no.1所示,其氨基酸序列如seq id no.2所示:matkmlrsltvfgalstalaapstrlcgpqydyivvgggtsglvvanrlsenpnvsvliieaggsvlnnsnvtdvngyglafgtdidwqyetinqsyagdapqvlragkalsgtsaingmaytraedvqvdawqtignegwtwdslfpyyrksenltaptasqrargatydpsangeegplsvawpdipannltntlnatfqglgvpwtedvnggkmrgfnvypstidytayvredaarayywpiasrpnlhlmldtfvnrlvwknggsqgnataagveitssngtisvigasqeviisagslkspgilelsgignrdilerynisvrvdlptvgenlqdqtnaglgasttpgltgtktvvypnvydvfgndtlavaqsvrrqlkqwanetaqvssgtmkaedlealfqlqydlifkdkitiaeilyypgstssisaqywalmpfarghvhiasadptakpvinpnyykfdwdltsqiavakyvrktfqsaplaniiaeetnpgfeavaangseedwkawlltqyrsnfhpvgtaammpqdkggvvndrltvygtsnvrvvdasvlpfqvcghlvstlyavaerasdlikadsalf。
22.该葡萄糖脱氢酶突变体的碱基序列如seq id no.3所示:
23.1 atggccacca agatgcttcg aagcttgacc gttttcggtg cgctgtcaac ggcccttgca
24.61 gcgccttcca cccgtctctg tggtcctcag tatgactacattgttgttgg tggaggtacc
25.121 agcggtctag tggttgccaa ccgcctctcg gagaacccca acgtgtcggt cctgatcatt
26.181 gaagccggcg gttctgtcct caacaactcc aacgtcacag atgtcaatgg ctacggacta
27.241 gcctttggta ctgacatcga ctggcagtat gagacaatca accagtccta tgccggcgac
28.301 gcacctcagg tgctacgtgc cggaaaggcg ctttcgggca cgagtgccat caacggaatg
29.361 gcatatactc gggccgaaga tgtccaggtc gacgcatggc agaccatcgg taacgaggga
30.421 tggacctggg acagcctgtt cccttactac cggaagagtg agaacctgac tgctcccacc
31.481 gccagtcagc gtgccagagg agccacctac gaccccagtg ccaatgggga ggagggtccg
32.541 ctgtccgtgg cttggcccga cattcccgcc aacaacctca cgaacactct caatgctacc
33.601 ttccaggggc tcggcgtccc atggaccgag gatgtcaacg ggggcaagat gcgtggcttc
34.661 aacgtctacc cttccaccat cgattacacc gcatatgtgc gtgaagatgc cgcccgtgca
35.721 tactattggc ccattgcgtc ccggcccaac ctgcacctga tgcttgatac tttcgtcaac
36.781 cgtcttgtct ggaagaatgg aggatcccag ggcaacgcca ccgctgctgg tgtcgagatt
37.841 acctcttcca atggcactat tagtgtcatc ggagccagcc aagaagtcat tatttctgcc
38.901 ggttcgttga agtcgcccgg tatcctggaa ctctccggta tcggtaaccg ggatatcctg
39.961 gagcggtaca acatttccgt ccgtgtcgat cttcccaccg tcggtgagaa ccttcaggat
40.1021 cagaccaacg cggggctggg tgcttccact acccctggtc tcacaggcac caagacggtg
41.1081 gtgttcccca acgtctatga tgtgtttggc aacgacaccc tggcggtcgc acagtccgtc
42.1141 cgccgtcagc tcaagcaatg ggccaatgaa accgcccagg tgagcagtgg cacaatgaag
43.1201 gccgaggatc tggaagctct cttccagctg cagtatgacc tgatcttcaa ggacaagatc
44.1261 acgatcgccg agatcttgta cttccctggt agcaccagca gcatcagcgc ccagtactgg
45.1321 gctctgatgc cctttgcccg cggccatgtc cacattgcct ctgccgatcc gactgccaag
46.1381 ccggtcatca accccaacta ctacaagttc gactgggatc ttaccagtca aattgcggtg
47.1441 gctaagtacg tccgcaagac gttccagtca gctcccttgg ccaacattat tgccgaggag
48.1501 accaaccctg gctttgaggc cgtggctgcc aacggctcgg aggaggactg gaaggcgtgg
49.1561 ctgctgactc aatatcgttc gaacttccac ccggtcggca ctgctgccat gatgccccag
50.1621 gacaagggcg gtgtggtcaa cgatcgcttg acggtgtacg gcaccagcaa tgtgcgcgtg
51.1681 gtggatgcat ccgtcctccc cttccaggtg tgcggccacc tggtgagcac cctgtacgcg
52.1741 gtggccgagc gggcctctga cctgatcaag gccgactctg ctctctttta a。
53.该葡萄糖脱氢酶突变体的氨基酸序列如seq id no.4所示:
54.matkmlrsltvfgalstalaapstrlcgpqydyivvgggtsglvvanrlsenpnvsvliieaggsvlnnsnvtdvngyglafgtdidwqyetinqsyagdapqvlragkalsgtsaingmaytraedvqvdawqtignegwtwdslfpyyrksenltaptasqrargatydpsangeegplsvawpdipannltntlnatfqglgvpwtedvnggkmrgfnvypstidytayvredaarayywpiasrpnlhlmldtfvnrlvwknggsqgnataagveitssngtisvigasqeviisagslkspgilelsgignrdilerynisvrvdlptvgenlqdqtnaglgasttpgltgtktvvfpnvydvfgndtlavaqsvrrqlkqwanetaqvssgtmkaedlealfqlqydlifkdkitiaeilyfpgstssisaqywalmpfarg
hvhiasadptakpvinpnyykfdwdltsqiavakyvrktfqsaplaniiaeetnpgfeavaangseedwkawlltqyrsnfhpvgtaammpqdkggvvndrltvygtsnvrvvdasvlpfqvcghlvstlyavaerasdlikadsalf。
55.本实施例的葡萄糖脱氢酶突变体是将海枣曲霉中位于362位和428位的酪氨酸进行突变为苯丙氨酸得到。其中,将位于362位的酪氨酸进行突变过程中采用的引物包括如seq id no.5所示的正向引物a1(5
’‑
caagacggtggtgttccccaacgtctatga)以及如seq id no.6所示的反向引物a1(5
’‑
tcatagacgttggggaacaccaccgtctt)。将位于428位的酪氨酸进行突变过程中采用的引物包括如seq id no.7所示的正向引物b1(5
’‑
gagatcttgtacttccctggtagcaccag)以及如seq id no.8所示的反向引物b1(5
’‑
tggtgctaccgaagaagtacaagatct)。
56.具体过程如下:
57.将野生型fad-gdh的碱基序列进行合成,并在5’加入酶切位点ecori序列,在3’端键入noti序列,用来克隆;将合成好的序列用ecori和noti双酶切,回收产物;对载体ppic9k进行ecori和noti双酶切,回收酶切产物;
58.测定回收产物浓度,按基因片段比质粒质量6:1配置20ul,加入t4连接酶,16℃水浴连接过夜;连接产物转化至大肠杆菌dh5α感受态细胞,用氨苄青霉素筛选阳性克隆;对阳性克隆测序,测序正确的菌种扩大培养并提取质粒保存;提取得到质粒ppic9k-fad-gdh用saci单酶切使其线性化,回收产物-20℃保存;
59.在ypd培养基中培养单克隆的毕赤酵母gs115,使其od600达到1.3~1.8,用预冷的无菌水清洗三次,用遇冷的1m山梨醇溶液清洗一到两次,分装为100ul管,保存在-80℃冰箱中备用;取100ul制备好的gs115感受态细胞,加入10~20ug线性化dna,冰上静置5分钟后电转化,条件为1500v电压、400ω电阻、25uf电容、电击时间10ms;立即加入遇冷的1m山梨醇溶液,吹打混匀,加入ypd培养基培养1小时;
60.将培养后的菌液涂布于md平板,30℃恒温培养2天,观察菌落生长情况;挑选生长良好的菌落,做菌落pcr鉴定,阳性菌保种;将阳性菌接种到bmgy培养基中,培养过夜,od600达到2~5;离心收集细胞,用bmmy培养基重悬,加入无水甲醇至终浓度0.5%,继续培养;每24小时取一次样,并补加无水甲醇至0.5%,所取样品离心后取上清液,测试酶活性,酶活测定采用dcip法,测定上清液od600吸光度的变化来标定,具体是:反应溶液为2ml:20mm mops缓冲液(ph7.5)、100mm d-葡萄糖、0.6mm pms、0.06mm dcip、10ul酶液;
61.将上述体系加入比色皿,25℃反应,一分钟内还原1umol dcip等于1单位酶活。
62.设计两组引物(第一组:如seq id no.5所示的正向引物a1以及如seq id no.6所示的反向引物a1;第二组:如seq id no.7所示的正向引物b1以及如seq id no.8所示的反向引物b1),采用点突变试剂盒对提取的野生型质粒进行突变,具体是在突变362位的基础上,再突变428位,从而得到双突变株。
63.该葡萄糖脱氢酶突变体的sds-page蛋白电泳图详见图1,其中:1为bsa为0.1%bsa的对照品;阳性对照为购买的标准品fad-gdh;b为未诱导的酵母菌液;y362为仅在362位突变诱导后表达结果;y428f为仅在428位突变诱导后表达结果;y362f y428f为本实施例1中在362位和428位进行双突变诱导后表达结果。由图1可知:单位点突变和双位点突变均可正常可溶性表达,且表达量无明显差异,说明单、双突变都不会影响蛋白的宏观结构。
64.对比例1:
65.与实施例1不同之处在于:
66.萄糖脱氢酶突变体是将海枣曲霉中位于362位和428位的酪氨酸进行突变为缬氨酸得到,其氨基酸序列如seq id no.9:
67.matkmlrsltvfgalstalaapstrlcgpqydyivvgggtsglvvanrlsenpnvsvliieaggsvlnnsnvtdvngyglafgtdidwqyetinqsyagdapqvlragkalsgtsaingmaytraedvqvdawqtignegwtwdslfpyyrksenltaptasqrargatydpsangeegplsvawpdipannltntlnatfqglgvpwtedvnggkmrgfnvypstidytayvredaarayywpiasrpnlhlmldtfvnrlvwknggsqgnataagveitssngtisvigasqeviisagslkspgilelsgignrdilerynisvrvdlptvgenlqdqtnaglgasttpgltgtktvvvpnvydvfgndtlavaqsvrrqlkqwanetaqvssgtmkaedlealfqlqydlifkdkitiaeilyvpgstssisaqywalmpfarghvhiasadptakpvinpnyykfdwdltsqiavakyvrktfqsaplaniiaeetnpgfeavaangseedwkawlltqyrsnfhpvgtaammpqdkggvvndrltvygtsnvrvvdasvlpfqvcghlvstlyavaerasdlikadsalf。
68.其中,将位于362位的酪氨酸进行突变过程中采用的引物包括如seq id no.10所示的正向引物a2(5
’‑
caagacggtggtggtgcccaacgtctatga)以及如seq id no.11所示的反向引物a2(5
’‑
tcatagacgttgggcaccaccaccgtctt)。将位于428位的酪氨酸进行突变过程中采用的引物包括如seq id no.12所示的正向引物b2(5
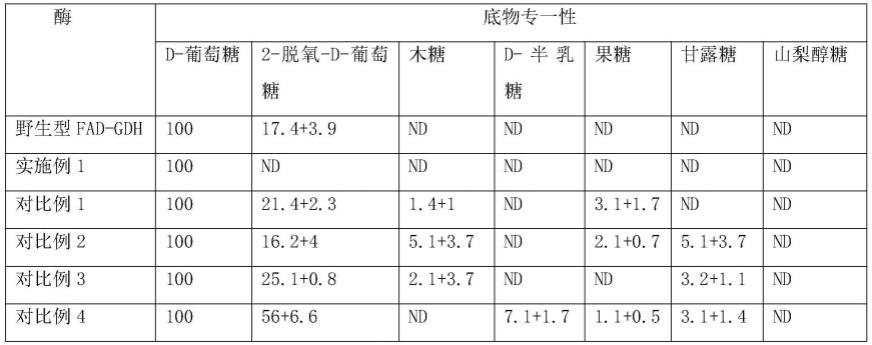
’‑
gagatcttgtacgtgcctggtagcaccag)以及如seq id no.13所示的反向引物b2(5
’‑
tggtgctacccacgaagtacaagatct)。
69.对比例2:
70.与实施例1不同之处在于:萄糖脱氢酶突变体是将海枣曲霉中位于362位和428位的酪氨酸进行突变为精氨酸得到,其氨基酸序列表如seq id no.14:
71.matkmlrsltvfgalstalaapstrlcgpqydyivvgggtsglvvanrlsenpnvsvliieaggsvlnnsnvtdvngyglafgtdidwqyetinqsyagdapqvlragkalsgtsaingmaytraedvqvdawqtignegwtwdslfpyyrksenltaptasqrargatydpsangeegplsvawpdipannltntlnatfqglgvpwtedvnggkmrgfnvypstidytayvredaarayywpiasrpnlhlmldtfvnrlvwknggsqgnataagveitssngtisvigasqeviisagslkspgilelsgignrdilerynisvrvdlptvgenlqdqtnaglgasttpgltgtktvvrpnvydvfgndtlavaqsvrrqlkqwanetaqvssgtmkaedlealfqlqydlifkdkitiaeilyrpgstssisaqywalmpfarghvhiasadptakpvinpnyykfdwdltsqiavakyvrktfqsaplaniiaeetnpgfeavaangseedwkawlltqyrsnfhpvgtaammpqdkggvvndrltvygtsnvrvvdasvlpfqvcghlvstlyavaerasdlikadsalf。
72.其中,将位于362位的酪氨酸进行突变过程中采用的引物包括如seq id no.15所示的正向引物a3(5
’‑
caagacggtggtgcgccccaacgtctatga)以及如seq id no.16所示的反向引物a3(5
’‑
tcatagacgttggggcgcaccaccgtctt)。将位于428位的酪氨酸进行突变过程中采用的引物包括如seq id no.17所示的正向引物b3(5
’‑
gagatcttgtaccgccctggtagcaccag)以及如seq id no.18所示的反向引物b3(5
’‑
tggtgctaccgcggaagtacaagatct)。
73.对比例3:
74.与实施例1不同之处在于:萄糖脱氢酶突变体是将海枣曲霉中位于362位和428位的酪氨酸进行突变为丙氨酸得到,其氨基酸序列如seq id no.19:
75.matkmlrsltvfgalstalaapstrlcgpqydyivvgggtsglvvanrlsenpnvsvliieaggsvlnnsnvtdvngyglafgtdidwqyetinqsyagdapqvlragkalsgtsaingmaytraedvqvdawqtignegwtwdslfpyyrksenltaptasqrargatydpsangeegplsvawpdipannltntlnatfqglgvpwtedvnggkmrgfnvypstidytayvredaarayywpiasrpnlhlmldtfvnrlvwknggsqgnataagveitssngtisvigasqev
iisagslkspgilelsgignrdilerynisvrvdlptvgenlqdqtnaglgasttpgltgtktvvapnvydvfgndtlavaqsvrrqlkqwanetaqvssgtmkaedlealfqlqydlifkdkitiaeilyapgstssisaqywalmpfarghvhiasadptakpvinpnyykfdwdltsqiavakyvrktfqsaplaniiaeetnpgfeavaangseedwkawlltqyrsnfhpvgtaammpqdkggvvndrltvygtsnvrvvdasvlpfqvcghlvstlyavaerasdlikadsalf。
76.其中,将位于362位的酪氨酸进行突变过程中采用的引物包括如seq id no.20所示的正向引物a4(5
’‑
caagacggtggtgcggcccaacgtctatga)以及如seq id no.21所示的反向引物a4(5
’‑
tcatagacgttgggccgcaccaccgtctt)。将位于428位的酪氨酸进行突变过程中采用的引物包括如seq id no.22所示的正向引物b4(5
’‑
gagatcttgtaccggcctggtagcaccag)以及如seq id no.23所示的反向引物b4(5
’‑
tggtgctaccccggaagtacaagatct)。
77.对比例4:
78.与实施例1不同之处在于:萄糖脱氢酶突变体是将海枣曲霉中位于362位和428位的酪氨酸进行突变为亮氨酸得到,其氨基酸序列如seq id no.24:
79.matkmlrsltvfgalstalaapstrlcgpqydyivvgggtsglvvanrlsenpnvsvliieaggsvlnnsnvtdvngyglafgtdidwqyetinqsyagdapqvlragkalsgtsaingmaytraedvqvdawqtignegwtwdslfpyyrksenltaptasqrargatydpsangeegplsvawpdipannltntlnatfqglgvpwtedvnggkmrgfnvypstidytayvredaarayywpiasrpnlhlmldtfvnrlvwknggsqgnataagveitssngtisvigasqeviisagslkspgilelsgignrdilerynisvrvdlptvgenlqdqtnaglgasttpgltgtktvvlpnvydvfgndtlavaqsvrrqlkqwanetaqvssgtmkaedlealfqlqydlifkdkitiaeilylpgstssisaqywalmpfarghvhiasadptakpvinpnyykfdwdltsqiavakyvrktfqsaplaniiaeetnpgfeavaangseedwkawlltqyrsnfhpvgtaammpqdkggvvndrltvygtsnvrvvdasvlpfqvcghlvstlyavaerasdlikadsalf。
80.其中,将位于362位的酪氨酸进行突变过程中采用的引物包括如seq id no.25所示的正向引物a5(5
’‑
caagacggtggtgctgcccaacgtctatga)以及如seq id no.26所示的反向引物a5(5
’‑
tcatagacgttgggcagcaccaccgtctt)。将位于428位的酪氨酸进行突变过程中采用的引物包括如seq id no.27所示的正向引物b5(5
’‑
gagatcttgtacctgcctggtagcaccag)以及如seq id no.28所示的反向引物b5(5
’‑
tggtgctacccaggaagtacaagatct)。
81.将实施例1以及对比例1-4所得葡萄糖脱氢酶突变体还可制作用于葡萄糖测定的组合物以及将上述葡萄糖脱氢酶突变体应用于血糖检测中。
82.对该葡萄糖脱氢酶突变体进行活性测试如表1所示:
83.表1双突变酶活性测试
84.对象活性(u/umol)野生型酶5.38
×
104本实施例1双突变株酶5.16
×
104对比例12.19
×
104对比例23.55
×
104对比例31.38
×
104对比例44.07
×
10485.从表1中可以看出,本实施例所得双突变株酶的反应速率有所下降,但下降不明显,即突变后的酶依然能够保存较高的反应速率。而对比例1-4所得双突变株酶的反应速率下降幅度大,原因在于对比例1-4中分别采用缬氨酸、精氨酸、丙氨酸或亮氨酸来进行替换
的氨基酸的空间结构与酪氨酸、苯丙氨酸差异较大,影响了底物与活性中心的结合以及底物与fad分子的电子传递效果。
86.将野生型fad-gdh、实施例1以及对比例1-4的葡萄糖脱氢酶突变体进行底物专一性测试详见表2。
87.表2底物专一性测试结构
[0088][0089]
其中nd代表未检测到。
[0090]
从表2中可以看出本实施例所得葡萄糖脱氢酶突变体与野生型相比较,其底物专一性有明显提高,其原理是采用本发明的手段(独特的引物结合独特的苯丙氨酸)进行突变后,突变位结构采用更为疏水的苯丙氨酸,从而限制非葡萄糖底物的结合,进而达到提高底物专一性的目的。将突变位的结构采用其他的氨基酸,在不能彻底限制非葡萄糖底物的结合的情况下,还可能衍生出对某些葡萄糖底物的结合具有促进作用,从而使得葡萄糖脱氢酶突变体与其他大量的非葡萄糖底物进行结合,从而影响其底物专一性。
[0091]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。