水稻抗菌蛋白antib-1及其应用
技术领域
1.本发明属于农业生物工程领域,本发明涉及一种水稻抗菌蛋白antib-1及其应用。
背景技术:
2.稻瘟病是危害水稻安全生产的最具有破坏性的真菌病害。化学农药具有杀菌效果明显等优点,常被作为第一选择在农业生产上进行稻瘟病防治,但对生态环境安全具有潜在不利影响。利用抗性基因培育和推广抗病水稻品种是当前农业生产防控稻瘟病的重要途径。然而,抗病基因随着抗性品种的大面积推广,在3-5年后易于丧失抗性。迫切需求安全高效持久的稻瘟病防控技术。
3.生物农药作为一类以天然产物或蛋白作为有效成分的非化学合成农药,与化学农药相比具有选择性强,对人畜无害、易降解、低毒或无毒以及不易产生抗扰性等特点,成为解决化学农药负面问题的重要途径和农药产业发展的新方向。在绿色农业发展新形势下,植物抗菌蛋白在病害绿色防控中的作用逐渐凸显出来。在棉花、黄瓜、银杏等的外源抗菌蛋白编码基因转入水稻中抗菌效果有报道,且在体外对多种病原菌显示出广谱抗性。但是,来源于水稻的内源抗菌蛋白被报道研究较为稀少,具有巨大的潜在开发利用价值。植物抗菌蛋白由于其独特的杀菌机制,有望成为保护植物免受病原菌为害的新型“抗生素”。本发明,为了研究水稻抗菌蛋白antib-1对稻瘟病菌的杀菌效果,我们通过将抗菌蛋白antib-1基因编码序列克隆到原核表达载体,并对antib-1蛋白进行纯化,并体外验证对稻瘟病菌的抑菌效果。
技术实现要素:
4.本发明的目的是针对现有技术的上述不足,提供一种水稻抗菌蛋白antib-1的应用。
5.本发明的目的可通过以下技术方案实现:
6.水稻antib-1蛋白在制备防治水稻稻瘟病的药剂中的应用。该蛋白的编码序列在genbank中的编号为xm_015779840.2。
7.水稻antib-1蛋白的编码基因在制备防治水稻稻瘟病的药剂中的应用。
8.有益效果:
9.本发明提供了水稻antib-1蛋白在制备防治水稻稻瘟病的药剂中的应用。本发明利用源于水稻自身的抗菌蛋白,对稻瘟病菌的防治具有安全绿色高效等优点。
附图说明
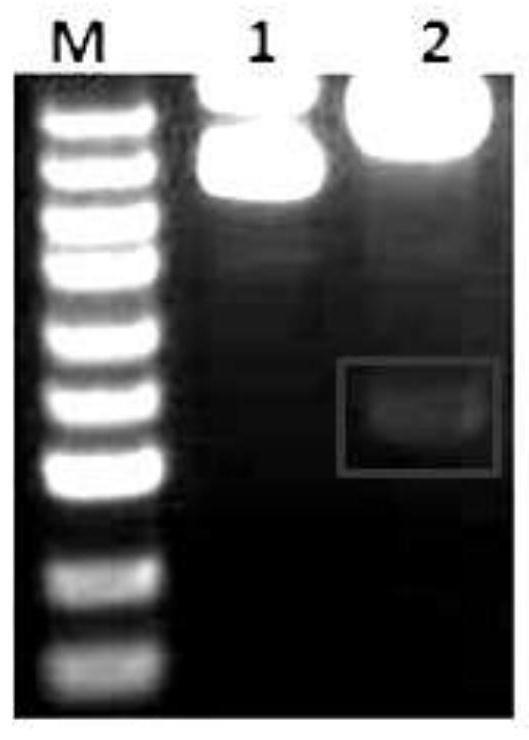
10.图1 antib-1基因酶切鉴定结果
11.marke:100,250,500,750,1000,1500,2000,3000,5000
12.基因名称:(od260/od280:1.81)
13.酶切鉴定:nde i/xba i
14.m:marker;line1:酶切前质粒;line2:酶切后质粒
15.图2 pczn1质粒谱图
16.图3蛋白诱导表达sds-page结果
17.m:protein marker,泳道1:未诱导,泳道2:诱导,泳道3:0.5mm iptg 37度诱导上清;泳道4:0.5mm iptg 37度诱导的沉淀
18.图4 antib-1-his融合蛋白的纯化sds-page结果
19.m:protein marker,泳道1:未纯化,泳道2:流穿,泳道3:洗脱
20.图5体外抑制稻瘟病菌生长
具体实施方式
21.下面实施例中所用方法如无特别说明均为常规方法。
22.实施例1
23.基因克隆与载体构建
24.根据水稻antib-1蛋白编码基因ncbi登录号xm_015779840.2,获得基因编码区序列,并利用引物设计软件oligo 6设计基因编码区全长扩增引物antib-1-f:catatgatggcgcggtgcactttgctcgtt(seq id no:1)和antib-1-r:tctagactactcacgcagcaccacc(seq id no:2),上下游引物分别加酶切位点nde i和xba i(下划线标示)。使用primestar hs dna polymerase(takara,dalian)从粳稻品种苏垦118中扩增基因编码区序列,凝胶电泳并切胶回收目标片段(omega,美国)。对pcr回收产物进行双酶切,操作方法如下:10μl pcr产物,1.0μl nde i,1.0μl xba i,1.0μl buffer,ddh2o补足30μl。37℃,3h后,使用凝胶回收试剂盒(omega,美国)回收目标条带。使用t4连接酶将回收的dna与表达载体pczn1进行连接。获得的重组质粒pczn1-antib-1转入arctic express表达菌株。操作方法如下:将质粒1μl加入100μl感受态细菌中,置冰上20min;42℃热激90sec,迅速置冰中5min;加入600μl lb培养液;37℃,220rpm振摇1h,离心后全部涂布于含50μg/ml amp的lb平板,37℃倒置培养过夜。
25.实施例2
26.2.1 iptg诱导pczn1-antib-1载体融合蛋白的表达
27.2.1.1挑取转化平板上的单克隆接种于含50μg/ml amp的3ml lb培养液的试管中,37℃220rpm振摇过夜;
28.2.1.2次日按1:100接种于50μg/ml amp的30ml lb培养液中,37℃220rpm振摇至菌体od600为0.6-0.8(约2h);
29.2.1.3取出1ml培养物,10000g室温离心2min,弃上清,用100μl 1
×
上样缓冲液重悬菌体沉淀;
30.21.4向剩余的培养物中加入iptg至终浓度为0.5mm,37℃220rpm振摇4h,诱导lwq-his融合蛋白表达;
31.2.1.5取出1ml培养物,12000g室温离心2min,弃上清,用100μl 1
×
上样缓冲液重悬菌体沉淀。
32.2.1.6进行12%sds-page分析。
33.2.2包涵体蛋白的变复性
34.2.2.1将诱导表达后的培养菌液低温离心6000g,10min,菌体沉淀重悬与20ml lysis buffer(20mm tris-hcl containing 1mm pmsf and bacteria protease inhibitor cocktail,ph 8.0),超声破碎(功率400w,工作4sec,间歇8sec,共20min);
35.2.2.2将超声破碎的细胞裂解液4℃10000g离心20min,收集沉淀;
36.2.2.3使用包涵体洗涤液(20mm tris,1mm edta,2m尿素,1m nacl,1%triton x-100,ph8.0)洗涤包涵体3次;
37.2.2.4用溶解缓冲液(20mm tris,5mm dtt,8m尿素ph8.0),按一定比例溶解包涵体,4度放置过夜;室温,15000rpm离心15min;
38.2.2.5将上述溶液滴加20mm tris-hcl 5mm edta buffer ph7.8缓冲液中,逐步成倍梯度稀释缓慢搅拌,将蛋白溶液装入透析袋于pbs ph7.4溶液中透析过夜。
39.2.3融合蛋白的ni柱亲和纯化
40.2.3.1利用低压层析系统,包涵体溶液以0.5ml/min流速上样至ni-ida binding-buffer预平衡的ni-ida
ꢀ‑
sepharose cl-6b亲和层析柱;
41.2.3.2用ni-ida binding-buffer以0.5ml/min流速冲洗,至流出液od280值到达基线;
42.2.3.3用ni-ida washing-buffer(20mm tris-hcl,20mm咪唑,0.15m nacl,ph8.0)以1ml/min流速冲洗,至流出液od280值到达基线;
43.2.3.4用ni-ida elution-buffer(20mm tris-hcl,250mm咪唑,0.15m nacl,ph8.0)以1ml/min流速洗脱目的蛋白,收集流出液;
44.2.3.5上述收集的蛋白溶液加入透析袋中,使用pbs(ph7.4)进行透析过夜;
45.2.3.6进行12%sds-page分析。
46.2.4蛋白表达纯化分析
47.利用iptg诱导蛋白表达,经12%sds-page分析,目标蛋白主要存在于沉淀中。包涵体经过变复性的方式,重溶目标蛋白,通过ni柱亲和纯化获得目标蛋白,进行12%sds-page分析。
48.实施例3抑菌试验方法
49.5ml pda培养基(抑菌蛋白浓度20mmol/l pbs(ph7.2),对照(20mmol/l pbs;含1mol/l nacl 20mmol/l pbs)加入小孔中)灌入150mm培养试管底层。待完全凝固后,在培养基中心位置接种稻瘟病菌,26℃黑暗培养,接种后24、48、72、120小时,观察稻瘟病菌生长情况。结果表明,antib-1蛋白能够显著抑制稻瘟病菌生长(图5)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。