用于神经调制的非侵入性组织位移控制和监测
背景技术:
1.本文公开的主题涉及经由施加神经调制能量来靶向和/或给予受试者中的感兴趣的区域以引起靶向生理结果的技术。特别地,所公开的技术可以监测和/或控制作为神经调制治疗的结果的超声诱导的组织位移。
2.神经调制已经用于治疗各种临床病况。例如,在沿脊髓的不同位置的电刺激已经用于治疗慢性背痛。然而,将电极定位在靶向神经处或附近是有挑战性的。例如,这样的技术可以涉及递送能量的电极的外科手术放置。此外,经由神经调制的特定组织靶向是具有挑战性的。位于某些靶向神经处或附近的电极通过触发神经纤维中的动作电位来介导神经调制,这进而导致神经递质在神经突触处释放以及与下一神经的突触通信。这样的传播可能导致比期望的相对更大或更分散的生理作用,因为植入电极的当前实施一次刺激许多神经或轴突。因为神经通路是复杂且互连的,更具选择性和靶向调制作用可能在临床上更有用。然而,考虑到患者解剖学和临床响应的个体可变性,识别将能量递送至期望的感兴趣的区域并引起期望的生理结果的有效能量施加参数是复杂的。
技术实现要素:
3.所公开的实施方案不旨在限制所要求保护的主题的范围,而是这些实施方案仅旨在提供可能的实施方案的简要概述。实际上,本公开可以涵盖可以与下面阐述的实施方案类似或不同的多种形式。
4.在一个实施方案中,提供了神经调制递送系统,所述系统包括能量施加装置,其被配置为将神经调制能量递送至受试者中的内部组织的感兴趣的区域。所述系统还包括控制器,其被配置为控制经由所述能量施加装置向所述感兴趣的区域施加所述神经调制能量以向其递送一定剂量的所述神经调制能量;在施加所述神经调制能量期间和/或之后接收所述感兴趣的区域的图像数据;识别所述受试者中的感兴趣的分子相对于在施加所述神经调制能量时或之前获取的基线的变化作为施加所述神经调制能量的结果;和确定与所述感兴趣的分子的所述变化相关联的所述感兴趣的区域的组织位移,其中基于所述图像数据确定所述组织位移。
5.在一个实施方案中,提供了神经调制递送系统,所述系统包括超声探头,其被配置为经由治疗传感器将神经调制能量递送至受试者中的内部组织的感兴趣的区域,并且经由成像传感器获取所述感兴趣的区域的图像数据。所述系统还包括控制器,其被配置为控制经由所述超声探头的所述治疗传感器向所述感兴趣的区域施加所述神经调制能量以向其递送一定剂量的所述神经调制能量,其中在控制参数下控制所述治疗传感器;接收在施加所述神经调制能量期间由所述超声探头的所述成像传感器获取的所述感兴趣的区域的图像数据;基于所述图像数据确定在施加所述神经调制能量期间所述感兴趣的区域的组织位移;和基于所确定的组织位移或基于所述受试者中的感兴趣的分子的浓度相对于在施加所述神经调制能量时或之前获取的基线浓度的变化,修改所述治疗传感器的一个或多个控制参数。
6.在另一个实施方案中,提供了方法,所述方法包括以下步骤:经由能量施加装置将参考脉冲递送至受试者的感兴趣的区域;在递送所述参考脉冲之后,经由所述能量施加装置将治疗脉冲递送至所述感兴趣的区域;在递送所述治疗脉冲之后,经由所述能量施加装置将跟踪脉冲递送至所述感兴趣的区域;识别所述参考脉冲与所述跟踪脉冲之间的相位变化;和基于所述相位变化确定所述感兴趣的区域中或附近的组织位移。
7.在另一个实施方案中,提供了方法,所述方法包括以下步骤:经由能量施加装置将参考脉冲递送至受试者的感兴趣的区域;在递送所述参考脉冲之后,经由所述能量施加装置将治疗脉冲递送至所述感兴趣的区域;在递送所述治疗脉冲之后,经由所述能量施加装置将跟踪脉冲递送至所述感兴趣的区域;识别相对于基线的感兴趣的分子的浓度变化并且作为递送所述治疗脉冲的结果;和基于所述相位变化确定所述感兴趣的区域中或附近的与所述浓度变化相关联的组织位移。
附图说明
8.当参照附图阅读以下详细描述时,本公开的这些和其它特征、方面和优点将变得更好理解,在附图中,相同的符号在整个图中表示相同的部件,其中:图1是根据本公开的实施方案的在组织上的超声参数和超声辐射力的示意性表示;图2是根据本公开的实施方案的作为在组织上的超声辐射力的结果的组织位移模型的示意性表示;图3显示从指示超声诱导的组织位移的组织获得的图像;图4显示根据本公开的实施方案的位移距离与在组织上的超声辐射力的脉冲时间之间的关系;图5显示根据本公开的实施方案的位移距离与在组织上的超声辐射力的脉冲时间之间的关系;图6显示在lps暴露的动物模型中,对脾施加不同的超声压力对全血肿瘤坏死因子(tnf)水平的作用;图7显示在lps暴露的动物模型中,对脾施加不同脉冲长度的超声对葡萄糖水平的作用;图8是根据本公开的实施方案的用于确定组织位移的参考和跟踪脉冲中的相位变化的示意性表示;图9是根据本公开的实施方案的用于确定组织位移的技术的流程图;图10显示用于向图13-16的人受试者施加超声能量的实验时间线;图11显示用于向图13-16的人受试者施加超声能量的实验控制参数;图12显示用于向图13-16的人受试者施加超声能量的感兴趣的集中的和分布的区域;图13显示相对于与施加超声能量相关联的组织位移的程度的tnf响应的比较;图14显示与集中的和分布的施加超声能量相关联的位移的tnf响应的比较;图15显示与集中的和分布的施加超声能量相关联的位移的tnf响应的比较;图16显示在不同时间点的tnf响应和位移的总结;
图17是根据本公开的实施方案的超声神经调制系统的示意性表示;图18是根据本公开的实施方案的超声神经调制系统的框图;和图19是根据本公开的实施方案的用于调谐组织位移的技术的流程图。
具体实施方式
9.下面将描述一个或多个具体实施方案。努力提供这些实施方案的简明描述,在说明书中没有描述实际实施的所有特征。应当理解,在任何这样的实际实施的开发中,如在任何工程或设计项目中,必须做出许多实施特定的决定以实现开发者的特定靶向,例如符合系统相关的和商业相关的约束,其可能从一个实施到另一个实施而变化。此外,应当理解,这样的开发努力可能是复杂且耗时的,但对于受益于本公开的普通技术人员而言,仍然是设计、制作和制造的例行任务。
10.本文给出的任何实例或说明不应以任何方式视为对与其一起使用的任何一个或多个术语的约束、限制或表达定义。相反,这些实例或说明应被认为是关于各种特定实施方案描述的,并且仅是说明性的。本领域普通技术人员将理解,与这些实例或说明一起使用的任何一个或多个术语将涵盖可以或不可以与其一起或在说明书中的其它地方给出的其它实施方案,并且所有这样的实施方案旨在包括在该一个或多个术语的范围内。指定这样的非限制性实例和说明的语言包括但不限于:“例如(for example)”、“例如(for instance)”、“例如(such as)”、“例如(e.g.)”、“包括”、“在某些实施方案中”、“在一些实施方案中”和“在一个实施方案中”。
11.组织内的神经调制可以通过局部机械应力/应变实现,其拉伸或移位组织并响应地激活不同的细胞内和细胞间过程。本文提供了控制和/或监测由神经调制能量施加(例如非侵入性超声)引起的拉伸和/或位移的量的技术。通过控制和监测被神经调制能量靶向的特定组织内的拉伸和/或位移的量,可以调节神经调制能量剂量的控制参数以产生不同水平的作用和/或不同类型的作用。在实例中,控制拉伸量和/或位移量的剂量改变在人的某些神经调制方案中的抗炎作用的水平。此外,由超声能量诱导的拉伸和/或位移的量也可以使用超声(例如,使用组合探头)来非侵入性地测量,以提供用于实时量化和精确控制递送的剂量的反馈。
12.在某些实施方案中,可以使用剪切波(弹性成像)成像来评估响应于聚焦超声的辐射力的组织中的位移。本公开证明,在活的生物体中观察到阈值作用,由此少量位移(亚阈值位移)不产生神经调制作用,而较大量的位移(超阈值)产生神经调制作用。在活的生物体中观察到第二阈值作用,其中大量位移(过度暴露)产生不期望的作用,并且预期的神经调制作用不存在或减弱。也就是说,可以针对每个患者调节剂量的控制参数以实现期望的组织位移。除了识别与特定控制参数相关联的平稳或最大位移水平之外,在所公开的实施方案中观察在其上施加位移的组织区域和位移的时变性质以产生不同的神经调制作用。如本公开中所提供的,已经显示这种空间-时间关系和所施加剂量的总持续时间,以在活的生物体中产生不同水平的神经调制。
13.由于个体解剖学的变化和个体组织性质的变化,在不同个体中产生适量的拉伸和/或位移是具有挑战性的。也就是说,肝可能与胰腺不同地响应。在神经调制能量剂量期间测量和监测拉伸和/或位移的量可以用于最小化与个体患者的最佳剂量的偏差。实时测
量和监测允许对所施加的拉伸和/或位移的时间方面进行更精确的控制。在尺寸变化的组织区域上进行测量和监测允许对所施加的拉伸和/或位移的空间方面进行更精确的控制。例如,可以针对期望的组织位移选择或监测用于能量施加的特定感兴趣的区域。在某些实施方案中,本技术促进为特定个体(个性化的)确定适当的或靶向量的空间-时间拉伸和/或位移,并且更可靠地产生在多个时间尺度上所确定的空间-时间拉伸和/或位移量。因此,在施加神经调制能量期间和之后评估组织位移可以允许能量参数的微调,以不仅产生靶向生理结果,而且考虑患者对患者的响应可变性和组织响应可变性(组织间和/或组织内)。
14.可以以多种方式将拉伸和/或位移诱至导组织中。在非侵入性超声的背景下讨论所公开的实施方案,其允许施加到感兴趣的区域的能量的受控聚焦和形状,同时深深地穿透到组织中。图1是表示焦点的超声束的示意性表示,以及所施加的超声能量的详细视图,显示振幅和频率12、脉冲高时间或脉冲长度14以及脉冲重复间隔16的特性。本技术证明对产生超声波的驱动电压(所施加的压力)以及脉冲长度和脉冲重复间隔的修改产生与组织位移相关的可测量的生理作用。在某些公开的实施方案中,比较了全幅和半幅驱动电压的作用。此外,评估脉冲长度和脉冲重复间隔的变化。
15.图2是简化的组织位移模型,其显示假设超声焦点是在z方向上具有均匀分布的位移的简单线源时的位移。该模型还假设组织是衰减的、均匀的、弹性的介质。该模型允许计算2d组织f(x,y,t)中的任何观察点处的位移f。每个箭头表示施加的脉冲。图3是从时间点零开始并在4毫秒内拍摄的超声图像的时间序列,显示20mm
×
20mm区域上的位移,使用直径10mm长的线源假设,并且总推动脉冲在3毫秒内。每个单独的图像表示0.5毫秒内的位移;在每0.5毫秒处,将另外的500微秒脉冲(如图2中的黄色箭头所示)施加到组织。所示的位移是用30 db显示范围进行对数缩放的。超声图像证明在施加3毫秒总脉冲的时间内组织中几微米的位移。
16.图4显示在图3的图像中观察到的位移与位移的脉冲长度之间的关系。随着时间的推移,随着总脉冲增加(多个脉冲的总剂量递送),每500微秒的脉冲长度推动,观察到更大的位移,直到来自源的所有贡献的位移不能相干地加和。因此,位移振幅(显示为任意单位)达到平稳。在所描述的实例中,脉冲推动是没有弛豫周期的累加的500微秒脉冲。因此,如本文所提供的,可以选择在剂量时间段的过程中的脉冲长度和/或总脉冲高时间,以在平稳脉冲长度值的较低范围处实现针对特定驱动电压(以及针对特定感兴趣的区域)的最大和/或平稳值潜在组织位移,因此在所施加的剂量的过程中最小化感兴趣的区域处的超声能量暴露,这可以导致更靶向的作用。因此,在实施方案中,本技术可以随着剂量递送实时跟踪位移,计算组织位移的变化率。在确定变化率正在减小(例如,落在选择的阈值以下)指示接近平稳时,超声探头的控制器可以自动修改能量递送。例如,控制器可以停止能量递送或可以修改控制参数以移出曲线的平稳部分。这样的跟踪可能是期望的,因为最小化超声能量暴露可能阻止或延迟组织中的补偿机制,将感兴趣的区域作为适当的治疗位点保留更长的时间段。此外,通过避免图4的曲线的平稳部分,治疗的不期望的另外的生理作用不会被激活。
17.然而,如本文所提供的,可以修改超声剂量递送的其它控制参数以实现与特征性组织位移和/或弛豫相关联的期望的生理结果。例如,如在中图5所示,500微秒的脉冲重复间隔(在2khz prf)或5毫秒脉冲重复间隔(500 hz prf)可以在脉冲长度“接通”或脉冲高时间上变化,伴随所得组织位移的变化。例如,在相同prf下增加的脉冲高时间量导致在较高
(2 khz)和较低(500 hz)频率设置两者下在10毫秒的过程中总体上更大的位移。也就是说,150微秒的脉冲高时间导致比350微秒的接通时间更少的组织位移。因此,可以调谐超声治疗传感器以改变脉冲重复间隔内的脉冲高时间,以改变组织位移的曲线。此外,增加脉冲重复间隔还可以允许脉冲之间的弛豫,这进而改变复合位移对剂量的作用。对于150、250和350微秒脉冲接通时间的5毫秒脉冲重复间隔允许接近完全的弛豫,而更短的500微秒脉冲重复间隔允许小于完全的弛豫。以这种方式,500微秒脉冲重复间隔中的脉冲证明随着时间的复合位移作用,一旦剂量停止,该复合位移作用就消失。如本文所提供的,本技术允许超声剂量治疗方案具有用于能量递送的控制参数,其调谐驱动电压、频率、脉冲长度和脉冲重复间隔和/或总剂量递送时间。例如,对于顶部面板的条件(500微秒pri,在2khz prf下)而言,相比于下部面板的条件(5毫秒pri,在500 hz prf下),观察递送至感兴趣的区域的总能量。估计的位移可以被评估或估计为在剂量递送时段上的曲线下面积,并且控制参数可以被编程为落入特定感兴趣的区域的组织位移的期望的曲线下面积内。
18.本技术靶向由神经调制引起的组织位移,其与靶向生理结果相联系。图6显示lps暴露的动物模型中施加于脾的超声压力(mpa)对全血tnf的不同作用。由超声引起的位移量是组织的弹性性质和所施加的能量的特性的函数,例如推动多久(脉冲长度、脉冲重复间隔)和/或推动多硬(时间平均强度mw/cm2和/或峰值压力mpa)。在由超声施加的力等于由组织推回的力的情况下,位移达到最大值。一旦达到该最大值,推得更长就不再产生任何更多的位移。更硬地推动(例如,更大的压力)是获得更多位移(达到新的最大值)的方式。在图6中所示的情况中,对于lps暴露的动物模型,具有所得炎症和相关联的tnf基线增加,推动的持续时间保持相同,但压力的量是变化的。观察到两个阈值作用,一个具有极小的生理作用(在0.03 mpa下压力太低),而第二个阈值是生理作用消失的阈值(在1.72 mpa巴下压力太高)。然而,阈值之间的数据显示,与lps暴露相关联的全血tnf的增加对于某些超声压力是相反的,而在太高或太低的压力下不受影响。因此,如本文所提供的,本技术可以允许识别位于与无生理作用相关联的阈值之间的超声压力和/或在这些识别的压力的范围内施加超声能量。如本文所提供的,由超声能量引起的组织位移可以用作期望的生理作用的标记。在实施方案中,1.27 mpa巴和1.72 mpa巴之间的作用变化与组织对所施加的超声能量的反应的物理变化有关,所述组织反应是从拉伸位移到在较高压力下的加热/空化。在与拉伸位移相关联的压力下可以观察到期望的作用。因此,可以选择用于超声剂量的控制参数以引起拉伸位移,并且可以避免峰值压力,所述峰值压力太低而不能引起位移,或者所述峰值压力太高以至于感兴趣的区域中或附近的主要组织作用是热/空化。
19.图7显示相对于葡萄糖相对于基线变化的对照,推动(脉冲)的压力保持相同(200毫秒)的变化持续时间的结果。结果显示两种阈值作用,一种具有极小的生理作用(持续时间太短),而第二种阈值是生理作用消失(持续时间太长)。因此,可以选择控制参数以与组织位移对准,所述组织位移与葡萄糖百分比的期望变化相关联。
20.为此,本技术提供了用于监测和/或评估组织位移的系统和方法。在实施方案中,组织位移可以经由超声来评估。在一个实施方案中,超声探头可以是包括治疗传感器和评估(成像)传感器的组合探头。成像传感器可以用于识别和选择感兴趣的区域以及跟踪由施加神经调制能量引起的组织的位移。图8显示用于识别组织位移的实例控制或驱动信号,其可以用于控制超声探头以递送治疗并跟踪相关联的组织作用。在实施方案中,短参考成像
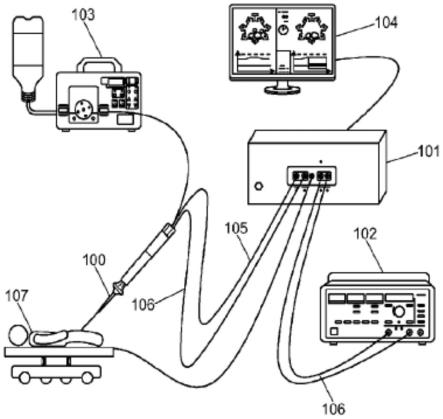
脉冲和跟踪脉冲置于治疗脉冲两侧。基于超声图像数据的参考和跟踪信号之间的相位变化用于计算组织位移。如所示的,位移可以是沿轴的正方向或负方向,并且总位移或曲线下面积可以用作位移度量。
21.图9是用于评估由于向靶向内部组织中的感兴趣的区域超声能量施加而导致的组织位移的方法100的流程图。在方法100中,超声探头的传感器将参考成像脉冲递送至感兴趣的区域,并且收集从组织反射的超声波以生成基线或参考数据(框102),其由超声探头的控制器(例如,超声系统)接收。控制超声探头的相同超声传感器或不同的超声传感器(例如,专用治疗传感器)以施加超声治疗脉冲(框104)。超声治疗施加在感兴趣的区域中或附近引起组织位移,在施加超声能量之后使用递送的跟踪脉冲来识别所述组织位移(框106)。来自跟踪脉冲的反射波生成跟踪数据。跟踪数据和参考数据用于确定由超声能量脉冲引起的组织位移(框108)。
22.在某些实施方案中,选择参考和跟踪脉冲的控制参数,使得它们是短的并且能量足够低以引起组织的最小位移或不引起组织的位移。也就是说,所识别的位移是由治疗脉冲而不是由参考/跟踪脉冲引起的。在某些实施方案中,在脉冲间隔之间发射跟踪脉冲,使得针对所施加的每个脉冲跟踪位移。以这种方式,可以跟踪复合位移直到达到平稳值。此外,可以实时确定位移,以允许调节或修改治疗脉冲控制参数。
23.对60个人受试者检查了作为神经调制超声治疗结果的组织位移和生理作用之间的关系。将受试者随机分配到六个组之一(每组n = 10)。如本文所公开的,超声用于引起靶向内部组织的感兴趣的区域的组织位移振动。各组人受试者接受假对照超声剂量、115 w/cm2的半幅剂量 (isppa空间峰脉冲平均强度)或362 w/cm2的全幅剂量(isppa)。50%振幅(368 w/cm2)的时间平均功率(ispta)高于100%振幅(290 w/cm2),因为它被更频繁地推动。将用于接受超声能量的受试者的超声剂量施加到单个位点(第1-3组)或分布在多个位点之间(第4-6组)。
24.图10显示每个受试者的实验方案。对于接受超声的那些人受试者,在禁食抽血后递送治疗剂量,以获得各种血液分子的基线水平,所述血液分子例如tnf、细胞因子(il-1、il-6、il-8、il-10)、葡萄糖和去甲肾上腺素。通过对静脉抽血的血液进行lps测定,评估血液细胞对lps的tnf响应。将血液暴露于浓度为0、0.1、1、10和100ng/ml的lps,然后用人tnf elisa分析每个样品。计算五个lps浓度的tnf响应浓度的曲线下面积(auc),并用于表征血液细胞的tnf响应。将超声能量施加到每个受试者的脾组织中的感兴趣的区域。在治疗剂量后1小时、2小时和24小时进行禁食抽血。图11总结了不同组中的每一组的受试者的控制参数和所得组织位移。图12是脾的单一位点相对于多位点递送的示意性表示。
25.图13显示在感兴趣的集中的(单个位点)区域内的脾超声刺激的结果。较大的位移与刺激后2小时血液细胞对lps的tnf响应的较大降低有关。上方括号显示比较感兴趣的单个或集中治疗区域内的小和大位移的p值(wilcoxon测试)。所示数据来自第1组的8个受试者(小位移)、第2组的10个受试者(中等位移)和第3组的8个受试者(大位移)。
26.图14显示中等位移组的集中的(单个位点)与分布的(多个位点)超声能量施加之间的组织位移之间的比较。对于集中的区域内的中等位移,脾超声刺激倾向于在刺激后2小时引起血液细胞对lps的tnf响应的更大降低。上方括号显示比较集中的区域相对于分布的区域内的中等位移的p值(wilcoxon测试)。所示数据来自第2组的10个受试者(中等位移)和
第5组的9个受试者(中等位移)。
27.图15显示大位移组的集中的(单个位点)与分布的(多个位点)超声能量施加之间的组织位移之间的比较。对于集中的区域内的大位移,脾超声刺激倾向于在刺激后2小时引起血液细胞对lps的tnf响应的更大降低。上方括号显示比较集中的区域相对于分布的区域内的大位移的p值(wilcoxon测试)。所示数据来自第3组的8个受试者(大位移)和第6组的9个受试者(大位移)。
28.图16是6个受试者组中tnf响应的总结。上方面板显示对于单个位点能量施加的tnf变化,而底部面板显示对于分布的能量施加的tnf变化。结果显示,第2组和第3组之间所施加的压力或功率的变化与tnf响应相对于基线的显著变化相关联。研究组还显示在24小时时恢复到基线tnf水平。
29.如所示的,超声能量施加控制参数的变化和感兴趣的区域选择以与组织位移程度相关的方式影响生理结果。虽然实验结果显示作为超声能量施加(例如超声治疗)的结果的tnf相对于基线的变化,应当理解这些结果作为实例呈现。本技术可以诱导和评估与期望的生理结果相关联的感兴趣的区域中的组织位移的存在或水平,例如感兴趣的分子的浓度相对于治疗前的基线水平的变化。代替跟踪分子浓度的变化或除了跟踪分子浓度的变化之外,本技术可以评估组织位移以确定神经调制超声治疗是有效的。
30.图17显示用于神经调制以实现神经调制作用的系统200,例如,神经调制递送系统,所述神经调制作用例如与响应于能量的施加的突触的组分(例如,突触前细胞、突触后细胞)的神经递质释放和/或激活相关联的靶向组织204的一个或多个感兴趣的区域202处的组织位移。所描述的系统包括耦合到能量施加装置206的脉冲发生器214。能量施加装置206被配置为例如经由导线或无线连接接收能量脉冲,所述能量脉冲在使用中被引导到受试者的一个或多个内部组织或一个或多个器官中的多个感兴趣的区域20,这进而导致靶向生理结果。
31.在某些实施方案中,能量施加装置206和/或脉冲发生器214可以无线通信,例如与可以进而向脉冲发生器214提供指令的控制器216通信。在其它实施方案中,能量施加装置206可以是体外装置,例如,可以经皮或以非侵入方式从受试者体外的位置操作以施加能量,并且在某些实施方案中,可以与脉冲发生器214和/或控制器16集成。在其中能量施加装置206是体外的实施方案中,能量施加装置206可以由护理者操作并且定位在受试者皮肤上或上方的点,使得能量脉冲经皮递送至期望的内部组织。一旦定位成将能量脉冲施加到期望的一个或多个感兴趣的区域202,系统200就可以启动一个或多个神经通路的神经调制,以实现靶向生理结果或临床作用。在其它实施方案中,脉冲发生器14和/或能量施加装置206可以植入在生物相容性位点(例如腹部)处,并且可以例如经由一根或多根导线在内部耦合。在一些实施方案中,系统200可以被实施为使得一些或所有元件可以以有线或无线方式彼此通信。
32.在某些实施方案中,系统200可以包括评估装置220,其耦合到控制器216并且评估指示是否已经实现调制的靶向生理结果的特性。在一个实施方案中,靶向生理结果可以是局部的。例如,一个或多个神经通路的调制可以导致局部组织或功能变化,例如组织结构变化、某些分子的浓度的局部变化、组织位移、增加的流体运动等。靶向生理结果可以是治疗方案的目标。
33.调制一个或多个神经通路以实现靶向生理结果可以导致全身或非局部变化,并且靶向生理结果可以与循环分子的浓度变化或不包括直接施加能量的感兴趣的区域的组织的特性变化相关。在一个实例中,位移可以是期望的调制的替代测量,并且低于预期位移值的位移测量可以导致调制参数的修改,直到诱导预期的位移值。因此,在一些实施方案中,评估装置220可以被配置为评估浓度变化。在一些实施方案中,评估装置220可以被配置为评估组织位移。例如,评估装置可以被配置为使用弹性成像技术。弹性成像可以用于检查组织材料性质。在本技术中,弹性成像可以用于评估由超声治疗脉冲或剂量方案诱导的组织变化。虽然单独显示系统200的所描述的元件,应当理解,这些元件中的一些或全部可以彼此组合。
34.基于该评估,可以改变控制器216的调制参数,使得递送有效量的能量。例如,如果期望的调制与在限定的时间窗(例如,在能量施加程序开始之后5分钟、30分钟)内或相对于程序开始时的基线浓度(一个或多个分子的循环浓度或组织浓度)的变化相关联,则可能期望调制参数(例如脉冲频率或其它参数)的变化,其进而可以由操作者或经由自动反馈回路提供给控制器216,用于限定或调节脉冲发生器214的能量施加参数或调制参数,直到调制参数导致有效量的能量被施加。在一个实施方案中,可以基于来自评估装置的关于在治疗方案的过程中神经调制能量的功效的反馈来细化初始限定的感兴趣的区域202以产生更新的感兴趣的区域202。反馈可以是例如由于神经调制能量的施加而导致的组织位移。对感兴趣的区域的这些细化或更新可以用作患者特定网络的一部分,其中更新网络以基于期望的临床结果来识别对该特定个体的感兴趣的生理参数具有最大影响的特定感兴趣的区域。
35.如本文所提供的系统200可以根据各种调制控制参数提供能量脉冲作为治疗方案的一部分以施加有效量的能量。例如,调制控制参数可以包括从连续到间歇范围的各种刺激时间模式。使用间歇刺激,在信号接通时间期间以特定频率在一段时间内递送能量。信号接通时间之后是没有能量递送的时间段,称为信号断开时间。控制参数还可以包括刺激施加的频率和持续时间。施加频率可以是连续的,或者在各种时间段(例如在一天或一周内)被递送。此外,治疗方案可以指定一天中施加能量的时间或者与进食或其它活动相关的时间。引起靶向生理结果的治疗持续时间可以持续各种时间段,包括但不限于几分钟至几小时。在某些实施方案中,具有指定的刺激模式的治疗持续时间可以持续一小时,以例如72小时的间隔重复。在某些实施方案中,可以以较高的频率(例如每三小时)递送能量较短的持续时间(例如30分钟内)。根据调制参数(例如治疗持续时间、频率和振幅)可以可调节地控制能量的施加以实现期望的结果。
36.图18是系统200的某些组件的框图。如本文所提供的,用于神经调制的系统200可以包括脉冲发生器214,其适于生成用于施加到受试者的组织的多个能量脉冲。脉冲发生器214可以是单独的,或者可以集成到外部装置(例如控制器216)中。控制器216包括用于控制装置的处理器230。软件代码或指令存储在控制器216的存储器232中,以由处理器230执行来控制装置的各种组件。控制器216和/或脉冲发生器214可以经由一个或多个导线或无线地连接到能量施加装置206。
37.控制器216可以包括具有输入/输出电路234和显示器236的用户界面,其适于允许临床医生向调制程序提供选择输入(例如,选择感兴趣的区域20或与期望的感兴趣的区域20相关联的靶向组织的图像上的特定片段)或控制参数。处理器230可以被配置为控制能量
施加装置并且驱动如本文提供的治疗传感器208和/或成像传感器210。此外,处理器230可以被配置为基于从成像传感器210接收的数据来确定组织位移。
38.系统可以包括光束控制器237,其可以通过控制能量施加装置206的转向和/或聚焦中的一个或两个来控制能量施加装置206的传感器14的能量光束的聚焦位置以施加治疗。光束控制器237还可以控制能量施加装置206的一个或多个铰接部分以重新定位传感器。光束控制器可以从处理器230接收指令以引起能量光束的聚焦和/或转向的改变。系统200可以响应于提供关于能量施加装置206的反馈的一个或多个位置传感器238和/或一个或多个接触传感器239。光束控制器237可以包括马达以促进能量施加装置206的一个或多个铰接部分的转向。预期系统200可以包括允许位置、转向和/或聚焦调节的特征,以促进本文公开的技术。
39.存储在存储器232中的每个调制程序可以包括一组或多组调制参数,包括脉冲振幅、脉冲持续时间、脉冲频率、脉冲重复率等。脉冲发生器214响应于来自控制器装置216的控制信号修改其内部参数,以改变通过导线233传输到能量施加装置206所施加到的受试者的能量脉冲的刺激特性。可以采用任何合适类型的脉冲发生电路,包括但不限于恒定电流、恒定电压、多个独立的电流或电压源等。所施加的能量是电流振幅和脉冲持续时间的函数。控制器216允许通过改变调制参数和/或在某些时间启动能量施加或在某些时间抑制能量施加来可调节地控制能量。在一个实施方案中,对能量施加装置206施加能量的可调节控制基于与确定的组织位移有关的信息。
40.如果信息来自评估装置220,则反馈回路可以驱动可调节的控制。例如,可以基于响应于神经调制的由评估装置220测量的组织位移来进行诊断。当位移高于所选择的阈值或范围时,控制器216可以启动向感兴趣的区域(例如,脾)施加能量并且利用与靶向生理结果相关联的调制参数(例如,循环葡萄糖的减少)的治疗方案。治疗方案可以使用与诊断方案中使用的那些不同的调制参数(例如,更高的能量水平、更频繁的施加)。
41.在一个实施方案中,存储器232存储可由操作者选择的不同的操作模式。例如,存储的操作模式可以包括用于识别特定的感兴趣的区域和执行与特定治疗位点相关联的一组调制参数的单独算法,所述特定治疗位点例如肝、胰腺、胃肠道、脾中的感兴趣的区域。基于相关器官的深度、感兴趣的区域的尺寸、期望的生理结果等,每个器官或位点可以具有不同的相关联的调制参数。不是让操作者手动输入模式,控制器216可以被配置为基于特定器官的选择来执行适当的指令。在另一实施方案中,存储器232存储用于不同类型的程序的操作模式。例如,激活可以与相对于与抑制或阻断组织功能相关联的刺激压力或频率范围不同的刺激压力或频率范围相关联。
42.在具体的实例中,当能量施加装置是超声传感器时,能量的有效量可以涉及施加到感兴趣的区域的所选择的时间平均强度。例如,能量的有效量可以包括时间平均功率(时间平均强度)和在1 mw/cm
2-30,000 mw/cm
2 (时间平均强度)和0.1 mpa-7 mpa (峰值压力)范围内的峰值正压。在一个实例中,在感兴趣的区域中,时间平均强度小于35 mw/cm2、小于500 mw/cm2或小于720 mw/cm2。在实例中,时间平均强度与小于与热损伤和消融/空化相关联的水平相关联。控制器216能够在验证模式下操作以获取所选择的治疗位置,并且所选择的治疗位置可以作为治疗操作模式的一部分实施,该治疗操作模式被配置为当能量施加装置206被定位在所选择的治疗位置处时执行治疗方案。
43.系统还可以包括成像装置,其促进聚焦能量施加装置206。在一个实施方案中,成像装置可以与能量施加装置206集成或与其成为同一装置,使得施加不同的超声参数(频率、孔径或能量)以用于选择(例如,空间选择)感兴趣的区域并且用于将能量聚焦到所选择的感兴趣的区域以用于靶向和随后的神经调制。在另一个实施方案中,存储器232存储一个或多个用于空间选择器官或组织结构内的感兴趣的区域的靶向或聚焦模式。空间选择可以包括选择器官的亚区域以识别对应于感兴趣的区域的器官的体积。空间选择可以依赖于如本文所提供的图像数据。基于空间选择,能量施加装置206可以聚焦(例如,使用光束控制器237)到对应于感兴趣的区域的所选择的体积上的位置。应当理解,用于引导聚焦位置的图像数据可以是体积或平面。例如,能量施加装置206可以被配置为首先在验证模式下操作,以通过捕获图像数据来获取所选择的治疗位置,所述图像数据用于识别与捕获感兴趣的区域相关联的所选择的治疗位置。验证模式能量不在适合于神经调制治疗的水平和/或应用适合于神经调制治疗的调制参数。然而,一旦识别感兴趣的区域,控制器216然后可以根据与实现靶向生理结果相关联的调制参数以治疗模式操作。
44.靶向组织可以是内部组织或包括轴突末端的突触和非神经元细胞的器官。可以通过向聚焦在靶向组织的感兴趣的区域20上的超声传感器的聚焦场内的轴突末端直接施加超声能量来刺激突触,以引起分子释放到突触空间中。可以选择感兴趣的区域以包括某些类型的轴突末端,例如特定神经元类型的轴突末端和/或与某些类型的非神经元细胞形成突触的轴突末端。因此,可以选择感兴趣的区域20以对应于具有期望的轴突末端的靶向组织(和相关联的非神经元细胞)的一部分。可以选择能量施加以优先触发由突触内的神经释放一种或多种分子(例如神经递质),或通过直接能量转导直接激活非神经元细胞本身,或引起神经和非神经元细胞两者内的激活,其引起期望的生理作用。
45.控制器216还可以被配置为接收与靶向生理结果相关的输入作为对调制参数的选择的输入。例如,当使用成像模态来评估组织位移时,控制器216可以被配置为接收特性的计算的指数或参数(例如,总位移、位移的变化率)。基于指数或参数是高于还是低于预定的阈值,可以提供诊断的指示或与达到的治疗目标相关的指示(例如,经由显示器)。在一个实施方案中,参数可以是受影响的组织的组织位移的度量或受影响的组织的深度的度量。其它参数可以包括评估一个或多个感兴趣的分子的浓度(例如,评估相对于阈值或基线/对照的浓度变化、变化率、确定浓度是否在期望的范围内中的一个或多个)。此外,能量施加装置206 (例如,超声传感器)可以在控制器216的控制下操作,以a)获取组织的图像数据,其可以用于在空间上选择靶向组织内的感兴趣的区域,b)将调制能量施加到感兴趣的区域,以及c)获取图像数据,以确定靶向生理结果已经发生(例如,经由位移测量)。在这样的实施方案中,成像装置、评估装置220和能量施加装置206可以是相同的装置。
46.在实施方案中,系统200可以被配置为设置用于治疗传感器208的控制参数以实现特定的分布、感兴趣的分子的变化或特征性组织位移。例如,受试者对神经调制能量的响应可以变化,并且可以涉及不同的控制参数以实现受试者之间的类似位移。可以调谐控制参数直到实现特征性组织位移。特征性或靶向组织位移可以是总位移度量,或者可以是基于度量的阈值或范围,由此实现靶向范围内的位移值指示成功的治疗。在实施方案中,特征性组织位移是存在两个阈值,低阈值和高阈值,并且靶向范围是在两个阈值之间的位移。与阈值相关联的控制参数可以随受试者而变化,并且系统200可以被调谐以基于施加到受试者
的试验或校准方案来识别阈值。一旦为每个受试者识别,在治疗方案的过程中可以使用实现阈值之间的位移和有效治疗范围内的位移的相关参数。组织位移或没有实现特征性或靶向位移也可以用于选择新的感兴趣的区域202。在一个实例中,感兴趣的区域202可能随着时间的推移在治疗上不太有效。这种治疗有效性的降低可以通过治疗方案过程中组织位移的变化或降低来识别。在另一个实例中,可以基于组织位移来识别或映射更响应的感兴趣的区域202。在一个实施方案中,在治疗开始时,可以使用期望的控制参数来映射靶向组织200,以基于通过以控制参数施加超声能量而引起的组织位移的程度来识别更有响应性的器官或组织的亚区域。一旦被映射,感兴趣的区域202可以从响应性(即,组织位移)中的排序在前的区域中选择,所述区域在物理上也位于含有一个或多个轴突末端的区域中,所述轴突末端在被刺激时引起期望的生理响应。这可以随受试者不同以及在受试者内随时间而变化。
47.本文讨论的神经调制技术可以用于引起感兴趣的分子的浓度变化(例如,增加、减少)和/或感兴趣的分子的特性变化。即,治疗可以引起组织产生或释放一个或多个感兴趣的分子(例如,第一感兴趣的分子、第二感兴趣的分子等)的变化,并且可以指由于向一个或多个组织(例如,第一组织、第二组织等)中的一个或多个感兴趣的区域(例如,第一感兴趣的区域、第二感兴趣的区域等)施加能量而改变分子的浓度(循环、组织)或特性(共价修饰)。感兴趣的分子的变化可以包括分子特性的变化,例如蛋白质的表达、分泌、易位和直接活性变化。可以基于所施加的能量对离子通道的作用来驱动所述变化,所述离子通道驱动神经活动和其自身功能,或者作为源自神经活动的分子或在非神经元细胞内直接激活的结果而调制相邻的非神经元细胞。感兴趣的分子的变化也可以指维持分子的期望的浓度,使得浓度的预期变化或波动(例如,由于进食)不因神经调制而发生。感兴趣的分子的变化可以指引起分子特征的变化,例如酶介导的共价修饰(磷酸化、乙酰化、核糖基化等的变化)。也就是说,应当理解,感兴趣的分子的变化可以指分子浓度和/或分子特性。感兴趣的分子可以是生物分子,例如碳水化合物(单糖、多糖)、脂质、核酸(dna、rna)或蛋白质中的一种或多种。在某些实施方案中,感兴趣的分子可以是信号分子,例如激素(胺激素、肽激素或类固醇激素)。
48.受试者之间的生理差异可以产生与实现感兴趣的分子浓度的靶向增加或减少或感兴趣的分子的其它类型的变化(例如,分子的激活状态的变化)相关联的组织位移水平的可变性。图19是用于调谐治疗脉冲的控制参数以相对于在治疗开始时或之前获取的基线测量实现感兴趣的分子中的期望的组织位移和/或特征性或阈值变化中的一个或两个的方法300的流程图。在方法300中,超声探头的传感器将参考成像脉冲递送至感兴趣的区域,并且收集从组织反射的超声波以生成基线或参考数据(框302),其由超声探头的控制器(例如,超声系统)接收。控制超声探头的相同超声传感器或不同的超声传感器(例如,专用治疗传感器)以施加超声治疗脉冲(框304)。在施加超声能量之后递送跟踪脉冲(框306),并且基于参考脉冲与跟踪脉冲之间的相位变化来确定组织位移(框308)。在某些实施方案中,识别感兴趣的分子的变化(框310)并且将其用于评估治疗脉冲的有效性。在某些实施方案中,组织位移用于评估治疗脉冲的有效性。基于感兴趣的分子的变化和/或组织位移,可以调谐治疗脉冲的控制参数(框312)以校准用于患者的治疗脉冲并促进更有效的神经调制治疗。
49.例如,可以调节驱动电压、脉冲重复间隔和脉冲长度中的一个或多个以调节治疗
脉冲的控制参数。在一个实施方案中,可以执行受试者特异性校准,其中施加治疗脉冲的控制参数并通过各种设置循环,同时在各种设置处跟踪感兴趣的分子的浓度。识别参数的有效范围,在该范围中观察到期望的作用(例如,阈值距离基线的%变化)。例如,如在图7中所示,增加200ms脉冲的周期数识别治疗脉冲引起葡萄糖浓度相对于基线的显著百分比变化的周期范围(150-250个周期)。可以使用与感兴趣的分子中观察到的期望的变化相关联的范围内的控制参数的设置来施加未来的治疗脉冲。在另一实施方案中,可以在调节控制参数期间跟踪组织位移。可以施加未来的治疗脉冲以引起与在校准期间所观察到的感兴趣的分子中的期望的变化相关联的组织位移(例如,在感兴趣的分子中相对于基线的特定百分比变化处的特定位移)。这可以导致控制参数动态调节到不同剂量的不同设置,因为受试者的组织可能基于受试者的代谢状态或临床病况在治疗方案的过程中不同地响应。应当理解,控制参数的调节可以是一个或多个控制参数的调节,并且可以包括与期望的生理结果相关联的控制参数的组合。此外,调节可以是对治疗脉冲的isppa或ispta的调节。在实施方案中,调节可以包括在多个感兴趣的区域之间分布治疗脉冲,或者基于对感兴趣的分子的变化的评估将分布的剂量合并到单个感兴趣的区域。例如,治疗方案可以开始于将剂量施加到单个感兴趣的区域。随着时间的推移,补偿或其它作用可能降低使用初始控制参数的治疗脉冲的有效性。治疗方案可以包括在多个位点之间分布的某些剂量以避免这样的补偿。
50.感兴趣的分子的变化可以是与阈值浓度的偏差或特定范围之外的浓度。感兴趣的分子的变化可以是距离基线的百分比变化,其可以高于或低于阈值百分比变化。例如,治疗方案可以具有引起感兴趣的分子的浓度改变(增加或减少)至少50%的阈值治疗目标。如果未达到治疗目标阈值,则调节控制参数,直到达到与治疗目标相关联的阈值,并且方法300可以迭代回到框304,直到超过阈值。在实施方案中,阈值可以是感兴趣的分子的浓度增加至少100%。在实施方案中,治疗目标可以是实现感兴趣的分子的浓度在特定范围内。
51.本公开的技术作用包括受控施加神经调制能量(例如,超声能量),以引起与期望的生理结果相关联的组织位移。通过跟踪组织位移作为治疗有效性的标记,神经调制递送系统可以通过在较低的总能量水平下实现期望的位移而更有效地操作。此外,神经调制能量可以在与靶向组织位移相关的治疗有效性的区域内递送,其避免无效的较低施加的能量以及可能与组织中的热和/或空化作用相关联的较高施加能量。
52.本书面描述使用实例(包括最佳模式),并且还使本领域技术人员能够实践所公开的技术,包括制造和使用任何装置或系统以及执行任何结合的方法。可专利范围由权利要求限定,并且可以包括本领域技术人员想到的其它实例。如果这样的其它实例具有与权利要求的字面语言没有不同的结构要素,或者如果它们包括与权利要求的字面语言无实质差异的等同结构要素,则这样的其它实例旨在处于权利要求的范围内。
背景技术:
1.本文公开的主题涉及经由施加神经调制能量来靶向和/或给予受试者中的感兴趣的区域以引起靶向生理结果的技术。特别地,所公开的技术可以监测和/或控制作为神经调制治疗的结果的超声诱导的组织位移。
2.神经调制已经用于治疗各种临床病况。例如,在沿脊髓的不同位置的电刺激已经用于治疗慢性背痛。然而,将电极定位在靶向神经处或附近是有挑战性的。例如,这样的技术可以涉及递送能量的电极的外科手术放置。此外,经由神经调制的特定组织靶向是具有挑战性的。位于某些靶向神经处或附近的电极通过触发神经纤维中的动作电位来介导神经调制,这进而导致神经递质在神经突触处释放以及与下一神经的突触通信。这样的传播可能导致比期望的相对更大或更分散的生理作用,因为植入电极的当前实施一次刺激许多神经或轴突。因为神经通路是复杂且互连的,更具选择性和靶向调制作用可能在临床上更有用。然而,考虑到患者解剖学和临床响应的个体可变性,识别将能量递送至期望的感兴趣的区域并引起期望的生理结果的有效能量施加参数是复杂的。
技术实现要素:
3.所公开的实施方案不旨在限制所要求保护的主题的范围,而是这些实施方案仅旨在提供可能的实施方案的简要概述。实际上,本公开可以涵盖可以与下面阐述的实施方案类似或不同的多种形式。
4.在一个实施方案中,提供了神经调制递送系统,所述系统包括能量施加装置,其被配置为将神经调制能量递送至受试者中的内部组织的感兴趣的区域。所述系统还包括控制器,其被配置为控制经由所述能量施加装置向所述感兴趣的区域施加所述神经调制能量以向其递送一定剂量的所述神经调制能量;在施加所述神经调制能量期间和/或之后接收所述感兴趣的区域的图像数据;识别所述受试者中的感兴趣的分子相对于在施加所述神经调制能量时或之前获取的基线的变化作为施加所述神经调制能量的结果;和确定与所述感兴趣的分子的所述变化相关联的所述感兴趣的区域的组织位移,其中基于所述图像数据确定所述组织位移。
5.在一个实施方案中,提供了神经调制递送系统,所述系统包括超声探头,其被配置为经由治疗传感器将神经调制能量递送至受试者中的内部组织的感兴趣的区域,并且经由成像传感器获取所述感兴趣的区域的图像数据。所述系统还包括控制器,其被配置为控制经由所述超声探头的所述治疗传感器向所述感兴趣的区域施加所述神经调制能量以向其递送一定剂量的所述神经调制能量,其中在控制参数下控制所述治疗传感器;接收在施加所述神经调制能量期间由所述超声探头的所述成像传感器获取的所述感兴趣的区域的图像数据;基于所述图像数据确定在施加所述神经调制能量期间所述感兴趣的区域的组织位移;和基于所确定的组织位移或基于所述受试者中的感兴趣的分子的浓度相对于在施加所述神经调制能量时或之前获取的基线浓度的变化,修改所述治疗传感器的一个或多个控制参数。
6.在另一个实施方案中,提供了方法,所述方法包括以下步骤:经由能量施加装置将参考脉冲递送至受试者的感兴趣的区域;在递送所述参考脉冲之后,经由所述能量施加装置将治疗脉冲递送至所述感兴趣的区域;在递送所述治疗脉冲之后,经由所述能量施加装置将跟踪脉冲递送至所述感兴趣的区域;识别所述参考脉冲与所述跟踪脉冲之间的相位变化;和基于所述相位变化确定所述感兴趣的区域中或附近的组织位移。
7.在另一个实施方案中,提供了方法,所述方法包括以下步骤:经由能量施加装置将参考脉冲递送至受试者的感兴趣的区域;在递送所述参考脉冲之后,经由所述能量施加装置将治疗脉冲递送至所述感兴趣的区域;在递送所述治疗脉冲之后,经由所述能量施加装置将跟踪脉冲递送至所述感兴趣的区域;识别相对于基线的感兴趣的分子的浓度变化并且作为递送所述治疗脉冲的结果;和基于所述相位变化确定所述感兴趣的区域中或附近的与所述浓度变化相关联的组织位移。
附图说明
8.当参照附图阅读以下详细描述时,本公开的这些和其它特征、方面和优点将变得更好理解,在附图中,相同的符号在整个图中表示相同的部件,其中:图1是根据本公开的实施方案的在组织上的超声参数和超声辐射力的示意性表示;图2是根据本公开的实施方案的作为在组织上的超声辐射力的结果的组织位移模型的示意性表示;图3显示从指示超声诱导的组织位移的组织获得的图像;图4显示根据本公开的实施方案的位移距离与在组织上的超声辐射力的脉冲时间之间的关系;图5显示根据本公开的实施方案的位移距离与在组织上的超声辐射力的脉冲时间之间的关系;图6显示在lps暴露的动物模型中,对脾施加不同的超声压力对全血肿瘤坏死因子(tnf)水平的作用;图7显示在lps暴露的动物模型中,对脾施加不同脉冲长度的超声对葡萄糖水平的作用;图8是根据本公开的实施方案的用于确定组织位移的参考和跟踪脉冲中的相位变化的示意性表示;图9是根据本公开的实施方案的用于确定组织位移的技术的流程图;图10显示用于向图13-16的人受试者施加超声能量的实验时间线;图11显示用于向图13-16的人受试者施加超声能量的实验控制参数;图12显示用于向图13-16的人受试者施加超声能量的感兴趣的集中的和分布的区域;图13显示相对于与施加超声能量相关联的组织位移的程度的tnf响应的比较;图14显示与集中的和分布的施加超声能量相关联的位移的tnf响应的比较;图15显示与集中的和分布的施加超声能量相关联的位移的tnf响应的比较;图16显示在不同时间点的tnf响应和位移的总结;
图17是根据本公开的实施方案的超声神经调制系统的示意性表示;图18是根据本公开的实施方案的超声神经调制系统的框图;和图19是根据本公开的实施方案的用于调谐组织位移的技术的流程图。
具体实施方式
9.下面将描述一个或多个具体实施方案。努力提供这些实施方案的简明描述,在说明书中没有描述实际实施的所有特征。应当理解,在任何这样的实际实施的开发中,如在任何工程或设计项目中,必须做出许多实施特定的决定以实现开发者的特定靶向,例如符合系统相关的和商业相关的约束,其可能从一个实施到另一个实施而变化。此外,应当理解,这样的开发努力可能是复杂且耗时的,但对于受益于本公开的普通技术人员而言,仍然是设计、制作和制造的例行任务。
10.本文给出的任何实例或说明不应以任何方式视为对与其一起使用的任何一个或多个术语的约束、限制或表达定义。相反,这些实例或说明应被认为是关于各种特定实施方案描述的,并且仅是说明性的。本领域普通技术人员将理解,与这些实例或说明一起使用的任何一个或多个术语将涵盖可以或不可以与其一起或在说明书中的其它地方给出的其它实施方案,并且所有这样的实施方案旨在包括在该一个或多个术语的范围内。指定这样的非限制性实例和说明的语言包括但不限于:“例如(for example)”、“例如(for instance)”、“例如(such as)”、“例如(e.g.)”、“包括”、“在某些实施方案中”、“在一些实施方案中”和“在一个实施方案中”。
11.组织内的神经调制可以通过局部机械应力/应变实现,其拉伸或移位组织并响应地激活不同的细胞内和细胞间过程。本文提供了控制和/或监测由神经调制能量施加(例如非侵入性超声)引起的拉伸和/或位移的量的技术。通过控制和监测被神经调制能量靶向的特定组织内的拉伸和/或位移的量,可以调节神经调制能量剂量的控制参数以产生不同水平的作用和/或不同类型的作用。在实例中,控制拉伸量和/或位移量的剂量改变在人的某些神经调制方案中的抗炎作用的水平。此外,由超声能量诱导的拉伸和/或位移的量也可以使用超声(例如,使用组合探头)来非侵入性地测量,以提供用于实时量化和精确控制递送的剂量的反馈。
12.在某些实施方案中,可以使用剪切波(弹性成像)成像来评估响应于聚焦超声的辐射力的组织中的位移。本公开证明,在活的生物体中观察到阈值作用,由此少量位移(亚阈值位移)不产生神经调制作用,而较大量的位移(超阈值)产生神经调制作用。在活的生物体中观察到第二阈值作用,其中大量位移(过度暴露)产生不期望的作用,并且预期的神经调制作用不存在或减弱。也就是说,可以针对每个患者调节剂量的控制参数以实现期望的组织位移。除了识别与特定控制参数相关联的平稳或最大位移水平之外,在所公开的实施方案中观察在其上施加位移的组织区域和位移的时变性质以产生不同的神经调制作用。如本公开中所提供的,已经显示这种空间-时间关系和所施加剂量的总持续时间,以在活的生物体中产生不同水平的神经调制。
13.由于个体解剖学的变化和个体组织性质的变化,在不同个体中产生适量的拉伸和/或位移是具有挑战性的。也就是说,肝可能与胰腺不同地响应。在神经调制能量剂量期间测量和监测拉伸和/或位移的量可以用于最小化与个体患者的最佳剂量的偏差。实时测
量和监测允许对所施加的拉伸和/或位移的时间方面进行更精确的控制。在尺寸变化的组织区域上进行测量和监测允许对所施加的拉伸和/或位移的空间方面进行更精确的控制。例如,可以针对期望的组织位移选择或监测用于能量施加的特定感兴趣的区域。在某些实施方案中,本技术促进为特定个体(个性化的)确定适当的或靶向量的空间-时间拉伸和/或位移,并且更可靠地产生在多个时间尺度上所确定的空间-时间拉伸和/或位移量。因此,在施加神经调制能量期间和之后评估组织位移可以允许能量参数的微调,以不仅产生靶向生理结果,而且考虑患者对患者的响应可变性和组织响应可变性(组织间和/或组织内)。
14.可以以多种方式将拉伸和/或位移诱至导组织中。在非侵入性超声的背景下讨论所公开的实施方案,其允许施加到感兴趣的区域的能量的受控聚焦和形状,同时深深地穿透到组织中。图1是表示焦点的超声束的示意性表示,以及所施加的超声能量的详细视图,显示振幅和频率12、脉冲高时间或脉冲长度14以及脉冲重复间隔16的特性。本技术证明对产生超声波的驱动电压(所施加的压力)以及脉冲长度和脉冲重复间隔的修改产生与组织位移相关的可测量的生理作用。在某些公开的实施方案中,比较了全幅和半幅驱动电压的作用。此外,评估脉冲长度和脉冲重复间隔的变化。
15.图2是简化的组织位移模型,其显示假设超声焦点是在z方向上具有均匀分布的位移的简单线源时的位移。该模型还假设组织是衰减的、均匀的、弹性的介质。该模型允许计算2d组织f(x,y,t)中的任何观察点处的位移f。每个箭头表示施加的脉冲。图3是从时间点零开始并在4毫秒内拍摄的超声图像的时间序列,显示20mm
×
20mm区域上的位移,使用直径10mm长的线源假设,并且总推动脉冲在3毫秒内。每个单独的图像表示0.5毫秒内的位移;在每0.5毫秒处,将另外的500微秒脉冲(如图2中的黄色箭头所示)施加到组织。所示的位移是用30 db显示范围进行对数缩放的。超声图像证明在施加3毫秒总脉冲的时间内组织中几微米的位移。
16.图4显示在图3的图像中观察到的位移与位移的脉冲长度之间的关系。随着时间的推移,随着总脉冲增加(多个脉冲的总剂量递送),每500微秒的脉冲长度推动,观察到更大的位移,直到来自源的所有贡献的位移不能相干地加和。因此,位移振幅(显示为任意单位)达到平稳。在所描述的实例中,脉冲推动是没有弛豫周期的累加的500微秒脉冲。因此,如本文所提供的,可以选择在剂量时间段的过程中的脉冲长度和/或总脉冲高时间,以在平稳脉冲长度值的较低范围处实现针对特定驱动电压(以及针对特定感兴趣的区域)的最大和/或平稳值潜在组织位移,因此在所施加的剂量的过程中最小化感兴趣的区域处的超声能量暴露,这可以导致更靶向的作用。因此,在实施方案中,本技术可以随着剂量递送实时跟踪位移,计算组织位移的变化率。在确定变化率正在减小(例如,落在选择的阈值以下)指示接近平稳时,超声探头的控制器可以自动修改能量递送。例如,控制器可以停止能量递送或可以修改控制参数以移出曲线的平稳部分。这样的跟踪可能是期望的,因为最小化超声能量暴露可能阻止或延迟组织中的补偿机制,将感兴趣的区域作为适当的治疗位点保留更长的时间段。此外,通过避免图4的曲线的平稳部分,治疗的不期望的另外的生理作用不会被激活。
17.然而,如本文所提供的,可以修改超声剂量递送的其它控制参数以实现与特征性组织位移和/或弛豫相关联的期望的生理结果。例如,如在中图5所示,500微秒的脉冲重复间隔(在2khz prf)或5毫秒脉冲重复间隔(500 hz prf)可以在脉冲长度“接通”或脉冲高时间上变化,伴随所得组织位移的变化。例如,在相同prf下增加的脉冲高时间量导致在较高
(2 khz)和较低(500 hz)频率设置两者下在10毫秒的过程中总体上更大的位移。也就是说,150微秒的脉冲高时间导致比350微秒的接通时间更少的组织位移。因此,可以调谐超声治疗传感器以改变脉冲重复间隔内的脉冲高时间,以改变组织位移的曲线。此外,增加脉冲重复间隔还可以允许脉冲之间的弛豫,这进而改变复合位移对剂量的作用。对于150、250和350微秒脉冲接通时间的5毫秒脉冲重复间隔允许接近完全的弛豫,而更短的500微秒脉冲重复间隔允许小于完全的弛豫。以这种方式,500微秒脉冲重复间隔中的脉冲证明随着时间的复合位移作用,一旦剂量停止,该复合位移作用就消失。如本文所提供的,本技术允许超声剂量治疗方案具有用于能量递送的控制参数,其调谐驱动电压、频率、脉冲长度和脉冲重复间隔和/或总剂量递送时间。例如,对于顶部面板的条件(500微秒pri,在2khz prf下)而言,相比于下部面板的条件(5毫秒pri,在500 hz prf下),观察递送至感兴趣的区域的总能量。估计的位移可以被评估或估计为在剂量递送时段上的曲线下面积,并且控制参数可以被编程为落入特定感兴趣的区域的组织位移的期望的曲线下面积内。
18.本技术靶向由神经调制引起的组织位移,其与靶向生理结果相联系。图6显示lps暴露的动物模型中施加于脾的超声压力(mpa)对全血tnf的不同作用。由超声引起的位移量是组织的弹性性质和所施加的能量的特性的函数,例如推动多久(脉冲长度、脉冲重复间隔)和/或推动多硬(时间平均强度mw/cm2和/或峰值压力mpa)。在由超声施加的力等于由组织推回的力的情况下,位移达到最大值。一旦达到该最大值,推得更长就不再产生任何更多的位移。更硬地推动(例如,更大的压力)是获得更多位移(达到新的最大值)的方式。在图6中所示的情况中,对于lps暴露的动物模型,具有所得炎症和相关联的tnf基线增加,推动的持续时间保持相同,但压力的量是变化的。观察到两个阈值作用,一个具有极小的生理作用(在0.03 mpa下压力太低),而第二个阈值是生理作用消失的阈值(在1.72 mpa巴下压力太高)。然而,阈值之间的数据显示,与lps暴露相关联的全血tnf的增加对于某些超声压力是相反的,而在太高或太低的压力下不受影响。因此,如本文所提供的,本技术可以允许识别位于与无生理作用相关联的阈值之间的超声压力和/或在这些识别的压力的范围内施加超声能量。如本文所提供的,由超声能量引起的组织位移可以用作期望的生理作用的标记。在实施方案中,1.27 mpa巴和1.72 mpa巴之间的作用变化与组织对所施加的超声能量的反应的物理变化有关,所述组织反应是从拉伸位移到在较高压力下的加热/空化。在与拉伸位移相关联的压力下可以观察到期望的作用。因此,可以选择用于超声剂量的控制参数以引起拉伸位移,并且可以避免峰值压力,所述峰值压力太低而不能引起位移,或者所述峰值压力太高以至于感兴趣的区域中或附近的主要组织作用是热/空化。
19.图7显示相对于葡萄糖相对于基线变化的对照,推动(脉冲)的压力保持相同(200毫秒)的变化持续时间的结果。结果显示两种阈值作用,一种具有极小的生理作用(持续时间太短),而第二种阈值是生理作用消失(持续时间太长)。因此,可以选择控制参数以与组织位移对准,所述组织位移与葡萄糖百分比的期望变化相关联。
20.为此,本技术提供了用于监测和/或评估组织位移的系统和方法。在实施方案中,组织位移可以经由超声来评估。在一个实施方案中,超声探头可以是包括治疗传感器和评估(成像)传感器的组合探头。成像传感器可以用于识别和选择感兴趣的区域以及跟踪由施加神经调制能量引起的组织的位移。图8显示用于识别组织位移的实例控制或驱动信号,其可以用于控制超声探头以递送治疗并跟踪相关联的组织作用。在实施方案中,短参考成像
脉冲和跟踪脉冲置于治疗脉冲两侧。基于超声图像数据的参考和跟踪信号之间的相位变化用于计算组织位移。如所示的,位移可以是沿轴的正方向或负方向,并且总位移或曲线下面积可以用作位移度量。
21.图9是用于评估由于向靶向内部组织中的感兴趣的区域超声能量施加而导致的组织位移的方法100的流程图。在方法100中,超声探头的传感器将参考成像脉冲递送至感兴趣的区域,并且收集从组织反射的超声波以生成基线或参考数据(框102),其由超声探头的控制器(例如,超声系统)接收。控制超声探头的相同超声传感器或不同的超声传感器(例如,专用治疗传感器)以施加超声治疗脉冲(框104)。超声治疗施加在感兴趣的区域中或附近引起组织位移,在施加超声能量之后使用递送的跟踪脉冲来识别所述组织位移(框106)。来自跟踪脉冲的反射波生成跟踪数据。跟踪数据和参考数据用于确定由超声能量脉冲引起的组织位移(框108)。
22.在某些实施方案中,选择参考和跟踪脉冲的控制参数,使得它们是短的并且能量足够低以引起组织的最小位移或不引起组织的位移。也就是说,所识别的位移是由治疗脉冲而不是由参考/跟踪脉冲引起的。在某些实施方案中,在脉冲间隔之间发射跟踪脉冲,使得针对所施加的每个脉冲跟踪位移。以这种方式,可以跟踪复合位移直到达到平稳值。此外,可以实时确定位移,以允许调节或修改治疗脉冲控制参数。
23.对60个人受试者检查了作为神经调制超声治疗结果的组织位移和生理作用之间的关系。将受试者随机分配到六个组之一(每组n = 10)。如本文所公开的,超声用于引起靶向内部组织的感兴趣的区域的组织位移振动。各组人受试者接受假对照超声剂量、115 w/cm2的半幅剂量 (isppa空间峰脉冲平均强度)或362 w/cm2的全幅剂量(isppa)。50%振幅(368 w/cm2)的时间平均功率(ispta)高于100%振幅(290 w/cm2),因为它被更频繁地推动。将用于接受超声能量的受试者的超声剂量施加到单个位点(第1-3组)或分布在多个位点之间(第4-6组)。
24.图10显示每个受试者的实验方案。对于接受超声的那些人受试者,在禁食抽血后递送治疗剂量,以获得各种血液分子的基线水平,所述血液分子例如tnf、细胞因子(il-1、il-6、il-8、il-10)、葡萄糖和去甲肾上腺素。通过对静脉抽血的血液进行lps测定,评估血液细胞对lps的tnf响应。将血液暴露于浓度为0、0.1、1、10和100ng/ml的lps,然后用人tnf elisa分析每个样品。计算五个lps浓度的tnf响应浓度的曲线下面积(auc),并用于表征血液细胞的tnf响应。将超声能量施加到每个受试者的脾组织中的感兴趣的区域。在治疗剂量后1小时、2小时和24小时进行禁食抽血。图11总结了不同组中的每一组的受试者的控制参数和所得组织位移。图12是脾的单一位点相对于多位点递送的示意性表示。
25.图13显示在感兴趣的集中的(单个位点)区域内的脾超声刺激的结果。较大的位移与刺激后2小时血液细胞对lps的tnf响应的较大降低有关。上方括号显示比较感兴趣的单个或集中治疗区域内的小和大位移的p值(wilcoxon测试)。所示数据来自第1组的8个受试者(小位移)、第2组的10个受试者(中等位移)和第3组的8个受试者(大位移)。
26.图14显示中等位移组的集中的(单个位点)与分布的(多个位点)超声能量施加之间的组织位移之间的比较。对于集中的区域内的中等位移,脾超声刺激倾向于在刺激后2小时引起血液细胞对lps的tnf响应的更大降低。上方括号显示比较集中的区域相对于分布的区域内的中等位移的p值(wilcoxon测试)。所示数据来自第2组的10个受试者(中等位移)和
第5组的9个受试者(中等位移)。
27.图15显示大位移组的集中的(单个位点)与分布的(多个位点)超声能量施加之间的组织位移之间的比较。对于集中的区域内的大位移,脾超声刺激倾向于在刺激后2小时引起血液细胞对lps的tnf响应的更大降低。上方括号显示比较集中的区域相对于分布的区域内的大位移的p值(wilcoxon测试)。所示数据来自第3组的8个受试者(大位移)和第6组的9个受试者(大位移)。
28.图16是6个受试者组中tnf响应的总结。上方面板显示对于单个位点能量施加的tnf变化,而底部面板显示对于分布的能量施加的tnf变化。结果显示,第2组和第3组之间所施加的压力或功率的变化与tnf响应相对于基线的显著变化相关联。研究组还显示在24小时时恢复到基线tnf水平。
29.如所示的,超声能量施加控制参数的变化和感兴趣的区域选择以与组织位移程度相关的方式影响生理结果。虽然实验结果显示作为超声能量施加(例如超声治疗)的结果的tnf相对于基线的变化,应当理解这些结果作为实例呈现。本技术可以诱导和评估与期望的生理结果相关联的感兴趣的区域中的组织位移的存在或水平,例如感兴趣的分子的浓度相对于治疗前的基线水平的变化。代替跟踪分子浓度的变化或除了跟踪分子浓度的变化之外,本技术可以评估组织位移以确定神经调制超声治疗是有效的。
30.图17显示用于神经调制以实现神经调制作用的系统200,例如,神经调制递送系统,所述神经调制作用例如与响应于能量的施加的突触的组分(例如,突触前细胞、突触后细胞)的神经递质释放和/或激活相关联的靶向组织204的一个或多个感兴趣的区域202处的组织位移。所描述的系统包括耦合到能量施加装置206的脉冲发生器214。能量施加装置206被配置为例如经由导线或无线连接接收能量脉冲,所述能量脉冲在使用中被引导到受试者的一个或多个内部组织或一个或多个器官中的多个感兴趣的区域20,这进而导致靶向生理结果。
31.在某些实施方案中,能量施加装置206和/或脉冲发生器214可以无线通信,例如与可以进而向脉冲发生器214提供指令的控制器216通信。在其它实施方案中,能量施加装置206可以是体外装置,例如,可以经皮或以非侵入方式从受试者体外的位置操作以施加能量,并且在某些实施方案中,可以与脉冲发生器214和/或控制器16集成。在其中能量施加装置206是体外的实施方案中,能量施加装置206可以由护理者操作并且定位在受试者皮肤上或上方的点,使得能量脉冲经皮递送至期望的内部组织。一旦定位成将能量脉冲施加到期望的一个或多个感兴趣的区域202,系统200就可以启动一个或多个神经通路的神经调制,以实现靶向生理结果或临床作用。在其它实施方案中,脉冲发生器14和/或能量施加装置206可以植入在生物相容性位点(例如腹部)处,并且可以例如经由一根或多根导线在内部耦合。在一些实施方案中,系统200可以被实施为使得一些或所有元件可以以有线或无线方式彼此通信。
32.在某些实施方案中,系统200可以包括评估装置220,其耦合到控制器216并且评估指示是否已经实现调制的靶向生理结果的特性。在一个实施方案中,靶向生理结果可以是局部的。例如,一个或多个神经通路的调制可以导致局部组织或功能变化,例如组织结构变化、某些分子的浓度的局部变化、组织位移、增加的流体运动等。靶向生理结果可以是治疗方案的目标。
33.调制一个或多个神经通路以实现靶向生理结果可以导致全身或非局部变化,并且靶向生理结果可以与循环分子的浓度变化或不包括直接施加能量的感兴趣的区域的组织的特性变化相关。在一个实例中,位移可以是期望的调制的替代测量,并且低于预期位移值的位移测量可以导致调制参数的修改,直到诱导预期的位移值。因此,在一些实施方案中,评估装置220可以被配置为评估浓度变化。在一些实施方案中,评估装置220可以被配置为评估组织位移。例如,评估装置可以被配置为使用弹性成像技术。弹性成像可以用于检查组织材料性质。在本技术中,弹性成像可以用于评估由超声治疗脉冲或剂量方案诱导的组织变化。虽然单独显示系统200的所描述的元件,应当理解,这些元件中的一些或全部可以彼此组合。
34.基于该评估,可以改变控制器216的调制参数,使得递送有效量的能量。例如,如果期望的调制与在限定的时间窗(例如,在能量施加程序开始之后5分钟、30分钟)内或相对于程序开始时的基线浓度(一个或多个分子的循环浓度或组织浓度)的变化相关联,则可能期望调制参数(例如脉冲频率或其它参数)的变化,其进而可以由操作者或经由自动反馈回路提供给控制器216,用于限定或调节脉冲发生器214的能量施加参数或调制参数,直到调制参数导致有效量的能量被施加。在一个实施方案中,可以基于来自评估装置的关于在治疗方案的过程中神经调制能量的功效的反馈来细化初始限定的感兴趣的区域202以产生更新的感兴趣的区域202。反馈可以是例如由于神经调制能量的施加而导致的组织位移。对感兴趣的区域的这些细化或更新可以用作患者特定网络的一部分,其中更新网络以基于期望的临床结果来识别对该特定个体的感兴趣的生理参数具有最大影响的特定感兴趣的区域。
35.如本文所提供的系统200可以根据各种调制控制参数提供能量脉冲作为治疗方案的一部分以施加有效量的能量。例如,调制控制参数可以包括从连续到间歇范围的各种刺激时间模式。使用间歇刺激,在信号接通时间期间以特定频率在一段时间内递送能量。信号接通时间之后是没有能量递送的时间段,称为信号断开时间。控制参数还可以包括刺激施加的频率和持续时间。施加频率可以是连续的,或者在各种时间段(例如在一天或一周内)被递送。此外,治疗方案可以指定一天中施加能量的时间或者与进食或其它活动相关的时间。引起靶向生理结果的治疗持续时间可以持续各种时间段,包括但不限于几分钟至几小时。在某些实施方案中,具有指定的刺激模式的治疗持续时间可以持续一小时,以例如72小时的间隔重复。在某些实施方案中,可以以较高的频率(例如每三小时)递送能量较短的持续时间(例如30分钟内)。根据调制参数(例如治疗持续时间、频率和振幅)可以可调节地控制能量的施加以实现期望的结果。
36.图18是系统200的某些组件的框图。如本文所提供的,用于神经调制的系统200可以包括脉冲发生器214,其适于生成用于施加到受试者的组织的多个能量脉冲。脉冲发生器214可以是单独的,或者可以集成到外部装置(例如控制器216)中。控制器216包括用于控制装置的处理器230。软件代码或指令存储在控制器216的存储器232中,以由处理器230执行来控制装置的各种组件。控制器216和/或脉冲发生器214可以经由一个或多个导线或无线地连接到能量施加装置206。
37.控制器216可以包括具有输入/输出电路234和显示器236的用户界面,其适于允许临床医生向调制程序提供选择输入(例如,选择感兴趣的区域20或与期望的感兴趣的区域20相关联的靶向组织的图像上的特定片段)或控制参数。处理器230可以被配置为控制能量
施加装置并且驱动如本文提供的治疗传感器208和/或成像传感器210。此外,处理器230可以被配置为基于从成像传感器210接收的数据来确定组织位移。
38.系统可以包括光束控制器237,其可以通过控制能量施加装置206的转向和/或聚焦中的一个或两个来控制能量施加装置206的传感器14的能量光束的聚焦位置以施加治疗。光束控制器237还可以控制能量施加装置206的一个或多个铰接部分以重新定位传感器。光束控制器可以从处理器230接收指令以引起能量光束的聚焦和/或转向的改变。系统200可以响应于提供关于能量施加装置206的反馈的一个或多个位置传感器238和/或一个或多个接触传感器239。光束控制器237可以包括马达以促进能量施加装置206的一个或多个铰接部分的转向。预期系统200可以包括允许位置、转向和/或聚焦调节的特征,以促进本文公开的技术。
39.存储在存储器232中的每个调制程序可以包括一组或多组调制参数,包括脉冲振幅、脉冲持续时间、脉冲频率、脉冲重复率等。脉冲发生器214响应于来自控制器装置216的控制信号修改其内部参数,以改变通过导线233传输到能量施加装置206所施加到的受试者的能量脉冲的刺激特性。可以采用任何合适类型的脉冲发生电路,包括但不限于恒定电流、恒定电压、多个独立的电流或电压源等。所施加的能量是电流振幅和脉冲持续时间的函数。控制器216允许通过改变调制参数和/或在某些时间启动能量施加或在某些时间抑制能量施加来可调节地控制能量。在一个实施方案中,对能量施加装置206施加能量的可调节控制基于与确定的组织位移有关的信息。
40.如果信息来自评估装置220,则反馈回路可以驱动可调节的控制。例如,可以基于响应于神经调制的由评估装置220测量的组织位移来进行诊断。当位移高于所选择的阈值或范围时,控制器216可以启动向感兴趣的区域(例如,脾)施加能量并且利用与靶向生理结果相关联的调制参数(例如,循环葡萄糖的减少)的治疗方案。治疗方案可以使用与诊断方案中使用的那些不同的调制参数(例如,更高的能量水平、更频繁的施加)。
41.在一个实施方案中,存储器232存储可由操作者选择的不同的操作模式。例如,存储的操作模式可以包括用于识别特定的感兴趣的区域和执行与特定治疗位点相关联的一组调制参数的单独算法,所述特定治疗位点例如肝、胰腺、胃肠道、脾中的感兴趣的区域。基于相关器官的深度、感兴趣的区域的尺寸、期望的生理结果等,每个器官或位点可以具有不同的相关联的调制参数。不是让操作者手动输入模式,控制器216可以被配置为基于特定器官的选择来执行适当的指令。在另一实施方案中,存储器232存储用于不同类型的程序的操作模式。例如,激活可以与相对于与抑制或阻断组织功能相关联的刺激压力或频率范围不同的刺激压力或频率范围相关联。
42.在具体的实例中,当能量施加装置是超声传感器时,能量的有效量可以涉及施加到感兴趣的区域的所选择的时间平均强度。例如,能量的有效量可以包括时间平均功率(时间平均强度)和在1 mw/cm
2-30,000 mw/cm
2 (时间平均强度)和0.1 mpa-7 mpa (峰值压力)范围内的峰值正压。在一个实例中,在感兴趣的区域中,时间平均强度小于35 mw/cm2、小于500 mw/cm2或小于720 mw/cm2。在实例中,时间平均强度与小于与热损伤和消融/空化相关联的水平相关联。控制器216能够在验证模式下操作以获取所选择的治疗位置,并且所选择的治疗位置可以作为治疗操作模式的一部分实施,该治疗操作模式被配置为当能量施加装置206被定位在所选择的治疗位置处时执行治疗方案。
43.系统还可以包括成像装置,其促进聚焦能量施加装置206。在一个实施方案中,成像装置可以与能量施加装置206集成或与其成为同一装置,使得施加不同的超声参数(频率、孔径或能量)以用于选择(例如,空间选择)感兴趣的区域并且用于将能量聚焦到所选择的感兴趣的区域以用于靶向和随后的神经调制。在另一个实施方案中,存储器232存储一个或多个用于空间选择器官或组织结构内的感兴趣的区域的靶向或聚焦模式。空间选择可以包括选择器官的亚区域以识别对应于感兴趣的区域的器官的体积。空间选择可以依赖于如本文所提供的图像数据。基于空间选择,能量施加装置206可以聚焦(例如,使用光束控制器237)到对应于感兴趣的区域的所选择的体积上的位置。应当理解,用于引导聚焦位置的图像数据可以是体积或平面。例如,能量施加装置206可以被配置为首先在验证模式下操作,以通过捕获图像数据来获取所选择的治疗位置,所述图像数据用于识别与捕获感兴趣的区域相关联的所选择的治疗位置。验证模式能量不在适合于神经调制治疗的水平和/或应用适合于神经调制治疗的调制参数。然而,一旦识别感兴趣的区域,控制器216然后可以根据与实现靶向生理结果相关联的调制参数以治疗模式操作。
44.靶向组织可以是内部组织或包括轴突末端的突触和非神经元细胞的器官。可以通过向聚焦在靶向组织的感兴趣的区域20上的超声传感器的聚焦场内的轴突末端直接施加超声能量来刺激突触,以引起分子释放到突触空间中。可以选择感兴趣的区域以包括某些类型的轴突末端,例如特定神经元类型的轴突末端和/或与某些类型的非神经元细胞形成突触的轴突末端。因此,可以选择感兴趣的区域20以对应于具有期望的轴突末端的靶向组织(和相关联的非神经元细胞)的一部分。可以选择能量施加以优先触发由突触内的神经释放一种或多种分子(例如神经递质),或通过直接能量转导直接激活非神经元细胞本身,或引起神经和非神经元细胞两者内的激活,其引起期望的生理作用。
45.控制器216还可以被配置为接收与靶向生理结果相关的输入作为对调制参数的选择的输入。例如,当使用成像模态来评估组织位移时,控制器216可以被配置为接收特性的计算的指数或参数(例如,总位移、位移的变化率)。基于指数或参数是高于还是低于预定的阈值,可以提供诊断的指示或与达到的治疗目标相关的指示(例如,经由显示器)。在一个实施方案中,参数可以是受影响的组织的组织位移的度量或受影响的组织的深度的度量。其它参数可以包括评估一个或多个感兴趣的分子的浓度(例如,评估相对于阈值或基线/对照的浓度变化、变化率、确定浓度是否在期望的范围内中的一个或多个)。此外,能量施加装置206 (例如,超声传感器)可以在控制器216的控制下操作,以a)获取组织的图像数据,其可以用于在空间上选择靶向组织内的感兴趣的区域,b)将调制能量施加到感兴趣的区域,以及c)获取图像数据,以确定靶向生理结果已经发生(例如,经由位移测量)。在这样的实施方案中,成像装置、评估装置220和能量施加装置206可以是相同的装置。
46.在实施方案中,系统200可以被配置为设置用于治疗传感器208的控制参数以实现特定的分布、感兴趣的分子的变化或特征性组织位移。例如,受试者对神经调制能量的响应可以变化,并且可以涉及不同的控制参数以实现受试者之间的类似位移。可以调谐控制参数直到实现特征性组织位移。特征性或靶向组织位移可以是总位移度量,或者可以是基于度量的阈值或范围,由此实现靶向范围内的位移值指示成功的治疗。在实施方案中,特征性组织位移是存在两个阈值,低阈值和高阈值,并且靶向范围是在两个阈值之间的位移。与阈值相关联的控制参数可以随受试者而变化,并且系统200可以被调谐以基于施加到受试者
的试验或校准方案来识别阈值。一旦为每个受试者识别,在治疗方案的过程中可以使用实现阈值之间的位移和有效治疗范围内的位移的相关参数。组织位移或没有实现特征性或靶向位移也可以用于选择新的感兴趣的区域202。在一个实例中,感兴趣的区域202可能随着时间的推移在治疗上不太有效。这种治疗有效性的降低可以通过治疗方案过程中组织位移的变化或降低来识别。在另一个实例中,可以基于组织位移来识别或映射更响应的感兴趣的区域202。在一个实施方案中,在治疗开始时,可以使用期望的控制参数来映射靶向组织200,以基于通过以控制参数施加超声能量而引起的组织位移的程度来识别更有响应性的器官或组织的亚区域。一旦被映射,感兴趣的区域202可以从响应性(即,组织位移)中的排序在前的区域中选择,所述区域在物理上也位于含有一个或多个轴突末端的区域中,所述轴突末端在被刺激时引起期望的生理响应。这可以随受试者不同以及在受试者内随时间而变化。
47.本文讨论的神经调制技术可以用于引起感兴趣的分子的浓度变化(例如,增加、减少)和/或感兴趣的分子的特性变化。即,治疗可以引起组织产生或释放一个或多个感兴趣的分子(例如,第一感兴趣的分子、第二感兴趣的分子等)的变化,并且可以指由于向一个或多个组织(例如,第一组织、第二组织等)中的一个或多个感兴趣的区域(例如,第一感兴趣的区域、第二感兴趣的区域等)施加能量而改变分子的浓度(循环、组织)或特性(共价修饰)。感兴趣的分子的变化可以包括分子特性的变化,例如蛋白质的表达、分泌、易位和直接活性变化。可以基于所施加的能量对离子通道的作用来驱动所述变化,所述离子通道驱动神经活动和其自身功能,或者作为源自神经活动的分子或在非神经元细胞内直接激活的结果而调制相邻的非神经元细胞。感兴趣的分子的变化也可以指维持分子的期望的浓度,使得浓度的预期变化或波动(例如,由于进食)不因神经调制而发生。感兴趣的分子的变化可以指引起分子特征的变化,例如酶介导的共价修饰(磷酸化、乙酰化、核糖基化等的变化)。也就是说,应当理解,感兴趣的分子的变化可以指分子浓度和/或分子特性。感兴趣的分子可以是生物分子,例如碳水化合物(单糖、多糖)、脂质、核酸(dna、rna)或蛋白质中的一种或多种。在某些实施方案中,感兴趣的分子可以是信号分子,例如激素(胺激素、肽激素或类固醇激素)。
48.受试者之间的生理差异可以产生与实现感兴趣的分子浓度的靶向增加或减少或感兴趣的分子的其它类型的变化(例如,分子的激活状态的变化)相关联的组织位移水平的可变性。图19是用于调谐治疗脉冲的控制参数以相对于在治疗开始时或之前获取的基线测量实现感兴趣的分子中的期望的组织位移和/或特征性或阈值变化中的一个或两个的方法300的流程图。在方法300中,超声探头的传感器将参考成像脉冲递送至感兴趣的区域,并且收集从组织反射的超声波以生成基线或参考数据(框302),其由超声探头的控制器(例如,超声系统)接收。控制超声探头的相同超声传感器或不同的超声传感器(例如,专用治疗传感器)以施加超声治疗脉冲(框304)。在施加超声能量之后递送跟踪脉冲(框306),并且基于参考脉冲与跟踪脉冲之间的相位变化来确定组织位移(框308)。在某些实施方案中,识别感兴趣的分子的变化(框310)并且将其用于评估治疗脉冲的有效性。在某些实施方案中,组织位移用于评估治疗脉冲的有效性。基于感兴趣的分子的变化和/或组织位移,可以调谐治疗脉冲的控制参数(框312)以校准用于患者的治疗脉冲并促进更有效的神经调制治疗。
49.例如,可以调节驱动电压、脉冲重复间隔和脉冲长度中的一个或多个以调节治疗
脉冲的控制参数。在一个实施方案中,可以执行受试者特异性校准,其中施加治疗脉冲的控制参数并通过各种设置循环,同时在各种设置处跟踪感兴趣的分子的浓度。识别参数的有效范围,在该范围中观察到期望的作用(例如,阈值距离基线的%变化)。例如,如在图7中所示,增加200ms脉冲的周期数识别治疗脉冲引起葡萄糖浓度相对于基线的显著百分比变化的周期范围(150-250个周期)。可以使用与感兴趣的分子中观察到的期望的变化相关联的范围内的控制参数的设置来施加未来的治疗脉冲。在另一实施方案中,可以在调节控制参数期间跟踪组织位移。可以施加未来的治疗脉冲以引起与在校准期间所观察到的感兴趣的分子中的期望的变化相关联的组织位移(例如,在感兴趣的分子中相对于基线的特定百分比变化处的特定位移)。这可以导致控制参数动态调节到不同剂量的不同设置,因为受试者的组织可能基于受试者的代谢状态或临床病况在治疗方案的过程中不同地响应。应当理解,控制参数的调节可以是一个或多个控制参数的调节,并且可以包括与期望的生理结果相关联的控制参数的组合。此外,调节可以是对治疗脉冲的isppa或ispta的调节。在实施方案中,调节可以包括在多个感兴趣的区域之间分布治疗脉冲,或者基于对感兴趣的分子的变化的评估将分布的剂量合并到单个感兴趣的区域。例如,治疗方案可以开始于将剂量施加到单个感兴趣的区域。随着时间的推移,补偿或其它作用可能降低使用初始控制参数的治疗脉冲的有效性。治疗方案可以包括在多个位点之间分布的某些剂量以避免这样的补偿。
50.感兴趣的分子的变化可以是与阈值浓度的偏差或特定范围之外的浓度。感兴趣的分子的变化可以是距离基线的百分比变化,其可以高于或低于阈值百分比变化。例如,治疗方案可以具有引起感兴趣的分子的浓度改变(增加或减少)至少50%的阈值治疗目标。如果未达到治疗目标阈值,则调节控制参数,直到达到与治疗目标相关联的阈值,并且方法300可以迭代回到框304,直到超过阈值。在实施方案中,阈值可以是感兴趣的分子的浓度增加至少100%。在实施方案中,治疗目标可以是实现感兴趣的分子的浓度在特定范围内。
51.本公开的技术作用包括受控施加神经调制能量(例如,超声能量),以引起与期望的生理结果相关联的组织位移。通过跟踪组织位移作为治疗有效性的标记,神经调制递送系统可以通过在较低的总能量水平下实现期望的位移而更有效地操作。此外,神经调制能量可以在与靶向组织位移相关的治疗有效性的区域内递送,其避免无效的较低施加的能量以及可能与组织中的热和/或空化作用相关联的较高施加能量。
52.本书面描述使用实例(包括最佳模式),并且还使本领域技术人员能够实践所公开的技术,包括制造和使用任何装置或系统以及执行任何结合的方法。可专利范围由权利要求限定,并且可以包括本领域技术人员想到的其它实例。如果这样的其它实例具有与权利要求的字面语言没有不同的结构要素,或者如果它们包括与权利要求的字面语言无实质差异的等同结构要素,则这样的其它实例旨在处于权利要求的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。