1.本发明涉及一种基于聚乙烯醇修饰的四氧化三铁磁珠的制备方法。
背景技术:
2.脱氧核糖核酸(dna)是一种携带生物细胞中合成蛋白质所必需的遗传信息的核酸,是生物体发育和正常运转所必需的。dna分析由于其固有的特异性和技术能力,使得检测灵敏、快速对临床诊断、基因组学和食品安全有着至关重要的作用。在复杂的生物样品中,dna的含量相对较低(相对于其他成分),因此样品中含有的蛋白质、多糖、磷脂和代谢物会严重干扰dna检测。
3.传统dna检测方法如苯酚/氯仿抽提法,异丙醇沉淀法,甲酰胺裂解法等主要借助沉淀,离心和过滤步骤,耗时耗力且提取效率低下。近年来,新的dna提取方法如液-液萃取法、液-液微萃取法、固相萃取法、磁固相微萃取法等得到了越来越多的研究。在以上提及这些方法中,磁固相微萃取因其低成本、少用有机溶液、过程简单、省时省力等优点,被广泛用于dna的富集检测。同时,磁固相微萃取中使用的磁性纳米颗粒(mnps)可以利用外部磁场快速收集,从而避免了因离心步骤产生的剪切力导致核酸降解损失。
4.在实际应用中,通常需要对磁性纳米颗粒(mnps)进行合适的表面修饰,一方面是为防止裸露的磁性纳米颗粒氧化和团聚,另一方面可以实现对核酸的高通量、自动化提取。常用于表面修饰的材料包括氨基硅烷化试剂、二巯基丁二酸、壳聚糖、聚乙烯亚胺、聚乙烯醇等。聚乙烯醇因其生物相容、无毒、低成本等优点,被广泛用于磁性纳米颗粒的修饰。基于聚乙烯醇修饰的fe3o4,材料表面富含大量的羟基官能团,材料分散性得到了很大的提高。如在wo 01/70831中,w.jeffery等报道了pva修饰的磁性纳米颗粒的合成及其生物材料分离方面的潜在性能。他们以体积分数2~7%的戊二醛为交联剂,质量分数为2.5~5%、分子量大于50000g/mol的聚乙烯醇为聚合物层,10-200nm的fe3o4为磁核,采用反向微乳液法合成了聚乙烯醇包覆的磁性纳米颗粒,但该方法制得的磁性纳米粒子尺寸大小为0.5~5μm,分布范围宽,尺寸大小不均一。再如在wo 2014/015966中,jungen oster等人探究了搅拌速度、聚合物浓度和交联剂浓度等因素对pva修饰的磁性纳米颗粒尺寸的影响,并将其用于实时定量荧光pcr检测。结果表明,高搅拌速度、低浓度聚合物和交联剂可以使微粒尺寸减小,磁性核心占比增加,甚至可以达到90%以上,但带来的是微粒悬浮分散性能变差。以上方法制得的磁性纳米粒子虽然可以实现对游离dna的分离富集,但都存在修饰过程繁琐,材料尺寸不一,尺寸分布范围较宽,磁性核心占比较少等问题,导致批次之间分离性能差异较大,分离时间有所延长。
技术实现要素:
5.发明目的:本发明目的旨在提供一种磁珠尺寸均一、且不同批次间磁珠尺寸差异小、磁性核心占比大、磁响应速度快的四氧化三铁磁珠的制备方法。
6.技术方案:本发明所述的基于聚乙烯醇修饰的四氧化三铁磁珠的制备方法,在有
机溶剂中,以1,6-己二基二异氰酸酯作为交联剂将fe3o4@sio2与聚乙烯醇进行桥联得到聚乙烯醇修饰的四氧化三铁磁珠。
7.上述制备方法具体包括如下步骤:
8.(1)将fe3o4@sio2超声分散于无水dmso中,搅拌下再往其中加入1,6-己二基二异氰酸酯,得到异氰酸基修饰的fe3o4@sio2;
9.(2)将步骤(1)得到的异氰酸基修饰的fe3o4@sio2分散于聚乙烯醇的dmso溶液中,反应后得到聚乙烯醇修饰的四氧化三铁磁珠。
10.其中,步骤(1)中,fe3o4@sio2中fe3o4的尺寸为15~400nm,二氧化硅壳层厚度为5~10nm。
11.其中,步骤(1)中,对于每g fe3o4@sio2,1,6-己二基二异氰酸酯的加入量为不大于1ml。
12.其中,步骤(2)中,聚乙烯醇的dmso溶液中,聚乙烯醇的质量分数为1~1.5%,聚乙烯醇的醇解度为92~94mol%。
13.其中,步骤(2)中,异氰酸基修饰的fe3o4@sio2与聚乙烯醇dmso溶液的质量体积比为10:1。
14.其中,步骤(1)中,fe3o4@sio2采用如下方法制备而成:
15.(1.1)按质量比1:1.5~3将fecl3·
6h2o和naac加入到有机溶剂中,充分溶解后,将混合物料置于高温下反应,得到fe3o4纳米粒子;所述fe3o4纳米粒子的粒径范围为15-400nm;通过控制原料fecl3·
6h2o和naac的加入比例,控制铁离子的水解速度快慢,最后通过加热得到超顺磁性fe3o4颗粒;
16.(1.2)将步骤(1.1)得到的fe3o4纳米粒子超声分散于盐酸溶液中,超声处理后用水洗涤至中性;将fe3o4纳米粒子与盐酸反应,使铁氧键暴露出来利于与二氧化硅的结合;
17.(1.3)将步骤(1.2)处理过的fe3o4超声分散于乙醇和水的混合溶剂中,加入氨水调节溶液为碱性,然后加入正硅酸四乙酯,反应后得到fe3o4@sio2;fe3o4@sio2为以四氧化三铁为核,在四氧化三铁表面包裹有二氧化硅层;通过控制fe3o4与正硅酸四乙酯的加入比,控制fe3o4外sio2层的包裹厚度,当sio2层的包裹厚度厚会影响终产物磁珠的磁性强度。
18.本发明方法的合成路线为:
[0019][0020]
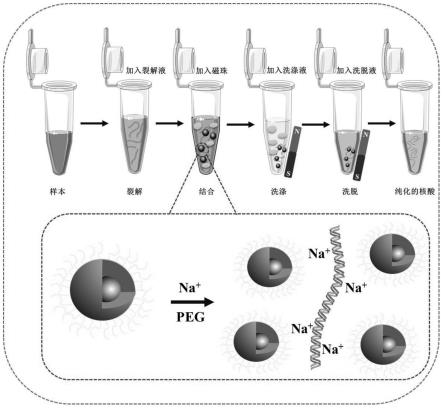
本发明制得的聚乙烯醇修饰的fe3o4磁珠应用于核酸富集分离的原理为:在一定浓度nacl和peg溶液的协同作用下,游离的dna分子被沉淀下来,借助na
的盐桥作用,实现fe3o4磁珠对dna的结合,达到分离富集检测的目的。
[0021]
本发明制得的聚乙烯醇修饰的fe3o4在细菌质粒dna提取方面的应用,具体为:
[0022]
s1、裂解:菌体裂解液的制备:取过夜培养液于离心管中,4℃下10000r/min条件离心5min,弃上清液;向离心管中加入200μl溶菌酶溶液重悬菌体,37℃水浴30min,间或混匀直至细胞壁破碎,然后加入400μl细菌裂解液i和20μl蛋白酶k,震荡混匀5-6次,至溶液完全澄清;取出离心管,然后加入300μl细菌裂解液ii,充分混匀,12000rpm下离心5~10min,留上清液,得到细菌裂解液;
[0023]
s2、结合:取15μl fe3o4磁珠浓度为10mg/ml的悬浮液,悬浮液是将磁珠分散在水里,与结合缓冲液按合适体积比混匀,然后加入s1所得的细菌裂解液中,吹打混匀,室温静置1min;磁分离20s后,弃上清液,向离心管中加入质量分数为70%乙醇溶液洗涤2~3次,晾干至管内无液体残留;所用结合缓冲液为质量分数20%peg 8000和浓度2mol/l naci的混合溶液,结合缓冲液和悬浮液的体积比为50:1;
[0024]
s3、洗脱:加入te缓冲溶液洗脱吸附在fe3o4磁珠表面的dna,65℃水浴5~10min,间或混匀,磁分离,小心取上清液至新的离心管,获得细菌组dna。
[0025]
有益效果:(1)本发明方法制得的聚乙烯醇修饰的fe3o4磁珠尺寸均一,不同批次间尺寸差异小且重现性良好;(2)本发明方法制得的fe3o4磁珠磁性核心占比高,四氧化三铁外的二氧化硅和聚乙烯醇共同形成的壳层厚度为10nm以下,而fe3o4核尺寸大,为400nm左右,磁性核心占比高,磁性强,磁珠的饱和磁强度为77.21emu/g,磁响应时间为20s,具有磁响应速度快、分离时间短的优点,在磁分离过程中,能够实现30s以内的快速分离;(3)本发明方法制得的fe3o4磁珠表面富含羟基基团,材料在样品中分散稳定性良好,在一定浓度peg和nacl溶液协助下,与游离的dna分子实现结合,从而实现其能够应用于微量核酸的分离富集;(4)本发明制得的聚乙烯醇修饰的四氧化三铁磁珠dna提取灵敏度高,能够在较低的浓度下,实现dna实时荧光pcr扩增,ct值为18。
附图说明
[0026]
图1为实施例1制得的fe3o4磁珠提取细菌质粒dna的流程以及原理图;
[0027]
图2为实施例1制得的fe3o4磁珠的磁滞回线图;
[0028]
图3为不同fe3o4磁珠用量对细菌质粒dna提取效率的影响;
[0029]
图4为不同浓度nacl对fe3o4磁珠细菌质粒dna提取效率的影响;
[0030]
图5为不同浓度peg 8000对fe3o4磁珠细菌质粒dna提取效率的影响;
[0031]
图6为洗脱温度对fe3o4磁珠细菌质粒dna提取效率的影响;
[0032]
图7为在优化条件下,fe3o4磁珠与fe3o4@sio2提取细菌质粒dna的磁响应速度对比图;
[0033]
图8为在优化条件下,fe3o4磁珠与fe3o4@sio2提取细菌质粒dna的实时pcr扩增结果图。
[0034]
图9为在优化条件下,fe3o4磁珠与fe3o4@sio2提取细菌质粒dna的荧光pcr扩增结果图。
具体实施方式
[0035]
以下结合具体实施例对本发明的技术方案做进一步说明。
[0036]
实施例1
[0037]
本发明基于聚乙烯醇修饰的四氧化三铁磁珠的制备方法,包括如下步骤:
[0038]
(1)将200mgfe3o4@sio2超声分散于40ml无水dmso中,搅拌(搅拌速度100r/min)后往其中加入200μl1,6-己二基二异氰酸酯,得到异氰酸基修饰的fe3o4@sio2;
[0039]
(2)将步骤(1)中200mg异氰酸基修饰的fe3o4@sio2分散于20ml质量浓度为1%的聚乙烯醇dmso溶液中,反应后得到聚乙烯醇修饰的四氧化三铁磁珠。超声混匀后测定固含量,即每毫升溶液中,聚乙烯醇包覆的四氧化三铁磁珠的质量为4.2mg/ml。
[0040]
从图2可以看出,制得的聚乙烯醇修饰的fe3o4磁珠呈现超顺磁性,无任何磁滞现象,饱和磁强度为77.21emu/g。
[0041]
实施例2
[0042]
聚乙烯醇修饰fe3o4磁珠加入量的不同对细菌质粒dna提取效率的影响:
[0043]
(1)裂解:菌体裂解液的制备:取过夜培养液于离心管中,4℃下10000r/min条件离心5min,弃上清。向离心管中加入200μl溶菌酶溶液重悬菌体,37℃水浴30min,间或混匀直至细胞壁破碎。然后加入200μl细菌裂解液i和20μl蛋白酶k,震荡混匀5-6次,至溶液完全澄清。取出离心管,然后加入细菌裂解液ii,充分混匀,12000rpm离心5~10min,留上清,得到细菌裂解液。
[0044]
(2)结合:设置磁珠用量梯度,分别取5μl、10μl、15μl、20μl、25μl和30μl浓度为10mg/ml的聚乙烯醇修饰的fe3o4磁珠与结合缓冲液按体积比1:50混匀,其中结合缓冲液中nacl浓度为2mol/l,peg 8000质量分数为20%。然后分别加入(1)所得的细菌裂解液中,吹打混匀,室温静置1min;磁分离,弃上清,向离心管中加入70%乙醇洗涤2~3次,晾干至管内无液体残留。
[0045]
(3)洗脱:加入ph=8的te缓冲溶液洗脱吸附在材料表面的dna,65℃水浴5~10min,间或混匀,磁分离,小心取上清至新的离心管,获得细菌组dna。
[0046]
(4)检测:借助nanodrop 2000微量紫外分光光度计测定dna浓度;具体如下,首先将得到的细菌组dna摇动混匀,取1μl滴加到检测台上,读出dna浓度。然后依据公式q=c
×
v/m,计算得到提取dna的效率。其中,q为提取dna的效率(mg/g),m为加入的聚乙烯醇修饰的磁珠质量(μg),c为得到的dna浓度,v为得到的细菌dna的体积。
[0047]
从图3的结果可以看出,随着聚乙烯醇修饰fe3o4磁珠加入量的增加,提取dna量效率先是不断增加,然后逐渐降低,推测原因可能为菌液中dna总量有限,磁珠吸附已经达到饱和。(加入量增加提取量降低的原因是随着磁珠加入量增加,分母增大,分子不变,提取效率降低),临界点加入聚乙烯醇修饰fe3o4磁珠的体积为15μl。可以得出,当聚乙烯醇修饰fe3o4磁珠的加入量为15μl,吸附效率最高。
[0048]
实施例3
[0049]
结合缓冲液中nacl浓度的不同对细菌质粒dna提取效率的影响:
[0050]
(1)裂解:菌体裂解液的制备:取过夜培养液于离心管中,4℃下10000r/min条件离心5min,弃上清。向离心管中加入200μl溶菌酶溶液重悬菌体,37℃水浴30min,间或混匀直至细胞壁破碎。然后加入200μl细菌裂解液i和20μl蛋白酶k,震荡混匀5-6次,至溶液完全澄清。取出离心管,然后加入细菌裂解液ii,充分混匀,12000rpm离心5~10min,留上清,得到细菌裂解液。
[0051]
(2)结合:取15μl、10mg/ml聚乙烯醇修饰的fe3o4磁珠与一系列结合缓冲液按体积
比1:50混匀,其中,结合缓冲液中nacl浓度分别为0.5mol/l、1.0mol/l、1.5mol/l、2.0mol/l、2.5mol/l、3.0mol/l和3.5mol/l。然后分别加入(1)所得的细菌裂解液中,吹打混匀,室温静置1min。磁分离,弃上清,向离心管中加入70%乙醇洗涤2~3次,晾干至管内无液体残留。
[0052]
(3)洗脱:加入ph=8的te缓冲溶液洗脱吸附在材料表面的dna,65℃水浴5~10min,间或混匀,磁分离,小心取上清至新的离心管,获得细菌组dna。
[0053]
(4)检测:借助nanodrop 2000微量紫外分光光度计测定dna浓度。具体如下,首先将得到的细菌组dna摇动混匀,取1μl滴加到检测台上,读出dna浓度。然后依据公式q=c
×
v/m,计算得到提取dna的效率。其中,q为提取dna的效率(mg/g),m为加入的聚乙烯醇修饰的磁珠质量(μg),c为得到的dna浓度,v为得到的细菌dna的体积。
[0054]
从图4可以看出,随着nacl浓度的增加,提取dna的效率是不断增加,然后逐渐降低。可以得出,当nacl浓度为2.5mol/l时,吸附效率最高。原因是当nacl浓度不断升高,溶液中离子强度增大,聚乙烯醇修饰的fe3o4磁珠出现聚沉现象,影响其吸附效率。
[0055]
实施例4
[0056]
结合缓冲液中peg 8000浓度的不同对细菌质粒dna提取效率的影响:
[0057]
(1)裂解:菌体裂解液的制备:取过夜培养液于离心管中,4℃下10000r/min条件离心5min,弃上清。向离心管中加入200μl溶菌酶溶液重悬菌体,37℃水浴30min,间或混匀直至细胞壁破碎。然后加入200μl细菌裂解液i和20μl蛋白酶k,震荡混匀5-6次,至溶液完全澄清。取出离心管,然后加入细菌裂解液ii,充分混匀,12000rpm离心5~10min,留上清,得到细菌裂解液。
[0058]
(2)结合:取15μl、10mg/ml聚乙烯醇修饰的高磁性fe3o4与一系列结合缓冲液按体积比1:50混匀,其中,结合缓冲液中peg 8000质量分数分别为5%、10%、15%、20%、25%和30%,然后分别加入(1)所得的细菌裂解液中,吹打混匀,室温静置1min。磁分离,弃上清,向离心管中加入70%乙醇洗涤2~3次,晾干至管内无液体残留。
[0059]
(3)洗脱:加入ph=8的te缓冲溶液洗脱吸附在材料表面的dna,65℃水浴5~10min,间或混匀,磁分离,小心取上清至新的离心管,获得细菌组dna。
[0060]
(4)检测:借助nanodrop 2000微量紫外分光光度计测定dna浓度。具体如下,首先将得到的细菌组dna摇动混匀,取1μl滴加到检测台上,读出dna浓度。然后依据公式q=c
×
v/m,计算得到提取dna的效率。其中,q为提取dna的效率(mg/g),m为加入的聚乙烯醇修饰的磁珠质量(μg),c为得到的dna浓度,v为得到的细菌dna的体积。
[0061]
从图5可以看出,随着peg 8000质量分数的增加,提取dna的效率先是不断增加,然后略微降低,但分离时间显著增加。原因是peg 8000质量分数过高时,混合液黏性增强,磁性粒子扩散受阻,混合和磁分离时间延长,给实际操作带来了一定困难。由此可以得出,当peg 8000质量分数为15%,分离时间短且吸附效率最高。
[0062]
实施例5
[0063]
洗脱温度的不同对细菌质粒dna提取效率的影响:
[0064]
(1)裂解:菌体裂解液的制备:取过夜培养液于离心管中,4℃下10000r/min条件离心5min,弃上清。向离心管中加入200μl溶菌酶溶液重悬菌体,37℃水浴30min,间或混匀直至细胞壁破碎。然后加入200μl细菌裂解液i和20μl蛋白酶k,震荡混匀5-6次,至溶液完全澄清。取出离心管,然后加入细菌裂解液ii,充分混匀,12000rpm离心5~10min,留上清,得到
细菌裂解液。
[0065]
(2)结合:取15μl、10mg/ml聚乙烯醇修饰的fe3o4磁珠与一系列结合缓冲液按体积比1:50混匀,其中,结合缓冲液中nacl的浓度为2.5mol/l,peg 8000质量分数分别为15%,然后分别加入(1)所得的细菌裂解液中,吹打混匀,室温静置1min。磁分离,弃上清,向离心管中加入70%乙醇洗涤2~3次,晾干至管内无液体残留。
[0066]
(3)洗脱:分别加入ph=8的te缓冲溶液洗脱吸附在材料表面的dna,分别在40℃、50℃、60℃、70℃、80℃和90℃条件下水浴5~10min,间或混匀,磁分离,小心取上清至新的离心管,获得细菌组dna。
[0067]
(4)检测:借助nanodrop 2000微量紫外分光光度计测定dna浓度。具体如下,首先将得到的细菌组dna摇动混匀,取1μl滴加到检测台上,读出dna浓度。然后依据公式q=c
×
v/m,计算得到提取dna的效率。其中,q为提取dna的效率(mg/g),m为加入的聚乙烯醇修饰的磁珠质量(μg),c为得到的dna浓度,v为得到的细菌dna的体积。
[0068]
从图6可以看出,随着洗脱温度的增加,提取得到的dna量先是不断增加,然后略微降低。原因是温度升高减弱了dna和材料间的相互作用,提取的细菌dna更容易脱附下来,脱附效率显著提高。但温度过高给实际操作带来了一定麻烦,相应操作繁琐(如冷却到室温时间长,影响后续相关pcr实验的开展)、升温时间长(水浴升温时间长)。由此可以得出,当洗脱温度为70℃,脱附效率最高。
[0069]
实施例6
[0070]
为了凸显本发明制备的聚乙烯醇修饰的fe3o4提取质粒dna的磁响应速度快,将聚乙烯醇修饰的fe3o4磁珠与fe3o4@sio2提取细菌质粒dna的磁响应速度进行了对比:
[0071]
1)裂解:菌体裂解液的制备:取过夜培养液于离心管中,4℃下10000r/min条件离心5min,弃上清。向离心管中加入200μl溶菌酶溶液重悬菌体,37℃水浴30min,间或混匀直至细胞壁破碎。然后加入200μl细菌裂解液i和20μl蛋白酶k,震荡混匀5-6次,至溶液完全澄清。取出离心管,然后加入细菌裂解液ii,充分混匀,12000rpm离心5~10min,留上清,得到细菌裂解液。
[0072]
(2)结合:分别取15μl、10mg/ml聚乙烯醇修饰的fe3o4磁珠、fe3o4@sio2与结合缓冲液按体积比1:50混匀,其中,结合缓冲液中nacl的浓度为2.5mol/l,peg 8000质量分数分别为15%,然后分别加入(1)所得的细菌裂解液中,吹打混匀,室温静置1min。磁分离,弃上清,评估磁分离速度快慢。
[0073]
磁响应速度结果如图7所示,可以清楚的看到,相较于fe3o4@sio2(图8左),在外部磁场作用下,聚乙烯醇修饰的fe3o4磁珠可以在20s内快速响应,而fe3o4@sio2响应时间稍稍延长。因此,可以得出结论,本发明制得的聚乙烯醇修饰的fe3o4具有快的磁响应速度,将其应用于微量核酸的分离,大大节省时间。
[0074]
实施例7
[0075]
为了凸显本发明制备的聚乙烯醇修饰的fe3o4提取质粒dna的效率高,将聚乙烯醇修饰的fe3o4磁珠与fe3o4@sio2提取细菌质粒dna的效果进行了对比:
[0076]
(1)裂解:菌体裂解液的制备:取过夜培养液于离心管中,4℃下10000r/min条件离心5min,弃上清。向离心管中加入200μl溶菌酶溶液重悬菌体,37℃水浴30min,间或混匀直至细胞壁破碎。然后加入200μl细菌裂解液i和20μl蛋白酶k,震荡混匀5-6次,至溶液完全澄
清。取出离心管,然后加入细菌裂解液ii,充分混匀,12000rpm离心5~10min,留上清,得到细菌裂解液。
[0077]
(2)结合:分别取15μl、10mg/ml聚乙烯醇修饰的fe3o4磁珠、fe3o4@sio2与结合缓冲液按体积比1:50混匀,其中,结合缓冲液中nacl的浓度为2.5mol/l,peg 8000质量分数分别为15%,然后分别加入(1)所得的细菌裂解液中,吹打混匀,室温静置1min。磁分离,弃上清,向离心管中加入70%乙醇洗涤2~3次,晾干至管内无液体残留。
[0078]
(3)洗脱:分别加入ph=8的te缓冲溶液洗脱吸附在材料表面的dna,分别在40℃、50℃、60℃、70℃、80℃和90℃条件下水浴5~10min,间或混匀,磁分离,小心取上清至新的离心管,获得细菌组dna。
[0079]
(4)pcr扩增:选用的合适的mix体系进行扩增,具体条件如下:首先依次在pcr扩增管中加入5μl 2
×
mix buffer,2μl ddh2o,上游引物和下游引物各1μl,模板为提取的细菌dna2μl,总体积为10μl。然后将其放入pcr扩增仪进行扩增,循环扩增条件如下:95℃预变性2min,94℃变形30s,61℃退火30s,72℃预延伸30s,72℃延伸10min,循环次数为35次。
[0080]
pcr扩增结果如图8所示,聚乙烯醇修饰的fe3o4磁珠和fe3o4@sio2提取的乙肝病毒质粒dna均得到了良好的扩增。相较于fe3o4@sio2,聚乙烯醇修饰的fe3o4磁珠对应的条带更亮,说明聚乙烯醇修饰的fe3o4磁珠提取出的初始dna模板量比fe3o4@sio2多,由此可以得出结论,本发明制得的聚乙烯醇修饰的fe3o4磁珠具有良好的dna提取效果,可以将其应用于微量核酸的检测。
[0081]
实施例8
[0082]
为了凸显本发明制备的聚乙烯醇修饰的fe3o4提取质粒dna的灵敏度更高,将聚乙烯醇修饰的fe3o4磁珠与fe3o4@sio2提取细菌质粒dna的荧光pcr扩增结果进行了对比:
[0083]
(1)裂解:菌体裂解液的制备:取过夜培养液于离心管中,4℃下10000r/min条件离心5min,弃上清。向离心管中加入200μl溶菌酶溶液重悬菌体,37℃水浴30min,间或混匀直至细胞壁破碎。然后加入200μl细菌裂解液i和20μl蛋白酶k,震荡混匀5-6次,至溶液完全澄清。取出离心管,然后加入细菌裂解液ii,充分混匀,12000rpm离心5~10min,留上清,得到细菌裂解液。
[0084]
(2)结合:分别取15μl、10mg/ml聚乙烯醇修饰的fe3o4磁珠、fe3o4@sio2与结合缓冲液按体积比1:50混匀,其中,结合缓冲液中nacl的浓度为2.5mol/l,peg 8000质量分数分别为15%,然后分别加入(1)所得的细菌裂解液中,吹打混匀,室温静置1min。磁分离,弃上清,向离心管中加入70%乙醇洗涤2~3次,晾干至管内无液体残留。
[0085]
(3)洗脱:分别加入ph=8的te缓冲溶液洗脱吸附在材料表面的dna,分别在40℃、50℃、60℃、70℃、80℃和90℃条件下水浴5~10min,间或混匀,磁分离,小心取上清至新的离心管,获得细菌组dna。
[0086]
(4)荧光pcr扩增:选用的合适的mix体系进行扩增,具体条件如下:首先依次在pcr扩增板中加入10μl 2
×
mix buffer,6μl ddh2o,上游引物和下游引物各0.5μl,探针0.5μl,模板为提取的细菌dna2.5μl,总体积为20μl。然后将其放入pcr扩增仪进行扩增,循环扩增条件如下:95℃预变性2min,94℃变形15s,61℃退火30s,72℃预延伸30s,72℃延伸10min,循环次数为40次。
[0087]
荧光pcr扩增结果如图9所示,可以明显看到,聚乙烯醇修饰的fe3o4磁珠和fe3o4@
sio2提取的乙肝病毒质粒dna均得到了良好的扩增,当荧光pcr扩增信号到达设定阈值时,相应的ct值分别为18和22,即达到相同的荧光强度时,聚乙烯醇修饰的fe3o4循环圈数更少,灵敏度更高。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。