1.本发明属于细胞培养技术领域,尤其涉及一种猪骨髓间充质干细胞分离培养的优化方法。
背景技术:
2.目前,间充质干细胞(mscs)可从各种组织来源分离出来,包括骨髓、脂肪、胎盘、结缔组织等,其中骨髓来源的mscs被称为骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,bmscs),具有免疫调节功能和向多种细胞分化的能力,还有高增殖率的特点,具有广阔的研究和应用前景。传统的全骨髓培养法是利用bmscs在低血清条件下具有良好的粘附能力,并在更换培养液时清除非附着的杂细胞,以实现bmscs的分离纯化;percoll和ficoll浓度梯度离心法是根据bmscs浓度与其他各组分不同从而进行分离;还有根据细胞表面标记物,采用流式细胞仪对bmscs进行分选,流式细胞仪分选可得到高纯度的bmscs,但对细胞的活力及分化能力影响较大,对骨髓要求量大、实验条件也较苛刻。由于bmscs在骨髓中的含量低,细胞占比也很小,要使分离后的bmscs有较好的活性和较高的增殖能力,采用传统的分离方法,bmscs中通常会混杂其他细胞,导致bmscs分离纯度不高,对其后续分化能力也有影响。
3.通过上述分析,现有技术存在的问题及缺陷为:传统的骨髓间充质干细胞分离方法中,bmscs中通常会混杂其他细胞,分离效果不理想。
技术实现要素:
4.针对现有技术存在的问题,本发明提供了一种猪骨髓间充质干细胞分离培养的优化方法。
5.本发明是这样实现的,一种猪骨髓间充质干细胞分离培养的优化方法,所述猪骨髓间充质干细胞分离培养的优化方法包括:
6.向收集的骨髓液中加入一定量的红细胞裂解液促使红细胞裂解,采用半换液的方法,利用bmscs在低血清培养基中对塑料培养皿有较强的粘附性的特点,在换液的过程中逐渐除去不贴壁的杂细胞,并通过传代纯化细胞。
7.进一步,所述猪骨髓间充质干细胞分离培养的优化方法包括以下步骤:
8.步骤一,利用pbs冲洗腿骨外部,并利用全骨髓干细胞培养液采集骨髓;
9.步骤二,将冲洗后的全骨髓干细胞培养液移至离心管中进行离心;
10.步骤三,加红细胞裂解液,吹打,静置;
11.步骤四,将经步骤三静置后的液体进行离心,收集细胞层;
12.步骤五,向细胞沉淀中加入培养液,每三天更换一半培养基;
13.步骤六,第9天对细胞进行传代。
14.进一步,所述步骤一中的采集骨髓包括:
15.获取小猪的大腿骨,并用含3%、1%青链霉素的pbs多次冲洗腿骨外部,在无菌超
净台中,用经高压灭菌过的手术刀将猪腿骨两端脆骨削开露出红色骨髓,用20ml无菌注射器头戳穿骨髓两端。
16.进一步,所述步骤一中的采集骨髓还包括:
17.用10ml含1%青链霉素的pbs清洗将穿孔的猪腿骨的外部轻轻清洗干净,将穿孔的猪腿骨放于新的10cm培养皿中。
18.进一步,所述步骤一中的采集骨髓还包括:
19.用1ml的一次性无菌注射器抽取5ml全骨髓干细胞培养液,从腿骨一端向另一端冲洗骨髓内部,反复冲洗骨髓3~5次。
20.进一步,所述步骤二中的离心包括:
21.将冲洗后的全骨髓干细胞培养液移至15ml离心管中,1200r/min离心5min,弃上清液,得细胞沉淀。
22.进一步,所述步骤三中的加红细胞裂解液包括:
23.加入步骤二所述细胞沉淀5倍体积量的红细胞裂解液,轻轻吹打细胞沉淀,静置5min。
24.进一步,所述步骤四中的离心包括:
25.静置后的液体在1200r/min的转速下离心5min,弃上清,得细胞沉淀。
26.进一步,所述步骤五中,向步骤四所述细胞沉淀中加10ml干细胞培养液,并将吹打后的细胞悬液铺于t75细胞培养瓶,每隔3d对细胞进行一次半换液。
27.进一步,所述步骤六中,在第9天bmscs的细胞形态明显区别于其他类型的细胞时进行传代,所述细胞传代包括:
28.吸出全部培养液,加入预热的pbs轻柔清洗一次,弃去pbs,加2ml胰酶消化1~3min;将培养瓶置于显微镜下观察,待细胞变圆漂浮时加入6~9ml含血清的培养基或1ml血清终止消化;用巴氏吸管吹打使细胞从培养瓶壁上脱落下来,收集液体至15ml离心管,1200r/min离心5min,弃上清;向细胞沉淀中加10ml干细胞培养液,细胞悬液铺于10cm细胞培养皿中。
29.结合上述的技术方案和解决的技术问题,请从以下几方面分析本发明所要保护的技术方案所具备的优点及积极效果为:
30.第一、针对上述现有技术存在的技术问题以及解决该问题的难度,紧密结合本发明的所要保护的技术方案以及研发过程中结果和数据等,详细、深刻地分析本发明技术方案如何解决的技术问题,解决问题之后带来的一些具备创造性的技术效果。具体描述如下:
31.从猪腿骨的骨髓中分离出纯度较高的间充质干细胞,并保证细胞较好的活性,能增殖。由于骨髓中间充质干细胞占比较少,同时骨髓中含有大量红细胞和其他类型的杂细胞,采用传统分离方法获得的bmscs纯度不高,通常还需借助流式细胞仪来分选细胞,需要一定的技术要求且成本高。故通过本发明提供的优化实验步骤,简洁高效的分离出纯度较高的bmscs,并使之大量增殖,可满足后续的其他研究;一是加入用红细胞裂解液来裂解骨髓液中的红细胞这一步骤,可以快速去除大量红细胞,提高分离bmscs的纯度;二是在细胞铺板后每三天进行一次半换液,而不是一次性换走全部培养液,这样可以在注入新鲜培养液的同时又尽可能多的保留bmscs;三是在铺板后的第9天,bmscs的细胞形态显现后进行传代,可进一步去除杂细胞,纯化bmscs。
32.腿骨中的骨髓液含有大量红细胞,影响bmscs的分离,本发明通过向收集的骨髓液中加入一定量的红细胞裂解液来促使红细胞裂解,进而提高bmscs的分离效率;再利用bmscs在低血清培养基中对塑料培养皿有较强的粘附性的特点,在换液的过程中逐渐除去不贴壁的杂细胞,从而达到分离纯化bmscs的目的,其操作简单且不易污染。采用本发明提供的半换液方法,在一定程度上可以保留更多的bmscs,以免只更换一次培养液损失许多还未贴壁的细胞。
33.本发明提供的猪骨髓间充质干细胞分离培养优化方法还具有以下优点:
34.①
用含青链霉素的pbs多次冲洗外部,保证了无菌,消除外部污染对后续细胞培养的影响。用全骨髓干细胞培养液冲洗骨髓,使我们要分离的bmscs一开始就处于适宜生长的培养液中;
35.②
第一次离心后获得鲜红色的细胞沉淀(此时细胞沉淀中含有大量红细胞),弃上清,去除了上清液中的杂质;
36.③
加入红细胞裂解液裂解上一步细胞沉淀中的红细胞,提高bmscs分离的纯度,离心后获得白色的细胞沉淀,若还有红色可重复步骤三;
37.④
采用半换液的方式留住更多的bmscs,在此过程中bmscs的细胞形态逐渐显现,并明显区别于其他类型的细胞;
38.⑤
bmscs的细胞形态显现后通过传代的方式,进一步纯化细胞,并使bmscs增殖。
39.第二,把技术方案看做一个整体或者从产品的角度,本发明所要保护的技术方案具备的技术效果和优点,具体描述如下:
40.本发明采用优化操作来分离bmscs,在骨髓液中加入红细胞裂解液,使得骨髓液中占比多的红细胞破碎裂解,可提高细胞纯度;另一方面是采用半换液的方法,通过少量多次的手段以保留更多的细胞;使用优化后的方法,可以提高bmscs的分离效率和纯度,又避免对其活性的影响,且操作简便,成本低。
41.第三,作为本发明的权利要求的创造性辅助证据,还体现在以下几个重要方面:
42.(1)本发明的技术方案填补了国内外业内技术空白:
43.bmscs的分离方法很多,但少有将几种方法融合起来使用。本发明分离猪的bmscs,首先加入红细胞裂解液去除骨髓液中的红细胞,再通过bmscs贴壁的特性进一步去除杂细胞,并用半换液的方法尽可能多的留住bmscs,最后通过传代纯化细胞,并使bmscs增殖。采用传统的单一方法,bmscs的分离效果不理想,本发明融合多种方法,优化细节操作,可以更简便的从骨髓中分离出纯度较高的、活性较好的bmscs。
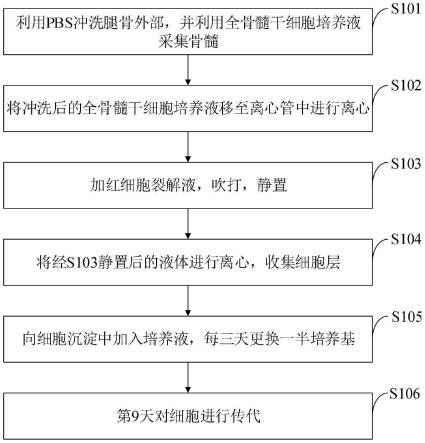
44.(2)本发明的技术方案是否克服了技术偏见:
45.传统方法中仅使用密度梯度离心来分离bmscs,并不能较好的去除包括红细胞在内的杂细胞,有人认为红细胞裂解液在裂解红细胞的同时,可能会影响其他细胞的活性。本发明优化的操作中增加了红细胞裂解液的使用,提高了bmscs的分离纯度,同时分离出的bmscs有较好的活性,能大量增殖,也能进行后续的成脂诱导分化实验。
附图说明
46.为了更清楚地说明本发明实施例的技术方案,下面将对本发明实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本发明的一些实施例,对于
本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。
47.图1是本发明实施例提供的猪骨髓间充质干细胞分离培养优化方法流程图。
具体实施方式
48.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
49.针对现有技术存在的问题,本发明提供了一种猪骨髓间充质干细胞分离培养的优化方法,下面结合附图对本发明作详细的描述。
50.一、解释说明实施例。为了使本领域技术人员充分了解本发明如何具体实现,该部分是对权利要求技术方案进行展开说明的解释说明实施例。
51.如图1所示,本发明实施例提供的猪骨髓间充质干细胞分离培养的优化方法包括以下步骤:
52.s101,利用pbs冲洗腿骨外部,并利用全骨髓干细胞培养液采集骨髓;
53.s102,将冲洗后的全骨髓干细胞培养液移至离心管中进行离心;
54.s103,加红细胞裂解液,吹打,静置;
55.s104,将经s103静置后的液体进行离心,收集细胞层;
56.s105,向细胞沉淀中加入培养液,每三天更换一半培养基;
57.s106,第9天对细胞进行传代。
58.本发明实施例提供的步骤s101中的采集骨髓包括:获取小猪的大腿骨,并用含青链霉素的pbs冲洗腿骨外部,在无菌超净台中,用经高压灭菌过手术刀将猪腿骨两端脆骨削开露出红色骨髓,用20ml无菌注射器头戳穿骨髓两端;用10ml含1%青链霉素的pbs清洗将穿孔的猪腿骨的外部轻轻清洗干净,将穿孔的猪腿骨放于新的10cm培养皿中;用1ml的一次性无菌注射器抽取5ml全骨髓干细胞培养液,从腿骨一端向另一端冲洗骨髓内部,反复冲洗骨髓3~5次。
59.本发明实施例提供的步骤s102中的离心包括:将冲洗后的全骨髓干细胞培养液移至15ml离心管中,1200r/min离心5min,弃上清液,得细胞沉淀。
60.本发明实施例提供的步骤s103中的加红细胞裂解液包括:加入细胞沉淀5倍体积量的红细胞裂解液,轻轻吹打,静置5min。
61.本发明实施例提供的步骤s104中的离心包括:静置后的液体在1200r/min的转速下离心5min,弃上清,得细胞沉淀。
62.本发明实施例提供的步骤s105中,向细胞沉淀中加10ml干细胞培养液,细胞悬液铺于t75细胞培养瓶,每隔3d对细胞进行一次半换液。
63.二、应用实施例。为了证明本发明的技术方案的创造性和技术价值,该部分是对权利要求技术方案进行具体产品上或相关技术上的应用实施例。
64.使用本发明的技术方案分离一月龄雌性巴马猪的bmscs,分离出的细胞刚铺板时(记为第0天),在光学显微镜下呈单细胞悬浮状态,每三天进行一次半换液,培养液中存在很多漂浮细胞,多呈圆形,培养至第7天时出现纤维状细胞,第9天时纤维状细胞汇合度达到
80%左右,此时进行传代培养。传代后,圆形细胞明显减少,纤维状细胞随培养时间的延长而增多,多呈排列状分布,有的呈“旋涡”状。
65.分离出的巴马猪bmscs用流式细胞仪分析其表面抗原:孵育抗体cd44时,检测到bmscs中共有81.7%的细胞表达cd44;孵育抗体cd90时,检测到bmscs中共有88.3%的细胞表达cd90;孵育抗体cd105时,检测到bmscs中共有89.3%的细胞表达cd105。综上按此方法分离纯化的巴马猪bmscs细胞纯度在86.4%左右。
66.待bmscs长满后,进行成脂诱导培养,在诱导的第1-2天可以观察到细胞内有脂滴出现,随着诱导时间的增加脂滴不断变大变圆。通过油红o染色可观察到诱导分化后的细胞脂滴明显,通过实时荧光定量pcr(qpcr)检测诱导分化后细胞的成脂标志基因的表达水平,发现这些基因的表达水平显著高于未诱导分化的细胞。综上按此方法分离纯化的巴马猪bmscs细胞有较好的活性,并能进行成脂诱导实验。
67.本发明的技术方案能简便高效的分离猪bmscs,成本低,并且分离出的细胞活性好,可用于后续其他的实验。
68.三、实施例相关效果的证据。本发明实施例在研发或者使用过程中取得了一些积极效果,和现有技术相比的确具备很大的优势,下面内容结合试验过程的数据、图表等进行描述。
69.1.实验原理
70.腿骨中的骨髓液含有大量红细胞,影响bmscs的分离,向收集的骨髓液中加入一定量的红细胞裂解液来促使红细胞裂解,进而提高bmscs的分离效率。再利用bmscs在低血清培养基中对塑料培养皿有较强的粘附性的特点,在换液的过程中逐渐除去不贴壁的杂细胞,从而达到分离纯化bmscs的目的,其操作简单且不易污染。采用半换液的方法,在一定程度上可以保留更多的bmscs,以免只更换一次培养液损失许多还未贴壁的细胞。
71.2.实验流程(见表1)
72.表1实验流程
[0073][0074]
3.实验具体步骤
[0075]
(1)获取小猪的大腿骨,并用含3%、1%青链霉素的pbs多次冲洗腿骨外部,在无菌
超净台中,用经高压灭菌过的手术刀将猪腿骨两端脆骨削开露出红色骨髓,用20ml无菌注射器头戳穿骨髓两端,再用10ml含1%青链霉素的pbs清洗将穿孔的猪腿骨的外部轻轻清洗干净,把穿孔的猪腿骨放于新的10cm培养皿中。
[0076]
(3)用1ml的一次性无菌注射器抽取5ml全骨髓干细胞培养液,从腿骨一端向另一端冲洗骨髓内部,反复冲洗骨髓3~5次。
[0077]
(4)将冲洗后的全骨髓干细胞培养液移至15ml离心管中,1200r/min离心5min,弃上清液。
[0078]
(5)加入沉淀5倍体积量的红细胞裂解液,轻轻吹打细胞沉淀,静置5min。
[0079]
(6)静置后的液体在1200r/min的转速下离心5min,弃上清。
[0080]
(7)向细胞沉淀中加10ml干细胞培养液,吹打后的细胞悬液铺于t75细胞培养瓶。
[0081]
(8)每隔3d对细胞进行一次半换液。
[0082]
(9)第9天bmscs的细胞形态明显区别于其他类型的细胞,进行传代:吸出全部培养液,加入预热的pbs轻柔清洗一次,弃去pbs,加2ml胰酶消化1~3min,将培养瓶置于显微镜下观察,待细胞变圆漂浮时加入6~9ml含血清的培养基(或1ml血清)终止消化,用巴氏吸管吹打使细胞从培养瓶壁上脱落下来,收集液体至15ml离心管,1200r/min离心5min,弃上清,向细胞沉淀中加10ml干细胞培养液,细胞悬液铺于10cm细胞培养皿中。
[0083]
4.实验器材及试剂
[0084]
(1)主要实验器材:手术刀、无菌注射器、10cm培养皿、烧杯、t75细胞培养瓶、常温离心机、15ml离心管、co2培养箱;
[0085]
(2)主要实验试剂:青链霉素、pbs、全骨髓干细胞培养液、红细胞裂解液。
[0086]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。