1.本发明涉及单细胞组学分析领域,更具体地涉及一种应用于单细胞组学分析的细胞-微珠配对捕获方法。
背景技术:
2.细胞是生物体基本的结构和功能单位,多细胞生物体由各种形态功能不同的细胞组成。细胞的异质性是一种普遍存在的生物学现象,即使看起来相同的细胞,也可能存在显著的异质性。因此,在单细胞层面上研究细胞的异质性是十分必要的,需要建立有效分析单个细胞的化学信息,抑或是测定单细胞对外界刺激的反应的研究平台,使人们更充分地了解细胞群体中某些特殊的细胞功能,更能鉴别大量细胞群体中少量的不正常细胞,为重大疾病的早期诊断和治疗、药物筛选和细胞间相互作用等研究提供可靠的科学依据。实现单细胞分析的一个重要过程是进行细胞-微珠的配对捕获,将其置于独立的环境,以防止细胞间交叉污染。细胞-微珠配对捕获涉及到微流控技术,微流控技术是一种精确控制和操控微尺度流体,以在微纳米尺度空间中对流体进行操控为主要特征的技术,可将反应缩小到微米尺度,因而也可以对微米尺度的细胞进行精确的操控。基于微流控技术的单细胞分析系统通常具有微量、高效、高通量、微型化、集成化、便携化的特点。
3.当前微流控芯片技术发展到了一个相对成熟的阶段,基于液滴的微流控技术和基于流体力学的微流控技术在单细胞分析领域中广泛应用,基于微流控芯片技术的商业化产品也见诸市场。利用液滴微流控法捕获单细胞是在封闭的微通道网络中生成纳升至皮升级液滴并将单个细胞包裹在液滴中,每个液滴皆可作为独立的单细胞微反应器,最终可满足多种单细胞的研究需求。基于液滴微流控的单细胞捕获芯片,加工成本低,消耗试剂和样品量少,捕获速度快,但是这种方法配对效率低,即常存在单个液滴中无细胞包裹或多个细胞包裹的情况,并且包裹单细胞后的微液滴位置难以固定,不太适合特定单细胞的实时观察。如市面上的drop-seq和paired-seq,二者均是基于液滴进行细胞-微珠配对捕获,采取先进行细胞-微珠配对后形成液滴的策略。drop-seq结构简单,易于操作,但细胞-微珠配对效率低;paired-seq在基于液滴策略的基础上,通过应用差流阻力原理和微阀微泵结构,提高了细胞-微珠的配对效率,但复杂的器件结构大大提高了成本和操作复杂度,加工设计难,且当前只能实现2000个通量。
4.基于流体力学的微流控技术在单细胞分析中的应用,通常需要合理地设计芯片中微通道及与细胞尺寸相当的捕获微结构,即可实现高通量的细胞-微珠捕获。传统的流体力学捕获法操作过程简单,无需使用特殊的缓冲液,并且固定的捕获位点适合于单细胞的实时观察和追踪分析,但是这种方法的芯片可能会存在交叉污染的问题,如seq-well,细胞往往暴露在同一溶质下,细胞存在与临近细胞交流的可能,并非完全意义上的单细胞组学分析。
技术实现要素:
5.本发明的目的是提供一种应用于单细胞组学分析的细胞-微珠配对捕获方法,从而解决现有单细胞组学分析平台中捕获结构存在交叉污染、样本消耗量大、结构复杂、通量低的问题。
6.为了解决上述问题,本发明采用以下技术方案:
7.提供一种应用于单细胞组学分析的细胞-微珠配对捕获方法,包括以下步骤:s1:提供一种微流控捕获装置,所述微流控捕获装置包括可分离的颗粒捕获层与衬底层,所述颗粒捕获层中设置有入口、出口、以及若干捕获微结构,所述捕获微结构呈阵列式分布,用于细胞-微珠的一对一配对捕获;s2:从所述入口处通入细胞悬浊液或微珠悬浊液,逐步完成单个细胞、单个微珠在所述捕获微结构中的一对一配对捕获,从而形成由若干细胞-微珠捕获单元组成的阵列;s3:继续从所述入口处灌注可受控固化溶液以替换所述颗粒捕获层上的细胞悬浊液或微珠悬浊液,根据溶液特性在所述微流控捕获装置内实现所述可受控固化溶液的固化,使每一个细胞-微珠捕获单元形成相互隔绝的独立腔室;s4:将所述衬底层与所述颗粒捕获层分开,从而形成敞口的细胞-微珠捕获单元阵列,被捕获的细胞-微珠可进行下一步的单细胞组学分析。
8.步骤s2中,细胞和微珠的捕获方法包括流体动力学方法、外加物理场捕获方法等,其中,所述外加物理场包括:光、声、磁、电等。
9.步骤s3中,所述可受控固化溶液包括光敏水凝胶、热敏水凝胶,或者各种类型的疏水性聚合物等。
10.步骤s4中,所述下一步的单细胞组学分析包括:单细胞基因组测序、单细胞转录组测序、单细胞全转录组测序、单细胞基因组与转录组平行测序。
11.所述细胞-微珠配对捕获方法可用于不同尺寸的细胞和微珠、细胞与细胞、微珠与微珠的捕获。
12.所述衬底层的材料包括:玻璃,pdms,有机玻璃等,优选为玻璃。
13.根据本发明的一个优选实施方式,步骤s1中,提供一种微流控捕获装置,所述颗粒捕获层包括:流入区、捕获区、流出区,所述流入区包括依次连接的入口、分流道、预过滤器,所述捕获区包括阵列式分布的捕获微结构,每个捕获微结构由数个微柱组成,所述数个微柱在内部围成一个捕获腔,其中两个微柱之间构成一个微结构入口,另外两个微柱之间构成一个微结构出口,通过应用流体动力学方法即可实现细胞-微珠的一对一配对捕获。
14.优选地,用于构成微结构入口的其中一个微柱采用可发生形变的薄膜结构,在中等流量下经过滤后的细胞或微珠进入捕获区,所述薄膜结构保持形状不变,一个单细胞捕获微结构捕获到一个细胞或微珠,然后将流量提高,所述薄膜结构发生形变,所述微结构入口尺寸变大,所述捕获到的一个细胞或微珠得以释放和储存在所述捕获腔中。
15.应当理解的是,本发明以流体动力学方法进行细胞和微珠的一一配对捕获为例,但此处仅作为举例而非限制,实际上任何能够实现细胞和微珠的一一配对捕获的微流控捕获装置均适用于本发明。
16.根据本发明的一个优选实施方式,所述可受控固化溶液为光敏水凝胶时,当细胞-微珠配对捕获完成后,从所述微流控捕获装置的入口处通入光敏水凝胶,翻转所述微流控捕获装置,使所述衬底层朝上,紫外光经掩模版照射至颗粒捕获层,光敏水凝胶发生选择性
固化,形成独立腔室,去掉衬底层,则形成敞口的细胞-微珠捕获单元阵列。
17.根据本发明的一个优选实施方式,所述微流控捕获装置的制备方法如下:1)光刻掩膜版设计与制作:绘制微流控装置设计图,使用高精度打印输出为多张掩膜版,每张掩膜版具有透光和不透光的图案,用以在曝光步骤中形成图案;2)光刻制备模具:用光刻胶、掩模板和紫外光进行微制造,模具加工完成可重复可用,依次包括:清洗硅片、前烘、曝光、显影、坚膜,su-8模具制作完成;3)倒模;4)基底键合:使用等离子清洗机将需要键合的器件表面和洁净的玻璃片进行等离子体处理,将洁净器件有流道结构的表面和玻璃片接触,并轻轻按压,获得微流控捕获装置。
18.本发明的关键发明点在于,采取先进行细胞-微珠配对后形成类似于微井的独立腔室的策略,达到更高的捕获效率,解决交叉污染的问题,实现粒子之间相互作用的高通量并行动态观察,无需微阀微泵等复杂结构,大大降低了成本,为细胞-微珠的配对捕获提供新的思路,进而为单细胞测序及其他单细胞组学分析提供新方法。
19.与现有技术相比,本发明具有以下有益效果:
20.1)本发明采用先进行细胞-微珠配对再形成独立微井的策略,解决了现有的单细胞组学分析平台中捕获结构存在交叉污染的问题,也适用于样品较为稀缺的应用场合;
21.2)相较于先进行细胞-微珠配对后形成液滴的方法,本发明在配对效率和进行特定单细胞的实时观察方面具有显著优势;
22.3)本发明采用简单的流体动力学原理实现细胞-微珠捕获,无需借助微阀微泵等辅助结构,器件简单,易于操作,降低了成本,具有商业化、产业化优势;
23.4)本发明包含高密度微流控阵列,未来也将达到数万通量的测序,可实现大规模并行单细胞捕获和分析;
24.5)本发明通过软光刻倒模工艺制备,结构一次成型,工艺简单,易于实现。
25.综上所述,本发明为单细胞组学分析提供了一种高通量、高捕获效率、低成本、低污染的细胞-微珠配对捕获方法。
附图说明
26.图1为根据本发明的实施例1提供的一种细胞-微珠配对捕获方法的示意图,其中示出了采用一种微流控捕获装置进行细胞-微珠配对捕获的状态,a为侧视图,b为俯视图;
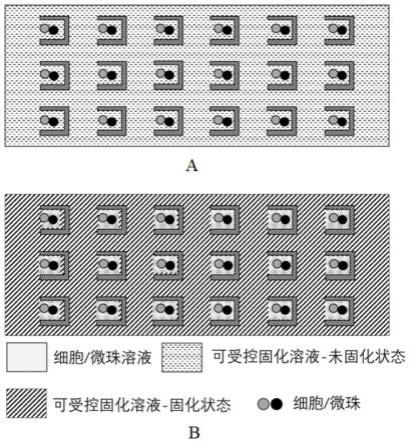
27.图2为根据本发明的实施例1提供的细胞-微珠配对捕获方法的步骤s3的过程示意图,其中,a为步骤s3中灌注可受控固化溶液替换细胞/微珠溶液的示意图,b为步骤s3中根据溶液特性在微流控捕获装置内实现选择性固化后的示意图;
28.图3为根据本发明的实施例1提供的细胞-微珠配对捕获方法的步骤s4的过程示意图,其中示出了步骤s4中实现选择性固化后将微流控捕获装置翻转,形成敞口细胞-微珠单元阵列的过程;
29.图4为根据本发明的实施例2提供的一种微流控捕获装置的颗粒捕获层的结构示意图;
30.图5为如图4所示颗粒捕获层中单个捕获微结构的细节放大示意图;
31.图6为采用如图4所示微流控捕获装置进行细胞-微珠配对捕获时,颗粒捕获层捕获细胞的过程示意图;
32.图7为采用如图4所示微流控捕获装置进行细胞-微珠配对捕获时,颗粒捕获层在完成细胞捕获后,进一步捕获微珠的过程示意图;
33.图8为根据本发明的实施例2提供的细胞-微珠配对捕获方法的步骤s3~s4中,实现选择性固化后形成敞口细胞-微珠单元阵列的立体示意图;
34.图9为根据本发明的实施例3中微流控捕获装置的加工示意图。
35.其中,附图标记含义如下:1、流入区,2、捕获区,3、流出区,4、入口,5、分流道,6、预过滤器,7、第三条流道,8、出口,9、细胞-微珠捕获阵列,10、薄膜结构,11、微结构入口,12、微结构出口,13、捕获腔。
具体实施方式
36.以下结合具体实施例,对本发明做进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。
37.实施例1一种细胞-微珠配对捕获方法
38.结合图1~图3所示,示出了根据本发明的一个优选实施例提供的一种细胞-微珠配对捕获方法,包括以下步骤:
39.s1:首先提供一种如图1所示的微流控捕获装置,该微流控捕获装置由颗粒捕获层与衬底层构成,两层之间可分离;该颗粒捕获层中设置有入口、出口、以及可一对一配对捕获细胞-微珠的若干捕获微结构,该捕获微结构呈阵列形式分布。
40.s2:依次从入口处向颗粒捕获层中通入细胞悬浊液、微珠悬浊液,在捕获微结构中依次实现单个细胞和单个微珠的捕获,从而形成大规模细胞-微珠配对阵列。
41.s3:配对捕获完成后,从入口处灌注可受控固化溶液以替换步骤s2中所用的细胞、微珠溶液,如图2中的a所示,根据溶液特性在装置内实现选择性固化,使每一个细胞-微珠捕捉单元形成相互隔绝的腔室,形成独立腔室,如图2中的b所示;每一个独立腔室代表一个微反应单元,每个微反应单元中包括单个细胞和单个微珠。
42.s4:首先将步骤s3中完成选择性固化的微流控捕获装置上下翻转,使衬底层朝上,然后将衬底层与颗粒捕获层分开,从而形成敞口的细胞-微珠单元阵列,类似于微井结构,如图3所示,被捕获的细胞-微珠即可进行下一步的单细胞组学分析。
43.应当理解的是,步骤s2中细胞和微珠的捕获方法包括但不限于包括流体动力学方法、外加物理场(光、声、磁、电等)捕获方法等,考虑到降低成本和简化结构,优选流体动力学方法。
44.还应当理解的是,利用上述方法实施单个细胞和单个微珠捕获时,分别地、先后地对微珠和细胞进行捕获。可选择地,先捕获微珠再捕获细胞,或先捕获细胞再捕获微珠。在捕获微珠或细胞时,微珠或细胞处于液体中。
45.步骤s3中,先在每一个腔室中完成单个细胞和单个微珠的捕获后,再通入可受控固化溶液并发生选择性固化,继而形成细胞-微珠的独立腔室阵列,以避免不同细胞-微珠之间的交叉污染;每一个独立腔室代表一个微反应单元,每个微反应单元中包括单个细胞和单个微珠。
46.步骤s3中,可受控固化溶液包括但不限于光敏水凝胶(可通过紫外光进行选择性固化);热敏水凝胶(可通过局部加热进行选择性固化),或者各种类型的疏水性聚合物等,
优选光敏水凝胶。
47.进一步的,若在步骤s4后需要进行下一步单细胞组学分析,可直接从敞口的一侧灌注溶液;如若进行细胞裂解,可从敞口一侧灌注细胞裂解液,实现每对细胞-微珠在单独的腔室中进行细胞裂解;
48.根据本发明,所述方法所捕获的对象实际并不局限于一个细胞与一个微珠,也可以是两个大小不同的微珠或微颗粒,或者是两个大小不同的细胞。
49.单细胞组学分析的范围包括但不限于单细胞基因组测序、单细胞转录组测序、单细胞全转录组测序、单细胞基因组与转录组平行测序等。
50.衬底层材料包括但不限于玻璃,pdms,有机玻璃等材料,优选玻璃。
51.实施例2一种微流控捕获装置以及细胞-微珠配对捕获方法
52.结合图4~图5所示,示出了根据本优选实施例提供的一种微流控捕获装置,该微流控捕获装置可通过流体动力学方法进行细胞-微珠捕获,详细描述如下:
53.该微流控捕获装置由颗粒捕获层与衬底层构成,两层之间可分离。如图4所示,颗粒捕获层从上游到下游依次包括:流入区1、捕获区2、流出区3。
54.流入区1包括:入口4、分流道5、预过滤器6。入口4与等宽的数条分流道5相连,分流道5以第三条流道7为对称轴对称,同时在流入区1后端预留一段形成预过滤器6,预过滤器6由相同大小的柱子等距交错排列组成。流出区3包括出口8。
55.捕获区2由高密度的阵列式排列的捕获微结构组成,每个捕获微结构可实现细胞-微珠的一对一配对捕获,通过这些捕获微结构组成一个细胞-微珠捕获阵列9。
56.根据该优选实施例,如图5所示,每个捕获微结构由四个微柱组成,这四个微柱在内部围成一个捕获腔13,其中两个微柱之间构成一个微结构入口11,另外两个微柱之间构成一个微结构出口12,微结构入口11、微结构出口12的开口尺寸均小于细胞粒径和微珠粒径,用于构成微结构入口11的其中一个微柱采用可发生形变的薄膜结构10,在中等流量下经过滤后的细胞或微珠进入捕获区,薄膜结构10保持形状不变,一个单细胞捕获微结构通过微结构入口11捕获到一个细胞或微珠,然后将流量提高,薄膜结构10发生形变,微结构入口11尺寸变大,捕获到的一个细胞或微珠得以释放和储存在捕获腔13中。
57.根据该优选实施例,还提供一种细胞-微珠配对捕获方法,包括以下步骤:
58.s1:提供如图4所示的微流控捕获装置;
59.s2:依次从入口处通入细胞悬浊液、微珠悬浊液,完成在微流控捕获装置中的单个细胞和单个微珠捕获,从而形成大规模细胞-微珠配对阵列。其中:
60.单个细胞捕获过程如下:
61.如图6所示,细胞悬浊液依次经过入口4、预过滤器6进入捕获区2,此时薄膜结构10变形小,微结构入口11的开口尺寸小于细胞粒径,细胞困在该微结构入口11处;接着,通过施加过量流量,微结构入口11随着薄膜结构10变形而逐渐变宽,大于细胞直径,释放细胞进入捕获腔13,细胞被释放后,变形的薄膜结构10就会因其弹性恢复而降低流速,从而恢复到其原始状态,完成一个细胞的捕获。
62.细胞捕获完成后进行微珠捕获,单个微珠捕获过程如下:
63.如图7所示,微珠悬浊液依次经过入口4、预过滤器6进入捕获区2,此时薄膜结构10变形小,微结构入口11的开口尺寸小于微珠粒径,微珠困在该微结构入口11处;接着,通过
施加过量流量,微结构入口11随着薄膜结构10变形而逐渐变宽,大于微珠直径,释放微珠进入捕获腔13,微珠被释放后,变形的薄膜结构10就会因其弹性恢复而降低流速,从而恢复到其原始状态,完成一个微珠的捕获。
64.应当理解的是,在正常流量状态下经过滤后的细胞或微珠进入捕获区2,一个捕获微结构捕获到一个细胞或微珠,随后的细胞或微珠通过流体流动的动态变化绕过该捕获微结构,前往下一个捕获微结构,导致单个细胞或微珠被截留。通过增加流量使薄膜结构10发生变形,微结构入口11开口尺寸增大,即可成功地完成被截留细胞或微珠的释放和储存。
65.s3:若可控固化溶液优选光敏水凝胶,当细胞-微珠配对捕获完成后,从入口处通入光敏水凝胶,翻转所述微流控捕获装置,使衬底层向上,紫外光经掩模版照射至所述微流控捕获装置,如图8中的a所示,光敏水凝胶发生选择性固化,形成独立腔室,每个独立腔室内包含一个细胞和一个微珠,如图8中的b所示。
66.s4:将衬底层与颗粒捕获层分开,从而形成敞口的细胞-微珠单元阵列,如图8中的c所示,被捕获的细胞-微珠可进行下一步的单细胞组学分析。
67.实施例3一种微流控捕获装置的制备
68.根据该优选实施例,本发明还提供一种微流控捕获装置的制备方法,加工流程如图9所示,详细描述如下:
69.(1)光刻掩膜版设计与制作:绘制微流控装置设计图,使用高精度打印输出为多张掩膜版,每张掩膜版具有透光和不透光的图案,用以在曝光步骤中形成图案。
70.(2)光刻制备模具
71.光刻是用光刻胶、掩模板和紫外光进行微制造,模具加工完成可重复可用,具体工艺如下:
72.①
清洗硅片
73.②
前烘(soft bake)
74.③
曝光(exposure):将掩模板放置在硅片上方,紫外光照射旋涂有光刻胶的硅片,光刻胶发生光化学反应,在掩模板上制备所需的图案;
75.④
显影(development):用显影液通过显影的化学方法除去未经曝光的光刻胶,将掩模版上的图案精确地复制到光刻胶层上;
76.⑤
坚膜(hard bake)
77.su-8模具制作完成。
78.(3)倒模
79.①
将su-8模具放置在大小合适的铝箔纸盒子里,倒入pdms,高度控制在2-3mm;
80.②
在120℃温度下加热0.5小时,0.5小时后pdms固化,将固化后的pdms从模具中轻轻脱模出来;
81.(4)基底键合
82.①
将上一步得到的器件有流道结构的表面朝上,在出入口处自上至下打孔,使流道能够与外界连通;
83.②
对打孔后的器件和玻璃片进行超声清洗,去离子水冲洗,氮气吹干,加热去除水分后保持器件洁净;
84.③
器件整体键合:使用等离子清洗机将需要键合的器件表面和洁净的玻璃片进行
等离子体处理,将洁净器件有流道结构的表面和玻璃片接触,并轻轻按压,获得芯片。
85.(5)衬底分离
86.按前述步骤完成细胞/微珠配对并且形成独立腔室后,将衬底玻璃片与pdms分离,分离过程保持玻璃片在上方,从而使得分离后pdms上所捕获细胞/微珠的腔室敞口向上。
87.以上所述的,仅为本发明的较佳实施例,并非用以限定本发明的范围,本发明的上述实施例还可以做出各种变化。凡是依据本发明申请的权利要求书及说明书内容所作的简单、等效变化与修饰,皆落入本发明专利的权利要求保护范围。本发明未详尽描述的均为常规技术内容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。