1.本发明属于有机化学合成技术领域,涉及百克级手性3-氟-1-氮杂二环[2,2,1]庚烷的合成。
背景技术:
[0002]
杂环化合物由于其独特的性能已广泛应用于农药、医药、染料等各个领域,特别在农药行列(张进,肖国民, 含氮杂环化合物的研究进展[j].石油化工,2011, 40, 579.)。氟有着原子体积小,电负性大的特点,在药物的设计中引入氟原子或者含氟基团,可调节物质的物理化学特性,提高药物的生物利用度,通过影响化合物的构象,会增强配体与靶标蛋白的相互结合能力以及对其它靶标蛋白的选择性,通过阻断易代谢位点进而提高药物代谢稳定性,所以氟原子在医药和农药方面起着重要的作用(赵方诺, 氟原子在药物设计中的主要应用以及引入方法[j].文化与艺术, 2019, 247.)。如今含氟杂环化合物成为新型农药、医药中间体开发的重中之重,而氮杂二环[2,2,1]庚烷是部分药物中间体中的分子骨架(johnson, c. r., kangas, b. d., jutkiewicz, e. m., winger, g., bergman, j., coop, a., woods, j. h. j pharmacol exp ther.,2021, 377, 336.),使得3-氟-1-氮杂二环[2,2,1]庚烷在药物应用方面具有可能性。氟原子在铁电材料的设计中也有着很好的作用,常常利用单氟原子取代设计策略来提高铁电材料的居里温度,研究发现f原子的引入通常会增强其生物相容性并且不会影响到极性点群的变化,可以诱导对称破缺来增强居里温度和自发极化等物理性质,如1-氮杂二环[2,2,1]庚烷、奎宁环,这种氮杂环被氟原子取代后,会使原本铁电体的居里温度升高,其在文献中已有报道(liu, h. y., zhang, h. y., chen, x. g., xiong, r. g. j. am. chem. soc., 2020, 142, 15205.)。如氟取代的4-氟-1-氮杂二环[2,2,1]庚烷(tang, y. y., xie, y., zeng, y. l., liu, j. c., he, w. h., huang, x. q., xiong, r. g. adv. mater., 2020, 32, 2003530.)和4-氟奎宁环(tang, y. y., xie, y., ai, y., liao, w. q., li, p. f., nakamura, t., xiong, r. g. j. am. chem. soc.,2020, 142, 21932.)属于氟取代的胺类化合物都能被用来设计分子铁电材料。
[0003]
在文献的检索中发现虽然已有研究人员对3-氟-1-氮杂二环[2,2,1] 庚烷进行了合成,但是其所用的原料3-羟基-1-氮杂二环[2,2,1]庚烷需要通过已知的化合物进行多步合成得到。利用其合成得到的3-氟-1-氮杂二环[2,2,1] 庚烷,没有给出产物明确的产率,也没有产物的数据,并且没有涉及到它的手性产物分子的合成(macleod, a. m., herbert, r., hoogsteen, k. j. chem. soc. chem. comm.,1990, 100.)。而手性3-氟取代-1-氮杂二环[2,2,1]庚烷无法直接从市场上直接购买,并且迄今为止还没有比较合适的能够大量合成手性3-氟-1-氮杂二环[2,2,1]庚烷的方法。
技术实现要素:
[0004]
本发明的目的在于提供一种利用廉价原料合成手性3-氟-1-氮杂二环[2,2,1]庚
烷的方法。此反应过程原料易得,合成步骤简便,化学技术可行,产率高,是大量合成此化合物可行的实验方法。
[0005]
一种合成手性3-氟-1-氮杂二环[2,2,1]庚烷的方法,以n-叔丁氧羰基-3-氟-4-哌啶酮为原料,经过五步反应与手性超临界流体色谱分离,实现了4种新型手性3-氟-1-氮杂二环[2,2,1]庚烷异构体的合成。具体包括以下步骤,第一步是将n-叔丁氧羰基-3-氟-4-哌啶酮与叶立德试剂、碱发生wittig反应,将羰基的碳氧双键转化成碳碳双键;第二步是利用第一步生成的化合物ii,加入硼烷络合物、过氧化氢和碱与碳碳双键发生硼氢化氧化反应,将化合物ii的双键变成羟甲基;第三步是用试剂m,在碱作用的条件下将羟基转变成容易离去的-ots基团得到的异构体混合物,可用高效液相色谱(hplc)分离得到两种外消旋体混合物iva与ivb,再用手性超临界流体色谱拆分得到两对对映异构体va和vb、vc和vd;第四步反应是va、vb、vc或vd在酸性的条件下脱去n原子上的叔丁氧羰基保护基团(boc)后,得到化合物via、vib、vic或vid;第五步是在碱性条件下发生亲核取代的关环反应,经过萃取、去除溶剂和浓缩后,得到4种新的手性3-氟-1-氮杂二环[2,2,1]庚烷异构体viia和viib、viic和viid。viia和viib、viic和viid。
[0006]
第一步反应由n-叔丁氧羰基-3-氟-4-哌啶酮到化合物ii的叶立德试剂为甲基三
2.29 ~ 2.37 (m, 1h), 2.98 (s, 1h), 3.23 ~ 3.34 (m, 1h), 3.87(s, 2h), 4.90 ~ 5.03 (m, 2h), 5.11 (s, 1h);
19
f nmr (400mhz, dmso ) δ
ꢀ‑
181.05 ~ 180.37 (m, 1f).化合物iii的合成步骤:将化合物ii(400 g,1.86 mol,1.00 eq)溶于四氢呋喃(4.00 l)溶液中,在0oc下滴加硼烷二甲基硫醚(10.0 m,278 ml,1.50 eq)。将混合物在n2环境和0oc下搅拌1h,结束后在15oc下搅拌15h。通过tlc(石油醚:乙酸乙酯= 5:1)监测反应进程,反应结束后在0oc下滴加naoh(3.00 m,1052 ml,1.70eq)。反应混合物在n2和0oc环境下搅拌反应15min。 然后在0oc下滴加h2o2(632 g,5.58 mol,534 ml,纯度30.0%,3.00eq)搅拌15min。将反应在15oc下搅拌15h,tlc检测(石油醚:乙酸乙酯= 5:1,rf = 0.07)到化合物ii被完全消耗。反应混合物静置后在0oc下加入na2s2o3饱和溶液(1.00 l)搅拌,并加入dcm(500 ml * 3)进行萃取。将有机层合并后用盐水(500ml * 1)进行洗涤后,用na2so4干燥,过滤并在减压下浓缩。化合物iii(400克,粗品)以黄色油的形式获得。
[0015]
化合物va、vb、vc、vd的合成步骤:在化合物iii(800 g,3.43 mol,1.00 eq)和toscl(982 g,5.15 mol,1.50 eq)的dcm(8.00 l)溶液中,在0
°
c 和n2环境下滴加吡啶(1027 g,13.0 mol,1050 ml, 3.80 eq)。然后加热到25
°
c,搅拌12 h。通过tlc(石油醚:乙酸乙酯=1:1,rf
1 = 0.64,rf
2 = 0.56)检测反应进程,当反应物已被完全消耗,将反应混合物倒入1200ml冰水中搅拌20 min。水相采用dcm(40.0 ml*3)进行萃取。合并的有机相用盐水(4.00 l)进行洗涤后,用无水na2so4干燥,然后进行真空过滤浓缩。由硅胶柱层析法纯化(石油醚/乙酸乙酯= 10:1)、高效液相色谱(hplc)纯化得到一黄色油状外消旋体混合物iva与另一外消旋体混合物白色固体ivb。两组混合物再用手性超临界流体色谱(sfc)技术进一步分离,得到化合物va(220 g, 563 mmol,产率16.4%,纯度99.2%)为白色固体,化合物vb(215 g,552 mmol,产率16.1%,纯度99.6%)为白色固体,化合物vc(215 g,545 mmol,产率15.9%,纯度98.3%)为白色固体产率为15.9%,纯度为98.3%,化合物vd(205 g, 525 mmol,产率15.3%,纯度99.3%)为白色固体。
[0016]
外消旋混合物iva:1h nmr (400 mhz, dmso)δ 1.15 ~ 1.25 (m, 1h), 1.38 (s, 9h), 1.66 ~ 1.71 (m, 1h), 1.96 ~ 2.07 (m, 1h), 2.42(s, 3h), 2.76 (s, 2h), 3.72 ~ 3.76 (d, 1h, j = 13.00 hz ), 4.05 ~ 4.12 (m, 3h), 4.19 ~ 4.37 (m, 1h), 7.47 ~ 7.50 (d, 2h, j = 8.12 hz), 7.79 ~ 7.81 (d, 2h, j = 8.28 hz);
19
f nmr (400mhz, dmso ) δ
ꢀ‑
186.16.外消旋混合物ivb:1h nmr (400 mhz, dmso) δ1.17 ~ 1.27 (m, 1h), 1.36 (s, 9h), 1.42 ~ 1.46 (dd, 1h, j = 13.20 , 2.88 hz), 2.03 ~ 2.13 (m, 1h), 2.42 (s, 3h), 2.58 ~ 3.01 (m, 2h), 3.87 ~ 4.00 (m, 3h ), 4.17 (s, 1h), 4.65 ~ 4.77 (d, 1h, j = 48.16 hz), 7.47 ~ 7.49 (d, 2h, j = 8.08 hz), 7.79 ~ 7.81 (d, 2h, j = 8.24 hz);
19
f nmr (400mhz, dmso ) δ
ꢀ‑
203.27.化合物va:1h nmr (400mhz, dmso) δ1.16~1.26 (m, 1h), 1.36 (s, 9h), 1.42~1.46 (dd, 1h, j = 13.16 , 3.00 hz), 2.00~2.16 (m, 1h), 2.43 (s, 3h), 2.66~3.01 (m, 2h), 3.86~4.00 (m, 3h), 4.16 (s, 1h), 4.64~4.76 (d, 1h, j = 48.12 hz), 7.48~4.50 (d, 2h, j = 8.04 hz), 7.79~7.81(d, 2h, j = 8.32 hz);
19
f nmr (400mhz, dmso ) δ
ꢀ‑
203.04;
13
c nmr (100mhz, dmso ) δ21.62 (s, 1c), 25.71 (s, 1c), 28.46 (s, 1c), 40.90 (s, 1c), 70.32 ~70.35 (d, 1c), 79.83 (s, 1c), 86.31~88.06 (d, 1c), 128.17 (s, 2c), 130.76 (s, 2c), 132.55 (s, 1c), 145.61 (s, 1c), 154.18 (s,1c).化合物vb:1h nmr (400 mhz, dmso) δ 1.16~1.26 (m, 1h), 1.36 (s, 9h), 1.42~1.46 (dd, 1h, j = 13.24 , 3.16 hz), 2.00~2.16 (m, 1h), 2.42 (s, 3h), 2.66~3.01 (m, 2h), 3.86~4.00 (m, 3h), 4.16 (s, 1h), 4.64~4.76 (d, 1h, j = 48.08 hz), 7.48~4.50 (d, 2h, j = 8.00 hz), 7.79~7.81(d, 2h, j = 8.32 hz);
19
f nmr (400mhz, dmso ) δ
ꢀ‑
203.04;
13
c nmr (100mhz, dmso ) δ 21.62 (s, 1c), 25.74 (s, 1c), 28.46 (s, 1c), 40.91 (s, 1c),70.31~70.34 (d, 1c) , 79.83 (s, 1c), 86.31~88.06 (d, 1c), 128.16 (s, 2c), 130.75 (s, 2c), 132.56 (s, 1c), 145.61 (s, 1c), 154.17 (s, 1c).化合物vc:1h nmr (400mhz, dmso) δ 1.14~1.25 (m, 1h), 1.38 (s, 9h), 1.66~1.71 (dt, 1h, j = 13.68 , 3.52 hz), 1.97~2.06 (m, 1h), 2.43 (s, 3h), 2.76~2.95 (m, 2h), 3.72~3.75 (d, 1h, j = 13.2 hz), 4.05~4.12 (m, 3h), 4.19~4.37 (m, 1h), 7.48~4.50 (d, 2h, j = 8.04 hz), 7.79~7.81(d, 2h, j = 8.32hz);
19
f nmr (400mhz, dmso ) δ-186.11 (s, 1f);
13
c nmr (100mhz, dmso )δ21.63 (s, 1c), 22.08 (s, 1c), 22.19 (s, 1c), 28.51 (s, 1c), 38.25 (s, 1c), 38.44 (s, 1c), 70.65 ~70.69 (d, 1c), 79.36 (s, 1c), 84.85 (s, 1c), 86.60 (s, 1c), 128.17 (s, 2c), 130.75 (s, 2c), 132.56 (s, 1c), 145.59 (s, 1c), 154.73 (s, 1c).化合物vd:1h nmr (400mhz, dmso) δ 1.15~1.25 (m, 1h), 1.38 (s, 9h), 1.66~1.72 (dt, 1h, j = 17.44 , 3.76 hz), 1.96~2.07 (m, 1h), 2.42 (s, 3h), 2.76~2.84 (m, 2h), 3.72~3.75 (d, 1h, j = 13.16 hz), 4.05~4.12 (m, 3h), 4.19~4.37 (m, 1h), 7.48~4.50 (d, 2h, j = 8.04 hz), 7.79~7.81(d, 2h, j = 8.32hz);
19
f nmr (400mhz, dmso ) δ
ꢀ‑
186.12 (s, 1f);
13
c nmr (100mhz, dmso ) δ 21.62 (s, 1c), 22.13 (s, 1c), 22.28 (s, 1c), 28.51 (s, 1c), 38.25 (s, 1c), 38.45 (s, 1c), 70.65~70.69 (d, 1c), 79.36 (s, 1c), 84.86 (s, 1c), 86.60 (s, 1c), 84.86~86.60 (d, 1c), 128.17 (s, 2c), 130.74 (s, 2c), 132.57 (s, 1c), 145.59 (s, 1c), 154.72 (s, 1c).化合物via、vib、vic、vid的合成步骤:将化合物va(220 g,567 mmol,1.00 eq)溶于乙酸乙酯(etoac)(1.10 l)中在25oc下加入hcl/ etoac (1.10 l)。混合物在25oc下搅拌3 h。通过tlc(石油醚:乙酸乙酯= 3:1,rf = 0.03)检测表明反应物已被完全消耗。将混合物在真空中浓缩得到化合物via的盐酸盐(180 g,粗品)为白色固体。
[0017]
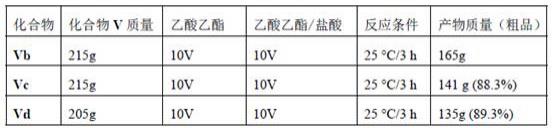
化合物vib、vic、vid的合成步骤与化合物via合成步骤类似,结果如下表显示。
[0018]
由化合物via、vib、vic、vid到目标产物viia、viib、viic、viid的合成步骤:将化合物via (180 g,627 mmol,1.00 eq)溶于mecn (3.60 l)中,加入k2co
3 (260 g,1881 mmol,3.00 eq)和nai (9.41 g,62.7 mmol,0.10 eq),将混合物在80 o
c下搅拌16 h。lc-ms监测表明反应物已经被完全消耗后,对反应混合物进行过滤,滤液在80oc、15 psi环境下蒸馏掉大部分溶剂,得到含有产物的残液mecn (3.6 l)中,在0oc环境下加入hcl/etoac (4m)至ph = 4~5,然后真空浓缩。粗产物用1200ml乙酸乙酯(etoac)在25oc下沉淀结晶1 h,然后过滤并收集滤饼,滤饼在真空下浓缩得到目标产物viia的盐酸盐(45.8 g,302 mmol,产率48.2%,纯度100%,hcl)为白色固体。
[0019]
目标产物viib、viic、viid的合成方法与目标产物viia类似,其结果如下表显示。
[0020]
化合物viia:1h nmr (400 mhz, dmso)δ1.43 ~ 1.49 (m, 1h), 1.94 ~ 2.04 (m, 1h), 3.00 ~ 3.06 (m, 2h), 3.18 ~ 3.38 (m, 4h), 3.59 ~ 3.69 (m, 1h), 4.97 ~ 5.12 (dd, 1h, j = 56.04, 5.24 hz), 11.47 (s, 1h);
19
f nmr (400mhz, dmso ) δ
ꢀ‑
168.19 (s, 1f);
13
c nmr (75mhz, dmso ) δ20.31~20.43 (d, 1c), 51.10 (s, 1c), 56.28, (s, 1c), 59.80 (s,1c) , 60.15 (s, 1c) , 90.03 ~ 92.49 (d, 1c).化合物viib:1h nmr (400 mhz, dmso) δ1.44 ~ 1.51 (m, 1h), 1.95 ~ 2.05 (m, 1h), 3.02 ~ 3.08 (m, 2h), 3.21 ~ 3.34 (m, 4h), 3.62 ~ 3.71 (m, 1h), 4.98 ~ 5.14 (dd, 1h, j = 56.04, 5.44 hz), 11.75 (s,1h);
19
f nmr (400mhz, dmso )δ
ꢀ‑
168.19 (s, 1f);
13
c nmr (75mhz, dmso ) δ 20.31~20.43 (d, 1c), 51.02 (s, 1c), 56.25, (s, 1c), 59.73 (s,1c) , 60.09 (s, 1c) , 90.06 ~ 92.51 (d, 1c).化合物viic:1h nmr (400 mhz, dmso) δ1.95 ~ 2.00 (m, 2h), 3.09 ~ 3.24 (m, 3h), 3.24 ~ 3.42 (m, 3h), 3. 59 ~ 3.69 (m, 1h), 5.33 ~ 5.51 (m, 1h), 11.79 (s,1h);
19
f nmr (400mhz, dmso )δ
ꢀ‑
193.99 (s, 1f);
13
c nmr (75mhz, dmso ) δ18.88~19.03 (d, 1c), 51.42 (s, 1c), 56.75, (s, 1c), 57.12 (s,1c) , 57.39~57.46 (d, 1c) , 87.90 ~ 90.38 (d, 1c).化合物viid:1h nmr (300 mhz, dmso) δ1.90~2.06(m, 2h), 3.08 ~ 3.23 (m, 3h), 3.23 ~ 3.44 (m, 3h), 3.56 ~ 3.70 (m, 1h), 5.29 ~ 5.53 (m, 1h), 11.56 (s,1h);
19
f nmr (400mhz, dmso )δ
ꢀ‑
193.99 (s, 1f);
13
c nmr (75 mhz, dmso ) δ 18.90~19.04 (d, 1c), 51.40 (s, 1c), 56.75, (s, 1c), 57.13 (s,1c) , 57.37~57.44 (d, 1c) , 87.91 ~ 90.39 (d, 1c).尽管已经对本发明的技术方案做了较为详细的阐述和列举,应当理解,对于本领域技术人员来说,对上述实施例做出修改或者采用等同的替代方案,这对本领域的技术人员而言是显而易见,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
