1.本发明涉及单臂化巯基化合物合成技术领域,尤其是涉及一种巯基联苯化合物及其制备方法。
背景技术:
2.点击化学(click chemistry),又称“链接化学”、“动态组合化学”,是在温和条件下通过小单元的拼接的形式,高选择性的实现分子多样性构建。目前有机合成领域主要分四种点击化学反应:端基炔与叠氮之间的cuaac反应;烯烃间的d-a反应;巯基-烯反应;以及自由基引发的巯基-炔反应。巯基-烯点击化学,能够充分的将光引发过程的优点和传统的点击反应的优点相结合,反应条件温和、产率高、具有高度的选择性、生物相容性和环境友好性,能广泛的应用于聚合物功能化、大分子构建、材料的设计和合成。
3.几十年来,人们已经知道自由基加成是通过一种有效的分步生长链过程进行的。对硫醇-烯自由基化学和聚合进行了几次综述,最近一次是在2004年。到2004年,已经清楚和广泛地证明了硫醇-烯网络作为基准聚合物材料,可以反应形成高度均匀的玻璃、弹性体和粘合剂。任何非球面受阻的末端烯都能够参与自由基介导的硫醇烯过程,富电子烯(乙烯基醚)和/或应变烯(降冰片烯)的反应比缺电子烯更快。由这些体系形成的交联聚合物是自由基聚合所形成的最理想的均相网络结构,具有窄的玻璃化转变区和极低的聚合收缩应力。到了21世纪初,硫醇烯化学的许多基础知识都得到了很好的定义,它们用于相对简单的材料应用,如保护涂层和薄膜,得到了充分的应用。然而,将硫醇-烯化学结合到各种新兴技术中仍有巨大的潜力。硫醇-烯反应在聚合物结构的分子和空间控制方面的特殊优势尚未完全实现。涉及丙烯酸酯和甲基丙烯酸酯的经典自由基光聚合通过链生长机制提供空间和时间控制,并且该聚合广泛用于从涂料到牙科材料、隐形眼镜和光刻工艺的一系列应用。
4.近年来,虽然巯基类化合物在合成方面已经取得了很大的进展,但巯基联苯型化合物的制备仍然是一个具有挑战性的任务,并且一些含巯基的聚合物缺乏生物相容性,使其难以应用靶向药物传递、组织工程等医学领域。
技术实现要素:
5.为了解决上述问题,本发明的目的是提供一种巯基联苯化合物及其制备方法。本发明首先利用外降冰片烯酸酐和4-溴苯胺反应,用氨基取代外降冰片烯酸酐中的氧,接着利用suzuki反应形成联苯化合物,随后利用酯化反应与丙烯酰氯反应引入单烯烃,制备得到含有联苯的单烯烃的化合物。本发明制备得到的巯基联苯化合物可用于后期联用巯基-烯迈克尔加成制备巯基化合物。与现有技术相比,本发明利用suzuki反应的优点,合成了单臂化含端烯烃的化合物,对后期制备不同功能性巯基化合物,对研究单臂化含糖共聚物中不同功能性巯基化合物对蛋白质特异性识别作用的影响,具有重要的指导意义。
6.本发明的目的可以通过以下技术方案来实现:
7.本发明的第一个目的是提供一种巯基联苯化合物,所述巯基联苯化合物的化学结
构式如式(i)所示:
[0008][0009]
其中,r选自苯基、2-苯基乙基、苄基、4-硝基苯基、丙醇基、丙酸甲酯基、乙醇基、3,4,5,5,6,6,7,7,8,8,8-十三氟-1-辛基、辛基中的一种。
[0010]
本发明的第二个目的是提供一种巯基联苯化合物的制备方法,包括以下步骤:
[0011]
(1)外降冰片烯二酸酐和对-溴苯胺发生苯胺取代反应,后处理得到第一化合物;
[0012]
(2)步骤(1)制备得到的第一化合物与pd(pph3)4、碳酸钠和4-羟基苯基硼酸发生suzuki偶联反应,后处理得到第二化合物;
[0013]
(3)步骤(2)制备得到的第二化合物与三乙胺和丙烯酰氯发生酰氯与羟基的酯化反应,后处理得到第三化合物;
[0014]
(4)步骤(3)制备得到的第三化合物与含巯基基团的化合物和二甲基苯基膦发生thiol-ene加成反应,后处理得到巯基联苯化合物;
[0015]
其中,所述巯基联苯化合物、第一化合物、第二化合物、第三化合物、含巯基集团的化合物的化学结构式分别如式(i)、式(ii)、式(iii)、式(iv)、式(v)所示:
[0016][0017]
其中,r选自苯基、2-苯基乙基、苄基、4-硝基苯基、丙醇基、丙酸甲酯基、乙醇基、3,4,5,5,6,6,7,7,8,8,8-十三氟-1-辛基、辛基中的一种。
[0018]
在本发明的一个实施方式中,步骤(1)中,外降冰片烯二酸酐与对-溴苯胺的摩尔比为1.0:1.0-1.4。
[0019]
在本发明的一个实施方式中,步骤(1)中,苯胺取代反应过程中,反应温度为120℃-135℃,反应时间为30min-60min。
[0020]
在本发明的一个实施方式中,步骤(1)中,后处理为纯化处理。
[0021]
在本发明的一个实施方式中,步骤(2)中,第一化合物、pd(pph3)4、碳酸钠、4-羟基苯基硼酸的摩尔比为1.0:0.03-0.08:2.0-2.4:1.0-1.5。
[0022]
在本发明的一个实施方式中,步骤(2)中,suzuki偶联反应过程中,反应温度为95℃-115℃,反应时间为16h-24h。
[0023]
在本发明的一个实施方式中,步骤(2)中,后处理为洗涤、干燥、纯化。
[0024]
在本发明的一个实施方式中,洗涤过程中采用二氯甲烷/水体系。
[0025]
在本发明的一个实施方式中,反应过程具体为:先用氮气吹扫具有第一化合物和
pd(pph3)4和碳酸钠的两颈圆底烧瓶,并在烧瓶上安装冷凝器;用氮气吹扫具有4-羟基苯基硼酸的圆底烧瓶,然后溶于脱气的甲醇中。将该硼酸溶液通过注射器加入两颈圆底烧瓶,将反应混合物在100℃条件下反应20h。
[0026]
在本发明的一个实施方式中,步骤(3)中,第二化合物、三乙胺、丙烯酰氯的摩尔比为1.0:1.5-2.5:1.5-2.5。
[0027]
在本发明的一个实施方式中,步骤(3)中,酯化反应过程中,反应温度为15℃-35℃,反应时间为20h-28h。
[0028]
在本发明的一个实施方式中,步骤(3)中,后处理为洗涤、干燥、纯化。
[0029]
在本发明的一个实施方式中,洗涤过程中采用二氯甲烷/水体系。
[0030]
在本发明的一个实施方式中,步骤(4)中,第三化合物、含巯基基团的化合物、二甲基苯基膦的摩尔比为1.0:1.2-1.8:0.04-0.06;
[0031]
thiol-ene加成反应过程中,反应温度为15℃-35℃,反应时间为3h-6h。
[0032]
在本发明的一个实施方式中,步骤(4)中,后处理为洗涤、干燥、纯化。
[0033]
在本发明的一个实施方式中,反应过程具体为:25℃下混匀第三化合物和含巯基基团化合物,搅拌反应10min后加二甲基苯基膦,随后继续在室温下反应4h。
[0034]
本发明首先利用外降冰片烯酸酐和4-溴苯胺反应,用氨基取代外降冰片烯酸酐中的氧,接着利用suzuki反应形成联苯化合物,随后利用酯化反应与丙烯酰氯反应引入单烯烃;然后利用巯基-烯加成反应,制备出含巯基糖的单体衍生物,可运用于后聚合改性;对后期制备不同功能性含糖单体,对研究单臂化含糖共聚物中不同功能性巯基化合物对蛋白质特异性识别作用的影响,具有重要的指导意义。
[0035]
本发明创新性的将suzuki反应和点击化学和联用,制备出一系列含有柔性硫醇链生物,可用于后期共聚物的合成,有利于探究不同的柔性链段对含甘露糖共聚物特异性识别功能的影响。由于现有技术未对含联苯的巯基型化合物进行探索研究,故本发明创新性的将suzuki反应和巯基-烯迈克尔加成反应相结合,使得实验操作简单、高效、具有一定的环境友好性,为含巯基衍生物对联苯物骨架提供了一个可观的途径,以实现人工合成含巯基类化合物。
[0036]
由聚合物骨架和具有生物活性的巯基化合物组合而成的具有各种用途的聚合物特殊性能材料在靶向给药系统、亲和分离和生物测定等均表现出很好的应用效果。巯基化聚合物是一种新型黏膜黏附性材料,为亲水性高分子聚合物侧链经巯基化修饰后的产物。生理环境下,巯基化聚合物的游离巯基与黏膜黏液层糖蛋白中富含半胱氨酸的区域形成二硫键,通过共价键紧密结合于黏膜,延长药物在体内的停留时间,提高药物局部浓度,促进药物吸收,是口服给药的优良载体。
[0037]
本发明中,反应过程如式(vi)所示:
[0038][0039]
与现有技术相比,本发明具有以下有益效果:
[0040]
(1)本发明通过利用suzuki反应和巯基-烯迈克尔加成合成巯基联苯化合物的方法,制备出一种可运用于后聚合改性的巯基联苯化合物,且合成方法稳定、高效。
[0041]
(2)本发明所合成的巯基联苯化合物适用于后聚合改性,可制备出能够与生物蛋白特异性识别、诊断的材料。
[0042]
(3)本发明制备巯基联苯化合物的方法还适用于同种类型的其它硫醇化合物与其它巯基物质的合成。
附图说明
[0043]
图1为本发明实施例1中第一化合物的核磁氢谱图。
[0044]
图2为本发明实施例1中第一化合物的核磁碳谱图。
[0045]
图3为本发明实施例1中第二化合物的核磁氢谱图。
[0046]
图4为本发明实施例1中第二化合物的核磁碳谱图。
[0047]
图5为本发明实施例1中第三化合物的核磁氢谱图。
[0048]
图6为本发明实施例1中第三化合物的核磁碳谱图。
[0049]
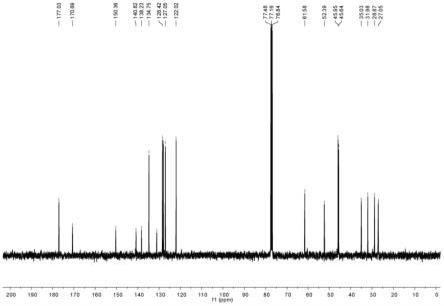
图7为本发明实施例1中巯基联苯化合物的核磁氢谱图。
[0050]
图8为本发明实施例1中巯基联苯化合物的核磁碳谱图。
[0051]
图9为本发明实施例2中巯基联苯化合物的核磁氢谱图。
[0052]
图10为本发明实施例2中巯基联苯化合物的核磁碳谱图。
[0053]
图11为本发明实施例3中巯基联苯化合物的核磁氢谱图。
[0054]
图12为本发明实施例3中巯基联苯化合物的核磁碳谱图。
具体实施方式
[0055]
本发明提供一种巯基联苯化合物,所述巯基联苯化合物的化学结构式如式(i)所示:
[0056][0057]
其中,r选自苯基、2-苯基乙基、苄基、4-硝基苯基、丙醇基、丙酸甲酯基、乙醇基、3,4,5,5,6,6,7,7,8,8,8-十三氟-1-辛基、辛基中的一种。
[0058]
本发明提供一种巯基联苯化合物的制备方法,包括以下步骤:
[0059]
(1)外降冰片烯二酸酐和对-溴苯胺发生苯胺取代反应,后处理得到第一化合物;
[0060]
(2)步骤(1)制备得到的第一化合物与pd(pph3)4、碳酸钠和4-羟基苯基硼酸发生suzuki偶联反应,后处理得到第二化合物;
[0061]
(3)步骤(2)制备得到的第二化合物与三乙胺和丙烯酰氯发生酰氯与羟基的酯化反应,后处理得到第三化合物;
[0062]
(4)步骤(3)制备得到的第三化合物与含巯基基团的化合物和二甲基苯基膦发生thiol-ene加成反应,后处理得到巯基联苯化合物;
[0063]
其中,所述巯基联苯化合物、第一化合物、第二化合物、第三化合物、含巯基集团的化合物的化学结构式分别如式(i)、式(ii)、式(iii)、式(iv)、式(v)所示:
[0064][0065]
其中,r选自苯基、2-苯基乙基、苄基、4-硝基苯基、丙醇基、丙酸甲酯基、乙醇基、3,4,5,5,6,6,7,7,8,8,8-十三氟-1-辛基、辛基中的一种。
[0066]
在本发明的一个实施方式中,步骤(1)中,外降冰片烯二酸酐与对-溴苯胺的摩尔比为1.0:1.0-1.4。
[0067]
在本发明的一个实施方式中,步骤(1)中,苯胺取代反应过程中,反应温度为120℃-135℃,反应时间为30min-60min。
[0068]
在本发明的一个实施方式中,步骤(1)中,后处理为纯化处理。
[0069]
在本发明的一个实施方式中,步骤(2)中,第一化合物、pd(pph3)4、碳酸钠、4-羟基苯基硼酸的摩尔比为1.0:0.03-0.08:2.0-2.4:1.0-1.5。
[0070]
在本发明的一个实施方式中,步骤(2)中,suzuki偶联反应过程中,反应温度为95℃-115℃,反应时间为16h-24h。
[0071]
在本发明的一个实施方式中,步骤(2)中,后处理为洗涤、干燥、纯化。
[0072]
在本发明的一个实施方式中,洗涤过程中采用二氯甲烷/水体系。
[0073]
在本发明的一个实施方式中,反应过程具体为:先用氮气吹扫具有第一化合物和pd(pph3)4和碳酸钠的两颈圆底烧瓶,并在烧瓶上安装冷凝器;用氮气吹扫具有4-羟基苯基
硼酸的圆底烧瓶,然后溶于脱气的甲醇中。将该硼酸溶液通过注射器加入两颈圆底烧瓶,将反应混合物在100℃条件下反应20h。
[0074]
在本发明的一个实施方式中,步骤(3)中,第二化合物、三乙胺、丙烯酰氯的摩尔比为1.0:1.5-2.5:1.5-2.5。
[0075]
在本发明的一个实施方式中,步骤(3)中,酯化反应过程中,反应温度为15℃-35℃,反应时间为20h-28h。
[0076]
在本发明的一个实施方式中,步骤(3)中,后处理为洗涤、干燥、纯化。
[0077]
在本发明的一个实施方式中,洗涤过程中采用二氯甲烷/水体系。
[0078]
在本发明的一个实施方式中,步骤(4)中,第三化合物、含巯基基团的化合物、二甲基苯基膦的摩尔比为1.0:1.2-1.8:0.04-0.06;
[0079]
thiol-ene加成反应过程中,反应温度为15℃-35℃,反应时间为3h-6h。
[0080]
在本发明的一个实施方式中,步骤(4)中,后处理为洗涤、干燥、纯化。
[0081]
在本发明的一个实施方式中,反应过程具体为:25℃下混匀第三化合物和含巯基基团化合物,搅拌反应10min后加二甲基苯基膦,随后继续在室温下反应4h。
[0082]
本发明首先利用外降冰片烯酸酐和4-溴苯胺反应,用氨基取代外降冰片烯酸酐中的氧,接着利用suzuki反应形成联苯化合物,随后利用酯化反应与丙烯酰氯反应引入单烯烃;然后利用巯基-烯加成反应,制备出含巯基糖的单体衍生物,可运用于后聚合改性;对后期制备不同功能性含糖单体,对研究单臂化含糖共聚物中不同功能性巯基化合物对蛋白质特异性识别作用的影响,具有重要的指导意义。
[0083]
下面结合附图和具体实施例对本发明进行详细说明。
[0084]
以下各实施例中,顺-5-降冰片烯-外-2,3-二酸酐,上海阿达玛斯试剂有限公司产品;4-溴苯胺,上海阿达玛斯试剂有限公司产品;乙酸,上海探索科技股份有限公司;碳酸钠,上海探索科技股份有限公司;对羟基苯硼酸,上海阿达玛斯试剂有限公司产品;丙烯酰氯,上海阿达玛斯试剂有限公司产品;三乙胺,上海探索科技股份有限公司;其余所用原料均为市售的分析纯试剂,其中无水甲醇、无水二氯甲烷(dcm)和无水甲苯(装有分子筛,含水量≤0.05%)均购于上海麦克林生化有限公司等以及其他未提及试剂和药品均购自上海探索科技股份有限公司。
[0085]
实施例1
[0086]
本实施例提供一种巯基联苯化合物及其制备方法。
[0087]
(1)第一化合物的制备
[0088]
将顺-5-降冰片烯-外-2,3-二羧酸酐(20g,0.122mol)放入干燥的圆底烧瓶中加入,并加入乙酸140ml。将混合物加热至120℃待顺-5-降冰片烯-外-2,3-二羧酸酐溶解之后加入4-溴苯胺(25.2g,0.146mol)。在120℃条件下反应45min。反应结束后倒入冰水中,形成白色沉淀。用二氯甲烷提取单体,并用蒸馏水洗涤干燥。得到白色固体(即第一化合物)29g,产率为75%。
[0089]
第一化合物的核磁氢谱图与核磁碳谱图分别参见图1和图2所示;
[0090]
第一化合物的化学结构式如下式所示:
[0091][0092]
第一化合物的核磁数据如下所示:
[0093]1h nmr(400mhz,cdcl3)δ7.57(d,j=8.7hz,2h),7.16(d,j=8.7hz,2h),6.33(s,2h),3.37(s,2h),2.82(s,2h),1.60(d,j=9.9hz,1h),1.42(d,j=9.9hz,1h).
[0094]
(2)第二化合物的制备
[0095]
用氮气吹扫具有第一化合物(10g,31.4mmol)和pd(pph3)4(1.81g,0.942mmol)和碳酸钠(6.28g,62.8mmol)的250ml圆底烧瓶。然后加入100ml脱气的无水甲苯,并在烧瓶上安装冷凝器。用氮气吹扫另一种带有4-羟基苯基硼酸(5.28g,37.68mmol)的50ml圆底烧瓶,然后溶于20ml脱气的甲醇中。将该硼酸溶液通过注射器加入第一化合物和催化剂溶液中。将反应混合物在100℃加热24h。反应完成后,将反应混合物用碳酸氢钠溶液淬灭,并用盐水溶液洗涤。有机层用二氯甲烷萃取三次,并用无水硫酸钠干燥。然后在旋转蒸发仪上除去溶剂。通过柱色谱用乙酸乙酯-石油醚(体积比为1:4)洗脱液纯化产物。收集分离的产物溶液并浓缩以产生最终产物为白色固体(即第二化合物),6.55g,产率为63%。
[0096]
第二化合物的核磁氢谱图与核磁碳谱图分别参见图3和图4所示;
[0097]
第二化合物的化学结构式如下式所示:
[0098][0099]
第二化合物的核磁数据如下所示:
[0100]1h nmr(400mhz,dmso)δ7.79(d,j=8.4hz,2h),7.64(d,j=8.6hz,2h),7.40(d,j=8.4hz,2h),7.02(d,j=8.5hz,2h),6.48(s,2h),3.56(s,2h),2.97(s,2h),1.57(q,j=9.7hz,2h).
[0101]
(3)第三化合物的制备
[0102]
将第二化合物(5g,15.1mmol),干燥的二氯甲烷50ml及新蒸馏的三乙胺(4.17ml,30mmol)置于洁净的圆底烧瓶中,在冰水浴下搅拌均匀。丙烯酰氯(2.44ml,30mmol)缓慢滴加0.5h,滴加结束后维持0℃不变继续搅拌反应1h,然后18℃下反应24h。反应液依次使用1mol/l的hcl(200ml),1mol/l的naoh(200ml)和去离子水(200ml)洗涤,有机层用二氯甲烷萃取三次,并用无水硫酸钠干燥。然后在旋转蒸发仪上除去溶剂,通过柱色谱用乙酸乙酯-石油醚(体积比为1:2)洗脱液纯化产物。收集分离的产物溶液并浓缩以产生最终产物为白色固体(即第三化合物),3.78g,产率为65%。
[0103]
第三化合物的核磁氢谱图与核磁碳谱图分别参见图5和图6所示;
[0104]
第三化合物的化学结构式如下式所示:
[0105][0106]
第三化合物的核磁数据如下所示:
[0107]1h nmr(500mhz,dmso)δ7.73(d,j=8.2hz,4h),7.29(d,j=7.7hz,2h),7.20(d,j=7.6hz,2h),6.56(d,j=17.2hz,1h),6.47
–
6.41(m,1h),6.25(s,2h),6.17(d,j=10.3hz,1h),3.51(s,2h),3.34(s,2h),2.49(s,2h),1.61(s,2h).
[0108]
(4)巯基联苯化合物的制备
[0109]
将第三化合物(100mg,0.26mmol)和4-巯基苯硫醇(48mg,0.312mmol)溶于10ml二氯甲烷溶液中,25℃条件下搅拌10min,加入0.013mmol二甲基苯基膦,35℃条件下搅拌3h,反应结束后浓缩滤液,通过柱色谱用石油醚-乙酸乙酯(体积比为4:1)洗脱液纯化产物。收集分离的产物溶液并浓缩以产生最终产物为白色固体(即巯基联苯化合物),119mg,产率为85%。
[0110]
巯基联苯化合物(4'-((4r,7s)-1,3-dioxo-1,3,3a,4,7,7a-hexahydro-2h-4,7-methanoi soindol-2)的核磁氢谱图与核磁碳谱图分别参见图7和图8所示;
[0111]
本实施例制备得到的巯基联苯化合物的化学结构式如下式所示:
[0112][0113]
本实施例制备得到的巯基联苯化合物的核磁数据如下所示:
[0114]1h nmr(400mhz,cdcl3)δ7.57(dd,j=17.4,8.4hz,4h),7.19(dd,j=17.5,8.3hz,4h),6.27(s,2h),3.70(s,3h),3.48(d,j=26.5hz,4h),2.97
–
2.83(m,6h),2.66(t,j=7.3hz,2h),1.79(d,j=8.7hz,1h),1.61(d,j=8.7hz,1h).
[0115]
实施例2
[0116]
本实施例提供一种巯基联苯化合物及其制备方法。
[0117]
(1)第一化合物的制备
[0118]
将顺-5-降冰片烯-外-2,3-二羧酸酐(20g,0.122mol)放入干燥的圆底烧瓶中加入,并加入乙酸140ml。将混合物加热至135℃待顺-5-降冰片烯-外-2,3-二羧酸酐溶解之后加入4-溴苯胺(0.122mol)。在135℃条件下反应30min。反应结束后倒入冰水中,形成白色沉淀。用二氯甲烷提取单体,并用蒸馏水洗涤干燥。得到白色固体(即第一化合物)28.2g,产率为73%。
[0119]
(2)第二化合物的制备
[0120]
用氮气吹扫具有第一化合物(10g,31.4mmol)和pd(pph3)4(1.22mmol)和碳酸钠(73.1mmol)的250ml圆底烧瓶。然后加入100ml脱气的无水甲苯,并在烧瓶上安装冷凝器。用氮气吹扫另一种带有4-羟基苯基硼酸(31.4mmol)的50ml圆底烧瓶,然后溶于20ml脱气的甲醇中。将该硼酸溶液通过注射器加入第一化合物和催化剂溶液中。将反应混合物在115℃加
热18h。反应完成后,将反应混合物用碳酸氢钠溶液淬灭,并用盐水溶液洗涤。有机层用二氯甲烷萃取三次,并用无水硫酸钠干燥。然后在旋转蒸发仪上除去溶剂。通过柱色谱用乙酸乙酯-石油醚(体积比为1:4)洗脱液纯化产物。收集分离的产物溶液并浓缩以产生最终产物为白色固体(即第二化合物),6.24g,产率为60%。
[0121]
(3)第三化合物的制备
[0122]
将第二化合物(5g,15.1mmol),干燥的二氯甲烷50ml及新蒸馏的三乙胺(22.65mmol)置于洁净的圆底烧瓶中,在冰水浴下搅拌均匀。丙烯酰氯(37.75mmol)缓慢滴加0.5h,滴加结束后维持0℃不变继续搅拌反应1h,然后15℃下反应28h。反应液依次使用1mol/l的hcl(200ml),1mol/l的naoh(200ml)和去离子水(200ml)洗涤,有机层用二氯甲烷萃取三次,并用无水硫酸钠干燥。然后在旋转蒸发仪上除去溶剂,通过柱色谱用乙酸乙酯-石油醚(体积比为1:2)洗脱液纯化产物。收集分离的产物溶液并浓缩以产生最终产物为白色固体(即第三化合物),3.84g,产率为66%。
[0123]
(4)巯基联苯化合物的制备
[0124]
将第三化合物(100mg,0.26mmol)和4-巯基苯硫醇(0.36mmol)溶于10ml二氯甲烷溶液中,25℃条件下搅拌10min,加入0.015mml二甲基苯基膦,15℃条件下搅拌6h,反应结束后浓缩滤液,通过柱色谱用石油醚-乙酸乙酯(体积比为4:1)洗脱液纯化产物。收集分离的产物溶液并浓缩以产生最终产物为白色固体(即巯基联苯化合物),106mg,产率为81%。
[0125]
巯基联苯化合物(4'-((4r,7s)-1,3-dioxo-1,3,3a,4,7,7a-hexahydro-2h-4,7-methano isoindol-2-yl)-[1,1'-biphenyl]-4-yl 3-((3-methoxy-3-oxopropyl)thio)propanoate)的核磁氢谱图与核磁碳谱图分别参见图9和图10所示;
[0126]
本实施例制备得到的巯基联苯化合物的化学结构式如下式所示:
[0127][0128]
本实施例制备得到的巯基联苯化合物的核磁数据如下所示:
[0129]
1h nmr(400mhz,cdcl3)δ7.57(dd,j=17.4,8.4hz,4h),7.19(dd,j=17.5,8.3hz,4h),6.27(s,2h),3.70(s,3h),3.48(d,j=26.5hz,4h),2.97
–
2.83(m,6h),2.66(t,j=7.3hz,2h),1.79(d,j=8.7hz,1h),1.61(d,j=8.7hz,1h).
[0130]
实施例3
[0131]
本实施例提供一种巯基联苯化合物及其制备方法。
[0132]
(1)第一化合物的制备
[0133]
将顺-5-降冰片烯-外-2,3-二羧酸酐(20g,0.122mol)放入干燥的圆底烧瓶中加入,并加入乙酸140ml。将混合物加热至130℃待顺-5-降冰片烯-外-2,3-二羧酸酐溶解之后加入4-溴苯胺(0.171mol)。在130℃条件下反应60min。反应结束后倒入冰水中,形成白色沉淀。用二氯甲烷提取单体,并用蒸馏水洗涤干燥。得到白色固体(即第一化合物)30g,产率为78%。
[0134]
(2)第二化合物的制备
[0135]
用氮气吹扫具有第一化合物(10g,31.4mmol)和pd(pph3)4(2.512mmol)和碳酸钠(75.36mmol)的250ml圆底烧瓶。然后加入100ml脱气的无水甲苯,并在烧瓶上安装冷凝器。用氮气吹扫另一种带有4-羟基苯基硼酸(47.1mmol)的50ml圆底烧瓶,然后溶于20ml脱气的甲醇中。将该硼酸溶液通过注射器加入第一化合物和催化剂溶液中。将反应混合物在95℃加热16h。反应完成后,将反应混合物用碳酸氢钠溶液淬灭,并用盐水溶液洗涤。有机层用二氯甲烷萃取三次,并用无水硫酸钠干燥。然后在旋转蒸发仪上除去溶剂。通过柱色谱用乙酸乙酯-石油醚(体积比为1:4)洗脱液纯化产物。收集分离的产物溶液并浓缩以产生最终产物为白色固体(即第二化合物),6.13g,产率为59%。
[0136]
(3)第三化合物的制备
[0137]
将第二化合物(5g,15.1mmol),干燥的二氯甲烷50ml及新蒸馏的三乙胺(37.75mmol)置于洁净的圆底烧瓶中,在冰水浴下搅拌均匀。丙烯酰氯(22.65mmol)缓慢滴加0.5h,滴加结束后维持0℃不变继续搅拌反应1h,然后35℃下反应20h。反应液依次使用1mol/l的hcl(200ml),1mol/l的naoh(200ml)和去离子水(200ml)洗涤,有机层用二氯甲烷萃取三次,并用无水硫酸钠干燥。然后在旋转蒸发仪上除去溶剂,通过柱色谱用乙酸乙酯-石油醚(体积比为1:2)洗脱液纯化产物。收集分离的产物溶液并浓缩以产生最终产物为白色固体(即第三化合物),4g,产率为69%。
[0138]
(4)巯基联苯化合物的制备
[0139]
将第三化合物(100mg,0.26mmol)和4-巯基苯硫醇(0.468mmol)溶于10ml二氯甲烷溶液中,25℃条件下搅拌10min,加入0.01mmol二甲基苯基膦,25℃下搅拌4h,反应结束后浓缩滤液,通过柱色谱用石油醚-乙酸乙酯(体积比为4:1)洗脱液纯化产物。收集分离的产物溶液并浓缩以产生最终产物为白色固体(即巯基联苯化合物),94mg,产率为76%。
[0140]
巯基联苯化合物(4'-((4r,7s)-1,3-dioxo-1,3,3a,4,7,7a-hexahydro-2h-4,7-methano isoindol-2-yl)-[1,1'-biphenyl]-4-yl 3-((3-hydroxypropyl)thio)propanoate)的核磁氢谱图与核磁碳谱图分别参见图11和图12所示;
[0141]
本实施例制备得到的巯基联苯化合物的化学结构式如下式所示:
[0142][0143]
本实施例制备得到的巯基联苯化合物的核磁数据如下所示:
[0144]
1h nmr(400mhz,cdcl3)δ7.57(dd,j=17.2,8.4hz,4h),7.19(dd,j=16.4,8.4hz,4h),6.28(s,2h),3.76(t,j=6.0hz,2h),3.51(s,2h),3.45(s,2h),2.96
–
2.86(m,4h),2.72(t,j=7.1hz,2h),1.90
–
1.85(m,2h),1.79(d,j=8.8hz,1h),1.62(d,j=8.8hz,1h),1.24(d,j=6.9hz,1h).
[0145]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。