1.本发明涉及一种利用蛋白质谷氨酰胺酶改善糖酶催化性能的方法,属于基因工程和酶工程技术领域。
背景技术:
2.糖酶是一类能够利用大分子多糖,具有水解或转糖苷催化活力的酶。常见的糖酶有淀粉酶、琼胶酶、乳糖酶、纤维素酶、果胶酶、葡萄糖基转移酶等。现已发现的绝大多数野生型糖酶普遍存在催化活性低、稳定性差、特异性不强的问题,除通过发酵条件和反应条件优化来提高其催化效率外,通常还需要从蛋白结构本身入手对其进行优化和改造,使其更适合于工业化生产应用。目前酶工程中主要采用分子生物学的手段从基因层面对酶进行改造,这不仅需要大量的专业知识储备,还需要对酶结构具有准确的认知以进行理性设计,存在研发周期长、操作难度大、研究成本高等局限性,因此有必要挖掘更加简捷高效的手段对酶进行改性和修饰。
3.脱酰胺作用已被证实是最有效的蛋白质修饰方法之一,其将蛋白质的酰胺基团转化为羧基,羧基数目的增加,导致蛋白质表面负电荷增加,蛋白质等电点降低,使蛋白在酸性溶液中更易溶解,且蛋白质结构更加舒展,内部疏水基团暴露出来,蛋白质的两亲性增强,同时,zeta电位增大,导致蛋白质之间的静电斥力增大,抵御分子间吸引的能力增强,有助于蛋白溶液更加稳定。脱酰胺的方法有很多种。采用水浴加热或超声波的物理改性方法以及通过酸碱法脱酰胺的化学改性方法,特异性差,安全性低,常会引起蛋白质肽链断裂,氨基酸结构改变,蛋白质变性,不良风味产生等副作用,影响食品风味。相比之下,酶法脱酰胺反应迅速,安全性能高,毒副作用小,条件温和,专一性强。因此,倍受关注,研究较多。已经研究的用于脱酰胺作用的酶主要有肽谷氨酰胺酶、蛋白酶、谷氨酰胺转氨酶以及蛋白质谷氨酰胺酶。其中,蛋白酶在脱酰胺过程中容易引起蛋白质的交联和水解,形成短肽并产生苦味;而肽谷氨酰胺酶只作用短肽,且在进行脱酰胺作用时,必须先对蛋白质进行化学修饰,成本高,容易引发潜在问题。因此,找到一种能够克服现有酶法存在的问题的方法,从而提升糖酶的催化性能,是目前亟待解决的问题。
技术实现要素:
4.为了解决现有技术当中绝大多数糖酶催化活性低、稳定性差、特异性不足等问题,同时拓展蛋白质谷氨酰胺酶(pg酶)的应用领域,本发明提供了一种利用蛋白质谷氨酰胺酶(pg酶)改善糖酶催化性能的方法,利用来源于解朊金黄杆菌的蛋白质氨酰胺酶与糖酶反应,以提升糖酶催化性能。
5.在一种实施方式中,所述的改善糖酶催化性能,是指通过pg酶对糖酶分子中谷氨酰胺基团的脱酰胺作用,使得糖酶的结构和理化性质发生改变,糖酶分子的稳定性催化活力或催化特异性提高,最终表现为其水解性能或催化模式的改善。
6.在一种实施方式中,所述pg酶来源于金黄杆菌chryseobacterium sp.strb126,
genbank号:bap30741.1;或是来源于溶蛋白金杆菌chryseobacterium proteolyticum,genbank号:bab21508.1。
7.优选的,所述pg酶来源于金黄杆菌chryseobacterium sp.strb126,genbank号:bap30741.1。
8.在一种实施方式中,所述方法包括如下步骤:
9.(1)配制底物糖酶溶液:利用磷酸盐缓冲溶液配制成浓度为1%~20%(w/v)的底物糖酶溶液;
10.(2)酶反应:在步骤(1)制得的底物糖酶溶液中加入pg酶获得一定酶与底物比例的体系,酶解反应温度为4℃~50℃,反应时间0.5~24小时,酶解ph值为6.0~8.0;
11.(3)分离:采用透析或超滤将糖酶与pg酶分离;所述超滤是采用截留分子量大于40kda且小于糖酶分子量的超滤离心管进行离心,所得上清液即为去除pg酶的改性后糖酶溶液;
12.(4)干燥:采用真空冷冻干燥方法,获得改性后的糖酶产品。
13.在一种实施方式中,所述步骤(1)中底物糖酶溶液的浓度为10%~20%(w/v)。
14.优选的,所述底物糖酶溶液的浓度为20%(w/v)。
15.在一种实施方式中,所述步骤(2)中pg酶在反应体系中的浓度为6~12u/ml。
16.优选的,浓度为8~12u/ml。
17.更优选的,浓度为10~12u/ml。
18.在一种实施方式中,所述步骤(2)中的酶解ph值优选为7.0。
19.在一种实施方式中,所述步骤(2)中的酶解反应温度为4℃~40℃。
20.在一种实施方式中,当酶解温度为40℃,酶反应时间不超过6h。
21.优选的,酶解反应温度为4℃~25℃。
22.在一种实施方式中,所述步骤(2)中的酶解反应时间不少于3h。
23.优选的,酶解反应时间为3~12h。
24.在一种实施方式中,所述步骤(3)中的透析是采用去离子水或糖酶缓冲液作为透析液,透析时间为6~12小时,每隔两小时换一次透析液,最终透析袋内残留溶液即为去除pg酶的改性后糖酶溶液。
25.在一种实施方式中,所述步骤(4)中的真空冷冻干燥温度为-50℃~-60℃,真空度15pa,干燥时间24~72h。
26.在一种实施方式中,所述糖酶包括但不限于琼胶酶、淀粉分支酶、麦芽低聚糖生成酶、γ-环糊精葡萄糖基转移酶。
27.本发明还提供了根据所述方法制备的改性后糖酶产品。
28.本发明的有益效果:
29.(1)本发明提供了一种利用蛋白质谷氨酰胺酶(pg酶)改善糖酶催化性能的方法,创新性地通过酶法改造糖酶,在显著改善糖酶催化性能的同时拓宽了pg酶的应用场景,提高了pg酶和糖酶的应用价值,填补了该研究领域的空白,为酶的高效改性开辟了新的思路。
30.(2)本发明提供的改性方法使得两种α-琼胶酶催化活力分别提高了339.29%和311.56%,β-琼胶酶和γ-环糊精葡萄糖基转移酶催化活力分别提高了103.13%和129.52%,琼胶酶的热稳定性显著增强,其他糖酶的催化活力也均有一定程度的提升,其改
性效果显著且具有普遍性。
31.(3)本发明提供的这种改性方法还能够提升琼胶酶在40℃下的稳定性,有利于提升糖酶在较高温度下的持续反应效率,打破其在较高温度下无法利用的瓶颈。
32.(4)本发明改性后的糖酶可与pg酶完全分离,糖酶回收率达95%以上,所得产物损失小、纯度高,具有良好的工业应用价值。
附图说明
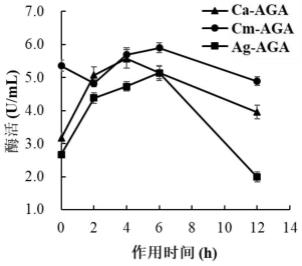
33.图1为pg酶于40℃下对三种琼胶酶改性不同时间后的酶活变化。
34.图2为α-琼胶酶cm-aga经tg酶作用并去除tg酶前后的sds-page分析;其中,m:蛋白质分子量标准;泳道1:经tg酶作用并去除tg酶的cm-aga;泳道2:经tg酶作用后未去除tg酶的cm-aga。
具体实施方式
35.下述实施例中所涉及的检测方法如下:
36.琼胶酶酶活测定方法如下:以tris-hcl缓冲液(20mm,ph 7.0)配制3g/l的琼脂糖底物,在0.9ml底物中加入0.1ml适当稀释的酶液,40℃下反应30min,加入1ml 3,5-二硝基水杨酸(dns)溶液终止酶促反应,沸水浴5min后冰浴冷却,540nm下测定吸光值,与半乳糖标准曲线比较。定义在每分钟生成1μmol还原糖(以半乳糖计)所需的酶量为1个酶活单位(u)。
37.淀粉分支酶酶活测定方法如下:使用磷酸钠缓冲液(50mmol/l,ph 7.0)配置0.25%(w/v)马铃薯支链淀粉作为底物,在离心管中加入900μl底物,并于65℃下保温10min,然后加入100μl稀释好的酶液,在65℃下反应15min。反应结束后采用沸水浴灭酶30min终止反应,待反应液冷却至室温后,取300μl反应液与5ml碘液(0.05%(w/v)ki,0.005%(w/v)i2,ph 6.0)于室温显色15min,而后在530nm处测定吸光值。已灭活的酶作为空白对照。定义在上述条件下,相比于对照吸光值每分钟降低1%为一个酶活力单位(u)。
38.淀粉脱支酶酶活测定方法如下:称取1.00g de 2麦芽糊精并用90ml左右去离子水分散,在沸水浴中糊化15min,冷却后加去离子水定容至100ml制备1%(w/v)de 4麦芽糊精;吸取700μl de 4麦芽糊精溶液于7ml离心管中,然后加入150μl 500mm醋酸钠缓冲液(ph 5.0)混匀后置于70℃水浴锅中保温10min,在底物中加入150μl酶液反应15min;反应结束后将反应产物沸水浴15min终止反应,待冷却后吸取100μl反应液于7ml离心管中,加入100μl 0.01m i
2-0.1m ki静置显色10min,后加入4.8ml去离子水,充分震荡混匀后于610nm条件下测定吸光度值。以高温灭酶的酶液作为空白对照。定义在a
610nm
吸光度值下,以1%大米淀粉为底物每小时升高0.1作为1个酶活力单位(u)。
39.麦芽低聚糖生成酶酶活测定方法如下:以tris-hcl缓冲液(20mm,ph 7.0)配制1%(w/w)的可溶性淀粉底物,在0.9ml底物中加入0.1ml适当稀释的酶液,50℃下反应30min,加入1ml 3,5-二硝基水杨酸(dns)溶液终止酶促反应,沸水浴5min后冰浴冷却,540nm下测定吸光值,与葡萄糖标准曲线比较。定义在每分钟生成1μmol还原糖(以葡萄糖计)所需的酶量为1个酶活单位(u)。
40.环糊精葡萄糖基转移酶酶活测定方法如下:取适当稀释的酶液0.1ml,加入装有0.9ml预先用ph 6.5、10mm磷酸缓冲液(pbs)配制的1%麦芽糊精(de=4)的离心管中,预热
5min后在50℃下反应10min,加入100μl 1.0m盐酸溶液终止反应,随后加入2ml 0.2m、ph 4.2的柠檬酸缓冲液和100μl 5mm溴甲酚绿溶液(bcg),室温下显色20min,于波长630nm下测定吸光值。以失活酶液作为空白。
41.实施例1:不同来源pg酶对琼胶酶的改性
42.分别采用来源于金黄杆菌chryseobacterium sp.strb126的pg酶(pg1,genbank号:bap30741.1)和来源于溶蛋白金杆菌chryseobacterium proteolyticum的pg酶(pg2,genbank号:bab21508.1)于4℃下改性琼胶酶12h,测定改性前后糖酶催化活力的变化。所用琼胶酶分别为来源于catenovulum agarivorans的α-琼胶酶(ca-aga)、来源于catenovulum maritimum的α-琼胶酶(cm-aga)、来源于agarivorans gilvus的β-琼胶酶(ag-aga)。
43.具体步骤如下:
44.(1)配制底物糖酶溶液:采用磷酸盐缓冲溶液(ph 7)将琼胶酶母液统一稀释至蛋白浓度为0.2mg/ml的底物琼胶酶溶液;
45.(2)酶反应:所述底物琼胶酶溶液中分别加入两种pg酶(pg1和pg2),使得pg酶终浓度为10u/ml,酶解反应温度为4℃,反应时间12小时;
46.(3)分离:采用截留分子量为50kda的超滤离心管将琼胶酶与pg酶分离,所得上清液即为去除pg酶的改性后琼胶酶溶液;
47.(4)酶活测定:将改性后琼胶酶体积调整至反应前相同体积后,采用相应酶活测定方法测定其改性前后酶活。
48.三种琼胶酶经不同来源pg酶改性前后的酶活变化如表1所示。结果表明,不同来源的pg酶改性对三种琼胶酶活力均表现出明显的提高作用,其中pg1相比于pg2,其改性效果更加显著,经pg1改性后的两种α-琼胶酶酶活均提高了300%以上,因此后续选用pg1进行其他方面的改性研究。
49.表1不同糖酶改性前后的酶活变化
[0050][0051]
实施例2:pg酶对不同糖酶的改性
[0052]
分别采用pg1于4℃下改性不同的糖酶12h,测定改性前后糖酶催化活力的变化。所用糖酶分别为来源于catenovulum agarivorans的α-琼胶酶(ca-aga)、来源于catenovulum maritimum的α-琼胶酶(cm-aga)、来源于agarivorans gilvus的β-琼胶酶(ag-aga)、来源于rhodothermus obamensis的淀粉分支酶(ro-gbe)、来源于geobacillus stearothermophilus的淀粉分支酶(gt-gbe)、来源于sulfolobus solfataricus的淀粉脱支酶(ss-gde)、来源于pseudomonas saccharophila的麦芽低聚糖生成酶(ps-mfa)、来源于bacillus sp.g-825-6的γ-环糊精葡萄糖基转移酶(γ-cgt)。
[0053]
具体步骤如下:
[0054]
(1)配制底物糖酶溶液:采用磷酸盐缓冲溶液(ph 7)将糖酶母液统一稀释至蛋白浓度为0.2mg/ml的底物糖酶溶液;
[0055]
(2)酶反应:所述底物糖酶溶液中加入pg1,使得pg酶终浓度为10u/ml,酶解反应温度为4℃,反应时间12小时;
[0056]
(3)分离:采用截留分子量为50kda的超滤离心管将糖酶与pg1分离,所得上清液即为去除pg1的改性后糖酶溶液;
[0057]
(4)酶活测定:将改性后糖酶体积调整至反应前相同体积后,采用相应酶活测定方法测定其改性前后酶活。
[0058]
不同糖酶改性前后的酶活变化如表2所示。经改性后各糖酶的催化活力均表现出一定程度的提高,其中两种α-琼胶酶ca-aga和cm-aga水解活力提升最为显著,改性后酶活超过原始酶活的4倍,ag-aga和γ-cgt酶活也增加了超过一倍,表明pg1对糖酶的改性作用具有高效性和普遍性的特点。
[0059]
表2不同糖酶改性前后的酶活变化
[0060][0061]
实施例3:不同反应条件下pg酶对琼胶酶的改性
[0062]
在40℃下采用pg1对三种琼胶酶改性不同时间,具体步骤如下:
[0063]
(1)配制底物糖酶溶液:采用磷酸盐缓冲溶液(ph 7)将琼胶酶母液统一稀释至蛋白浓度为0.2mg/ml的底物琼胶酶溶液;
[0064]
(2)酶反应:所述底物琼胶酶溶液中加入pg酶,使得pg酶终浓度为10u/ml(或为6、8、12u/ml),酶解反应温度分别为4℃、25℃、40℃,分别于反应0、2、3、4、5、6、10、12h时取样;
[0065]
(3)分离:采用截留分子量为50kda的超滤离心管将糖酶与pg酶分离,所得上清液即为去除pg酶的改性后琼胶酶溶液;
[0066]
(4)酶活测定:将改性后琼胶酶体积调整至反应前相同体积后,采用相应酶活测定方法测定其改性前后酶活。
[0067]
不同反应条件下pg酶对三种琼胶酶改性的酶活变化如表3所示。当在不同温度下反应时,随着温度升高,反应琼胶酶活力增量逐渐下降,4℃下改性效果最好,表明低温可能有利于pg酶保持活性和发生改性作用。当在4℃下反应不同时间时,随着时间延长,三种琼胶酶活力均呈现出先升高后稳定的趋势,超过10h后酶活略有下降,可能是改性到一定时间后趋于饱和,继续增加保温时间,琼胶酶的稳定性下降,活力随之下降。当采用不同浓度的pg1进行改性时,三种琼胶酶活力同样表现出先升高后稳定的趋势。
[0068]
由于ca-aga和cm-aga原始酶在40℃下保温10min即会迅速失活,而经pg酶作用后于40℃下保温12h酶仍具有较高活性,因此特别测定了在40℃下反应不同时间对三种琼胶酶活力的影响,结果如图1所示。随着反应时间的延长,ca-aga和ag-aga的活力均呈现出先上升后下降的趋势,其中ca-aga在反应4h时酶活最高提升了76.0%,cm-aga在反应6h时酶
活最高提升了92.1。酶活前期上升说明pg酶的作用提高了酶的催化性能,后期下降可能是由于长时间保温于40℃导致酶的稳定性下降。cm-aga酶活则在较长的保温时间内保持稳定。该结果表明pg酶的作用显著提高了三种琼胶酶的热稳定性,有利于该酶在较高温度下持续反应,打破了其对琼脂糖底物在较高温度下无法利用的瓶颈,大大减少了能源损耗,提高了琼胶寡糖的生产效率。
[0069]
表3不同反应条件下琼胶酶改性前后的酶活变化
[0070][0071]
实施例4:反应后超滤离心对pg酶的去除效果
[0072]
根据实施例1中相同条件采用pg1对α-琼胶酶cm-aga改性后,利用截留分子量为50kda的超滤离心管将cm-aga与pg1分离,分离前后样品的sds-page结果如图2所示。对比两个条带可见pg1经超滤后可完全去除,且cm-aga几乎无损失,根据蛋白浓度计算回收率约为96.58%,回收效率高,可用于改性后cm-aga的制备和进一步应用。
[0073]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。