一种ctb/ltb多肽与vp8的融合蛋白及轮状病毒疫苗
技术领域
1.本发明涉及分子生物学领域,具体涉及一种ctb/ltb多肽与vp8的融合蛋白及轮状病毒疫苗。
背景技术:
2.轮状病毒引起的腹泻是5岁以下儿童最常见的疾病之一。一个孩子在5岁前的几个月里都患有腹泻,这些症状也与成长缓慢有关(glass r i ,lang d r ,ivanoff b n , et al. introduction: rotavirus-from basic research to a vaccine[j]. journal of infectious diseases(supplement_1):s1.)。这些数据引发了儿科医生和公共卫生专家的关注,预防和治疗轮状腹泻疾病成为提高儿童存活率的一个关键目标。
[0003]
早在1998年,wyeth推出了口服的轮状病毒疫苗rotashield,使用一年期间,发现接种的儿童发生肠套叠的风险增高,因此,产品不得不撤市。后来merck和gsk分别推出了口服轮状病毒活疫苗,这两个产品在全球80多个国家广泛应用,对控制轮状病毒造成的严重脱水性腹泻,以及其引起的住院和儿童死亡起到非常好的保护作用。由于口服轮状病毒活疫苗在低收入国家只有大约60%的保护作用,尽管如此,许多这些国家的疫苗覆盖率仍保持在大约70%(glass ri, jiang b, parashar u. the future control of rotavirus disease: can live oral vaccines alone solve the rotavirus problem. vaccine 2018; 36:2233
–
6),仅口服活疫苗无法完全控制轮状病毒疾病,人们未来想控制严重轮状病毒疾病的造成的公共卫生健康问题,新一代疫苗的研究将是非常必要的。
技术实现要素:
[0004]
为构建高可溶性的重组亚单位疫苗,本发明提供了一种ctb/ltb多肽与vp8的融合蛋白,此融合蛋白具有高免疫原性和较好的可溶性。还公开了一种轮状疫苗,能使得免疫机体产生较高的特异性抗体igg、igg1和igg2a。
[0005]
本发明通过下述技术方案实现:一种ctb/ltb多肽与vp8的融合蛋白,其氨基酸序列包括人轮状病毒vp8蛋白氨基酸片段和外源多肽片段组成,所述外源多肽片段为ctb-1,ctb-2和/或ltb-1,所述ctb-1的氨基酸序列如seq id no:1所示,ltb-1的氨基酸序列如seq id no:2所示,ctb-2的氨基酸序列如seq id no:6所示,所述vp8蛋白氨基酸片段是人轮状病毒wa株蛋白的氨基酸片段第64-223位氨基酸序列,其氨基酸序列如seq id no:3。
[0006]
融合蛋白为(1)ctb-vp8 p[8],其氨基酸序列如seq id no:4所示;(2)ltb1-vp8 p[8],其氨基酸序列如seq id no:5所示。3)ctb2-vp8 p[8],其氨基酸序列如seq id no:7所示。
[0007]
一种轮状病毒疫苗,包含如前所述的融合蛋白。
[0008]
进一步的,所述融合蛋白为10-100微克。
[0009]
进一步的,还包含医学上可适用的佐剂。
[0010]
进一步的,所述融合蛋白和佐剂体积比为1:1。
[0011]
本发明与现有技术相比,具有如下的优点和有益效果:本发明从ctb和ltb中筛选出多肽片段ctb-1、ctb-2和ltb-1,将多肽片段与轮状病毒的vp8蛋白进行融合表达,分别纯化得到3个多肽-vp8融合蛋白,具有较好的蛋白水溶性,并且能产生高免疫原性,所制备得到的疫苗能够使得小鼠产生较高的特异性抗体igg、igg1和igg2a。
附图说明
[0012]
此处所说明的附图用来提供对本发明实施例的进一步理解,构成本技术的一部分,并不构成对本发明实施例的限定。在附图中:图1为本发明融合蛋白合成图;图2为融合蛋白水溶性图;图3为纯化效果图;图4为免疫特异性结果图。
具体实施方式
[0013]
为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例和附图,对本发明作进一步的详细说明,本发明的示意性实施方式及其说明仅用于解释本发明,并不作为对本发明的限定。
[0014]
实施例1表达系统的构建。
[0015]
本发明通过对ctb和ltb蛋白的一级结构进行t细胞抗原表位分析筛选出2个多肽片段(如表一所示),其中一条来自ctb-1(含t细胞抗原表位),一条来自ltb-1(含t细胞抗原表位)。(ctb-1:霍乱肠毒素b亚单位;ltb-1:大肠杆菌不耐热肠毒素b亚单位)。本发明还筛选出了一条不含t细胞抗原表位的多肽片段ctb-2,其氨基酸序列如seq id no:6。
[0016]
表一外源多肽序列多肽氨基酸序列ctb-1seqidno:1hgtpqnitdlcaeyhntqiltb-1seqidno:2gapqtitelcseyrntqictb-2seqidno:6tdlcaeyhntqiytlndkifs在本实施案例中,将ctb-1、ctb-2和ltb-1多肽与轮状病毒的vp8蛋白(aa64-223)进行融合表达,将得到如下融合蛋白(不含外源多肽的vp8p[8]本身作为对照): 1)vp8p[8]2)ctb1-vp8p[8]融合蛋白,氨基酸序列如seq id no:4所示;3)ltb1-vp8p[8] 融合蛋白,氨基酸序列如seq id no:5所示;4)ctb2-vp8p[8] 融合蛋白,氨基酸序列如seq id no:7所示;表二轮状病毒vp8蛋白和融合蛋白的氨基酸序列轮状病毒毒株vp4p型vp8蛋白氨基酸序列wa株(genbank:mt025868)vp4p[8]seqidno:3其中vp8p[8]的序列来源于rotavirus a strain wa isolate rva/human-lab/
usa/g1p8/wa/virulent vp4 (vp4) gene(genbank:mt025868)的蛋白序列的氨基酸集团64-223。为了防止外源多肽影响vp8蛋白的2级和3级结构,在外源多肽和vp8之间增加了一个链接肽(gsgsg),链接肽由不带正电或负电荷的氨基酸组成,所以不影响蛋白的等电点。
[0017]
融合蛋白的dna序列交给北京擎科生物技术有限公司进行全序列合成,密码子按照大肠杆菌表达系统进行优化,优化后的序列:seq id no 8:霍乱肠毒素b亚单位(ctb1)多肽核酸序列;seq id no 9:霍乱肠毒素b亚单位(ctb2)多肽核酸序列;seq id no 10:大肠杆菌不耐热肠毒素b亚单位(ltb)多肽核酸序列;seq id no 11:轮状病毒vp8 p[8]蛋白核酸序列(aa64-223);seq id no 12: ctb1-vp8核酸序列;seq id no 13: ctb2-vp8核酸序列;seq id no 14: ltb-vp8核酸序列;seq id no 8:霍乱肠毒素b亚单位(ctb1)多肽核酸序列catggcaccccgcagaatattaccgatctgtgcgccgaatatcataatacccagatt;seq id no 9:霍乱肠毒素b亚单位(ctb2)多肽核酸序列accgatctgtgtgccgaatatcataatacccagatctataccctgaatgataaaattttc;seq id no 10:大肠杆菌不耐热肠毒素b亚单位(ltb)多肽核酸序列ggtgcacctcagaccattaccgaactgtgcagtgaatatcgtaatacccagatt;seq id no 11:轮状病毒vp8 p[8]蛋白核酸序列(aa64-223)atgattctggatggtccgtatcagccgaccacctttaccccgccgaatgattattggattctgattaatagtaacaccaacggcgttgtgtatgaaagcaccaataatagcgatttttggaccgccgttgtggccattgaaccgcatgtgaatccggttgatcgccagtataccatttttggcgaaagcaaacagtttaatgtgagcaatgatagtaacaaatggaaatttctggagatgtttcgcagcagcagtcagaatgaattttataatcgtcgtaccctgaccagtgatacccgttttgtgggcattctgaaatatggcggccgcgtttggacctttcatggcgaaaccccgcgtgcaaccaccgatagcagtagtaccgcaaatctgaataatattagcattaccatccacagcgaattttatattatcccgcgcagtcaggaaagtaaatgtaatgaatatatcaacaacggcctg;seq id no 12:ctb1-vp8核酸序列atgcatggcaccccgcagaatattaccgatctgtgcgccgaatatcataatacccagattggtagtggtagcggcattctggatggcccgtatcagccgaccacctttaccccgccgaatgattattggattctgattaatagcaacaccaatggcgttgtttatgaaagcaccaataatagcgatttttggaccgcagttgttgccattgaaccgcatgtgaatccggttgatcgccagtataccatttttggcgaaagcaaacagtttaatgtgagtaatgatagcaacaaatggaaatttctggaaatgtttcgcagtagtagtcagaatgaattttataatcgccgtaccctgaccagtgatacccgttttgttggcattctgaaatatggcggtcgcgtttggacctttcatggtgaaaccccgcgtgcaaccaccgatagtagtagtaccgcaaatctgaataatattagtatcaccatccacagcgaattttatattattccgcgtagtcaggaaagcaaatgcaatgaatatattaacaacggtctgseq id no 13:ctb2-vp8核酸序列atgaccgatctgtgtgccgaatatcataatacccagatctataccctgaatgataaaattttcggtagtggtagtggtattctggatggtccgtatcagccgaccacctttaccccgccgaatgattattggattctgattaatagtaacaccaacggcgtggtttatgaaagcaccaataatagtgatttctggaccgcagttgttgcaattgaaccgc
atgttaatccggttgatcgccagtataccatttttggcgaaagcaaacagtttaatgtgagcaatgatagcaataagtggaaatttctggaaatgtttcgcagcagcagccagaatgaattttataatcgtcgcaccctgaccagcgatacccgttttgttggtattctgaaatatggcggccgcgtttggacctttcatggtgaaaccccgcgtgccaccaccgatagtagcagcaccgcaaatctgaataatattagtattaccatccacagtgagttttatattatcccgcgcagccaggaaagcaaatgtaatgaatatattaacaacggcctg;seq id no 14:ltb1-vp8核酸序列atgggtgcacctcagaccattaccgaactgtgcagtgaatatcgtaatacccagattggcagtggcagcggtattctggatggtccgtatcagccgaccacctttaccccgccgaatgattattggattctgattaatagtaacaccaacggcgttgtgtatgaaagcaccaataatagcgatttttggaccgccgttgtggccattgaaccgcatgtgaatccggttgatcgccagtataccatttttggcgaaagcaaacagtttaatgtgagcaatgatagtaacaaatggaaatttctggagatgtttcgcagcagcagtcagaatgaattttataatcgtcgtaccctgaccagtgatacccgttttgtgggcattctgaaatatggcggccgcgtttggacctttcatggcgaaaccccgcgtgcaaccaccgatagcagtagtaccgcaaatctgaataatattagcattaccatccacagcgaattttatattatcccgcgcagtcaggaaagtaaatgtaatgaatatatcaacaacggcctg。
[0018]
将合成好的目的序列构建到pet30a的ndei和xhoi酶切位点之间(质粒构建过程由北京擎科生物科技有限公司完成),如图1所示。然后将有目标基因的质粒转化入bl21(de3)感受态菌体内,进行抗生素筛选。以t7启动子引物为测序引物,通过检测(北京擎科生物科技有限公司)证实目的片段插入pet30a载体的ndei和xhoi酶切位点之间(seq id no 12、seq id no 13和seq id no 14)。
[0019]
实施例2菌种培养和诱导表达。
[0020]
vp8蛋白是一个非糖基化的蛋白,因此,选择了大肠杆菌表达系统。所用的质粒为pet30a,宿主细胞e.coli bl21(de3)。挑取生长好的菌落在摇瓶中37 ℃,220rpm培养至od值约为0.5-0.8,然后把培养的温度降低到16 ℃,加入终浓度为0.2 mm的iptg诱导表达6-8个小时,诱导结束后将菌体收集,收集条件为4℃,4000 rpm离心30分钟。通过计算,1l的培养体积能够得到5-8g(湿重)的菌。sds-page(浓缩胶12.5%)检测分析证明菌体表达的蛋白都是可溶性蛋白,sds-page的结果显示目的蛋白大小与理论值相近,如图2所示。
[0021]
实施例3蛋白纯化。
[0022]
将收集的菌体(ltb1-vp8 /ctb1-vp8/ ctb2-vp8)用buffer a(10mm ph 8.0 tris-hcl 500mm nacl 30mm 咪唑)重悬,高压裂解后离心取上清。用buffer a平衡ni-nta nupharose ff层析柱子(纽龙,ni-nta nupharose ff,5ml),流速为1ml/min。将样品以1ml/min通过亲和柱,上样结束之后,用buffer a用冲洗亲和柱10个柱体积。蛋白的洗脱条件为:60%的buffer b(10mm ph 8.0 tris-hcl 500mm 咪唑)将目的蛋白洗脱下来。
[0023]
将蛋白通过10kda mwco的离心式过滤器(millipore)进行缓冲液的置换,将缓冲液置换成q buffer a(10mm ph 8.0 tris-hcl)。将置换缓冲液之后的样品以1ml/min的流速通过已经事先平衡好的阴离子交换q柱(cytiva,capto q,5ml);目的蛋白洗脱条件是通过0-100% q buffer b(10mm ph 8.0 tris-hcl 0.5 m nacl)线性梯度进行洗脱10个柱体积。纯化之后的目的蛋白通过sds-page检测蛋白的纯化效果,如图3所示。
[0024]
实施例4抗原蛋白免疫原性研究。
[0025]
疫苗的配制。在本实施例中,在疫苗的配置中加入了氢氧化铝佐剂(invivogen, vac-alu-250)。配制的方法是用100微升的蛋白(分别含10微克、50微克和100微克蛋白)与100微升的氢氧化铝佐剂1:1混合乳化,然后放于4℃冰箱,准备免疫。
[0026]
动物实验的分组(本实验的动物小鼠均为健康的balb/c小鼠(mus musculus)(雄性),6-8周龄,22.5 g
ꢀ±ꢀ
2.5 g。),本试验中,小鼠采用随机区组法分成11组,每组6只,将小鼠分为对照组和实验组,其中对照组包含阴性对照组(0.01 m pbs,标号为:pbs组)和佐剂对照组(铝佐剂),分别选择融合蛋白ctb1-vp8组,ctb2-vp8组,ltb1-vp8 组和vp8组,不同的蛋白免疫剂量即10 μg、50 μg和100 μg免疫实验组。
[0027]
疫苗的免疫接种:免疫途径为后腿肌肉注射,免疫三次,一次基础免疫,两次加强免疫,每次免疫间隔两周。实验组中,每只小鼠每次免疫接种疫苗为200 μl(含100 μl融合蛋白稀释液和100 μl佐剂)。以相同途径免疫阴性对照pbs组(每只小鼠每次免疫接种200 μl的0.01 m pbs)和佐剂对照al组(每只小鼠每次免疫接种100 μl的0.01 m pbs和100 μl佐剂)。
[0028]
免疫接种后,观察并记录各组小鼠的情况,主要观察小鼠有无突发性死亡等情况。采血方式:采用断尾取血的方式进行收集小鼠血液,最后一次采血后可以直接将其处死。(注意:每只小鼠分别取样)血液样品的处理方式:(1)首先收集小鼠的尾部血液,盛于1.5 ml ep管内,至少满足每只每次得到的血清不低于100
ꢀµ
l。
[0029]
(2)收集血液后37 ℃放置1 h,取出放置4 ℃过夜,然后在4 ℃环境中,5000 rpm离心15 min。
[0030]
(3)仔细收集析出的上层血清,最后将血清分装(每只每次采血分装2管即可,每管50
ꢀµ
l)做好标记、置于-80 ℃保存。
[0031]
实施例5间接elisa法检测蛋白特异性抗体igg\igg1\igg2a。
[0032]
取保存于-80℃冰箱的免疫后血清,间接elisa法检测血清中各蛋白特异性抗体igg、igg1、gg2a。具体操作步骤如下:(1)、包被:用包被液稀释蛋白(抗原),稀释比例为1:200,每孔100 μl,4℃过夜。
[0033]
(2)、弃蛋白液,拍干,pbst洗3次,每次5 min(尽量加满,但不串孔)。
[0034]
(3)、封闭:5%脱脂奶粉封闭(加满),37℃,1h30min。
[0035]
(4)、pbst洗3次,每次5 min。
[0036]
(5)、待检血清样品稀释:选取阳性血清和阴性血清,用pbs稀释,稀释比例为1:400,每孔100 μl,37℃,1 h。
[0037]
(6)、pbst洗3次,每次5 min。
[0038]
(7)、加入相应的igg、igg1、gg2a的hrp二抗(按照说明书稀释),每孔100 μl,37℃,1 h。
[0039]
(8)、pbst洗5次,每次5 min。
[0040]
(9)、显色:每孔加入tmb,每孔100 μl,37℃,避光15-20 min。
[0041]
(10)、终止:加入2m h2so4,每孔100 μl,测od值(450nm)。
[0042]
注:igg二抗(辣根过氧化物酶标记山羊抗小鼠igg(h l),a0216,上海碧云天生物技术有限公司)、igg1二抗(山羊抗小鼠igg1 (hrp),ab97240,艾博抗(上海)贸易有限公司)、igg2a二抗(山羊抗小鼠igg2a heavy chain,ab97245,艾博抗(上海)贸易有限公司)。
[0043]
th1细胞分泌 ifn-γ,介导细胞免疫反应,th2细胞分泌il-4,促进体液免疫反应。但ifn-γ和il-4水平通常是反向调节的。il-4诱导th0细胞分化为th2细胞,th2细胞分泌的il-4促进th2细胞增殖,引起体液免疫,抑制th1增殖(chen, l. et al. il-4 induces differentiation and expansion of th2 cytokine-producing eosinophils. 2004, j immunol172, 2059-2066),同时该因子能促进抗体向lgg1转换。ifn-γ及il-12促进th0向th1分化,th1细胞分泌ifn-γ,该细胞因子能促进抗体向lgg2a转换(prompetchara, e. et al. dna vaccine candidate encoding sars-cov-2 spike proteins elicited potent humoral and th1 cell-mediated immune responses in mice. plos one, 2021, 16, e0248007; ding, y. et al. a novel combined vaccine against classical swine fever and porcine epidemic diarrhea viruses elicits a significant th2-favored humoral response in mice. vaccine, 2021, 39, 4573-4576)。在小鼠体内,th1型会产生lgg2a型抗体,th2型会产生lgg1型抗体,通常使用lgg1/lgg2a来评价疫苗诱导的免疫应答中占主导地位的免疫应答(yue, x. et al. molecular characterization of a trichinella spiralis serine proteinase. vet res, 2020, 51, 125)。
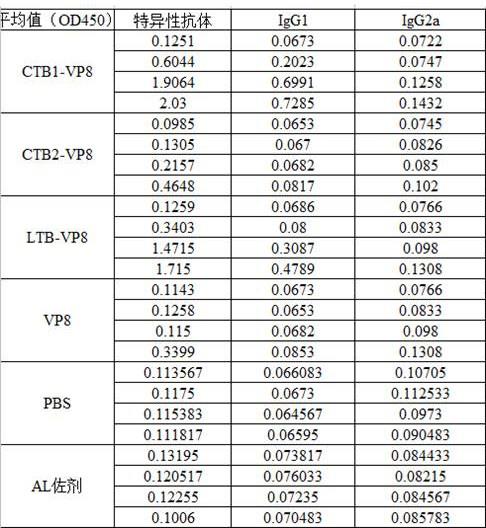
[0044]
结果表3和如图4所示,在特异性抗体指标和igg1指标中可以看出:ctb1-vp8和ltb1-vp8蛋白的免疫效果显著高于ctb2-vp8蛋白组、vp8蛋白组、pbs对照组和al佐剂对照组(p《0.001),然而ctb2-vp8蛋白和vp8蛋白免疫的效果与pbs对照组和al佐剂对照组没有明显的差异(p》0.001),其中ctb1-vp8蛋白免疫组的效果最好。在igg2a指标中可以看出:ctb1-vp8和ltb1-vp8蛋白的免疫效果于vp8蛋白免疫效果相比,ctb1-vp8和ltb1-vp8蛋白免疫效果在第二次免疫呈现上升的趋势,并在42 day时与ctb2-vp8蛋白组、vp8蛋白组、pbs对照组和al佐剂对照组有明显的差异(p《0.05),在特异性抗体指标、igg1指标和igg2a指标中,vp8蛋白组与pbs对照组和al佐剂对照组没有明显的差异(p》0.05)。总的来说:ctb1-vp8和ltb1-vp8能刺激小鼠产生较高的特异性抗体和igg1和igg2a,能引起小鼠体内产生较好的免疫应答。
[0045]
表3 动物免疫后血清中特异性抗体、igg1和igg2a数据
本发明涉及到的氨基酸序列表如下:seq id no 1:霍乱肠毒素b亚单位(ctb1)多肽氨基酸序列;seq id no 2:大肠杆菌不耐热肠毒素b亚单位(ltb)多肽氨基酸序列;seq id no 3:轮状病毒vp8 p[8]蛋白氨基酸序列(aa64-223);seq id no 4:ctb1-vp8氨基酸序列;seq id no 5:ltb-vp8氨基酸序列;seq id no 6:霍乱肠毒素b亚单位(ctb2)多肽氨基酸序列;seq id no 7:ctb2-vp8氨基酸序列;seq id no 8:霍乱肠毒素b亚单位(ctb1)多肽核酸序列;seq id no 9:霍乱肠毒素b亚单位(ctb2)多肽核酸序列;seq id no 10:大肠杆菌不耐热肠毒素b亚单位(ltb)多肽核酸序列;seq id no 11:轮状病毒vp8 p[8]蛋白核酸序列(aa64-223);seq id no 12:ctb1-vp8核酸序列;seq id no 13:ctb2-vp8核酸序列;seq id no 14:ltb1-vp8核酸序列;seq id no 1:hgtpqnitdlcaeyhntqi;
seq id no 2:gapqtitelcseyrntqi;seq id no 3:mildgpyqpttftppndywilinsntngvvyestnnsdfwtavvaiephvnpvdrqytifgeskqfnvsndsnkwkflemfrsssqnefynrrtltsdtrfvgilkyggrvwtfhgetprattdssstanlnnisitihsefyiiprsqeskcneyinngl;seq id no 4:mhgtpqnitdlcaeyhntqigsgsgildgpyqpttftppndywilinsntngvvyestnnsdfwtavvaiephvnpvdrqytifgeskqfnvsndsnkwkflemfrsssqnefynrrtltsdtrfvgilkyggrvwtfhgetprattdssstanlnnisitihsefyiiprsqeskcneyinngl;seq id no 5:mgapqtitelcseyrntqigsgsgildgpyqpttftppndywilinsntngvvyestnnsdfwtavvaiephvnpvdrqytifgeskqfnvsndsnkwkflemfrsssqnefynrrtltsdtrfvgilkyggrvwtfhgetprattdssstanlnnisitihsefyiiprsqeskcneyinngl;seq id no 6:tdlcaeyhntqiytlndkif;seq id no 7:mtdlcaeyhntqiytlndkifgsgsgildgpyqpttftppndywilinsntngvvyestnnsdfwtavvaiephvnpvdrqytifgeskqfnvsndsnkwkflemfrsssqnefynrrtltsdtrfvgilkyggrvwtfhgetprattdssstanlnnisitihsefyiiprsqeskcneyinngl;seq id no 8:霍乱肠毒素b亚单位(ctb1)多肽核酸序列catggcaccccgcagaatattaccgatctgtgcgccgaatatcataatacccagatt;seq id no 9:霍乱肠毒素b亚单位(ctb2)多肽核酸序列accgatctgtgtgccgaatatcataatacccagatctataccctgaatgataaaattttc;seq id no 10:大肠杆菌不耐热肠毒素b亚单位(ltb)多肽核酸序列ggtgcacctcagaccattaccgaactgtgcagtgaatatcgtaatacccagatt;seq id no 11:轮状病毒vp8 p[8]蛋白核酸序列(aa64-223)atgattctggatggtccgtatcagccgaccacctttaccccgccgaatgattattggattctgattaatagtaacaccaacggcgttgtgtatgaaagcaccaataatagcgatttttggaccgccgttgtggccattgaaccgcatgtgaatccggttgatcgccagtataccatttttggcgaaagcaaacagtttaatgtgagcaatgatagtaacaaatggaaatttctggagatgtttcgcagcagcagtcagaatgaattttataatcgtcgtaccctgaccagtgatacccgttttgtgggcattctgaaatatggcggccgcgtttggacctttcatggcgaaaccccgcgtgcaaccaccgatagcagtagtaccgcaaatctgaataatattagcattaccatccacagcgaattttatattatcccgcgcagtcaggaaagtaaatgtaatgaatatatcaacaacggcctg;seq id no 12:ctb1-vp8核酸序列atgcatggcaccccgcagaatattaccgatctgtgcgccgaatatcataatacccagattggtagtggtagcggcattctggatggcccgtatcagccgaccacctttaccccgccgaatgattattggattctgattaatagcaacaccaatggcgttgtttatgaaagcaccaataatagcgatttttggaccgcagttgttgccattgaaccgcatgtgaatccggttgatcgccagtataccatttttggcgaaagcaaacagtttaatgtgagtaatgatagcaacaaatggaaatttctggaaatgtttcgcagtagtagtcagaatgaattttataatcgccgtaccctgaccagtgatacccgttttgttggcattctgaaatatggcggtcgcgtttggacctttcatggtgaaaccccgcgtgcaaccaccgatagtagtagta
ccgcaaatctgaataatattagtatcaccatccacagcgaattttatattattccgcgtagtcaggaaagcaaatgcaatgaatatattaacaacggtctgseq id no 13:ctb2-vp8核酸序列atgaccgatctgtgtgccgaatatcataatacccagatctataccctgaatgataaaattttcggtagtggtagtggtattctggatggtccgtatcagccgaccacctttaccccgccgaatgattattggattctgattaatagtaacaccaacggcgtggtttatgaaagcaccaataatagtgatttctggaccgcagttgttgcaattgaaccgcatgttaatccggttgatcgccagtataccatttttggcgaaagcaaacagtttaatgtgagcaatgatagcaataagtggaaatttctggaaatgtttcgcagcagcagccagaatgaattttataatcgtcgcaccctgaccagcgatacccgttttgttggtattctgaaatatggcggccgcgtttggacctttcatggtgaaaccccgcgtgccaccaccgatagtagcagcaccgcaaatctgaataatattagtattaccatccacagtgagttttatattatcccgcgcagccaggaaagcaaatgtaatgaatatattaacaacggcctg;seq id no 14:ltb1-vp8核酸序列atgggtgcacctcagaccattaccgaactgtgcagtgaatatcgtaatacccagattggcagtggcagcggtattctggatggtccgtatcagccgaccacctttaccccgccgaatgattattggattctgattaatagtaacaccaacggcgttgtgtatgaaagcaccaataatagcgatttttggaccgccgttgtggccattgaaccgcatgtgaatccggttgatcgccagtataccatttttggcgaaagcaaacagtttaatgtgagcaatgatagtaacaaatggaaatttctggagatgtttcgcagcagcagtcagaatgaattttataatcgtcgtaccctgaccagtgatacccgttttgtgggcattctgaaatatggcggccgcgtttggacctttcatggcgaaaccccgcgtgcaaccaccgatagcagtagtaccgcaaatctgaataatattagcattaccatccacagcgaattttatattatcccgcgcagtcaggaaagtaaatgtaatgaatatatcaacaacggcctg。
[0046]
以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。