1.本发明属于基因工程领域,具体涉及一种稳定性高的嗜盐古菌胞外蛋白酶截短体的制备方法及其应用。
背景技术:
2.蛋白酶是水解蛋白质肽链的一类酶的总称,广泛用于食品、生物医学、皮革、纺织和洗涤剂等工业领域,但在极端条件下应用受限。嗜盐古菌通常生活在盐湖、盐碱地、晒盐场、腌制食品等高盐环境,其来源的酶类通常具有耐盐碱、耐高温、耐有机溶剂等特征。因此,嗜盐古菌是广适性蛋白酶的良好来源,可应用于高盐、高温等特殊工业条件中。
3.目前,已发表的嗜盐古菌胞外蛋白酶均为丝氨酸蛋白酶,属于枯草杆菌蛋白酶类蛋白酶 (subtilase)s8a家族。已发现的蛋白酶均是以前体的形式在胞内形成,含有信号肽、前肽、催化结构域和c-端延伸区(c-terminal extension,cte)。前体经过跨膜运输后切除信号肽和前肽形成成熟酶,成熟酶包括催化结构域和cte。
4.嗜盐古菌产生的蛋白酶在低盐条件下会解聚或失活,故其分离纯化存在一定的限制。目前,蛋白酶的纯化方法包括杆菌肽亲和层析、凝胶过滤层析等方法,这些方法得到的蛋白一般同时含有目的条带和杂带,还需要进一步的纯化,并且稳定性不佳。
技术实现要素:
5.本发明提供一种稳定性高的嗜盐古菌(halococcus salifodinae)胞外蛋白酶截短体的制备方法,及其在高盐、高温等特殊工业条件中的应用。本发明涉及的嗜盐古菌胞外蛋白酶截短体是成熟酶hlya中没有cte的hlya
△
cte,其在高温、低盐、高盐、碱性等环境下均具有良好的稳定性,hlya
△
cte纯化及性能检测为嗜盐古菌蛋白酶的工业应用提供基础,为高盐、高温等环境中的蛋白降解提供新型酶制剂。
6.重组质粒pet28a-hlya公开自文献《大连盐场与茶卡盐湖嗜盐古菌多样性及胞外蛋白酶研究》,其编码蛋白质的基因为hlya,来源自嗜盐古菌(halococcus salifodinae)。
7.本发明涉及稳定性高的嗜盐古菌胞外蛋白酶截短体的制备方法,具体包括以下步骤:
8.(1)重组质粒pet28a-hlya转化原核生物宿主,诱导表达;
9.首先基于重组质粒pet28a-hlya,将其转化原核生物宿主,转化后的宿主细胞在添加诱导剂的lb培养基中进行诱导表达,随后在一定温度条件下离心收集菌体;
10.(2)嗜盐古菌蛋白酶hlya的纯化与复性;
11.收集步骤(1)诱导表达后的菌体于细胞裂解液中进行重悬,超声破碎,离心收集上清液,使用镍柱亲和层析进行纯化,随后通过超滤置换复性得到成熟蛋白酶,记为hlya;
12.(3)嗜盐古菌蛋白酶hlya在一定条件下孵育得到hlya
△
cte;
13.将步骤(2)中得到成熟蛋白酶(hlya)在水浴条件下进行孵育,即得到嗜盐古菌胞外蛋白酶截短体,记为hlya
△
cte,其氨基酸序列为seq id no.1。
14.优选的,步骤(1)中所述原核生物宿主为e.coli bl21。
15.优选的,步骤(1)中所述诱导表达中的诱导剂为iptg,在lb培养基中的终浓度为0.5 mm。
16.优选的,步骤(1)中所述诱导表达的时间为4~5h,温度为37℃。
17.优选的,步骤(1)中所述一定温度条件为4℃。
18.优选的,步骤(2)中所述细胞裂解液成分为8m尿素,10mm cacl2,50mm tris-hcl, ph 8.0。
19.优选的,步骤(2)中所述镍柱亲和层析纯化的步骤为:流尽镍柱中的保存的体积分数为 20%的乙醇,然后用10倍柱床体积ddh2o洗柱,再用10倍柱床体积的细胞裂解液平衡柱子;将离心收集的上清液流进柱子,重复两次;用10倍柱床体积的缓冲液i流进柱子洗脱杂蛋白;用10ml的缓冲液ⅱ流进柱子洗脱目的蛋白,获得纯化后的hlya。
20.优选的,所述缓冲液i的成分为40mm咪唑,8m尿素,10mm cacl2,50mm tris-hcl, ph 8.0。
21.优选的,所述缓冲液ii成分为100mm咪唑,8m尿素,10mm cacl2,50mm tris-hcl, ph 8.0。
22.优选的,步骤(2)中所述超滤是使用截留分子量为10kda的超滤离心管浓缩。
23.优选的,步骤(3)中所述水浴的温度为60℃,孵育的时间为4h。
24.优选的,步骤(3)中所述hlya
△
cte通过蛋白质的c端测序确定。
25.本发明制备的嗜盐古菌胞外蛋白酶截短体可为高盐、高温等环境中的蛋白降解提供新型酶制剂;具体应用于鱼露发酵中促进对鱼蛋白的水解作用。
26.性能检测:
27.(1)嗜盐古菌蛋白酶hlya
△
cte的稳定性表征;
28.将上述得到的嗜盐古菌蛋白酶hlya
△
cte放置在不同的温度、盐度、ph下孵育一定时间后,用sds-page表征其稳定性;所述不同温度为:-20℃~80℃,盐度为:0.08m~4m, ph为:6~10,孵育时间为:0~72h。
29.(2)嗜盐古菌蛋白酶hlya
△
cte的酶学性质表征;
30.基于步骤(1)稳定性的表征,进一步以偶氮酪蛋白为底物测定蛋白酶hlya
△
cte的酶活来表征嗜盐古菌蛋白酶hlya
△
cte酶学性质,具体包括:酶催化反应的最适温度、最适ph、最适nacl浓度,不同金属离子对嗜盐古菌蛋白酶hlya
△
cte活性的影响,不同有机溶剂和洗涤剂对嗜盐古菌蛋白酶hlya
△
cte活性的影响,不同蛋白酶抑制剂对嗜盐古菌蛋白酶 hlya
△
cte活性的影响以及酶促动力学参数测定;其中所述温度、ph和nacl浓度的确定范围分别是30~80℃、ph 6.0~10.5、nacl浓度0.5~4m;所述不同的金属离子为:fe
3
、k
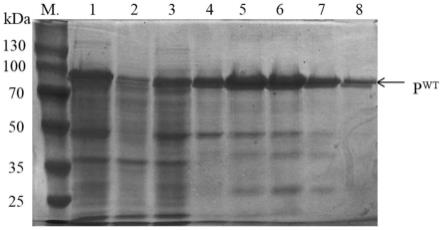
、 ca
2
、cu
2
、mg
2
、mn
2
、zn
2
、sr
2
、ni
2
;所述不同的有机溶剂和洗涤剂为:甲醇、乙醇、甘油、丙酮、dmso、吐温20、吐温80、乙腈、异丙醇、dmf和triton x-100;所述不同蛋白酶抑制剂为:pmsf、dtt、edta;所述酶学性质均是以偶氮酪蛋白为底物测定hlya
△
cte 的催化活性来表征。
31.(3)嗜盐古菌蛋白酶hlya
△
cte对不同底物的水解活性。
32.基于步骤(2)酶学性质的表征,进一步以不同的底物测定酶活来探究嗜盐古菌蛋白酶 hlya
△
cte对其水解活性;其中所述不同底物为:偶氮酪蛋白、弹性蛋白、牛血红蛋白、鸡蛋白蛋白、牛白蛋白、脱脂奶粉、明胶。
33.本发明的优点和技术效果:
34.(1)本发明提出了一种稳定性高的嗜盐古菌胞外蛋白酶截短体hlya
△
cte的制备方法,与大多数嗜盐古菌胞外蛋白酶截短体的获得相比,本发明操作更加简易,可以快速获得有活性的嗜盐古菌胞外蛋白酶截短体,同时保持了较高的纯度。
35.(2)嗜盐古菌胞外蛋白酶hlya
△
cte具有优良的酶学特性,可以水解多种大分子蛋白质底物;其对nacl的耐受性尤为突出,在低盐到高盐范围内均具有很高的稳定性和酶活;在 50~75℃下均具有较高酶活,在60℃以下有很好的稳定性;在酸性、中性、碱性的ph范围内具有较高的稳定性;可耐受多种金属离子、有机试剂和洗涤剂。具有优良性状的嗜盐古菌胞外蛋白酶截短体hlya
△
cte可应用于高盐、高温等特殊工业环境中。
附图说明
36.图1为镍柱亲和层析纯化后的hlya的聚丙烯酰胺凝胶电泳分析图。
37.图2为超滤置换复性后hlya热处理的聚丙烯酰胺凝胶电泳分析图。
38.图3为液质联用(lc-ms/ms)所得hlya
△
cte的c端序列分析图。
39.图4为hlya
△
cte在-20℃和4℃下稳定性的聚丙烯酰胺凝胶电泳分析图。
40.图5为hlya
△
cte在30℃下稳定性的聚丙烯酰胺凝胶电泳分析图。
41.图6为hlya
△
cte在60℃和80℃下稳定性的聚丙烯酰胺凝胶电泳分析图。
42.图7为hlya
△
cte在0.08m nacl下稳定性的聚丙烯酰胺凝胶电泳分析图。
43.图8为hlya
△
cte在0.5m、1m、2m nacl下稳定性的聚丙烯酰胺凝胶电泳分析图。
44.图9为hlya
△
cte在4m nacl、ph 8下稳定性的聚丙烯酰胺凝胶电泳分析图。
45.图10为hlya
△
cte在ph 6和ph 10条件下稳定性的聚丙烯酰胺凝胶电泳分析图。
46.图11为温度对hlya
△
cte催化活性的影响图。
47.图12为ph对hlya
△
cte催化活性的影响图。
48.图13为盐浓度对hlya
△
cte催化活性的影响图。
49.图14为不同金属离子对hlya
△
cte催化活性的影响图。
50.图15为不同有机试剂和洗涤剂对hlya
△
cte催化活性的影响图。
51.图16为不同蛋白酶抑制剂对hlya
△
cte催化活性的影响图。
52.图17为hlya
△
cte以偶氮酪蛋白为底物的动力学曲线图。
53.图18为hlya
△
cte对不同底物的催化活性图。
具体实施方式
54.下面结合说明书附图和具体实施实例对本发明做进一步说明。
55.重组质粒pet28a-hlya的构建:参考文献“大连盐场与茶卡盐湖嗜盐古菌多样性及胞外蛋白酶研究”,即通过pcr获得嗜盐古菌(halococcus salifodinae)编码蛋白质的基因hlya,用相同限制性核酸内切酶对目的基因和载体pet28a进行双酶切,连接后,转化到e.coli dh5 α感受态,重组子验证正确后寄生物公司测序,测序正确即得到重组质粒pet28a-hlya。
56.实施例1:
57.(1)重组质粒pet28a-hlya转化原核生物宿主,诱导表达;
58.将重组质粒pet28a-hlya转化e.coli bl21表达菌株中,构建表达重组菌株。然后将2ml 重组表达菌液转接到200ml含有50μg/ml卡那霉素的lb液体培养基中,37℃振荡培养至生长对数期(od
600
在0.55~0.65之间),加入终浓度为0.5mm的iptg诱导表达4~5h;4℃离心收集菌体。
59.(2)嗜盐古菌蛋白酶hlya的纯化:
60.收集步骤(1)诱导表达后的菌体(表达了蛋白酶hlya的e.coli bl21菌体)于细胞裂解液(8m尿素,10mm cacl2,50mm tris-hcl,ph 8.0)中进行重悬,重悬后进行超声破碎,超声时间3s,间隔5s,破碎直至菌体透亮,4℃离心后收集上清液,上清液经过镍柱亲和层析纯化得到纯化后的蛋白酶,记为hlya;如图1所示,图1为镍柱亲和层析纯化后的 hlya的聚丙烯酰胺凝胶电泳分析图,其中:p
wt
:hlya前体分子;m.:蛋白分子量指示marker; 1:细胞裂解液;2:上样流穿液;3:40mm咪唑洗脱杂蛋白;4~8:100mm咪唑洗脱目的蛋白;从图1可以看出100mm咪唑可以将蛋白酶hlya洗脱下来,且表达了重组质粒 pet28a-hlya的大肠杆菌的粗酶液液经过镍柱亲和层析纯化后可以得到条带较为单一的无活性的蛋白酶hlya(hlya前体分子),表观分子量在100kda左右。
61.具体操作如下:
62.1)流尽镍柱中的保存液体(体积分数20%的乙醇)后用10倍柱床体积(20ml)ddh2o 洗柱,再用10倍柱床体积的细胞裂解液平衡柱子;
63.2)将上清液流进柱子,重复两次(每次让上清液在柱中停留10min,期间缓慢用枪吸打,以保证目的蛋白能够充分与镍柱结合);
64.3)加入25ml的缓冲液ⅰ(50mm tris-hcl,10mm cacl2,8m尿素,40mm咪唑,ph 8.0)洗脱杂蛋白;
65.4)加入10ml的缓冲液ⅱ(50mm tris-hcl,10mm cacl2,8m尿素,100mm咪唑,ph 8.0)洗脱目的蛋白,每1ml洗脱一管,收集于eppendorf管中,获得纯化后的蛋白酶hlya;
66.5)加入10ml的缓冲液ⅲ(50mm tris-hcl,10mm cacl2,8m尿素,500mm咪唑,ph 8.0)清洗镍柱;再加入20ml ddh2o清洗镍柱;最后10ml 20%乙醇溶液清洗镍柱,并将镍柱充满20%乙醇,于4℃保存;
67.6)所得目的蛋白进行sds-page检测。
68.(3)嗜盐古菌蛋白酶hlya的复性:
69.进一步将镍柱纯化后的蛋白酶hlya置于超滤管中离心,进行置换复性即得到成熟的蛋白酶hlya;如图2所示,图2为超滤置换复性后hlya热处理的聚丙烯酰胺凝胶电泳分析图, m.:蛋白分子量指示marker;1~6:超滤置换后在37℃分别保温0、2、4、6、8、24h;m:成熟酶hlya条带;
△
c:hlya
△
cte;从图2可以看出经过超滤管离心后的蛋白酶hlya在未进行37℃孵育(即37℃保温0h)可以得到成熟的蛋白酶hlya(表观分子量在70kda 左右),同时含有降解条带(表观分子量在35kda左右)。随着孵育时间的延长,可以观察成熟的蛋白酶hlya(表观分子量在70kda左右)和降解条带(表观分子量在35kda左右) 在逐渐减少,与此同时,蛋白酶hlya
△
cte(表观分子量在50kda左右)逐渐增加。具体操作如下:
70.1)sds-page检测颜色最深的5ml镍柱纯化后的蛋白酶hlya样品混合均匀后加入 50μl的1m ddt,室温放置30min;
71.2)向5ml镍柱纯化后的蛋白酶hlya和dtt混合液中加入45ml复性buffer(4m nacl,
50mm tris-hcl,10mm cacl2,ph 8.0)后,超滤至1ml以提高初始酶量。然后加入9ml复性buffer超滤至1ml,最后再加入9ml复性buffer超滤至1ml;
72.(4)hlya
△
cte的获得:
73.成熟的蛋白酶hlya在60℃条件下孵育4h便可获得高纯度的嗜盐古菌胞外蛋白酶截短体,记为hlya
△
cte,如图3所示,图3为液质联用(lc-ms/ms)所得hlya
△
cte的c 端序列分析图,从图3可以看出hlya
△
cte的c末端氨基酸序列为 aavttdpadgggggggggggge,与hlya的氨基酸序列相比缺少c-端延伸区(c-terminalextension,cte)。
74.性能分析;
75.(1)hlya
△
cte稳定性分析;
76.以sds-page分析表征hlya
△
cte的稳定性。
77.hlya
△
cte的热稳定性分析具体操作为:nacl终浓度为4m的50mm tris-hcl、10mmcacl2、ph 8.0缓冲液,将蛋白酶hlya
△
cte分别于-20、4、30、60和80℃孵育0、48和 72h,采用tca/丙酮处理法对蛋白酶hlya
△
cte上样前处理后,进行sds-page分析。
78.图4为hlya
△
cte在-20℃和4℃下稳定性的聚丙烯酰胺凝胶电泳分析图;图5为hlya
ꢀ△
cte在30℃下稳定性的聚丙烯酰胺凝胶电泳分析图;图6为hlya
△
cte在60℃和80℃下稳定性的聚丙烯酰胺凝胶电泳分析图。
79.从图4-图6可以看出,在-20、4、30和60℃下,孵育至72h,蛋白酶hlya
△
cte仍未发生降解,在80℃下孵育48h几乎看不见蛋白酶hlya
△
cte条带,即几乎全部发生降解。综上,hlya
△
cte具有较好的热稳定性。
80.hlya
△
cte的nacl稳定性分析具体操作为:将蛋白酶hlya
△
cte分别于nacl终浓度为0.08、0.5、1、2和4m的50mm tris-hcl、10mm cacl2、ph 8.0缓冲液中孵育0、48和 72h,采用tca/丙酮处理法对hlya
△
cte上样前处理后,进行sds-page分析。
81.图7为hlya
△
cte在0.08m nacl下稳定性的聚丙烯酰胺凝胶电泳分析图;图8为hlya
ꢀ△
cte在0.5m、1m、2m nacl下稳定性的聚丙烯酰胺凝胶电泳分析图;图9为hlya
△
cte 在4m nacl、ph 8.0下稳定性的聚丙烯酰胺凝胶电泳分析图。
82.从图7-图9可以看出,hlya
△
cte在0.08m nacl的缓冲液中孵育48和72h时,hlya
ꢀ△
cte条带明显相对于0h减弱,但72h仍可见少量条带。蛋白酶hlya
△
cte在0.5、1、2 和4m nacl浓度下,72h仍有清晰条带可见,均未发生降解。综上,hlya
△
cte具有较好的盐度稳定性。
83.hlya
△
cte的ph稳定性分析具体操作为:将蛋白酶hlya
△
cte分别于ph 6.0(磷酸盐缓冲液)、ph 8.0(tris-hcl缓冲液)和ph 10.0(ches-naoh缓冲液)的4m nacl、50mmtris-hcl、10mm cacl2的缓冲液中孵育0、48和72h,采用tca/丙酮处理法对蛋白酶hlya
ꢀ△
cte上样前处理后,进行sds-page分析。
84.图9为hlya
△
cte在4m nacl、ph 8下稳定性的聚丙烯酰胺凝胶电泳分析图;图10 为hlya
△
cte在ph 6和ph 10条件下稳定性的聚丙烯酰胺凝胶电泳分析图。
85.从图9-图10可以看出,hlya
△
cte在缓冲液ph 6.0、ph 8.0和ph 10.0条件下孵育72h 仍有清晰条带,均未发生降解。综上,hlya
△
cte具有良好的ph稳定性。
86.(2)hlya
△
cte的酶活检测;
87.以偶氮酪蛋白为底物测定hlya
△
cte的催化活性。具体操作:蛋白酶hlya
△
cte的
酶活测定缓冲液为4m nacl,50mm tris-hcl,ph 8.0。设置空白对照组和测试组,以0.22 5μg纯酶定量,根据所得的蛋白酶hlya
△
cte蛋白浓度计算所需酶液的体积后用酶活测定缓冲液补充到30μl。在37℃水浴锅中预热两分钟。接着在测试组中加入30μl 0.5%(w /v)偶氮酪蛋白溶液后放置在37℃下反应60分钟,空白组30μl 0.5%偶氮酪蛋白溶液单独放置在37℃孵育60分钟。孵育结束后,往对照管与测试管中加入60μl 10%(w/v)tca 溶液。再把单独孵育的30μl 0.5%偶氮酪蛋白溶液加入到空白对照组中,测试组和空白组均在室温静置30分钟,离心所得上清液与1m naoh以1:1比例混合后,采用紫外可见光分光光度计测定吸光值a
440
;一个酶活力单位定义为每分钟吸光值增加0.01所需要的酶量。
88.上述底物购买自美国sigma公司。
89.(3)hlya
△
cte最适反应条件分析;
90.以偶氮酪蛋白为底物测定hlya
△
cte的最适反应条件。
91.以0.225μg定量,根据所得的蛋白酶hlya
△
cte浓度计算所需酶液的体积。蛋白酶hlya
ꢀ△
cte最适反应温度在30~80℃范围内测定。具体操作为:配制含4.0m nacl、50mmtris-hcl、ph 8.0的缓冲液,以此溶液配制0.5%偶氮酪蛋白底物溶液,于30、35、40、45、 50、55、60、65、70、75、80℃下测定各梯度蛋白酶hlya
△
cte的酶活,并分别设置温度梯度下各自空白对照(酶活测定中除反应温度不同外,其余方法同性能分析(2)),以最高酶活为100%计算其他梯度相对酶活,每组三次平行试验。图11为温度对hlya
△
cte催化活性的影响图,结果表明hlya
△
cte在50~75℃范围有较高酶活(最高酶活的75%以上),最适为60℃。
92.最适反应ph在6.0~10.5范围内测定。具体操作为:分别以磷酸盐缓冲液(ph 6~7.5)、 tris-hcl缓冲液(ph 7.5~9)和ches-naoh缓冲液(ph 9~10.5)配制终浓度为4.0m nacl、 50mm tris-hcl的缓冲液,分别设置各ph梯度下各自空白对照,最适温度60℃测定各梯度蛋白酶hlya
△
cte的酶活(酶活测定中除反应温度以及ph不同外,其余方法同性能分析 (2)),以最高酶活为100%计算其他梯度相对酶活,每组三次平行试验。图12为ph对 hlya
△
cte催化活性的影响图,结果表明hlya
△
cte在ph值为6.5~8.0范围内均保持最高酶活的75%以上,最适ph为7.0。
93.最适nacl浓度在0.5~4m范围内测定。具体操作为:分别配制nacl浓度为0.5、1.0、 1.5、2.0、2.5、3.0、3.5和4.0m的50mm tris-hcl、ph 7.0缓冲液,以上述各浓度分别配制相应浓度的偶氮酪蛋白底物溶液。设置各nacl梯度下的空白对照,最适温度60℃,ph为 7.0测定各梯度蛋白酶hlya
△
cte的酶活(酶活测定中除nacl浓度,反应温度以及ph不同外,其余方法同性能分析(2)),以最高酶活为100%计算其他梯度相对酶活,每组三次平行试验。图13为盐浓度对hlya
△
cte催化活性的影响图,结果表明hlya
△
cte在0.5~2.5mnacl均保持最高酶活的75%以上,最适为1.5m nacl。
94.hlya
△
cte最适反应条件为60℃、ph 7.0以及1.5m nacl。
95.(4)hlya
△
cte环境耐受性分析;
96.金属离子对hlya
△
cte活性影响的测定具体操作为:反应体系为nacl终浓度1.5m、 ph为7.0,其中添加不同的金属离子(fe
3
、k
、ca
2
、cu
2
、mg
2
、mn
2
、zn
2
、sr
2
、ni
2
) 使其终浓度为10mm,阳性对照体系中以ddh2o代替金属离子。分别设置阳性对照和实验组各自空白对照,60℃测定蛋白酶hlya
△
cte的酶活(酶活测定中除nacl浓度、ph以及反应温度更改为最
适条件外,其余方法同性能分析(2)),以阳性对照结果为100%酶活,比较含金属离子的反应体系的相对酶活,每组三次平行试验。图14为不同金属离子对hlya
△ꢀ
cte催化活性的影响图,结果表明hlya
△
cte对ca
2
、sr
2
、k
、mg
2
有良好的耐受性。
97.有机溶剂和洗涤剂对hlya
△
cte活性影响的测定具体操作为:反应体系为nacl终浓度 1.5m、ph为7.0,其中添加15%的甲醇、乙醇、甘油、丙酮、dmso、吐温20、吐温80、乙腈、异丙醇、dmf和triton x-100,阳性对照体系中ddh2o代替有机试剂和洗涤剂。分别设置阳性对照和实验组各自空白对照,60℃测定蛋白酶hlya
△
cte的酶活(酶活测定中除 nacl浓度、ph以及反应温度更改为最适条件外,其余方法同性能分析(2)),以阳性对照结果为100%酶活,比较含有机试剂和洗涤剂体系的相对酶活,每组三次平行试验。图15为不同有机试剂和洗涤剂对hlya
△
cte催化活性的影响图,结果表明hlya
△
cte对甘油、丙酮、dmso、吐温20有较好的耐受性。
98.不同蛋白酶抑制剂对hlya
△
cte活性影响的测定具体操作为:反应体系为nacl终浓度 1.5m、ph为7.0,其中添加终浓度为4mm的pmsf、10mm dtt、5mm edta。其中4mmpmsf用甲醇溶解,10mm dtt用水溶解,5mm edta用50mm tris-hcl ph 8.0缓冲液溶解。抑制剂以10倍浓度扩大配置储备液,使用时按照十分之一的量加入。阳性对照体系中用相应溶解溶剂代替抑制剂。60℃测定蛋白酶hlya
△
cte的酶活(酶活测定中除nacl浓度、 ph以及反应温度更改为最适条件外,其余方法同性能分析(2)),以阳性对照结果为100%酶活,比较含有抑制剂的相对酶活,每组三次平行试验。图16为不同蛋白酶抑制剂对hlya
ꢀ△
cte催化活性的影响图,结果表明pmsf几乎使hlya
△
cte酶活完全丧失,表明hlya
△ꢀ
cte是丝氨酸蛋白酶。dtt使得酶活明显降低,金属蛋白酶抑制剂edta使酶活降低了约 10%。
99.以偶氮酪蛋白为底物测定hlya
△
cte的酶促反应动力学曲线具体操作为:反应体系为 nacl终浓度1.5m、ph为7.0,以0.225μg蛋白酶hlya
△
cte与终浓度为0.01~1.9mm偶氮酪蛋白底物60℃反应60min,测定吸光度a
440
,蛋白酶hlya
△
cte的酶活测定中除nacl 浓度、ph和反应温度更改为最适条件,以及底物浓度更改外,其余步骤同性能分析(2),根据米氏方程(michael-menten equation)计算hlya
△
cte的动力学常数km和最大反应速率 v
max
。图17为hlya
△
cte以偶氮酪蛋白为底物的动力学曲线图,hlya
△
cte以偶氮酪蛋白为反应底物最大反应速率v
max
为15195u/mg,动力学常数km为0.9924mm。
100.(5)hlya
△
cte对不同底物的水解活性分析;
101.hlya
△
cte对不同底物的水解活性的测定具体操作为:反应体系为nacl终浓度1.5m、 ph为7.0,其中添加终浓度为0.5%的偶氮酪蛋白、弹性蛋白、牛血红蛋白、鸡蛋白蛋白、牛白蛋白、脱脂奶粉、明胶。分别设置实验组和各自空白对照,60℃测定吸光值a
280
(酶活测定中除nacl浓度、ph以及反应温度更改为最适条件外,偶氮酪蛋白换成相应底物,静置30 分钟离心后直接测定吸光值a
280
,其余方法同性能分析(2)),每组三次平行试验。图18 为hlya
△
cte对不同底物的催化活性图,结果表明hlya
△
cte对不同底物催化活性依次为偶氮酪蛋白》牛血红蛋白》脱脂奶粉》鸡蛋白蛋白》弹性蛋白。
102.说明:以上实施例仅用以说明本发明而并非限制本发明所描述的技术方案;因此,尽管本说明书参照上述的各个实施例对本发明已进行了详细的说明,但是本领域的普通技术人员应当理解,仍然可以对本发明进行修改或等同替换;而一切不脱离本发明的精神和范围的技术方案及其改进,其均应涵盖在本发明的权利要求范围内。
103.hlya
△
cte氨基酸序列:seq id no.1
104.mvekptpgrrsflkaigagtlfgglsgvasatpgrqpgpkkdeilvgvsasaadmega vtqavpgnaevvhrneklsyvavkfpsqaadrakenfidaitkkdhikyaepntthealyq psdprfgdqyapkqvesdrawdttlgdsgvtiavvdtgaqydhpdlqanyksnpgrdfad ndsdpypdapsseyhgthvsgcaaavvdngtgvagqsnsslingraldeggsgstadiada iewaadqgadiinlslggggytstmknavsyatdngslviaaagnngsssvsypaaysecm aisavddneqlasfsqygenvelcapgvdvlsttteargsyerlsgtsmatpvtsgvagltl akwnltnqelrshlkntaediglsaneqgsgqvdalaavttdpadgggggggggggge。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
