1.本发明整体涉及荧光化合物。特别地,本发明涉及基于罗丹明的荧光染料以及用于合成和使用这些染料的方法。
背景技术:
2.具有定制特性的荧光染料对于依赖荧光检测的几乎任何分析方法都很重要。在生命科学领域,荧光染料的应用范围从实时聚合酶链反应(pcr)测定到荧光成像技术(包括但不限于荧光显微镜、单分子成像、超分辨率显微镜以及细胞标记和跟踪实验)。
3.分析pcr领域的当前进展针对的是多路复用,即同时检测分析样品中的多个靶标。采用tags(温度辅助信号生成,公开于美国专利公开号2018/0073064中,其全文以引用方式并入本文)的pcr是一种多路复用技术,其能够通过在热循环期间采集不同温度下的荧光数据以测量每个荧光通道中的多个单独靶标。因此,使用两个或三个温度通道的tags多路复用可使每个光通道的可分辨靶标数量增加一倍或两倍。原则上,该技术可部署在任何能够在每个pcr循环中采集多个荧光读数的定量pcr(qpcr)仪器上。
4.对于任何依赖荧光检测的应用,采用tags的pcr技术都需要明亮的染料。荧光团的亮度由其消光系数与量子产率的乘积定义。虽然消光系数决定了荧光团吸收激发光的效率,但量子产率是衡量每个激发事件中荧光团发射的光子数的指标。一个常见问题是,当向电磁波谱的红色端移动时,荧光团的整体亮度往往显著降低。因此,近红外(nir)光谱范围(在650nm与900nm之间的激发和发射)内的荧光团受到亮度下降的影响,从而降低了基于荧光的应用的整体灵敏度。
5.在采用tags的pcr技术的背景下,对荧光染料的另一个要求是温度稳定的荧光发射。特别地,花青染料诸如cy5、cy5.5或cy7在升高的温度下表现出显著的亮度损失;这是具有共轭双键的构象上灵活的链的聚甲炔支架所固有的特征。
6.又一个要求是使来自猝灭探针(即在被聚合酶切割和未猝灭之前)的背景荧光最小化。背景荧光与pcr探针的数量成比例,并且导致每个靶标的可测量信号增益发生整体下降。因此,残余荧光的积累取决于每个荧光团猝灭的效率,并且其不仅是分子距离的函数,而且取决于荧光团-猝灭剂对的性质。
7.在本公开中讨论的荧光染料通过向常见罗丹明的基础结构中引入两种结构变化来解决这些关键问题。氧被硅或锗取代,而芳基基团被咪唑或咪唑鎓杂环交换。两种修饰的联合作用导致异常红移的罗丹明,其尺寸小于该波长范围内的典型荧光团。
8.荧光染料的水溶性是任何以水为主要溶剂的应用的先决条件,并且通常通过用带负电荷的官能团诸如羧酸盐或硫酸盐修饰发色团来实现。通过由咪唑鎓部分引入第二正电荷以及紧凑的尺寸,获得了具有极高水溶性的发色团。染料尺寸、电荷和溶解度也是荧光显微镜背景下的重要参数,对组织、细胞或细胞器渗透具有显著影响。例如,由于靶标与脂质双层的聚集或强相互作用,疏水性也可能导致有误导性的荧光信号。
9.本公开中的单阳离子染料和双阳离子染料扩展了远红光至近红外光谱范围内可
用荧光团支架的数量。荧光的热稳定性、改进的背景荧光和高水溶性使这些染料可用于多重pcr和荧光显微镜。
技术实现要素:
10.本发明涉及新颖的基于罗丹明的荧光染料以及用于合成和使用这些染料的方法。
11.在一个方面,本发明提供了式a荧光染料:
[0012][0013]
其中:
[0014]
x=si、ge或c;
[0015]
y=me、et、ipr或苯基;
[0016]
z=以下项中的任一者:
[0017][0018]
w=以下项中的任一者:
[0019][0020]
r1和r2为以下项的任意组合:
[0021]
并且
[0022]
l=h、so3h、conh2、co2h、n3或经受点击化学官能团的任何部分。
[0023]
在另一方面,本发明提供了式b荧光染料:
[0024][0025]
其中:
[0026]
x=si、ge或c;
[0027]
y=me、et、ipr或ph;
[0028]
z=以下项中的任一者:
[0029][0030]
r1和r2为以下项的任意组合:
[0031]
并且
[0032]
l=h、so3h、conh2、co2h、n3或经受点击化学官能团的任何部分。
[0033]
在一个实施例中,z=以下项中的任一者:
[0034][0035]
在另一个实施例中,
[0036][0037]
在另一方面,本发明提供了选自以下结构的荧光染料:
[0038][0039][0040]
在另一方面,本发明提供了用于制备本发明的荧光染料的方法。在本文中,用于制备荧光染料的方法可包括实例4、5、6、7或8中所述的步骤。在又一方面,本发明提供了本发明的荧光染料的用途。在一个实施例中,本发明的荧光染料的用途是通过pcr测定(特别是在多重pcr测定中)来检测样品中的一种或多种靶核酸。在另一个实施例中,在pcr测定中通过本发明的荧光染料对靶核酸的检测可在升高(例加65℃及更高)的温度下执行。在一个实施例中,本发明的荧光染料的用途是通过免疫组织化学测定来检测组织样品中的一种或多种靶蛋白。在另一个实施例中,在免疫组织化学测定对靶蛋白的检测采用由本发明的荧光染料标记的一抗或二抗。
附图说明
[0041]
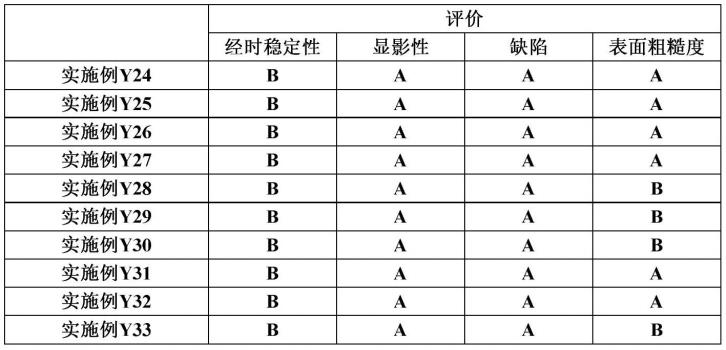
图1:上图显示了两种代表性荧光染料编号29、30和市售参比染料的荧光光谱。下图显示了同一组染料的荧光的温度依赖性。这些结果表明,带有氮杂环丁烷修饰的荧光染料显示出改善的荧光热稳定性。
[0042]
图2a:显示了使用应变促进的叠氮化物-炔烃环加成(点击化学)用荧光染料标记dna探针后的uplc色谱图。dbco与叠氮化物部分之间的反应生成三唑位置异构体,其在色谱图中分离为双峰。
[0043]
图2b:显示了从图2a中所示的uplc色谱峰中提取的dna-染料缀合物的吸收光谱。
[0044]
图3:显示了使用经染料编号36标记相比于经市售参比染料标记的dna探针的qpcr扩增生长曲线。将原始荧光信号除以总增益(rfi)。结果:染料编号36与qpcr兼容,并且与qpcr测定中的市售染料相比,表现出改善的由bhq-2所导致的猝灭。
[0045]
图4:显示了放大10倍、20倍和40倍(从左到右)的经免疫组织化学染色的扁桃体组织切片的光学显微镜图像。用confirm
tm
抗ki-67(30-9)兔单克隆一抗(igg)处理福尔马林固定石蜡包埋的组织切片,该抗体是扁桃体组织上丰富的生物标志物并且针对ki-67抗原的c端部分。ki-67是一种在增殖细胞中表达的核蛋白。对ki-67进行染色,可用于帮助评估正常组织和肿瘤组织的增殖活性。染料叠氮化物编号36(上排)和参比染料cf680r(下排)用于在200μm的浓度下进行染色。结果:正确的细胞结构被染色,无明显的背景,证明了染料编号36与免疫组织化学组织染色的相容性。
[0046]
图5:显示了用于合成根据本发明所述的荧光染料的一般反应方案。
具体实施方式
[0047]
定义
[0048]
除非另外指明,本文所用的所有科学技术术语具有如本发明所属领域的普通技术人员通常理解的相同意义。尽管基本上任何与本文描述的方法和材料相似的方法和材料都可以用于本发明的实践或测试中,但是仅描述了示例性方法和材料。出于本发明的目的,以下术语定义如下。
[0049]
除非上下文另外清楚指出,术语“一个”、“一种”、“所述”包含复数指代。
[0050]
如本文所用且除非另有说明,否则术语“烷基”是指饱和、单价、直链或支链的烃链。烷基的实例包括但不限于c1-c6烷基基团,诸如甲基、乙基、丙基、异丙基、2-甲基-1-丙基、2-甲基-2-丙基、2-甲基-1-丁基、3-甲基-1-丁基、2-甲基-3-丁基、2,2-二甲基-1-丙基、2-甲基-1-戊基、3-甲基-1-戊基、4-甲基-1-戊基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、2,2-二甲基-1-丁基、3,3-二甲基-1-丁基、2-乙基-1-丁基、丁基、异丁基、叔丁基、戊基、异戊基、新戊基和己基,以及更长的烷基基团,诸如庚基和辛基。烷基可以是未取代的或者被一个或两个合适的取代基取代。
[0051]
如本文所用且除非另有说明,否则化学符号“si”和“ge”分别是指硅和锗。此外,如本文所用,“me”是指甲基,“et”是指乙基,“ipr”是指异丙基,“ph”是指苯基。
[0052]
如本文所用且除非另有说明,否则术语-o-烷基(或烷基-o-)意指“烷氧基”,其中烷基如上文所定义。烷氧基可以未被取代或者被一个或多个合适的取代基取代。烷氧基基团的烷基链的长度可以为例如1至6个碳原子。
[0053]
如本文所用且除非另有说明,否则术语“金属”是指第i族或第ii族金属,包括但不限于li
、na
、ca
2
或mg
2
。
[0054]
如本文所用且除非另有说明,否则术语“连接基团”和“接头”可互换使用,并且是指能够将碱基与标记物共价结合,例如,形成将核苷、核苷酸或核酸与标记物连接的“连接”的可检测标记物的部分。接头的实例包括但不限于o、s或nh。任选地,连接基团或接头是共价键(即,标记物与碱基共价结合)。
[0055]
如本文所用且除非另有说明,否则术语“反荷离子”是指稳定且可合成获得的离子。反荷离子的实例包括但不限于氯离子、溴离子、碘离子、硫酸根、苯磺酸根、对甲苯磺酸根、对溴苯磺酸根、甲磺酸根、三氟甲磺酸根、磷酸根、高氯酸根、四氟硼酸根、六氟磷酸根、四苯基硼化物离子、硝酸根以及芳香族或脂肪族甲酸的阴离子。
[0056]
术语“点击化学”、“点击反应”和“点击化学反应”可互换使用,并且是指炔烃与叠氮化物之间的[3 2]环加成反应,该反应在生物样品中的缀合反应中具有显著的选择性,如rostovtsev等天angew.chem.int.ed.,2002,41,2596-2599率先所述,该文献据此全文以引用方式并入本文。尽管早期点击化学反应利用铜作为催化剂,但在核酸研究中优选无铜的点击化学反应,并且二苯并环辛炔(dbco)衍生物的使用描述于wo2009/067663中(其全文以引用方式并入本文)。试剂诸如dbco-脱氧胸苷(dbco-dt)和dbco-丝氨醇可作为用于寡核苷酸合成的亚磷酰胺从glen research(sterling,va)获得。
[0057]
根据本发明所述的化合物提供了分子,这些分子由于其光谱特性(在约650nm及更高的波长区域内具有最大吸收并且在670nm以上具有最大发射)而非常适合作为染料,特别是作为荧光染料。特别优选的是在约700nm处具有最大吸收。同时,这些分子的光谱特性可通过改变残基相对于z、w、r1和r2的同一性、数量和位置来改变。通过这种方式,可生产在高于650nm下具有几乎任何最大吸收和最大发射的荧光染料。因此,本发明的主题也是根据本发明所述的罗丹明衍生物作为荧光染料或作为激光染料的用途。
[0058]
在根据本发明所述的通式a或b化合物中,残基r1或r2中的至少一者优选地以适合偶联的活化的基团的形式或以可被活化以进行偶联的基团的形式存在。此类活化的基团特别地衍生自可被活化的羧酸或磺酸基团,并且可为例如酸酯、酸酐、酰卤化物,优选溴化物,特别是氯化物或n-羟基琥珀酰亚胺酯或ω-烷基卤化物。此外,此类活化的基团也可为例如亚磷酰胺。
[0059]
为生产包含根据本发明所述的罗丹明衍生物的缀合物,可合成例如适合于生物分子标记或标记其他分析试剂的活化的衍生物。活化的衍生物的生产需要至少一种能够被活化的基团,其中活化根据专家已知的标准方案来执行。根据后续应用不同,可引入不同的反应基团。亚磷酰胺和h-膦酸酯可例如来源于羟基基团。因此,罗丹明亚磷酰胺和h-膦酸酯的生产通常根据迄今已知的方案执行(methods in mol.biol.第20卷.“protocols for oligonucleotides and analogs,synthesis and properties”.s.agrawal hrsg.,humana press totowa,n.j.)。
[0060]
然而,n-羟基琥珀酰亚胺(nhs)酯通常来源于羧基基团、来自氨基基团的马来酰亚胺(p.y.reddy,synthesis(1998)999)或通过用相应的ω-氨基烷基马来酰亚胺延伸活化的甲酸来实现。
[0061]
nhs-酯的生产优选地根据ep0543333中所述的方法来执行,其中将游离甲酸与nhs
在缩合试剂诸如dcc或mei存在下混合。罗丹明异硫氰酸酯的生产优选地通过氨基基团与硫光气反应进行(advanced organic chemistry,mc graw hill,第2版,第383页,1997)。
[0062]
因此,本发明的主题也是根据本发明所述的罗丹明的活化的衍生物。活化的衍生物的反应基团优选地为亚磷酰胺、n-羟基琥珀酰亚胺(nhs)-酯、马来酰亚胺-烷基酰胺、h-膦酸酯或异硫氰酸酯或ω-烷基卤化物。
[0063]
本发明的另一主题是可通过结合根据本发明所述的罗丹明化合物或其活化的衍生物而获得的缀合物。因此,此类缀合物由至少两种组分组成,其中一种组分代表根据本发明所述的罗丹明衍生物。从活化的衍生物开始,根据标准方案进行缀合物的生产。待应用的适当的缀合方法为专家所知。
[0064]
一旦缀合物的第二组分可与待分析的结合配偶体结合并且可通过检测经适当的吸收波长的光激发后由构建的复合物所发射的荧光来鉴定该构建的复合物,根据本发明所述的缀合物即可用于分析目的。
[0065]
由于在近红外区域的吸收,根据本发明所述的化合物也适用于体内使用。为此,根据本发明所述的染料的水溶性衍生物及其缀合物与生物分子一起施用。通过测量荧光或吸收来进行体内测量。
[0066]
根据本发明所述的缀合物的用途特别适用于诊断分析或医学或生物材料的分析。因此,本发明的主题特别是那些能够与生物分子相互作用的缀合物。这些缀合物通常还包含一种或几种生物分子作为进一步的组分的缀合物。
[0067]
缀合物中包含的这些生物分子可为例如单链核酸或双链核酸,诸如dna、rna或三螺旋体结构或核酸类似物诸如pna、寡核苷酸以及寡核苷酸衍生物,也可以为单核苷酸、核苷酸衍生物、核苷酸类似物或核苷三磷酸。此类分子的标记发生在5
′
位(优选地通过nhs酯或亚磷酰胺进行标记),发生在3
′
位(但优选地经由染料取代的载体物质例如cpg进行标记)。其他位置的标记,诸如核酸碱基,也优选地通过nhs酯进行。
[0068]
在标记蛋白质、蛋白质复合物、抗体或氨基酸的情况下,优选地通过nhs酯、m-马来酰亚胺或异硫氰酸酯或ω-烷基卤化物执行缀合。其他缀合物组分的实例为维生素、类固醇激素、脂质分子以及半抗原。此外,还可以标记更复杂的生物结构,诸如膜部分或整个细胞。
[0069]
根据本发明所述的缀合物的一个特定实施例是与根据本发明所述的罗丹明衍生物缀合的寡核苷酸。通过这种方式标记的寡核苷酸可用于迄今已知的核酸检测和分析方法,例如通过原位杂交来实施(meyne和myzis,methods mol.biol.33.63-74,1994),或作为引物用于不同的测序方法中(sheealy等人,anal.chem.67,247-251,1995)。
[0070]
除核酸的化学标记以外,分别用根据本发明所述的罗丹明染料标记的核糖核苷三磷酸和脱氧核糖核苷三磷酸还可通过不同的酶促反应作为聚合酶的底物插入核酸中。对于dna,这通过dna聚合酶实现,例如通过应用切口平移方法(rigby等人,j.mol.biol.113,第237页,1977)或通过“随机引物标记”(feinberg和vogelstein.anal.biochem.137,第266页,1984)来实现。在rna的情况下,这例如用t3、t7或sp6 rna聚合酶通过借助于来实现。通过使用末端转移酶的所谓3
′‑
尾化反应,可以实现另一种核酸标记方法。
[0071]
因此,本发明的另一个主题也是根据本发明所述的缀合物用于通过化学或酶促方法标记核酸的用途以及根据本发明所述的标记的杂交探针用于检测和分析核酸的用途。
[0072]
对于分析测定,首先用适当波长的光例如激光、激光二极管或led激发根据本发明
所述的罗丹明衍生物。根据分析物不同,荧光检测借助于专家已知的测量方法来执行。这些方法为例如用于原位方法的荧光显微镜或通过适当的光电二极管对发射的辐射进行检测。
[0073]
因此,本发明的另一个主题也是根据染料缀合物用于石蜡组织切片的免疫组织化学染色的用途。免疫组织化学允许经由依次应用与抗原结合的特异性抗体(一抗)、与一抗结合的二抗(连接抗体)、酶复合物和显色底物与插置洗涤步骤来实现抗原的可视化。生色团的酶促活化导致在抗原位点处产生可见的反应产物。
[0074]
除使用合适波长的辐射能量直接激发根据本发明所述的染料之外,激发还可通过所谓的荧光共振能量转移(也称为共振能量转移)来实现。利用该原理,第二荧光染料被适当波长的光激发。由于两种染料的局部接近,随后发生向根据本发明所述的罗丹明衍生物的非辐射能量转移(van der meer等天,resonance energy transfer,vch,1994)。检测该分子在一定波长下发射的光可优选地用于分析物的定量测定。因此,本发明的一个主题也是根据本发明所述的罗丹明衍生物或相应的缀合物作为荧光共振能量转移系统的组分的用途。
[0075]
根据本发明所述的化合物用作共振能量供体或受体。根据本发明所述的所有化合物的优选的共振能量供体为适用于光谱分析的荧光染料缀合物。因此,本发明的一个主题也是根据本发明所述的罗丹明衍生物或相应的缀合物与合适的荧光共振供体缀合物一起作为荧光共振能量转移系统中的荧光共振能量受体的用途。
[0076]
对于核酸的定量检测,用荧光染料标记的杂交探针诸如寡核苷酸是合适的,其可通过荧光共振电子转移(fret)的原理进行检测。在寡核苷酸的情况下,末端位置5
′
可例如用fret系统的一种染料组分标记,而3
′
端位置可用fret系统的剩余染料组分标记。在这种情况下,寡核苷酸也可以在序列内进行标记。
[0077]
在一个特别的实施例中,在核酸扩增期间使用此类用两种染料标记的寡核苷酸来检测所得产物,其中确定荧光共振能量供体的发射。如果寡核苷酸未与靶标结合,则由于非辐射能量转移,无法测量供体荧光。但是,如果寡核苷酸与靶dna结合,则两种染料组分由于所用的dna聚合酶的外切核酸酶活性而局部分离,使得fret供体的特定荧光程度变得可测量(美国专利号5,210,015)。
[0078]
在其他优选的实施例中,不同染料位于两种不同的杂交探针上,这些杂交探针可在与靶核酸的局部邻近区域内杂交。这些探针可为例如与靶核酸的同一链杂交的两个寡核苷酸探针,其中一种染料位于第一探针的3
′
端核苷酸处,而另一种染料位于第二探针的5
′
端核苷酸处,使得两者之间的距离仅由少量核苷酸(即在0与30之间的数字)组成。当使用与根据本发明所述的罗丹明衍生物组合的荧光素时,0至15个、特别是1至5个核苷酸的距离并且在许多情况下仅一个核苷酸的距离已被证明是有利的。如果染料组分之间的核苷酸距离保持不变,则探针在末端不与染料缀合,但在内部也可以使用。在双链靶核酸的情况下,也可以使用与靶标的不同链结合的探针,只要两种染料组分之间存在0至30个核苷酸的特定核苷酸距离即可。
[0079]
因此,本发明的另一个主题是由寡核苷酸和根据本发明所述的罗丹明衍生物组成的根据本发明所述的缀合物用于分析核酸的用途,其中使用由第二寡核苷酸和另外的合适的荧光染料组成的另外的缀合物,并且其中在激发优选与第二寡核苷酸偶联的染料后,可发生荧光共振能量转移。寡核苷酸组合在下文中称为“fret对”并且如此标记。
[0080]
已证明,在聚合酶链反应期间或之后使用此类fret对检测扩增产物是特别有利的。因此,本发明的另一个主题是根据本发明所述的缀合物作为fret对的组分用于检测核酸扩增反应的反应产物的用途。在特别的检测程序中,两种扩增引物中的一者可同时用两种染料中的一者进行标记,从而提供fret的两种组分中的一者。
[0081]
使用合适的fret对来检测扩增产物,允许对pcr反应进行所谓的“实时监测”,根据引发的反应循环次数确定生成扩增产物所需的数据。这通常通过以下事实实现:由于扩增引物所需的退火期间的反应和温度条件,fret对的寡核苷酸也与靶核酸杂交,并且在适当的激发下发射可测量的荧光信号。利用获得的数据,可通过定量分析确定最初施加的靶核酸的量。因此,这些实施例对于定量分析生物样品的rna浓度的定量rt-pcr实验而言特别重要。因此,本发明的一个主题也是根据本发明所述的缀合物作为fret对的组分用于检测核酸扩增反应的反应产物的用途,其中在每个循环中检测反应产物。此外,本发明的一个主题是根据本发明所述的缀合物作为fret对的组分用于对待扩增的核酸进行定量测定的用途。
[0082]
在不同的实施例中,在fret对与待检测的靶核酸杂交后,在融合曲线分析过程中随着温度持续升高,在扩增反应完成后进行扩增产物的检测。同时,测定取决于温度的所发射的荧光。这使得能够检测由于特定的错配而与所使用的fret对不太严格地杂交的序列。通过这种方式确定的融合点可用于检测点突变或其他多态性。因此,本发明的一个主题也是根据本发明所述的缀合物作为fret对的组分用于确定融合曲线(特别是在鉴定多态性和点突变期间)的用途。
[0083]
此类荧光共振能量转移过程通常可用于确定分子-分子相互作用,诸如例如蛋白质-蛋白质相互作用或抗原-抗体反应。当反应在同质条件下进行时,获得了特定的优势。
[0084]
作为反荷离子,可使用适合于电荷中和并且根据ph与本发明的阴离子基本结构相容的各种阳离子。
[0085]
优选地以合成产物包含适合于活化的基团的方式选择起始化合物。此类基团根据已知方法被活化,以获得适合于随后与生物活性分子的反应基团偶联以构建生物分子-染料缀合物的基团。在活化的基团与生物活性分子之间,可插入接头。
[0086]
接头用于改变根据本发明所述的染料与生物分子之间的距离。出于延伸的原因,可将例如氯基己酸插入甲酸中。这也可能涉及官能团的改变,例如通过甲酸与马来酰亚胺烷基胺的反应来实现。此外,接头电荷可影响染料的溶解度。带有电荷载流子的氨基酸诸如赖氨酸或谷氨酸特别适合于该效应。
[0087]
借助根据本发明所述的化合物,提供了新型化合物,其由于光谱特性(在高于650nm下的最大吸收),非常适合作为适合偶联的吸收染料,特别是作为用于半抗原、抗体、蛋白质缀合污物中的荧光染料,并且非常适合于多核苷酸标记和胶乳(latice)染色(荧光胶乳)。
[0088]
如果根据本发明所述的罗丹明衍生物染料可溶于与水不混溶的有机溶剂中并且可通过溶胀程序插入胶乳中,则它们尤其适合插入胶乳中。直径为约50nm至最多若干μm的此类荧光胶乳可借助于不同的涂覆方法来加载,例加用蛋白质、半抗原或核酸加载。
[0089]
用根据本发明所述的至少一种染料对混合物进行染色,使得可以发生共振能量转移。
[0090]
荧光染料与半抗原(诸如例如茶碱、地高辛、t3、t4)或蛋白质(诸如抗体)的缀合物
例如适用于诊断系统,特别是用于荧光免疫测定、荧光偏振免疫测定。
[0091]
本发明的另一个主题是一种测定第一免疫可连接物质的程序,其中根据本发明所述化合物的缀合物与第二(免疫)可连接物质一起使用,该第二(免疫)可连接物质与第一物质可相似或不同,并且确定由对第一物质具有特异性的(免疫学)结合反应所引起的根据本发明所述的化合物的吸收变化、荧光变化或荧光-偏振变化,作为样品中待分析且包含的物质的含量的指标。
[0092]
本发明的另一个主题是根据本发明所述的缀合物在免疫测定中的用途。
[0093]
如本文所用,“生物相容”的物质如所用是无毒的,并且对生物分子没有实质性有害作用。
[0094]
如本文所用且除非另有说明,否则术语“核碱基”是指腺嘌呤、胞嘧啶、鸟嘌呤、胸腺嘧啶或尿嘧啶。
[0095]
如本文所用且除非另有说明,否则术语“核碱基类似物”是指能够与互补核碱基或核碱基类似物形成watson-crick氢键的取代或未取代的含氮母体杂芳族环。优选地,核碱基类似物是嘌呤、脱氮嘌呤或嘧啶。示例性核碱基类似物包括但不限于,7-脱氮杂腺嘌呤、肌苷、水粉蕈素(nebularine)、硝基吡咯、硝基吲哚、2-氨基嘌呤、2,6-二氨基嘌呤、次黄嘌呤、假尿苷、5-丙炔基胞苷、异胞苷、异鸟嘌呤、7-脱氮鸟嘌呤、2-硫代嘧啶、6-硫鸟嘌呤、4-硫胸腺嘧啶、4-硫尿嘧啶、o
6-甲基鸟嘌呤、n
6-甲基腺嘌呤、o
4-甲基胸腺嘧啶、5,6-二氢胸腺嘧啶、5,6-二氢尿嘧啶、4-甲基吲哚、乙炔腺嘌呤等。其他示例性核碱基类似物可以见于fasman,1989,practical handbook of biochemistry and molecular biology,第385-394页,crc press,boca raton,fl,以及其中引用的参考文献,它们以引用方式并入本文。
[0096]
如本文所用且除非另有说明,否则术语“核苷”是指由与取代或未取代的核糖的c1′
碳共价连接的核碱基组成的化合物。典型的取代核糖包括但不限于,其中一个或多个碳原子,优选为一个,最优选为3
′
碳原子,被一个或多个相同或不同的-r、-or、-nrr或卤素基团取代的那些,其中r各自独立地为-h、(c
1-c6)烷基或(c
5-c
14
)芳基。特别优选的核糖(ribose sugar)是核糖(ribose)、2
′‑
脱氧核糖、2
′
,3
′‑
脱氧核糖、3
′‑
卤代核糖、3
′‑
氟核糖、3
′‑
氯核糖、3
′‑
烷基核糖等。当核碱基为a或g时,核糖附着在核碱基的n9位置。当核碱基为c、t或u时,戊糖附着在核碱基的n1位置(见,例加,kornberg and baker,1992,dna replication,第2版,freeman,san francisco)。
[0097]
如本文所用且除非另有说明,否则术语“核苷类似物”是指其中核碱基、核糖或两者被其各自的类似物替代的核苷。示例性核碱基类似物是先前定义的那些。示例性核糖类似物包括但不限于,具有多于或少于五个环原子的取代或未取代的呋喃糖(例如,赤藓糖和己糖)以及取代或未取代的3-6个碳无环糖。典型的取代的呋喃糖和无环糖是其中碳原子中的一者或多者被相同或不同的-r、-or、nrr或卤素基团中的一者或多者取代的那些,其中每个r独立为h、(c
1-c6)烷基或(c
5-c
14
)芳基。
[0098]
如本文所用且除非另有说明,否则术语“核苷酸”是指其中一个或多个(通常一个)核糖碳被具有下式的磷酸酯取代的核苷:
[0099][0100]
其中a是0至4之间的整数。优选地,a是2并且磷酸酯附着至核糖的3
′
碳或5
′
碳,例加,核糖3
′‑
三磷酸、2
′‑
脱氧核糖3
′‑
三磷酸、核糖5
′‑
三磷酸、2
′‑
脱氧核糖5
′‑
三磷酸、3
′‑
卤核糖5
′‑
三磷酸、3
′‑
烷基核糖5
′‑
三磷酸、2
′
,3
′‑
二脱氧核糖5
′‑
三磷酸等。
[0101]
如本文所用且除非另有说明,否则术语“核苷酸衍生物”是指其中核苷酸、核糖和/或一种或多种磷酸酯被其各自的类似物取代的核苷酸。示例性核碱基和核糖类似物是先前描述的与核苷类似物缀合的那些。示例性磷酸酯类似物包括但不限于烷基膦酸酯、甲基膦酸酯、氨基磷酸酯、磷酸三酯、硫代磷酸酯、二硫代磷酸酯、磷酸亚油酸酯、磷酸二硒代酸酯、磷代苯氨基硫代酸酯、磷代苯胺酸酯、磷代氨基甲酸酯、硼酸代磷酸酯、肽核酸(pna)单体等,包括任何缔合的反荷剂(如存在)。
[0102]
如本文所用且除非另有说明,否则术语“保护基”意指可逆地附着至羟基或胺部分的基团,其使得羟基或胺部分在随后的反应中不反应,并且一旦达到保护目的,就可以将其选择性地裂解以再生羟基或胺部分。保护基的实例可见于greene,t.w.,protective groups in organic synthesis,第3版(1999),其以引用方式并入本文。在一个实施例中,保护基在碱性反应培养基中具有稳定性,但是可以被酸裂解。适用于本发明的碱稳定的、酸不稳定的保护基的实例包括但不限于,醚类,诸如甲基、甲氧基甲基、甲硫基甲基、甲氧基乙氧基甲基、双(2氯乙氧基)甲基、四氢吡喃基、四氢噻喃基、四氢呋喃基、四氢硫呋喃基、1-乙氧基乙基、1-甲基-1-甲氧基乙基、叔丁基、烯丙基、苄基、邻硝基苄基、三苯甲基、α-萘基二苯甲基、对甲氧基苯基-二苯甲基、9-(9-苯基-10-氧代)蒽基、三甲基甲硅烷基、异丙基二甲基甲硅烷基、叔丁基二甲基甲硅烷基、叔丁基二苯基甲硅烷基、三苄基甲硅烷基和三异丙基甲硅烷基;和酯类,诸如新戊酸酯、金刚烷酸酯和2,4,6-三甲基苯甲酸酯。
[0103]
如本文所用且除非另有说明,否则术语“盐”包括但不限于可存在于本发明的化合物中的酸性或碱性基团的盐。本质上呈碱性的化合物能够与各种无机酸和有机酸形成多种盐。可用于制备此类碱性化合物的可接受的酸加成盐的酸为形成无毒酸加成盐的那些酸,即包含药用阴离子的盐,包括但不限于硫酸、柠檬酸、马来酸、乙酸、草酸、盐酸盐、氢溴酸盐、氢碘酸盐、硝酸盐、硫酸盐、硫酸氢盐、磷酸盐、酸性磷酸盐、异烟酸盐、乙酸盐、乳酸、水杨酸盐、柠檬酸盐、酸性柠檬酸盐、酒石酸盐、油酸盐、单宁酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡萄糖酸盐、葡糖醛酸盐、蔗糖盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和双羟萘酸盐(即,1,1
′‑
亚甲基-双-(2-羟基-3-萘甲酸盐))。除上述酸以外,包括氨基部分的本发明的化合物也可以与各种氨基酸形成可接受的盐。本质上呈酸性的本发明的化合物能够与各种药用阳离子形成碱盐。此类盐的实例包括碱金属盐或碱土金属盐,并且特别是钙盐、镁盐、钠盐、锂盐、锌盐、钾盐和铁盐。
[0104]
如本文所用且除非另有说明,否则术语“溶剂化物”意指本发明的化合物或其盐,其进一步包括由非共价分子间力结合的化学计量比或非化学计量比的溶剂。优选的溶剂为挥发性的且无毒的。术语“溶剂化物”包括水合物。“水合物”意指本发明的化合物或其盐,其
进一步包括由非共价分子间力结合的化学计量比或非化学计量比的水。
[0105]
如本文所用且除非另有说明,否则术语“核苷或核苷酸”是指核苷和/或核苷酸和/或其混合物。
[0106]
术语“核苷类似物”是指其中核碱基、核糖或两者被其各自的类似物替代的核苷。示例性核碱基类似物是先前定义的那些。示例性核糖类似物包括但不限于,具有多于或少于五个环原子的取代或未取代的呋喃糖(例如,赤藓糖和己糖)以及取代或未取代的3-6个碳无环糖。典型的取代的呋喃糖和无环糖是其中碳原子中的一者或多者被相同或不同的-r、-or、nrr或卤素基团中的一者或多者取代的那些,其中每个r独立为h、c
1-c6烷基或c
5-c
14
芳基。
[0107]
如本文所用且除非另有说明,否则术语“核苷酸类似物”是指其中核苷酸、核糖和/或一种或多种磷酸酯被其各自的类似物取代的核苷酸。示例性核碱基和核糖类似物是先前描述的与核苷类似物缀合的那些。示例性磷酸酯类似物包括但不限于烷基膦酸酯、甲基膦酸酯、氨基磷酸酯、磷酸三酯、硫代磷酸酯、二硫代磷酸酯、磷酸亚油酸酯、磷酸二硒代酸酯、磷代苯氨基硫代酸酯、磷代苯胺酸酯、磷代氨基甲酸酯、硼酸代磷酸酯、肽核酸(pna)单体等,包括任何缔合的反荷剂(如存在)。
[0108]
如本文所用且除非另有说明,否则术语“核酸”是指核苷单体单元的线性聚合物链,其通过磷酸酯核苷酸间键彼此共价连接。除非另有说明,否则本文所用的“核酸”包括任何长度的聚合物,包括寡核苷酸、核酸和本领域中通常使用的术语的核酸。因此,根据本发明的核酸的大小范围可以从几个单体单元(例如,4至40个),至数百个单体单元,至数千个单体单元,或甚至更多个单体单元。此类核酸还可在本文中以其功能进行描述,诸如引物或探针。每当核酸由字母序列例如“atgcctg”表示时,应理解该序列以5
′→3′
方向呈现。除非另有说明,否则本文描述的序列的核酸是2
′‑
脱氧核糖核酸。
[0109]
如本文所用且除非另有说明,否则术语“核酸类似物”是指其中至少一个核苷单体单元是“核苷类似物”和/或至少一个磷酸酯核苷酸间键是磷酸酯类似物的核酸,如上文“核苷酸类似物”中所定义。核酸类似物的优选类别是其中糖和核苷酸间键被不带电荷的中性酰胺取代的那些,诸如氨基甲酸吗啉代和肽核酸(“pna”)。优选的pna是具有n-(2-氨基乙基)甘氨酸酰胺主链的那些(参见,例如,nielsen等人,1991,science 254:1497-1500)。
[0110]
如本文所用且除非另有说明,否则术语“标记物”是指可检测的分子或原子,其共价或非共价附着至核苷或核苷酸、核苷或核苷酸类似物、核酸、核酸类似物或终止子。在一个实施例中,核苷或核苷酸、核苷或核苷酸类似物、核酸、核酸类似物或终止子具有共价附着至核碱基的可检测标记物。术语“标记物”还可以指调节另一种可检测标记物(诸如猝灭剂)的检测的分子。如本文所用,术语“可检测的标记物”旨在不仅包括“直接”检测到的分子或标记物(例如,生色团或荧光团),还包括“间接”检测到的部分(例如,生物素),其通过与第二、第三或更高级的结合配偶体(例如,亲和素或链霉亲和素)结合,其中一个带有“直接”标记物。
[0111]
标记物的其他实例包括荧光化合物,当暴露于适当波长的光时,该荧光化合物由于荧光而变得可检测,并通过显微镜或荧光法检测和/或测量。常用的荧光标记化合物包括异硫氰酸荧光素、罗丹明、藻红蛋白、藻蓝蛋白、别藻蓝蛋白、γ-苯甲醛和荧光胺。可检测的标记物可以是发射荧光的金属,诸如
152
eu,或可以使用金属螯合基团,诸如二亚乙基三胺五
乙酸或乙二胺四乙酸,附着至寡核苷酸的镧系元素的其他金属。
[0112]
标记物可以是化学发光化合物,其存在通过测量在化学反应过程中产生的发光进行检测。有用的化学发光标记化合物的实例是鲁米诺、异鲁米诺、热吖啶翁酯(theromatic acridinium ester)、咪唑、吖啶翁盐和草酸酯。同样,生物发光化合物可用于标记寡核苷酸,并通过测量发光进行检测。在这种情况下,催化蛋白增加化学发光反应的效率。可用的生物发光标记化合物的实例包括荧光素、荧光素酶和水母发光蛋白。
[0113]
如本文所用且除非另有说明,否则术语“报告染料”是指当暴露于光时以荧光形式发射能量的化合物。“报告染料的生色团”是报告染料的原子的网络,当其暴露于光时,其发射的辐射水平可通过常规光谱学手段检测到。
[0114]
如本文所用且除非另有说明,否则术语“非荧光的”是指当暴露于辐射时不以常规光谱学手段可检测的水平发射辐射的化合物。
[0115]
如本文所用且除非另有说明,术语“弱荧光”是指当暴露于辐射时以常规光谱学手段可检测的低水平发射辐射的化合物。
[0116]
如本文所用且除非另有说明,否则术语“光”是指具有使报告染料发出荧光的波长的电磁能,其中该波长可以在190-800nm的范围内。
[0117]
如本文所用且除非另有说明,否则术语“特异性”是指反应中使用的核酸,诸如杂交反应中使用的探针、pcr中使用的引物或组合物中存在的核酸,在正常检测环境中,仅与预期靶标杂交而不与检测样品中的其他核酸分子杂交。
[0118]
如本文所用且除非另有说明,否则术语“选择性”是指反应中使用的核酸,诸如杂交反应中使用的探针、pcr中使用的引物或药物制剂中存在的核酸,与正常检测环境中与检测样品中其他核酸的杂交相比,与目标靶标杂交的频率更高、更快或更持久。
[0119]
如本文所用,术语“在严格条件下杂交”描述了杂交和洗涤的条件,在该条件下,彼此具有至少60%(65%、70%或75%或更高)相同的核苷酸序列通常保持彼此杂交。严格条件取决于核酸的性质(例如,长度、gc含量等)和方法本身(杂交、扩增等)。此类方法是本领域熟知的,可见current protocols in molecular biology,john wiley&sons,n.y.(1989),6.3.1-6.3.6。在一个实施例中,严格的杂交条件是在约45℃下,在6x氯化钠/柠檬酸钠(ssc)中杂交,然后在约68℃下,在0.1xssc,0.2%sds中洗涤一或多次。在另一实施例中,严格的杂交条件是在约45℃下,在6x ssc中杂交,然后在50-65℃下,在0.2x ssc,0.1%sds中洗涤一次或多次(即,在50℃、55℃、60℃或65℃下洗涤一次或多次)。应当理解,本发明的核酸不包括在这些条件下仅与仅由a或t核苷酸组成的核苷酸序列杂交的核酸分子。例如,可以在以下条件下在聚合酶链反应(pcr)中将约15-40个碱基的寡核苷酸与互补序列进行严格杂交:盐浓度为50mm kcl,缓冲液浓度为10mm tris hcl,mg
2
浓度为1.5mm,ph为7-7.5,退火温度为55-60℃。聚合酶链反应(pcr)中约15-40个碱基的寡核苷酸与互补序列的中等严格杂交可以在以下条件下进行:盐浓度为50mm kcl,缓冲液浓度为10mm tris hcl,mg
2
浓度为1.5mm,ph为7-7.5,退火温度为48-54℃。聚合酶链反应(pcr)中约15-40个碱基的寡核苷酸与互补序列的低严格杂交可以在以下条件下进行:盐浓度为50mm kcl,缓冲液浓度为10mm tris
·
hcl,mg
2
浓度为1.5mm,ph为7-7.5,退火温度为37-47℃。
[0120]
如本文所用且除非另有说明,否则术语“立体异构纯的”是指包括化合物的一种立体异构体并且基本上不含该化合物的其他立体异构体的组合物。例如,具有一个手性中心
的化合物的立体异构纯组合物将基本上不含该化合物的相反对映体。具有两个手性中心的化合物的立体异构纯组合物将基本上不含该化合物的其他非对映异构体。典型的立体异构纯化合物包括大于约80重量%的化合物的立体异构体和小于约20重量%的化合物的其他立体异构体,更优选大于约90重量%的化合物的一种立体异构体和小于约10重量%的化合物的其他立体异构体,甚至更优选大于约95重量%的化合物的一种立体异构体和小于约5重量%的化合物的其他立体异构体,最优选大于约97重量%的化合物的一种立体异构体和小于约3重量%的化合物的其他立体异构体。
[0121]
如本文所用且除非另有说明,否则术语“基本上不含”是指包含一种化合物并且不含可检测的或大量的其他化合物的组合物。典型的基本上不含的组合物包含大于约80重量%的目标化合物和小于约20重量%的一种或多种其他化合物,更优选大于约90重量%的目标化合物和小于约10重量%的一种或多种其他化合物,甚至更优选大于约95重量%的目标化合物和小于约5重量%的一种或多种其他化合物,最优选大于约97重量%的目标化合物和少于约3重量%的一种或多种其他化合物。
[0122]
核酸扩增的方法是聚合酶链反应(pcr),其公开于美国专利号4,683,202、4,683,195、4,800,159和4,965,188以及其他参考文献。pcr通常采用两个或更多个寡核苷酸引物,其与所选核酸模板(例如dna或rna)结合。用于核酸分析的引物包括能够充当在靶核酸的核酸序列内的核酸合成起始点的寡核苷酸。引物可通过常规方法从限制性消化物中纯化,或其可合成产生。为了扩增中的最大效率,引物可以是单链的,但引物可以是双链的。首先将双链引物变性(即处理)以分离链。一种使双链核酸变性的方法是通过加热。“热稳定的聚合酶”是热稳定的聚合酶,即其为催化与模板互补的引物延伸产物的形成并且当处于升高的温度经受实现双链模板核酸变性所需的时间时没有不可逆地变性的酶。一般来讲,合成在每个引物的3
′
端起始,并且沿着模板链在5
′
至3
′
方向上进行。已从例如黄栖热菌(thermus flavus)、红栖热菌(t.ruber)、嗜热栖热菌(t.thermophilus)、水生栖热菌(t.aquaticus)、乳栖热菌(t.lacteus)、红色栖热菌(t.rubens)、嗜热脂肪芽胞杆菌(bacillus stearothermophilus)和炽热甲烷嗜热菌(methanothermus fervidus)分离出热稳定的聚合酶。然而,非热稳定的聚合酶也可用于pcr测定中,条件是补充该酶。
[0123]
如果模板核酸是双链的,则必须在其可用作pcr中的模板前分离两条链。链分离可通过任何合适的变性方法完成,包括物理、化学或酶促方式。分离核酸链的一种方法涉及加热核酸直至它多数变性(例如,大于50%、60%、70%、80%、90%或95%变性)。用于使模板核酸变性必需的加热条件将取决于例如缓冲液盐浓度以及变性核酸的长度和核苷酸组成,但通常范围在约90℃至约105℃,持续取决于反应特征(诸如温度和核酸长度)的一段时间。变性通常进行约5秒至9分钟。为了不使相应的聚合酶(例如,z05 dna聚合酶)暴露于此类高温太长时间并因此处于损失功能性酶的风险,可以优选使用短的变性步骤。
[0124]
如果双链模板核酸通过加热变性,则允许反应混合物冷却至促进每个引物退火至其在靶核酸上的靶标序列的温度。
[0125]
用于退火的温度可以是约35℃至约70℃,或约45℃至约65℃;或约50℃至约60℃,或约55℃至约58℃。退火时间可以是约10秒至约1分钟(例如,约20秒至约50秒;约30秒至约40秒)。在此上下文中,使用不同的退火温度以增加相应测定的包容性可以是有利的。简而言之,这意味着在相对低的退火温度下,引物也可以结合具有单一错配的靶标,因此也可以
扩增某些序列的变体。如果例如某种生物体具有已知或未知的遗传变体(其也应当检测),则这也是合乎需要的。另一方面,相对高的退火温度具有提供更高特异性的优点,因为朝向更高的温度,引物结合不完全匹配的靶序列的概率连续降低。为了受益于两种现象,在本发明的一些实施例中,上述方法包括在不同温度下退火,例如首先在较低温度下退火,然后在较高温度下退火。如果例如第一孵育在55℃下进行约5个循环,则可以(预)扩增非精确匹配的靶序列。这可以随后例如在58℃下进行约45个循环,在整个实验的主要部分提供更高的特异性。这样,不丢失潜在重要的遗传变体,而保持相对高的特异性。
[0126]
然后将反应混合物调整至聚合酶的活性得到促进或最佳化的温度,即足以使延伸从退火引物发生,以生成与待分析的核酸互补的产物的温度。温度应足以从退火至核酸模板的每个引物合成延伸产物,但不应如此高,以使延伸产物变性脱离其互补模板(例如用于延伸的温度通常范围为约40℃至80℃(例如约50℃至约70℃;约65℃))。延伸时间可以是约10秒至约5分钟,或约15秒至2分钟,或约20秒至约1分钟,或约25秒至约35秒。新近合成的链形成可以在反应的以后步骤中使用的双链分子。链分离、退火和延长步骤可以根据需要重复多次,以产生所需数量的对应于靶核酸的扩增产物。反应中的限制因素是反应中存在的引物、热稳定酶和三磷酸核苷的量。循环步骤(即变性、退火和延伸)可以重复至少一次。对于在检测中的使用,循环步骤数目将取决于例如样品的性质。如果样品是核酸的复杂混合物,则将需要更多的循环步骤来扩增足以进行检测的靶序列。通常,重复循环步骤至少约20次,但可重复多达40、60次或甚至100次。
[0127]
可以实施pcr,其中退火和延伸的步骤在同一步骤中进行(一步pcr),或者如上所述,在分开的步骤中进行(两步pcr)。一起进行退火和延伸,且因此在相同的物理和化学条件下进行退火和延伸,用合适的酶(诸如例如z05 dna聚合酶),具有节省每个循环中额外步骤的时间并且还消除退火与延伸之间的额外温度调节的需求的优点。因此,一步pcr降低相应测定的总体复杂性。
[0128]
通常,总体扩增的较短时间可以是优选的,因为至结果的时间减少并且导致可能的较早诊断。
[0129]
待使用的其他核酸扩增方法包括连接酶链反应(lcr;wu d.y.和wallace r.b.,genomics 4(1989)560-69;以及barany f.,proc.natl.acad.sci.usa 88(1991)189-193);聚合酶连接酶链反应(barany f.,pcr methods and applic.1(1991)5-16);gap-lcr(wo 90/01069);修复链式反应(ep 0439182 a2),3sr(kwoh d.y.等人,proc.natl.acad.sci.usa 86(1989)1173-1177;guatelli j.c.等人,proc.natl.acad.sci.usa 87(1990)1874-1878;wo 92/08808),和nasba (us 5,130,238)。此外,还有链置换扩增(sda)、转录介导的扩增(tma)和qb-扩增(综述参见,例如,whelen a.c.and persing d.h.,annu.rev.microbiol.50(1996)349-373;abramson r.d.和myers t.w.,curr.opin.biotechnol.4(1993)41-47)。
[0130]
术语“cp值”、“ct值”、“ct”或“交叉点”值是指允许对输入的目标核酸进行定量的值。可以根据二阶导数最大法(the second-derivative maximum method)确定cp或ct值(van luu-the等人,“improved real-time rt-pcr method for high-throughput measurements using second derivative calculation and double correction”,biotechniques,第38卷,第2期,2005年2月,第287-293页)。在二阶导数法中,cp/ct对应二
阶导数曲线的第一峰。此峰对应对数线性相的开始。二阶导数法计算实时荧光强度曲线的二阶导数值,且仅获得一个值。初始cp/ct方法基于强度值的局部定义的可微分的近似值,例如,通过多项式函数。然后计算三阶导数。cp/ct值是三阶导数的最小的根。也可以使用拟合点法确定cp/ct,其中通过在对数线性区域中平行线与阈值线的交叉确定cp/ct(van luu-the等人,biotechniques,第38卷,第2期,2005年2月,第287-293页)。roche提供的lightcycler仪器通过根据二阶导数最大法计算而提供cp/ct值。
[0131]
术语“pcr效率”是指循环至循环扩增效率的指标。使用以下方程式计算每种条件的pcr效率:pcr效率%=(10
(-斜率)-1)
×
100,其中通过y轴上绘制的对数拷贝数和x轴上绘制的cp的线性回归而计算斜率。可以使用完全匹配或错配的引物模板测量pcr效率。
[0132]
术语“fret”或“荧光共振能量转移”或“共振能量转移”是指至少两个发色团,供体发色团和受体发色团(被称为猝灭剂)之间的能量转移。当供体被合适波长的光辐射激发时,供体通常将能量转移到受体。受体通常以不同波长的光辐射形式重新发射转移的能量。当受体是“黑暗”猝灭剂时,它以除光以外的形式耗散转移的能量。特定的荧光团充当供体还是受体起作用取决于fret对的其他成员的特性。常用的供体-受体对包括fam-tamra对。常用的猝灭剂是dabcyl和tamra。常用的黑暗猝灭剂包括blackhole quenchers
tm
(bhq)(biosearch technologies,inc.,novato,cal.)、iowa black
tm
(integrated dna tech.,inc.,coralville,iowa)和blackberry
tm quencher 650(bbq-650)(berry&assoc.,dexter,mich.)。
[0133]
上文所述的方法可以基于供体荧光部分与受体荧光部分之间的荧光共振能量转移(fret)。代表性的供体荧光部分是荧光素,且代表性的对应的受体荧光部分包括lc-red 640、lc-red 705、cy5和cy5.5。通常,检测包括在由供体荧光部分吸收的波长处激发样品并且显现和/或测量由对应的受体荧光部分发射的波长。在根据本发明的方法中,检测之后可以定量fret。例如,在每个循环步骤之后进行检测。例如,实时进行检测。通过使用商购可得的实时pcr仪器(例如,lightcycler
tm
或),可以以显著减少的循环时间在单个封闭的小杯中组合pcr扩增和扩增产物的检测。由于检测与扩增同时发生,所以实时pcr方法消除了操作扩增产物的需要,并且减少了扩增产物之间交叉污染的风险。实时pcr大大减少周转时间并且是临床实验室中常规pcr技术的有吸引力的替代方案。
[0134]
以下专利申请描述了如技术中使用的实时pcr:wo 97/46707、wo 97/46714和wo 97/46712。仪器是一种与利用高质量光学器件的微体积荧光计组合的快速热循环仪。此快速热循环技术使用薄玻璃小杯作为反应容器。通过交替加热的和环境的空气来控制反应室的加热和冷却。由于空气的低质量和小杯的高表面积与体积比率,可以在热室内实现非常快速的温度交换速率。
[0135]
技术利用由两个荧光部分标记的单链杂交探针。当第一荧光部分用合适波长的光激发时,吸收的能量根据fret原理转移至第二荧光部分。第二荧光部分通常是猝灭剂分子。以此形式使用的典型荧光染料例如尤其是fam、hex、cy5、ja270、cyan和cy5.5。在pcr反应的退火步骤期间,标记的杂交探针与靶核酸(即扩增产物)结合,并且在后续延长期过程中,通过taq或如技术人员已知的另一合适的聚合酶(诸如突变z05聚合酶)的5
′
至3
′
外切核酸酶活性来降解。因此,激发的荧光部分和猝灭剂部分变得彼此空间上分离。因此,在不存在猝灭剂的情况下激发第一荧光部分后,可检测到来自第一荧光部分的荧光发射。
[0136]
在上述两种检测形式中,发射的信号的强度可以与原始的靶核酸分子的数量相关。
[0137]
最近,在美国专利公开号2018/0073056和美国专利公开号2018/0073064中描述了使用“加标签的”探针进行多重pcr测定的方法,这两件专利全文均以引用方式并入本文。
[0138]
作为fret的替换物,使用双链dna结合染料诸如荧光dna结合染料(例如,sybrgreen或(molecular probes)),可以检测扩增产物。在与双链核酸相互作用时,此类荧光dna结合染料在用合适波长的光激发后发射荧光信号。还可使用双链dna结合染料,诸如核酸嵌入染料。当使用双链dna结合染料时,通常进行解链曲线分析以证实扩增产物的存在。
[0139]
也可以使用与fret缀合的分子信标来检测使用本公开内容的实时pcr方法的扩增产物的存在。分子信标技术使用用第一荧光部分和第二荧光部分标记的杂交探针。第二荧光部分一般是猝灭剂,并且荧光标记通常位于探针的每个端部。分子信标技术使用具有允许二级结构形成(例如发夹)的序列的探针寡核苷酸。作为在探针内形成二级结构的结果,当探针在溶液中时,两个荧光部分空间接近。在与扩增产物杂交以后,探针的二级结构被破坏,并且荧光部分变得彼此分离,从而使得在用合适波长的光激发后,可以检测第一荧光部分的发射。
[0140]
因而,根据本发明的方法是上述使用fret的方法,其中所述探针包含允许二级结构形成的核酸序列,其中所述二级结构形成导致所述第一荧光部分与第二荧光部分之间的空间接近。
[0141]
只有当荧光部分直接局部接近,并且当供体荧光部分的发射光谱与受体荧光部分的吸收光谱重叠时,有效的fret才发生。
[0142]
因而,在一个实施例中,所述供体和受体荧光部分在所述探针上在彼此的不多于5个核苷酸内。在进一步的实施例中,所述受体荧光部分是猝灭剂。
[0143]
如上所述,在形式中,在pcr反应的退火步骤期间,标记的杂交探针与靶核酸(即扩增产物)结合,并且在后续延长期过程中,通过taq或如技术人员已知的另一合适的聚合酶(诸如突变z05聚合酶)的5
′
至3
′
外切核酸酶活性来降解。因而,在一个实施例中,在上述的方法中,扩增采用具有5
′
至3
′
外切核酸酶活性的聚合酶。
[0144]
进一步有利的是,仔细地选择由于上述方法产生的扩增子的长度。通常,相对短的扩增子增加扩增反应的效率。因而,本发明的一个方面是上述的方法,其中扩增的片段包含最多450个碱基、最多300个碱基、最多200个碱基或最多150个碱基。
[0145]“序列”是核酸的一级结构,即组成各个核酸的单个核碱基的特定排列。必须理解,术语“序列”不表示特定类型的核酸如rna或dna,而是适用于这两者以及其他类型的核酸,诸如例如pna或其他。如相关领域中众所周知的,在核碱基彼此对应的场合,特别是在尿嘧啶(存在于rna中)和胸腺嘧啶(存在于dna中)的情况下,可以认为这些碱基在rna与dna序列之间是等同的。
[0146]
临床上有关的核酸经常是dna,其可以源自dna病毒,如例如乙型肝炎病毒(hbv)、巨细胞病毒(cmv)等,或细菌,如例如砂眼衣原体(ct)、淋病奈瑟氏球菌(ng)等。在这样的情况下,为了反映靶核酸性质,使用由dna组成的内部对照核酸可以是有利的。术语“细胞”、“细胞系”和“细胞培养物”可以互换使用,且所有这样的名称都包括后代。因而,词语“转化体”或“转化的细胞”包括原代转化的细胞和不考虑转移的数目从该细胞衍生出的培养物。由于故意的或非故意的突变,所有后代可能在dna含量上不是精确地相同的。在转化体的定义中包括具有与在最初转化的细胞中筛选的功能相同的功能的突变后代。细胞可以是原核的或真核的。
[0147]
术语“控制序列”指在特定宿主生物体中表达可操作连接的编码序列所必需的dna序列。适合用于原核生物的控制序列例如包括启动子、任选地操纵子序列、核糖体结合位点、正反向调控元件(参见美国专利号4,666,848,其以引用方式并入本文)和可能的其他序列。已知真核细胞利用启动子、多腺苷酸化信号和增强子。
[0148]
术语“可操作连接”指编码序列的定位,使得控制序列将起作用以驱动由编码序列编码的蛋白的表达。因而,与控制序列“可操作连接”的编码序列表示这样的构型:其中编码序列可以在控制序列的指导下表达。
[0149]
术语“限制性内切核酸酶”和“限制性内切酶”是指通常在细菌中起源的酶,其在特定核苷酸序列处或附近切割双链dna。
[0150]
在本文中定义了具有类似侧链的氨基酸残基的家族。这些家族包括具有以下侧链的氨基酸:碱性侧链(刃加,赖氨酸、精氨酸、组氨酸)、酸性侧链(例如,天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如,天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸)、非极性侧链(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸、色氨酸、半胱氨酸、甘氨酸)、β-分支侧链(例如,苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)。
[0151]
术语“试剂溶液”是包含至少一种用于pcr目的需要或使用的试剂的任何溶液。大多数典型成分是聚合酶、核苷酸、引物、离子、镁、盐、ph缓冲剂、核苷酸三磷酸(ntp)或脱氧核苷酸三磷酸(dntp)、探针、荧光染料(可以连接至探针)、核酸结合剂、核酸模板。试剂还可以是其他聚合酶反应添加剂,其对聚合酶反应或其监测具有影响。
[0152]
术语“主混合物”是指pcr发生所需的所有或大部分成分或因子的混合物,且在一些情况下,指除了样品和扩增子特异性的模板和引物以外的全部。可商购获得的主混合物通常是浓缩的溶液。主混合物可包含多种样品共用的所有试剂,但其也可以仅为一种样品构建。使用主混合物有助于减小由移液的体积之间的差异引起的样品之间的移液错误和变动。
[0153]
术语“热稳定的聚合酶”指这样的酶:其对热稳定,耐热,并且当处于升高的温度经受双链核酸变性所需的时间之后保留足够的活性以实现随后的引物延伸反应。核酸变性所需的加热条件是本领域众所周知的并在例如美国专利号4,965,188和4,889,818中举例说明,这些专利以引用方式并入本文。如本文所用,热稳定的聚合酶适合用在温度循环反应(诸如pcr)中。热稳定的核酸聚合酶的实例包括水生栖热菌taq dna聚合酶、栖热菌属z05聚合酶、黄栖热菌聚合酶、海栖热袍菌聚合酶诸如tma-25和tma-30聚合酶、tth dna聚合酶等。
[0154]“具有逆转录酶活性的聚合酶”是能够基于rna模板合成dna的核酸聚合酶。一旦
rna已经被逆转录为单链cdna,其还能够复制单链或双链dna。在本发明的一个实施例中,具有逆转录酶活性的聚合酶是热稳定的。
[0155]
在通过dna聚合酶的rna分子扩增中,第一延伸反应是使用rna模板的逆转录,并且产生dna链。使用dna模板的第二延伸反应产生双链dna分子。因此,通过dna聚合酶从rna模板合成互补dna链为扩增提供原料。
[0156]
热稳定的dna聚合酶可以在偶联的单酶逆转录/扩增反应中使用。在此上下文中,术语“同质”是指用于rna靶标的逆转录和扩增的两步单一加成反应。同质意味着在逆转录(rt)步骤之后,在扩增步骤前不需要打开反应容器或在其他方面调整反应组分。在非同质rt/pcr反应中,在逆转录后且在扩增前,例如调节、添加或稀释一种或多种反应组分(诸如扩增试剂),对此必须打开反应容器,或至少必须操作其内容物。本发明的范围均包含同质和非同质的实施例。
[0157]
逆转录是rt/pcr中的一个重要步骤。例如,在本领域中已知rna模板表现出形成二级结构的倾向,所述二级结构可以妨碍引物结合和/或通过相应的逆转录酶的cdna链延伸。因而,rt反应的相对高温度就转录的效率而言是有利的。另一方面,提高孵育温度也意味着更高的特异性,即rt引物将不退火至表现出与预期的一个或多个序列的错配的序列。特别是在多个不同靶rna的情况下,可以期望其也转录并且随后扩增和检测具有单一错配的序列,例如,在流体样品中可能存在未知的或罕见的生物体的亚株或亚种的情况下。
[0158]
为了受益于上述的两个优点,即二级结构的减少和具有错配的模板的逆转录,可以在多于一个不同的温度实施rt孵育。
[0159]
因此,本发明的一个方面是上文所述的方法,其中具有逆转录酶活性的聚合酶的所述孵育在30℃至75℃、或45℃至70℃、或55℃至65℃的不同温度下实施。
[0160]
作为逆转录的一个进一步的重要方面,长rt步骤可以破坏可能存在于流体样品中的dna模板。如果流体样品同时包含rna和dna种类,则因而有利的是保持rt步骤的持续时间尽可能短,但同时确保为随后的扩增和任选的扩增产物检测合成足够量的cdna。
[0161]
因此,本发明的一个方面是上文所述的方法,其中用于孵育具有逆转录酶活性的聚合酶的时间段是长达30分钟、20分钟、15分钟、12.5分钟、10分钟、5分钟或1分钟。
[0162]
本发明的一个进一步方面是上文所述的方法,其中具有逆转录酶活性并且包含突变的聚合酶选自:
[0163]
a)cs5 dna聚合酶
[0164]
b)cs6 dna聚合酶
[0165]
c)海栖热袍菌(thermotoga maritima)dna聚合酶
[0166]
d)水生栖热菌(thermus aquaticus)dna聚合酶
[0167]
e)嗜热栖热菌(thermus thermophilus)dna聚合酶
[0168]
f)黄栖热菌(thermus flavus)dna聚合酶
[0169]
g)丝状栖热菌(thermus filiformis)dna聚合酶
[0170]
h)栖热菌属物种sps17(thermus sp.sps17)dna聚合酶
[0171]
i)栖热菌属物种(thermus sp.)z05 dna聚合酶
[0172]
j)那不勒斯栖热袍菌(thermotoga neapolitana)dna聚合酶
[0173]
k)非洲栖热腔菌(termosipho africanus)dna聚合酶
[0174]
l)thermus caldophilus dna聚合酶
[0175]
特别适用于这些要求的是在聚合酶结构域中携带在更快的延伸速率方面增强其逆转录效率的突变的酶。
[0176]
因此,在上述方法中,其中具有逆转录酶活性的聚合酶是包括突变的酶,该突变赋予相对于相应的野生型聚合酶改善的核酸延伸速率和/或改善的逆转录酶活性。
[0177]
在一个实施例中,在上述方法中,具有逆转录酶活性的聚合酶是包括突变的酶,该突变赋予相对于相应的野生型聚合酶改善的逆转录酶活性。
[0178]
wo 2008/046612中公开了携带点突变的聚合酶,所述点突变使得它们特别有用。具体而言,待使用的聚合酶可以是在聚合酶结构域中至少包含以下基序的突变dna聚合酶:
[0179]
t-g-r-l-s-s-xb7-xb8-p-n-l-q-n;其中xb7是选自s或t的氨基酸,且其中xb8是选自g、t、r、k或l的氨基酸,其中聚合酶包含3
′‑5′
外切核酸酶活性并且具有相对于野生型dna聚合酶改善的核酸延伸速率和/或改善的逆转录效率,其中在所述野生型dna聚合酶中,xb8是选自d、e或n的氨基酸。
[0180]
一个实例是来自栖热菌属物种(thermus species)z05(描述于例如us 5,455,170中)的热稳定性dna聚合酶的突变体,所述变异包含与相应的野生型酶z05相比在聚合酶结构域中的突变。用于根据本发明的方法的一个实施例是突变z05 dna聚合酶,其中位置580处的氨基酸选自:g、t、r、k和l。
[0181]
对于使用热稳定性聚合酶的逆转录,通常以盐形式包括二价阳离子(诸如mn
2
或mg
2
),例如氯化锰(mncl2)、乙酸锰(mn(oac)2)或硫酸锰(mnso4)或氯化镁(mgcl2),乙酸镁(mg(oac)2)或硫酸镁(mgso4)。如果在含有50mm tricine缓冲液的反应中包括mncl2,则例如mncl2通常以0.5-7.0mm的浓度存在;当使用各200μm的dgtp、datp、dutp和dctp时,通常存在2.5-3.5mm。
[0182]“经修饰的”热稳定的聚合酶是指其中至少一个单体不同于参照序列的聚合酶,诸如天然或野生型形式的聚合酶或另一种修饰形式的聚合酶。示例性修饰包括单体插入、缺失和取代。经修饰的聚合酶还包括嵌合聚合酶,其具有衍生自两个或更多个亲本的可鉴定的组分序列(例如,结构或功能结构域等)。在经修饰的聚合酶的定义内还包括包含参照序列的化学修饰的那些。经修饰的热稳定的聚合酶的实例包括g46e e678g cs5 dna聚合酶、g46e l329a e678g cs5 dna聚合酶、g46e l329a d640g s671f cs5 dna聚合酶、g46e l329a d640g s671f e678g cs5 dna聚合酶、g46e e678g cs6 dna聚合酶、z05 dna聚合酶、δz05聚合酶、δz05-gold聚合酶、δz05r聚合酶、e615g taq dna聚合酶、e678g tma-25聚合酶、e678g tma-30聚合酶等。
[0183]
术语“热活性的聚合酶”是指在确保特异性的引发和引物延伸所必需的高温(例如,55-80℃)有活性的酶。
[0184]
术语“肽”、“多肽”和“蛋白”互换使用。术语“核酸”和“多核苷酸”互换使用。除非另外指出,否则从氨基末端至羧基末端书写氨基酸序列。除非另外指出,否则从5
′
至3
′
书写单链核酸序列。除非另外指出,否则从5
′
至3
′
书写双链核酸序列的上链,且从3
′
至5
′
书写下链。
[0185]
虽然为了清楚和理解的目的已经相当详细地描述了上述发,但是本领域技术人员通过阅读本公开将清楚,在不脱离本发明的真实范围的情况下,可在形式和细节上进行各
种改变。例如,上述所有组合物和方法可以以各种组合使用。本技术中引用的所有出版物、专利、专利申请和/或其他文档全文以引用方式并入以用于所有目的,其程度如同每项单独的出版物、专利、专利申请和/或其他文档被单独地指示通过引用并入以用于所有目的。
[0186]
本技术中公开的化合物的化学结构编号如下所示:
[0187]
硅和锗苯胺/氮杂环丁烷
[0188][0189][0190]
二溴化物
[0191]
[0192]
[0193][0194]
咪唑
[0195][0196]
咪唑染料
[0197]
[0198][0199]
咪唑鎓染料
[0200]
[0201][0202]
实例
[0203]
给出以下实例来举例说明本发明的实施例,如其目前优选所实行的。应当理解,所述实例是说明性的,并且除了在所附权利要求中指示以外,本发明不应视作受到限制。
[0204]
缩写:abs.=无水,acoh=乙酸,aq.=水性,datp=2
′‑
脱氧腺苷5
′‑
三磷酸,dctp=2
′‑
脱氧胞苷5
′‑
三磷酸,dgtp=2
′‑
脱氧鸟苷5
′‑
三磷酸,dbco=二苯并环辛炔修饰;dcm=二氯甲烷,dmf=n,n
′‑
二甲基甲酰胺,dmso=二甲基亚砜,dutp=2
′‑
脱氧尿苷5
′‑
三磷酸,eq.=摩尔当量,et2o=二乙醚,etoac=乙酸乙酯,mecn=乙腈,meoh=甲醇,qpcr=实时聚合酶链反应,rt=室温,spe=固相萃取,tbaf=四丁基氟化铵,thf=四氢呋喃,tlc=薄层色谱,uplc-ms=超高效液相色谱-质谱联用法。
[0205]
一般材料和方法
[0206]
除非另有说明,否则试剂均购自milliporesigma(burlington,ma,u.s.a.)。叔丁基锂溶液(1.5m,在正戊烷中)得自alfa aesar(haverhill,ma,u.s.a.)。1-(3-溴苯基)氮杂环丁烷和1-丁基-1h-咪唑-2-甲酸甲酯得自chemshuttle(hayward,ca,u.s.a.)。1-甲基-1h-咪唑-2-甲酸甲酯得自aa blocks llc(san diego,ca,u.sa.)。1,4,5-三甲基-1h-咪唑-2-甲酸甲酯得自chemspace(monmouth junction,nj,u.s.a.)。三氟甲磺酸2-(三甲基甲硅烷基)苯酯得自tci america(porrland,oregon,u.s.a.)。1-叠氮基-2-(2-(2-(2-溴乙氧基)乙氧基)乙氧基)乙烷(溴-peg
3-叠氮化物)得自broadpharm(san diego,ca,u.s.a.)。用
于化学dna合成的试剂和材料得自glen research(sterling,va,u.s.a.)。
[0207]
除非另有说明,否则所有合成转化均在干燥的氩气气氛下使用经火焰烘干的玻璃器皿进行。化学反应用溶剂得自acros organics (thermo fisher scientific,waltham,ma,u.s.a.)并且储存在活化的分子筛上。色谱用溶剂(hplc级)得自milliporesigma或vwr(radnor,pa,u.s.a.),并且无需进一步纯化即可使用。微波辅助反应使用cem(matthews,nc,usa)的sp微波系统进行,该系统在厚壁玻璃小瓶(2.0ml或10.0ml)中配备聚焦单模反应室(2.45ghz)。用内置红外温度传感器监测反应温度,并且通过自动功率控制使其反应温度保持恒定。在使用压缩空气进行主动冷却的条件下搅拌微波辅助反应。使用来自teledyne-isco(lincoln,ne,u.s.a.)的自动化快速色谱系统(rf
lumen)进行快速柱色谱分离。uplc分析采用配备有二极管阵列、荧光和质谱(zspray
tm
)检测器的waters i-class acquity uplc(waters corporation,milford,ma,usa)进行。将waters beh c18寡核苷酸分析专用柱(1.7μm,2.1
×
50mm)与流速为1.0ml/min的适当梯度的teaa缓冲液(100mm,ph 7.0)或h2o(0.1%甲酸)对mecn配合使用。半制备型hplc纯化在配备996光电二极管阵列检测器和waters xbridge
tm
beh c18 obd prep色谱柱(5μm,19.0
×
250mm)的waters 600 hplc上以10.0ml/min的流速进行。在进样之前,样品通过teflon注射器式过滤器(0.20μm)过滤。用agilent 8453紫外-可见分光光度计(santa clara,ca,u.s.a.)获得吸收光谱。用agilent cary eclipse荧光分光光度计记录荧光光谱。
[0208]
根据相应的后处理或纯化方法不同,带有一个或多个正电荷的化合物(24-36)以乙酸盐、氯化盐、溴化盐或碘化盐的形式获得。通过使用合适的离子交换树脂的标准离子交换程序、液-液萃取或从有机溶剂中沉淀,实现反荷离子的取代。
[0209]
实例1:反应方案一般程序
[0210]
图5提供了用于制备根据本发明所述的荧光染料的一般反应方案。如该图中所示,用于制备荧光染料的方法包括形成染料核的步骤。在本文中,用有机锂试剂对二卤化物(1)执行双卤素-金属交换以得到相应的二锂化合物,该有机锂试剂可以是例如叔丁基锂。随后,中间体(“原位”)与烷基酯(例如1-烷基-或1-芳基-1h-咪唑-2-甲酸甲酯(2))反应。随后,加入布朗斯特酸(“一锅法反应”),例如乙酸,从羟基中间体中消除水以执行芳构化,以得到化合物(3)。在染料核形成反应之后,咪唑季铵化为咪唑鎓。在一些方面,通过用烷基卤化物、烷基甲苯磺酸酯、烷基三氟甲磺酸酯或烷基甲磺酸酯进行亲核取代,使咪唑(3)季铵化为咪唑鎓化合物,以得到烷基化化合物(4)。在其他方面,咪唑(3)季铵化为咪唑鎓化合物用环内酯(例如β-丙内酯)在路易斯酸(例如三溴化铝)存在下进行,以得到甲酸(5)。在还其他方面,用由三氟甲磺酸2-(三甲基甲硅烷基)苯酯试剂和氟化物供体原位生成的芳炔,使3-咪唑氮(3)季铵化为咪唑鎓,该氟化物供体为例如四丁基氟化铵或四正丁基铵二氟三苯基硅酸盐,以得到芳基化化合物(6)。
[0211]
实例2:合成化合物1-10的一般程序
[0212]
[0213]
其中x=si、ge;y=me、ipr、ph;z=nme2、nc3h6。
[0214]
化合物1-10[3,3
′‑
(二甲基硅烷二基)双(n,n-二甲基苯胺)1、双(3-(氮杂环丁烷-1-基)苯基)二甲基硅烷2、3,3
′‑
(二异丙基硅烷二基)双(n,n-二甲基苯胺)3、双(3-(氮杂环丁烷-1-基)苯基)二异丙基硅烷4、3,3
′‑
(二苯基硅烷二基)双(n,n-二甲基苯胺)5、双(3-(氮杂环丁烷-1-基)苯基)二苯基硅烷6、3,3
′‑
(二甲基锗烷二基)双(n,n-二甲基苯胺)7、双(3-(氮杂环丁烷-1-基)苯基)二甲基锗烷8、3,3
′‑
(二苯基锗烷二基)双(n,n-二甲基苯胺)9、双(3-(氮杂环丁烷-1-基)苯基)二苯基锗烷10]从3-溴-n,n-二甲基苯胺或1-(3-溴苯基)氮杂环丁烷和相应的硅烷或锗烷试剂(其选自二氯二甲基硅烷、二氯二异丙基硅烷、二氯二苯基硅烷、二甲基二氯化锗或二苯基二氯化锗)开始合成。
[0215]
将3-溴-n,n-二甲基苯胺或1-(3-溴苯基)氮杂环丁烷(2.4eq.)在干燥thf(17.0ml)中的溶液冷却至-78℃,然后缓慢并且逐滴加入正-丁基锂溶液(2.4eq.,2.5m,在己烷中)。将反应混合物在-78℃搅拌0.5h。在相同温度下,加入相应的硅烷或锗烷(1.0eq.,4.0mmol)在thf(2.2ml)中的溶液。随后,移除冷却浴,并且将反应混合物在rt搅拌3h,或直至tlc分析(硅胶,etoac/己烷)显示起始材料已完全转化。将反应用饱和nh4cl(5.0ml)猝灭,用h2o(20ml)稀释,并且用etoac萃取。将合并的有机层用盐水洗涤,经无水mgso4干燥,并且过滤。蒸发溶剂,并且将残余物在高真空下干燥。通过硅胶快速色谱(硅胶,在己烷中的0-10%etoac)纯化粗产物,得到标题化合物,其为无色油状物。通过nmr和uplc-ms分析(c
18
,h2o,0.1%甲酸,mecn在2.0分钟内从50%增加至100%)确认产物的特性。
[0216]
实例3:合成化合物11-20的一般程序
[0217][0218]
其中x=si、ge;y=me、ipr、ph;z=nme2、nc3h6。
[0219]
化合物11-20[3,3
′‑
(二甲基硅烷二基)双(4-溴-n,n-二甲基苯胺)11、双(5-(氮杂环丁烷-1-基)-2-溴苯基)二甲基硅烷12、3,3
′‑
(二异丙基硅烷二基)双(4-溴-n,n-二甲基苯胺)13、双(5-(氮杂环丁烷-1-基)-2-溴苯基)二异丙基硅烷14、3,3
′‑
(二苯基硅烷二基)双(4-溴-n,n-二甲基苯胺)15、双(5-(氮杂环丁烷-1-基)-2-溴苯基)二苯基硅烷16、3,3
′‑
(二甲基锗烷二基)双(4-溴-n,n-二甲基-苯胺)17、双(5-(氮杂环丁烷-1-基)-2-溴苯基)二甲基锗烷18、3,3
′‑
(二苯基锗烷二基)双(4-溴-n,n-二甲基苯胺)19、双(5-(氮杂环丁烷-1-基)-2-溴苯基)二苯基锗烷20]由化合物1-10进行合成。
[0220]
将苯胺或氮杂环丁烷(1.0eq.,3.0mmol)溶于干燥dmf(18.9ml)中,并且用冰浴冷却。在搅拌的同时,历经0.5h的时间加入n-溴琥珀酰胺(2.02eq.)。将反应在室温搅拌3h,或直至tlc分析(硅胶,etoac/己烷)显示起始材料已完全转化。将混合物用dcm稀释,并且用半饱和nahco3水溶液萃取两次。将有机层用饱和nacl水溶液洗涤,用mgso4干燥,并且过滤。蒸发溶剂,并且将残余物在高真空下干燥。通过快速色谱(硅胶,在己烷中的0-10%etoac)或重结晶获得纯产物。通过nmr和uplc-ms分析(c
18
,h2o,0.1%甲酸,mecn在2.0分钟内从50%增加至100%)确认产物的特性。
[0221]
实例4:合成染料的一般程序24-28
[0222][0223]
其中x=si、ge;y=me、ipr、ph;z=nme2、nc3h6;r=me、bu。
[0224]
染料24-28由化合物11、12、20以及相应的咪唑甲酯21-23[1-甲基-1h-咪唑-2-甲酸甲酯21、1,4,5-三甲基-1h-咪唑-2-甲酸甲酯22、1-丁基-1h-咪唑-2-甲酸甲酯23]合成。
[0225]
将相应的二溴化物(1.0eq.,450μmol)在无水thf(5.75ml)中的溶液冷却至-78℃。逐滴加入叔丁基锂溶液(4.4eq.,1.5m,在正戊烷)中,并且将反应混合物在-78℃搅拌30min。将反应温度升至-20℃,然后历经0.5h缓慢加入相应的咪唑甲酯(2.2eq.)在无水thf(5.75ml)中的溶液。将混合物在rt搅拌18h。将反应混合物的ph用冰乙酸设定为4.0,并且将溶液在rt搅拌4h,其间形成显著的蓝色。将反应混合物用饱和kbr水溶液和dcm萃取。将合并的有机层用h2o洗涤,经na2so4干燥,并且过滤。在减压下蒸发溶剂。将残余物重新溶于最少量的dcm中,并且加入et2o的搅拌溶液中。将形成的蓝色沉淀分离并且通过离心进行洗涤。弃去黄色上清液。将深蓝色染料在高真空下干燥,并且通过半制备型hplc(c
18
,teaa/mecn)进行纯化。
[0226]
实例5:合成染料29和30的一般程序
[0227][0228]
其中z=nme2、nc3h6。
[0229]
咪唑鎓染料29和30分别由染料24和25进行合成。
[0230]
将咪唑染料(1.0eq.,17μmol)和碘甲烷(2.0eq.)在mecn中的溶液通过微波辐射6h以加热至80℃。将反应混合物加入搅拌的et2o中。将沉淀通过离心分离,并且弃去上清液。最后,通过半制备型hplc(c
18
,teaa/mecn)纯化粗产物。荧光光谱和荧光的温度依赖性如图1所示。
[0231]
实例6:合成染料31的程序
[0232]
[0233]
制备咪唑染料(1.0eq.,17μmol,最终浓度30mm)和三氟甲磺酸2-(三甲基甲硅烷基)苯酯(5.0eq.)在无水mecn中的溶液,并且最后加入干燥tbaf(1.0m,在thf中,5.0eq.)以开始反应。通过微波辐射将搅拌溶液在50℃加热1.0h。uplc-ms分析(mecn在2分钟内从30%增加至60%)确认反应已完成。将混合物倒入搅拌的et2o中,向其中加入固体nai(2.0eq.)。将形成的沉淀通过离心分离。弃去上清液并且将残余物吸收于h2o中。用teflon注射器式过滤器去除不溶性副产物,并且通过半制备型hplc(c
18
,teaa,30-60%mecn)从上清液中获得咪唑鎓染料。
[0234]
实例7:合成染料32-35的一般程序
[0235][0236]
其中x=si、ge;r1=me、bu,r2=h、me。
[0237]
制备咪唑染料(1.0eq.,20μmol,最终浓度78mm)和β-丙内酯(10.0eq.)在无水mecn中的溶液,并且最后加入albr3以开始反应。将溶液在rt搅拌1.0h,其间形成一些沉淀。uplc-ms分析(mecn在2分钟内从30%增加至60%)确认反应已完成。将混合物倒入搅拌的et2o中。将形成的沉淀通过离心分离。将残余物用et2o洗涤,在高真空下干燥,并且重新溶于mecn(400μl)中。加入teaa缓冲液(3.6ml),并且用teflon注射器式过滤器去除不溶性副产物。通过半制备型hplc(c
18
,teaa,30-60%mecn)从上清液中获得咪唑鎓染料。
[0238]
实例8:合成染料36的程序
[0239][0240]
将咪唑染料(1.0eq.,17μmol,最终浓度50mm)和溴-peg
3-叠氮化物(2.0eq.)和nai(10.0eq.)在无水mecn中的溶液在50℃加热12h。使产物从et2o中沉淀出来,并且通过半制备型hplc(c
18
,teaa,25%-45%mecn)进行纯化。通过spe对纯化的产物脱盐。
[0241]
实例9:制备染料标记的dna探针
[0242]
通过在dna结合的dbco与叠氮化物修饰的染料之间应变促进的叠氮化物-炔烃环加成来制备染料标记的dna探针。因此,通过固相dna合成制备包含3
′‑
c3延伸阻断剂、内部bhq-2和5
′‑
dbco dt修饰的30mer dna探针,并且用标准方法进行纯化。将dna (1.0eq.,100μm,50mm teaa)和染料叠氮化物#36(1.1eq.,100μm,50mm teaa)混合并且在摇床上于rt保持2h。以相同方式制备与市售参比染料(经叠氮化物修饰)的dna缀合物。使用常用程序,通过乙醇沉淀完全去除任何过量的染料。uplc分析显示了dna的定量标记(图2a和2b)。
[0243]
实例10:使用染料标记的dna探针进行pcr扩增
[0244]
所有qpcr组分均使用无核酸酶的h2o进行制备。通过混合称为主混合物(20μl)、缓
冲液混合物(20μl)和dntp混合物(10μl)的三种组分,制备总体积为50μl的反应混合物。主混合物包含tricine缓冲液(ph 8.2)、乙酸锰、乙酸钾、甘油、dmso、去污剂、靶dna(5000个拷贝/反应)、聚合酶适体、标记的dna探针、正向和反向引物dna以及聚合酶。dntp混合物含有datp、dctp、dgtp(每个2.0mm)和dutp(4.0mm)。每个qpcr在96孔板的孔中一式三份制备。将板密封并且使用480系统(弗里兹
·
豪夫迈
·
罗氏股份有限公司,瑞士巴塞尔)使其经受扩增循环。根据在cy5.5通道中采集的荧光数据分析生长曲线,并且如图3所示。
[0245]
实例11:免疫组化组织染色
[0246]
染料叠氮化物编号36和cf680r用于对扁桃体组织切片进行染色。用confirm
tm
抗ki-67(30-9)兔单克隆一抗(ventana medical systems,inc.,tucson,az,u.s.a.)处理福尔马林固定石蜡包埋的组织切片,并且用浓度为200μm的相应的染料叠氮化物进行标记。放大10倍、20倍和40倍的光学显微镜图像如图4所示。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。