基于聚集诱导发光和mxenes的多功能纳米材料、制备方法、应用
技术领域
1.本发明属于荧光纳米材料技术领域,具体涉及基于聚集诱导发光和mxenes的多功能纳米材料、制备方法、应用。
背景技术:
2.mxenes通常是通过从层状m
n 1
axn块状相中提取a元素制备的,其中m代表早期过渡金属碳化物,a代表13或14族元素,x代表c或n,例如ti3c2纳米片(纳米片就是典型的mxenes。ti3c2纳米片由于其多样的表面化学特性,优异的导电性、充足的表面端基和高的光热转换效率(pce),在光热治疗(ptt)领域具有极大的应用潜力。ti3c2(纳米片在近红外一区(nir-i,750-1000nm)中具有较高的吸收能力,这有利于深层组织穿透。ti3c2的光热转换效率(pce)高达40%,甚至高于许多报道的ptt光敏剂(pss),如金纳米棒,碳基纳米材料和许多有机纳米粒子。
3.然而,ti3c2(纳米片在光疗中的开发还远远不够。首先,ti3c2(纳米片在nir-i照射下是不发射荧光的,因此并不具有fli导航能力。此外,mxenes与石墨烯类似,其严重的猝灭效应使其在直接连接荧光探针时效率低下。因此,fli导航在ti3c2(纳米片光疗中具有重要意义,但目前仍难以实现。在生物相容性方面,传统的表面修饰策略涉及到聚合物与ti3c2(纳米片之间的静电力相互作用,这种作用力在生理环境中的稳定性太弱,可能导致结构分解并产生生物毒性。
4.因此,现有技术还有待于进一步的提升。
技术实现要素:
5.针对上述存在的问题,本发明旨在提供一种基于聚集诱导发光和mxenes的多功能纳米材料、制备方法、应用,旨在解决现有的mxenes材料在生理环境中稳定性弱,在近红外一区不发射荧光的问题。
6.本发明为解决上述技术问题所采用的技术方案如下:
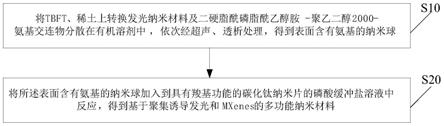
7.一种基于聚集诱导发光和mxenes的多功能纳米材料的制备方法,其中,方法包括如下步骤:
8.将tbft、稀土上转换发光纳米材料及二硬脂酰磷脂酰乙醇胺-聚乙二醇2000-氨基交连物分散在有机溶剂中,依次经超声、透析处理,得到表面含有氨基的纳米球;
9.将所述表面含有氨基的纳米球加入到具有羧基功能的碳化钛纳米片的磷酸缓冲盐溶液中反应,得到基于聚集诱导发光和mxenes的多功能纳米材料。
10.可选地,所述的制备方法,其中,所述稀土上转换发光纳米材料为nayf4:yb
3
,er
3
或nayf4:yb
3
,tm
3
。
11.可选地,所述的制备方法,其中,所述有机溶剂选自四氢呋喃、乙腈和二甲基亚砜中的一种。
12.可选地,所述的制备方法,其中,所述步骤将tbft、稀土上转换发光纳米材料及二硬脂酰磷脂酰乙醇胺-聚乙二醇2000-氨基交连物分散在有机溶剂中,依次经超声、透析处理,得到表面含有氨基的纳米球,具体包括:
13.将tbft、稀土上转换发光纳米材料及二硬脂酰磷脂酰乙醇胺-聚乙二醇2000-氨基交连物分散在有机溶剂中,静置,静置后注入到去离子水中;
14.采用微探针声纳器进行超声处理,得到混合物;
15.将所述混合物转移至透析管中,在去离子水中透析去除有机溶剂,得到表面含有氨基的纳米球。
16.可选地,所述的制备方法,其中,所述步骤将所述表面含有氨基的纳米球加入到含具有羧基功能的碳化钛纳米片的磷酸缓冲盐溶液中反应,得到基于聚集诱导发光和mxenes的多功能纳米材料,具体包括:
17.将含有1-乙基3-[3-二甲基氨基丙基]碳二亚胺盐酸盐、n-羟基琥珀酰亚胺和具有羧基功能的碳化钛纳米片的磷酸缓冲盐溶液搅拌10-30min;
[0018]
将表面含有氨基的纳米球加入到所述磷酸盐缓溶液中,在37℃摇床中保存过夜,依次经离心分离、去离子水洗涤,得到基于聚集诱导发光和mxenes的多功能纳米材料。
[0019]
可选地,所述的制备方法,其中,所述具有羧基功能的碳化钛纳米片的制备方法,包括:
[0020]
将氢氧化钠和4-氨基苯甲酸分散在水中,得到苯羧酸重氮盐水溶液;
[0021]
将所述苯羧酸重氮盐水溶液的温度保持在0-5℃,依次加入亚硝酸钠和盐酸,得到浅黄色溶液;
[0022]
将所述浅黄色溶液加入到碳化钛纳米片的水溶液中,依次经搅拌、超声、离心处理,得到具有羧基功能的碳化钛纳米片。
[0023]
一种基于聚集诱导发光和mxenes的多功能纳米材料,其中,由上述所述制备方法制备得到。
[0024]
一种如上述所述基于聚集诱导发光和mxenes的多功能纳米材料的应用,其中,所述基于聚集诱导发光和mxenes的多功能纳米材料作为纳米光敏剂在肿瘤成像中的应用。
[0025]
一种如上述所述基于聚集诱导发光和mxenes的多功能纳米材料的应用,其中,所述基于聚集诱导发光和mxenes的多功能纳米材料作为抗肿瘤药物的应用。
[0026]
有益效果:本发明所述的基于聚集诱导发光和mxenes的多功能纳米材料,通过将两亲性聚合物二硬脂酰磷脂酰乙醇胺-聚乙二醇2000-氨基交连物(dspe-peg2000-nh2)通过沉淀法将稀土上转换发光纳米材料(ucnps)和tbft分子包裹在聚合物的内部空间,将peg2000-nh2留在外表面,形成tu nps。然后,通过-nh2和羧基功能化的碳化钛纳米片(ti3c2)表面的-cooh发生的酰胺化反应,将ti3c2纳米片与tu nps整合在一起形成多功能纳米平台tut nps。由于tbft分子与ti3c2纳米片之间的空间隔离保证了tbft的明亮荧光,而tbft分子和ucnps的空间限制也实现了tbft的nir-i调控。与传统的利用聚合物与ti3c2纳米片之间的静电力进行表面修饰的策略相比,聚合物表面的共价键合使tut nps具有长期的稳定性和高效的肿瘤积累。借助ti3c2纳米片的光热转换能力、tbft必不可少的fli导航能力和ros生成能力,该fli/pai/pti三模态成像引导的pdt/ptt纳米平台实现了aie-pss与ti3c2纳米片的双赢合作,显示了在癌症高效诊疗方面的巨大潜力。
附图说明
[0027]
图1为本发明提供的一种基于聚集诱导发光和mxenes的多功能纳米材料的制备方法流程图;
[0028]
图2是dspe-peg-nh2包裹ucnps和aie-pss的示意图;
[0029]
图3是tbft分子的吸收和发射图谱;
[0030]
图4是tbft分子在不同比例thf/水溶液中的荧光光谱;
[0031]
图5是tu nps和tut nps分别在白光/808nm激光照射下的活性氧产生能力;
[0032]
图6是(a)不同浓度的tut nps在808nm激光(1w/cm2)照射下的升温曲线;(b)100μg/ml的tut nps在不同功率的808nm激光照射下的升温曲线;(c)用808nm激光(1w/cm2)反复照射tut nps水溶液得到的升温降温曲线;
[0033]
图7是不同浓度的tut nps在黑暗、白光或者808nm激光(1w/cm2)照射下产生的细胞毒性;
[0034]
图8是小鼠在不同时间点的荧光成像效果;
[0035]
图9是(a)不同治疗组的肿瘤抑制率;(b)不同治疗组的最终治疗结果;(c)不同治疗组的小鼠体重变化。
具体实施方式
[0036]
下面结合具体实施例和附图对本发明作进一步的具体详细描述,但本发明的实施方式不限于此,对于未特别注明的工艺参数,可参照常规技术进行。
[0037]
名词说明
[0038]
光热治疗(ptt);光动力治疗(pdt);光声成像(pai);活性氧(ros);光热成像系统(pti);荧光成像(fli);光热转换效率(pce);光热治疗光敏剂(pss);碳化钛纳米片(ti3c
2 nss);近红外一区(nir-i 750-1000nm);四丙基氢氧化铵(tpaoh)
[0039]
tbft:4,4'-((5,6-difluorobenzo[c][1,2,5]thiadiazole-4,7-diyl)bis(thiophene-5,2-diyl))bis(n-phenyl-n-(4-(1,2,2-triphenylvinyl)phenyl)aniline)
[0040]
经发明人研究发现,现有的具有聚集致猝灭(聚集诱导发光aie)特性的pss在荧光成像导航中表现突出,这使他们成为ti3c2的极好的fli候选材料,然而,大多数aie-pss是在紫外/可见光(200-700nm)下激发/发射的,这种光的穿透深度较浅,严重抑制了它们的诊疗效果,而且与ti3c2纳米片的nir-i吸收范围不匹配。由于开发一种具有长波长光学窗的aie-pss通常需要较多步骤的反应和繁琐的纯化过程。
[0041]
如图1所示,为了解决上述技术问题,本发明提供了一种基于聚集诱导发光和mxenes的多功能纳米材料的制备方法,其中,方法包括如下步骤:
[0042]
s10、将tbft、稀土上转换发光纳米材料及二硬脂酰磷脂酰乙醇胺-聚乙二醇2000-氨基交连物分散在有机溶剂中,得到混合溶液;
[0043]
s20、将所述混合溶液加入到含有1-乙基3-[3-二甲基氨基丙基]碳二亚胺盐酸盐和具有羧基功能的碳化钛纳米片的磷酸缓冲盐溶液中反应,得到基于聚集诱导发光和mxenes的多功能纳米材料。
[0044]
在本实施例中,所述dspe-peg-nh2是一种两亲性聚合物,在水中会自组装形成一个内部疏水外部亲水的纳米球,ucnps和aie-ps都是疏水材料,会被包裹在纳米球内部,如
图2所示。
[0045]
所述稀土上转换发光纳米材料包括但不限于:nayf4:yb
3
,er
3
、nayf4:yb
3
,tm
3
;所述有机溶剂包括但不限于:四氢呋喃、乙腈和二甲基亚砜。
[0046]
在本实施例中,通过共沉淀法上转化纳米颗粒(ucnps)和aie-pss被封装在两亲性聚合物dspe-peg
2000-nh2纳米球中。作为一种典型的mxenes,ti3c2纳米片表面被丰富的羧基化,通过-nh2和-cooh的酰胺化反应,将ucnps、aie-pss和ti3c2纳米片被整合成为多功能纳米平台。聚合物表面的共价键合使得纳米平台具有长期的稳定性和高效的肿瘤积累。ucnps的引入实现了aie-pss的nir-i激活,显著增加了光治疗的组织穿透深度。aie-pss和ti3c2纳米片的空间隔离有利于抑制ti3c2纳米片对光敏剂的猝灭效应。该方法在fli/pai/pti三模态成像引导的ptt/pdt中具有优异的表现。
[0047]
下面通过具体的实施例对本发明所提供的基于聚集诱导发光和mxenes的多功能纳米材料及其制备方法、应用,做进一步的解释说明。
[0048]
实施例1
[0049]
碳化钛纳米片的制备
[0050]
ti3alc2是由ti,al和c粉末以2:1:1的摩尔比混合并球磨10h后得到的,在10mpa的压力下压制成圆饼。在流动的氩气下,在管式炉中将圆盘加热至1500℃ 2小时。用研钵和杵将得到的ti3alc2粉碎。然后在室温下取大约10g粉末浸泡在80ml40%hf水溶液中3天。离心收集后,用去离子水和乙醇洗涤,在50ml tpaoh中室温搅拌3d。然后,将ti3c2纳米片原料离心收集,用乙醇和水洗涤3次,去除残留的tpaoh。经过30分钟的超声处理,得到小尺寸的ti3c2纳米片。
[0051]
实施例2
[0052]
ti3c2纳米片的羧基功能:
[0053]
在重氮盐:ti3c2的反应比为5:1的典型合成过程中,将7mmol的氢氧化钠和4-氨基苯甲酸加入80ml的水中,制备苯羧酸重氮盐。随后,将温度保持在0-5℃,缓慢加入7.6mmol的亚硝酸钠。最后,快速加入6ml 20%的hcl溶液,搅拌45分钟,溶液颜色变为浅黄色。然后将25ml重氮盐溶液加入到1ml ti3c2纳米片的水溶液(5mg/ml)中,以1000转/分搅拌4h。超声15min,9000rpm离心30min,用去离子水、丙酮、乙醇依次洗涤。
[0054]
实施例3
[0055]
制备tu nps
[0056]
将1mg tbft、6μl nayf4:yb
3
、er
3
ucnps(5mg/ml in thf)和10mg dspe-peg
2000-nh2加入到1ml thf中,静置30min,快速注入9ml di(去离子水)水中,然后用45%输出功率的微探针声纳器连续2分钟进行超声。然后将混合物转移到透析管(mwco 8000-14000da)中,在去离子水中透析24小时。为了完全去除thf(四氢呋喃),每4小时用淡水代替水。最终得到的tu nps溶液经过超滤浓缩后使用。
[0057]
实施例4
[0058]
制备tut nps
[0059]
tut nps是由tu nps和tcch nss通过酰胺反应制备得到。首先,将10ml含有edc/nhs(1mm/5mm)和tcch(10g/ml)的pbs(磷酸缓冲盐溶液)搅拌15min,然后将1ml tu nps水溶液([tbft]=0.5mm)加入上述溶液中。溶液在37℃摇床中保存过夜。以10000转/分离心10分
钟,di水洗3次得到产物。
[0060]
应用实施例1
[0061]
对实施例1制备的化合物tbft在thf中的紫外/可见吸收光谱和在水中的荧光光谱进行测试,其紫外/可见吸收光谱和荧光光谱如图3所示;在不同比例thf/水混合溶液中对tbft(10μm)的聚集诱导发光性质进行评估,其aie荧光光谱如图4所示。
[0062]
应用例2:光致活性氧产生能力评估
[0063]
使用dchf-da作为指示剂对tbft的活性氧产生能力进行评估。0.5ml的dcfh-da(1
×
10-3m)乙醇溶液加入到2ml naoh(1
×
10-2
m)溶液中进行活化得到dcfh,加入10ml pbs(ph 7.4)调节溶液酸碱度,避光放置。使用dcfh(5μm)在pbs(ph 7.4)溶液中对tbft nps和tut nps(0.2μm)进行活性氧产生能力评估,分别使用白光/808nm激光进行照射,使用荧光分光光度计记录488nm激发下不同时间点的525nm处的荧光强度,得到其荧光增强倍数。如图5所示,808nm激光的照射明显增强了tut nps的ros产生能力。
[0064]
应用例3:光热产生能力评估
[0065]
将不同浓度的tut nps和ti3c2纳米片水溶液在不同功率密度的808nm激光照射下连续照射5min,每30秒测量一次温度,直至温度接近稳定,如图6a和6b所示。用808nm激光(1w/cm2)反复照射tut nps水溶液50分钟,使用flir e6相机每30秒获取实时热成像数据,并通过flir examiner软件进行量化,如图6c所示。
[0066]
应用例4:诊疗剂对乳腺癌细胞4t1细胞的光治疗抗增殖实验
[0067]
受试细胞:乳腺癌细胞4t1细胞;受试药物:化合物tbft;光源:808nm激光器。
[0068]
将处于对数生长期的细胞用胰酶消化后,完全培养基重悬成细胞悬液,随之将其以5
×
103个/孔的密度接种于96孔板,置于37℃,5%co2培养箱培养,24h后加入不同浓度的tut nps,使得终浓度分别为1,2,5,10,15,20,50μg/ml的样品,培养4h,然后光照(功率1w/cm2的808nm激光10min),与此同时,处于相同实验条件下不进行光照的实验组也进行暗毒性研究。在培养4h后,使用pbs溶液洗3次,接着用新鲜的含10%cck-8无fbs的培养基在黑暗条件下培养2h,然后用酶标仪测试450nm处的吸光度值(od值),相应的细胞存活率计算是通过以下公式:细胞存活率(%)=(od样品-od背景)/(od对照-od背景)
×
100%。实验结果见图7,在药物浓度为50μm时,未受激光照射的对照组,细胞存活率超过95%,证明该化合物的暗毒性较小,生物相容性较好。实验组tut nps在激光照射下,细胞存活率仅为7%,证明tut nps对乳腺癌细胞4t1细胞具有明显的光治疗抗增殖作用
[0069]
应用例5:诊疗剂在4t1肿瘤小鼠体内的荧光成像实验
[0070]
用2%异氟醚2l/min的氧流量对移植瘤4t1小鼠进行麻醉,然后在瘤内注射tut nps(200μl,1mm)。使用ivis光谱成像系统(perkinelmer)和商用系列ii 900/1700成像系统,在注射后预定的时间间隔(3、6、12、24、36、48、72和96小时)获得体内近红外一区荧光成像,如图8所示。
[0071]
应用例6:诊疗剂对4t1肿瘤小鼠体内的光治疗抗增殖实验
[0072]
移植瘤4t1肿瘤小鼠被随机分为6组(每组5只小鼠,包括生理盐水组、tut nps组、tu nps组、tut nps 激光组和tut nps 激光组),当肿瘤体积达到100mm3后,通过尾静脉注射打入200μl的对应药物。36h瘤内注射后,各组小鼠肿瘤连续用808nm激光(1w/cm2)照射10min进行治疗。在各种治疗后,每三天记录每只小鼠的肿瘤大小和体重。用游标卡尺测量
肿瘤体积,按常用公式v=(肿瘤长度
×
肿瘤宽度2)/2计算。相对体积v/v0(v0为治疗前肿瘤初始体积)反映相对肿瘤生长比。实验结果见图9所示,tut nps 激光组的组肿瘤生长抑制率最大,达到90%以上。
[0073]
以上内容描述了本发明的基本原理、主要特征及性能优势。应当理解的是,本发明的性能与应用不限于上述的举例,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,所有这些改进和变换都应属于本发明所附权利要求的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。