1.本发明属于分子生物学和生物技术领域,涉及了一种丝状真菌的荧光融合蛋白原位表达的基因方法及其应用,具体是涉及一种丝状真菌荧光融合蛋白原位表达基因技术及其在真菌蛋白细胞定位和表达量检测中的应用。
背景技术:
2.丝状真菌在发酵工业上长期以来一直用于抗生素、酶类和有机酸等生产,尤其在工业用酶生产中确立了核心地位(applied mycology and biotechnology,2003,3:241-259)。工业用酶的国际市场每年大约数十亿美元,并且在不断增长,其中近40%的酶类生产来自丝状真菌(fungal genetics and biology,2000,29:28-37)。丝状真菌强大的分泌能力是与它们的生活方式相适应的(journal of microbiological methods,2007,69(2):399-401)。菌丝顶端和分支不断生长向底物拓殖,利用菌丝体分泌各种大量的蛋白将底物降解为可被吸收的营养分子供生长需要。例如,里氏木霉(trichoderma reesei)菌株分泌的胞外总蛋白可达40g/l(enzyme microb technol,1988,10:341-345)。这种高效生产和分泌蛋白的能力是细菌无法相比的,同时,丝状真菌还能进行各种翻译后加工,如糖基化修饰、蛋白酶切割和二硫键的形成等,这使其成为能够完成真核蛋白质精确的翻译后修饰的潜在表达宿主(trends in biotechnology,1997,15:256-263)。即使与酵母相比,丝状真菌糖基化作用也明显占有优势,因为它与哺乳动物更接近,甚至可形成与哺乳动物一致的糖基化结构(glcnac2man5),而酵母生产的蛋白总表现出高甘露糖型(glcnac2man 20)(trends in biotechnology,2002,20:200-206)。
3.在分子生物学的研究过程中,往往会涉及到对于具体基因的研究,目前对于基因层面的研究方法主要有基因过表达、基因敲除、基因回补等手段,通过这些基因操作对重组菌株的各个方面进行表征从而得到具体基因对于菌株各方面例如生长、产酶、形态等方面的影响。通常而言,为了研究基因的表达产物——蛋白质在细胞中的亚细胞定位、分泌水平等指标时,研究者会在目的基因后连接一个荧光蛋白进行基因过表达。这种基因过表达实际上就是利用非同源重组将重组基因随机插入到出发菌株的基因组内,这种随机插入的方法难以避免以下问题:1、随机插入的基因可能插入到其他基因的表达区域从而影响其他基因的表达;2、随机插入的基因在表达过程中可能收到其上游或下游的基因或调控因子的影响,和出发菌株内该基因的表达环境可能不同,得到的结果不一定准确;3、随机插入的基因因为插入位点的不同得到的不同转化子会存在较大的差异性,最后得到的实验结果具有较大随机性。
4.因此构建一种能够将荧光标记的重组基因进行原位表达的方法十分重要,即在对目的基因进行荧光标记的同时保证其在基因组中的位置不发生改变。
技术实现要素:
5.针对长期以来,由于基因操作难度大、基因操作手段少,在丝状真菌中对目的蛋白
进行原位荧光标记的基因操作手段缺乏;针对该问题,本发明开发了一种丝状真菌的荧光融合蛋白原位表达的基因方法及其应用于真菌蛋白细胞定位和表达量检测。
6.本发明的技术方案是:本发明所述的一种丝状真菌的荧光融合蛋白原位表达的基因方法,其具体操作步骤如下:
7.步骤(1)、利用pxbthg载体构建pxrednos载体;
8.步骤(2)、利用步骤(1)得到的pxrednos载体构建重组质粒px-n-red;
9.步骤(3)、将步骤(2)得到的重组质粒px-n-red转化丝状真菌构建荧光融合蛋白原位表达重组菌株;
10.最终得到的荧光融合蛋白原位表达重组菌株用于原位表达目的基因的荧光融合蛋白。
11.进一步的,在步骤(1)中,所述的pxrednos载体由酶切位点、细菌筛选抗性基因、真菌筛选抗性基因、融合蛋白接头、荧光蛋白基因及终止子组成;
12.其中,所述酶切位点、细菌筛选抗性基因及真菌筛选抗性基因位于pxbthg载体上,融合蛋白接头位于pcr引物上,荧光蛋白基因和终止子为pcr片段;
13.其构建方式是:
14.首先,通过pcr克隆分别得到荧光蛋白基因和终止子的片段;
15.然后,利用dna克隆连接方法将荧光蛋白基因和终止子的片段连接到pxbthg载体的xho i位点得到重组质粒;
16.其中,dna克隆连接方法包括但不限于dna连接酶连接方法或multi-exnase连接方法;
17.最后,将得到的重组质粒转入大肠杆菌感受态d5hα中克隆,该质粒命名为pxrednos,通过菌落pcr和测序最后得到正确的pxrednos载体。
18.进一步的,所述的融合蛋白接头是柔性融合蛋白接头、刚性融合蛋白接头或可剪切融合蛋白接头中的一种。
19.进一步的,所述的荧光蛋白基因是红色荧光蛋白dsred、绿色荧光蛋白gfp、黄色荧光蛋白yfp及蓝色荧光蛋白bfp各种荧光蛋白基因中的一种。
20.进一步的,在步骤(2)中,所述重组质粒px-n-red的构建方法具体是:
21.首先,通过pcr克隆分别得到基因片段和目的基因的下游片段;
22.然后,利用dna克隆连接方法,将目的基因片段和目的基因的下游片段分别连接到pxrednos载体的xho i和bamh i位点;
23.最后,将得到的重组质粒转入大肠杆菌感受态d5hα中克隆,该质粒命名为px-n-red,通过菌落pcr和测序得到纯的px-n-red重组质粒。
24.进一步的,在步骤(3)中,所述荧光融合蛋白原位表达重组菌株的构建过程是:将重组质粒px-n-red通过丝状真菌的转化方法转化到目的丝状真菌中,再利用抗性筛选得到转化子,得到原位荧光融合表达重组菌株;
25.其中,所述的的丝状真菌转化方法包括但不限于农杆菌转染、原生质体热转及原生质体电转化。
26.进一步的,所述制备的一种丝状真菌的荧光融合蛋白原位表达的基因方法在真菌蛋白检测中的应用。
27.进一步的,所述真菌蛋白检测包括但不限于荧光融合蛋白共聚焦成像和荧光融合蛋白定量分析。
28.进一步的,所述荧光融合蛋白共聚焦成像的操作过程是:将得到的重组菌株进行发酵培养,在培养过程中对发酵液进行取样,在荧光共聚焦显微镜下进行观察,拍摄荧光共聚焦图像;
29.所述荧光融合蛋白定量分析的操作过程是:取发酵样品中的上清液,在荧光酶标仪中测量其荧光强度,可以表征荧光融合蛋白的分泌水平。
30.进一步的,所述丝状真菌包括里氏木霉、粗糙脉孢菌、黑曲霉、草酸青霉及粗糙脉孢霉。
31.本发明的有益效果是:本发明的特点是:本发明首次在丝状真菌中构建了原位荧光蛋白融合表达的基因技术,结合荧光显微镜和酶标仪,实现直接、动态地观察丝状真菌蛋白的时空定位,并对起表达量进行检测。无需进行样品处理,无损样品,操作过程简单。相对于已有的荧光蛋白融合过表达的基因技术来说,在对目的基因进行荧光修饰的同时,没有改变目的基因在基因组中的位置,使用了目的基因本身的启动子,对出发菌株的影响最小,得到的实验结果更为准确。
附图说明
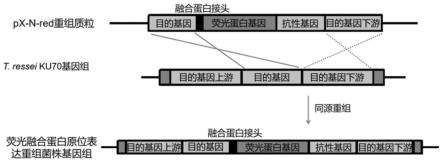
32.图1是本发明中原位表达载体工作原理示意图;
33.图2是本发明中构建得到的pxrednos载体示意图;
34.图3是本发明中实施例中得到的重组质粒px-n-red的实例图;
35.图4是本发明中用到的引物序列表示意图;
36.图5是本发明中里氏木霉转化子实例图;
37.图6是本发明中转化子验证dna电泳图一;其中泳道m为dl5000 dna marker,泳道1为ku70基因组对照,泳道2-4为三个ncel1a重组菌株转化子;
38.图7是本发明中原位表达菌株ncel1a荧光共聚焦显微镜图,图中比例尺为10μm;
39.图8是本发明实施例中发酵培养第五天原位表达菌株ncel1a和ku70对照的胞外发酵液荧光强度表征示意图。
具体实施方式
40.为了更清楚地说明本发明的技术方案,下面结合附图对本发明的技术方案做进一步的详细说明:
41.如图所述,一种丝状真菌基因原位表达荧光融合蛋白的方法,具体操作步骤如下:
42.步骤(1)、原位表达载体(pxrednos载体)的构建,得到的原位表达载体用于构建目的基因的原位基因荧光融合表达重组质粒:通过pcr克隆得到荧光蛋白基因(dsred)和终止子(nos terminal)片段,其中融合蛋白街头linker和his-tag位于pcr引物上;如图1所示,利用dna连接酶或multi-exnase等方式将其连接到pxbthg载体的xho i位点得到pxbthg-red载体,将得到的重组质粒转入大肠杆菌感受态d5hα中克隆;
43.步骤(2)、原位基因荧光融合表达重组质粒的构建(构建重组质粒px-n-red),该重组质粒用于转化丝状真菌得到目的基因的原位基因荧光融合表达重组菌株:通过pcr得到
目的基因片段,通过dna连接酶或multi-exnase等方式将其连接到pxbthg-red载体的xho i酶切位点处,将得到的重组质粒转入大肠杆菌感受态d5hα中克隆;
44.步骤(3)、重组质粒px-n-red转化丝状真菌构建荧光融合蛋白原位表达重组菌株,原位荧光融合该重组菌株被用于荧光融合蛋白的共聚焦成像和定量分析:
45.将得到的重组质粒通过电转或农杆菌转染等方法转化到目的真菌中,利用抗性筛选得到转化子,得到重组菌株。
46.在步骤(1)中,所述原位表达载体由酶切位点、细菌筛选抗性基因、真菌筛选抗性基因、融合蛋白接头、荧光蛋白基因及终止子等组成;其构建方法主要包括:首先,通过pcr克隆得到荧光蛋白基因和终止子片段,其中,融合蛋白接头和his-tag位于pcr引物上;
47.然后,利用dna克隆连接方法,包括但不限于dna连接酶连接方法或multi-exnase连接方法,将荧光蛋白基因和终止子片段连接到pxbthg载体的xho i位点得到原位表达载体;
48.最后,将得到的重组质粒转入大肠杆菌感受态d5hα中克隆,得到纯的原位表达载体。
49.进一步的,所述的融合蛋白接头是柔性融合蛋白接头、刚性融合蛋白接头或可剪切融合蛋白接头中的一种,可根据连接目的基因和荧光蛋白基因、实验目的具体选择合适的融合蛋白接头。
50.所述的荧光蛋白基因包括但不限于红色荧光蛋白dsred、绿色荧光蛋白gfp、黄色荧光蛋白yfp、蓝色荧光蛋白bfp等各种荧光蛋白基因。
51.进一步的,在步骤(2)中,所述重组质粒px-n-red的构建方法主要包括:
52.首先,通过pcr克隆得到基因片段和目的基因的下游片段;
53.然后,利用dna克隆连接方法,包括但不限于dna连接酶连接方法或multi-exnase连接方法,将目的基因片段和目的基因的下游片段分别连接到pxbthg-red载体的xho i和bamh i位点;
54.最后,将得到的重组质粒转入大肠杆菌感受态d5hα中克隆,得到纯的基因荧光融合表达重组质粒。
55.进一步的,在步骤(3)中,所述荧光融合蛋白原位表达重组菌株的构建过程是:将所述的原位荧光融合表达重组质粒通过电转或农杆菌转染等方法转化到目的丝状真菌中,利用抗性筛选得到转化子,得到原位荧光融合表达重组菌株。
56.其中的转化方法包括但不限于农杆菌转染、原生质体热转及原生质体电转。
57.进一步的,所述制备的一种丝状真菌的荧光融合蛋白原位表达的基因方法在丝状真菌中的蛋白检测的应用,其中,所述真菌蛋白检测包括但不限于荧光融合蛋白共聚焦成像和荧光融合蛋白定量分析。
58.进一步的,所述荧光融合蛋白共聚焦成像的过程是:将得到的重组菌株进行发酵培养,在培养过程中对发酵液进行取样,在荧光共聚焦显微镜下进行观察,拍摄荧光共聚焦图像;
59.所述荧光融合蛋白定量分析的过程是:取发酵样品中的上清液,在荧光酶标仪中测量其荧光强度,可以表征荧光融合蛋白的分泌水平。
60.进一步的,所述丝状真菌包括但不限于里氏木霉、粗糙脉孢菌、黑曲霉、草酸青霉
及粗糙脉孢霉。
61.如图所述,本发明应用的系统构架或场景:本发明方法主要应用于丝状真菌中蛋白质分泌水平以及亚细胞定位的研究;在分子生物学研究过程中,蛋白质在细胞中的亚细胞定位往往可以表征其功能、分泌路径等;为了实现对研究蛋白进行亚细胞定位,本发明设计了一种通过原位表达由目的蛋白和荧光蛋白组成的融合蛋白的方法,实现对目标蛋白的细胞定位,研究目标蛋白的细胞分布,同时可以通过荧光强度表征分泌蛋白的分泌水平;这种标记方式对于基因的表达和蛋白的分泌影响较小,对于实验结果更加准确。
62.本发明的核心装置:本发明构建了一种能够对目的基因融合荧光蛋白并原位表达的质粒;该质粒如附图2所示,该质粒由酶切位点、初步筛选抗性基因、转化子筛选抗性基因、融合蛋白接头、荧光蛋白基因、终止子等部分组成;该表达载体工作原理如图1所示,质粒和丝状真菌基因组dna通过同源序列发生同源重组,利用同源重组作用将改造基因导入丝状真菌中。
63.本发明的流程方法:荧光融合蛋白原位表达主要包括以下步骤:
①
、通过pcr得到目的基因片段和目的基因的下游片段分别插入到构建好的pxbthg-red质粒中xho i和bamh i酶切位点中;
②
、将得到的重组质粒转化进大肠杆菌感受态进行筛选和克隆;
③
、通过农杆菌感染或电刺激转化等方法将重组质粒转化进丝状真菌,通过筛选挑去转化子,得到重组菌株。
64.实施例1红色荧光融合蛋白原位表达载体的构建:
65.(1)、分别按照表(1.1)和表(1.2)给出的体系进行pcr,产物命名为red-his和nos片段;实施例中使用的引物序列均由图4列出;
66.表1.1 red-his片段pcr体系组分
[0067][0068]
表1.2 nos片段pcr体系组分
[0069][0070]
(2)、xhoi酶处理pxbthg载体进行酶切得到线性化质粒,使用multis酶按照表1.3添加连接体系;
[0071]
表1.3 multis连接体系组分
[0072][0073]
(3)、向100μl的dh5α感受态细胞中加入连接反应得到10μl重组质粒,依次将感受态细胞置于冰上30min、42℃水浴45s、冰上2min后加入900μl无抗lb培养基于37℃震荡培养
1h后涂布于含有kan抗性的lb平板上培养8h,挑取单菌落进行菌落pcr验证;
[0074]
(4)、验证正确的重组大肠杆菌在37℃震荡培养12h;后提取质粒,送公司进行测序验证,质粒命名为原位表达载体。
[0075]
实施例2以里氏木霉为例构建β-葡萄糖苷酶基因cel1a的红色荧光融合蛋白原位表达重组菌株:
[0076]
(1)、以里氏木霉ku70基因组为模板,按照表(2.1)和表(2.2)体系进行pcr,得到产物片段记为1a-red-up和1a-red-down;
[0077]
表2.1 red-his片段pcr体系组分
[0078][0079]
表2.2 red-his片段pcr体系组分
[0080][0081]
(2)、同时用xhoi和bamhi酶对实施例1中得到的pxbthg-red进行酶切得到线性化质粒;
[0082]
使用multis酶进行连接反应,连接体系如表2.3所示;
[0083]
(3)、向100μl的dh5α感受态细胞中加入连接反应得到的10μl重组质粒,依次将感受态细胞置于冰上30min、42℃水浴45s、冰上2min后加入900μl无抗lb培养基于37℃震荡培养1h后涂布于含有kan抗性的lb平板上培养8h,挑取单菌落进行菌落pcr验证;
[0084]
表2.3 multis连接体系组分
[0085][0086]
(4)、验证正确的重组大肠杆菌在37℃震荡培养12h;后提取质粒,进行测序验证,质粒命名为pxbthg-1a-red,其结构如图3所示;
[0087]
(5)、向100μl的农杆菌感受态细胞中加入10μl重组质粒pxbthg-1a-red,依次将感受态细胞置于冰上30min、液氮2min、42℃水浴45s、冰上2min后加入700μl无抗lb培养基于28℃震荡培养2h后涂布于含有卡那霉素和利福平抗性的lb平板上培养3天;
[0088]
(6)、挑取单菌落于含有卡那霉素和利福平的lb培养基中28℃震荡培养5天,转接到无抗的im液体培养基中于28℃培养至od600为0.8-1.2。用0.02%吐温80刮下新鲜培养的ku70孢子与农杆菌菌液1:1体积混合后涂布在无抗的im固体培养基中,25℃培养24h后用0.02%吐温80刮下后转涂到含有潮霉素和头孢噻肟的pda平板上28℃培养7天,如图5所示,挑取平板上转化子,提取基因组进行pcr验证结果如图6所示;挑取三个转化子进行测序验证,命名为ncel1a-1,ncel1a-2和ncel1a-3。
[0089]
实施例3原位表达重组菌株ncel1a-1荧光共聚焦观察:
[0090]
(1)、将原位表达重组菌株ncel1a在sdb培养基中进行活化培养,28℃震荡96h;
[0091]
(2)、将活化后的菌液转接到以纤维素为碳源的tmm(1l:硫酸铵4g,磷酸二氢钾6.5g,酵母提取物0.25g,蛋白胨0.75g,马来酸11.6g,吐温80 0.186ml,母液1ml,50%尿素2ml,30%氯化钙2ml,10%硫酸镁4ml,ph=5.8)培养基中发酵,28℃震荡培养120h;
[0092]
(3)、将重组菌株ncel1a的菌丝滴到载玻片上,用盖玻片覆盖;
[0093]
(4)、在具有100
×
1.4na油浸物镜的倒置共聚焦激光扫描显微镜sp8(leica,germany)上观察(见图7);
[0094]
(5)、红色荧光蛋白dsred激发波长为552nm,发射波长为570-700nm;
[0095]
结果如图5所示;在荧光共聚焦显微镜下能够看到清晰的红色荧光,主要是再液泡中,表明cel1a在胞内主要分布在液泡中,表明本发明所开发的原位表达烦可以用来观察蛋白在细胞内的亚细胞器定位和分布。
[0096]
实施例4通过酶标仪检测原位表达重组菌株ncel1a的cel1a蛋白分泌水平:
[0097]
采用和实施例4中相同的方法培养原位表达菌株,120h和168h取样13000rpm离心30min取上清液,加入96孔板中;
[0098]
利用荧光酶标仪检测样品的荧光强度;激发波长为540nm激发,发射波长为650nm;结果如图8所示;三株重组菌株的胞外荧光远远高于ku70对照组,表明cel1a蛋白分泌到胞外,为分泌蛋白;同时,还可以通过胞外荧光强度定量分析cel1a蛋白的分泌水平。
[0099]
最后,本发明中所述实施例仅用以说明本发明实施例的原则;其他的变形也可能属于本发明的范围;因此,本发明实施例的替代配置可视为与本发明的教导一致;相应地,本发明的实施例不限于本发明明确介绍和描述的实施例。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。