1.本发明,尤其涉及,使用包含胆汁酸螯合剂的胃滞留口服剂型来治疗例如gerd的方法。
背景技术:
2.当胆汁从小肠向上(回流)进入胃部然后进入食道时,就会发生胆汁反流。当将食道和胃隔离的食管下括约肌(les)发生故障时,胆汁酸会回流到食道。
3.许多疾病和/或症状只与胆汁反流有关,或与胆汁反流和胃酸倒流的结合有关;其中,这些疾病和/或症状包括胃食管反流疾病或gerd,胃灼热,不消化,消化不良,糜烂性食管炎,消化性溃疡,胃溃疡,食道溃疡,食道炎,喉炎,咽炎,声音粗糙或嘶哑,与gerd相关的肺功能障碍(例如咳嗽和/或哮喘),巴雷特食管,食道癌(例如腺癌)和胃炎。
4.gerd是通用术语,其包含具有各种消化系统症状的疾病,例如胃灼热,反酸,活力阻碍,吞咽困难,胸痛,渗透感以及其它由食管反流和胃内容物、十二指肠液、胰液等等的滞留引起的类似的感觉。该术语既包括在内窥镜下观察到糜烂和溃疡的反流性食管炎,也包括在内窥镜下未观察到异常的食道反流型非溃疡性消化不良(nud)。当les不能正常关闭并且胃内容物漏回或回流到食道时,就会发生gerd。
5.当前,用于治疗gerd和上消化道疾病的主要疗法包括降低胃酸度的药物,例如通过使用组胺h2受体阻滞剂或质子泵抑制剂(ppi)。h2阻滞剂是抑制胃酸产生的药物。ppi通过抑制负责从这些细胞分泌酸的壁细胞h
/k
atpase质子泵起作用。ppi,比如奥美拉唑及其药学上可接受的盐,公开于例如ep 05129,ep 124495和美国专利no.4255431。尽管有一定功效,ppi仍具有明显的局限性。一些gerd患者对ppi治疗没有完全反应。
技术实现要素:
6.本发明提供了一种在不完全响应质子泵抑制剂(ppi)的有症状性gerd的人类患者中减轻胃食管反流疾病(gerd)的一种或多种症状的方法,该方法包括向患者施用治疗有效量的肠溶性胃滞留口服剂型,该口服剂型以胆汁酸螯合剂片剂形式分散在聚合物基质中。该聚合物基质包含或基本上由聚(烯烃基)氧化物和在某些实施例中的一种或多种填充剂或压缩剂组成;该填充剂或压缩剂选自微晶纤维素,丁基化羟基甲苯,二氧化硅胶体,乳糖,淀粉,麦芽糖糊精,硬脂酸镁,双乙酰化单甘油酯,羟丙甲纤维素和磷酸氢钙。该片剂用肠溶包衣,以延长胆汁酸螯合剂在患者胃中的滞留时间(在某些实施例中,胆汁酸螯合剂的剂量为500mg,700mg,750mg,1000mg,1400mg,1500mg,2100mg或更高;在某些其它实施例中,患者每天服用两次),并施用包含ppi的药物组合物;其中一些患者有一种或多种gerd症状的有临床意义的减轻。
7.另一方面,本发明提供了片剂形式的肠溶衣的胃滞留口服剂型,其包含:分散在聚合物基质中的考来维仑或盐酸考来维仑,所述聚合物基质包含或基本上由聚(亚烷基)氧化物组成,并且在某些实施例中的一种或多种填充剂或压缩剂组成,该填充剂或压缩剂选自
微晶纤维素,丁基化羟基甲苯,二氧化硅胶体,乳糖,淀粉,麦芽糖糊精,硬脂酸镁,双乙酰化单甘油酯,羟丙甲纤维素和磷酸氢钙。该片剂采用肠溶包衣,以延长胆汁酸螯合剂在胃中的滞留时间。
8.实施例1根据本发明的第一方面,提供了一种减轻不完全响应质子泵抑制剂(ppi)的有症状性gerd的患者胃食管反流疾病(gerd)的一种或多种症状的方法,该方法包括向患者施用治疗有效量的肠溶性胃滞留口服剂型,该口服剂型以胆汁酸螯合剂片剂形式分散在聚合物基质中。该聚合物基质本质上由聚环氧乙烷cas#25322-68-3和一种或多种填充剂或压缩剂组成。其中,聚环氧乙烷的大致分子量为300000(peg-7m)(polyox
tm
wsr n-750);填充剂或压缩剂选自微晶纤维素,丁基化羟基甲苯,二氧化硅胶体,乳糖,淀粉,麦芽糖糊精,硬脂酸镁,双乙酰化单甘油酯,羟丙甲纤维素和磷酸氢钙。其中片剂具有片剂核,采用肠溶包衣,以延长胆汁酸螯合剂在胃中的滞留时间,并施用包含ppi的药物组合物;其中一些患者有一种或多种gerd症状的有临床意义的减轻。
9.实施例2根据实施例1中的方法,其中胆汁酸螯合剂为考来维仑或盐酸考来维仑。
10.实施例3根据实施例1或实施例2中的方法,其中胆汁酸螯合剂为盐酸考来维仑。
11.实施例4根据实施例1-3任一中的方法,其中患者被施以剂量为500mg,700mg,750mg,1000mg,1400mg,1500mg,2100mg或更高的胆汁酸螯合剂,每天两次。
12.实施例5根据实施例1-4任一中的方法,其中患者被施以剂量为1500mg的胆汁酸螯合剂,每天两次。
13.实施例6根据实施例1-5任一中的方法,其中剂量为1500mg,每天两次。
14.实施例7根据实施例1-6任一中的方法,其中1500mg的剂量以2片,每片含有750mg的胆汁酸螯合剂的形式给药或以3片,每片具有500mg的胆汁酸螯合剂的形式给药,每天两次。
15.实施例8根据实施例1-7任一中的方法,其中1500mg的剂量以2片,每片含有750mg的胆汁酸螯合剂的形式给药,每天两次。
16.实施例9根据实施例1-7任一中的方法,其中1500mg的剂量以3片,每片具有500mg的胆汁酸螯合剂的形式给药,每天两次。
17.实施例10根据实施例1-9任一中的方法,其中在施用上述以胆汁酸螯合剂片剂的形式的肠溶包衣的胃滞留性口服剂型之前,患者对其它治疗没有完全反应,包括单独每日使用最佳的标准剂量的ppi进行治疗至少8周。
18.实施例11根据实施例1-10任一中的方法,其中患者患有糜烂性食管炎。
19.实施例12根据实施例11的方法,其中,患者有糜烂性食管食管胃十二指肠镜检测(egd)的检查和通过与患者食道相连的无导管的胶囊式ph监测系统对ph值进行约48至96小时的监测。
20.实施例13根据实施例11或12的方法,其中,患者可通过egd的检查和通过与患者食道相连的无导管的胶囊式ph监测系统对ph值进行约48至96小时的监测,发现病理性胃酸反流。
21.实施例14根据实施例1-13任一中的方法,其中以胆汁酸螯合剂片剂的形式的肠溶包衣的胃滞留性口服剂型给药8周(8个治疗周)或者更长时间。
22.实施例15根据实施例1-14任一中的方法,其中,与基线相比,患者每周的胃灼热严
重程度评分达到了有临床意义的减少。
23.实施例16根据实施例1-15任一中的方法,其中,与基线相比,在8个治疗周中的至少4周(包括最近2周中的至少1周)中,患者每周的胃灼热严重程度评分达到了有临床意义的至少30%的减少。
24.实施例17根据实施例1-16任一中的方法,其中,与基线相比,在8个治疗周中的至少4周(包括最近2周中的至少1周)中,患者每周的胃灼热严重程度评分达到了有临床意义的至少45%的减少。
25.实施例18根据实施例1-17任一中的方法,其中,与基线相比,患者的每周反流频率评分(wrfs)达到了有临床意义的减少。
26.实施例19根据实施例1-18任一中的方法,其中,与基线相比,在8个治疗周中的至少4个星期(包括最近2周中的至少1周)中,患者的每周反流频率评分(wrfs)达到了有临床意义的至少30%的减少。
27.实施例20根据实施例1-19任一中的方法,其中,与基线相比,在8个治疗周中的至少4个星期(包括最近2周中的至少1周)中,患者的每周反流频率评分(wrfs)达到了有临床意义的至少45%的减少。
28.实施例21根据实施例1-20任一中的方法,其中剂型滞留在胃中直至其基本上或完全分解。
29.实施例22根据实施例1-21任一中的方法,其中肠溶包衣的胃滞留性口服剂型还包括至少约占片剂核重量的0.06wt%的丁基化羟基甲苯。
30.本发明的另一个方面提供了一种减轻不完全响应质子泵抑制剂(ppi)的有症状性gerd的患者胃食管反流疾病(gerd)的一种或多种症状的方法。该方法包括向患者施用治疗有效量的肠溶性胃滞留口服剂型,该口服剂型以考来维仑或盐酸考来维仑片剂形式分散在聚合物基质中。该聚合物基质本质上由peg-7m(聚环氧乙烷cas#25322-68-3,大致分子量为300000(polyox
tm
wsr n-750))和一种或多种填充剂或压缩剂组成。填充剂或压缩剂选自微晶纤维素,丁基化羟基甲苯,二氧化硅胶体,乳糖,淀粉,麦芽糖糊精,硬脂酸镁,双乙酰化单甘油酯,羟丙甲纤维素和磷酸氢钙。其中片剂具有片剂核,并包被有聚乙烯醇基肠溶包衣,以延长胆汁酸螯合剂在每天两次服用1500mg剂量患者的胃中的滞留时间。其中,在施用上述以胆汁酸螯合剂片剂的形式的肠溶包衣的胃滞留性口服剂型之前,患有糜烂性食管炎的患者对其它治疗没有完全反应,包括单独每日使用最佳的标准剂量的ppi进行治疗至少8周。其中,以胆汁酸螯合剂片剂形式的肠溶包衣的胃滞留性口服剂型给药8周(8个治疗周)。其中剂型保留在胃中直至其基本上或完全分解。与基线相比,患者每周的临床烧伤严重程度评分达到了有临床意义的减少。与基线相比,患者的每周反流频率评分(wrfs)达到了有临床意义的减少。
31.实施例23根据实施例23,其中,与基线相比,在8个治疗周中的至少4周(包括最近2周中的至少1周)中,患者每周的胃灼热严重程度评分达到了有临床意义的至少30%的减少。
32.实施例24根据实施例23-24的方法,其中,与基线相比,在8个治疗周中的至少4周(包括最近2周中的至少1周)中,患者每周的胃灼热严重程度评分达到了有临床意义的至少45%的减少。
33.实施例25根据实施例23-25任一中的方法,其中,与基线相比,在8个治疗周中的至少4个星期(包括最近2周中的至少1周)中,患者的每周反流频率评分(wrfs)达到了有临床意义的至少30%的减少。
34.实施例26根据实施例23-26任一中的方法,其中,与基线相比,在8个治疗周中的至少4个星期(包括最近2周中的至少1周)中,患者的每周反流频率评分(wrfs)达到了有临床意义的至少45%的减少。
35.根据实施例23-27任一中的方法,其中,肠溶包衣的胃滞留性口服剂型还包括至少约占片剂核重量的0.06wt%的丁基化羟基甲苯。
36.实施例27本发明的其它方面还提供了片剂形式的肠溶包衣的胃滞留性口服剂型。该剂型包括溶解在聚合物基质中的考来维仑或盐酸考来维仑。该聚合物基质本质上由peg-7m(聚环氧乙烷cas#25322-68-3,大致分子量为300000(polyox
tm
wsr n-750))和一种或多种填充剂或压缩剂组成。填充剂或压缩剂选自微晶纤维素,丁基化羟基甲苯,二氧化硅胶体,乳糖,淀粉,麦芽糖糊精,硬脂酸镁,双乙酰化单甘油酯,羟丙甲纤维素和磷酸氢钙。其中片剂具有片剂核心,并且采用肠溶包衣,以延长胆汁酸螯合剂在胃中的滞留时间。
37.实施例28实施例28中的剂型,其中,该剂型用于在胃中长期滞留直至其基本上或完全分解。
38.实施例29实施例28或29中的剂型,其中,所述一种或多种填充剂或压缩剂为含量占所述片剂核大约1-10w/w%的微晶纤维素,含量占所述片剂核大约0.01-0.10w/w%的丁基化羟基甲苯,含量占所述片剂核大约1-5w/w%的二氧化硅胶体,含量占所述片剂核大约0.1-1.0w/w%的硬脂酸镁。
39.实施例30实施例28-30任一中的剂型,其中,所述肠溶包衣为聚乙烯醇基肠溶包衣。
40.实施例31实施例31中的剂型,其中,所述肠溶包衣为聚乙烯醇基肠溶包衣。
41.实施例32实施例28-32任一中的剂型,其中,肠溶包衣为占所述片剂核大约1-5w/w%的聚乙烯醇基肠溶包衣。
42.实施例33实施例28-33任一中的剂型,其中,所述peg-7m大约占所述片剂核的30-60w/w%。
43.实施例34实施例28-34任一中的剂型,其中,所述peg-7m大约占所述片剂核的46w/w%。
44.实施例35实施例28-35任一中的剂型,其中,肠溶包衣为占所述片剂核大约3w/w%的聚乙烯醇基肠溶包衣。
45.实施例36实施例28-36任一中的剂型,其中,所述一种或多种填充剂或压缩剂为含量占所述片剂核大约5.4w/w%的微晶纤维素,含量占所述片剂核大约0.06w/w%的丁基化羟基甲苯,含量占所述片剂核大约2.0w/w%的二氧化硅胶体,含量占所述片剂核大约0.5w/w%的硬脂酸镁。
46.实施例26-35任一中的剂型,其中,所述肠溶包衣的胃滞留性口服剂型还包括至少占所述片剂核心约0.06wt%的丁基化羟基甲苯。
47.实施例37在本发明的另一方面,提供了药物组合物。该药物包含实施例28-37中任一种的胃滞留口服剂型。
48.实施例38实施例38的所述药物组合物还包括另一种治疗剂。
49.实施例39在本发明的又一方面,提供了一种治疗包括胃灼热、不消化、消化不良、糜烂性食管炎、消化性溃疡、胃溃疡、食道溃疡、食道炎、喉炎、咽炎、声音粗糙、胃食管反流疾病(gerd)、巴雷特食管、胃癌、食道癌(例如腺癌)、胃炎和gerd相关的肺功能障碍、以及对质子泵抑制剂没有完全反应的症状性gerd的方法,包括对有需要的治疗者施用有效量的实施例28-38任一中的胃滞留性口服剂型或实施例39或实施例40的药物组合物。
50.实施例40实施例40中的方法,其中,所述疾病为胃食管反流疾病(gerd)。
51.实施例41实施例40中的方法,其中,所述疾病为对质子泵抑制剂没有完全反应的症状性gerd。
52.实施例42实施例40中的方法,其中,所述疾病为对质子泵抑制剂没有完全反应的症状性gerd,所述方法包括施用有效量的实施例38中的药物组合物。
53.实施例43在本发明的另一方面,提供了一种治疗/预防与胆汁酸反流相关的体征和/或症状的方法,该方法包括向患者施用治疗有效量的肠溶性胃滞留口服剂型,该口服剂型以胆汁酸螯合剂片剂形式分散在聚合物基质中。该聚合物基质包含或基本上由聚(烯烃基)氧化物和在某些实施例中的一种或多种填充剂或压缩剂组成;该填充剂或压缩剂选自微晶纤维素,丁基化羟基甲苯,二氧化硅胶体,乳糖,淀粉,麦芽糖糊精,硬脂酸镁,双乙酰化单甘油酯,羟丙甲纤维素和磷酸氢钙。该片剂采用肠溶包衣,以延长胆汁酸螯合剂在胃中的滞留时间,其量可有效改善、减轻、缓解、减少、延迟和/或缓和与胆汁酸反流有关的一种或多种体征和/或症状。
54.实施例44实施例44中的方法,其中,所述胆汁酸螯合剂是考来维仑或盐酸考来维仑。
55.实施例45实施例44或45中的方法,其中,所述剂型滞留在胃中直至其基本上或完全分解。
附图说明
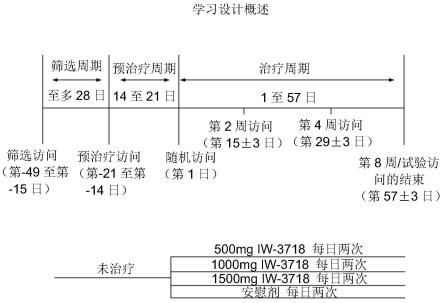
56.图1显示了功效研究设计的示意图(请参见示例1);
57.图2-图4显示第8周(mitt人群)whss的基线变化百分比的结果;*p值为0.04;locf为结转的最后观察结果(图2)(n范围为68-71);mmrm=混合模型重复测量(图3)(n范围为61-66);oc为观察到的情况(图4)(n范围为61-66);每周胃灼热严重度评分(whss)定义为每日胃灼热严重度评分(dhss)的每周平均值;dhss定义为用mresq-ed收集的特定一天中测量到的3次胃灼热严重度评分的最大值;*p值基于ancova模型中与安慰剂的成对比较,其中治疗组和食道炎的固定作用条件为基线,基线值为共同变量;采用线性对比表,t检验中p=0.0225;pbo为安慰剂。
58.图5(locf)-图6(mmrm)显示第8周whss每周相对基线的变化百分比的结果;第8周的差异:1500mg iw-3718与安慰剂相比,locf为11.9%,mmrm为9.4%;locf为结转的最后观察;mmrm为混合模型重复测量值;每周胃灼热严重度评分(whss)定义为每日胃灼热严重度评分(dhss)的每周平均值;dhss定义为用mresq-ed收集的特定一天中测量到的3次胃灼热严重度评分的最大值;
59.图7显示ee患者whss每周变化百分比的结果(n范围=36-37)(mitt人群;mmrm);第
8周的差异:1500mg iw-3718与安慰剂的比例为12.2%。
60.图8显示基线大于或等于2.5(n范围为36-37)(mitt人群;mmrm)的患者whss每周变化百分比的结果;第8周的差异:1500mg iw-3718与安慰剂(pbo或pbo等)的比值为12.7%;
61.图9显示全部胃灼热反应者百分比(mitt人群)的结果;在8个治疗周中的至少4周(包括最近2周中的至少1周),全部胃灼热反应者的whss降低了至少30%(45%);
62.图10显示ee患者的全部胃灼热反应者百分比(mitt人群)的结果;ee=糜烂性食管炎患者;在8个治疗周中的至少4周(包括最近2周中的至少1周),全部胃灼热反应者的whss降低了至少30%(45%);
63.图11和图13显示第8周时wrfs(基线大于零)的变化百分比(mitt人群;mmrm);1500mg和pbo之间的差异为16.6%(图11)或16.7%(图13);
64.图12和图14显示基线大于或等于2(mitt人群;mmrm)的wrfs变化百分比的结果;1500mg与pbo的差异为7.0%;
65.ee为糜烂性食管炎患者;在8个治疗周中的至少4周(包括最近2周中的至少1周),全部胃灼热反应者的whss降低了至少30%(45%);
66.图15显示ee患者在第8周(mitt人群;mmrm)的wrfs(bl大于0)的每周变化百分比结果(mitt人群;mmrm);mmrm为混合模型重复测量;每周反流频率评分(wrfs)定义为每日反流频率评分(drfs)的每周平均值;drfs定义为用mresq-ed收集的特定一天中测量反流的2次中的最大值;1500mg和pbo之间的差异为23.6%;
67.图16显示全部反流反应者百分比的结果,其中bl》0(mitt人群);在8个治疗周中的至少4周(包括最近2周中的至少1周),全部胃灼热反应者的的wrfs降低了至少30%(45%);
68.图17显示ee患者总反流反应者的程度百分比结果,其中bl》0(mitt人群);
69.图18显示基线大于或等于2(mitt人群)的缓解程度反应者的百分比结果;
70.图19显示缓解程度反应者的(hb,rg,gerd)(mitt人群)百分比结果;gerd为胃食管反流病患者;hb为胃灼热;rg为反流;在8个治疗周中的4周中,缓解程度反应者定义为“显著”或“中度”缓解;
71.图20显示治疗期间夜间醒来的天数比例的结果(mitt人群);^p值为0.0241,是从ancova模型中与安慰剂的成对比较中得出的,其中具有治疗组和食道炎状态的固定效应项以及基线值作为共同变量;
72.图21显示mresq-ed验证结果的概要;bl(基线);w8(第8周);最左边的参考线是中位反应者的变化百分比(-0.65);右参考线是中位反应者的变化百分比(-0.44);
73.图22显示闪烁显像研究设计的示意图;*在研究给药之前,将受试者随机分配到六个早餐序列之一(请参见示例2);请注意,没有0天;
74.图23-图26显示闪烁显像研究的结果:
75.图23显示iw-3718在胃中溶解所需的时间比ir秋水仙胶更长;18位受试者中的16位表明iw-3718片剂滞留在胃中直至完全崩解;胃滞留性(根据文献,标示值):旨在长时间保留在上胃肠道中的剂型,在此期间它们在受控的基础上释放药物。
76.延长的时间(根据文献):通常在进食状态下≥4h被接受;4h(2-6h范围)代表在进食状态下胃内不消化固体的排空;
77.图24显示iw-3718在胃中分解所需的时间比ir秋水仙胶更长;所有受试者的数据
均以图表表示;
78.图25显示与立即释放剂型相比,iw-3718的放射性从胃腔排空所需的时间更长;
79.图26显示与立即释放剂型相比,iw-3718的放射性从胃腔排空所需的时间更长;
80.图27显示iw-3718的完全胃排空要晚于立即释放剂型;
81.图28显示制剂2b比制剂2a更稳定;
82.图29显示制剂2a和2b的稳定性数据;同样制剂2b比制剂2a更稳定;
83.图30显示出bht对于稳定性的重要性;图30a显示了比较的药物释放数据;图30b显示了引物迫使peo降解的研究数据;
[0084]“ls”代表最小二乘。
具体实施方式
[0085]
如本发明所使用的,在名词之前的单词“一个”或“多个”表示一个或多个特定名词。
[0086]
如本发明所用,术语“受试者”和“患者”可互换使用。患者或受试者是人类患者或人类受试者。
[0087]
本发明使用的术语“peg-7m”是指聚氧乙烯cas号25322-68-3,其近似分子量300000(peg-7m)(polyox tm wsr n-750)。术语“polyox
tm
wsr n-750”和“peg-7m”均指聚氧乙烯cas号25322-68-3,分子量约为300000。
[0088]
如本发明所用,“有效治疗”是指产生有益作用,例如改善患者疾病或病症的至少一种症状。
[0089]
术语“有效量”或“治疗有效量”是指提供期望的生物学的、治疗的和/或预防的结果的试剂量。该结果可以是减小,改善,减轻,减少,延迟和/或缓和患者中疾病的一种或多种体征,症状或病因,或者生物系统的任何其它期望的改变。可以一次或多次服用有效量。
[0090]
术语“胃滞留剂型”表示被设计为在上消化道中滞留较长时间(通常至少4小时)的剂型,在此期间它们在受控的基础上释放药物。
[0091]
对于术语“例如”和“诸如”及其语法等同,除非另有明确说明,否则短语“但不限于”应理解为跟随。如本发明所使用的,术语“约”意在解释由于实验误差引起的变化。除非另有明确说明,否则无论是否明确使用术语“大约”,均应理解本发明所报告的所有测量均被术语“大约”修饰。如本发明所使用的,单数形式的“一个”,“一种”和“该”包括复数指示物,除非上下文另外明确指出。
[0092]
除非另有定义,否则本发明中使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同含义。本发明描述了用于本发明的方法和材料。其它,也可以使用本领域已知的合适方法和材料。材料,方法和示例仅是说明性的,而无意于进行限制。本发明提及的所有出版物,专利申请,专利,序列,数据库条目和其它参考文献通过引用整体并入本发明。在有冲突的情况下,以本说明书包括定义为准。
[0093]
与胆汁反流有关的疾病和/或症状
[0094]
上消化道由口腔,一部分喉咙,食道,胃,十二指肠以及小肠的最上部组成。食道通过其肌肉内层的协调收缩将食物,液体和唾液从嘴巴运送到胃。这个过程是自动的。食管的肌肉层通常被称为括约肌的肌肉在上下两端缩合在一起。当一个人吞咽时,括约肌会自动
放松,使食物或饮料从口腔进入胃中。然后,肌肉迅速闭合,以防止吞下的食物或饮料从胃中漏出回到食道或口腔中。这些括约肌使卧倒甚至倒立时都可以吞咽。
[0095]
胆汁反流发生在胆汁(一种在肝脏中产生的消化液)从小肠向上(回流)进入胃然后进入食道时发生。胆汁反流常伴有酸反流,它们一起可能导致食道内膜发炎,并可能增加食道癌的风险。参见ajg(1999)94(12):3649-3650。胆汁反流也可能影响胃部,引起炎症(胃炎,如果不加以治疗可能会导致消化性溃疡)胆汁反流可能很难与酸性反流区分开,因为其体征和症状相似,并且两种情况经常发生在同时。与胃酸反流不同,胆汁反流会使胃发炎,经常引起上腹部的苦痛或灼痛。其它体征和症状可能包括:频繁的胃灼热,即胸部灼热感有时会随着口中的酸味传播到喉咙;恶心;呕吐胆汁;咳嗽;或声音嘶哑。
[0096]
胆汁酸是类固醇酸,主要存在于哺乳动物的胆汁中。它们在肝脏中通过胆固醇的氧化而产生,并被储存在胆囊中并以盐的形式分泌到肠中。它们充当表面活性剂,乳化脂质,并协助饮食脂肪和胆固醇的吸收和消化。
[0097]
主要的胆汁酸是:胆酸,鹅去氧胆酸,脱氧胆酸,牛磺胆酸和甘胆酸。不同胆汁酸之间的化学区别很小,仅取决于3、7和12位上是否存在羟基。在人类中,最普遍的胆汁酸是胆酸和鹅去氧胆酸,以及它们与甘胆酸和牛磺酸(甘胆酸盐和牛黄酸盐)的结合物。一些哺乳动物主要合成脱氧胆酸。
[0098]
人体每天合成约800毫克的胆固醇,其中约一半用于胆汁酸的合成,每天总共约有20-30克胆汁酸被分泌到肠道中,大约90%的排泄胆汁酸被重新吸收(通过回肠中的主动转运)并循环利用。由于胆汁酸是由内源性胆固醇制成的,因此胆汁酸的肝肠循环可能会受到干扰,从而降低胆固醇。这是施用胆汁酸螯合剂的通常治疗原理。
[0099]
尽管胆汁酸在消化过程中起重要作用,但是在胃和食道中胆汁酸的长期存在或过量可导致对局部组织的毒性作用。十二指肠胃食管反流(dger)含有胆汁酸,被认为会产生诸如胸骨后疼痛,胃灼热,恶心和呕吐等症状,并且与患有胃食管反流病(gerd)和barrett食管的患者的更为严重的食管病理有关,食道癌变。
[0100]
胆汁反流和胆汁酸反流可严重破坏食道组织,因为食道与胃不同,缺乏粘稠的粘液粘膜以保护其免受胃酸的腐蚀作用。尽管胆汁反流可单独损害食管(即使反流的ph值为中性或碱性),但胆汁和胆汁酸反流的结合似乎特别有害,增加了并发症的风险。
[0101]
当胆汁酸回流到喉咙中时,会产生其它症状。喉咙靠近食道,仅由会厌分隔,这是一个将食道与气管(气管)分开并防止向肺部吸入食物或饮料的皮瓣。
[0102]
许多疾病和/或症状只与胆汁反流有关,或与胆汁反流和胃酸倒流的结合有关;其中,这些疾病和/或症状包括胃食管反流疾病或gerd,胃灼热,不消化,消化不良,糜烂性食管炎,消化性溃疡,胃溃疡,食道溃疡,食道炎,喉炎,咽炎,声音粗糙或嘶哑,与gerd相关的肺功能障碍(例如咳嗽和/或哮喘),巴雷特食管,食道癌(例如腺癌)和胃炎。
[0103]
gerd是通用术语,其包含具有各种消化系统症状的疾病,例如胃灼热,反酸,活力阻碍,吞咽困难,胸痛,渗透感以及其它由食管反流和胃内容物、十二指肠液、胰液等等的滞留引起的类似的感觉。该术语既包括在内窥镜下观察到糜烂和溃疡的反流性食管炎,也包括在内窥镜下未观察到异常的食道反流型非溃疡性消化不良(nud)。当les不能正常关闭并且胃内容物漏回或回流到食道时,就会发生gerd。持续性gerd患者是对ppi无应答的患者。
[0104]
食管裂孔疝可能导致gerd,并且可以发生在任何年龄的人中。可能导致gerd的其
它因素包括但不限于饮酒,超重,怀孕,吸烟,zollinger-ellison综合征,高钙血症和硬皮病。而且,某些食物可能与反流事件相关,包括柑橘类水果,巧克力,咖啡因饮料,脂肪和油炸食物,大蒜和洋葱,薄荷调味料,辛辣食物和番茄食物,例如意大利面条酱,辣椒和比萨。
[0105]
食道的内粘膜内有沿纵向折叠排列的未角质化的分层鳞状上皮细胞。食管内膜的损伤会导致食管内壁的正常鳞状细胞转变为一种通常在人类中不常见的细胞,称为特殊柱状细胞。通过酸回流发生的食道细胞的转化被称为巴雷特食管。尽管没有胃灼热的人可以患有巴雷特食管,但在这种情况下,这种食管的发病率是三至五倍。巴雷特的食道本身不会引起症状,而仅是因为它似乎早于一种特殊的癌症-食道腺癌的发展,才很重要。患有巴雷特食管的人患腺癌的风险要比不患有巴雷特食管的人高30至125倍。白人男性的这类癌症正在迅速增加。这种增加可能与肥胖症和gerd的增加有关。
[0106]
巴雷特食管不能治愈,不能通过手术去除食道,这是危急的手术。建议仅对罹患癌症或已经患癌症的人进行手术。大多数医生建议用抗酸药物治疗gerd,因为这有时与巴特雷组织范围的增加有关。但是,尚未证明这种方法可以降低患癌症的风险。用外科手术治疗gerd的反流似乎也不能治愈巴雷特食管。几种不同的实验方法正在研究中。人们试图通过内窥镜通过加热或其它方式破坏巴雷特的组织是否可以消除这种状况。但是,这种方法具有潜在的风险和未知的效果。
[0107]
食道癌几乎可以发生在沿食道长度的任何地方,但是它通常始于最接近胃的腺细胞(腺癌)。由于食管癌可能要等到晚期才能被诊断出来,因此该病患者的治疗前景通常较差。长期对食管的刺激,例如长期吸烟、大量饮酒和巴雷特食管炎,会增加食道癌的风险。因此,食道癌与胆汁反流和胆汁酸反流之间存在联系。在动物模型中,仅胆汁反流已显示会引起食道癌。
[0108]
与胆汁酸反流不同,胆汁反流通常不能通过饮食或生活方式的改变来控制。取而代之的是,胆汁反流通常通过某些药物或在严重的情况下通过手术来控制。两种方案均不能一致有效,有些人甚至在治疗后仍会继续出现胆汁反流。
[0109]
许多药物用于治疗胃灼热和消化不良。目前,用于治疗gerd和上消化道疾病的主要疗法包括用于降低胃酸度的药物,例如通过使用组胺h 2受体拮抗剂或质子泵抑制剂(ppi)。h2阻滞剂是抑制胃酸产生的药物。例如,组胺h 2受体拮抗剂例如西咪替丁(以商标名gagamet出售),法莫替丁(以商标名出售),尼扎替丁(以商标名出售)和雷尼替丁(以商标名出售)。两种药物都可有效治疗因酸反流引起的胃灼热,并且通常可在短时间内消除症状。
[0110]
ppi通过抑制负责从这些细胞分泌胆汁酸的壁细胞h
/k
atp酶质子泵起作用。ppi,例如奥美拉唑及其药学上可接受的盐公开于例如ep 05129,ep 124495和美国专利no.4255431。ppi尽管有充分记载的功效,但仍有明显的局限性。例如,对单独使用ppi抑制剂治疗无反应的患者可能无应答,因为即使ppi减少了胃酸反流,十二指肠的胆汁酸仍然存在。另外,一些gerd患者不能完全应答。
[0111]
gerd是一种慢性和常见的医学病症,在西方国家中其患病率估计为约20%至40%,并且与医疗保健利用率和成本上升相关。目前,质子泵抑制剂(ppi)是gerd的标准治疗方法。然而,据估计,大约10%至40%的gerd患者在标准剂量的ppi治疗中仍保持症状。dger被认为是尽管使用ppi进行治疗仍持续出现令人讨厌的gerd症状的患者的症状不完全
反应的潜在原因。
[0112]
胆汁酸螯合剂
[0113]
胆汁酸螯合剂包括,例如,消胆胺(比如胆汁酸螯合剂包括,例如,消胆胺(比如ca注册号11041-12-6),考来维仑(比如ca注册号182815-43)。-6和182815-44-7),selevamer和降胆宁(比如ca注册号50925-79-6和37296-80-3),或其任何药学上可接受的盐或它们的混合物。
[0114]
考来维仑或盐酸考来维仑(在本发明中可以统称为考来维仑)是与胃肠道中的胆汁酸结合的口服、不吸收、不易消化的聚合物。考来维仑于2000年在美国获得批准,成为welchol
tm
的活性成分,并被认为是饮食和运动的辅助剂,可减少原发性高脂血症成年人体内低密度脂蛋白胆固醇(ldl-c)的升高。目前,考来维仑仅以速释制剂形式提供。考来维仑不被系统吸收,也不干扰系统性药物代谢酶。考来维仑的分布仅限于胃肠道,并且通过粪便排泄而消除。
[0115]
γ闪烁显像
[0116]
γ闪烁显像技术于1976年首次用于研究药物制剂的体内释放特性,从那时起,它已成为评估药物剂型gi性能的越来越有用的手段。wilding ir et al.adv drug del rev 2001;46:103
–
124.
[0117]
γ闪烁显像技术已用于药物递送系统的开发和评估,包括肠溶片和复杂控释制剂。wilding ir.j clin pharm 2002;42:1200
–
1210.dobson cl et al.int j pharm 2002;248:61
–
70.cole et al.,int j pharm 2002;231:83
–
95.该技术提供有关制剂沉积,分散和移动的信息。通常,将这种闪烁显像成像与血液或尿液中药物浓度的测定相结合,以提供有关体内释放和吸收部位的信息(称为药物显像)。connor al et al.eur j pharm sci 2001;13:369
–
374.由于考来维仑不能被吸收,因此无需抽取血液样本来测定药物浓度。
[0118]
常用于γ闪烁显像研究的放射性核苷酸包括锝-99m(
99m
tc)和铟-111(
111
in),它们都是短寿命的放射性核苷酸,临床上用于核医学和研究。在下面的实施例2中,使用
99m
tc和
111
in分别标记立即释放的考来维仑和iw-3718(本发明详述),以允许通过闪烁显像来评估制剂的体内表现。
[0119]
尽管γ闪烁显像技术未设计成提供解剖学细节(特别是小肠的解剖学细节),这些图像确实可以识别胃中的剂型及其随后的胃排空,以及确定其到达盲肠。因此,可以测量剂型的各种胃肠道转运时间。先前的研究表明,正常受试者的胃排空时间范围从液体餐40分钟到固体餐85分钟。在健康的年轻成年男性中,发现胶囊和片剂平均在摄入后20至30小时内通过结肠。胃肠道的总转运时间是可变的,并受食物摄入,饮食和疾病的影响,范围为1到60多个小时。
[0120]
方法
[0121]
在某些方面,本发明提供了一种在不完全响应质子泵抑制剂(ppi)的有症状性gerd的人类患者中减轻胃食管反流疾病(gerd)的一种或多种症状的方法。该方法包括向患者施用治疗有效量的肠溶性胃滞留口服剂型,该口服剂型以胆汁酸螯合剂片剂形式分散在聚合物基质中。该聚合物基质包含或基本上由聚(烯烃基)氧化物和在某些实施例中的一种
或多种填充剂或压缩剂组成;该填充剂或压缩剂选自微晶纤维素,丁基化羟基甲苯,二氧化硅胶体,乳糖,淀粉,麦芽糖糊精,硬脂酸镁,双乙酰化单甘油酯,羟丙甲纤维素和磷酸氢钙中一种或多种。其中片剂具有片剂核心,并且采用肠溶包衣,在某些实施例中是聚乙烯醇基肠溶包衣(例如ii 85f),以延长胆汁酸螯合剂在患者(在某些实施例中,每天两次服用剂量为500mg,700mg,750mg,1000mg,1400mg,1500mg,2100mg或更高的胆汁酸螯合剂)胃中的滞留时间;在一些实施例中,该方法还包括施用包括ppi的药物组合物;在一些实施例中,患者有一种或多种gerd症状的有临床意义的减轻。
[0122]
在某些实施例中,将胆汁酸螯合剂以500mg,700mg,750mg,1000mg,1400mg,1500mg,2000mg,2100mg或更高的剂量给予患者。在一些实施例中,将胆汁酸螯合剂以每天一次,每天两次或每天3次的剂量施用于患者。在某些实施例中,胆汁酸螯合剂以500mg每片的片剂形式每天两次给予患者,一次三片。
[0123]
在另一方面,本发明提供了一种在不完全响应质子泵抑制剂(ppi)的有症状性gerd人类患者中减轻胃食管反流疾病(gerd)的一种或多种症状的方法,该方法包括向患者施用治疗有效量的肠溶性胃滞留口服剂型,该口服剂型以胆汁酸螯合剂片剂形式分散在聚合物基质中。该聚合物基质本质上由聚氧乙烯cas#25322-68-3和一种或多种填充剂或压缩剂组成;其中聚环氧乙烷的大致分子量为300000polyox
tm wsr n-750(inci名称为peg-7m)。在某些实施例中,填充剂或压缩剂选自微晶纤维素,乳糖,淀粉,麦芽糖糊精和磷酸氢钙,其中上述片剂具有片剂核心,并且采用肠溶包衣,以延长胆汁酸螯合剂在每天两次服用1500mg剂量患者的胃中的滞留时间。其中,在施用上述以胆汁酸螯合剂片剂的形式的肠溶包衣的胃滞留性口服剂型之前,患有糜烂性食管炎的患者对其它治疗没有完全反应,包括单独每日使用最佳的标准剂量的ppi进行治疗至少8周。其中,以胆汁酸螯合剂片剂的形式的肠溶包衣的胃滞留性口服剂型给药8周(8个治疗周)或者更多。其中剂型保留在胃中直至其基本上或完全分解。
[0124]
在某些方面,本发明介绍的方法包括将以胆汁酸螯合剂片剂的形式的肠溶包衣的胃滞留性口服剂型以有效改善、减轻、缓解、减少、延迟和/或缓和与胆汁酸反流有关的一种或多种体征和/或症状的剂量施用于患者。这样的有效量可以在单剂量之后或更通常在至少一周的治疗之后,更通常在至少两周的治疗之后测量。
[0125]
在某些实施例中,以胆汁酸螯合剂片剂的形式的肠溶包衣的胃滞留性口服剂型(在本技术中也称为组合物,制剂,剂型,片剂等)以能够使患者每周的胃灼热严重程度评分减少至少30%的量施用于患者。在其它实施例中,以有效降低whss至少45%,例如至少50%、至少55%、至少60%、至少65%或更多的量的的组合物施用于受试者。
[0126]
在其它实施例中,以胆汁酸螯合剂片剂的形式的肠溶包衣的胃滞留性口服剂型以能够使患者的每周反流频率评分(wrfs)减少至少30%的量施用于患者。在其它实施例中,以有效降低whss至少45%,例如至少50%、至少55%、至少60%、至少65%或更多的量的组合物施用于受试者。
[0127]
在其它实施例中,以胆汁酸螯合剂片剂的形式的肠溶包衣的胃滞留性口服剂型以能够使患者饭后2小时后测量的唾液总胆汁酸水平降低至少10%的量施用于患者。在其它实施例中,当与患者服用该组合物之前的唾液总胆汁酸水平相比,以有效降低饭后2小时后测量的唾液总胆汁酸水平至少15%,例如至少20%、至少30%、至少40%、至少50%或更多
的量的组合物施用于受试者。
[0128]
在其它实施例中,以胆汁酸螯合剂片剂的形式的肠溶包衣的胃滞留性口服剂型以能够使患者饭后2小时后测量的唾液总胆汁酸水平降低至200μmol/l或者更低的量施用于患者。在其它实施例中,以有效降低饭后2小时后测量的唾液总胆汁酸水平至等于或低于150μmol/l,例如等于或低于100μmol/l、等于或低于75μmol/l、等于或低于50μmol/l或者更低的量的组合物施用于受试者。
[0129]
在某些实施例中,胆汁酸螯合剂是考来维仑或盐酸考来维仑。所述考来维仑或盐酸考来维仑可以从合适的来源获得,也可以是dsm或formosa。
[0130]
在某些实施例中,用于延长胆汁酸螯合剂在患者胃中滞留时间的以片剂形式的肠溶包衣的胃滞留性口服剂型的每个剂量为500mg、700mg、750mg、1000mg、1400mg、1500mg、2000mg、2100mg或更多。在某些其它实施例中,该剂量每天给药两次。剂量可以是发明公开的几种剂型(片剂)或仅一种。在某些实施例中,每天两次向患者施用两片。在其它实施例中,每天两次向患者施用三片。
[0131]
在某些实施例中,该聚合物基质的成分是至少一种亲水的、水溶胀的、易蚀的或可溶的聚合物,其通常可被描述为“渗透聚合物”,“水凝胶”或“水溶胀性”聚合物。多于一种这样的聚合物可以与本发明的剂型结合以达到胃滞留以及期望的侵蚀率。
[0132]
适用于本发明方法中的为实现期望的滞留性和持续释放特性的剂型的聚合物由于从胃液吸收水而具有溶胀的特性,并在数小时的时间内逐渐侵蚀。由于聚合物的侵蚀是由流体与剂型表面的相互作用引起的,因此侵蚀在溶胀过程中或多或少地开始。虽然侵蚀和溶胀可能同时发生,但达到最大溶胀的速率应比剂型完全溶蚀以获得所需释放曲线的速率更快。这样的聚合物可以是线性的,支链的或交联的。聚合物可以是均聚物或共聚物。
[0133]
在一些实施例中,聚合物是聚环氧乙烷。在一些实施例中,至少一种或多种亲水性聚合物中是聚环氧乙烷(peo)。在其它实施例中,至少一种亲水聚合物是分子量约为300000d的聚环氧乙烷。
[0134]“聚环氧乙烷”或“peo”是指分子量范围宽的聚环氧乙烷聚合物。peo是未取代的环氧乙烷的线性聚合物,并且具有宽范围的粘均分子量。市售peo及其近似分子量(以g/mol或d为单位)包括但不限于:nf、wsr级凝结剂,分子量约500万;级wsr 301,分子量约为400万;级ws303,分子量约为700万;级wsr n60-k,分子量约为200万;级wsr n-80k,分子量约为200000;聚环氧乙烷cas编号25322-68-3,大约分子量300,000polyox
tm wsr n-750(inci名称:peg-7m),是环氧乙烷的聚合物,大约分子量300000。
[0135]
术语“聚环氧乙烷”和“聚(乙烯)氧化物”在本发明可互换使用。术语“聚烯烃氧化物”和“聚(烯烃)氧化物”在本发明可互换使用。
[0136]
在一些实施例中,聚(乙烯)氧化物在单位剂型中的存在量为片剂核的40wt%至75wt%。在一些实施例中,聚(乙烯)氧化物在单位剂型中的存在量为片剂核的40wt%至60wt%。
[0137]
在一些实施例中,聚(乙烯)氧化物在单位剂型中的存在量为片剂核的45wt%至55wt%。
[0138]
在一些实施例中,聚(乙烯)氧化物在单位剂型中的存在量为片剂核的45wt%至60wt%。
[0139]
在一些实施例中,聚(乙烯)氧化物以单位剂型存在的量为片剂核的40wt%至50wt%。在一些实施例中,聚(乙烯)氧化物以单位剂型存在的量为片剂核的的50wt%至60wt%。在一些实施例中,聚(乙烯)氧化物以单位剂型存在的量为片剂核的的47wt%至53wt%。
[0140]
在某些实施例中,聚(烯烃)氧化物是聚环氧乙烷cas号25322-68-3,大约分子量300000(peg-7m)(polyox
tm wsr n-750)。在某些实施例中,聚(烯烃)氧化物为聚环氧乙烷cas号25322-68-3,分子量约为300000(peg-7m)(polyox
tm wsr n-750),占片剂核重量的30至46至60wt%。上述片剂具有核,该核又被包被成为膜衣片剂。在某些实施例中,聚(烯烃)氧化物具有约300000d的分子量。在某些实施例中,在中等添加水平下,聚(烯烃)氧化物产生的粘度为600至1000。
[0141]
在其它实施例中,该剂型的至少一种亲水聚合物包括纤维素。在某些实施例中,聚合物可以是衍生自乙烯基,丙烯酸酯,甲基丙烯酸酯,氨基甲酸酯,酯和氧化物单体的合成聚合物。在其它实施例中,它们可以是天然存在的聚合物的衍生物,例如多糖(比如几丁质、壳聚糖、右旋糖酐和支链淀粉;琼脂胶、阿拉伯树胶、梧桐树胶、刺槐豆胶、黄蓍胶、角叉菜胶、印度树胶、瓜尔胶、黄原胶和硬葡聚糖),淀粉(例如糊精和麦芽糊精,未改性或预胶化的玉米淀粉),亲水性胶体(比如果胶),磷脂(比如卵磷脂),藻酸盐(例如藻酸铵,藻酸钠,藻酸钾或藻酸钙,丙二醇藻酸盐),明胶,胶原蛋白和纤维素。纤维素是通过在糖重复单元上的至少一部分羟基与化合物反应形成酯连接或醚连接的取代基而改性的纤维素聚合物。例如,纤维素乙基纤维素具有连接至糖重复单元的醚连接的乙基取代基,而纤维素乙酸纤维素具有酯连接的乙酸酯取代基。
[0142]
在某些实施例中,用于易蚀基质的纤维素包括水溶性纤维素和易受水侵蚀的纤维素,可以包括例如甲基乙基纤维素(mec),羧甲基纤维素(cmc),cmec,羟乙基纤维素(hec),羟丙基纤维素(hpc),醋酸纤维素(ca),丙酸纤维素(cp),丁酸纤维素(cb),乙酸丁酸纤维素(cab),cap,cat,羟丙基甲基纤维素(hpmc),hpmcp,hpmcas,羟丙基甲基纤维素乙酸偏苯三酸酯(hpmcat)和羟乙基乙基纤维素(ehec)。在某些实施例中,纤维素包括各种等级的低粘度(mw小于或等于50000d,例如dow methocel
tm
系列e5,e15lv,e50lv和k100ly)和高粘度(mw大于50000d,例如e4mcr,e10mcr,k4m,k15m和k100m以及methocel
tm
k系列)hpmc。hpmc的其它市售类型包括shin etsu metolose 90sh系列。
[0143]
可用作易蚀基质材料的其它材料包括但不限于支链淀粉,聚乙烯吡咯烷酮(聚维酮),聚乙烯醇,聚乙酸乙烯酯,甘油脂肪酸酯,聚丙烯酰胺,聚丙烯酸,乙基丙烯酸或甲基丙烯酸的共聚物(赢创医疗保健公司,阿拉巴马州伯明翰)和其它丙烯酸衍生物,例如甲基丙烯酸丁酯,甲基丙烯酸甲酯,甲基丙烯酸乙酯,丙烯酸乙酯,(2-二甲基氨基乙基)甲基丙烯酸酯和(三甲基氨基乙基)甲基丙烯酸氯的均聚物和共聚物。
[0144]
在一些实施例中,亲水性聚合物在单位剂型中用作粘合剂,并且选自聚维酮,淀粉,羟丙基纤维素和羟丙基甲基纤维素。
[0145]
在一些实施例中,在本发明公开的方法中使用的片剂包含核和肠溶包衣。围绕核的肠溶包衣可以使用标准包衣技术施加。用于形成肠溶衣的材料可以溶解或分散在有机或
水性溶剂中,并且可以包括以下中的一种或多种:甲基丙烯酸共聚物、虫胶、羟丙基甲基纤维素邻苯二甲酸酯、邻苯二甲酸聚乙酸乙烯酯、羟丙基甲基纤维素偏苯三酸酯、羧甲基纤维素、邻苯二甲酸醋酸纤维素或其它合适的肠溶衣聚合物。将肠溶包衣溶解的ph可以通过选择的聚合物或聚合物的组合和/或侧基的比例来控制。例如,可以通过游离羧基与酯基的比例来改变包衣的溶解特性。肠溶衣层还可包含药物增塑剂,例如:柠檬酸三乙酯、邻苯二甲酸二丁酯;三醋精、聚乙二醇、聚山梨醇酯和乙酰化甘油脂等等。肠溶衣层还包括添加剂,例如分散剂、着色剂、防粘剂、掩味剂和消泡剂。可以使用任何合适的肠溶包衣。在某些实施例中,肠溶衣是基于聚乙烯醇(pva)的包衣组合物,例如由colorcon提供的ii 85。enteric是colorcon全配方的缓释包衣系统的平台。
[0146]
上述胃滞留剂型可以通过任何合适的方法来制备,包括通过直接压制或通过干法制粒法。用于本发明公开的方法的剂型和片剂的制备方法是已知的。参见美国专利no.9205094和wo2014/113377。
[0147]
在某些实施例中,在该治疗之前,患者对其它治疗没有完全反应,包括单独每日使用最佳的标准剂量的ppi进行治疗至少8周。
[0148]
在某些实施例中,患者患有糜烂性食管炎。在进一步的实施例中,患者使用糜烂性食管食管胃十二指肠镜(egd)检查。在进一步的实施例中,患者使用糜烂性食管egd检查,并通进行约为48至96小时的ph监测。在进一步的实施例中,通过与患者食道相连的无导管的胶囊式ph监测系统(比如设备)对ph值进行监测的。在其它实施例中,患者基于食管胃十二指肠镜检查(egd)发现病理性酸反流。在其它实施例中,患者可通过egd的检查和通过对ph值进行约48至96小时的监测,发现病理性胃酸反流。在进一步的实施例中,通过与患者食道相连的无导管的胶囊式ph监测系统(比如设备)对ph值进行监测的。在进一步的实施例中,通过与患者食道相连的无导管的胶囊式ph监测系统(比如设备)的至少1-24小时时间间隔的监测,大于等于4.2%的患者ph检测值小于4,患有病理性酸反流。
[0149]
在某些实施例中,将包含胆汁酸螯合剂的片剂施用于患者八周(八治疗周)或更长时间。上述片剂施用的时间也可能更少,或者直到患者症状改善为止。
[0150]
在某些实施例中,与基线相比,患者每周的胃灼热严重程度评分达到了有临床意义的减少。在某些实施例中,与基线相比,在8个治疗周中的至少4周(包括最近2周中的至少1周)中,患者每周的胃灼热严重程度评分达到了有临床意义的至少30%的减少。在某些实施例中,与基线相比,在8个治疗周中的至少4周(包括最近2周中的至少1周)中,患者每周的胃灼热严重程度评分达到了有临床意义的至少45%的减少。在某些实施例中,与基线相比,患者的每周反流频率评分(wrfs)达到了有临床意义的减少。在某些实施例中,与基线相比,在8个治疗周中的至少4个星期(包括最近2周中的至少1周)中,患者的每周反流频率评分(wrfs)达到了有临床意义的至少30%的减少。在某些实施例中,与基线相比,在8个治疗周中的至少4个星期(包括最近2周中的至少1周)中,患者的每周反流频率评分(wrfs)达到了有临床意义的至少45%的减少。
[0151]
在某些实施例中,包括胆汁酸螯合剂的剂型在胃中长期滞留直至其基本上或完全分解。
[0152]
在某些实施例中,包含胆汁酸螯合剂的剂型完全分解的时间为至少1小时,至少2
小时,至少3小时,至少4小时,至少4.7小时,至少5小时,至少5.5小时,至少5.55小时,至少6小时,至少6.4小时或至少6.441小时。
[0153]
在某些实施例中,至少50%的包含胆汁酸螯合剂的剂型的在胃中滞留(未分解)至少4.5小时,至少4510小时,至少6.5小时,至少6.589小时,至少7小时或至少7.069小时。
[0154]
在某些实施例中,至少10%的包含胆汁酸螯合剂的剂型的在胃中滞留(未分解)至少6.4小时,至少6.432小时,至少8小时,至少8.394小时,至少9小时或至少9.179小时。
[0155]
在某些实施方式中,患者每天服用一次ppi。
[0156]
该方法可用于治疗患有以下疾病的患者:胃灼热、不消化、消化不良、糜烂性食管炎、消化性溃疡、胃溃疡、食道溃疡、食道炎、喉炎、咽炎、声音粗糙、胃食管反流疾病(gerd)、巴雷特食管、胃癌、食道癌(例如腺癌)、胃炎和gerd相关的肺功能障碍,代替,或除了,对质子泵抑制剂没有完全反应的有症状gerd的患者。
[0157]
配方和组成
[0158]
本发明提供了片剂形式的肠溶包衣的胃滞留性口服剂型,其包含:分散在聚合物基质中的考来维仑或盐酸考来维仑。在某些实施例中,聚合物基质包含聚环氧乙烷cas号25322-68-3或基本上由其组成,其分子量约为300,000(peg-7m)。在一些实施例中,剂型包含一种或多种填充剂或压缩剂。在某些实施例中,填充剂或压缩剂选自微晶纤维素,丁基化羟基甲苯,二氧化硅胶体,乳糖,淀粉,麦芽糖糊精,硬脂酸镁,双乙酰化单甘油酯,羟丙甲纤维素和磷酸氢钙。所述片剂采用肠溶包衣,以将胆汁酸螯合剂长时间滞留在患者的胃中。在某些实施例中,所述口服剂型包含二丁基羟基甲苯(bht)。在某些实施例中,所述口服剂型包含约0.01mg至约1.5mg的bht。在某些实施例中,所述口服剂型包含按剂型的重量计至少约0.06%的bht;将至少0.065%bht加入配方中。这些剂型可用于本发明提供的方法中。在某些实施例中,药物组合物还包含另外的治疗剂。片剂形式的肠溶包衣的胃滞留性口服剂型旨在口服递送给患者。
[0159]
将这些剂型、制剂和药物组合物与提供合适的转移,递送,耐受性等的合适的载体,赋形剂和其它试剂一起配制。可以在所有药物化学家都知道的配方中找到许多合适的制剂:雷明顿药物科学,马克出版公司,宾夕法尼亚州伊斯顿。这些制剂包括,例如,粉剂,糊剂,软膏剂,果冻,蜡,油,脂质,阳离子型或阴离子型的脂质体(如lipofectin
tm
),dna结合物,无水吸收糊剂,水包油和水油包油型乳剂,聚乙二醇乳剂(各种分子量的聚乙二醇),半固体凝胶和含聚乙二醇的半固体混合物。另请参见powell et al."compendium of excipients for parenteral formulations"pda(1998)j pharm sci technol 52:238-311.
[0160]
本发明提供的剂型,制剂和药物组合物以500mg,750mg,1000mg,1500mg,2100mg或更多的剂量(在安全的程度上)给药。在某些实施例中,这些剂型,制剂和药物组合物每天两次给药,各自以500mg,1000mg或1500mg,700mg,1400mg,2100mg或更高的剂量给药。在某些其它实施例中,每天两次。
[0161]
在某些实施例中,剂型可以另外包含合适的稀释剂,助流剂,润滑剂,酸化剂,稳定剂,填充剂,粘合剂,增塑剂或释放助剂和其它药学上可接受的赋形剂。
[0162]
该聚合物基质的成分是至少一种亲水的、水溶胀的、易蚀的或可溶的聚合物,其通常可被描述为“渗透聚合物”,“水凝胶”或“水溶胀性”聚合物。多于一种这样的聚合物可以
与本发明的剂型结合以达到胃滞留以及期望的侵蚀率。
[0163]
适合于为实现期望的滞留性和持续释放特性的剂型的聚合物由于从胃液吸收水而具有溶胀的特性,并在数小时的时间内逐渐侵蚀。由于聚合物的侵蚀是由流体与剂型表面的相互作用引起的,因此侵蚀在溶胀过程中或多或少地开始。虽然侵蚀和溶胀可能同时发生,但达到最大溶胀的速率应比剂型完全溶蚀以获得所需释放曲线的速率更快。这样的聚合物可以是线性的,支链的或交联的。聚合物可以是均聚物或共聚物。
[0164]
在一些实施例中,聚合物是聚氧化烯。在一些实施例中,所述一种或多种亲水性聚合物中的至少一种是聚环氧乙烷。在其它实施例中,至少一种亲水性聚合物是具有约300000道尔顿分子量的聚环氧乙烷。
[0165]
在某些实施例中,剂型包括一种或多种微晶纤维素(在片芯的1~10%w/w之间)、丁基羟基甲苯氧化物(在片芯的0.01~0.10%w/w之间);胶态氧化硅(在片芯的1~2.5%w/w之间)和硬脂酸镁(在片芯的0.1~1%w/w之间)。
[0166]
在某些实施例中,肠溶包衣是由卡乐康提供的聚乙烯醇基涂层成分,例如ii85。肠溶包衣是卡乐康全配方延迟释放涂层系统的平台。在某些实施例中,片剂涂有1-4%ii85fw/w的包衣片芯。
[0167]
已知制备本文公开的方法中使用的剂型和片剂的方法见美国专利号9205094和wo2014/113377,两者的披露均通过引用并入本文。
[0168]
在某些实施例中,口服剂型为iw-3718。iw-3718是一种胃泌素缓释片,固体或非固体药物,用于延长药物科尔塞韦兰在胃中的释放。释放出的结肠蛋白酶结合胆汁酸,胆汁酸从十二指肠回流到胃,通过形成胆汁酸结肠酶复合物使其在功能上惰性化。这将防止进入食管并减少质子泵抑制剂治疗的胃食管反流病患者因胆汁反流而导致的残留胃食管反流病症状和粘膜损伤。在某些实施例中,iw-3718片剂含有考来维仑并入聚合基质中。这种基质可以是水的可腐蚀性或水的可膨胀性或水的可溶性,即在纯水中可腐蚀性或可膨胀性或可溶性(或这些性质的组合),或者需要酸或碱的存在来电离聚合基质,足以引起侵蚀或溶解(例如胃液)。见美国专利号9205094和wo2014/113377。在某些实施方案中,iw-3718片包括聚环氧乙烷。聚环氧乙烷是未取代的环氧乙烷的线性聚合物,具有宽范围的粘度平均分子量。示例1和2中使用的iw-3718片剂如表14所示。
[0169]
在某些实施例中,含有胆汁酸螯合剂的口服剂型的一种或多种填料或压缩剂是片芯1-10%w/w的微晶纤维素、片芯0.01-0.10%w/w的丁基羟基甲苯、片芯1-5%w/w的胶态二氧化硅;和/或片芯0.1%-1.0%w/w的硬脂酸镁。在某些实施例中,一种或多种填料或压缩剂是片芯5.4%w/w的微晶纤维素,片剂约0.06w/w的丁基羟基甲苯,片芯2%w/w的胶体二氧化硅,和/或片芯0.5%w/w的硬脂酸镁。
[0170]
在某些实施例中,含有胆汁酸固形物的口服剂型的肠溶包衣是聚乙烯醇肠溶包衣。在某些实施例中,含有胆汁酸螯合物的口服剂型的肠溶包衣(聚乙烯醇肠衣)为ii85f。在某些实施例中,口服剂型的肠溶包衣包括胆汁酸隔离症一种聚乙烯醇肠溶包衣,在片芯1-5%w/w的条件下为ii85f。在进一步的实施例中,肠溶包衣是以3%w/w的片芯为条件的聚乙烯醇肠溶包衣是ii85f。
[0171]
在某些实施例中,聚乙二醇-7m(保益乐
tm
wsr n-750)为片芯的30%-60%w/w。在进一步实施例中,聚乙二醇-7m(保益乐
tm
wsr n-750)为片芯的46%w/w。
[0172]
综合疗法
[0173]
本文公开的方法可用于使用组合疗法治疗患者,包括施用含有至少一种胆汁酸螯合物的胃保持口服剂型以及一种或多种附加治疗剂。对于与一种以上活性剂的联合治疗,如果活性剂可以是单独的剂型,则活性剂可以单独或联合施用。此外,一个活化剂可以在另一个活化剂的之前、同时或之后。
[0174]
如本文所使用的,术语“联合”或“共给药”可以互换地用于指使用一种以上的治疗(例如,一种或多种预防性和/或治疗性药物)。使用这些术语并不限制对受试者进行治疗(例如预防性和/或治疗性药物)的顺序。
[0175]
在一些实施例中,这些方法还包括同时、单独或顺序地向患者施用一种或多种质子泵抑制剂。在某些实施例中,质子泵抑制剂以每天一次施用。在其他实施例中,所述方法还包括同时、单独或顺序施用一种或多种酸泵拮抗剂。在其他实施例中,所述方法还包括同时、单独或顺序施用一种或多种选自抗酸剂、组胺h2受体拮抗剂、γ-氨基丁酸-β激动剂、γ-氨基丁酸-β激动剂的前药和蛋白酶抑制剂的制剂。
[0176]
虽然联合治疗中的两种或两种以上药物可以同时使用,但它们不必同时使用。例如,第一个药物(或药物组合)的管理可以先于第二个药物(或药物组合)的管理分钟、小时、天或周。联合治疗也可以包括两次或多次服用一种或多种用于联合治疗的药物。
[0177]
质子泵抑制剂药物是取代苯并咪唑化合物,通过影响h
/k
atpase酶系统(质子泵)特异性地抑制胃酸分泌。这些药物,例如埃索美拉唑,吸收迅速,半衰期很短。然而,它们与h
/k
atpase酶的结合时间延长。每天一次给药后,抗分泌作用在4天内达到最大值。由于这些特点,开始质子泵抑制剂治疗的患者没有获得最大的药物效益,并且在开始治疗时,在开始使用质子泵抑制剂单独治疗上消化道疾病时,治疗可能不开始长达5天。
[0178]
质子泵抑制剂是一种有效的胃酸分泌抑制剂,可抑制胃酸分泌h /k atpase,这种酶参与壁细胞产生氢离子的最后一步。质子泵抑制剂的术语包括,但不限于,奥美拉唑(以losec,或品牌销售),兰索拉唑(以或品牌销售),雷贝拉唑(以或品牌销售),泮托拉唑(以或品牌销售),替那托拉唑(也称为苯那托拉唑)和柠檬酸唑,包括其异构体、对映体和互变异构体(例如,埃索美拉唑(以品牌销售))、地塞米松唑、地塞米松唑(s)-泮托拉唑,艾普拉唑及其碱性盐;以下专利描述了适合在本文所述公开中使用的各种苯并咪唑化合物:美国专利号4045563、美国专利号4255431、美国专利号4359465、美国专利号4472409、美国专利号4508905、jp-a-59181277、美国专利号4628098、美国专利号4738975、美国专利号5045321、美国专利号4786505、美国专利号4853230、美国专利号5045552、ep-a-295603、美国专利号5312824、ep-a-166287、美国专利号5877192、ep-a-519365、ep5129、ep174726、ep166287和gb2163747。因此,根据本发明使用的质子泵抑制剂及其医药上可接受的盐是已知化合物,并且可以通过已知过程产生。在某些实施例中,质子泵抑制剂是外消旋混合物中的奥美拉唑,或仅是美国专利中规定的奥美拉唑(即埃索美拉唑)的对映体。美国专利号5877192,特此通过引用并入。
[0179]
奥美拉唑通常在活动性十二指肠溃疡的4-8周内以20毫克剂量/天的剂量给药;在胃食管反流病或严重糜烂性食管炎的4-8周内以20毫克剂量/天的剂量给药;在幽门螺杆菌
的治疗(与其他药物结合)中以20毫克剂量/天的剂量给药;活动性十二指肠溃疡60毫克/天,持续4-8周,最多120毫克,3次/天;胃溃疡40毫克/天,持续4-8周。在本发明的其他实施例中,质子泵抑制剂的剂量是亚治疗性的。
[0180]
兰索拉唑一般为15-30毫克/天;雷贝拉唑一般为20毫克/天,泮托拉唑一般为40毫克/天。然而,这些药物的任何治疗剂量或亚治疗剂量被认为在本发明的范围内。
[0181]
酸泵拮抗剂通过与胃质子泵结合的k
竞争性和可逆性(与不可逆的质子泵抑制剂相反)作用,胃质子泵是激活壁细胞酸分泌的最后一步。其中一类是咪唑吡啶类。一些酸泵拮抗剂的例子包括但不限于:by-841(普鲁马哌唑),sch-28080,yja-20379-8,yja-20379-1,spi-447,sk&f-97574,au-2064,sk&f-96356,t-330,sk&f-96067,sb-641257a(yh-1885,盐酸瑞伐拉赞,revanexr),cs-526,r-105266,利纳普拉赞,索拉普拉扎,dbm-819,kr-60436,rq-00000004(rq-4)和yh-4808。
[0182]
其他药物包括:组胺h2受体阻滞剂、运动剂(胃促动力学)、抗酸剂、抗溃疡剂、γ-氨基丁酸-β激动剂、γ-氨基丁酸-β激动剂的前药、gcc激动剂和/或蛋白酶抑制剂。这些附加剂的非限制性实例包括:西尼他利、西沙必利、费多托嗪、洛昔康、亚历山大钠、铝镁加、氢氧化铝、铝镁硅酸盐、磷酸铝、偶氮苯、碱式碳酸铝凝胶、铝酸铋、磷酸铋、次没食子酸铋、亚硝酸铋、碳酸钙,氨基乙酸二羟基铝,碳酸二羟基铝钠,埃必马尔,麦角酸,碳酸氢镁,氢氧化镁,氧化镁,过氧化镁,磷酸镁(三价),硅酸镁,柠檬酸钾,碳酸氢钠,乙酰谷酰胺铝络合物,乙酰氧酮,阿迪沙星,阿巴前列素,盐酸贝尼西汀,卡本诺酮,西曲酯,西咪替丁,胶体次硝酸铋,依布罗替丁,依卡贝,恩前列素,伊沙拉唑,法莫替丁,吉法莫替丁,愈创木酚,伊索格拉丁,米索前列醇,尼扎替丁,奥莫前列素,-谷维素,哌仑西平,普劳诺醇,极普瑞锌,雷尼替丁,瑞巴米苷,里奥前列素,罗莎普托,罗哌替丁醋酸酯、索法酮、斯佐法隆、硫糖铝、特伦西平、替普瑞酮、曲美前列素、三硫嗪、曲昔派特、唑吡咪、巴氯芬、r-巴氯芬、xp1946(cas注册号847 35330-4)、胃蛋白酶抑制素和其他胃蛋白酶抑制剂(例如苯甲酸钠);以及糜蛋白酶和胰蛋白酶抑制剂。本领域技术人员已知多种胰蛋白酶和糜蛋白酶抑制剂,可用于本文所述的方法中。这种胰蛋白酶和糜蛋白酶抑制剂可以包括组织因子途径抑制剂;α-2抗血浆蛋白;丝氨酸蛋白酶抑制剂α-1抗糜蛋白酶家族成员;萘;水蛭素;埃格林包括埃格林c;来自家蚕的抑制剂(参见:例如jp4013698a2和jp04013697a2;ca注册号142628-93-1);水蛭素及其变体;分泌性白细胞蛋白酶抑制剂;α-1抗胰蛋白酶;鲍曼-伯克蛋白酶抑制剂;具有糜蛋白酶抑制活性的化合物,例如cas注册号为306762-66-3,306762-67-4,306762-68-5,306762-69-6,306762-70-9,306762-71-0,306762-72-1,306762-73-2,306762-74-3,306762-75-4,178330-92-2,178330-93-3,178330-94-4,81459-62-3,81459-79-2,81460-01-7,85476-59-1,85476-62-6,85476-63-7,85476-67-1,85476-70-6,85858-66-8,85858-68-0,85858-69-1,85858-70-4,85858-71-5,85858-72-6,85858-73-7,85858-75-9,85858-77-1,85858-79-3,85858-81-7,85858-83-9,85858-84-0,85858-85-1,85858-87-3,85858-89-5,85858-90-8,85858-92-0,85879-03-4,85879-05-6,85879-06-7,85879-08-9,85858-74-8,90186-24-6,90185-93-6,89703-10-6,138320-33-9(ys3025),94149-41-4(mr889),85858-76-0,89703-10-6,90185-92-5,90185-96-9,90185-98-1,90186-00-8,90186-01-9,90186-05-3,90186-06-4,90186-07-5,90186-08-6,90186-09-7,90186-10-0,90186-11-1,90186-12-2,90186-13-3,90186-14-4,90186-22-4,90186-23-5,90186-24-6,90186-25-7,90186-27-9,
90186-28-0,90186-29-1,90186-31-5,90186-35-9,90186-43-9,90209-88-4,90209-89-5,90209-92-0,90209-94-2,90209-96-4,90209-97-5,90210-01-8,90210-03-0,90210-04-1,90210-25-6,90210-26-7,90210-28-9,90230-84-5,90409-84-0,95460-86-9,95460-87-0,95460-88-1,95460-89-2,95460-91-6,114949-00-7,114949-01-8,114949-02-9,114949-03-0,114949-04-1,114949-05-2,114949-06-3,114949-18-7,114949-19-8,114964-69-1,114964-70-4,9076-44-2(凝乳酶),30827-99-7(佩法布洛克),618-39-3(苯甲酰胺),80449-31-6(乌司他丁),130982-43-3,197913-52-3,179324-22-2,274901-16-5,792163-40-7,339169-59-4,243462-36-4,654671-78-0,55123-66-5(亮抑蛋白酶肽),901-47-3,4272-74-6,51050-59-0,221051-66-7,80449-31-6,55-91-4,60-32-2,88070-98-8,87928-05-0,402-71-1(苯磺酰胺),139466-47-0,ci-2a(见us5167483),ci-2a(见bwo9205239),wci-3(见shibata等人,1988,jbiochem(东京)104:537-43),wci-2(见habu等人,1992,j biochem(东京)111:249-58),和wci-x(habu等人,上)和178330-95-5;以及专利出版物jp56092217a2,us4755383,us4755383,us4639435,us4620005,us4898876,和ep0128007。
[0183]
可与本发明化合物组合的其他治疗剂的实例,或单独施用或以相同的药物成分施用,包括但不限于利纳克罗肽、iw-9179、普卡那肽和sp-333。
[0184]
可以给患者服用任何其他合适的药物。
[0185]
具体实施例
[0186]
为了更好地理解本发明,提出以下具体例。这些具体实施例仅用于说明目的,并且不被解释为以任何方式限制本发明的范围。
[0187]
实施例1:一项随机、双盲、安慰剂对照、平行组、剂量范围发现试验,以确定胆汁酸隔离剂剂型对质子泵抑制剂没有完全反应的症状性胃食管反流病患者口服8周的安全性和有效性。
[0188]
本例提出了多中心(约60-80个中心在美国)的方案和结果,随机、双盲、安慰剂对照、平行组、8周的研究,由3个不同的时期组成(筛选期长达28天;预处理期为14-21天;治疗期为57天)。如图1,这项研究将有胃食管反流病并且在接受每天一次(研究者认为已优化的标准剂量质子泵抑制剂治疗)的同时继续经历胃食管反流病症状的患者纳入研究。合格患者继续服用质子泵抑制剂随机分为安慰剂组或每日两次服用500毫克iw-3718(每日两次)、1000毫克iw-3718每日两次或1500毫克iw-3718每日两次。
[0189]
iw-3718片剂是一种固体口服剂型,旨在延长药物科尔塞韦兰在胃中的释放。释放出的结肠蛋白酶结合胆汁酸,胆汁酸回流到胃和上十二指肠,形成胆汁酸大肠杆菌复合物并防止游离胆汁酸进入食道。胆汁酸大肠杆菌复合物沿胃肠道向下移动,在不被吸收的情况下排出。iw-3718片剂中的控释制剂基于depomed 技术,该技术利用膨胀聚合物使在给药状态下,片剂在胃中保留约9小时,在此期间,片剂缓慢释放胃和上消化道中的活性成分。该片的活性成分以接近零的顺序稳定地输送到胃和上消化道。该技术用于5种美国食品和药物管理局批准的药物的配方中:(盐酸二甲双胍,缓释)、xr(西他列汀和盐酸二甲双胍缓释)、xr(盐酸环丙沙星,缓释)、er(tapentadol缓释片)和每日一次gralise
tm
(加巴喷丁)片剂。科尔塞韦兰不被系统吸收,也不干扰系统药物代谢酶。鞘膜菌的分布局限于胃肠道,通过粪便排泄而消除。
[0190]
目的是评估口服iw-3718治疗胃食管反流病患者的安全性、有效性和剂量-反应关
系,这些患者在每天接受一次标准剂量质子泵抑制剂(每日一次)的同时仍有胃食管反流病症状。
[0191]
符合条件的患者继续服用质子泵抑制剂,随机分为安慰剂组或500mgiw-3718组,每日两次、1000mgiw-3718每日两次或1500mgiw-3718每日两次。在食管胃十二指肠镜检查中,随机化按是否有糜烂性食管炎分层。
[0192]
所有患者在筛选、治疗前和治疗期间每天在早餐前继续服用约30-60分钟的质子泵抑制剂。在治疗期间,所有患者在每天早晚饭后立即服用iw-3718或匹配安慰剂。
[0193]
筛选期:筛选期从签署知情同意书开始,预计最长持续28天。在此期间,将确定患者进入预处理期的资格。在筛选期间,所有患者都需要两个程序;第三个程序测试对选定地点的所有患者都是可选的(所有操作都要在患者继续服用质子泵抑制剂时进行):
[0194]
食管胃十二指肠镜
[0195]
大约48至96小时设备的ph测试。如果出于某种原因,96小时的测试是不可能的,那么大约48小时的测试是可接受的。
[0196]
使用bilitec监控系统(可选择所选定的地点)的胆红素检测约24小时
[0197]
组胺-2受体拮抗剂应在食管胃十二指肠镜和ph监测前5个自然日停止,抗酸剂应在食管胃十二指肠镜和ph监测前1个自然日停止。食管胃十二指肠镜必须在筛查期间和至少在预处理开始前7天进行,以留出收集ph值的时间,并允许患者按照这些程序稳定下来。在完成bravo测试后,患者应避免使用组胺-2受体拮抗剂,但如果需要,可继续使用抗酸剂。在整个筛查期间,患者将继续使用他们当前的质子泵抑制剂。筛选期的结束与预处理期的开始相一致。
[0198]
在选定的地点,接受食管胃十二指肠镜和bravo检测的研究筛选的患者也可以选择在当时插入一个bilitec监护仪。胆红素检测程序正在一部分病人中完成,以收集十二指肠-胃反流液中是否存在胆红素的信息。以前的bilitec2000研究表明总胆汁酸浓度和bilitec2000吸光度之间存在关联。参与bilitec手术的患者同意遵从以下定义的“白色饮食”,并在大约24小时后返回检测。bilitec监测的结果不影响入选资格,在参与研究期间,患者将见不到其bilitec检测结果。
[0199]
如果后勤需要延误,可延长筛选期窗口一周。
[0200]
预处理期:预处理期定义为随机访视前14至21个自然日。在此期间,患者继续使用质子泵抑制剂,并避免使用其他抗反流药物,包括抗酸剂和组胺-2受体拮抗剂,但作为救援药物分发的抗酸剂除外。他们在手持式电子日记本中提供以下信息;进行至少2周的症状评估,在此期间,他们必须在治疗期开始前的14个自然日内每周至少完成5天的每日评估,并在开始前的7个自然日内每周至少完成一次评估有资格随机化的治疗期:
[0201]
每天晚上使用改良反流症状问卷(来自终点结果)评估一次胃食管反流性疾病症状
[0202]
每天晚上使用每日消化不良症状问卷评估一次消化不良症状
[0203]
每天早晨使用每日睡眠问卷评估一次睡眠
[0204]
按方案使用救援药物,每天评估两次
[0205]
症状缓解和“困扰”在晚上每周评估一次
[0206]
患者在每天早餐前至少在30-60分钟内服用质子泵抑制剂,即使是在研究访问日。
符合所有进入标准的患者进入治疗期。
[0207]
治疗周期:治疗周期从治疗任务开始,持续8周。根据患者是否有食管胃十二指肠镜筛查中的糜烂性食管炎,对其进行分层,并在每个分层中随机分为4种治疗方法(1:1:1:1):安慰剂或500mg iw-3718每日两次、1000mg iw-3718每日两次或1500mg iw-3718每日两次。除非医学监护仪另有批准,否则对注册进行监控,以确保没有一个中心的贡献超过目标研究注册的15%。研究药物在早晚饭后立即服用。患者在每日早餐前继续服用质子泵抑制剂约30-60分钟,并使用电子日记本提供每日评估(胃食管反流性疾病症状、消化不良症状、睡眠评估)、每周评估(每周症状和缓解程度)、质子泵抑制剂依从性、以及按程序使用救援药物。
[0208]
根据国际协调会议e10,临床试验中对照组的选择和相关问题(国际协调会议人类药物注册技术要求,2001)的概念,选择一个双盲、安慰剂对照、平行组研究设计使用,以提供可比的治疗组和最小的选择机会或研究者偏见。
[0209]
本研究有14-21天的预处理期,以建立无治疗的基线,并使患者熟悉数据收集方法(即个人数字助理)和8周的治疗期,以比较试验治疗和安慰剂对照。
[0210]
研究人群的选择
[0211]
本研究是在对每日一次质子泵抑制剂治疗没有完全反应的胃食管反流性疾病患者中进行的。大约260名患者是随机的(每治疗组大约65例)。研究药物口服给药8周,预计患者总参与时间长达109天,包括筛选期。
[0212]
合格标准:入选标准
[0213]
每位患者必须符合以下所有标准,方可参加本研究:
[0214]
1.患者在执行任何研究特定程序之前已签署知情同意书。
[0215]
2.患者是一名流动的、居住在社区的男性或非怀孕女性,在筛查就诊时至少18岁。哺乳期女性必须同意不母乳喂养。
[0216]
3.患者在接受标准每日一次质子泵抑制剂治疗前8周内每周≥4天诊断为胃食管反流性疾病,并报告出现胃食管反流性疾病症状(烧心或反胃)。
[0217]
4.患者在筛查访视前至少8周接受了单独优化的、标准标记剂量的、每天一次的、质子泵抑制剂治疗(根据研究者的判断,通过改变质子泵抑制剂给药的品牌或时间不能进一步改善的治疗)。患者的质子泵抑制剂剂量和计划应与批准的标签一致。在筛选期间进行质子泵抑制剂改良的患者可在优化的标准标记剂量、一天一次、质子泵抑制剂治疗8周后重新筛选,前提是他们之前未进入预处理期。
[0218]
5.在筛查期间(当患者继续服用质子泵抑制剂)时,具有大约48至96小时ph监测的食管胃十二指肠镜(用装置)显示以下一种或多种:
[0219]
a.食管胃十二指肠镜上的糜烂性食管炎(根据洛杉矶食管炎分类为a级或更高级别)
[0220]
b.在使用装置进行ph测试的24小时间隔中,至少有1小时内出现病理性酸反流(ph值《4,记录时间≥4.2%)
[0221]
6.患者在至少2天内报告烧心严重程度≥3(中度),在随机分组前的最后7天内平均烧心严重程度≥2(轻度)。
[0222]
7.具有生育潜力的性活跃女性患者(即未绝经或未进行双侧卵巢切除术、子宫切
除术或输卵管结扎术的妇女)必须同意从签署知情同意书之日起至服用研究药物最后剂量后24小时内使用以下1种避孕方法:
[0223]
a、激素避孕(即避孕植入物或注射性激素避孕)
[0224]
b、双屏障避孕(如安全套加宫内节育器、隔膜加杀精剂等)患者可以在使用一种或多种屏障方法的同时继续口服避孕药。
[0225]
c、维持一夫一妻制关系的男性伴侣已通过输精管结扎手术绝育
[0226]
8.有生育潜力的女性必须在筛查访视时血清妊娠试验阴性,在给药前随机访视时尿妊娠试验阴性。
[0227]
9.患者同意在研究期间不改变其日常饮食,但参与bilitec测试的患者除外,这些患者必须在bilitec测试期间同意“白色饮食”。
[0228]
10.患者符合食疗完成要求,即在治疗期开始前14个自然日内,他们每周至少5天充分完成食疗问题。
[0229]
11.患者在治疗期开始前14个自然日内符合质子泵抑制剂每日一次剂量。如果患者如膳食中所述,每周至少服用5天质子泵抑制剂,则视为符合要求。
[0230]
12.患者能流利地使用英语或西班牙语。
[0231]
13.患者能够充分操作食疗室,并同意遵守研究要求。
[0232]
14.对于接受脂溶性维生素补充以纠正或避免脂溶性维生素缺乏的患者,患者愿意在服用研究药物前至少4小时服用维生素补充。
[0233]
合格标准:排除标准
[0234]
1.患者过去曾有过对质子泵抑制剂完全缺乏胃食管反流性疾病症状反应的病史。
[0235]
2.患者在筛查就诊时报告上腹部疼痛或灼烧为其主要症状。
[0236]
3.患者有胃轻瘫、肠梗阻史,或有肠梗阻风险(例如,患者有器质性胃肠动力障碍或有胃肠大手术史)。
[0237]
4.患者空腹血清甘油三酯浓度》500mg/dl,或在筛查时或预处理期间的任何时候空腹血清甘油三酯浓度》500mg/dl。
[0238]
5.患者有高甘油三酯血症引起的胰腺炎病史。
[0239]
6.研究者认为,患者易患脂溶性维生素缺乏症(尤其是维生素d缺乏症;例如,患者为非裔美国人或西班牙裔,或患有骨质疏松症、骨软化症等),并因服用考来司韦兰8周而处于危险之中。
[0240]
7.患者有活动性吞咽障碍,从而会阻止她吞下研究药物。
[0241]
8.患者有任何警报症状,包括但不限于胃肠道出血、贫血、呕吐或在筛查或预处理期间任何时候的意外体重下降。
[0242]
9.患者接受了符合以下任一标准的手术:
[0243]
a、除阑尾切除术、胆囊切除术、口腔或直肠小手术(如扁桃体切除术、痔疮切除术、直肠前突修补术)外的胃肠道手术(包括胃束带术)
[0244]
b、在筛查访视前3个月进行阑尾切除术,或在筛查访视前6个月进行胆囊切除术,或在筛查访视前30天进行口腔或直肠小手术
[0245]
c、筛查前6个月内腹部、骨盆或腹膜后结构的非胃肠道手术
[0246]
d、筛查前6个月的胸部手术
[0247]
e、筛查前30天的其他主要非胃肠道手术
[0248]
10.患者曾接受过胸部或腹部放射治疗。
[0249]
11.食管胃十二指肠镜,在筛查期间进行,显示患者有长段巴雷特氏食管(大于3厘米)或食道明显发育不良改变、消化性溃疡病、活动性胃肠道出血、有症状的食道狭窄、食道或胃底静脉曲张、糜烂性胃炎,或嗜酸性粒细胞性、疱疹性或念珠菌性食管炎。
[0250]
12.患者有吉尔伯特病、克罗恩病、糖尿病、佐林格-埃里森综合征、胰腺炎、胆囊炎或系统性硬化症。
[0251]
13.患者在筛查时或预处理期间的任何时候血清胆红素水平升高(实验室定义为高于正常上限的1.5倍)。
[0252]
14.患者对研究药物(活性或安慰剂)中所含的任何赋形剂有临床显著过敏或过敏史。
[0253]
15.患者有癌症病史(可接受切除基底细胞癌或鳞状细胞癌)。注:有癌症病史的患者可以接受,前提是在筛查访视之前,恶性肿瘤已经完全缓解至少5年。完全缓解是指治疗后所有癌症症状消失。
[0254]
16.患者在筛查前12个月内有酗酒、吸毒或非法吸毒(包括大麻)史。
[0255]
17.患者在签署知情同意书后,但在接受第一剂研究药物之前,在体检、12导联心电图或临床实验室检查中有任何临床意义的发现。(注:研究者确定某一特定发现是否具有临床意义。)在作出该决定时,研究者考虑该特定发现是否会阻止患者进行任何方案规定的评估,是否可能代表将患者排除在研究之外的情况,如果患者参与研究,则可能代表安全问题,或可能混淆研究指定的安全性或疗效评估。
[0256]
18.患者报告在筛选或预处理期间使用违禁药物,或不愿意或无法遵守有关使用违禁药物的限制。
[0257]
19.患者在筛查访视前30天内接受了研究药物,或计划在研究期间的任何时候接受另一种研究药物或使用研究设备。
[0258]
20.研究人员认为,患者患有急性或慢性疾病,会限制患者完成或参与本临床研究的能力。
[0259]
21.患者先前已进入iw-3718治疗的研究治疗期。
[0260]
22.患者已进入本研究的预处理期。
[0261]
23.患者在另一临床研究地点登记参加本研究;是该机构或铁木制药公司的雇员;或是与该机构或铁木制药公司的雇员同住的一级家庭成员、重要的其他人或亲属。
[0262]
从治疗或评估中移除患者
[0263]
当签署知情同意书的患者在治疗期结束前,不论情况如何,停止参与研究时,就会发生过早中止。
[0264]
患者在接受8周治疗并在第57天完成治疗结束访视后被视为完成了研究。治疗结束访视允许 3天的时间窗;如果患者在第57天之前完成治疗结束访视,则视为方案偏离。
[0265]
患者被告知,他们可以随时以任何理由退出研究。如果研究者认为继续研究不符合患者的最佳利益,研究者可以将患者从研究中移除。研究者或赞助人也可出于任何原因随时中止患者的研究,包括:
[0266]
未能满足临床相关且影响患者安全的纳入/排除标准
[0267]
不良事件
[0268]
违反协议,包括不遵守
[0269]
治疗反应不足(缺乏疗效)
[0270]
无法跟进(必须尽一切努力联系患者;必须寄出一封证明信)
[0271]
撤销同意书(如有可能,应尝试确定患者撤销同意书的原因)
[0272]
赞助人终止研究
[0273]
其他原因(如行政原因或怀孕)
[0274]
因任何原因中止研究的患者应在中止研究时完成治疗结束访视所需的评估。对停止研究的患者进行随访,直至其所有不良事件得到解决,或直到研究者判定未解决的不良事件稳定为止。研究中心应尽合理努力跟踪任何孕妇直到分娩或妊娠结束。
[0275]
如果患者未返回预定就诊,研究中心应联系患者。必须努力与患者联系,包括寄出一封认证信。在每一种情况下,患者的结果,包括丢失的随访信息,都被记录在案。
[0276]
在这项研究中,过早停止治疗的患者不会被替换。
[0277]
研究治疗
[0278]
研究药物为500mg iw-3718片剂,为白色至灰白色椭圆形薄膜包衣片剂,用于口服。除了活性物质考来维仑外,500毫克iw-3718片含有以下非活性成分:微晶纤维素、聚氧化乙烯、胶态氧化硅、丁基羟基甲苯、硬脂酸镁、聚乙烯醇、聚乙二醇、二氧化钛和滑石。药片应整片服用,不得破碎、压碎或咀嚼。另见表14。
[0279]
随机接受iw-3718治疗的患者服用试验产品如下:
[0280]
每日两次500mg iw-3718:每日两次,每次在早晚饭后给药立即一片500mg iw-3718口服片加上两片安慰剂口服片(共3片)
[0281]
每日两次1000mg iw-3718:每日两次,每次两片在早晚饭后立即给药500mg iw-3718口服片加1片安慰剂口服片(共3片)
[0282]
每日两次1500mg iw-3718:每日两次,每次在早晚饭后立即给药3片500mg iw-3718口服片
[0283]
与500毫克iw-3718片匹配的安慰剂被提供为白色至白色、椭圆形、薄膜包衣、含微晶纤维素、聚乙烯氧化物、胶态氧化硅、丁基羟基甲苯、硬脂酸镁、聚乙烯醇、聚乙二醇、二氧化钛和滑石的口服片剂。药片应整片服用,不得破碎、压碎或咀嚼。
[0284]
随机接受安慰剂治疗的患者在早晚饭后立即口服三片安慰剂。
[0285]
抗酸救援药物作为瓶装液体(氢氧化镁200毫克/氢氧化铝200毫克/每5毫升)提供给临床现场。
[0286]
在完成个人数字助理日间和夜间日记问题的过程中,通过回答以下问题,向患者询问其救援药物的使用情况:
[0287]“从今天早上起床到现在,你用了多少次急救药(液体抗酸药)?“(白天评估,晚上睡觉前完成)
[0288]“昨晚你用了多少次急救药(液体抗酸药)?“(夜间评估,上午完成)
[0289]
治疗依从性
[0290]
在下一次研究访视之前,患者被分发适当数量的赞助商包装的、贴上标签的吸塑钱包。要求患者在每次研究访问时归还所有吸塑钱包(包括未使用的药片),以评估其对给
药方案的依从性。患者需要每天(每天一次)在其电子日记中记录其质子泵抑制剂给药情况。
[0291]
包装和标签
[0292]
研究药物(iw-3718和安慰剂片)是由铁木制药公司提供的,在包装中有60片,表明早晨和晚上的剂量。研究药物是唯一编号和标签的双盲方式,符合监管要求。
[0293]
研究药物(iw-3718和安慰剂片)在2℃至8℃(36℉至46℉)的冷藏温度下运输,必须在2℃至8℃(36℉至46℉)的冷藏温度下储存。抗酸救援药物在20℃至25℃(68℉至77℉)的室温下运输,必须在20℃至25℃(68℉至77℉)的室温下储存。必须报告与这些储存条件的任何偏差,并暂停使用研究药物,直到获得继续使用的授权。
[0294]
研究者必须确保记录所有研究药物的接收和使用,并监督这些药物的储存和分配。所有研究药物必须保存在一个只有研究人员或其他正式指定人员才能进入的上锁房间内。研究药物不得在本研究方案的范围外使用,在任何情况下,研究人员或研究中心人员均不得允许使用本研究方案规定以外的用品。
[0295]
将患者分配到治疗组的方法
[0296]
符合所有纳入标准和不符合排除标准的患者在第1天随机进入研究。根据患者在筛查食管胃十二指肠镜检查中是否有糜烂性食管炎进行分层,然后以1:1:1:1的比例通过中央随机化进行随机化,以接受500mg iw-3718每日两次、1000mg iw-3718每日两次、1500mg iw-3718每日两次或安慰剂每日两次。
[0297]
计算机生成的随机化计划由一名独立的统计学家编制,与研究无关。
[0298]
在本研究中,在安慰剂对照研究中,研究了口服剂量为500mg每日两次(总日剂量为1000mg/天)、1000mg每日两次(总日剂量为2000mg/天)和1500mg每日两次(总日剂量为3000mg/天)的iw-3718作为每日一次质子泵抑制剂的辅料56天,以评估iw-3718的剂量-反应关系。在先前的2a期研究(研究icp-3718-201)中使用了1000mg每日两次剂量,并提供了合理的疗效水平和可接受的安全性和耐受性曲线。选择最高剂量水平(1500mg每日两次)以确定其是否能提供更高水平的疗效和可接受的安全性。最低剂量水平(500mg每日两次)包括在内,因为它可以证明疗效,并允许对iw-3718的剂量-反应关系进行更准确的评估。所有3种剂量下的安全性也进行了评估。
[0299]
患者随机接受500mg iw-3718每日两次、1000mg iw-3718每日两次、1500mg iw-3718每日两次或安慰剂每日两次。在随机化访视(第1天)时,研究药物的第一剂量在临床上与液体和零食一起服用。患者应在晚餐结束后立即服用第二剂,确保从临床第一剂开始至少8小时。
[0300]
在治疗期间,患者应在家中、早上(早餐后立即服用)和晚上(晚餐后立即服用)甚至在研究访问日服用研究药物。最后一次服用研究药物是在治疗结束访视的早晨。
[0301]
此外,所有患者在预处理、随机化和治疗期间(即第21天至第57天[ 3天])服用当前的质子泵抑制剂。质子泵抑制剂每天服用,大约在早餐前30-60分钟。
[0302]
在完成个人数字助理每日日记问题时,要求患者确认其质子泵抑制剂的每日剂量。
[0303]
盲板
[0304]
这项研究是双盲和安慰剂对照的。
[0305]
患者的非盲治疗任务仅限于紧急情况,仅应在需要了解治疗知识才能正确处理患者的情况下使用。除医疗紧急情况外,研究人员和失明的研究中心工作人员在进行研究期间以及在解决临床数据库中的所有差异之前(即数据库锁定时)保持盲视。
[0306]
在紧急情况下,研究者可以通过交互式网络响应系统对患者的个体治疗任务进行非盲治疗。研究人员应尽一切合理努力,在非盲治疗之前通知并与医疗监护人员或指定人员讨论需要非盲治疗的情况。如果治疗盲板破损,调查人员应记录原因和日期并签字,并尽快将非盲信息提交给申办方。如果密码被破解,患者将立即退出研究。在为了患者的安全而需要非盲治疗的情况下,赞助人也可以非盲治疗。
[0307]
既往及合并用药
[0308]
在筛查就诊时,为每位患者记录以下信息:
[0309]
患者正在服用的所有药物(正在服用)
[0310]
筛查前30天内服用的所有先前药物
[0311]
最近使用的h2受体抑制剂
[0312]
最近使用的抗酸剂
[0313]
患者在研究过程中(从筛查就诊开始)服用的任何药物,包括添加的任何新药物或先前报告的药物变化,以及使用原因。
[0314]
抢救用药
[0315]
在预处理和治疗期间,患者可使用配药、允许的抗酸剂(氢氧化镁200毫克/氢氧化铝200毫克/每5毫升,15毫升最多4次/天)作为抢救药物,当他们的烧心变得无法忍受时。每天,病人在他们的电子日记里记录使用抢救药物的次数。
[0316]
违禁药品
[0317]
在预处理和治疗期间不允许使用的药物如下。
[0318]
饮食要求
[0319]
根据纳入标准,患者必须同意在研究期间不改变其日常饮食,除非研究特定程序(如bilitec)有要求。
[0320]
安全性和有效性评估
[0321]
不良事件
[0322]
不良事件是服用药物的患者或临床调查对象中的任何不良医疗事件,不一定与该治疗有因果关系。因此,不良事件可以是任何不利和意外的迹象(例如包括异常的实验室发现),症状或疾病暂时与药物的使用有关,不论是否被认为与药物有关。
[0323]
不良事件包括但不限于:在一般情况下任何不利的变化;任何临床上显著恶化的预先存在的条件;任何并发的疾病和事故;程序不是不良事件,但程序的原因可能是不良事件。
[0324]
因果关系评估
[0325]
对于所有不良事件,研究者必须提供研究药物的因果关系评估。因果关系评估必须记录在患者的原始文档和患者电子病例报告表的不良事件页面上。因果关系必须根据以下内容进行评估:相关:事件与研究药物之间存在合理因果关系的不良事件;无关:任何其他不良事件。
[0326]
严重性评估
[0327]
研究者通过在患者源文件和患者电子病例报告表的不良事件页面上记录严重性等级,对每个不良事件的严重性进行评估。严重程度按以下等级评定:
[0328]
轻度:不良事件对患者是一种困扰,但不会进一步妨碍基线功能
[0329]
中度:不良事件使患者感到不适或干扰正常活动,但对健康无害;处方药治疗不良事件
[0330]
严重:不良事件导致患者出现严重不适或严重限制或阻止正常活动,并对健康构成一定危害;处方药治疗和/或住院治疗不良事件
[0331]
严重不良事件是指在任何剂量下发生的导致以下任何结果的不良事件:死亡;危及生命:患者在发生反应时有立即死亡的风险(即,它不包括假想可能导致死亡的反应,如果它以更严重的形式出现);住院治疗或延长现有住院时间;持续或显著残疾或无能力:严重破坏一个人正常日常生活能力的能力;先天性畸形或出生缺陷。
[0332]
重要医疗事件:可能不会导致死亡、危及生命或需要住院治疗的事件。如果根据适当的医学判断,此类事件可能危及受试者,并可能需要医疗或外科干预以防止出现本定义所列的1种结果,则可将其视为严重事件。此类医疗事件的例子包括需要在急诊室或家中进行强化治疗的过敏性支气管痉挛、不会导致住院的血液失调或痉挛、药物依赖或药物滥用的发展。
[0333]
不导致入院的急诊室就诊应评估其他严重后果(例如,危及生命的其他严重【医学上重要】事件)中的一项。
[0334]
报告不良事件、严重不良事件和妊娠
[0335]
特殊情况:怀孕期间接触研究药物
[0336]
在研究药物随机分组前报告怀孕的患者必须退出研究。怀孕被记录为筛查失败的原因。由于没有接触过研究药物,因此无需通知铁木药物的妊娠安全性。随机化后报告妊娠的患者必须立即停止研究药物。
[0337]
一般报告要求
[0338]
从患者在筛查就诊时签署知情同意书到治疗结束就诊后7天,收集并记录不良事件。研究地点在治疗结束访问后7天通过电话与患者联系,以收集与正在进行的不良事件相关的信息和与新不良事件相关的信息。所有不良事件,无论是否与研究程序或研究药物存在因果关系,都必须记录在患者的原始文档中,随后记录在患者电子病例报告表的相应不良事件页面上。此记录包括患者自发报告的不良事件、研究者观察到的不良事件,以及研究者在研究过程中回答开放性问题,如“自上次就诊以来您是否有任何健康问题?”[0339]
对于每个不良事件,调查员必须
[0340]
评估严重程度、与研究药物的因果关系以及事件的严重性;
[0341]
记录与研究药物有关的所有措施(即,未采取任何措施、治疗暂时中断或治疗中止);以及
[0342]
详细说明对不良事件采取的任何其他治疗措施,包括伴随药物和/或程序。
[0343]
预处理不良事件从患者签署知情同意书开始收集,直到患者接受研究药物。预处理不良事件记录在患者的原始文档中,但仅在患者电子病例报告表的不良事件页面上为随机患者输入。
[0344]
如果研究者认为实验室异常和生命体征、体检结果和12导联心电图参数的变化具
有临床意义和/或需要干预,则应将这些异常和变化视为不良事件,并在患者电子病例报告表的不良事件页面上报告。
[0345]
在筛查患者时出现的任何医疗状况,如果其严重程度和/或频率没有恶化,则应报告为病史,而不是不良事件。但是,如果在研究期间的任何时候病情的严重程度和/或频率确实恶化,则应报告为不良事件。
[0346]
研究者应根据其最佳医学判断采取适当的补救措施来治疗严重不良事件。应记录这些措施和患者对这些措施的反应。所有严重不良事件,无论与研究药物的关系如何,都应由研究者进行随访,直到满意的解决,研究者认为严重不良事件是慢性或稳定的,或直到患者失去随访。研究者应根据需要采用临床、实验室和诊断措施,以充分确定事件的病因。
[0347]
病史
[0348]
完整的病史按照事件表(表2)的规定进行。
[0349]
体检、体重和身高
[0350]
按照事件一览表(表2)的规定进行完整的体检。每位患者的体检应包括以下检查和评估:
[0351][0352][0353]
乳房、泌尿生殖系统和直肠检查是可选的,可由研究者自行决定。任何新的,临床上有意义的异常发现,体检报告为不良事件。
[0354]
每个患者的体重在每次研究访视时记录;身高仅在筛查访视时记录。
[0355]
心电图
[0356]
对事件(表2)进行12导联心电图,并记录在电子病例报告表上。病人仰卧至少5分钟后应作心电图检查。
[0357]
生命体征
[0358]
生命体征测量按照事件表(表2)的规定进行,并记录在电子病例报告表上。生命体征测量包括口腔温度(℃)、呼吸频率、收缩压和舒张压以及脉搏。呼吸频率、脉搏和血压读数是在患者就座至少5分钟后测量的。
[0359]
临床实验室测定
[0360]
临床实验室检查的血液和尿液样本在事件表(表2)中规定的就诊时采集。临床实验室评估包括临床化学、血液学、凝血和尿液分析参数如表1所示。
[0361]
表1.临床实验室检查
[0362][0363][0364]
缩写:a1c=糖化血红蛋白;alt=丙氨酸氨基转移酶;aptt=活化部分凝血活酶时间;ast=天冬氨酸氨基转移酶;bun=血尿素氮;cbc=全血计数;ggt=γ-谷氨酰转移酶;hdl=高密度脂蛋白;ldh=乳酸脱氢酶;ldl=低密度脂蛋白;mch=平均红细胞血红蛋白;mchc=平均红细胞血红蛋白浓度;mcv=平均红细胞体积;mpv=平均血小板体积;pt=凝血酶原时间;rbc=红细胞;rdw=红细胞分布宽度;wbc=白细胞
[0365]
在筛查和治疗结束访视时,从所有有生育潜力的女性患者(即未绝经或未进行双侧卵巢切除术、子宫切除术或输卵管结扎术的妇女)中采集用于血清妊娠试验的血样,在随机访视(给药前)和一周中采集尿样4次访问。
[0366]
这些妊娠测试结果必须是阴性的,才能符合患者资格。
[0367]
在筛查访问期间,对选定的滥用药物(可卡因、巴比妥类、安非他命、鸦片剂、苯二氮卓类和大麻素)进行尿液筛查,并对血清酒精进行筛查。
[0368]
食管胃十二指肠镜
[0369]
在所有的检查点,所有的病人在检查访问时都进行了食管胃十二指肠镜检查。在第8周/治疗结束访视时,对所有在筛查期间出现食管胃十二指肠镜的患者进行额外的食管胃十二指肠镜检查,检查结果显示为c或d级食管炎(根据洛杉矶食管炎分类;表4)。
[0370][0371]
在所有地点,所有患者都要使用设备(美国杜卢斯市given imaging)进行48至96小时的ph测试。ph监测是一种基于胶囊的、对患者友好的测试,用于确定是否存在酸回流。ph监测装置是一种无导管、胶囊型ph监测装置,连接在患者食道上。这些信息是在数天内收集的,医生可以通过确定酸回流到食道的频率和持续时间来评估反
流症状。该测试用于确认患者的症状是否由胃食管反流病引起。
[0372]
如果出于某种原因,96小时的测试是不可能的,那么大约48小时的测试是可以接受的。在ph监测的整个期间(大约48~96小时),患者在事件开始和完成时,通过按下设备上的“餐”按钮记录除水以外的任何摄取。患者还应通过在仰卧期开始和结束时按下装置上的“仰卧”按钮来记录他们躺下的任何时期。此外,在整个48-96小时ph值监测期间,患者还应填写纸质日记,至少记录所有膳食、零食、饮料和/或仰卧休息的情况。所有患者都要用ph监视器和病人日记返回现场,大约96小时后(或48小时),以返回记录装置。
[0373][0374]
在某些参与点,经食管胃十二指肠镜和检测筛选的患者在同一过程中也接受了装置的插入。患者的选择取决于研究者的选择和患者的同意。所有这些患者在拆除装置后大约24小时返回现场。参与测试的所有患者也必须遵循非常具体的程序,包括在这24小时内的“白色饮食”。
[0375]
疗效评估
[0376]
用于确定关键疗效参数的每日患者评估是对从改良反流症状问卷获得的烧心症状(按0-5顺序严重程度评分)和反流症状(按0-4顺序频率评分)的每日评估。其他评估也用于确定其他疗效参数。
[0377]
症状严重性评估
[0378]
每日评估
[0379]
在预处理和治疗期间,病人每天都要在同一时间内输入信息。
[0380]
每天晚上睡觉前完成一次胃食管反流病症状(改良反流症状问卷)。
[0381]
以下项目按0-5严重程度评分:0=没有,1=非常轻微,2=轻微,3=中等,4=中等严重,5=严重
[0382]
烧心;胸骨后或上腹部中心有烧灼感;胸骨后或上腹部中心有疼痛;吞咽困难;声音嘶哑;咳嗽
[0383]
以下项目按0-4频率等级进行评估:0=从不,1=很少,2=有时,3=经常,4=非常经常
[0384]
反刍(液体或食物)向上向喉咙或口腔移动;口腔中的酸或苦的味道;打嗝;咳嗽;消化不良症状(每日消化不良症状,附录2)每天睡前完成一次。
[0385]
所有项目均采用0-10数字评分量表进行评估,0=无症状,10=有最严重的症状
[0386]
最严重的恶心(感觉可能呕吐)
[0387]
吃完后最严重的胃胀
[0388]
你吃完饭有困难,因为你觉得吃得太快了
[0389]
最严重的腹痛睡眠评估(每日睡眠评估,附录3)每天早晨起床后完成一次(5:00am到12:00pm)
[0390]
昨晚你在睡梦中醒来了吗?是/否
[0391]
[如果有的话],你昨晚睡醒了多少次?
[0392]
你昨晚睡了多久?不要数你躺在床上但不想睡觉的次数。
[0393]
请评价你昨晚的睡眠质量。1=非常差,2=差,3=一般,4=好,5=非常好
[0394]
按方案使用救援药物(抗酸剂)
[0395]
每周评估
[0396]
以下信息每周与晚间每日评估(见附录6)同时输入电子日记:
[0397]
救济程度问题
[0398]
所有项目均采用7分平衡序贯量表进行评估:1=显著缓解,2=中度缓解,3=稍有缓解,4=无变化,5=稍有恶化,6=中度恶化,7=显著恶化
[0399]
在过去的7天里,你会如何评价你的胃灼热(胸口、胸骨后面的灼热感)?
[0400]
在过去的7天里,你会如何评价你的反胃(胃里的东西,液体或食物,向上移动到喉咙或嘴巴的感觉)?
[0401]
与你开始这项研究之前相比,你如何评价你在过去7天的胃食管反流病症状?
[0402]
全球治疗满意度评估
[0403]
以下项目按5分的顺序评分:1=非常不满意,2=不满意,3=既不满意也不满意,4=满意,5=非常满意
[0404]
你对研究治疗的满意程度如何?
[0405]
烦扰性评估。
[0406]
以下项目按5分的顺序评分:1=一点也不,2=一点点,3=适量,4=大量,5=极少量在过去的一周里,你有多少烧心(胸口、胸骨后面的灼热感)?
[0407]
在过去的一周里,你有多少被反胃(胃里的东西,液体或食物,向上移动到喉咙或嘴巴的感觉)所困扰?
[0408]
每周评估症状烦扰和症状缓解的项目用于探索应答者定义和治疗效益分析。
[0409]
胃肠道症状评定量表自我报告
[0410]
胃肠道症状评定量表自我报告是一份自填的15项问卷,使用7点李克特量表评定不适:
[0411]
1=无;2=轻微;3=轻度;4=中度;5=中度严重;6=严重;7=非常严重
[0412]
这些项目可分为5个领域:腹痛(3项)、反流综合征(2项)、消化不良(4项)、腹泻(3项)和便秘(3项)。患者应在随机化访视、第4周访视和治疗结束访视时自行完成胃肠道症状评定量表;通过便携式个人数字助手设备将反应记录在电子日记中。
[0413]
问题是:
[0414]
在过去的一周里,你是否因上腹部或胃部的疼痛或不适而烦恼?
[0415]
在过去的一周里你有没有被烧心困扰过?(胃灼热是指胸部有不愉快的刺痛感或灼热感。)
[0416]
在过去的一周里你有没有被胃酸倒流困扰过?(所谓胃酸倒流,是指从胃里倒出少量的酸或酸或苦的液体流到喉咙的感觉。)
[0417]
你有没有在过去的一周里被饥饿折磨?(这种空洞的感觉存在于气孔之间,而不需要在间隙处。)
[0418]
在过去的一周里你有没有因为恶心而烦恼?(恶心指的是一周的呕吐的感觉或呕吐物。)
[0419]
在过去的一周里,你有没有因为肚子里的咕噜声而烦恼?(咕噜声是指胃部的震动或噪音。)
[0420]
在过去的一周里你的胃感觉胀了吗?(胃胀是指胃里经常伴随着气体或空气的感觉的肿胀。)
[0421]
在过去的一周里你的胃感觉胀了吗?(胃胀是指胃里经常伴随着气体或空气的感觉的肿胀。)
[0422]
在过去的一周里,你有没有因为通气或气胀而烦恼?(通气或气胀指的是需要从肠道释放空气或气体,通常与缓解肿胀感有关。)
[0423]
在过去的一周里你有便秘的困扰吗?(便秘是指排便能力下降。)
[0424]
在过去的一周里你有腹泻的困扰吗?(腹泻是指排便过于频繁。)
[0425]
在过去的一周里,你有没有因为大便不畅而烦恼?(如果你的大便(运动)交替地变硬和变松,这个问题只指你对大便变松感到不安的程度。)
[0426]
在过去的一周里,你有没有被大便困扰过?(如果你的大便(运动)交替地变硬和变松,这个问题只指你被大便变硬所困扰的程度。)
[0427]
在过去的一周里,你有没有因为急需排便而烦恼?(这种上厕所的迫切需要常常会让人觉得你没有完全控制自己的情绪。)
[0428]
上周上厕所的时候,有没有感觉大便没有完全排空?(这种不完全排空的感觉意味着,尽管你已经尽力排便,但你仍然觉得需要排便。)
[0429]
抑郁症状学快速量表-自我报告-16
[0430]
抑郁症状学快速量表-自我报告-16是一份自行完成的问卷,旨在评估9种临床定义的抑郁症状的严重程度,范围从0(无症状影响)到3(严重影响)。rush aj等人;抑郁症状学16项快速量表、临床医生评定量表和自我报告量表:慢性抑郁症患者的心理测量评估;生物精神病学2003;54(5):573-83。该工具可用于筛选抑郁症或作为症状严重程度的衡量标准。患者在随机访视时完成抑郁症状学快速量表-自我报告-16
[0431]
短表-12v2健康调查
[0432]
短表-12v2是一种广泛使用的健康状况通用测量方法,测量8种健康概念:身体功能、身体健康问题引起的角色限制、身体疼痛、一般健康、活力(能量/疲劳)、社会功能、情感问题引起的角色限制和心理健康(心理困扰和心理健康幸福)。这8个量表被汇总成2个汇总指标:身体部分和心理部分汇总得分。患者在随机访视、第4周访视和治疗结束访视时完成短表-12v2。
[0433]
质量评价表-5d-3l型
[0434]
质量评价表-5d-3l是欧洲广泛使用的一种通用健康测量方法。欧洲质量集团。质量评价表——一种测量健康相关生活质量的新设施。卫生政策1990;16(3):199-208。第一个组成部分包括5个问题,评估以下维度:流动性,自我照顾,通常的活动,疼痛/不适,和焦虑/抑郁。对这5个问题的回答定义了一个健康状态,可以从已发布的算法中导出实用程序索引。shaw jw等人,医学护理2005;43(3):203-20。eq-5d的第二个组成部分是视觉模拟量表,要求患者将其健康状况从0分到100分(0代表可想象的最差健康状况,100代表可想象的最佳健康状况)。患者在随机化访视、第4周访视和治疗结束访视时完成质量评价表-5d-3l;反应通过便携式个人数字助手设备记录在电子日记中。
[0435]
治疗结束问题
[0436]
患者在最后一次就诊时被问到一个单独的项目,询问吞咽治疗药物的困难。这个
项目问“药片有多难咽?“并按4分顺序评分:
[0437]
1=一点都不难2=有点难3=中等难4=非常难
[0438]
改良反流症状问卷认知汇报访谈
[0439]
在临床试验的背景下,进行认知情况汇报访谈,以支持修改后的改良反流症状问卷。最初的电子改良反流症状问卷被修改,包括说明,删除多余的项目,并包括针对选定症状的替代反应量表。《器械开发指南》强调,在临床试验的目标人群中,需要有足够的经验证据来支持所需索赔的内容有效性。为此,在选定地点的病人样本被要求通过电话或面对面参加可选的症状日记访谈。
[0440]
约30名受试者从参与的网站进行访谈,5个屏幕故障,5个前处理和20个积极的治疗对象进行了采访。在一次性访谈中,要求患者回答开放性问题,以评估电子改良反流症状问卷工具的内容有效性。
[0441]
表2.事件一览表
[0442]
[0443][0444]
缩写:ae=不良事件;bp=血压;cbc=全血计数;ecg=心电图;egd=食管胃十二指肠镜检查;eot=治疗结束;eq=质量评价表;gsrs=胃肠道症状评定量表;h2ra=组胺-2受体拮抗剂;heent=头、眼、耳、鼻、喉;icf=知情同意书;iwrs=交互式网络反应系统;pda=个人数字助理;ppi=质子泵抑制剂;qid=抑郁症状快速量表;mresq-ed=改良反流症状问卷电子日记;sae=严重不良事件;sf=短表
[0445]
a、现场人员通过仓库登记访问并将其传输到相应的下一步研究中。
[0446]
b、体格检查应包括以下评估:一般外观;耳垂;颈部;心血管;呼吸系统;腹部/肝脏/脾脏;肌肉骨骼系统;淋巴结;皮肤;神经系统;神经系统和精神状态。乳房、泌尿生殖系
统和直肠曲张胺化术是选择性的,可由研究者自行决定。
[0447]
c、在访视时测身高。
[0448]
d、在筛查期间,患者开始冲洗h2受体抑制剂和抗酸剂。h2受体抑制剂应在食管胃十二指肠镜和bravo ph监测前5个自然日停止,抗酸剂应在食管胃十二指肠镜和bravo ph监测前1个自然日停止。患者在完成bravo测试后可以继续使用抗酸药,但在余下的研究中必须避免使用h2受体抑制剂。在预处理期间,患者不使用任何抗反流药物、抗酸剂和h2受体抑制剂,但作为救援药物提供的抗酸剂除外)。患者在治疗前继续使用他们目前的质子泵抑制剂。
[0449]
e、在选定的地点,为进行食管胃十二指肠镜和bravo试验的研究筛选的选定患者也可以选择在相同的手术过程中插入bilitec监护仪。这些病人将在24小时后返回,取出探针。bilitec测试结果不影响入选资格。必须同步bilitec设备和bravo记录器内部时钟,同时激活两个设备;但是,如果无法同时激活两个设备,则应首先激活bravo记录器,并在激活bravo ph记录器后立即(5分钟内)激活bilitec设备。
[0450]
f、所有患者在筛选期内都需要接受治疗。从筛选期到预处理期开始,必须至少7天。在第8周/治疗结束访视时,对所有在筛选期内获得的c或d级食管炎(基于洛杉矶分类的食管炎)患者进行食管胃十二指肠镜。
[0451]
约48至96小时的ph测试与bravo设备。如果出于某种原因,96小时的测试是不可能的,那么大约48小时的测试是可以接受的。在整个bravo ph监测期间(大约48~96小时),患者记录所有的膳食、零食和饮料,在开始和完成餐、小吃或饮料时,按下bravo记录器上的“餐”按钮。患者还可以在仰卧期开始和结束时按下bravo记录器上的“仰卧”按钮,记录他们躺下的任何时期。此外,在整个48-96小时的bravo ph监测期内,患者还完成一份纸质日记,至少记录所有膳食、零食、饮料和/或仰卧休息的情况。
[0452]
h、生命体征测量包括口腔温度(℃)、呼吸频率、收缩压和舒张压以及脉搏。呼吸频率、血压和脉搏测量必须在患者就座至少5分钟后进行。
[0453]
i、患者仰卧至少5分钟后,应获得12导联心电图。
[0454]
j、在筛选访问中收集以下优先指示:患者在筛选访问前30天内所做的所有医疗工作、最近使用的h2受体抑制剂和最近使用的抗酸。
[0455]
k、临床实验室检查包括临床化学、血液学、凝血和尿液分析。如果甘油三酯值超过方案规定的标准,且患者未处于禁食状态,则患者可返回完成禁食血脂测定。
[0456]
l、对于所有有生育潜力的女性患者,筛选访视时必须记录阴性血清妊娠试验,随机化访视时(给药前)必须记录阴性尿妊娠试验,以便患者随机化进入研究。在第四次就诊时进行尿妊娠试验;在第二次就诊时进行血清妊娠试验。
[0457]
m、患者必须在检查就诊时接受尿液药物筛查,以确定滥用药物(可卡因、巴比妥类、安非他命、鸦片剂、苯二氮卓类和大麻素)和血清酒精筛查。
[0458]
n、通过这次访问,所有患者都能从确定的肝脏中恢复过来。
[0459]
o、在随后的治疗访问中,提供和需要救援药物。
[0460]
在每一个所指示的访问中,患者提供大约1毫升唾液以供将来使用(胆汁酸在唾液中定量,胆汁酸的量可用于定义对iw-3718的潜在应答者)。在收集唾液时,研究现场工作人员将收集以下信息:一天中的时间、患者的最后一餐时间和最后一次服用研究药物的时间。
在随机化访问期间,研究地点的工作人员应在服用研究药物之前,在小吃之后立即采集唾液样本。
[0461]
q、食疗室在治疗前访视时分发,患者必须在治疗期前14个自然日内每周完成5天,才有资格进行随机分组。病人每次就诊都应带上食材。每日收集质子泵抑制剂给药、抢救用药、改良反流症状问卷电子日记(每日)、每日睡眠评估(每日)、每日消化不良症状(每日)。
[0462]
r、症状困扰和症状缓解(每周);治疗满意项目(每周)。
[0463]
s、研究药物的第一次剂量是在随机访视时在临床上使用液体和零食。在所有其他的访问中,患者在治疗前接受研究指示,但在进行额外的研究之前必须进行必要的治疗。
[0464]
t、研究药物治疗依从性被认为是不可用的药物。
[0465]
u、所有患者都需要根据iw-3718或可更换的电缆的壁厚进行评估。
[0466]
v、研究地点是在治疗结束就诊后7天通过电话联系每位患者,以收集与正在进行的不良事件/严重不良事件相关的信息以及自治疗结束就诊以来任何新的不良事件/严重不良事件相关的信息
[0467]
w、铁木可以在一周内根据需要扩展筛选周期窗口(例如,主题行程、计划问题、测试结果延迟、设备故障等)。每次拉伸前应获得铁木公司的批准。
[0468]
x、参与选择性改良反流症状问卷电子日记认知情况汇报访谈的患者被分配到三个访谈组中的一个。访谈在不同的时间点进行,具体取决于患者的小组任务。
[0469]
筛查期(第49天至第15天)
[0470]
筛查访视(访视1)程序
[0471]
签署知情同意书;在iwrs进行登记访问;审查纳入和排除标准;人口统计学;病史;体检;
[0472]
体重和身高;开始h2受体抑制剂和抗酸剂冲洗(在食管胃十二指肠镜检查和bravo ph监测[h2受体抑制剂]之前的5个自然日和在食管胃十二指肠镜检查和bravo ph监测[抗酸剂]之前的1个自然日)
[0473]
食管胃十二指肠镜检查
[0474]
大约48至96小时的ph测试与设备(如果96小时的测试是不可能的,那么大约48小时的测试是可接受的);可选24小时的胆红素测量使用bilitec装置(用于接受bilitec程序的患者-设备在24小时后被移除)
[0475]
坐姿生命体征
[0476]
12导联心电图
[0477]
既往药物(筛查前30天内服用的所有药物、最近使用的h2受体抑制剂和最近使用的抗酸剂)
[0478]
采集血液和尿液样本进行临床实验室测试,包括:
[0479]
临床化学
[0480]
血液学(全血计数);凝血;尿液分析;所有有生育潜力的女性患者的血清妊娠试验(必须确认为阴性);不良事件评估(整个筛查期);唾液收集
[0481]
筛选期延长:如果后勤延误(如受试者行程、日程安排问题、测试结果延误、设备故障等),筛选期窗口可延长一周。
[0482]
如果后勤延误需要延长一周以上,则被试被视为筛选失败,需要重新筛选。如果这
些受试者在最初的筛选期内已经完成了食管胃十二指肠镜检查/bravo(和bilitec,如果适用)评估,如果他们在评估后35天内进入治疗前,他们不需要重复这些测试。在重新筛选期间,应重复所有其他研究评估。预处理期(第21天至第1天)。
[0483]
预处理访视(访视2)程序
[0484]
在iwrs中进行登记访问;审查纳入和排除标准;体重;坐姿生命体征;既往和伴随用药;不良事件评估(整个预处理期间);抗酸救援药物分配;个人数字助理培训;个人数字助理被分发(用于记录食道中整个预处理和治疗期间的每日和每周评估);唾液收集
[0485]
在选定地点参加选择性认知情况汇报面谈的患者的一部分将在这次面谈中接受面谈。
[0486]
在选定站点参加可选的认知任务报告会的一部分患者将在这次访问中进行访谈。
[0487]
治疗期(第1天至第57天)
[0488]
对于在治疗期间的所有访问,患者在向研究站点报告之前应服用他们的ppi和研究药物(随机访问除外)。
[0489]
随机访问(访问3)程序
[0490]
在iwrs中注册访问;审查纳入和排除标准;体重;坐着的生命体征;12导心电图;伴随药物。
[0491]
采集临床实验室测试用的血液和尿液样本,包括:临床化学;血液学(cbc);凝血;尿液分析;对所有有生育能力的女性进行尿液妊娠试验(必须在给药前确认阴性);ae评估(整个治疗期间);抗酸抢救药的配药(如果需要);
[0492]
唾液收集;收集pda并查看ediary;gsrs-self;qids-sr-16;sf-12v2;eq-5d-3l;随机化;研究药物分配。
[0493]
研究药物的施用(在诊所配以液体和零食首次服用研究药物。患者应在当晚的晚饭后立即配以液体第二次服用其药物,同时应确保距在诊所中首次给药已经过去了至少8个小时)。
[0494]
第2周访问(访问4)程序
[0495]
在iwrs中注册访问;体重;坐着的生命体征;伴随药物;ae评估(整个治疗期间);抗酸抢救药的配药(如果需要);收集pda并查ediary;退还所有未使用的研究药物;分配了其他研究药物
[0496]
第4周(访问5)程序
[0497]
在iwrs中注册访问;体重;坐着的生命体征;伴随药物;采集临床实验室测试用的血液和尿液样本,包括:临床化学;血液学(cbc);凝血;尿液分析;对所有有生育能力的女性进行尿液妊娠试验;ae评估(整个治疗期间);抗酸抢救药的配药(如果需要);唾液收集;收集pda并查看ediary;gsrs-self;sf-12v2;eq-5d-3l;研究药物分配;退还所有未使用的研究药物
[0498]
在选定地点参加可选的认知任务报告会的一部分患者将在这次访问中进行访谈。
[0499]
第8周/治疗结束(eot)(访问6)程序
[0500]
在iwrs中注册访问;体检;体重;egd;坐着的生命体征;12导心电图;伴随药物;采集临床实验室测试用的血液和尿液样本,包括:临床化学;血液学(cbc);凝血;尿液分析;对所有有生育能力的女性患者进行血清妊娠试验;ae评估(整个治疗期间);唾液收集;审查
ediary;gsrs-self;sf-12v2;eq-5d-3l;退还所有未使用的研究药物;退还pda设备;治疗结束问题;跟进。
[0501]
研究站点将在eot访问后7天通过电话与所有患者联系,以收集有关自eot访问以来进行中的ae和/或sae以及任何新的ae和/或sae的信息。
[0502]
因任何原因中断研究的患者应在中断时完成eot访问时所需的评估。
[0503]
统计方法
[0504]
分析人群
[0505]
经筛选人群由同意参加研究的患者组成。
[0506]
改良的意向治疗(mitt)人群包括接受至少1剂研究治疗剂量的所有随机患者。
[0507]
符合方案人群(pp)定义为mitt人群中那些至少有6周有关胃灼热严重程度和反流频率评分的ediary数据记录,并且对目前治疗期内的研究治疗的依从性》80%的患者。
[0508]
安全人群定义为接受至少1剂研究治疗药物的所有随机患者。
[0509]
一般方法
[0510]
使用描述性统计量(n、均值、标准差、中位数和范围)汇总连续变量。使用每个类别的患者的受试者人数和比例汇总分类变量。除非另有说明,否则所有置信区间都是双向的,置信度为95%。由于试验的探索性质,因此不会对重复性进行任何调整。如果没有另外说明,则将基线值定义为在进行第1天实施研究治疗之前测得的最后一个非缺失值。所有统计分析均使用windows的版本9.3(或更高版本)进行。
[0511]
患者处置,人口统计学和基线特征
[0512]
功效分析
[0513]
表3提供了在预治疗期和治疗期中进行功效分析所允许的分析时间窗。
[0514]
表3.用于功效分析的分析时间窗
[0515][0516][0517]
a.相对于首次给药日期(第1天)。
[0518]
b.功效参数的基准值来自在预治疗期第-2周和第-1周中收集的每日ediary和ecrf数据。
[0519]
主要功效参数和次要功效参数
[0520]
主要功效参数是在第8周时每周胃灼热严重程度评分(whss)相对于与基线(即,预
治疗)的百分比变化。每日胃灼热严重程度评分(dhss)定义为使用mresq-ed仪器收集的在特定日期起测量的胃灼热的3项中的最大值;whss定义为特定一周内可用dhss的平均值。
[0521]
次要功效参数包括以下内容:第4周时whss相对于基线的百分比变化;(a)第4周和(b)第8周时whss相对于基线的变化;为总体胃灼热反应者的患者的比例;每周胃灼热反应者:whss较基线下降≥30%的患者;总体胃灼热反应者:至少在最后2周中的至少一周内以及在治疗周的一半时间内为每周胃灼热反应者的患者;在(a)第4周和(b)第8周的任何一天中,dhss不超过非常轻度(≤1)的患者所占的比例;在(a)第4周和(b)第8周,每周dhss不超过(≤1)非常轻度的天数。
[0522]
每个mresq-ed项目的基线按周变化。
[0523]
在第4周和第8周中没有胃灼热的天的比例
[0524]
dhss被定义为在特定一天的胃灼热评估中用mresq-ed仪器收集的3项中的最大值。此外,whss被定义为特定一周内dhss的平均值。
[0525]
通过两种方法计算无胃灼热天数。第一种方法使用了胃灼热域中的单个胃灼热项(mresq-ed:胃灼热),这类似于ppi文献中使用的胃灼热评级量表。第二种方法使用了胃灼热域中的所有3项(mresq-ed:胃灼热;在胸骨后或上腹部中部有灼痛感;在胸骨后或上腹中部有疼痛感)。在第一种方法中,胃灼热项需要评估为0(没有),而在第二种方法中,所有3个胃灼热域项都需要评估为0(没有)。为了分析连续参数(例如,相对于基线的绝对值变化和相对于基线的百分比变化),每个治疗组的描述性统计值(患者人数[n]、平均值、标准差、中位数和范围)均会显示。使用治疗组的协方差分析(ancova)模型对iw-3718组与安慰剂组进行比较,将食管炎层作为固定效应项,并将相应的基线功效参数值作为协变量。列出了每个治疗组的最小二乘均方(lsms),用于测试总体剂量反应的lsm之间的线性对比,每个iw-3718组与安慰剂组之间的lsms差异及其对应的置信区间以及与安慰剂的成对比较的p值。应探讨通过食管炎分层相互作用项进行的治疗,以评估是否存在定量或定性相互作用,并根据需要对每个分层进行治疗比较。按照治疗组绘制关键功效参数从基线变化的累积分布函数(cdf)。为了更好地解释各种治疗方法中cdf的图形表示,进行了两个样本的kolmogorov-smirnov试验。hollander m,wolfe da.第10章:旨在检测广泛替代方案的试验。在1973年纽约纽约州的约翰
·
威利父子公司出版的《非参数统计方法》的第219页中:p值≤0.05表示这2个治疗样本不太可能仅凭偶然从相同的连续分布中提取的。
[0526]
为了分析反应者参数(即,反应者与非反应者),针对每个治疗组计算反应者的计数和比例。使用cochran-mantel-haenszel(cmh)测试比较每个iw-3718组和安慰剂组区域之间反应者的比例,以控制食管炎分层。cmh测试主要用于分析反应者参数。列出了每个iw-3718组和安慰剂组之间反应者比例的差异,以及比值比的cmh估算值(iw-3718高于安慰剂)和相应的95%置信区间。
[0527]
其他功效参数包括:
[0528]
在平均基线反流频率≥2(有时)的患者中,从每周反流频率评分(wrfs)的基线在(a)第4周和(b)第8周的百分比变化。
[0529]
wrfs从基线更改为(a)第4周和(b)第8周
[0530]
总体反流反应者的患者比例(基线反流频率≥2[有时]的患者)
[0531]
每周反流反应者:wrfs较基线降低≥30%的患者
[0532]
总体反流反应者:在最后的2周中至少有1周且在治疗周的超过一半的时间内时是每周反应者的患者
[0533]
在(a)第4周和(b)第8周的任何一天,反流频率不超过很少(每日反流频率评分[drfs]≤1)的患者比例
[0534]
在每周drfs不多于很少(≤1)的天数中从基线到(a)第4周和(b)第8周的变化对于每天的症状评估,从基线到第8周以每周平均值的方式变化
[0535]
drfs是用mresq-ed仪器收集的特定日期的反流域评分中2个项中的最大值。同样,wrfs定义为特定一周内drfs的平均值。零drfs被视为在特定日期无反流。
[0536]
每日睡眠评估的每周平均值(醒来次数、睡眠时间、睡眠质量)
[0537]
每周症状麻烦性评估、症状缓解评估和治疗满意度评估的每周平均值
[0538]
探索性非功效参数和分析:概述在筛选期间进行或不进行胆汁反流监测的患者的患者基线疾病特征和关键功效差异;
[0539]
比较(在筛选期间,进行胆汁反流监测的患者小组中的)胆汁酸阳性患者与胆汁酸阴性患者之间的患者基线疾病特征和关键功效参数。
[0540]
评估唾液中测得的胆汁酸水平的敏感性和特异性(即受试者工作特征[roc]曲线),以胆汁反流测试结果作为参考标准对胆汁酸病理生理学进行测试(在筛选期间,进行胆汁反流监测的患者小组中的)
[0541]
利用唾液中的胆汁酸水平作为对治疗反应的预测指标
[0542]
为了分析连续参数,给出了每个治疗组的描述性统计值(n、均值、标准差、中位数和范围)。使用ancova模型将每个iw-3718组与安慰剂组进行比较,将治疗组和食管炎层作为固定效应项,并将相应的基线功效参数值作为协变量。
[0543]
安全性分析
[0544]
使用描述性统计值分析所有安全参数。对安全人群进行安全分析。安全参数包括ae、治疗紧急ae(teae)、临床实验室评估、生命体征、ecg和体检。对于每个安全参数,将在随机化之前进行的最后一次非缺失评估用作对该安全参数进行所有分析的基线。
[0545]
不良事件
[0546]
使用研究开始时可用的最新版的《监管活动医学词典》(meddra)对不良事件术语逐字逐句进行编码。如果ae的起始日期是在最初服用研究药物后且在最后一次服用研究药物的1天内,则ae(按首选术语分类)被视为teae。报告teae的患者数量和百分比按系统器官分类(soc)、首选术语和治疗组列出。报告teae的患者数量和百分比也按soc、首选术语、严重程度和治疗组列出。提供了导致研究中断的死亡(如果有)、严重不良事件、与药物相关的不良事件、严重不良事件和不良事件的清单。
[0547]
如果患者具有多于一个编码为相同首选术语的teae,则对该优选术语仅对该患者计数一次。为了按严重程度分析teae,使用患者在首选术语下的最高严重程度teae。
[0548]
ecg、生命体征和临床实验室试验
[0549]
按治疗组在每个评估时间点对ecg、生命体征和临床实验室试验结果进行描述性统计值的计算。治疗组还总结了每个基线后时间点相对于基线的变化。
[0550]
样本量的确定
[0551]
通过估计单向设计中线性趋势检验的总体功效来确定每个组的样本量,该单向设
计包含安慰剂和所有积极治疗组(500mg bid,1000mg bid和1500mg bid的iw-3718)。使用11点[0至10]nrs评估感兴趣的功效终点,其中0=无,10=非常严重。一项针对每组58名患者的研究(预期在第8周有260名患者的预期患者数)在总体趋势测试(即线性对比)中的统计功效至少为80%,其中最高的积极治疗组反映了110%的先前观察到的治疗差异,而最低的2个积极治疗组反映了55%的相同差异(两方面的,α=0.05)。在建议的样本量下,(反映先前观察到的治疗差异的)安慰剂与积极治疗组之间随后的成对比较具有80%的统计功效(两方面的,α=0.05)。
[0552]
mresq-ed要求患者自醒来后回答以下问题。
[0553]
在过去的24小时内,您如何评价[插入症状]的严重程度?
[0554]
0=没有,1=非常轻微,2=轻微,3=中等,4=中等严重,5=严重
[0555]
1.胃灼热;2.在胸骨后或上腹部中央有烧灼感;3.在胸骨后或上腹部中央有疼痛感;4.吞咽困难;5.声音嘶哑;6.咳嗽
[0556]
在过去的24小时中,您出现多久出现一次[插入症状]
‑‑
0=从未,1=很少,2=有时,3=经常,4=非常频繁
[0557]
反流(液体或食物向上流向您的喉咙或嘴巴);口中有酸味或苦味;打嗝;咳嗽
[0558]
患者每天晚上睡前应填写的每日消化不良症状。所有项目均以0到10的数字评级量表[nrs]进行评估,锚点0=没有症状,而10=极其严重的症状。
[0559]
在过去的24小时内,对您感到最恶心的状态进行分级(感觉自己可能会呕吐)。nrs锚点:0=无恶心,10=恶心到极致
[0560]
在过去的24小时内,对您吃完饭后最坏的胃部饱胀程度进行分级。nrs锚点:0=胃不饱,10=胃非常饱
[0561]
在过去的24小时内,您如何评价因您很快就饱而无法完成用餐的难度
[0562]
nrs锚点:0=没有难度,10=非常难
[0563]
在过去的24小时内,您如何评价最严重的腹部疼痛?nrs锚点:0=无疼痛,10=重度疼痛
[0564]
患者每天早晨醒来后完成睡眠的每日评估。
[0565]
醒来
[0566]
昨晚,您在入睡后又醒了吗?[醒了,没醒]
[0567]
[如果醒了],您昨晚入睡后醒了几次?[输入次数]
[0568]
睡眠时间
[0569]
您昨晚睡了多长时间?躺在床上时不要数数,但没有睡觉。[输入小时,输入分钟]
[0570]
总体睡眠质量
[0571]
请评价昨晚的整体睡眠质量。
[0572]
1=非常差2=差3=一般4=好5=非常好
[0573]
禁止的药物
[0574]
在筛选,预治疗,随机化和治疗期间,排除了以下各节中列出的所有药物。为期1天的冲洗意味着在egd和bravo ph监测之前的日历天内不允许使用特定药物;5天冲洗意味着在egd和bravo ph监测之前的5个日历日内不允许使用特定药物;14天的冲洗意味着在预治疗访问前的14个日历天内不允许使用特定药物。
[0575]
在筛选访问时,患者应服用所有伴随药物的稳定剂量,并且应打算在整个研究期间维持其常规药物治疗方案。
[0576]
在研究过程中,除非需要治疗ae或由医生开具来治疗另一个紧急医疗问题,否则在研究过程中,不允许改变伴随用药方案或使用以下所述的伴随药物外的新的伴随药物。
[0577]
1天冲洗:抗酸剂;硫糖铝
[0578]
1天冲洗
[0579]
h 2受体拮抗剂(处方或非处方[otc])(例如西咪替丁、雷尼替丁、法莫替丁和尼扎替丁)。
[0580]
14天冲洗
[0581]
胆汁酸螯合剂(例如,考来维仑(盐酸考来维仑),消胆胺和考来替泊)
[0582]
具有已知的药物相互作用或可能与考来维仑发生药物相互作用的药物(环孢霉素、左甲状腺素[和其他甲状腺替代疗法]、奥美沙坦酯、苯妥英钠、华法林)
[0583]
具有窄治疗指数的药物(例如华法林、地高辛、茶碱)
[0584]
促动力剂(例如,甲氧氯普胺、替加色罗、红霉素);抗胆碱能药和抗毒蕈碱药(例如双环胺、黄酮酸酯、东莨菪碱、莨菪碱、丙胺太林、奥昔布宁、托特罗定、索利那新、达非那新和曲司氯胺)
[0585]
[允许吸入异丙托溴铵和噻托溴铵]
[0586]
抗精神病药(例如,利培酮、氟哌啶醇、氟哌利多、氯丙嗪、奋乃静、所有吩噻嗪、喹硫平、奥氮平、氯氮平)
[0587]
gabaergics(例如巴氯芬、丙戊酸、加巴喷丁、普瑞巴林、苯二氮)
[0588]
钙通道阻滞剂(例如维拉帕米、硝苯地平、地尔硫卓、氨氯地平、非洛地平,尼卡地平、尼莫地平、尼索地平)
[0589]
β受体阻滞剂(例如美托洛尔、噻吗洛尔、阿替洛尔、倍他洛尔)
[0590]
单独或组合使用的所有麻醉剂(例如曲马多、可待因、吗啡、丙氧芬、洛哌丁胺、地芬诺酯)
[0591]
[作为用于egd的麻醉的麻醉剂在患者进入预治疗期之前需要7个日历日的冲洗。
[0592]
三环抗抑郁药(例如阿米替林、丙咪嗪和去甲替林)
[0593]
[患者可以服用另一种抗抑郁药(例如选择性5-羟色胺再摄取抑制剂{ssri}或5-羟色胺-去甲肾上腺素再摄取抑制剂{snri}药物),前体条件是剂量在筛选访问前至少稳定了30天,并且患者计划在整个研究过程中继续稳定剂量的药物。排除使用一种以上的抗抑郁药。]
[0594]
其他胃滞留药物(例如,glumetza、gralise)
[0595]
伴随药物:
[0596]
患者必须在筛选访问之前接受每日一次(qd)ppi治疗至少8周。
[0597]
如果在适当的评估(例如,病史和体检)后,研究者认为这些药物对患者的病情没有帮助,则允许每日使用雌激素和/或小剂量阿司匹林(最高162毫克/天)。
[0598]
允许偶尔使用非甾体抗炎药(nsaids)。不允许长期使用。
[0599]
含有乙炔基雌二醇和炔诺酮的口服避孕药与考来维仑具有已知的药物相互作用。使用具有上述成分的口服避孕药来避孕的所有有生育能力的女性患者必须同意从签署icf
之日起直至最终剂量的研究药物使用24小时后再使用另一种避孕方式(例如避孕套)。
[0600]
表4洛杉矶食管炎的分类
[0601]
类别定义不存在食管粘膜没有破裂(侵蚀)。(但是,可能会出现水肿、红斑或脆性。)a级一个或多个粘膜最大长度破裂不超过5毫米。b级一个或多个粘膜最大长度破裂超过5毫米,但在2个粘膜褶皱的顶部之间不连续。c级粘膜破裂,其在2个或多个粘膜褶皱的顶部之间连续,但占食管周长的75%以下。d级粘膜破裂,至少占食管周长的75%。
[0602]“白饮食”的示例:可接受的食物:水、牛奶、鸡肉、鱼、土豆。
[0603]
逐周治疗评估和结束
[0604]
缓解程度评估
[0605]
在预治疗期间开始的每周给药:您如何评价过去7天的胃灼热(胸部,在胸骨后方灼热的感觉)?您如何评价过去7天的反流(胃内食物(不论是液体还是食物)向上流向您的喉咙或嘴巴的感觉)
[0606]
在治疗期间每周给药:与开始本研究之前相比,您如何评价过去7天的总体gerd症状?
[0607]
所有缓解程度评估的反应量表:1=显著缓解2=中等缓解3=有所缓解4=不变5=有点严重6=中等严重7=非常严重
[0608]
总体治疗满意度评估
[0609]
在治疗期间每周给药:
[0610]
您对本次研究治疗的满意度如何?1=非常不满意2=不满意3=既不满意也不满意4=满意5=非常满意
[0611]
难受度评估
[0612]
在预治疗期间开始的每周给药:在过去一周中,您因胃灼热(胸部灼热的感觉,在胸骨后方)而受到困扰的程度如何?在过去一周中,您因反流(胃内食物(不论是液体还是食物)向上流向您的喉咙或嘴巴的感觉)而受到困扰的程度如何?
[0613]
1=完全不难受2=一点点难受3=适量难受4=很难受5=极其难受
[0614]
吞咽物品问题
[0615]
仅在治疗结束时给药
[0616]
片剂吞咽有多困难?
[0617]
1=一点都不困难2=有点困难3=中等难度4=非常难
[0618]
eq-5d-3l
[0619]
美国健康调查表英文版
[0620]
通过在下面每个组的一个方框中打勾,请指出哪些陈述最能描述您今天的健康状况。
[0621]
移动性
[0622]
我四处走动没有问题;我四处走动有点问题;我只能待在床上
[0623]
自己照顾自己
[0624]
我能自己照顾自己;我自己洗衣服或穿衣服有一些问题;我无法自己洗衣服或穿
衣服
[0625]
日常活动(例如工作、学习、做家务、家庭或休闲活动)
[0626]
我在进行日常活动时没有任何问题;我在进行日常活动时遇到一些问题;我无法进行日常活动
[0627]
疼痛/不适
[0628]
我没有疼痛或不适;我有中度疼痛或不适;我感到极度疼痛或不适
[0629]
焦虑/沮丧
[0630]
我并不焦虑或沮丧;我中度焦虑或沮丧;我非常焦虑或沮丧
[0631]
为了帮助人们说出健康状态的好坏,我们绘制了一个刻度(类似于温度计),在该刻度上您可以想象的最佳状态标记为100,而在您可以想象的最糟糕的状态标记为0。
[0632]
我们希望您以此刻度上指出您今天的健康状况是好是坏。为此,请从下面的方框到刻度上的任意点画一条线,以表示您今天的健康状况的好坏。
[0633]
qids-sr:
[0634]
抑郁症症状的快速量表(16项)(自我报告)(qids-sr16)
[0635]
在最能描述你过去7天中的状态的一个回答处打上勾。
[0636]
在过去的7天里
[0637]
1.入睡:
[0638]
□
1我不到30分钟就能入睡。
[0639]
□
2我花了至少30分钟才入睡,不到一半的时间。
[0640]
□
3我花了至少30分钟才入睡,超过一半的时间。
[0641]
□
4我花了60分钟才入睡,超过一半的时间。
[0642]
2.夜间睡眠情况
[0643]
□
0我晚上不会醒来。
[0644]
□
1我晚上睡不安宁,睡得比较浅,每个晚上都会醒来一会。
[0645]
□
2我一个晚上至少醒来一次,但是我很快又会睡着。
[0646]
□
3我一个晚上醒来超多一次,并且清醒的时间长达20分钟或更长,超过一半的时间。
[0647]
3.醒的太早
[0648]
□
0大多数时候,我在需要起床前已经醒了不超过30分钟。
[0649]
□
1大多数时候,我在需要起床前已经醒了超过30分钟。
[0650]
□
2我在需要起床前总是已经醒了至少约1个小时,但是我最后还是会睡着。
[0651]
□
3我在需要起床前醒了至少一个小时,但是我不能再睡着了。
[0652]
4.睡得太多
[0653]
□
0我每晚的睡眠时间不超过7-8个小时,白天也不午睡。
[0654]
□
1我24小时内的睡眠时间不超过10个小时,包括午睡时间。
[0655]
□
2我24小时内的睡眠时间不超过12个小时,包括午睡时间。
[0656]
□
3我24小时内的睡眠时间超过12个小时,包括午睡时间。
[0657]
5.感到难过:
[0658]
□
0我不难过。
[0659]
□
1我不到一半的时间感到难过。
[0660]
□
2我有一半以上的时间感到难过。
[0661]
□
3我几乎所有时间都感到难道。
[0662]
请完成6或7(不需要两项都填)
[0663]
6.食欲下降:
[0664]
□
0和我平时的胃口一样,没有变化。
[0665]
□
1我比平时少吃了一点。
[0666]
□
2我比平时少吃了很多,并且还是在自己的努力下才吃了那么点下去。
[0667]
□
3我一天之内都很少吃东西,只有硬逼自己或别人劝我吃一点的时候,我才能吃那么一点下去。
[0668]
或者
[0669]
7.食欲增加
[0670]
□
0和我平时的胃口一样,没有变化。
[0671]
□
1我需要比平时吃得多。
[0672]
□
2与平时相比,我吃得更频繁和/或吃得量也更多。
[0673]
□
3我在进餐时间和两餐时间吃得过饱,总想吃东西。
[0674]
请完成8或9(不需要两项都填)
[0675]
8.体重减轻(在过去的两周内)
[0676]
0我的体重没有变化。
[0677]
1我觉得我的体重减轻了一点点。
[0678]
2我轻了2磅或更多。
[0679]
3我轻了5磅或更多。
[0680]
或者
[0681]
9.体重增加(在过去的两周内)
[0682]
0我的体重没有变化。
[0683]
1我觉得我的体重重了一点点。
[0684]
2我重了2磅或更多。
[0685]
3我重了5磅或更多。
[0686]
抑郁症症状的快速量表(16项)(自我报告)(qids-sr16)
[0687]
10.集中注意力/做决定
[0688]
□
0我和平时一样,还是能集中注意力或做决定。
[0689]
□
1我偶尔会变得优柔寡断或觉得自己无法集中注意力。
[0690]
□
2大部分时间,我都需要努力集中注意力或做决定。
[0691]
□
3我无法集中注意力阅读或,即使小事,我都很难做决定。
[0692]
11.对自我的看法
[0693]
□
0我觉得自己和别人一样,同样是由价值的。
[0694]
□
1我比平时更容易自责。
[0695]
□
2我总是觉得自己会给别人带来麻烦。
[0696]
□
3我几乎一直在思考自身存在的大大小小的问题。
[0697]
12.有过想死或自杀的念头:
[0698]
□
0我没想过自杀也没想过死。
[0699]
□
1我觉得生活很空虚,或在思考是否值得活下去。
[0700]
□
2我一周总有几分钟想到过自杀或死亡。
[0701]
□
3我一天多次想到自杀或死亡,或者我都制定了自杀的详细计划,或我实际上已经尝试过结束自己的生命。
[0702]
13.一般兴趣
[0703]
□
0对于我感兴趣的人或活动没有发生变化。
[0704]
□
1我发现自己对人或活动不那么感兴趣。
[0705]
□
2我发现我只对自己以前从事的一项或两项活动感兴趣。
[0706]
□
3我对自己以前从事的的活动几乎没有了兴趣。
[0707]
14.精力大小
[0708]
□
0比平时相比,精力大小没有变化。
[0709]
□
1我比平时更容易感到疲劳。
[0710]
□
2我必须花大力气开始或完成我的日常活动(例如,购物,做家务,烹饪,或工作)。
[0711]
□
3我真的无法进行大部分日常活动,因为我没那个精力。
[0712]
15.感觉慢了下来:
[0713]
□
0我按照我正常的速度思考,说话和行动。
[0714]
□
1我发现我的思维变慢了或者我声音听起来有点沉闷或微弱。
[0715]
□
2我回答大多数问题都需要个几秒钟的时间来反应,我确信我的思维变慢了。
[0716]
□
3我需要很努力才能回答上来问题。
[0717]
16.感到焦躁不安
[0718]
□
0我并没有感到焦躁不安。
[0719]
□
1我经常感到很烦躁,扭动我的双手,或需要调整我的坐姿。
[0720]
□
2我经常想走来走去,变得非常躁动不安。
[0721]
□
3我有时无法一直坐着,需要踱来踱去。
[0722]
表5 sf-手持设备健康状况单项急性召回
[0723]
[0724][0725]
mresq-ed(改良的反流症状问卷电子日记)
[0726]
认知情况汇报访谈的主要目的是评估mresq-ed的内容有效性,并定性检查rgerd患者如何思考并定义症状改善的有意义变化。
[0727]
一部分参与者(30)参加认知汇报访谈。他们分为3群组。
[0728]
群组1:群组1中的患者每天要在预治疗期间和治疗期间至少四周内完成mresq-ed(n=20)。群组1中的患者必须完成mresq-ed而非resq,才有资格参加认知访谈。
[0729]
群组2:群组2中的患者患有糜烂性食管炎(通过egd评估)和/或病理性胃酸倒流的证据(通过装置评估),并且未接受mresq-ed治疗(n=5)。筛选失败则没有资格入选群组2。
[0730]
群组3:群组3中的患者没有糜烂性食管炎(通过egd评估)和/或病理性酸倒流的证据(通过装置评估),并且未接受mresq-ed治疗(n=5)。
[0731]
群组安排在下面概述的临床试验访问期间进行访谈。
[0732]
群组1 安排在以下期间进行访谈:第4周或第8周访问
[0733]
群组2 安排在以下期间进行访谈:预治疗访问
[0734]
群组3 安排在以下期间进行访谈:在ee筛选失败后的任何时间。访谈时间安排在
同一时间
[0735]
按计划在同一天进行其他群组1或2的访谈。
[0736]
不管是哪一个群组或访谈时机如何,所有访谈参与者对mresq-ed进行认知汇报,并要求他们提供有关mresq-ed症状改善的有意义变化的输入。
[0737]
访谈材料
[0738]
患者完成的筛选问题:
[0739]
筛选问题
[0740]
1a.在过去的7天里,您有几天感到胃灼热(包括在胸骨后或上腹部中央的疼痛或烧灼感)?
[0741][0742]
如果您对上述问题1a回答了1天或以上,请回答以下问题1b和1c。如果您对上述问题1a回答“0天”,请跳至问题2。
[0743]
1b.在过去的7天里,您如何评价胃灼热的严重程度(包括在胸骨后或上腹部中央的疼痛或烧灼感)?
[0744]
□
非常轻微
[0745]
□
轻微
[0746]
□
中度
[0747]
□
中度严重
[0748]
□
严重
[0749]
1c.在过去的7天里,您如何评价胃灼热最严重时的严重程度(包括在胸骨后或上腹部中央的疼痛或烧灼感)?
[0750]
□
非常轻微
[0751]
□
轻微
[0752]
□
中度
[0753]
□
中度严重
[0754]
□
严重
[0755]
2.在过去的7天里,您有多少天出现反流(液体或食物向上流向喉咙或嘴巴)和/或反流(嘴巴感到酸酸的或苦苦的)?
[0756][0757]
现场填写的筛选表:群组2:
[0758][0759]
在继续下一部分之前,请仔细阅读以下内容:
[0760]
如果以上任何包含标准问题1至7的答案均为“否”,则请停止。该患者没有资格参加访谈。您无需填写此表单的任何其他部分。
[0761]
o如果上述纳入标准问题8的答案为“否”,则患者仍可能符合参加群组3的资格。请参阅现场完成筛选表格:群组3。
[0762]
如果1至8的这8个纳入标准问题的答案均为“是”,请继续评估以下排除标准。该患者可能有资格参加群组2中的访谈。
[0763]
[0764][0765]
在继续下一部分之前,请仔细阅读以下内容:
[0766]
如果以上任何排除标准问题的答案为“是”,则该患者不符合参加群组2的资格。
[0767]
o如果由于egd结果而上述排除标准问题3的答案为“是”,则患者仍可能有资格参加群组3。请参阅现场完成筛选表格:群组3。
[0768]
如果以上每个排除标准的答案为“否”,且以上每个排除标准问题1至8为“是”,则该患者有资格参加群组2的访谈。
[0769]
现场填写的筛选表:群组3:
[0770]
[0771][0772]
在继续下一部分之前,请仔细阅读以下内容:
[0773]
如果以上任何纳入标准问题的答案均为“否”,则请停止。该患者没有资格参加访谈。您无需填写此表单的任何其他部分。
[0774]
如果以上任何纳入标准问题的答案均为“是”,则请继续评估以下排除标准。该患者可能有资格参加访谈。
[0775]
[0776][0777]
在继续下一部分之前,请仔细阅读以下内容:
[0778]
如果以上任何排除标准问题的答案为“是”,则该患者没有资格参加该访谈。
[0779]
如果以上任何排除标准问题的答案为“否”,且以上任何纳入标准问题的答案为“是”,则该患者有资格参加该访谈。
[0780]
[0781][0782]
表6研究参与期间的ppi剂量水平
[0783]
参与试验1的各种ppi的可接受剂量水平
[0784][0785]
1.剂量水平是可接受的,前提是已对ppi治疗进行了优化。(根据研究人员的判断,优化意味着无法通过更改ppi施用的品牌或时间来进一步改善治疗。)
[0786]
2.对于右兰索拉唑、埃索美拉唑和兰索拉唑,非侵蚀性食管炎的批准剂量水平是第一个列出的剂量。然而,对于该研究来说,任何一种剂量都是可接受的。
[0787]
结果
[0788]
这是随机的、安慰剂对照的、双盲的、剂量范围的研究;对70位患者/手臂的研究。
[0789]
每周胃灼热严重性评分(whss)
[0790]
每周胃灼热严重度评分(whss)定义为每日胃灼热严重度评分(dhss)的每周平均值。dhss定义为用mresq-ed收集的特定一天中测量到的三项胃灼烧的最大值。收集数据用于改良的意向治疗(mitt)组,患者人群作为locf(被推进的最后观察);mmrm(混合模型重复测量);ee(糜烂性食管炎患者)和oc(观察病例)出场。图2-图8显示,在所有3个患者人群中,每天两次服用1500mg iw-3718的患者在第8周时与基线(bl)相比,临床上具有显著百分比变化(介于7.2%和12.7%之间)。在所有3个患者人群,对iw-3718均存在剂量依赖性的临床反应。这些结论对于ee患者以及高于0或高于或等于2.5的基线都是正确的。p值基于带有固定效应项的ancova模型中与安慰剂的成对比较,ancova模型用于治疗组、食管炎和作为协变量的基线值。使用线性对比状态执行趋势测试标称p=0.0225。ee是糜烂性食管炎患者。
[0791]
在图9-图10中显示了mitt组的总体胃灼热反应者百分比的数据。在8个治疗周中的至少4周(包括最近2周中的至少1周),总体胃灼热响应者的每周胃灼热严重度评分降低了至少30%(或45%)。重申,与安慰剂组相比,在临床上每天两次服用1500mg iw-3718的患者总体上有胃灼热反应(比安慰剂多11.9%至15.8%;对于ee患者,介于19.4%至22.2%之间比使用安慰剂的人更多)。对iw-3718也有临床上显著的剂量依赖性反应。
[0792]
mitt患者(mmrm或混合模型重复测量)的基线在每周返流频率评分(wrfs)中的变化百分比的数据显示在图11-15中,在服用iw-3718的患者中,以剂量依赖性方式观察到临床上基线的显著下降。对于ee患者,对于bl大于0且bl大于或等于2的情况,这是正确的。每周返流频率评分(wrfs)定义为每日返流频率评分(drfs)的每周平均值。drfs被定义为从特定的一天开始测量反流的两个项目中的最大值,如用mresq-eddata收集的,用于mitt人群的总反流反应者的百分比在图16-18中示出。在服用以下药物的患者中,观察到在8个治疗周中有4个治疗周,总的反流反应者的临床显着百分比增加(总反流反应者的wrfs降低了至少30%(45%)。iw-3718(介于12.0%至26.8%之间),呈剂量依赖性。同样,对于ee患者,bl大于0且bl大于或等于2的情况也是如此。
[0793]
图19中显示了mitt人群的胃灼热(hb)、反流(rg)和gerd的缓解反应者百分比的数
据。在8个治疗周中的4个治疗周中,“缓解程度百分比”得到“显着”或“中度”缓解。服用iw-3718的患者观察到临床上显着的剂量依赖性反应,比安慰剂增加5.5%至12.9%。
[0794]
对于mitt人群,还观察到治疗期间夜间醒来的改善。见图20。
[0795]
图21显示了mresq-ed验证结果的摘要。iw-3718上的大量受试者都获得了gerd症状缓解。
[0796]
总体而言,没有安全问题。没有死亡事件,严重的不良事件很少(每组1-2人,全部不相关),很少患者因不良事件而退出(每组1-3人;2名iw3718患者因便秘而退出研究;iw-3718患者的teae率为42-52%,安慰剂患者为41%;iw-3718患者的便秘率为7.4-8.5%,与安慰剂患者(7.1%)相似。
[0797]
实施例2:健康受试者中进行的单中心,开放标签,随机,单剂量,3道闪烁的显像研究有3个时期,每个时期具有设计用于评估iw-3718的体内性能的不同早餐组合物,iw-3718的体内性能会与喂食状态的立即释放胆汁酸螯合剂的性能进行比较。
[0798]
这项研究的目的是比较500毫克iw-3718片剂在喂食状态下与即释剂(比较产品速释型cholestagel(考来胶)[胆汁酸螯合剂;625毫克])相比较的保胃性能。早餐后使用不同脂肪和卡路里含量的两种药物,研究两种药物的胃肠道保持性能。
[0799]
推荐的胆固醇剂量为每天6
×
625毫克片剂;在该研究中选择的剂量为3个时期中的每个时期为1
×
625毫克片剂。该剂量完全在建议的每日剂量之内,从而限制了健康志愿者的照射量,但足以通过闪烁显像分析观察片剂的崩解。
[0800]
该研究的目的是显示早餐后速释型胆汁酸螯合剂与iw-3718的胃保留差异、脂肪和卡路里含量不同。因此,最小化的可变性有利与实验的进行。因此,健康的志愿者是这项研究的最合适人群。
[0801]
欧洲药品管理局(ema)建议包括18至55岁年龄段的体重正常且非吸烟者且无酒精滥用药物史的受试者。提出后一个标准是为了避免药物代谢相互作用和避免不合规。
[0802]
因为gerd对大约20至50年的年龄的男性和女性的影响均相等,男性和女性受试者均符合这项研究的条件。在筛选和入院(第1天)时进行了妊娠测试,阳性结果将受试者排除在研究之外。
[0803]
在健康志愿者中的相互作用研究中,当与口服避孕药同时给药时,cholestagel(考来胶)降低了炔诺酮的cmax以及炔雌醇的auc和cmax。口服避孕药一小时后服用cholestagel(考来胶),也观察到这种相互作用。因此,本研究禁止采用激素避孕方法(口服、注射、透皮、阴道内、子宫内激素释放系统)的妇女。
[0804]
iw-3718(胆汁酸螯合剂)通常是胃肠道中与胆汁酸结合的、口服的、非吸收性的、不易消化的聚合物。2000年,colesevelam(考来胶)在美国被批准作为welchol的活性成分,该药物被认为是饮食和饮食的辅助药物,并且用于减少原发性高脂血症成人的ldl-c升高。colesevelam目前仅以速释型制剂形式提供。
[0805]
在胆汁酸螯合物(welchol)的临床试验中,最常见的不良反应包括便秘,消化不良和恶心。上市后的其他不良报道包括肠梗阻、吞咽困难、食道梗阻、粪便触动、高甘油三酯血症、胰腺炎和转氨酶升高。
[0806]
剂型包含放射性核素(不超过1兆贝克的(mbq;27μci)
111
in和不超过4mbq的(108μci)
99m
tc,因此受试者应受到电离辐射的照射。此外,为了捕获伽玛闪烁显像,每次给药时,
将两个解剖标记贴在皮肤上,每个都包含
99m
tc(不超过0.05mbq[1.35μci]),有效剂量为0.04毫西弗(msv)。每个项目中一次实施的有效剂量不得超过0.53msv。这大约是英国每年平均收到的自然背景辐射的平均3个月的自然照射量(22msv;数据来自英国公共卫生[phe]网站)。可以说略少于腹部x射线产生的辐射剂量(0.7msv)。
[0807]
在受试者的胸部和四肢上的心电图贴纸可能会引起一些局部刺激,并且去除可能引起不适感,但是要密切监测受试者以确保任何局部刺激都不会持续。
[0808]
该研究的主要目的是:使用闪烁显像方法,与速释型胆汁酸螯合剂相比,评估iw-3718的体内胃保留特性。
[0809]
研究的次要目的是:确定3种不同的早餐后iw-3718的胃保留特性;
[0810]
确定3种不同的早餐后iw-3718的崩解曲线;
[0811]
在3种不同的早餐后,评估速释型片剂的崩解特性;
[0812]
提供关于口服给药后iw-3718的安全性和耐受性的其他信息;
[0813]
端点
[0814]
主要端点:受试者食用低脂高热量早餐后,iw-3718与速释型胆汁酸螯合剂在完全胃排空时间t90上的比较。
[0815]
次要端点:
[0816]
通过测量以下闪烁显像参数,比较不同早餐后iw-3718的体内转运和崩解:胃排空情况、初始和完全崩解的时间和位置、侵蚀率。
[0817]
通过测量以下闪烁显像参数,比较不同早餐后速释型胆汁酸螯合剂片剂的体内转运和崩解:胃排空、初始和完全崩解的时间和位置。
[0818]
通过评估来收集有关iw-3718的安全性和耐受性的更多信息:身体检查、安全实验室测试、生命体征、ecgs和aes。
[0819]
研究设计
[0820]
研究计划
[0821]
这是针对健康受试者的单中心、开放标签、随机、单剂量3道闪烁显像研究,分为3个时期,每个时期具有不同的膳食组成。计划在临床研究结束时招募18名健康受试者,以收集15位可评估受试者的数据。如果受试者至少有一项闪烁显像评估,则认为该受试者可评估。
[0822]
受试者将接受筛选程序以确定其在筛选访视中的研究资格(可能发生在第2天至第28天)。每个时期均遵循相同的研究设计。图22显示符合条件的受试者应三次进入成像设备过夜,每次至少7天,但不超过3周。在给药前一天的晚上(第1天)入院,并留在现场直至给药后24h。在每个学习日中,受试者均接受以下3种不同的早餐之一:
[0823]
方案a:高脂,高热量-1000%的热量,50%的脂肪
[0824]
方案b:低脂,高热量-1000卡路里,33%脂肪,
[0825]
方案c:低脂,中低热量-500卡路里,33%脂肪
[0826]
将受试者以1:1:1:1:1:1的比例随机分配给6种可能的进餐顺序中的1种。表7显示在每个时期,受试者接受一粒500毫克的
111
in标记iw-3718片剂在适当的早餐结束后约30分钟,再服用一片625mg速释型
99m
tc标记的胆汁酸螯合剂。
[0827]
在禁食10小时(h)后,受试者应在imp给药前30分钟(分钟)开始分配早餐,并应在
25分钟内均匀地进餐;受试者应食用100%的膳食。早餐开始后30分钟管理imp。将测试产品与240毫升水一起使用,直到给药后4小时才允许进食。可以根据需要服用水,除了imp注射前后1小时。在研究的每个时期中,受试者会同时接受标准餐。
[0828]
根据随机化时间表,每个研究受试者的三个研究周期中的一个依次接受以下的配体:
[0829]
表7:研究用药品(imp)
[0830][0831]
施用imp后立即获取前后闪烁图像,然后给药后24小时的选定时间点也会获取前后闪烁图像。
[0832]
使用计算机生成的随机化时间表,将受试者编号重新分配给序列。表8.分配是平衡的,有3个受试者接收每个序列。
[0833]
表8:治疗顺序
[0834]
治疗序列治疗周期1治疗周期2治疗周期31药食摄入方式a药食摄入方式b药食摄入方式c2药食摄入方式a药食摄入方式c药食摄入方式b3药食摄入方式b药食摄入方式a药食摄入方式c4药食摄入方式b药食摄入方式c药食摄入方式a5药食摄入方式c药食摄入方式b药食摄入方式a6药食摄入方式c药食摄入方式a药食摄入方式b
[0835]
受试者撤销
[0836]
由于以下原因撤回受试者:
[0837]
经历严重或严重的ae,包括但不限于:校正的qt(qtc)间隔》500ms或从基线开始增加的qtc间隔》60ms(在重复ecg后确认);丙氨酸氨基转移酶(alt)浓度》3
×
参考范围的上限;终止研究;应受试者的请求(撤回同意);与协议的重大差异;并发疾病或需要禁用药物;
由研究人员酌情决定。
[0838]
由于imp相关的ae或研究的终止而提前中止研究的任何受试者被认为已经完成了研究,并且不被替换。因其他原因退出的受试者可以更换。该研究最多可招募3名替代受试者。可以分配的受试者的最大数量为21。退出受试者的原定下一个计划方案一起注射在了其他受试者身上,并且他们没有接受退出受试者已经接受的任何治疗方案。如果受试者具有至少一项闪烁显像评估,则被视为可评估受试者。
[0839]
受试者的选择
[0840]
在研究入组之前的最近12个月内,从每个受试者的全科医生(gp)处获得了完整的医学史。每个受试者的gp都被告知他们参加了该研究。
[0841]
在受试者入院之前,检查了防止过度志愿服务系统(tops),以确保每个受试者在给药日期后至少3个月内未参加过其他地点的研究。
[0842]
至少在筛查访视的前一天,向受试者提供研究的书面解释。医师或护士向每个受试者解释研究的性质,目的,预期持续时间以及参与研究所涉及的收益和风险。受试者被告知,出于安全原因,可能会向在当地进行临床研究的其他部门和公司透露其参与研究的简短细节。然后,受试者可以有机会提出自己的问题并在没有偏见的情况下退出研究。经过上述解释之后,在进入研究之前,受试者自愿签署知情同意书(icf)。与女性受试者讨论了国家放射防护委员会(1993)关于可能怀孕妇女的电离辐射暴露的建议,并在每个研究期之前使用敏感性尿液筛查试剂对其进行了测试。发现怀孕或无法合理排除怀孕的任何受试者,应退出研究。
[0843]
包含标准
[0844]
健康男性或未怀孕,不哺乳的健康女性
[0845]
年龄为18至55岁
[0846]
体重指数》18.5至≤32.0kg/m2,或者,如果超出该范围,则研究者认为其在临床上无意义
[0847]
受试者必须证明其吞咽空的000胶囊的能力
[0848]
必须愿意并且能够交流和参与整个研究
[0849]
必须提供书面知情同意书
[0850]
受试者同意从icf签署之日起到随访期间,不做任何主要的生活方式改变(例如,开始新的饮食或改变其运动方式)。
[0851]
必须同意使用适当的避孕方法。
[0852]
本研究禁止女性使用荷尔蒙避孕方法(口服、注射、透皮、阴道内、子宫内激素释放系统)。
[0853]
排除标准
[0854]
在过去3个月内在临床研究中接受过任何imp的受试者
[0855]
是研究场所的雇员,研究场所的直系亲属或赞助者雇员的受试者
[0856]
先前已参与本研究的受试者
[0857]
过去2年中有任何药物或酒精滥用的病史
[0858]
男性每周》21单位,女性每周》14单位的常规酒精消费(1单位=1/2品脱啤酒、25ml40%的烈酒或125ml葡萄酒)
[0859]
当前的吸烟者和最近12个月内吸烟者。筛查时呼吸一氧化碳读数大于10ppm。
[0860]
电子烟和尼古丁替代产品的当前用户以及最近12个月内使用这些产品的用户。
[0861]
怀孕或哺乳的有生育能力的女性(女性受试者在筛查时必须具有阴性的血清妊娠试验,而在入院时必须具有阴性的尿液妊娠试验)。除非长期不育(子宫切除术,双侧输卵管切除术或双侧输卵管切除术)或绝经后(在没有其他医学原因的情况下没有经血12个月且血清促卵泡激素[fsh]浓度≥40iu),否则认为该妇女具有生育潜力。/升)
[0862]
包括本研究在内的辐射照射,不包括背景辐射,但包括诊断x射线和其他医学照射,在过去12个月中超过5msv,在过去5年中超过10msv。根据《1999年电离辐射法规》的规定,任何职业中会被辐射照射的工作者均不得参与研究。
[0863]
根据研究者的判断,在筛选时具有临床意义的异常生物化学、血液学、凝血或尿液分析测试异常结果
[0864]
在筛查时受试者的alt,天冬氨酸转氨酶或肌酐水平升高(》1.25
×
正常上限)
[0865]
在筛查时阳性滥用药物测试结果
[0866]
在筛选具有临床意义的心血管、肾脏、肝、呼吸、代谢、血液学、肺、骨骼肌、皮肤病学的历史的阳性乙肝表面抗原(hbsag),丙型肝炎病毒抗体(hcv ab)或人免疫缺陷病毒(hiv)结果,泌尿生殖系统、眼睛、耳朵、鼻子和喉咙、精神病、神经系统疾病、尤其是胃肠道疾病、尤其是消化性溃疡、胃肠道出血、溃疡性结肠炎,克罗恩病、肠梗阻或肠易激综合症
[0867]
胆囊结石的病史,包括无症状胆囊结石,胆绞痛,胆道阻塞
[0868]
受试者具有恶性病史,在过去的5年中被诊断或已知为活跃或积极治疗的,除了切除的恶性程度低的病变(例如基底细胞皮肤癌)
[0869]
受试者的12导联心电图显示严重心动过缓(心率《40bpm)或使用fridericia公式(qtcf)校正的心率平均qt间隔:
[0870]
对于男性受试者,≥450ms;对于女性受试者,≥470ms(如果在初始ecg上,qtcf超过标准,则将ecg再重复2次,并使用3个qtcf值的平均值确定受试者的合格)。
[0871]
对任何药物或制剂赋形剂的严重不良反应或严重超敏反应
[0872]
根据研究者的判断,需要治疗的临床上显着过敏的存在或历史。除非处于活跃状态,否则允许花粉症。
[0873]
在过去3个月内捐献或损失的血液超过400毫升
[0874]
在imp施用前的14天内正在服用或已经服用任何处方药物(局部药物除外)的受试者。如果认为不影响研究目的,则可以逐案适用例外。
[0875]
在imp给药前7天内服用或已服用任何非处方药(每天4g扑热息痛和局部用药除外)或草药的受试者。如果认为不影响研究目的,则可以逐案适用例外。
[0876]
除轻微的皮肤病学程序外,受试者在第1天之前的30天内接受了外科手术。
[0877]
包括胆囊切除术在内的胃肠道手术史(阑尾切除术除外,除非在过去的12个月内进行过)。
[0878]
受试者患有急性或慢性病,研究者认为这将限制受试者完成或参与该临床研究的能力
[0879]
在预测的第一个研究日之前的7天中,急性腹泻或便秘。如果筛选在第一个研究日之前》7天发生,则应在第一个研究日确定该标准。腹泻被定义为每天有3次以上的大便次数
和/或大便次数。便秘被定义为比隔日更频繁地打开肠子
[0880]
吞咽困难、吞咽障碍或胃肠道阻塞的病史
[0881]
由于任何其他原因未能使健康调查者满意
[0882]
不满足研究的纳入/排除标准的健康受试者不应无例外地加入研究。
[0883]
避孕
[0884]
与具有生育潜能的伴侣发生性行为的男性受试者必须与伴侣一起使用避孕套以及经批准的高效避孕方法,从知情同意开始直至研究出院后90天,因为对imp进行了放射性标记。具有性活跃能力和生育能力的女性受试者必须与伴侣一起使用经过批准的有效避孕方法,从知情同意的时间到研究出院后30天,因为imp被放射性标记。
[0885]
以下方法是可接受的:可植入子宫内装置(iud)和外科手术灭菌(例如输精管切除术或双侧输卵管结扎术)。另外,如果真正的节制符合受试者的惯常生活方式,则可以接受。定期禁欲,例如排卵,症状热,后排卵方法和戒断是不可接受的避孕方法。如果受试者通常不具有性活动能力但变得活跃,则他们必须与伴侣一起遵守上述详细的避孕要求。
[0886]
没有生育能力的女性受试者不需要使用任何避孕方法。除非绝经后或永久不育,否则认为女性具有生育能力。永久性灭菌方法包括子宫切除术,双侧输卵管切除术和双侧输卵管切除术。绝经后状态定义为12个月内没有月经,无其他医疗原因,并且经fsh≥40iu/l能被证实。
[0887]
在研究过程中辐射伴侣
[0888]
存在通过射精(也适用于输精管切开的男性)的辐射暴露的显着风险,其可能对性伴侣(男性和女性)包括男性受试者的怀孕伴侣有害。因此,在整个研究过程中以及研究出院后的90天内,所有男性受试者都应使用安全套。
[0889]
男性受试者在研究期间和最后一次给药后至少90天不应捐赠精子。
[0890]
指示受试者如果他们/他们的伴侣在研究期间怀孕,则应将其报告给研究者。还应通知研究人员研究期间发生怀孕,但研究完成后再确认。如果受试者/受试者的伴侣在被纳入研究后随后被发现怀孕,则应征得该伴侣的同意,如获准,则应进行任何妊娠以及母亲、带孩子的人、母亲的身分。在研究期间报告怀孕的任何受试者都将退出研究治疗。
[0891]
其他研究限制
[0892]
受试者入院前24小时不得吃任何可能干扰胃肠道转运的东西(例如,辛辣或高脂肪餐,例如咖喱或炸鱼和薯条或高纤维含量的食物,例如全麦)直到最终剂量后24小时。
[0893]
受试者必须在筛选之前的48小时内和入院前的48小时内戒酒,直到最终剂量后24小时。
[0894]
从入院前12个月直至最终剂量后24小时,受试者不得吸烟或使用含尼古丁的产品。
[0895]
从入院前48小时直到最终剂量后24小时,受试者不得喝液体或吃含咖啡因的食物。
[0896]
从入院前72小时直到最终剂量后24小时,受试者不得喝液体或吃含葡萄柚或蔓越莓的食物。
[0897]
受试者应避免在筛选前48小时和入院前48小时进食含罂粟种子的食物,直到最终剂量后24h。
[0898]
从筛选访视之前的72小时开始,然后从入院之前的72小时开始,受试者不得参加任何不习惯的剧烈运动,直到退出研究为止。
[0899]
学习程序
[0900]
筛选
[0901]
在第一剂之前的28天之内,所有受试者都必须接受筛选访视。如果由于任何原因推迟了研究的开始,以至于筛选和首次给药之间的间隔超过28天,则由研究者决定是否重复全部或部分筛选程序。先前接受过另一项研究筛查或经过一般筛查的受试者,只要符合受试者选择标准,便可以参加此研究。从以前的研究或访视中筛选数据被认为足以满足本研究的要求。仅在上次研究或就诊时未执行本规程要求的程序,并且可以在进项目第1天进行。如上所述,所有筛选数据必须在服用研究药物之前28天内获得。
[0902]
受试者重新筛选
[0903]
该研究允许对由于研究前失败而中止该研究的受试者进行重新筛选(即,该受试者尚未被随机化/尚未被治疗);失败的原因必须是暂时的并且可以解决。如果重新进行筛选,则必须重新从受试者处取得同意。
[0904]
入院和给药前程序
[0905]
在1日入院并在第1天给药前确认受试者的身份。此外,在1日入院并在第1天给药前重新评估受试者的持续资格。如果在2天内服药,则在任何组中,对于任何组中的首次用药场合,都不需要重复进行入院程序。
[0906]
受试者在给药前一天的晚上(第1天)入院。
[0907]
研究日程序
[0908]
在研究期间,每个受试者的总血量不超过100ml。
[0909]
有时协议需要在同一时间点完成多个过程。在这些情况下:闪烁成像优先于其他程序,因此在标称时间收集;在标称时间之后记录生命体征;心电图记录在标称时间之前采集;所有安全性评估均相对于给药开始计时并执行。
[0910]
从临床单位出院
[0911]
在剂量后24小时完成特定于研究的程序后,允许受试者离开房舍,条件是:
[0912]
在研究访视期间没有报告ae
[0913]
当被问到他们是否感觉良好时,受试者做出肯定的回答
[0914]
如果不满足这些条件中的任何一个,则仅允许受试者在研究者或具有适当资格的代表的授权下离开临床单元。
[0915]
后续行动
[0916]
在最终剂量后3至5天进行随访电话,以确保受试者的持续健康。如果受试者报告可能引起关注的任何不良事件,则要求他们前往诊所进行进一步的随访评估(作为计划外的就诊)。最后一次随访电话或计划外随访的完成被视为研究结束。
[0917]
受试者的剂量
[0918]
食物和液体摄入
[0919]
需要在每个时期的第一天由临床工作人员控制膳食(早餐)。膳食在正常时间提供。为受试者提供了受限制的早餐菜单。
[0920]
在每个研究日中,受试者接受3种不同早餐中的1种:
[0921]
高脂,高热量-1000卡路里,脂肪含量50%
[0922]
低脂,高卡路里-1000卡路里,脂肪含量33%
[0923]
低脂,中低卡路里-500卡路里,脂肪含量33%
[0924]
进餐的开始和停止时间必须记录在源工作簿中,并且在进餐量不足100%的情况下,进餐的百分比和原因会记录在后。
[0925]
在源工作簿中记录的消耗必须《100%。受试者预期应食用100%的膳食。
[0926]
在计划的给药时间之前的1小时内允许受试者喝水,并在给药后1小时提供240毫升水。可以根据需要服用水,除了imp注射前后1小时。在服药当天的午餐时间起,可随意饮用不含咖啡因的液体。
[0927]
向受试者提供轻食,然后在第二天根据随机化安排向他们提供早餐时,轻食与所有食物和饮料(水除外)相距至少10小时,直到第二天早晨。
[0928]
早餐应在最多25分钟内食用,并且在早餐开始后约30分钟内开始加药。应鼓励受试者在25分钟内平均进餐。众所周知,有些受试者吃的时间更少,但是在早餐开始后约30分钟仍应服用。给药后4小时内不允许再进食。
[0929]
在给药后约4小时提供午餐,并在给药后约10小时提供晚餐。随后的几天,将在适当的时间提供饭菜。在研究的每个时期中,受试者将在同一时间安排接受标准化的进餐。
[0930]
受试者每天接受2000卡路里的热量。午餐时,所有受试者都摄入约500卡路里(约33%的脂肪);晚餐时,受试者的卡路里平衡与目标脂肪含量(占每日总卡路里的百分比为33%)保持平衡。因此,接受高卡路里早餐的受试者将接受500卡路里的晚餐,而接受低卡路里早餐的受试者将获得1000卡路里的晚餐。
[0931]
测试制剂的给药
[0932]
在每个研究期的第1天的早晨给受试者给药。给药的确切时间根据物流情况而定。受试者分别在3次不同的情况下接受两种imp的同时给药,每次给药之间的冲刷时间至少为7天,但不超过3周。口服后立即给予240ml水。
[0933]
在研究的所有临床时期中,研究人员观察受试者以确保遵守所有研究程序,包括剂量给药。闪烁显像证实吞咽片剂的顺应性。
[0934]
从入院前14天直到随访,不允许处方药物,包括激素避孕药和激素替代疗法,但以下情况除外:
[0935]
处方局部用药
[0936]
研究者认为治疗ae具有必要的那些处方药。
[0937]
未考虑到pi和申办者的医疗监护人同意的研究目标。
[0938]
除以下情况外,从入院前7天开始不允许使用非处方药或草药:单一成分的扑热息痛产品(每天最多4克);允许外用药物;未经pi和申办者的医疗监护人同意,不得视为干扰研究目标。
[0939]
伽马闪烁显像评估
[0940]
伽马闪烁显像程序
[0941]
对于方案a,b和c,如下进行体内伽马闪烁显像:
[0942]
将包含不超过0.05mbq(1.35μci)
99m
tc的前部解剖学标记物粘贴到锁骨中线与右肋缘相交的皮肤上,使得其位于与幽门大致相同的横向平面中。包含不超过0.05mbq(1.35μ
ci)
99m
tc的第二个解剖标志物直接与前标志物紧贴在皮肤后方。所有图像都是在拍摄受试者站在伽马相机前面的情况下获取的。
[0943]
使用具有40厘米视场(fov)并装有中能平行孔准直仪的伽马相机记录前持续时间和后持续时间的至少50s闪烁双同位素图像。图像持续时间将根据需要增加以确保数据质量。
[0944]
在给药后立即记录图像,然后以约10分钟的间隔记录直至给药后1小时,以每15分钟的间隔记录给药后1小时至4小时,以每30分钟的间隔记录给药后4小时至8小时。给药8小时后,以1h的间隔获取图像,直到给药后16h,并在给药后24h收集最终图像。
[0945]
提供的成像时间表是指导。采集的实际时间由执行图像的工作人员控制;但是,应在标称时间的
±
5分钟内记录图像。记录实际图像时间。
[0946]
通常,在每个时间点都需要一对图像。但是,如果单个fov不能涵盖gi区域内放射性的整个扩散,则可能需要第二对图像。例如,如果在拍摄过程中受试者移动了,或者需要调整相机的位置,则可能还需要重复图像。还可以对时间表进行调整,以留出时间来更改固定标记以保持图像质量。这些因素可能会影响成像计划。
[0947]
安全性评估
[0948]
不良事件的定义和分类
[0949]
ae是在受试者中在给药前(称为给药前ae)或一旦施用药物后发生的任何不良医学事件,包括不一定由该产品引起或与之有关的事件。药物不良反应是指与imp至少有合理因果关系(可能相关或相关)的任何ae。从受试者签署icf直到最后的随访电话之后,一直监测不良事件。不良事件的严重程度评估如下:
[0950]
轻度:受试者容易容忍的ae,引起最小的不适并且不干扰日常活动
[0951]
中度:足以使正常的日常活动干扰的不良事件;可能需要干预
[0952]
严重性:阻止正常日常活动的ae;通常需要的治疗或其他干预措施
[0953]
因果关系评估
[0954]
研究者应尽一切努力尝试解释每个ae并评估其与imp的关系(如果有)。在因果关系评估中应考虑事件与imp管理之间的时间关系(即,如果事件在imp管理之后不久就开始并且在imp停止时就解决了)。
[0955]
应使用以下类别评估因果关系:
[0956]
不相关:与imp给药的时间关系不相容的临床事件,可以用潜在疾病或其他药物或化学药品解释,或者与imp毫无争议地无关
[0957]
可能相关:与imp施用具有合理时间关系的临床事件,并且不太可能归因于并发疾病或其他药物或化学物质
[0958]
相关:与imp给药具有合理时间关系的临床事件,并且不能由并发疾病或其他药物或化学药品解释
[0959]
ae归因于imp给药的确定性程度(或其他原因,例如潜在疾病的自然病史,伴随疗法等),取决于对一种经验的理解程度。或以下一项或多项:imp的已知药理学;先前已与imp或此类药物观察到类似性质的反应;经验与时间有关,与imp管理有关,终止于imp退出或再次挑战时;替代原因。
[0960]
严重不良事件(sae)定义为在任何剂量下发生的任何不良医学事件:威胁生命;需
要住院或延长现有住院时间;导致持续或严重的残疾或丧失能力;由先天性异常或先天缺陷组成;pi sae认可的重要医学事件必须立即报告给申办者。
[0961]
可疑的意料之外的严重不良反应的定义:可疑的意料外的严重不良反应(susar)是被认为与imp有关的ae,并且是意料之外的和严重的。
[0962]
实验室测量:血液和尿液样品的结果由医师审查并在对受试者进行剂量给药或接受其下一次剂量或从研究中适当释放之前对其采取行动。
[0963]
血液学,临床化学和凝血;实验室测试由医生实验室执行。禁食状态下采集血液样本并进行处理。
[0964]
用于实验室评估的与标称血液采样时间点的可接受偏差是:
[0965]
给药前≤2h的给药前血样;从标称采血时间
±
1小时内排出血样。
[0966]
尿液分析:使用量液计在现场进行尿液分析。如果需要显微镜检查,则将尿液样本送至医生实验室。
[0967]
尿液分析与标称尿液采样时间点的可接受偏差为:
[0968]
在给药前或一天中的第一个空缺之前≤3h采集给药前尿液样本
[0969]
排出尿液样本应在标称尿液采样时间的
±
2小时内进行
[0970]
妊娠试验
[0971]
在筛查时进行血清妊娠试验,在入院时进行尿妊娠试验。
[0972]
促卵泡激素测试
[0973]
进行血清fsh测试。
[0974]
药物筛查
[0975]
尿液药物筛查将使用量液计法在现场进行。
[0976]
酒精呼气测试
[0977]
执行酒精呼气测试。阳性结果排除了受试者在该入院期间的用药剂量。
[0978]
一氧化碳呼吸测试
[0979]
将执行一氧化碳呼气测试。大于10ppm的结果将受试者排除在研究范围之外。
[0980]
实验室异常发现
[0981]
在实验室检查结果超出正常范围并且研究者认为结果可能具有临床意义的情况下,可以根据临床指示要求重复取样。如果异常发现具有临床意义,则应采取适当的措施,例如,不让受试者进入研究或让受试者从研究中退出。如果hbsag、hcv ab或hiv检测结果呈阳性,则同样适用,此外,研究人员确保根据要求提供足够的咨询。如果研究人员认为随访评估结果异常可能具有临床意义,则可能还需要重复测试。任何临床上明显的异常,包括基线变化,都必须报告为ae。可以采取其他和/或尿液样本进行安全性测试。此外,出于研究人员要求,出于安全原因,可以执行方案中指定的方法以外的其他方法。
[0982]
生命体征测量
[0983]
受试者处于仰卧姿势至少5分钟后,由自动记录仪测量血压和心率。表12显示了测量的口腔温度。表12与标称生命体征测量时间点的可接受偏差为:
[0984]
从标称时间点开始
±
1小时进行放电生命体征测量。如果受试者在任何阶段均显示异常评估,则可以进行重复测量,并在需要时将异常消除。研究者认为必要时可以采取其他措施。任何临床上明显的异常,包括基线变化,都必须报告为ae。
[0985]
ecg测量
[0986]
如研究流程图中所详述,在受试者已仰卧至少5分钟后测量12导联ecg。与标称心电图测量时间点的可接受偏差为:
[0987]
放电ecg测量是从标称时间点开始
±
1h。如果受试者在任何阶段均表现出异常评估,则可以进行重复测量,并在需要时将异常消除。研究者认为必要时可以采取其他措施。
[0988]
任何临床上显着的异常,包括从基线的变化,都将被报告为ae。
[0989]
体重
[0990]
测量受试者的体重。
[0991]
身体检查
[0992]
对受试者进行身体检查。
[0993]
附加安全程序
[0994]
如果认为imp(一个或多个)的重要作用正在发生或可能在没有安排测量的时间发生,则可以执行协议中已经指定的其他非侵入性程序,或者为了安全起见,需要采取程序。
[0995]
如果研究人员在任何时候需要,可以采集用于安全性评估的额外血样。
[0996]
进行统计和数据分析
[0997]
进行样本大小调整
[0998]
样品量的计算是基于配对的t检验,在受试者食用低脂高卡路里早餐后,在完全胃排空时间t90时,所述t检验将iw-3718与立即释放的ceesevelam进行了比较。假设不同受试者之间的标准差为5,则15名闪烁显像可评估受试者提供了90%的能力来检测iw-3718与立即释放的colesevelam之间5小时胃滞留时间的差异。i型误差控制在0.05(双面)。
[0999]
闪烁显像数据分析
[1000]
进行定性和定量闪烁显像数据分析以确定以下参数:
[1001]
iw-3718
[1002]
90%的胃排空时间(t90)
[1003]
时间为50%的胃排空时间(t50)
[1004]
初始片剂崩解的解剖位置和时间
[1005]
片剂完全崩解的解剖位置和时间
[1006]
片剂侵蚀的定量分析
[1007]
胃排空的定量分析以包括侵蚀的片剂残留物
[1008]
如果胃中不完全崩解,则片剂的胃排空时间
[1009]
片剂在到达结肠前未完全崩解时片剂的结肠到达时间(如果适用)
[1010]
小肠运输时间(如果适用)
[1011]
速释型colesevelam
[1012]
90%的胃排空时间(t90)
[1013]
胃排空时间为50%的时间(t50)
[1014]
定量分析速释型胆汁酸螯合剂残留物的胃排空
[1015]
片剂残余物的初始和完全胃排空时间
[1016]
初始片剂崩解的解剖位置和时间
[1017]
片剂完全崩解的解剖位置和时间
[1018]
关键闪烁参数分析
[1019]
在受试者食用低脂高卡路里早餐(即方案b)之后,在完全胃排空时间(t90)时,使用非参数的统计假设检验将iw-3718与立即释放的colesevelam进行比较。
[1020]
其他闪烁参数的分析
[1021]
在受试者食用方案a(高脂,高热量)、方案b(低脂,高热量)和方案c(低脂,低热量)在胃排空时间(t90和t50)时,使用非参数的统计假设检验将iw-3718与立即释放的colesevelam进行比较。多重性没有调整。p值被视为其他闪烁参数的标称值。
[1022]
使用报告和分析计划(rap)中定义的标准,确定数据库锁定后用于安全性和闪烁显像数据的分析人群;rap将在数据库锁定之前注销。
[1023]
表9investigational medicinal products
[1024][1025]
表10缩写列表
[1026]
缩写的定义
[1027]
99m
tc
ꢀꢀ
锝-99
[1028]
111
in
ꢀꢀ
铟-111
[1029]
ae
ꢀꢀꢀꢀꢀ
不良事件
[1030]
alt
ꢀꢀꢀꢀ
丙氨酸氨基转移酶
[1031]
arsac
ꢀꢀ
放射性物质管理局咨询委员会
[1032]
chmp
ꢀꢀꢀ
dger十二指肠胃食管反流人类用药品委员会
[1033]
ec
ꢀꢀꢀꢀꢀ
道德委员会
[1034]
ecg
ꢀꢀꢀꢀ
心电图
[1035]
ema
ꢀꢀꢀꢀ
欧洲药品管理局
[1036]
fda
ꢀꢀꢀꢀ
美国食品和药物管理局
[1037]
fov
ꢀꢀꢀꢀ
视野
[1038]
fsh
ꢀꢀꢀꢀ
卵泡刺激素
[1039]
gcp
ꢀꢀꢀꢀ
良好的临床实践
[1040]
gerd
ꢀꢀꢀ
胃食管反流病胃肠道
[1041]
gp
ꢀꢀꢀꢀꢀ
全科医生
[1042]
hbsag
ꢀꢀ
乙型肝炎表面抗原
[1043]
hcl
ꢀꢀꢀꢀ
盐酸
[1044]
hcv ab 丙型肝炎病毒抗体
[1045]
hiv
ꢀꢀꢀꢀ
人免疫缺陷病毒icf知情同意书
[1046]
ich
ꢀꢀꢀꢀ
国际协调委员会imp研究药物
[1047]
ir
ꢀꢀꢀꢀꢀ
即释
[1048]
isf
ꢀꢀꢀꢀ
调查员网络档案
[1049]
ldl-c
ꢀꢀ
低密度脂蛋白胆固醇低密度脂蛋白胆固醇
[1050]
meddra 监管活动医学词典
[1051]
mhra
ꢀꢀꢀ
药品和保健产品监管机构
[1052]
msv
ꢀꢀꢀꢀ
毫西弗
[1053]
phe
ꢀꢀꢀꢀ
公共卫生英格兰
[1054]
ppi
ꢀꢀꢀꢀ
质子泵抑制剂
[1055]
qa
ꢀꢀꢀꢀꢀ
质量检查质量保证
[1056]
qc
ꢀꢀꢀꢀꢀ
质量控制
[1057]
qtc
ꢀꢀꢀꢀ
校正的qt
[1058]
qfcf
ꢀꢀꢀ
使用fridericia的公式修正了心率的qt间隔
[1059]
rap
ꢀꢀꢀꢀ
报告和分析计划
[1060]
sae
ꢀꢀꢀꢀ
严重不良事件
[1061]
sop
ꢀꢀꢀꢀ
标准操作程序
[1062]
susar
ꢀꢀ
怀疑的意料之外的严重不良反应
[1063]
teae
ꢀꢀꢀ
治疗引起的不良事件
[1064]
whodde 世界卫生组织药物词典
[1065]
表11临床实验室参数
[1066][1067]
a筛查
[1068]
b进入
[1069]
表12研究流程表
[1070]
[1071][1072]
a病史更新
[1073]
b最终剂量后24小时进行有针对性的身体检查
[1074]
c血液学、凝血学和临床化学
[1075]
d仅进入第一期
[1076]
e血压和心率。口腔温度仅在筛查时测量
[1077]
f给药后立即记录图像,然后以大约10分钟的间隔记录直至给药后1小时,给药后1小时至4小时每15分钟记录一次,给药后4小时至8小时每30分钟记录一次图像。此后,以1h的间隔获取图像,直到给药后16h,并在给药后24h收集最终图像。
[1078]
结果
[1079]
如图23-图27所示,闪烁显影显示,对于所有3种治疗方案的受试者,配制成胃滞留片剂的iw-3718保留在胃中,在胃中的平均崩解时间明显长于胆汁酸螯合剂的速释制剂。将iw-3718片剂(在18名受试者中的16名中)保留在胃中直至完全崩解。但是,速释型胆汁酸螯合剂并非如此。图23图24显示了每个受试者的结果,并且与速释剂型相比,iw-3718的放射性明显保留在胃中的时间更长。同样,从iw-3718的50%和90%的放射性离开胃要胆汁酸螯合剂的速释制剂花费更长的时间。参照图25和图26,iw-3718完全从胃中排空放射性所需的时间要长于速释型胆汁酸螯合剂中的放射性。在方案a、b排空90%的速释制剂后,仍有50%的iw-3718保留在胃中。图27。
[1080]
表13
[1081][1082][1083]
*体外崩解的时间似乎把体内的崩解的时间花费过高的预估了
[1084]
表13b
[1085]
胃排空-定量
[1086][1087][1088]
表13c片剂崩解
[1089][1090][1091]
同时见图25到图27
[1092]
表14实施例1-2中iw-3718的剂型
[1093][1094]
注意,片剂核心和片剂的重量为约1100mg,其中500mg为胆汁酸螯合剂。
[1095]
表15其他示例性剂型
[1096][1097]
实施例1-2的结果概述
[1098]
1500mg bid剂量在安全性很强的hb(胃灼热)和rg(反流)中显示出疗效,与pbo相比iw-3718观察到的hb&rg改善更大
[1099]
使用pro分析表明的患者改善阈值,临床上有意义的是,与安慰剂相比,1500mg bid的应答者多10%
[1100]
由于大多数患者的bravo(反酸)阳性,因此研究人群反映了ugerd(不受控制的gerd)人群;ee占52%
[1101]
在主要ep上相对于pbo的1500mg分化(标称p值0.04;locf)
[1102]
差异对分析方法敏感
[1103]
hb和rg的改善幅度是一致的
[1104]
ee层显示相对于总受试人群的适度增长
[1105]
在mitt中观察到iw-3718与pbo的应答率提高了约12%
[1106]
与胆汁酸螯合剂不同,闪烁显像显示iw-3718的控制释放具有延长的胃排空特性
[1107]
mresq-ed的定量分析表明,对于个体患者的44-60%的改善在临床上是有意义的。
[1108]
实施例3,随机、双盲、安慰剂对照、平行组、剂量范围探索试验,以确定长达8星期
给胃食管反流病患者口服胆汁酸螯合剂剂型的安全性和有效性
[1109]
资格标准
[1110]
纳入标准
[1111]
每个患者必须满足以下所有标准,才有资格参加本研究:
[1112]
患者在执行任何特定于研究的程序之前已经签署了icf。
[1113]
患者是非住院的男性或女性(如果是女性,则未怀孕),并且在筛查访视时至少18岁。
[1114]
患者具有gerd的诊断,并报告在筛选访视前的最后8周中平均每周≥4天经历gerd症状(胃灼烧或反流)。
[1115]
在筛选之前至少8周,患者已接受标准标记的剂量、qd、ppi治疗(根据研究者的判断,该治疗无法通过更改ppi的品牌或时间进一步改善)。患者应该采用与批准的标签一致的ppi剂量和时间表。在筛选期间修改过ppi的患者,如果他们以前未进入预处理期,则可以在标准标记的剂量、qd、ppi治疗8周后重新进行筛选。
[1116]
在筛选期间(当患者继续服用其ppi时)长达96小时的ph监测(使用装置)显示出病理性酸倒流的证据(对于记录时间的≥4.2%,ph《4)。在通过装置进行ph测试的至少24小时时间间隔内,如通过集中检查ph监测所证实的。
[1117]
在随机分组之前的最后7天中,患者报告平均胃灼烧严重程度(hs、mresq-ed中项目#1和#2的最大值)≥2(轻度),每天hs≥3(中度)至少有2天。
[1118]
女性患者必须在绝经后≥1年,并且手术不育(即,双侧卵巢切除术、子宫切除术或输卵管绝育术[系带、夹子、带子或烧伤]);或必须同意完全戒除异性恋;或者,如果是异性恋活跃者,则必须同意从她签署icf之日起至最终服用研究药物后24小时内使用以下避孕方法之一:
[1119]
a.孕酮植入物或宫内节育器(iud)
[1120]
b.两种高效的节育方法的结合(例如,隔膜杀虫剂加避孕套,避孕套与杀虫剂加隔膜或宫颈帽,激素避孕药[例如口服和透皮贴剂]加屏障方法,输精管结扎术[筛选访视或确认前≥60天进行精子分析],再加上激素或屏障方法。
[1121]
具有生育能力的女性在筛选前和随机访视前必须在尿液或血清妊娠试验中呈阴性。尿液检测结果阳性可通过血清妊娠试验确认。
[1122]
患者同意在研究期间不对他们的常规饮食或运动方案进行任何改变。
[1123]
患者在治疗期开始前的14天内,每周至少5天已至少完成电子日志问题,并且在随机分组之前的7天中至少每周一次完成了每周问题。
[1124]
在治疗期开始之前的14天内,患者符合qd ppi剂量。如电子日记中所述,如果患者每周至少5天接受ppi,则认为患者是按照规则的。
[1125]
患者能够流利并具有至少一种用于pro评估的语言的素养。
[1126]
患者能够适当地操作电子日记并且同意遵守研究要求。
[1127]
对于正在接受脂溶性维生素补充以纠正或避免脂溶性维生素缺乏症的患者,该患者愿意在服用研究药物之前至少4小时服用维生素补充剂。
[1128]
排除标准
[1129]
满足以下任何标准的患者不符合参加研究的条件:
[1130]
患者具有完全缺乏对ppi的gerd症状反应的病史。
[1131]
患者在筛查访视中报告上腹部疼痛或上腹部灼烧为主要症状。
[1132]
患者通过胃排空研究诊断出胃轻瘫、或有肠梗阻病史、或有肠梗阻的风险(例如,患者患有器质性胃肠道[gi]运动障碍或有大肠胃手术史)。
[1133]
3.患者在筛查时或在预处理期间的任何时间都具有空腹样品上的血清甘油三酸酯浓度>500mg/dl的历史,或者在空腹样品上的血清甘油三酸酯浓度>500mg/dl的历史。
[1134]
患者具有高甘油三酸酯血症诱导的胰腺炎病史。
[1135]
在研究者看来,患者容易出现脂溶性维生素缺乏症(尤其是维生素d缺乏症;例如,患者患有骨质疏松症或骨软化症),并且接受了8个月的异戊四烯酸会使其处于危险之中。
[1136]
患者患有活动性吞咽障碍,这将损害其吞咽研究药物的能力。
[1137]
患者在筛选或预处理期间的任何时间具有任何警报症状,包括但不限于胃肠道出血、贫血、呕吐或意外体重减轻。
[1138]
患者已经接受了符合以下任何标准的手术:
[1139]
a.筛查访视之前的任何时间,除了阑尾切除术,胆囊切除术或小型口腔或直肠手术(例如扁桃体切除术、痔疮切除术、直肠膨出修复)以外的胃肠道手术(包括胃束带)。
[1140]
b.在筛选访视之前的3个月内进行阑尾切除术,或者在筛选访视之前的6个月内进行胆囊切除术,或者在筛选访视之前的30天内进行小型口腔或直肠手术。
[1141]
c.在筛选访视之前的6个月内,对腹部,骨盆或腹膜后结构进行非胃肠道手术。
[1142]
d.筛选访视前的6个月内进行胸外科手术。
[1143]
e.筛选访视前30天内的其他主要非胃肠道手术。
[1144]
患者先前已经接受了胸部或腹部放射治疗。
[1145]
患者患有较大的裂孔疝(》5cm)。
[1146]
在筛查期间进行的egd显示患者患有长段的巴雷特食管(大于3厘米)或食管中明确的增生异常改变/消化性溃疡疾病/胃肠道主动性出血/有症状的食管狭窄/存在食道或胃底静脉曲张/糜烂性胃炎或嗜酸性/疱疹或念珠菌性食管炎。
[1147]
患者患有吉尔伯特病、克罗恩病、糖尿病(定义为a1 c》6.5%),佐林格-埃里森综合症、胰腺炎、胆囊炎或全身性硬化症。
[1148]
患者在筛查时或在预处理期间的任何时间都升高了血清胆红素水平(被实验室定义为正常上限的1.5倍)。
[1149]
14.患者具有对研究药物中包含的任何赋形剂(活性或安慰剂)的临床上显着的超过敏性或过敏史。
[1150]
患者具有癌症病史(切除的基底细胞癌或鳞状细胞癌是可接受的)。注意:只要有恶性肿瘤病史,且筛查访视前至少5年恶性肿瘤完全缓解,则允许患者入院。完全缓解定义为对治疗的所有癌症征兆消失。
[1151]
患者在筛查访视之前的12个月内有活性物质滥用或慢性物质滥用史(包括酒精中毒,但不包括尼古丁),或在筛查访视中对以下任何一项呈阳性,除非法律规定胃肠道疼痛除外:苯丙胺、苯二氮卓、鸦片、巴比妥酸盐、可卡因或苯环利定。
[1152]
从筛选开始到研究期间的30天,禁止使用大麻,无论是否开处方。在研究期间不允许使用违禁药物。
[1153]
患者在签署icf之后但在接受第一剂研究药物之前,在体格检查,12导联心电图(ecg)或临床实验室测试中具有任何临床上显着的发现。(注意:研究者将确定特定发现是否具有临床意义。在做出此决定时,研究者将考虑该特定发现是否会阻止患者执行任何方案指定的评估,是否可能代表排除特定疾病的疾病。研究中的患者,如果患者参加了研究,可能表示安全问题,或者可能混淆了研究中指定的安全性或功效评估。)
[1154]
患者报告在筛选或预处理期间使用了禁用药物,或者不愿或不能遵守有关使用禁用药物的限制。
[1155]
19.患者在筛选访视之前的30天内已经接受了研究药物,或者计划在研究期间的任何时间接受另一种研究药物或使用研究装置。
[1156]
患者患有急性或慢性病,研究者认为这将限制患者完成或参与该临床研究的能力。
[1157]
患者先前已进入iw-3718研究的治疗期。
[1158]
22.患者先前已经进入了该研究的预处理期。(注意:由于实验室检查结果异常或时间问题而未能通过预处理的患者可能会被重新筛查。)
[1159]
23.患者在另一个临床研究地点参加了该研究;是该机构或ironwood制药公司的雇员;或者是与该机构或ironwood pharmaceuticals的雇员居住在一起的一级亲戚,重要的其他或亲戚。
[1160]
实施例4:分散在聚合物基质中的胆汁酸螯合剂的片剂形式的两种肠溶衣口服剂型的比较数据
[1161]
表16两种制剂的组成
[1162][1163]
制剂2b包含peg-7m(聚环氧乙烷cas号25322-68-3,大约分子量300,000(polyox
tm
wsr n-750),其分子量比polyox
tm
wsr n-60k(制剂2a中的inci名称:peg-45m)。制剂2b具有比2a(25%)增加的聚环氧乙烷(46%)量。制剂2b包含bht作为抗氧化剂,以抑制氧化裂解。制剂2a不包含bht。制剂2b包含胶体二氧化硅,而制剂2a不包含胶体二氧化硅。api的来源已从formosa更改为dsm。
[1164]
将制剂2a片剂包装在带有两个2g硅胶干燥剂小袋的100cc白色不透明感应密封高密度聚乙烯(hdpe)瓶中。每个瓶子包含三十五(35)片,并装有聚丙烯防儿童(cr)瓶盖。药品冷藏保存。
[1165]
制剂2b片剂包装在aclar泡罩条中。每条包含6片。药品冷藏保存。
[1166]
稳定性
[1167]
公开的剂型的实施方案制剂2b比制剂2a稳定。图28-30显示了制剂2a和2b随时间
的药物释放数据。
[1168]
制剂2a在5℃下储存1周后比在5℃下储存1周后释放药物的速度更快;在50℃的温度下存放1周甚至更快。相比之下,制剂2b在所有3种测试条件下具有相同的药物释放特性(在5℃下储存2周后;在40℃/75%rh下储存3个月;在40℃/75%rh下储存4.5个月之后)。见图28。
[1169]
制剂2a在40℃/75rh下存储一个月后比在5℃下存储一个月更快地释放药物;在40℃/75rh下储存1个月后,制剂2b释放药物的速率与在5℃下储存1个月的速率大致相同。见图29和表17。
[1170]
表17
[1171][1172]
api来源
[1173]
制备除了api之外的两种相同的制剂;1种来自formosa,1种来自dsm。表18显示,具有dsm api的制剂(iw-eln-000433-04a)的分解速度比具有formosa的制剂(iw-eln-000433-04i)慢。
[1174]
表18
[1175][1176]
生产方法(直接压缩与干法制粒)
[1177]
制剂2a利用干法制粒工艺来辅助流动性和压缩。药品是使用mcc kg1000制造的,以实现最高压缩率,但mcc方法并不会带来最佳流动性(kg1000的粉末性质是为可压缩性而不是流动性而设计的)。配方2b是通过直接压制工艺选择而成的。对于制剂2a,直接压缩可能并非100%无法实现,但初步工作表明并非如此。直接压缩是有益的,因为它消除了单位操作,从而为每个批次节省了时间和金钱。以1200千克的规模,至少每批要生产一天。
[1178]
bht
[1179]
当抗氧化剂的总含量不超过脂肪或油含量的0.02%,包括食品的必需(挥发性)油含量时,通常认为丁羟甲苯(bht)在食品中使用是安全的(gras)。该物质是根据良好制造规范使用的。对于普通成年人每天70克脂肪的参考值,0.02%=14毫克bht。这非常符合欧洲食品安全局2012年建议的0.25mg/kg/天bht,即60公斤患者=15毫克bht。当前的iw-3718片剂的目标最大剂量为8片(4000mg iw-3718)bht约4.8mg。iw-3718中的bht含量低于公认的
安全水平。
[1180]
使用dsm api以0%(不添加bht)、0.06%(添加bht)、0.12%(添加bht)和0.2%(添加bht)制备四种制剂。这4个样品分别在50℃、75℃、50℃下保存1周,在40℃/75%rh下保存1个月后进行测试。1周后,bht为0.06%和0.12%的配方之间没有差异,因此仅进行了0.06%的测试。0.12和0.2%在以后的时间点被拉出,但从未经过测试。
[1181]
在40℃/75%rh下存储3个月后,添加了0.06%bht的制剂与在5℃下存储3个月的相同制剂一样稳定。如图30a。与在5℃下保存3个月的相同制剂相比,在40℃/75%rh下保存后不添加0.06%bht的制剂开始变得不稳定。如图30a。primera强制peo降解研究,图30b显示0.06%bht对制剂稳定性的贡献。
[1182]
其他实施方式
[1183]
前面的描述仅公开了本发明的示例性实施例。
[1184]
应当理解,尽管已经结合本发明的详细描述描述了本发明,但是前述描述旨在说明而不是限制本发明的范围,本发明的范围由所附权利要求的范围限定。其他方面,优点和修改在所附权利要求的范围内。因此,尽管仅示出和描述了本发明的某些特征,但是本领域技术人员可以进行许多修改和改变。因此,应理解,所附权利要求书旨在涵盖落入本发明的真实精神内的所有此类修改和改变。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。