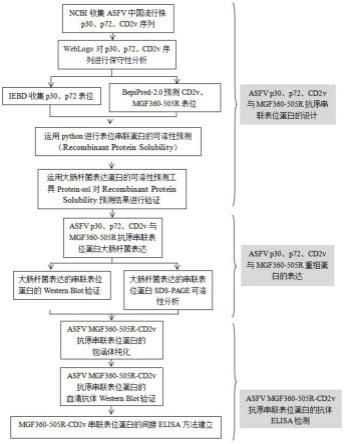
一种免疫细胞用无血清培养基
【技术领域】
1.本发明涉及免疫细胞体外培养技术领域,具体涉及一种免疫细胞用无血清培养基。
背景技术:
2.随着免疫细胞生物学及免疫分子生物学的高速发展,体细胞免疫治疗已成为肿瘤患者放、化疗后辅助治疗的重要手段之一,其对于促进患者免疫系统的重建、消除残留病灶及骨髓净化都具有良好效果。生物治疗是继手术、放疗、化疗后的第四种肿瘤治疗模式。生物治疗是通过调动宿主天然防卫机制或给予天然产生的靶向性很强的物质来达到临床治疗效果,生物领域中的一个重要方法就是免疫细胞疗法,即将分离的自身免疫细胞在体外通过细胞因子诱导,扩增出大量具有高度细胞毒性的异质细胞群,再回输到体内发挥治疗作用。此类免疫细胞的种类包括了淋巴因子激活的杀伤细胞(lak),肿瘤浸润淋巴细胞(til),细胞毒淋巴细胞(ctl)等,在众多的免疫细胞中,cik细胞由于有杀瘤活性高,杀瘤谱广,对多种耐药细胞同样敏感以及对正常骨髓造血前提细胞毒性更小等优良特点,广泛的应用于临床。
3.体细胞免疫治疗,是向肿瘤患者输入具有抗肿瘤活性的免疫细胞,直接杀伤肿瘤或激发机体抗肿瘤免疫反应,从而达到治疗效果的生物疗法。体外操作包括细胞在体外的传代、扩增、修饰、筛选及经药物或其他能改变细胞生物学行为的处理。经体外操作后的体细胞可用于肿瘤治疗,也可用于肿瘤预防。自体细胞免疫疗法,主要包括树突状细胞疫苗(dc)、cik、dc刺激的cik细胞(dccik)、自然杀伤细胞(nk)、nkt细胞等。具体方法是:通过提取患者体内不成熟的免疫细胞(采血),在实验室中进行活化培养使其具有高效识别和杀灭肿瘤细胞的能力后,再回输患者体内。患者只需配合做采血与回输血两个步骤。
4.cik细胞治疗肿瘤的疗效主要取决于输注细胞的数量和杀伤活性。cik细胞中最具细胞毒活性的是cd3 cd56 细胞(nkt细胞),nkt细胞表面能够同时表达cd3和cd56两种膜蛋白分子,既具有t淋巴细胞强大的抗肿瘤活性又具备nk细胞的非mhc限制性杀瘤的特点,然而nkt细胞在正常的外周血中含量极低,仅为1%左右。根据实验观察,清除一个肿瘤细胞需要上百个淋巴细胞,而1cm3大小的瘤块中约有10亿个瘤细胞。因此,在体外培养中,提高cik细胞的绝对数量和其中的nkt细胞的比例对提高临床治疗效果至关重要。
5.罗汉果(siraitia grosvenorii)是一种发现于中国南部地区著名的食药用植物。罗汉果中的总苷为葫芦烷型三萜苷类化合物,包括罗汉果苷v(mogroside v,mv)、罗汉果苷ive(mogroside ive)、罗汉果苷iiie(mogroside iiie)、罗汉果苷ii a2(mogroside ii a2)、罗汉果苷iii a1(mogroside iii a1)、罗汉果苷iva(mogroside iva)、罗汉果苷i(mogrosidevi)、赛门苷i(siamenoside i)、11-o-罗汉果苷v(11-oxomogroside v)等,其中的mogroside i、iii、iv和v是从罗汉果中提取的一组具有药理生物活性的三萜类成分,具有抗氧化、抗高血糖、免疫、镇咳和抗细胞毒活性。罗汉果苷v是研究最充分和最常见的形式之一,已被报道可减轻炎症和高反应性,并抑制高血糖诱导的肺癌细胞迁移和侵袭。罗汉果
苷v在中枢神经系统疾病中的保护作用日益受到人们的关注。在非竞争性nmda受体拮抗剂地佐西平mk801诱导的类精神分裂症小鼠模型中,罗汉果苷v可以通过促进神经突生长、抑制细胞凋亡和[ca
2
]i释放减少来拯救精神分裂症相关的行为表型。在体外卵母细胞衰老过程中,罗汉果苷v能够缓解卵母细胞质量的恶化,可能是通过sirt1上调来降低氧化应激。
[0006]
目前,血清仍是免疫细胞培养中最基本的的添加物,尤其是在细胞生长状况不良时,常常会先使用有血清的培养液进行培养,待细胞生长旺盛以后,再换成无血清培养液。传统细胞培养基含有异源血清成分,如牛血清。由于不同批次牛血清活性和因子的不一致,细胞培养中使用牛血清存在污染外源病毒和致病因子的风险,制品中残留的牛血清易引起接种者对血清的过敏反应,导致产品和实验结果的重现性差。若使用患者自身血清,必须较大量地使用患者的血液,造成患者的负担增大。因此,人们希望在不使用或尽可能减少血清使用量的培养基中使免疫细胞增殖。
[0007]
无血清培养基和试剂被广泛的应用于培养哺乳动物和无脊椎动物细胞,以制备单克隆抗体,病毒抗原和重组蛋白等。然而,由于动物血清中含有动物成分,且成分复杂,含有很多对细胞有利的成分,同时也含有对细胞有害的成分,如多胺氧化酶等,若其用于临床细胞治疗体系中,可能会导致一些潜在的风险,而且在大规模生产中,血清来源越来越困难且价格昂贵,这些都是构成动物细胞培养对生产成本的主要部分之一。
技术实现要素:
[0008]
本发明的目的是解决上述技术问题,本发明提供了一种免疫细胞用无血清培养基。本发明所述的免疫细胞用无血清培养基在尽可能不向培养基中添加血清的情况下可以使免疫细胞得到迅速增殖。
[0009]
为了实现上述目的,本发明所采用以下技术方案:
[0010]
一种免疫细胞用无血清培养基,以rpmi 1640培养基为基础,还含有添加成分,所述添加成分的浓度为:羟乙基哌嗪硫磺酸3/l、酚红
·
钠0.0001g/l、l-谷氨酸盐0.1g/l、碳酸氢钠0.5g/l、胰岛素0.001g/l、转铁蛋白0.001g/l、硒0.0001g/l、人血白蛋白2g/l、白介素-240iu/ml、罗汉果苷v10μg/ml;
[0011]
所述rpmi 1640培养基包括无机盐、氨基酸、维生素、糖;
[0012]
所述无机盐的浓度为:
[0013]
四水二硝酸钙0.01g/l、无水硫酸镁0.04g/l、氯化钾0.04g/l、碳酸氢钠0.2g/l、氯化钠2g/l、磷酸氢二钠0.08g/l;
[0014]
所述氨基酸的浓度为:
[0015]
l-精氨酸0.02g/l、l-缬氨酸0.002g/l、l-天冬氨酸0.002g/l、l-天冬酰胺0.005g/l、l-谷氨酸0.002g/l、l-半胱氨酸盐酸0.006g/l、l-谷氨酰胺0.03g/l、l-组氨酸0.0015g/l、l-苯丙氨酸0.0015g/l、l-异亮氨酸0.005g/l、l-羟脯氨酸0.002g/l、l-赖氨酸盐酸0.004g/l、l-亮氨酸0.005g/l、l-脯氨酸0.002g/l、l-甲硫氨酸0.0015g/l、l-丝氨酸0.003g/l、甘氨酸0.001g/l、l-酪氨酸二钠盐0.002g/l、l-色氨酸0.0005g/l、l-苏氨酸0.002g/l; [0016]
所述维生素的浓度为:
[0017]
p-氨基苯酸0.0001g/l、d-生物素0.00002g/l、氯化胆碱0.0003g/l、还原性谷胱甘肽0.0001g/l、叶酸0.0001g/l、肌醇0.0035g/l、d-泛酸钙0.000025g/l、烟酰胺0.0001g/l、盐酸吡哆醇0.0001g/l、维生素b
12 0.0000005g/l、核黄素0.00002g/l、盐酸硫胺素0.01g/l;
[0018]
所述糖的浓度为:d-葡萄糖0.2g/l。
[0019]
本发明中:
[0020]
所述的免疫细胞,是指与免疫应答有关的所有细胞,包括t细胞、b细胞、杀伤细胞(k细胞)、自然杀伤细胞(nk细胞)、单核巨噬细胞等,其中t细胞和b细胞又称为免疫活性细胞,因这类细胞受抗原刺激而被活化,分裂增殖、发生特异性免疫应答。
[0021]
所述的一种免疫细胞用无血清培养基,其中在本发明的培养基中培养的免疫细胞,主要是指识别抗原,产生特异性免疫应答的淋巴细胞,包括t淋巴细胞、b淋巴细胞、k淋巴细胞、nk淋巴细胞等。
[0022]
所述的罗汉果苷v的纯度为98%-99.5%。
[0023]
优选的,所述的罗汉果苷v的纯度为99%-99.5%。
[0024]
制备上述一种免疫细胞用无血清培养基的方法,包括如下步骤:
[0025]
1)称取无机盐、氨基酸、维生素、糖以及添加成分的含量;
[0026]
2)将无机盐、氨基酸、维生素、糖以及添加成分溶解在水中,优选三蒸水;
[0027]
3)用水将无机盐、氨基酸、维生素、糖以及添加成分的溶解混合物定容到1l,即制得无血清培养基。
[0028]
采用本发明所述的一种免疫细胞用无血清培养基培养免疫细胞培养,按照现有技术的的方法进行,通常在37℃、5%co2浓度和饱和湿度的环境下进行。
[0029]
和现有技术相比,本发明具有如下优点:
[0030]
本发明所述培养基中添加罗汉果苷v,可以高效扩增免疫细胞,提高了免疫细胞的生长速度和细胞毒性作用。此外,本发明的培养基中不含有血清,大大避免了含血清培养基的血清批次间不稳定、有细胞毒性和大量异源蛋白等缺陷,为免疫细胞的临床治疗提供了很好的工具。
【具体实施方式】
[0031]
以下结合实施例对本发明的具体实施方式做进一步说明。
[0032]
以下实施例的材料均为市售。
[0033]
实施例1:
[0034]
一种免疫细胞用无血清培养基,以rpmi 1640培养基为基础,还含有添加成分,所述添加成分的浓度为:羟乙基哌嗪硫磺酸3/l、酚红
·
钠0.0001g/l、l-谷氨酸盐0.1g/l、碳酸氢钠0.5g/l、胰岛素0.001g/l、转铁蛋白0.001g/l、硒0.0001g/l、人血白蛋白2g/l、白介素-240iu/ml、罗汉果苷v10μg/ml;所述的罗汉果苷v的纯度为99.5%;
[0035]
所述rpmi 1640培养基包括无机盐、氨基酸、维生素、糖;
[0036]
所述无机盐的浓度为:
[0037]
四水二硝酸钙0.01g/l、无水硫酸镁0.04g/l、氯化钾0.04g/l、碳酸氢钠0.2g/l、氯化钠2g/l、磷酸氢二钠0.08g/l;
[0038]
所述氨基酸的浓度为:
[0039]
l-精氨酸0.02g/l、l-缬氨酸0.002g/l、l-天冬氨酸0.002g/l、l-天冬酰胺0.005g/l、l-谷氨酸0.002g/l、l-半胱氨酸盐酸0.006g/l、l-谷氨酰胺0.03g/l、l-组氨酸0.0015g/l、l-苯丙氨酸0.0015g/l、l-异亮氨酸0.005g/l、l-羟脯氨酸0.002g/l、l-赖氨酸盐酸0.004g/l、l-亮氨酸0.005g/l、l-脯氨酸0.002g/l、l-甲硫氨酸0.0015g/l、l-丝氨酸0.003g/l、甘氨酸0.001g/l、l-酪氨酸二钠盐0.002g/l、l-色氨酸0.0005g/l、l-苏氨酸0.002g/l; [0040]
所述维生素的浓度为:
[0041]
p-氨基苯酸0.0001g/l、d-生物素0.00002g/l、氯化胆碱0.0003g/l、还原性谷胱甘肽0.0001g/l、叶酸0.0001g/l、肌醇0.0035g/l、d-泛酸钙0.000025g/l、烟酰胺0.0001g/l、盐酸吡哆醇0.0001g/l、维生素b
12 0.0000005g/l、核黄素0.00002g/l、盐酸硫胺素0.01g/l;
[0042]
所述糖的浓度为:d-葡萄糖0.2g/l。
[0043]
制备上述一种免疫细胞用无血清培养基的方法,包括如下步骤:
[0044]
1)称取无机盐、氨基酸、维生素、糖以及添加成分的含量;
[0045]
2)将无机盐、氨基酸、维生素、糖以及添加成分溶解在水中,优选三蒸水;
[0046]
3)用水将无机盐、氨基酸、维生素、糖以及添加成分的溶解混合物定容到1l,即制得无血清培养基。
[0047]
实施例2:
[0048]
一种免疫细胞用无血清培养基,以rpmi 1640培养基为基础,还含有添加成分,所述添加成分的浓度为:羟乙基哌嗪硫磺酸3/l、酚红
·
钠0.0001g/l、l-谷氨酸盐0.1g/l、碳酸氢钠0.5g/l、胰岛素0.001g/l、转铁蛋白0.001g/l、硒0.0001g/l、人血白蛋白2g/l、白介素-240iu/ml、罗汉果苷v10μg/ml;所述的罗汉果苷v的纯度为99%;
[0049]
所述rpmi 1640培养基包括无机盐、氨基酸、维生素、糖;
[0050]
所述无机盐的浓度为:
[0051]
四水二硝酸钙0.01g/l、无水硫酸镁0.04g/l、氯化钾0.04g/l、碳酸氢钠0.2g/l、氯化钠2g/l、磷酸氢二钠0.08g/l;
[0052]
所述氨基酸的浓度为:
[0053]
l-精氨酸0.02g/l、l-缬氨酸0.002g/l、l-天冬氨酸0.002g/l、l-天冬酰胺0.005g/l、l-谷氨酸0.002g/l、l-半胱氨酸盐酸0.006g/l、l-谷氨酰胺0.03g/l、l-组氨酸0.0015g/l、l-苯丙氨酸0.0015g/l、l-异亮氨酸0.005g/l、l-羟脯氨酸0.002g/l、l-赖氨酸盐酸0.004g/l、l-亮氨酸0.005g/l、l-脯氨酸0.002g/l、l-甲硫氨酸0.0015g/l、l-丝氨酸0.003g/l、甘氨酸0.001g/l、l-酪氨酸二钠盐0.002g/l、l-色氨酸0.0005g/l、l-苏氨酸0.002g/l; [0054]
所述维生素的浓度为:
[0055]
p-氨基苯酸0.0001g/l、d-生物素0.00002g/l、氯化胆碱0.0003g/l、
还原性谷胱甘肽0.0001g/l、叶酸0.0001g/l、肌醇0.0035g/l、d-泛酸钙0.000025g/l、烟酰胺0.0001g/l、盐酸吡哆醇0.0001g/l、维生素b
12 0.0000005g/l、核黄素0.00002g/l、盐酸硫胺素0.01g/l;
[0056]
所述糖的浓度为:d-葡萄糖0.2g/l。
[0057]
制备上述一种免疫细胞用无血清培养基的方法,同实施例1。
[0058]
实施例3:
[0059]
一种免疫细胞用无血清培养基,以rpmi 1640培养基为基础,还含有添加成分,所述添加成分的浓度为:羟乙基哌嗪硫磺酸3/l、酚红
·
钠0.0001g/l、l-谷氨酸盐0.1g/l、碳酸氢钠0.5g/l、胰岛素0.001g/l、转铁蛋白0.001g/l、硒0.0001g/l、人血白蛋白2g/l、白介素-240iu/ml、罗汉果苷v10μg/ml;所述的罗汉果苷v的纯度为98%;
[0060]
所述rpmi 1640培养基包括无机盐、氨基酸、维生素、糖;
[0061]
所述无机盐的浓度为:
[0062]
四水二硝酸钙0.01g/l、无水硫酸镁0.04g/l、氯化钾0.04g/l、碳酸氢钠0.2g/l、氯化钠2g/l、磷酸氢二钠0.08g/l;
[0063]
所述氨基酸的浓度为:
[0064]
l-精氨酸0.02g/l、l-缬氨酸0.002g/l、l-天冬氨酸0.002g/l、l-天冬酰胺0.005g/l、l-谷氨酸0.002g/l、l-半胱氨酸盐酸0.006g/l、l-谷氨酰胺0.03g/l、l-组氨酸0.0015g/l、l-苯丙氨酸0.0015g/l、l-异亮氨酸0.005g/l、l-羟脯氨酸0.002g/l、l-赖氨酸盐酸0.004g/l、l-亮氨酸0.005g/l、l-脯氨酸0.002g/l、l-甲硫氨酸0.0015g/l、l-丝氨酸0.003g/l、甘氨酸0.001g/l、l-酪氨酸二钠盐0.002g/l、l-色氨酸0.0005g/l、l-苏氨酸0.002g/l; [0065]
所述维生素的浓度为:
[0066]
p-氨基苯酸0.0001g/l、d-生物素0.00002g/l、氯化胆碱0.0003g/l、还原性谷胱甘肽0.0001g/l、叶酸0.0001g/l、肌醇0.0035g/l、d-泛酸钙0.000025g/l、烟酰胺0.0001g/l、盐酸吡哆醇0.0001g/l、维生素b
12 0.0000005g/l、核黄素0.00002g/l、盐酸硫胺素0.01g/l;
[0067]
所述糖的浓度为:d-葡萄糖0.2g/l。
[0068]
制备上述一种免疫细胞用无血清培养基的方法,同实施例1。
[0069]
实验例:cik细胞的培养
[0070]ⅰ、cik细胞用培养基的配制
[0071]
2.m-0培养基的配制
[0072]
以终浓度计,在imdm培养基中加入ksr 10%(v/v)、2-巯基乙醇0.7mg/l、人血清白蛋白10g/l、hepes 1%(v/v)、生长因子7.5mg/l、青/链霉素100u/ml。调节培养基ph至7.1,用0.22μm滤器过滤除菌,密封,4℃避光保存备用;
[0073]
在细胞培养时,以终浓度计,向m-0培养基中依次加入ifn-γ1000u/ml、cd3激发型单抗20mg/l、il-1α100u/ml、il-21000u/ml和gm-csf1000u/ml。
[0074]
2.m-1培养基的配制
[0075]
在m-0培养基的基础上,以终浓度计,在imdm培养基中再加入活性多糖2mg/l。
[0076]
3.m-2培养基(即实施例1的无血清培养基)的配制
[0077]
在m-0培养基的基础上,以终浓度计,在imdm培养基中再加入壳寡糖5mg/l、活性多糖2mg/l。
[0078]ⅱ、cik细胞的诱导培养
[0079]
cik细胞的制备方法:
[0080]
①
用常规方法从人外周血中分离获得外周血单个核细胞(pbmc),用m-0培养基悬浮,并调整细胞密度为1-2
×
106/ml,37℃、5%co2、饱和湿度条件下孵育2h;
[0081]
②
收集悬浮细胞并调整细胞密度为1-2
×
106/ml,转移至f75培养瓶中,加入1000u/ml的ifn-γ,在37℃、5%co2、饱和湿度条件下培养24h;
[0082]
③
第二天加入cd3激发型单抗、il-2、il-1α、ifn-γ、gm-csf,并分别加入m-0、m-1和m-2培养基,在37℃、5%co2、饱和湿度条件下连续培养7-15天,离心收集即可获得的cik细胞。
[0083]
其中,加入培养基中的cd3激发型单抗的浓度为20mg/l,il-2的浓度为1000u/ml,il-1α的浓度为100u/ml、ifn-γ的浓度为1000u/ml、gm-csf的浓度为1000u/ml;
[0084]
④
步骤
③
过程中,每隔3天换液一次,换液前后进行细胞计数,并根据细胞浓度补加相应培养基和il-2至相应浓度。
[0085]ⅲ、cik细胞活性和细胞增值倍数比较分析
[0086]
分别在第3、6、9、12、15天收集各组培养的cik细胞用于各项检测。以下从几个方面比较m-0、m-1和m-2组获得的cik细胞的差异性。
[0087]
1、细胞活性的比较
[0088]
将3、6、9、12、15天收集m-0、m-1和m-2组培养的cik细胞用0.4%的台盼蓝染色,然后用全自动细胞计数仪进行计数,其中,死细胞被染成蓝色,活细胞不被染色。具体情况见表1:不同实验条件下,cik细胞活性的变化
[0089] 03691215m-096.12
±
1.0897.35
±
1.2397.25
±
1.8997.49
±
2.2297.56
±
0.3697.88
±
2.42m-196.11
±
0.9997.33
±
1.4297.38
±
1.6397.48
±
1.8998.02
±
0.9897.53
±
2.12m-296.22
±
1.2297.46
±
1.2897.74
±
1.5497.86
±
1.7598.63
±
1.2897.65
±
2.02
[0090]
由表1可以看出,各组细胞活性均大于95%,但m-2组活性均高于m-1组和m-0组,各组间没有显著性差异(p>0.05)。
[0091]
2、细胞增殖倍数的比较
[0092]
将各组取得的cik细胞用0.4%的台盼蓝染液染色后进行细胞计数,将当前的细胞总数除以培养前的单个核细胞数,数值即为细胞的增殖倍数。具体情况见表2;
[0093]
表2不同实验条件下,cik细胞增殖倍数的变化
[0094] 03691215m-013.38
±
1.7410.36
±
2.4225.37
±
5.5648.44
±
5.0272.01
±
4.27m-116.98
±
2.8914.33
±
3.5649.65
±
5.02101.33
±
4.88158.63
±
4.23m-2110.69
±
3.4522.36
±
3.9958.47
±
5.66121.89
±
5.69249.87
±
4.66
[0095]
由表2可以看出,随着培养时间的延长,三组细胞均在增长,但在每个时间节点上,
m-2组的增殖倍数都大于m-1组和m-0组,且增殖倍数最高。
[0096]
上述说明是针对本发明较佳可行实施例的详细说明,但实施例并非用以限定本发明的专利申请范围,凡本发明所提示的技术精神下所完成的同等变化或修饰变更,均应属于本发明所涵盖专利范围。
【技术领域】
1.本发明涉及免疫细胞体外培养技术领域,具体涉及一种免疫细胞用无血清培养基。
背景技术:
2.随着免疫细胞生物学及免疫分子生物学的高速发展,体细胞免疫治疗已成为肿瘤患者放、化疗后辅助治疗的重要手段之一,其对于促进患者免疫系统的重建、消除残留病灶及骨髓净化都具有良好效果。生物治疗是继手术、放疗、化疗后的第四种肿瘤治疗模式。生物治疗是通过调动宿主天然防卫机制或给予天然产生的靶向性很强的物质来达到临床治疗效果,生物领域中的一个重要方法就是免疫细胞疗法,即将分离的自身免疫细胞在体外通过细胞因子诱导,扩增出大量具有高度细胞毒性的异质细胞群,再回输到体内发挥治疗作用。此类免疫细胞的种类包括了淋巴因子激活的杀伤细胞(lak),肿瘤浸润淋巴细胞(til),细胞毒淋巴细胞(ctl)等,在众多的免疫细胞中,cik细胞由于有杀瘤活性高,杀瘤谱广,对多种耐药细胞同样敏感以及对正常骨髓造血前提细胞毒性更小等优良特点,广泛的应用于临床。
3.体细胞免疫治疗,是向肿瘤患者输入具有抗肿瘤活性的免疫细胞,直接杀伤肿瘤或激发机体抗肿瘤免疫反应,从而达到治疗效果的生物疗法。体外操作包括细胞在体外的传代、扩增、修饰、筛选及经药物或其他能改变细胞生物学行为的处理。经体外操作后的体细胞可用于肿瘤治疗,也可用于肿瘤预防。自体细胞免疫疗法,主要包括树突状细胞疫苗(dc)、cik、dc刺激的cik细胞(dccik)、自然杀伤细胞(nk)、nkt细胞等。具体方法是:通过提取患者体内不成熟的免疫细胞(采血),在实验室中进行活化培养使其具有高效识别和杀灭肿瘤细胞的能力后,再回输患者体内。患者只需配合做采血与回输血两个步骤。
4.cik细胞治疗肿瘤的疗效主要取决于输注细胞的数量和杀伤活性。cik细胞中最具细胞毒活性的是cd3 cd56 细胞(nkt细胞),nkt细胞表面能够同时表达cd3和cd56两种膜蛋白分子,既具有t淋巴细胞强大的抗肿瘤活性又具备nk细胞的非mhc限制性杀瘤的特点,然而nkt细胞在正常的外周血中含量极低,仅为1%左右。根据实验观察,清除一个肿瘤细胞需要上百个淋巴细胞,而1cm3大小的瘤块中约有10亿个瘤细胞。因此,在体外培养中,提高cik细胞的绝对数量和其中的nkt细胞的比例对提高临床治疗效果至关重要。
5.罗汉果(siraitia grosvenorii)是一种发现于中国南部地区著名的食药用植物。罗汉果中的总苷为葫芦烷型三萜苷类化合物,包括罗汉果苷v(mogroside v,mv)、罗汉果苷ive(mogroside ive)、罗汉果苷iiie(mogroside iiie)、罗汉果苷ii a2(mogroside ii a2)、罗汉果苷iii a1(mogroside iii a1)、罗汉果苷iva(mogroside iva)、罗汉果苷i(mogrosidevi)、赛门苷i(siamenoside i)、11-o-罗汉果苷v(11-oxomogroside v)等,其中的mogroside i、iii、iv和v是从罗汉果中提取的一组具有药理生物活性的三萜类成分,具有抗氧化、抗高血糖、免疫、镇咳和抗细胞毒活性。罗汉果苷v是研究最充分和最常见的形式之一,已被报道可减轻炎症和高反应性,并抑制高血糖诱导的肺癌细胞迁移和侵袭。罗汉果
苷v在中枢神经系统疾病中的保护作用日益受到人们的关注。在非竞争性nmda受体拮抗剂地佐西平mk801诱导的类精神分裂症小鼠模型中,罗汉果苷v可以通过促进神经突生长、抑制细胞凋亡和[ca
2
]i释放减少来拯救精神分裂症相关的行为表型。在体外卵母细胞衰老过程中,罗汉果苷v能够缓解卵母细胞质量的恶化,可能是通过sirt1上调来降低氧化应激。
[0006]
目前,血清仍是免疫细胞培养中最基本的的添加物,尤其是在细胞生长状况不良时,常常会先使用有血清的培养液进行培养,待细胞生长旺盛以后,再换成无血清培养液。传统细胞培养基含有异源血清成分,如牛血清。由于不同批次牛血清活性和因子的不一致,细胞培养中使用牛血清存在污染外源病毒和致病因子的风险,制品中残留的牛血清易引起接种者对血清的过敏反应,导致产品和实验结果的重现性差。若使用患者自身血清,必须较大量地使用患者的血液,造成患者的负担增大。因此,人们希望在不使用或尽可能减少血清使用量的培养基中使免疫细胞增殖。
[0007]
无血清培养基和试剂被广泛的应用于培养哺乳动物和无脊椎动物细胞,以制备单克隆抗体,病毒抗原和重组蛋白等。然而,由于动物血清中含有动物成分,且成分复杂,含有很多对细胞有利的成分,同时也含有对细胞有害的成分,如多胺氧化酶等,若其用于临床细胞治疗体系中,可能会导致一些潜在的风险,而且在大规模生产中,血清来源越来越困难且价格昂贵,这些都是构成动物细胞培养对生产成本的主要部分之一。
技术实现要素:
[0008]
本发明的目的是解决上述技术问题,本发明提供了一种免疫细胞用无血清培养基。本发明所述的免疫细胞用无血清培养基在尽可能不向培养基中添加血清的情况下可以使免疫细胞得到迅速增殖。
[0009]
为了实现上述目的,本发明所采用以下技术方案:
[0010]
一种免疫细胞用无血清培养基,以rpmi 1640培养基为基础,还含有添加成分,所述添加成分的浓度为:羟乙基哌嗪硫磺酸3/l、酚红
·
钠0.0001g/l、l-谷氨酸盐0.1g/l、碳酸氢钠0.5g/l、胰岛素0.001g/l、转铁蛋白0.001g/l、硒0.0001g/l、人血白蛋白2g/l、白介素-240iu/ml、罗汉果苷v10μg/ml;
[0011]
所述rpmi 1640培养基包括无机盐、氨基酸、维生素、糖;
[0012]
所述无机盐的浓度为:
[0013]
四水二硝酸钙0.01g/l、无水硫酸镁0.04g/l、氯化钾0.04g/l、碳酸氢钠0.2g/l、氯化钠2g/l、磷酸氢二钠0.08g/l;
[0014]
所述氨基酸的浓度为:
[0015]
l-精氨酸0.02g/l、l-缬氨酸0.002g/l、l-天冬氨酸0.002g/l、l-天冬酰胺0.005g/l、l-谷氨酸0.002g/l、l-半胱氨酸盐酸0.006g/l、l-谷氨酰胺0.03g/l、l-组氨酸0.0015g/l、l-苯丙氨酸0.0015g/l、l-异亮氨酸0.005g/l、l-羟脯氨酸0.002g/l、l-赖氨酸盐酸0.004g/l、l-亮氨酸0.005g/l、l-脯氨酸0.002g/l、l-甲硫氨酸0.0015g/l、l-丝氨酸0.003g/l、甘氨酸0.001g/l、l-酪氨酸二钠盐0.002g/l、l-色氨酸0.0005g/l、l-苏氨酸0.002g/l; [0016]
所述维生素的浓度为:
[0017]
p-氨基苯酸0.0001g/l、d-生物素0.00002g/l、氯化胆碱0.0003g/l、还原性谷胱甘肽0.0001g/l、叶酸0.0001g/l、肌醇0.0035g/l、d-泛酸钙0.000025g/l、烟酰胺0.0001g/l、盐酸吡哆醇0.0001g/l、维生素b
12 0.0000005g/l、核黄素0.00002g/l、盐酸硫胺素0.01g/l;
[0018]
所述糖的浓度为:d-葡萄糖0.2g/l。
[0019]
本发明中:
[0020]
所述的免疫细胞,是指与免疫应答有关的所有细胞,包括t细胞、b细胞、杀伤细胞(k细胞)、自然杀伤细胞(nk细胞)、单核巨噬细胞等,其中t细胞和b细胞又称为免疫活性细胞,因这类细胞受抗原刺激而被活化,分裂增殖、发生特异性免疫应答。
[0021]
所述的一种免疫细胞用无血清培养基,其中在本发明的培养基中培养的免疫细胞,主要是指识别抗原,产生特异性免疫应答的淋巴细胞,包括t淋巴细胞、b淋巴细胞、k淋巴细胞、nk淋巴细胞等。
[0022]
所述的罗汉果苷v的纯度为98%-99.5%。
[0023]
优选的,所述的罗汉果苷v的纯度为99%-99.5%。
[0024]
制备上述一种免疫细胞用无血清培养基的方法,包括如下步骤:
[0025]
1)称取无机盐、氨基酸、维生素、糖以及添加成分的含量;
[0026]
2)将无机盐、氨基酸、维生素、糖以及添加成分溶解在水中,优选三蒸水;
[0027]
3)用水将无机盐、氨基酸、维生素、糖以及添加成分的溶解混合物定容到1l,即制得无血清培养基。
[0028]
采用本发明所述的一种免疫细胞用无血清培养基培养免疫细胞培养,按照现有技术的的方法进行,通常在37℃、5%co2浓度和饱和湿度的环境下进行。
[0029]
和现有技术相比,本发明具有如下优点:
[0030]
本发明所述培养基中添加罗汉果苷v,可以高效扩增免疫细胞,提高了免疫细胞的生长速度和细胞毒性作用。此外,本发明的培养基中不含有血清,大大避免了含血清培养基的血清批次间不稳定、有细胞毒性和大量异源蛋白等缺陷,为免疫细胞的临床治疗提供了很好的工具。
【具体实施方式】
[0031]
以下结合实施例对本发明的具体实施方式做进一步说明。
[0032]
以下实施例的材料均为市售。
[0033]
实施例1:
[0034]
一种免疫细胞用无血清培养基,以rpmi 1640培养基为基础,还含有添加成分,所述添加成分的浓度为:羟乙基哌嗪硫磺酸3/l、酚红
·
钠0.0001g/l、l-谷氨酸盐0.1g/l、碳酸氢钠0.5g/l、胰岛素0.001g/l、转铁蛋白0.001g/l、硒0.0001g/l、人血白蛋白2g/l、白介素-240iu/ml、罗汉果苷v10μg/ml;所述的罗汉果苷v的纯度为99.5%;
[0035]
所述rpmi 1640培养基包括无机盐、氨基酸、维生素、糖;
[0036]
所述无机盐的浓度为:
[0037]
四水二硝酸钙0.01g/l、无水硫酸镁0.04g/l、氯化钾0.04g/l、碳酸氢钠0.2g/l、氯化钠2g/l、磷酸氢二钠0.08g/l;
[0038]
所述氨基酸的浓度为:
[0039]
l-精氨酸0.02g/l、l-缬氨酸0.002g/l、l-天冬氨酸0.002g/l、l-天冬酰胺0.005g/l、l-谷氨酸0.002g/l、l-半胱氨酸盐酸0.006g/l、l-谷氨酰胺0.03g/l、l-组氨酸0.0015g/l、l-苯丙氨酸0.0015g/l、l-异亮氨酸0.005g/l、l-羟脯氨酸0.002g/l、l-赖氨酸盐酸0.004g/l、l-亮氨酸0.005g/l、l-脯氨酸0.002g/l、l-甲硫氨酸0.0015g/l、l-丝氨酸0.003g/l、甘氨酸0.001g/l、l-酪氨酸二钠盐0.002g/l、l-色氨酸0.0005g/l、l-苏氨酸0.002g/l; [0040]
所述维生素的浓度为:
[0041]
p-氨基苯酸0.0001g/l、d-生物素0.00002g/l、氯化胆碱0.0003g/l、还原性谷胱甘肽0.0001g/l、叶酸0.0001g/l、肌醇0.0035g/l、d-泛酸钙0.000025g/l、烟酰胺0.0001g/l、盐酸吡哆醇0.0001g/l、维生素b
12 0.0000005g/l、核黄素0.00002g/l、盐酸硫胺素0.01g/l;
[0042]
所述糖的浓度为:d-葡萄糖0.2g/l。
[0043]
制备上述一种免疫细胞用无血清培养基的方法,包括如下步骤:
[0044]
1)称取无机盐、氨基酸、维生素、糖以及添加成分的含量;
[0045]
2)将无机盐、氨基酸、维生素、糖以及添加成分溶解在水中,优选三蒸水;
[0046]
3)用水将无机盐、氨基酸、维生素、糖以及添加成分的溶解混合物定容到1l,即制得无血清培养基。
[0047]
实施例2:
[0048]
一种免疫细胞用无血清培养基,以rpmi 1640培养基为基础,还含有添加成分,所述添加成分的浓度为:羟乙基哌嗪硫磺酸3/l、酚红
·
钠0.0001g/l、l-谷氨酸盐0.1g/l、碳酸氢钠0.5g/l、胰岛素0.001g/l、转铁蛋白0.001g/l、硒0.0001g/l、人血白蛋白2g/l、白介素-240iu/ml、罗汉果苷v10μg/ml;所述的罗汉果苷v的纯度为99%;
[0049]
所述rpmi 1640培养基包括无机盐、氨基酸、维生素、糖;
[0050]
所述无机盐的浓度为:
[0051]
四水二硝酸钙0.01g/l、无水硫酸镁0.04g/l、氯化钾0.04g/l、碳酸氢钠0.2g/l、氯化钠2g/l、磷酸氢二钠0.08g/l;
[0052]
所述氨基酸的浓度为:
[0053]
l-精氨酸0.02g/l、l-缬氨酸0.002g/l、l-天冬氨酸0.002g/l、l-天冬酰胺0.005g/l、l-谷氨酸0.002g/l、l-半胱氨酸盐酸0.006g/l、l-谷氨酰胺0.03g/l、l-组氨酸0.0015g/l、l-苯丙氨酸0.0015g/l、l-异亮氨酸0.005g/l、l-羟脯氨酸0.002g/l、l-赖氨酸盐酸0.004g/l、l-亮氨酸0.005g/l、l-脯氨酸0.002g/l、l-甲硫氨酸0.0015g/l、l-丝氨酸0.003g/l、甘氨酸0.001g/l、l-酪氨酸二钠盐0.002g/l、l-色氨酸0.0005g/l、l-苏氨酸0.002g/l; [0054]
所述维生素的浓度为:
[0055]
p-氨基苯酸0.0001g/l、d-生物素0.00002g/l、氯化胆碱0.0003g/l、
还原性谷胱甘肽0.0001g/l、叶酸0.0001g/l、肌醇0.0035g/l、d-泛酸钙0.000025g/l、烟酰胺0.0001g/l、盐酸吡哆醇0.0001g/l、维生素b
12 0.0000005g/l、核黄素0.00002g/l、盐酸硫胺素0.01g/l;
[0056]
所述糖的浓度为:d-葡萄糖0.2g/l。
[0057]
制备上述一种免疫细胞用无血清培养基的方法,同实施例1。
[0058]
实施例3:
[0059]
一种免疫细胞用无血清培养基,以rpmi 1640培养基为基础,还含有添加成分,所述添加成分的浓度为:羟乙基哌嗪硫磺酸3/l、酚红
·
钠0.0001g/l、l-谷氨酸盐0.1g/l、碳酸氢钠0.5g/l、胰岛素0.001g/l、转铁蛋白0.001g/l、硒0.0001g/l、人血白蛋白2g/l、白介素-240iu/ml、罗汉果苷v10μg/ml;所述的罗汉果苷v的纯度为98%;
[0060]
所述rpmi 1640培养基包括无机盐、氨基酸、维生素、糖;
[0061]
所述无机盐的浓度为:
[0062]
四水二硝酸钙0.01g/l、无水硫酸镁0.04g/l、氯化钾0.04g/l、碳酸氢钠0.2g/l、氯化钠2g/l、磷酸氢二钠0.08g/l;
[0063]
所述氨基酸的浓度为:
[0064]
l-精氨酸0.02g/l、l-缬氨酸0.002g/l、l-天冬氨酸0.002g/l、l-天冬酰胺0.005g/l、l-谷氨酸0.002g/l、l-半胱氨酸盐酸0.006g/l、l-谷氨酰胺0.03g/l、l-组氨酸0.0015g/l、l-苯丙氨酸0.0015g/l、l-异亮氨酸0.005g/l、l-羟脯氨酸0.002g/l、l-赖氨酸盐酸0.004g/l、l-亮氨酸0.005g/l、l-脯氨酸0.002g/l、l-甲硫氨酸0.0015g/l、l-丝氨酸0.003g/l、甘氨酸0.001g/l、l-酪氨酸二钠盐0.002g/l、l-色氨酸0.0005g/l、l-苏氨酸0.002g/l; [0065]
所述维生素的浓度为:
[0066]
p-氨基苯酸0.0001g/l、d-生物素0.00002g/l、氯化胆碱0.0003g/l、还原性谷胱甘肽0.0001g/l、叶酸0.0001g/l、肌醇0.0035g/l、d-泛酸钙0.000025g/l、烟酰胺0.0001g/l、盐酸吡哆醇0.0001g/l、维生素b
12 0.0000005g/l、核黄素0.00002g/l、盐酸硫胺素0.01g/l;
[0067]
所述糖的浓度为:d-葡萄糖0.2g/l。
[0068]
制备上述一种免疫细胞用无血清培养基的方法,同实施例1。
[0069]
实验例:cik细胞的培养
[0070]ⅰ、cik细胞用培养基的配制
[0071]
2.m-0培养基的配制
[0072]
以终浓度计,在imdm培养基中加入ksr 10%(v/v)、2-巯基乙醇0.7mg/l、人血清白蛋白10g/l、hepes 1%(v/v)、生长因子7.5mg/l、青/链霉素100u/ml。调节培养基ph至7.1,用0.22μm滤器过滤除菌,密封,4℃避光保存备用;
[0073]
在细胞培养时,以终浓度计,向m-0培养基中依次加入ifn-γ1000u/ml、cd3激发型单抗20mg/l、il-1α100u/ml、il-21000u/ml和gm-csf1000u/ml。
[0074]
2.m-1培养基的配制
[0075]
在m-0培养基的基础上,以终浓度计,在imdm培养基中再加入活性多糖2mg/l。
[0076]
3.m-2培养基(即实施例1的无血清培养基)的配制
[0077]
在m-0培养基的基础上,以终浓度计,在imdm培养基中再加入壳寡糖5mg/l、活性多糖2mg/l。
[0078]ⅱ、cik细胞的诱导培养
[0079]
cik细胞的制备方法:
[0080]
①
用常规方法从人外周血中分离获得外周血单个核细胞(pbmc),用m-0培养基悬浮,并调整细胞密度为1-2
×
106/ml,37℃、5%co2、饱和湿度条件下孵育2h;
[0081]
②
收集悬浮细胞并调整细胞密度为1-2
×
106/ml,转移至f75培养瓶中,加入1000u/ml的ifn-γ,在37℃、5%co2、饱和湿度条件下培养24h;
[0082]
③
第二天加入cd3激发型单抗、il-2、il-1α、ifn-γ、gm-csf,并分别加入m-0、m-1和m-2培养基,在37℃、5%co2、饱和湿度条件下连续培养7-15天,离心收集即可获得的cik细胞。
[0083]
其中,加入培养基中的cd3激发型单抗的浓度为20mg/l,il-2的浓度为1000u/ml,il-1α的浓度为100u/ml、ifn-γ的浓度为1000u/ml、gm-csf的浓度为1000u/ml;
[0084]
④
步骤
③
过程中,每隔3天换液一次,换液前后进行细胞计数,并根据细胞浓度补加相应培养基和il-2至相应浓度。
[0085]ⅲ、cik细胞活性和细胞增值倍数比较分析
[0086]
分别在第3、6、9、12、15天收集各组培养的cik细胞用于各项检测。以下从几个方面比较m-0、m-1和m-2组获得的cik细胞的差异性。
[0087]
1、细胞活性的比较
[0088]
将3、6、9、12、15天收集m-0、m-1和m-2组培养的cik细胞用0.4%的台盼蓝染色,然后用全自动细胞计数仪进行计数,其中,死细胞被染成蓝色,活细胞不被染色。具体情况见表1:不同实验条件下,cik细胞活性的变化
[0089] 03691215m-096.12
±
1.0897.35
±
1.2397.25
±
1.8997.49
±
2.2297.56
±
0.3697.88
±
2.42m-196.11
±
0.9997.33
±
1.4297.38
±
1.6397.48
±
1.8998.02
±
0.9897.53
±
2.12m-296.22
±
1.2297.46
±
1.2897.74
±
1.5497.86
±
1.7598.63
±
1.2897.65
±
2.02
[0090]
由表1可以看出,各组细胞活性均大于95%,但m-2组活性均高于m-1组和m-0组,各组间没有显著性差异(p>0.05)。
[0091]
2、细胞增殖倍数的比较
[0092]
将各组取得的cik细胞用0.4%的台盼蓝染液染色后进行细胞计数,将当前的细胞总数除以培养前的单个核细胞数,数值即为细胞的增殖倍数。具体情况见表2;
[0093]
表2不同实验条件下,cik细胞增殖倍数的变化
[0094] 03691215m-013.38
±
1.7410.36
±
2.4225.37
±
5.5648.44
±
5.0272.01
±
4.27m-116.98
±
2.8914.33
±
3.5649.65
±
5.02101.33
±
4.88158.63
±
4.23m-2110.69
±
3.4522.36
±
3.9958.47
±
5.66121.89
±
5.69249.87
±
4.66
[0095]
由表2可以看出,随着培养时间的延长,三组细胞均在增长,但在每个时间节点上,
m-2组的增殖倍数都大于m-1组和m-0组,且增殖倍数最高。
[0096]
上述说明是针对本发明较佳可行实施例的详细说明,但实施例并非用以限定本发明的专利申请范围,凡本发明所提示的技术精神下所完成的同等变化或修饰变更,均应属于本发明所涵盖专利范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。