一种能够靶向乙型肝炎病毒的药物构造及药物组合物
1.相关专利申请的交叉引用
2.本技术旨在获得美国专利申请号为63/140,232(专利名称:targeted nucleic acid therapy for hepatitis b)、专利申请日为2021年1月21日的专利申请,以及中国专利申请号为2021102899267(专利名称:一种能够靶向乙型肝炎病毒的药物构造及药物组合物)、专利申请日为2021年3月18日的专利申请的权益和优先权,其全文以引用方式并入本文中。
技术领域
3.本发明具体涉及一种能够靶向乙型肝炎病毒的药物构造及药物组合物。
背景技术:
4.乙型肝炎病毒
5.乙型肝炎病毒(hbv)是特性研究得最为彻底和最复杂的肝炎病毒之一。感染性粒子由病毒核心和外层表皮组成。核心含有环状部分双链dna和dna聚合酶,在受感染的肝细胞核内复制。乙型肝炎是由hbv引起的,可能引起危及生命的肝脏感染。它可以导致急性和慢性感染,使人们很高风险死于肝硬化和肝癌。leung,med.j.malaysia;60suppl b:63-6.(2005)。世界卫生组织(who)估计,2015年全世界有2.57亿人患有慢性乙型肝炎。尽管有预防性疫苗和有效且耐受性良好的病毒抑制剂,但病患数量还在继续上升。然而,目前还没有有效的治疗方法可以清除hbv感染。
6.超过90%受感染的婴儿将会患上慢性乙型肝炎。患者可能无症状,也有的表现为非特异性症状,如疲劳和不适。如果不进行治疗,乙型肝炎可能在几十年内自行痊愈(不常见),可能进展迅速,或缓慢发展为肝硬化。症状的缓解通常始于疾病严重程度的瞬时增加,导致血清从乙型肝炎e抗原(hbeag)转换为乙型肝炎e抗原抗体(anti-hbe)。此外,与丁型肝炎病毒(hdv)共同感染会导致最严重的hbv感染,如果不进行治疗,多达70%的患者会发生肝硬化。慢性hbv感染会增加患肝细胞性肝癌的风险。christopher et al.,clin liver dis;.23(3):557-572(2019)
7.急性乙型肝炎可持续六个月(无论是否有病征),感染者在这段期间可将病毒传染给其他人。一个简单的血液测试就能检测出血液中的hbv。急性感染的症状可能包括食欲不振、关节和肌肉疼痛、低烧以及胃痛。虽然大多数人没有症状,但他们可以在感染后60—150天出现症状,平均90天或3个月。有些人可能会出现更严重的症状,如恶心、呕吐、黄疸(眼睛和皮肤发黄)或胃部肿胀。
8.抗乙型肝炎药物研发的现状
9.免疫调节剂药物已用于治疗重症肺炎、免疫缺陷和慢性乙型肝炎jiang,vaccine;.30(4):758-766(2012)。这些药物可以提高病人的免疫反应,特别是对hbv的特异性免疫,可能有助于免疫细胞识别和破坏hbv感染的细胞,清除这些细胞中的乙肝病毒。干扰素(ifn)是一种分泌性糖蛋白,具有抗病毒、抗增殖和免疫调节细胞因子的功能。此外,胸
腺肽-α1是另一类免疫调节药物,其主要功能是促进t细胞向成熟阶段分化,增强对抗原等刺激物的反应。此外,多种类型的免疫细胞(如单核细胞、巨噬细胞、t细胞、b细胞和nk细胞)和非免疫细胞(如内皮细胞、表皮细胞和成纤维细胞)在刺激下合成和分泌细胞因子。
10.核苷和核苷类似物药物(统称:na)也被用于治疗hbv感染。拉米夫定是一种嘧啶核苷类药物,是第一个被核准用于治疗慢性乙肝病毒感染的na。替比夫定是一种治疗慢性乙型肝炎的特异性、选择性和口服的药物。其他药物如恩替卡韦、阿德福韦和替诺福韦也是口服抗病毒药物,可有效选择性抑制hbv感染。这些na被整合到病毒dna中,阻止病毒dna的合成延伸。kang et al.,viruses;7:4960-77(2015)
11.目前批准的每一种慢性乙型肝炎(chb)临床干预治疗方法都需要对大多数患者进行长期的治疗。尽管使用目前的治疗方法持续抑制hbv dna与临床结果的改善相关,但过高风险的肝细胞性肝癌(hcc)仍然存在,而且乙肝表面抗原(hbsag)清除是不常见的。
12.sirna的治疗
13.双链rna已被证明可以通过rna干扰(rnai)抑制基因表达。小干扰rna(sirna)诱导的rna干扰调控在治疗各种人类疾病方面显示出巨大的潜力,包括从癌症到其他传统的非药物性疾病。但是将sirna导入到人体所需的组织内仍然是个难题。特别是,需要提高针对特定细胞类型或组织的核酸药物靶向性,以及开发无毒性的内涵体逃逸剂,这一点将在下文进一步解释。
14.目前,核酸药物常用的有效给药途径有两种。一种方法是使用含有多种成分的脂质纳米颗粒(脂质体)。另一种方法是利用含有galnac分子的偶联物靶向去唾液酸糖蛋白受体(asgpr)。
15.rna治疗的一个主要挑战是,所有传递到细胞的药物最终需要从内涵体逃逸出来。由于asgpr的特性非常适合于大分子药物向肝细胞的传递,asgpr靶向的galnac-sirna偶联物可以实现aso和sirna向肝脏的传递。特别是,肝细胞在其细胞表面表达数以百万计的asgpr,它们以每10—15分钟快速循环一次。这些特性使得基于galnac的递送方法能够取得显著效果,即使在按目前假定认为的内涵体逃逸率小于0.01%的情况下。相比之下,aso或rna向其他组织的有效递送还没有实现。没有其他配体-受体系统像asgpr这样的高水平表达受体,也没有像asgpr那样快速循环进入内涵体。事实上,大多数细胞表面受体的表达范围在每个细胞10000-100000(或更低),小窝蛋白和网格蛋白介导的内吞作用通常每90分钟循环一次。juliano,nucleic acids res.44,6518
–
6548(2016)
16.对于所有rna为基础的治疗,内涵体逃逸仍然是一大挑战。为了靶向肝细胞以外的细胞或组织,需要通过开发新的化学物质和材料来增强内涵体逃逸。小分子内涵体溶解剂,如氯喹,已被用来破坏或溶解内涵体,但在有效浓度下,这些药剂总是溶解细胞内的所有类型的内涵体,从而产生严重的毒性。
17.另一种内涵体逃逸的方法是将内涵体溶解肽或分子直接与rna结合,但这会严重限制含有治疗性rna的内涵体的作用。由于毒性效应,使用含有胆固醇或溶解性蜂毒肽的双分子动态聚合物(dpc)系统逃逸内涵体的多项临床试验都被迫终止。wooddell,et al.,mol.ther.21,973
–
985(2013);hou et al.,biotechnol.adv.33,931
–
940(2015)
18.sirna技术治疗乙型肝炎感染
19.在小鼠模型中,sirna分子可诱导rna干扰抑制hbv在哺乳动物肝细胞中的复制
lian et al.,j pharmacol sci;114(2):147-57(2010)。化学合成的sirna/shrna已被证明是治疗hbv感染的一种潜在的治疗手段wu et al.,virus research,112:100-107(2005)。然而,一种基于rnai的药物的二期临床试验并没有显示某些病人的病毒数量有所减少。进一步分析证实,病毒抗原是由不含目标序列的hbv转录产物产生的。
20.细胞因子也可能导致rnai耐药dowdy,nature biotechnology,35:222-229(2017)。这对于以符合临床用药的方式,将合成sirna和shrna表达载体系统传递到特定的靶细胞或组织提出了挑战。这个挑战也是由于rnai分子是小的双链寡核苷酸,具有高度负电荷的亲水性磷酸骨架。这使得它们无法与细胞膜相互作用并穿过细胞膜,使它们被肾脏血液循环迅速过滤掉。与靶细胞接触的rnai分子通过内吞作用被吸收,并滞留在内涵体中,时间长了会被核酸裂解酶降解。因此,需要一些方法使完整的rnai分子从内涵体逃逸到rna诱导沉默复合体(risc)所在的细胞质中。
技术实现要素:
21.本发明所要解决的技术问题是提供使用具有增强治疗效益的干扰rna分子的组合物和方法。
22.为解决上述技术问题,本发明采用如下技术方案:
23.本发明提供一种用于递送靶向乙型肝炎病毒(hbv)的sirna分子的组合物和方法。所述sirna分子可以是一种或多种核酸,包含核苷酸或核苷酸类似物。所述sirna分子共价结合到肽对接载体(pdov)上,并进一步共价结合到一个或多个galnac配体上。本发明提供应对慢性hbv感染和相关疾病的方法。
24.本发明提供了使用具有增强治疗效益的干扰rna分子的组合物和方法。所述组合物和方法通过将靶向配体连接到所述化合物上,将治疗化合物(如sirna分子)靶向细胞/组织递送到实验对象。实验对象可能是动物或人类。
25.在一些实施例中,如本文所述的靶向配体可通过正交生物接合方法与内涵体释放肽共价结合。所述靶向配体可特别用于改善rnai分子向所选定的目标(例如肝脏)的递送。在其他实施例中,靶向配体允许将rnai分子靶向递送到其他组织中,例如皮肤和大脑。
26.本文所描述的靶向配体,可以是一个或多个靶向部分、一个或多个连接体。通过点击化学、硫醇/马来酰亚胺化学或其他生物正交化学方法,将连接体与sirna共价结合,并将其作为靶向配体。连接体优先选择具有亲水性的,例如可以是一种水溶性的柔性聚乙二醇(peg),它足够稳定,并限制了一个或多个靶向基团之间的潜在相互作用。peg已被临床研究证实是安全的和兼容的,且适用于临床治疗。在一些实施例中,连接体可以是具有特定分子量的聚(l-丙交酯)n,(其中n=5-20),其中酯键是酶解或水解不稳定的。
27.所述靶向配体,可包括一个或多个靶向部分、一个或多个具有连接反应活性单元的连接子。它们通过点击化学、硫醇/马来酰亚胺化学或其他生物正交化学方法与sirna和靶向配体共价结合。连接体反应活性单元可能是,但不限于,巯基-马来酰亚胺键、由炔烃和叠氮化合物反应形成的三唑键,以及胺-琥珀酰亚胺酯连接形成的酰胺。这些连接体中的每一个都适合于靶向配体和治疗化合物的共价连接。
28.在一些实施例中,本发明公开的靶向特异性rna化合物可通过rna的3’或5’末端直接与内涵体释放对接肽结合。所述靶向配体(例如n-乙酰基-半乳糖胺)也可以兼容的方法
与相同的对接肽结合。
29.在一些实施例中,本发明公开的靶向特异性rna化合物还可通过如rna的3’或5’末端直接连接到靶向配体(例如n-乙酰基-半乳糖胺)。在一些实施例中,rna可包含一个或多个经修饰的核苷酸,如3
’‑
ome、3
’‑
f或3
’‑
moe。在一些实施例中,rna可以是rnai制剂,例如双链rnai制剂。在一些实施例中,此处公开的靶向配体连接到双链rnai制剂的正义链的5’或3’端或双链rnai制剂的反义链的5’或3’端。靶向配体可选择地连接到双链rnai制剂正义链和反义链的3’/3”、3’/5’或5’/5’末端。靶向配体可以通过双链rnai制剂的3’或5’末端的磷酸盐、硫代磷酸盐或膦酸盐基团共价结合到rna分子上。
30.在一些实施例中,本发明公开的靶向特异性rna分子是靶向hbv的mrna并抑制该hbv的mrna表达的sirna分子。正如在这里使用的,术语“靶向”主要是指一个hbv基因中的一个或多个核苷酸序列。
31.在一些实施例中,选定sirna的目标序列位于hbv基因组中的表面基因(hbsag)中。这个区域是hbv特异性的,且高度保守的区域。hbv表面抗原蛋白的主要功能是形成hbv包膜。
32.在一些实施例中,选定sirna的目标序列位于hbv基因组中的核心蛋白(hbcag)基因中。hbcag形成二聚体,在c端富含精氨酸序列,被认为与核衣壳中的病毒核酸具有相互作用。
33.在一些实施例中,所选sirna的目标序列位于hbv基因组中的e抗原(hbeag)基因中。hbeag orf编码一个内质网(er)靶向序列,将肽协同传递到er中,在er中蛋白质被加工成最终的15kd的hbeag,并从hbv感染细胞分泌出来。
34.在一些实施例中,选定sirna的目标序列位于hbv基因组中的x(hbx)基因中。hbx是hbv编码的唯一一个调节蛋白,在hbv复制过程中起重要作用,如hbx能与cccdna结合;hbx是cdna转录所必需的;下游hbx介导的效应是hbv复制所必需的。
35.在一些实施例中,选定sirna的目标序列位于hbv基因组中的聚合酶(hbp)/逆转录酶(rt)基因中。聚合酶在hbv的生命周期中起着关键作用,这两种酶的活性在hbv增殖的生命周期中对hbv的复制至关重要。
36.在一些实施例中,hbv的基因靶向sirna包括一条正义链和一条反义链,每一条正义链包含长度为19-21个碱基的核心序列。所描述的sirna正义链和反义链的长度分别为19到27个核苷酸长度。
37.在一些实施例中,sirna正义链和反义链的长度分别为21或25个核苷酸长度。sirna的正义链和反义链通常退火形成双链。在互补双链区,正链核心序列与反义核心序列100%互补。
38.在一些实例中,sirna可能具有不对称结构,其中所述正义链长度约为19个核苷酸,而所述反义链长度约为21个核苷酸。
39.由于上述技术方案运用,本发明与现有技术相比具有下列优点:
40.本发明的药物构造能够显著抑制hbv靶基因的表达,并且药物发挥作用的浓度远低于现有技术中的其他药物,并且本发明的药物构造的细胞毒性低,能够有效地将活性成分传递到靶向细胞中,并且能够使完整的活性分子从内涵体逃逸到rna诱导沉默复合体(risc)所在的细胞质中。
附图说明
41.图1显示了hbv基因组的示意图(nc_003977.2)。hbv基因组是一个呈松弛的环形构象(rcdna),约3.2kb的部分双链dna。hbv基因组有四个重叠的开放阅读框架(orf),即表面(s)、核心(c)、pol(p)和x(x)。总的来说,这四个hbv orf共同编码了七种不同的hbv蛋白。
42.图2展示了[galnac]肽对接载体(g-pdov)的设计。三价galnac共价结合在一个结合位点a上,寡核苷酸和sirna分别共价结合在另一个或两个结合位点b上。
[0043]
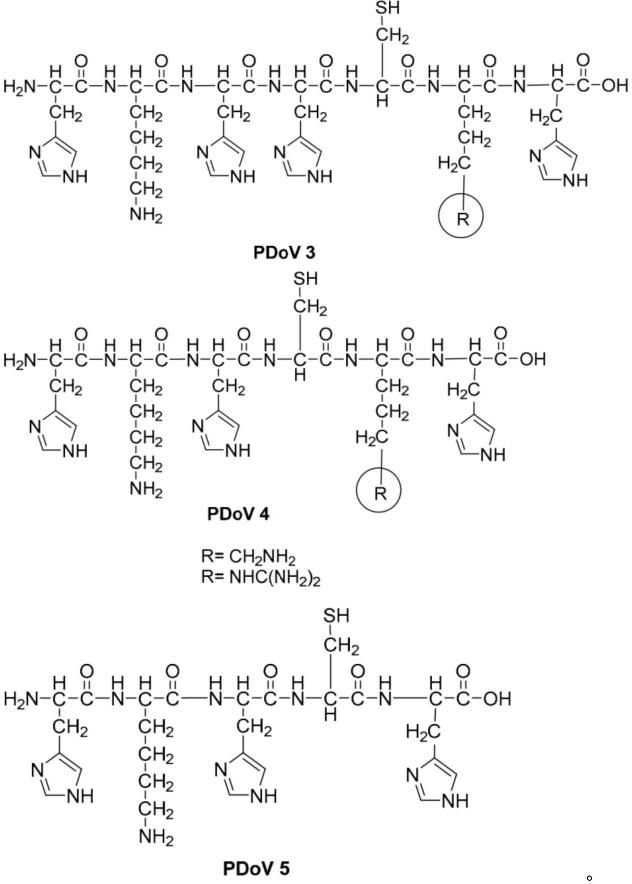
图3显示了肽对接载体(pdov)的设计。它有一个(hnkm)oxpyq多肽主链,具有多个重复单元组氨酸(h)、赖氨酸(k)和功能单元x(氨基酸或功能连接体),其中n=1-10,m=1-10,o=1-10,p=1-5,q=1-5。hk重复单位已被证明具有良好的细胞穿透能力,为了促进内涵体的释放,将采用赖氨酸或各种功能单位x或y作为结合配体的结合位点,y将被用作通过不同的共价键接合寡核苷酸的结合位点。例如,位点
①
仅在配体,如galnac或其他靶向配体存在时发生反应。位点
③
只能在特定条件下与寡核苷酸和sirna结合。
[0044]
图4显示了一个pdov的结构示例,包含一个或两个寡核苷酸位点和一个配体结合位点。
[0045]
图5显示了三价galnac靶向配体分子的示例。
[0046]
图6显示了hbv sirna-pdov-配体化合物1的构建示例。
[0047]
图7显示了双hbv sirna-pdov-配体化合物2的构建示例。
[0048]
图8显示了双hbv sirna-pdov-配体化合物3的构建示例。
[0049]
图9为克隆1(psi-p&s&s)荧光定量表达分析方法筛选sirna的结果。大多数sirna对目的基因表达的抑制率都在80%以上(星号),有的甚至超过90%。nts00042代表实验代码,21或25代表sirna的长度,1#代表21或25个碱基对长度的sirna的序列号。
[0050]
图10为克隆2(psi-p&x&c&c0 uorf)荧光定量表达分析方法筛选sirna的结果。只有几个sirna对目的基因表达有良好的抑制作用。星号表示抑制率超过80%。nts00042代表实验代码,21或25代表sirna的长度,1#代表21或25个碱基对长度的sirna的序列号。
[0051]
图11显示了部分筛选过的sirna在293t和a549两种细胞中的半最大效应浓度(ec
50
)数据。绝大多数sirna的ec
50
均小于10pg/μl,表明这些sirna分子在远低于传统药物分子浓度时就显示了强大的抑制活性。
[0052]
图12显示了部分筛选过的sirna以及修饰的sirna对hepad38细胞上清中hbsag基因表达的抑制率。
[0053]
图13显示了部分筛选过的sirna以及修饰的sirna对hbeag基因和hbsag基因的抑制率。
[0054]
图14显示了部分筛选过的sirna以及修饰的sirna对hbv颗粒表达的抑制率。
[0055]
图15显示了部分筛选过的sirna以及修饰的sirna对hbv core particles dna的表达水平的检测结果。
[0056]
图16显示了部分筛选过的sirna以及修饰的sirna对hbv cccdna的表达水平的检测结果。
[0057]
图17为经过化学修饰的sirna分子对靶标基因的抑制效果,并以未经修饰相同序列的正常sirna分子作为比对。经过修饰的sirna分子对靶标基因的抑制效率有所降低,但依然超过80%,多数保持在90%以上。
[0058]
图18显示了部分经过修饰的sirna在293t和a549两种细胞中的半最大效应浓度(ec
50
)数据。与未经修饰的sirna相比,多数经过修饰后的sirna的ec
50
增大。
具体实施方式
[0059]
下面将更详细地描述本发明的这些内容和其他方面的内容。
[0060]
定义:
[0061]
如本文所用的“寡核苷酸”是指长度小于100个核苷酸(例如小于50、30或25个核苷酸)的化学修饰或未修饰的核酸分子(rna或dna)。它可以是sirna、microrna、抗microrna、microrna模拟物、dsrna、ssrna、适配体、形成三链体的寡核苷酸。在一种实施方案中,寡核苷酸是rnai制剂。
[0062]
如本文所用的“sirna分子”或“rnai分子”是双链体寡核苷酸,它们是短的双链多核苷酸,将这些分子引入细胞内后,可以干扰细胞中基因的表达。例如,sirna分子靶向结合单链目标rna分子中的互补核苷酸序列。一般情况下,当sirna分子被特定核苷酸序列识别时,该序列是指双链体分子的有义链。包含该分子的一种或多种核糖核苷酸可以通过本领域已知的技术进行化学修饰。除了在一个或多个寡核苷酸的水平上被修饰之外,寡核苷酸的主链也可以被修饰。其他修饰包括使用小分子(例如糖基)、氨基酸、肽、胆固醇和其他大分子偶联到sirna分子上。
[0063]“肽对接载体”(pdov)是指具有确定序列的合成肽,其包含多个缀合位点以允许其与一种或多种靶向配体,以及一种或多种寡核苷酸缀合。它包含的官能团(例如疏水链或ph敏感残基)有助于在将缀合的pdov递送至细胞后,释放包裹在细胞内涵体内部的寡核苷酸有效载荷。
[0064]“表达的抑制”是指来自靶基因的蛋白质和/或mrna表达产物的水平不存在或显著降低。抑制不必是绝对的,可以是部分抑制,足以产生由于施用本发明的sirna分子而导致可检测或可观察到的变化。抑制可以通过分析细胞内sirna分子所靶向基因对应的mrna和/或蛋白质产物水平的降低来测量,与无sirna分子处理的细胞作为比较,可能低至10%、50%或绝对(即100%)抑制。抑制作用可以通过检查细胞或生物体的外在性质,即定量和/或定性表型来确定,并且还可以包括在施用本发明的sirna分子后评估病毒载量。
[0065]
sirna分子可以以最小的脱靶事件直接靶向活性基因。“脱靶事件”是指非sirna分子靶标的特定核酸的表达受抑制而显着降低。对于hbv感染,最小的脱靶事件提供了一个独特的机会来满足hbv尚未满足的临床治疗需求。因此,在本发明的一方面,提供了用于抑制hbv基因中的一个或多个靶序列表达的hbv dna特异性的rna干扰制剂。
[0066]
pdov的结构
[0067]
本发明提供了一种内涵体逃逸肽(pdov),其以无毒的方式增强了大分子物质(如sirna分子)向细胞质的逃逸。pdov平台的各种示例如图4所示。在pdov中,内涵体逃逸肽既充当rna的对接位点接头,又充当靶向配体,可以将多个rna分子与同一结构体偶联,以实现针对不同目标mrna的sirna分子的共导入,从而为沉默与多种疾病相关的基因提供协同效益。已证明富含组氨酸和赖氨酸的多肽或富含组氨酸和赖氨酸的线性肽是rna药物递送中有效的细胞穿透和内涵体释放剂。该肽含有一个富含组氨酸的结构域,其中组氨酸残基的咪唑环在较低的ph值(ph《~6)下被质子化,并在内涵体中充当质子海绵,从而导致内涵体
脂质双分子层裂解,释放rna分子。pdov上的缀合位点在一下部分详细地描述。
[0068]
图2是[galnac]肽对接载体设计的示意图。三价galnac配体共价缀合在肽的一个停靠位点
①
上,而寡核苷酸或sirna分别缀合在另一个或两个停靠位点
③
上。
[0069]
rnai制剂
[0070]
hbv有一个小的环状dna基因组,长约3.2kb,包含4个基因,这些基因具有部分重叠的开放阅读框(orf)。这些orf编码聚合酶蛋白(p基因);核心抗原和e抗原(c基因);大、中、小表面抗原蛋白(s基因);和x蛋白(x基因)。hbv的结构示意图如图1所示,其ncbi登录号为nc_003977.2。hbv基因组以两种形式存在:环状共价闭合dna(cccdna)和松弛环状dna(rcdna)。hbv病毒dna的基因组织在所有病毒亚型之间高度保守,非常适合采用基因沉默技术来抑制其复制。
[0071]
本发明设计并选择的sirna分子,可以靶向至少七个hbv株的序列,以覆盖尽可能多的hbv突变体。sirna分子使用两种长度:21个碱基对长度(19 dtdt)和25个碱基对长度。
[0072]
双链sirna,可以不进行修饰,也可以在2'位置的2'-och3、2'-f或2'-ome和/或在5'位置的-p(o)2=s、-p(s)2=o上进行化学修饰。其他化学修饰,例如聚乙二醇化或脂质官能化,可用于改善rnai的整体稳定性和生物利用度。
[0073]
所选的sirna分子可抑制hbv核酸序列的表达。优选的,hbv靶基因是表达为聚合酶(p)基因的核酸序列。因此,在一个实施方案中,sirna制剂抑制hbv病毒p基因中一种或多种靶序列的表达。hbv基因组具有重叠的开放阅读框,因此,靶向聚合酶基因的特定序列也可以靶向重叠基因中的其它相同序列。因此,本发明的sirna分子能够以单个效应子序列靶向多个基因。因此,在下面描述的每个实施方案中,至少聚合酶基因是被靶向的。由于hbv基因组的基因在大多数区域中在四个orf之间重叠,因此本发明的sirna分子也能够靶向hbv的c基因、s基因和x基因。如表1所示,本发明根据11种hbv毒株,设计了52个sirna。
[0074]
表1.针对hbv病毒基因保守设计的sirna序列:
[0075]
[0076][0077]
靶向配体
[0078]
此处公开的靶向配体部分是n-乙酰基-半乳糖胺(galnac)、半乳糖、半乳糖胺、n-甲酰基-半乳糖胺、n-丙酰基-半乳糖胺或n-丁酰基半乳糖胺。靶向配体与肽可共价偶联。可以使用一种、两种或三种靶向配体,并且可以具有如图5所示的结构。在该结构中,通过肽的半胱氨酸残基与靶向配体上的马来酰亚胺之间的反应来实现与pdov的剩余部分的偶联。
[0079]
本发明进一步将所设计的sirna分子与galnac偶联,形成galnac-sirna缀合物,其
中galnac配体可以结合肝细胞表达的去唾液酸糖蛋白受体(asialoglycoprotein receptor,asgpr)并将sirna靶向递送至肝细胞。研究证实,每个肝细胞表达0.5-1百万个拷贝的asgpr,且在种属间具有高度保守性,这些受体内化迅速,约15min即可循环到肝细胞表面,是靶向肝脏的理想受体。因此,galnac-sirna可用于开发多种肝靶向递送核酸药物,包括抑制乙肝病毒复制的sirna分子。galnac与在肝细胞上高度表达的asgpr结合后,通过快速的内吞作用,将sirna分子递送到细胞内,发挥高效特异的病毒基因表达沉默作用。
[0080]
内涵体释放对接肽
[0081]
肽对接载体(pdov)具有一个配体缀合位点以及多个寡核苷酸位点。pdov具有一般结构的肽主链:(hnkm)oxpyq,具有组氨酸(h),赖氨酸(k)和功能单元x和y(其中x或y是氨基酸或氨基酸衍生物)的多个重复单元,其中:n=1-10;m=1-10;o=1-10,p=1-5,q=1-5。已证明hk重复单元具有促进内涵体释放的功能。赖氨酸残基或功能单元x可以用作配体缀合的停靠位点,而y通过不同的共价键提供用于寡核苷酸缀合的停靠位点。图3显示了如何结合pdov的示意图。例如,位点
①
仅能够在配体如galnac或其他靶向配体的存在下反应;而位点
③
只能在选定的条件下与寡核苷酸和sirna缀合。
[0082]
采用pdov与sirna偶联,可以利用galnac的肝靶向功能,将sirna递送到肝细胞内。众所周知,sirna进入细胞内后,是在内涵体中,只有从内涵体释放到细胞质,才能发挥核酸干扰作用。研究表明,galnac-sirna从内涵体中释放到细胞质内的效率非常低(甚至低于0.1%),因此,如果能提高内涵体释放效率,将大大提高治疗效果。pdov对接肽中含有组氨酸成分,而组氨酸为一种碱性氨基酸,其分子结构中咪唑环上的不饱和氮原子在弱酸性的条件下可接受外界环境的质子,产生质子化,导致组氨酸寡肽产生疏水性至亲水性的转变。这种转变有助于内涵体膨胀,将sirna分子释放出来,发挥rnai作用,抑制hbv基因的表达,从而阻断病毒生命周期。
[0083]
具体实施例1.基于hbv基因组结构和蛋白质功能的靶标选择
[0084]
本发明选择hbv基因保守序列作为sirna设计的候选靶标区域,从而获得可以抑制所有类型hbv病毒株的sirna分子。共包含十一株hbv病毒突变体用于sirna分子设计(ncbi登录号分别为:nc_003977.2,ky003230.1,ab933282.1,kr013949.1,kr014081.1,af090840.1,af325900.1,u95551.1,x02763.1,x70185.1和x75311.1)。选择这些菌株是因为它们覆盖了尽可能多的hbv突变体。
[0085]
具体实施例2.靶向hbv关键基因的sirna设计
[0086]
开放阅读框p编码hbv聚合酶的逆转录酶结构域,该结构域代表抗病毒制剂的靶标(如核苷/核苷酸类似物和无环核苷酸类似物)。由于该阅读框与s阅读框重叠,抑制逆转录酶结构域也可以同时抑制s基因的表达。
[0087]
开放阅读框s可编码三个包膜蛋白(分别为大、中和小包膜蛋白),它们可以决定病毒的装配和病毒在肝细胞上的附着。大蛋白是病毒受体附着的底物,中蛋白的功能尚不清楚,小蛋白通常称为hbsag或澳大利亚抗原。小蛋白、中蛋白和大蛋白被检测为hbsag。s区域是肝细胞结合位点,也与隐匿性hbv状态有关。此外,s区域会影响hbsag的表达、合成和分泌。s区域缺失会抑制肝病的进展。
[0088]
开放阅读框c可编码两种蛋白质一种结构,hbcag是形成核衣壳的蛋白,hbeag是分泌蛋白。hbeag是hbv复制和感染性的标志物。在hbv慢性感染的自然过程中,hbeag表达的丧
失和针对它的抗体的出现(抗hbe)通常代表病毒复制的结束和肝炎的消退。前核心区(pre-core)和核心区(core)的突变会导致hbeag阴性的慢性乙型肝炎,并伴有抗hbe,其中复制性感染仍在继续,并且hbv病毒的dna仍可检测到。
[0089]
开放阅读框x编码一些功能尚不清楚的多功能非结构蛋白,已被证明在建立感染和病毒复制中起作用。近年来,有人推测x基因在hbv致癌中起重要的作用。
[0090]
本发明的sirna设计的基本原理是,所设计的sirna序列涵盖了7种选定的hbv毒株中尽可能多的hbv突变体。本发明选择了两种碱基对长度(mer)的sirna分子:21mer(19 dtdt)和25mer。
[0091]
如本发明所述的sirna分子,可抑制hbv病毒核酸序列的表达。优选的,hbv靶基因是聚合酶(p)基因。因此,在一个实施方案中,sirna分子抑制hbv病毒p基因中一个或多个靶序列的表达。hbv基因组具有重叠的开放阅读框。这样,靶向聚合酶p基因的特定序列也可以靶向重叠区域其它基因中的相同序列。因此,本发明的sirna分子能够以单个效应子序列靶向多个基因。然而,在每个优选的实施方案中,至少聚合酶p基因是被靶向的。因为hbv基因组的基因在大多数区域中在四个orf之间重叠,所以本发明的sirna分子也可以靶向hbv的c基因、s基因和x基因。
[0092]
具体实施例3.sirna与多价galnac(半乳糖胺)的结合
[0093]
sirna与pdov的第3组(multivalent galnac-linker)可以通过2’和5’核苷酸位置结合,也可以通过如下所示的5’和2’个核苷酸位置结合。
[0094][0095]
具体实施例4.基于细胞培养筛选有效的抗hbv sirna分子
[0096]
为了鉴定在a549和293t细胞培养实验中沉默hbv基因最有效的sirna,使用带有hbv基因序列的dna片段的重组psicheck-2质粒进行实验。用真正的hbv感染hepg2细胞,来检测所选sirna的抗hbv感染活性。
[0097]
为了研究所选sirna在降解靶向hbv基因中的作用,使用具有表面、核心、e、x、聚合酶、逆转录酶基因片段的双荧光素酶报告载体psicheck-2。psicheck-2载体旨在为rna干扰(rnai)的初始优化提供了一种定量和快速的方法。这些载体能够监测与报告基因融合的靶基因表达的变化。研究中,先合成hbv基因组的dna片段,且克隆到psicheck-2载体的多个克隆位点中。该载体以海肾细胞荧光素酶为主要报告基因,sirna靶向基因位于海肾荧光素酶基因翻译终止密码子的下游。
[0098]
将a549或293t细胞接种于96孔板中,孵育12小时。报告质粒(重组载体)psi-p&s&x、psi-p&x&c&c0 uorf和sirna候选基因用lipofectamine 2000在不含胎牛血清的dmem中共转染到a549或293t细胞内。空白的psi质粒载体作为阴性对照。转染6小时后,培养基替换为补充有10%胎牛血清的dmem。转染后18、24、36和48h,使用双荧光素酶试剂盒检测每孔萤火虫萤光素酶和海肾荧光素酶的活性。sirna候选物显著降低了荧光素酶活性,这表明
sirna可以显著抑制hbv靶基因的表达。这些候选基因被筛选出来用于体外hbv感染试验。
[0099]
16#等。具有最佳抑制效果的sirna,例如nts00042-21-1#、nts00042-21-3#、nts00042-21-11#、nts00042-25-3#对靶基因有显著的抑制作用,达到90%甚至95%以上。
[0102]
进一步,测定部分sirna分子,即nts00042-21-1#、nts00042-21-3#、nts00042-21-6#、nts00042-21-7#、nts00042-21-9#、nts00042-21-11#、nts00042-21-22#、nts00042-25-1#、nts00042-25-3#、nts00042-25-6#、nts00042-25-16#sirna分子在293t和a549两种细胞中抑制靶标基因表达的半最大效应浓度(引起50%基因沉默效应的浓度,ec
50
),从图11可以看出,所有sirna的ec
50
均小于10pg/μl,其中效果相对更好的两种sirna是:21-6#号sirna(靶向hbv的p基因和s基因)在293t和a549细胞中的ec
50
分别为0.3pg/μl(图11a)和1.1pg/μl(图11d);21-11#号sirna(靶向hbv的p基因)在293t和a549细胞中的ec
50
分别为0.7pg/μl(图11a)和0.9pg/μl(图11d)。这些结果表明,本发明所选定的sirna显示了良好的对靶标基因的抑制活性,药物发挥作用的浓度远远小于其他传统的药物分子。
[0103]
具体实施例5.初筛抗hbv sirna分子抑制细胞内hbv的基因表达
[0104]
对实施例4中筛选的部分对靶基因抑制效果较好的sirna,即nts00042-21-3#(21-3)、nts00042-21-6#(21-6)、nts00042-21-9#(21-9)、nts00042-21-11#(21-11)、nts00042-21-22#(21-22)、nts00042-25-3#(25-3)、nts00042-25-16#(25-16),进行2
’‑
o-甲基修饰,得到经过修饰的sirna分子,即21-3-x、21-6-x、21-9-x、21-11-x、21-22-x、25-3-x、25-16-x。
[0105]
本实施例用于检测实施例4中筛选的部分sirna分子,即nts00042-21-1#、nts00042-21-3#、nts00042-21-6#、nts00042-21-7#、nts00042-21-9#、nts00042-21-11#、nts00042-21-22#、nts00042-25-1#、nts00042-25-3#、nts00042-25-6#、nts00042-25-16#(即21-1、21-3、21-6、21-7、21-9、21-11、21-22、25-1、25-3、25-6、25-16)表示的sirna分子,以及经过修饰的sirna分子对肝癌细胞株hepad38的细胞活力抑制效果。具体实验步骤如下:
[0106]
将对数生长期的hepad38细胞以1
×
104个/孔种于96孔板,每孔100μl细胞悬液,过夜培养。转染按照lipofectamintm3000的说明书转染,sirna按50nm/孔加入,每个样品配制3个复孔,6h后换液,转染96h。收集细胞上清,按照elisa检测试剂盒(上海科华生物工程有限公司)说明书的步骤检测细胞上清中的hbsag基因表达水平,以nc-sirna为阴性对照。
[0107]
检测结果如图12所示,可以看出,所选sirna分子与nc-sirna相比,均能显著抑制hepad38细胞上清中hbsag基因的表达,其中21-7,21-9,21-11,25-1,25-6,21-22,25-16,21-9-x,21-11-x表示的sirna分子对靶基因的抑制率较高,后续对其进行复筛。
[0108]
具体实施例6.复筛抗hbv sirna分子对肝癌细胞株的的基因表达和复制
[0109]
本实施例用于检测实施例5中筛选出的sirna分子对肝癌细胞株的细胞活力抑制效果。具体实验步骤如下:
[0110]
将对数生长期的hepad38细胞以2
×
105个/孔种于6孔板,每孔2ml细胞悬液,过夜培养。转染按照lipofectamintm3000的说明书转染,sirna按50nm/孔加入,每个样品配制3个复孔,6h后换液,转染7天。
[0111]
(1)检测hbsag、hbeag基因的表达水平:
[0112]
收集细胞上清,按照elisa检测试剂盒(上海科华生物工程有限公司)说明书的步骤检测细胞上清中的hbsag和hbeag基因表达水平,以nc-sirna为阴性对照。
[0113]
hbeag和hbsag检测结果分别如图13a和图13b所示,从图中可以看出,25-16、21-11-x表示的sirna分子对靶基因的抑制率较高,两者对hbeag基因的抑制率超过40%,对hbsag的抑制率超过50%。
[0114]
(2)实时定量pcr检测hbv dna拷贝数:
[0115]
通过实时荧光定量pcr(quantitative real-time pcr)检测hbv dna拷贝数,取细胞上清加入已配制好的pcr反应管中,同时设立nc-sirna对照组。建立如下10μl的反应体系:4μl的模板,5μl的sybr premix ex taq,0.5μl的pcr正向引物(10μm),0.5μl的pcr反向引物(10μm)。按表2所示的程序进行扩增,其中用于扩增和作为内参基因的gapdh的pcr引物如表3所示。
[0116]
表2.pcr程序设置:
[0117][0118][0119]
表3.pcr引物
[0120][0121]
细胞上清中hbv dna拷贝数的检测结果如图14所示,从图中可以看出,与nc-sirna相比,所选sirna均能显著性抑制上清中hbv颗粒的表达,抑制率在35.437%~81.225%,且除21-11抑制率为35.437%,其余样品抑制率均超过40.000%。
[0122]
(3)实时定量pcr检测hbv core particles dna的表达水平:
[0123]
从细胞中提取hbv core particles dna进行实时荧光定量pcr检测,将core particles dna加入已配制好的pcr反应管中,同时设立nc-sirna对照组。建立如下10μl的反应体系:4μl的模板,5μl的sybr premix ex taq,0.5μl的pcr正向引物(10μm),0.5μl的pcr反向引物(10μm)。按表2所示的程序进行扩增,其中用于扩增和作为内参基因的gapdh的pcr引物如表3所示。
[0124]
hbv core particles dna的表达水平检测结果如图15所示,与nc-sirna相比,所选sirna均能显著性抑制hbv core particles的表达,其中样品21-7、21-9、25-16、21-9-x、
21-11-x与对照样品nc-sirna相比均具有显著性差异。
[0125]
(4)实时定量pcr检测hbv cccdna的表达水平:
[0126]
从细胞中提取cccdna进行实时荧光定量pcr检测,将cccdna加入已配制好的pcr反应管中,同时设立nc-sirna对照组。建立如下10μl的反应体系:4μl的模板,5μl的sybr premix ex taq,0.5μl的pcr正向引物(10μm),0.5μl的pcr反向引物(10μm)。按表2所示的程序进行扩增,其中用于扩增和作为内参基因的gapdh的pcr引物如表3所示。
[0127]
hbv cccdna的表达水平检测结果如图16所示,与nc-sirna相比,所选sirna均能显著性抑制hbv cccdna的表达,其中,25-6、21-11-x的抑制效果最好。
[0128]
具体实施例7.经过化学修饰的sirna分子对hbv靶标基因的沉默作用
[0129]
本发明进一步采用2
’‑
o-甲基等化学基团对sirna进行修饰,以期提高sirna的稳定性和进入细胞的效率,减少脱靶(off-target)效应。在两种细胞中测定这些经2
’‑
o-甲基修饰的sirna对靶标基因的抑制效果,结果表明(图17),修饰后的sirna对靶标基因的抑制活性有所降低,但对基因表达的抑制效率均在80%;以抑制效果较好的21-6#号sirna为例,在293t细胞中,未修饰的sirna抑制效率达到98%,修饰sirna的抑制率为97%(图17a),在a549细胞中,修饰后的sirna抑制效率从96%下降到95%(图17c)。
[0130]
测定经过修饰的sirna的ec
50
数据,结果从图18中可以看出,与未修饰sirna的ec
50
相比,大部分修饰后的sirna的ec
50
有所升高(与对靶标基因的抑制效率降低结果相吻合),比如21-6#号sirna在293t细胞中,未修饰sirna的ec
50
为0.3pg/μl,修饰后上升到0.9pg/μl(图18a)。也有个别sirna经修饰后ec
50
降低,如21-22#号sirna(靶向hbv的x基因),未修饰时在293t和a549细胞中的ec
50
分别为3.9和2.64pg/μl,修饰后的sirna的ec
50
分别降低到0.67和0.3pg/μl(图18b和18d)。总体而言,修饰后的sirna的ec
50
浓度多数还在10pg/μl以下,依然保持了良好的抑制效率。
[0131]
尽管本公开描述了所述组合物和方法的某些实施例,并且出于说明的目的已经阐述了很多细节,但是对于本领域技术人员显而易见的是,这些组合物和方法易受其他实施例的影响,并且某些细节在不脱离本公开的基本原理的情况下,可以对本文中描述的实施方式进行改变。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。