1.本发明涉及病原分离鉴定及病原培养技术领域,具体涉及一种鸡滑液囊支原体生物被膜的培育方法及其应用、筛选方法。
背景技术:
2.鸡滑液囊支原体(mycoplasma synoviae,ms)感染会引发鸡、鸭、鹅、火鸡等一些禽类的传染性滑膜炎,其特点呈现为关节渗出性的滑液囊膜及腱鞘滑膜炎症。ms感染还能够引起呼吸道疾病,但主要表现为亚临床型,故不易观察到,若并发感染新城疫或传染性支气管炎则会引起气囊炎。此外,ms感染还可引起蛋壳顶端异常。因此受ms感染的鸡常会表现出跛行、关节肿胀、呼吸道炎症等症状,进而导致产蛋下降、生长发育迟缓及饲料转化率降低等后果。
3.目前防治ms感染主要依靠抗菌药物,但由于抗菌药物的不合理使用,抗菌药物对ms的敏感性日益下降,这时抗菌药物的筛选准确性需求进一步提高。虽然,目前并没有研究对于活鸡体内是否具有鸡滑液囊支原体生物被膜这一生长形式进行探讨。但现时,对于抗菌药物的鸡滑液囊支原体的体外抗菌活性筛选,所使用的鸡滑液囊支原体普遍是简单地通过悬浮培育制得,并没有形成鸡滑液囊支原体生物被膜这一生长形式。而普遍认为培育所得的鸡滑液囊支原体就是存在于活鸡环境中的鸡滑液囊支原体,使得筛选出的药物抗菌活性结果与实际应用存在较大的差异风险,理论给药量并不能够指导实际应用。
4.因此,亟需提出一种鸡滑液囊支原体生物被膜的培育方法及其应用、筛选方法,使得筛选出的药物抗菌活性结果更加接近实际应用。
技术实现要素:
5.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种鸡滑液囊支原体生物被膜的培育方法及其应用、筛选方法,该鸡滑液囊支原体生物被膜的培育方法及其应用、筛选方法能够使得筛选出的药物抗菌活性结果更加接近实际应用。
6.本发明的发明构思为:通过增加培育阶段、选择合适的初始培育浓度、以及选择特定范围的培育温度来培育制得鸡滑液囊支原体生物被膜。
7.本发明的第一方面提供一种鸡滑液囊支原体生物被膜的培育方法,所述培育方法包括以下步骤:一种鸡滑液囊支原体生物被膜的培育方法,其特征在于,所述培育方法包括以下步骤:将生长至对数生长期的鸡滑液囊支原体用液体培养基稀释至(0.9-1.5)
×
10
6 cfu/ml,进行第一培育,生长至对数生长期,除去悬浮菌体,制得所述鸡滑液囊支原体生物被膜;所述液体培养基为改良frey氏液体培养基,所述生长至对数生长期的判断标准为所述改良frey氏液体培养基由红变黄;所述第一培育的培育温度为30-37℃。
8.优选的,所述改良frey氏液体培养基按照《中华人民共和国兽药典》2015年版三部“检验用培养基的配制”部分所记载改良frey氏液体培养基的配制方法进行配制。所述改良frey氏液体培养基的变色原理为支原体对培养基中的葡萄糖进行分解,使得改良frey氏液体培养基的ph从7.7降低到6.5-6.9,使得培养基中的酚红从红(ph=7.7)变黄(ph=6.5-6.9),从而实现生长至对数生长期的判断。
9.相对于现有技术,本发明第一方面提供的一种鸡滑液囊支原体生物被膜的培育方法的有益效果如下:目前用于体外生物实验的鸡滑液囊支原体通常是从关节炎性渗出物经过分离培养、传代培养和纯化培养而得到的,并没有形成鸡滑液囊支原体生物被膜这一生长形式。而本发明通过增加培育阶段、选择合适的初始培育浓度、以及选择特定范围的培育温度来培育制得鸡滑液囊支原体生物被膜,能够使得生物实验中所测得的数据(如药物对鸡滑液囊支原体的抗菌活性)更加准确。
10.进一步优选的,所述将生长至对数生长期的鸡滑液囊支原体用液体培养基稀释至的浓度为1
×
10
6 cfu/ml。
11.优选的,所述鸡滑液囊支原体经过分离培养、传代培养和纯化培养所制得。
12.优选的,所述鸡滑液囊支原体由禽类的关节炎性渗出物经过分离培养、传代培养和纯化培养所制得。
13.优选的,所述分离培养包括以下步骤:禽类的关节炎性渗出物接种于液体培养基进第二培育至对数生长期制得经过分离培养的菌液。
14.优选的,所述第二培育的环境为密封环境、温度为35-38℃;进一步优选的,所述第二培育的温度为37℃。
15.优选的,所述第二培育的培育器皿包括西林瓶、培养皿、96孔板、12孔板、锥形瓶中的至少一种。
16.优选的,所述传代培养的目的是获得能够稳定传代的培养物;进一步优选的,所述传代培养进行的次数为2-10次;再进一步优选的,所述传代培养进行的次数为3-5次;更进一步优选的,所述传代培养进行的次数为3次。
17.优选的,所述传代培养包括以下步骤:将所述经过分离培养的菌液分离菌体,取10%-50%菌体接种于新的液体培养基中进行培育,生长至对数生长期。
18.优选的,所述纯化培养包括以下步骤:将所述经过传代培养的生长至对数生长期的菌液稀释至800-1500倍、取10-100μl于固体培养基中,进行第三培育,当出现煎蛋状菌落后,取单菌落的菌液体培养基中进行第二培育,生长至对数生长期时制得所述鸡滑液囊支原体;进一步优选的,所述稀释倍数为900-1100倍;更进一步优选的,所述稀释倍数为1000倍。
19.优选的,所述固体培养基由所述液体培养基施加琼脂粉制得;进一步优选的,所述琼脂粉的施加量为所述液体培养基的(0.5-1.5)wt%;更进一步优选的,所述琼脂粉的施加量为所述液体培养基的0.9-1.1wt%。
20.优选的,所述进行第三培育的培育条件为30-40℃、4-8% co2体积百分比浓度、培育时间3-7天;进一步优选的,所述co2体积百分比浓度为5%。
21.优选的,所述鸡滑液囊支原体还经过冻干保存与复苏,所述冻干保存的温度为0至-80℃;进一步优选的,所述冻干保存的温度为-50至-80℃;更进一步优选的,所述冻干保存的温度为-70至-80℃。
22.优选的,所述冻干保存使用到冻干液,所述冻干液为脱脂奶粉、蔗糖、水经混合、高温高压灭菌制得。
23.优选的,所述冻干保存与复苏在所述将生长至对数生长期的鸡滑液囊支原体用液体培养基稀释之前进行实施,在所述传代培养和纯化培养之后进行实施,先进行所述冻干保存、后进行所述复苏。
24.优选的,所述第一培育的培育环境为密封环境。
25.优选的,所述培育方法中当需要最大生物被膜尺寸时,所述第一培育的培育温度选择30-31℃,当需要生物被膜生物量最多时,所述第一培育的培育温度选择32-34℃;更进一步优选的,所述培育方法中当需要最大生物被膜尺寸时,所述第一培育的培育温度选择30℃,当需要生物被膜生物量最多时,所述第一培育的培育温度选择33℃。在本发明中,第一培育的作用为培育出鸡滑液囊支原体生物被膜,第二培育的作用为鸡滑液囊支原体的分离培养,第三培育的作用为纯化培养。
26.优选的,所述第一培育的培育器皿包括12孔板、96孔板、西林瓶、培养皿、锥形瓶中的至少一种。
27.优选的,所述除去悬浮菌体的步骤为:使用缓冲液对培养基中的悬浮菌进行冲洗。
28.优选的,所述除去悬浮菌体的步骤中,所述缓冲液为磷酸盐缓冲液;进一步优选的,所述磷酸盐缓冲液ph为6.5-7.5、浓度为0.05-0.15m。
29.优选的,所述鸡滑液囊支原体生物被膜还进行染色观察,所述染色观察的染色方法使用到刚果红。
30.优选的,所述染色方法包括以下步骤:(1)清洗:所述鸡滑液囊支原体生物被膜在缓冲液中清洗、自然干燥;(2)固定:将清洗后的所述鸡滑液囊支原体生物被膜固定5-20min、自然干燥;(3)染色:将固定完成后的所述鸡滑液囊支原体生物被膜放入刚果红染色液中染色10-20min;(4)冲洗:染色完成后的所述鸡滑液囊支原体生物被膜放入蒸馏水中清洗、自然干燥。
31.优选的,所述染色方法的步骤(1)中,所述缓冲液为磷酸缓冲液,所述磷酸缓冲液浓度为0.05-0.5mol/l、ph为6.5-7.5;进一步优选的,所述磷酸缓冲液浓度为0.1mol/l、ph为7。
32.优选的,所述染色方法的步骤(2)中,所述固定所使用的试剂为甲醇;进一步优选的,所述甲醇为无水甲醇。
33.优选的,所述染色方法的步骤(2)中,所述固定的时间为5-15min;进一步优选的,所述固定的时间为9-11min。
34.优选的,所述染色方法的步骤(3)中,所述刚果红染色液中所述刚果红的质量百分比为(0.5-1.5)%;进一步优选的,所述刚果红染色液中所述刚果红的质量百分比为0.9-1.1%。
35.优选的,所述染色方法的步骤(3)中,所述染色的时间为13-17min;进一步优选的,所述染色的时间为15min。
36.本发明的第二方面提供一种药物筛选方法,所述药物筛选方法包括以下步骤:使
用药物所述的培育方法所制得的所述鸡滑液囊支原体生物被膜进行抗菌活性测试。
37.优选的,所述药物包括恩诺沙星、多西环素、泰乐菌素、泰妙菌素中的至少一种。
38.本发明的第三方面提供任一项所述的培育方法制备得到的所述鸡滑液囊支原体生物被膜在药物筛选中的应用。
39.相对于现有技术,本发明的有益效果如下:(1)目前用于体外生物实验的鸡滑液囊支原体通常是从关节炎性渗出物经过分离培养、传代培养和纯化培养而得到的,并没有形成鸡滑液囊支原体生物被膜这一生长形式。而本发明则能够在体外培育出鸡滑液囊支原体生物被膜,能够使得生物实验中所测得的数据(如药物对鸡滑液囊支原体的抗菌活性)更加准确。
40.(2)目前,生物被膜的结晶紫染色后的颜色较为明显,但在试验过程中会发现结晶紫染色会因为染色液的状态和染色手法而产生偏差,并不能达到一个统一的颜色。刚果红染色原理是与多糖成分进行结合。而刚果红的染色一般是将刚果红添加到固体培养基中,根据固体培养基上长出的菌落内多糖成分含量的多少,使得刚果红染色的深浅会不一样,随着菌落内多糖成分的增加,颜色会逐渐由红色变为黑色(“modification of the congo red agar method to detect biofilm production by staphylococcus epidermidis”,doi:10.1016/j.diagmicrobio.2012.11.014)。目前,并没有相关的文献显示使用刚果红直接对生物被膜进行染色。在本发明中,刚果红直接染色鸡滑液囊支原体生物被膜较为稳定、染色效果统一。而且,刚果红染色液配制较易,可以现配现用。
41.(3)随着温度的改变,生物量有极显著变化(p《0.01),培养温度为33℃时生物量较多,培养温度为30℃时生物被膜(bf)的尺寸较大。
附图说明
42.图1为实施例1步骤(2)中ms分离株的单菌落显微镜图;图2为实施例1步骤(3)中鸡滑液囊支原体生物被膜的扫描电镜图;图3为不同培养温度下ms生物被膜生长情况的结晶紫染色显微镜图;图4为ms生物被膜染色结果;图5为ms生物被膜生长前后药物敏感性变化对比图。
具体实施方式
43.为了让本领域技术人员更加清楚明白本发明所述技术方案,现列举以下实施例进行说明。需要指出的是,以下实施例对本发明要求的保护范围不构成限制作用。
44.以下实施例中所用的原料、试剂或装置如无特殊说明,均可从常规商业途径得到,或者可以通过现有已知方法得到。
45.本发明中所使用到的抗菌药物:恩诺沙星钠(有效成分含量 92.1%,批号:dk06-2011022,广东华晨药业有限公司)、盐酸多西环素(有效成分含量92.3%,批号:a202012066,广东温氏大华农生物科技有限公司)、酒石酸泰乐菌素(有效成分含量 80.45%,批号:01105010008,山东鲁抗舍里乐药业公司)、延胡索酸泰妙菌素(有效成分含量80.48%,批号:402070010771,广东温氏大华农生物科技有限公司)。
46.本发明中改良frey氏液体培养基的配制方法:按照《中华人民共和国兽药典》2015
年版三部“检验用培养基的配制”部分所记载改良frey氏液体培养基的配制方法进行配制。配制完成后需放入4℃冰箱保存,于1个月内使用。
47.本发明中固体培养基的制作方法:改良frey氏液体培养基的基础上加入1wt%的琼脂粉,高压灭菌后冷却至60℃在超净工作台内将培养基倒至一次性无菌培养皿中。待琼脂冷却凝固后装袋密封放入4℃冰箱保存,于1个月内使用。
48.本发明中冻干溶液的配制:在蒸馏水中加入脱脂奶粉和蔗糖,混合均匀并溶解后进行高压灭菌。待其冷却后密封放入4℃冰箱保存,于1个月内使用。
49.本发明中染色液的配制:1wt%结晶紫染色液使用商品化的成品染色液。1wt%刚果红染色液配制时,首先称取1g刚果红加入烧杯中,再加入100ml蒸馏水或0.1m磷酸盐缓冲液(ph7.0)并超声混匀,配制完成后倒入棕色瓶中在常温下保存,1个月之内使用。
50.本发明中ms(鸡滑液囊支原体)标准株为wvu1853,由甘肃农业大学赠予。
51.本发明中pcr扩增程序参照takara taq
tm version 2.0 plus dye(takara bio inc)的说明书进行设置,具体步骤如下:
①
94℃预变性2min;
②
94℃解链30s、52℃退火30s、72℃延伸32s,一共35个循环;
③
72℃延伸5min。引物序列为:上游引物: 5'-ggccattgctcctrctgttat-3'(seq id no:1);下游引物: 5'-agtaaccgatccgcttaatgc-3'(seq id no:2)(引物交由生工生物工程(上海)有限公司合成)。pcr反应体系的配制以50μl为例:takara taq
tm version 2.0 plus dye 25μl、上游引物(10 μm) 1.5μl、下游引物(10 μm) 1.5μl、ddh2o 17μl、菌液 5μl。
52.实施例1鸡滑液囊支原体的分离及鸡滑液囊支原体生物被膜的培育,包括以下步骤:(1)ms的分离培养:将从不同地区找的148只疑似ms感染的病鸡从颈部放血处死,从股关节截肢,用75%酒精消毒后做好标记,在超净工作台内用采集关节炎性渗出物等样品,将其接种至盛有3ml改良frey氏液体培养基的西林瓶中。接种完成后盖上瓶塞,同时设立空白对照组,用封口膜将西林瓶密封,置于37℃的条件下进行培养,当培养基颜色由红色变为黄色或橙黄色时立即进行传代培养,获得能够稳定传代的培养物。
53.(2)ms的纯化:将生长至对数生长期的ms菌液稀释1000倍。取50μl稀释后的菌液用涂布棒均匀涂布在固体培养基上。完成操作后将平皿用封口膜封好,在37℃、5% co2的条件下培养,待固体培养基上长出煎蛋状菌落后,挑取单菌落至改良frey氏液体培养基中进行培养(第三培育),培养基由红变黄时再次传代培养,连续进行3次传代培养后制得生长至对数生长期的ms菌液,对所提取得到纯化菌株进行鉴定分型、命名,最终得到29个ms分离株。
54.(3)鸡滑液囊支原体生物被膜的培育:将生长至对数生长期的ms菌液使用改良frey氏液体培养基稀释至106cfu/ml备用。在12孔板中放入灭菌后的20mm圆形盖玻片,再加入1ml稀释至106cfu/ml的菌液,制得培养体系,同时用空白培养基做阴性对照,密封后在37℃的条件下培养(第一培育),待培养基由红变黄时取出盖玻片制得鸡滑液囊支原体生物被膜。
55.本发明中,鉴定分型的具体步骤为:本试验对分离到的29个ms分离株的vlha(variable lipoprotein haemagglutinin a)基因进行pcr扩增,扩增产物经测序拼接后在genbank上根据genbank登录号对应的基因序列进行比对,确定其基因型。
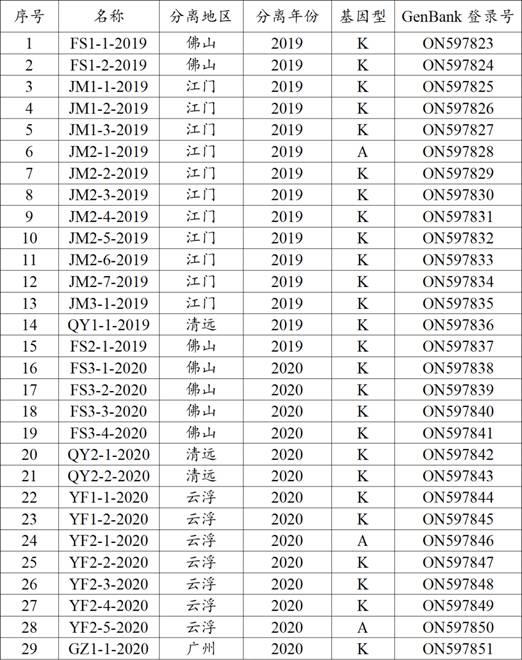
56.本发明中,对29个ms的命名对应的名称、分离地区、分离年份、基因型、genbank登
录号见下表1 ms分离株详细信息与分型结果。
57.表1 ms分离株详细信息与分型结果对实施例1步骤(2)中生长至对数生长期的ms菌液进行菌量的计算:将生长至对数生长期的菌液按10倍梯度稀释5次,吸取最后2个梯度的菌液10μl滴至固体培养基上,密封后在37℃、5% co2的条件下培养,直至生长出肉眼可见的菌落。根据最后2个梯度生长出来的菌落密度来选择计数的梯度,菌落密度不能过大也不能过小,每组试验重复3次。通过此方法计算的菌量为菌落形成单位(colony forming units,cfu),单位为cfu/ml,本实施例1步骤(2)中,生长至对数生长期的菌液里ms的数量有10
8 cfu/ml的数量级。
58.图1为实施例1步骤(2)中ms分离株的单菌落显微镜图(放大倍数为40倍);分离到的ms分离株在固体培养基上生长出来的菌落在显微镜下可以观察到典型的“荷包蛋”的形态。
59.图2为实施例1步骤(3)中鸡滑液囊支原体生物被膜的扫描电镜图;从中可以清晰的看到生物被膜(bf)典型的由胞外多聚物(eps)包裹菌体形成的复合结构。从图2的a中可以看出ms生物被膜的整体结构,并且从表面可以看到ms的生物被膜排列紧密,并且叠加起来形成了一定的厚度;图2的b是图2的a中整块生物被膜(bf)右上角缺口处放大拍摄的照片,其中可以看到生物被膜(bf)的通道结构。
60.对比例1普通的鸡滑液囊支原体的分离培育ⅰ对比例1与实施例1不同之处在于:对比例1不具有步骤(3)。
61.对比例2普通的鸡滑液囊支原体的分离培育ⅱ对比例2与实施例1不同之处在于:对比例2步骤(3)操作过程与实施例步骤(2)相同。
62.由于在培育过程中鸡滑液囊支原体初始浓度不在(0.9-1.5)
×
10
6 cfu/ml这个范围之内(初始浓度在10
5 cfu/ml数量级或以下),所培育得到的仍然只是普通的鸡滑液囊支原体。
63.实施例2鸡滑液囊支原体的分离及鸡滑液囊支原体生物被膜的培育实施例2与实施例1不同之处在于:实施例2还经过冻干保存;具体包括以下步骤:(1)ms的分离培养:将从不同地区找的148只疑似ms感染的病鸡从颈部放血处死,从股关节截肢,用75%酒精消毒后做好标记,在超净工作台内用采集关节炎性渗出物等样品,将其接种至盛有3ml改良frey氏液体培养基的西林瓶中。接种完成后盖上瓶塞,同时设立空白对照组,用封口膜将西林瓶密封,置于37℃的条件下进行培养,当培养基颜色由红色变为黄色或橙黄色时立即进行传代培养,获得能够稳定传代的培养物。
64.(2)ms的纯化:将生长至对数生长期的ms菌液稀释1000倍。取50μl稀释后的菌液用涂布棒均匀涂布在固体培养基上。完成操作后将平皿用封口膜封好,在37℃、5% co2的条件下培养,待固体培养基上生长出煎蛋状菌落后,挑取单菌落至改良frey氏液体培养基中进行培养(第三培育),培养基由红变黄时再次传代培养,连续进行3次传代培养后制得生长至对数生长期的ms菌液,对所提取得到的纯化后的29个ms进行命名、鉴定分型。
65.(3)ms的冻干保存:取纯化后的生长至对数生长期的ms菌液,按照1:1的比例加入冻干液,混合均匀,先将其进行预冷冻。拿出冷冻好的样品后立即用真空冷冻干燥机冷冻干燥24h,操作完成后取出样品密封好,放置于-80℃冰箱内冷冻保存。
66.(4)ms的复苏:在西林瓶中加入3ml的ms液体培养基,再加入适量的保存于-80℃冰箱的ms冻干粉,同时设立空白对照组。完成操作后盖上瓶塞并用封口膜密封,在37℃的条件下培养,当观察到培养基由红色变为黄色时,说明ms已生长至对数生长期,制得生长至对数生长期的ms菌液。
67.(5)鸡滑液囊支原体生物被膜的培育:将生长至对数生长期的ms菌液使用改良frey氏液体培养基稀释至106cfu/ml备用。在12孔板中放入灭菌后的20mm圆形盖玻片,再加入1ml稀释至106cfu/ml的菌液,制得培养体系,同时用空白培养基做阴性对照,密封后在37℃的条件下培养(第一培育),待培养基由红变黄时取出盖玻片制得鸡滑液囊支原体生物被
膜。
68.实施例3温度对ms生物被膜生长的影响,具体包括以下步骤:(1)不同温度下生物被膜(bf)的培养:在96孔板中加入用改良frey氏液体培养基稀释至10
6 cfu/ml的标准株wvu185菌液,同时用空白培养基设立对照组,完成后分别在25℃、30℃、33℃、37℃、40℃的温度下培养,待培养基由红变黄后取出,每组试验重复3次。
69.(2)生物被膜(bf)生物量的计数:将上述生长好bf的96孔板取出,在超净台内吸去培养基并用无菌0.1m磷酸盐缓冲液(ph7.0)冲洗2-3次洗去残余培养基和悬浮菌。冲洗完毕后加入200μl新鲜培养基(改良frey氏液体培养基)用微量移液器反复吹打分散bf中的ms,将分散之后的菌液用改良frey氏液体培养基10倍梯度稀释4次,每个梯度吸取10μl滴至固体培养基上,密封后在37℃、5% co2的条件下培养3~7天,直至生长出肉眼可见的菌落。根据4个梯度生长出来的菌落密度选择计数的梯度,每组试验重复3次。
70.(3)数据分析:试验数据使用spss 22.0采用one-way anova方法对数据进行统计分析,不同培养温度对ms生物被膜生长的影响见下表2。
71.表2 不同培养温度对ms生物被膜生长的影响不生长是指培养生物被膜时培养基经过较长的时间未由红变黄。
72.表2所得结果经统计学分析发现随着温度的改变,生物量有极显著变化(p《0.01),培养温度为33℃时生物量最多,培养温度为30℃与37℃时生物量接近但不如培养温度为33℃下的结果,而培养温度为25℃和40℃时均无结果。
73.图3中用结晶紫染色也得到了验证,图3为不同培养温度下ms生物被膜生长情况的结晶紫染色显微镜图(放大倍数为40倍);图3的(b)33℃中可以明显的看出培养温度为33℃时bf明显更密集,培养温度为30℃(图3的(a)30℃)和37℃(图3的(c)37℃)时bf整体数量上差距不大,但培养温度为30℃时bf的尺寸较大。
74.实施例4生物被膜的染色方法,包括以下步骤:(1)清洗:取出实施例1步骤(3)中生物被膜(bf)生长完成的圆形盖玻片,在0.1m磷酸盐缓冲液(ph=7.0)中洗去培养基和悬浮的菌体后晾干。
75.(2)固定:将清洗后的圆形盖玻片放入无水甲醇中固定10min后取出晾干。
76.(3)染色:将固定完成后的圆形盖玻片分别放入1wt%结晶紫染色液或1wt%刚果红染色液中染色15min。
77.(4)冲洗:染色完成后放入蒸馏水中轻柔的洗去浮色,最后晾干。
78.(5)bf染色完成后将圆形盖玻片放在光学显微镜下观察(生长有bf的一面朝上)。
79.图4为ms生物被膜染色结果(放大倍数为100倍),在光学显微镜下可以看到染色后成块或连片点状的生物被膜(bf),结晶紫染色(图4的(a)结晶紫染色)对比刚果红染色(图4的(b)刚果红染色)颜色更深。
80.目前,生物被膜的结晶紫染色后的颜色较为明显,但在试验过程中会发现结晶紫染色会因为染色液的状态和染色手法而产生偏差,并不能达到一个统一的颜色。刚果红染色原理是与多糖成分进行结合。而现时刚果红的染色一般是将刚果红添加到固体培养基中,根据固体培养基上生长出的菌落内多糖成分含量的多少,使得刚果红染色的深浅会不一样,随着菌落内多糖成分的增加,颜色会逐渐由红色变为黑色(“modification of the congo red agar method to detect biofilm production by staphylococcus epidermidis”,doi:10.1016/j.diagmicrobio.2012.11.014),并没有相关的文献显示使用刚果红直接对生物被膜进行染色。在本发明中,刚果红直接染色鸡滑液囊支原体生物被膜较为稳定、染色效果统一。而且,刚果红染色液配制较易,可以现配现用。
81.实施例5药物筛选方法1:实施例1中29个ms分离株和ms标准株(wvu1853)进行mic(最低抑菌浓度)、mbic(最低生物被膜抑菌浓度)的测定(需要说明的是,本试验测得的mic与mbic均为体外试验测得的结果):(1)ms生物被膜的培养:在96孔板的1~11孔中分别加入200μl用改良frey氏液体培养基稀释至10
6 cfu/ml的实施例1步骤(2)中所制得的29个ms分离株菌液、ms标准株(wvu1853)菌液,同时第12孔用空白培养基做阴性对照,密封后在33℃的条件下培养,待培养基由红变黄时进行后续试验,每组试验重复3次;(2)最低生物被膜抑菌浓度(mbic)的测定:将生长好bf的96孔板放入超净台内,吸去培养基后用0.1m磷酸盐缓冲液(ph=7.0)轻柔冲洗2~3次备用。另取一个96孔板,在1~10孔内将抗菌药物用新鲜培养基(改良frey氏液体培养基)2倍梯度稀释至合适的浓度,每孔配制220μl,恩诺沙星稀释到浓度范围为64~0.125μg/ml;多西环素与泰乐菌素稀释到浓度范围为6.4~0.0125μg/ml;泰妙菌素稀释到浓度范围为0.64~0.00125μg/ml。将稀释好的1~10孔的抗菌药对应的加入上述冲洗完的96孔板1~10孔内,每孔加200μl,第11孔和第12孔分别加入200μl新鲜培养基(改良frey氏液体培养基)作为阳性对照和阴性对照,密封后在37℃的条件下培养,每组试验重复3次。操作完成后每天观察颜色变化,当阳性对照组由红色变为黄色时开始记录结果,当试验组超过2天孔位颜色未发生变化时,最后一个未变色孔位的药物浓度即为该抗菌药物的mbic值,记录数据于下表3;(3)最低抑菌浓度(mic)的测定:在96孔板的第1~10孔加入100μl用新鲜培养基(改良frey氏液体培养基)2倍梯度稀释的抗菌药液,再加入100μl稀释至10
6 cfu/ml的对比例1步骤(2)(同实施例1步骤(2))中所制得的29个ms分离株菌液、ms标准株(wvu1853)菌液,第11孔为200μl与试验组相同浊度的菌液作为阳性对照,第12孔为200μl空白培养基作为阴性对照,密封后在37℃的条件下培养,每组试验重复3次。按照上述方法,恩诺沙星稀释到浓度范围为32~0.0625μg/ml;多西环素与泰乐菌素稀释到浓度范围为3.2~0.00625μg/ml;泰妙菌素稀释到浓度范围为0.32~0.000625μg/ml;ms的数量最终稀释到5
×
10
5 cfu/ml。操作完成后每天观察颜色变化,当阳性对照组由红色变为黄色时开始记录结果,当试验组超过2天孔位颜色未发生变化时,最后一个未变色孔位的药物浓度即为该抗菌药物的mic值,记录数据于下表3。
82.表3 ms生物被膜生长前后药物敏感性的变化
表3中mic、mbic的单位均为μg/ml。
83.图5为ms生物被膜生长前后药物敏感性变化对比图(mbic与mic比值),对于图5的(a)恩诺沙星,有63.3%(19/30)的菌株在生物被膜形成后mbic与mic的比值上升超过2倍及以上,平均上升倍数为1.83倍;对于图5的(b)多西环素,有63.3%(19/30)的菌株在生物被膜形成后mbic与mic的比值上升超过2倍及以上,平均上升倍数为1.79倍;对于图5的(c)泰乐菌素,有70%(21/30)的菌株在生物被膜形成后mbic与mic的比值上升超过2倍及以上,平均上升倍数为4.24倍;对于图5的(d)泰妙菌素,有80%(24/30)的菌株在生物被膜形成后mbic与mic的比值上升超过2倍及以上,平均上升倍数为2.7倍。
84.实施例6药物筛选方法2:mbic与ms生物被膜生物量相关性分析(1)生物量测定前ms生物被膜的培养:在96孔板中加入用改良frey氏液体培养基稀释至200μl稀释至106cfu/ml的实施例1步骤(2)中所制得的29个ms分离株菌液、ms标准株(wvu1853)菌液,同时用空白培养基做阴性对照,密封后在37℃的条件下培养,待培养基由红变黄时进行后续试验,每组试验重复3次。
85.(2)采用平板计数法测定生物量:将步骤(1)生长至对数生长期的菌液按10倍梯度稀释5次,吸取最后2个梯度的菌液10μl滴至固体培养基上,密封后在37℃、5% co2的条件下培养,直至生长出肉眼可见的菌落。根据最后2个梯度生长出来的菌落疏密程度来选择计数的梯度,菌落密度不能过大也不能过小,每组试验重复3次。通过此方法计算的菌量为菌落形成单位(colony forming units,cfu),单位为cfu/ml,生物量测定结果数据记录于下表4。
86.(3)试验数据均用spss 22.0进行统计分析,用pearson相关性分析来检验实施例5中mbic与ms生物被膜生物量之间的相关性,mbic与bf生物量的pearson相关性分析结果见下表5。
87.表4 生物量测定结果测定的ms分离株bf的生物量大多数在106~107,少数ms临床株bf的生物量在105,不同ms临床分离株的bf的生物量有较大差异,最多可差2个数量级。
88.表5 mbic与bf生物量的pearson相关性分析结果
在软件spss 22中用pearson相关性分析来检验mbic与生物量之间的相关性,得到的结果经过汇总见表5。恩诺沙星的mbic与bf生物量之间存在显著低负相关(r《0,0.3≤|r|《0.5,p《0.05),其它3种抗菌药的mbic与bf生物量之间均无相关性。
89.实施例7实施例7与实施例1不同之处在于:步骤(3)中,将生长至对数生长期的ms菌液使用改良frey氏液体培养基稀释至的浓度为0.9
×
106cfu/ml。实施例7同样能够培育出鸡滑液囊支原体生物被膜。
90.实施例8实施例8与实施例1不同之处在于:步骤(3)中,将生长至对数生长期的ms菌液使用改良frey氏液体培养基稀释至的浓度为1.5
×
106cfu/ml。实施例8同样能够培育出鸡滑液囊支原体生物被膜。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。