微米,所述第二凹槽截面的内切圆直径为10微米-100微米。
12.本发明的另一目的,在于提供所述的装置在液滴生成中的应用。
13.本发明的再一目的,在于提供所述的装置多重置换扩增反应中的应用。
14.本发明的再一目的,在于提供.一种多重置换扩增反应方法,包括如下步骤:
15.1)配置所述的装置;
16.2)细胞取用:将细胞悬浮液离心,再用缓冲溶液重悬;
17.3)单细胞捕获
18.在盖子中滴加含细胞的缓冲液,静置待细胞沉降,落入第二凹槽。若细胞未落入第二凹槽,使用吹打后放至震荡孵育器震荡;若细胞仍未落入凹槽,可继续震荡;在第二凹槽捕获细胞后,用缓冲溶液轻轻吹打芯片,洗去多余的细胞,最终只留下第二凹槽的单细胞;
19.4)液滴生成
20.进行细胞裂解,之后进行dna扩增,然后将盖体和芯篇和管体组装成完整的装置后,离心,在管体内生成液滴;
21.5)mda产物文库构建
22.纯化后让dna片段化,最后进行pcr富集。
23.优选地,步骤1)中加入1-5%的聚乙二醇水溶液并在烘箱中烘干。
24.优选地,步骤3)中,向取用的细胞悬浮液中滴加细胞染剂对细胞进行染色。
25.优选地,步骤4)的离心,为500-15000rpm下转1-5min。
26.本发明与
背景技术:
相比具有的优点有:
27.1、本发明的装置解决了现有的多重置换扩增反应中,手动将单个细胞放入缓冲液中操作过于困难的缺点。
28.2、本发明的液滴生成装置制作简单
29.3、本发明液滴生成简单、高效,同时,具有稳定性和准确性。
附图说明
30.图1为本发明的一管式平台结构示意图。
31.图2为本发明的原理示意图。
32.图3为芯片生成装置,(a)芯片模板结构;(b)打孔笔;(c)八连管盖芯片。
33.图4为芯片捕获mrc-5细胞全过程在显微镜下的成像,明场和荧光场一一对应。(a)重悬前;(b)重悬后;(c)洗涤后。
34.图5为液滴生成装置及实物(a)防蒸发高温胶布;(b)装置组成;(c)离心生成液滴; (d)液滴实物。
35.图6为单细胞捕获效率分析。(a)不同沉淀时间和细胞浓度下的捕获效率;(b)不同细胞捕获效率的比较。
36.图7为微液滴表征。(a)不同孔径毛细管生成液滴的比较;(b)不同毛细管孔径和液滴直径。
37.图8为归一化读取深度图。
具体实施方式
38.实施例1
39.参见图1,为本发明管式平台的结构示意图。图中,1为管体,2为漏斗部,3为毛细管, 4为油相液体,5为盖体,6为胶,7为第一凹槽,8为第二凹槽。
40.其中,管式平台包括八连管,所述的八连管包括管体1和盖体2,管体1的上部设有倒锥形的漏斗部2,漏斗部2的底部向下设有毛细管3,管体1的下半部设有油相液体4,毛细管3底端插入该油相液体中。盖体5的底部设有芯片6,所述的芯片6底部向上设有第一凹槽7,所述的第一凹槽7的上底面向上设有第二凹槽6。
41.所述第第一凹槽7的横截面为正方形,所述第二凹槽6的横截面为正六边形。第二凹槽 6的横截面小于第一凹槽7的横截面。
42.所述第一凹槽6截面的内切圆直径为5微米~1000微米,所述第二凹槽7截面的内切圆直径为1微米-500微米。进一步优选,所述第一凹槽6截面的内切圆直径为20微米-200微米,所述第二凹槽7截面的内切圆直径为10微米-100微米。
43.离心驱动液滴mda
44.具体步骤如下:
45.1、芯片制作
46.1)配胶:在塑料杯中分别加入30gpdms单体和3gpdms引发剂,用勺子搅拌均匀,放入高压灭菌锅之中30min抽真空排气泡。
47.2)芯片生成:拿出一个干净的培养皿,在底部倒上适量的pdms混合胶,将如图3(a) 所示的芯片模板放入培养皿之中(所述的芯片模板上和培养皿形状配套,未显示的另一面设有多个凸柱,凸柱的下半部为截面为正六边形的六柱体,上半部为截面为正四边形的四柱体),芯片模板具有凸柱的一面朝上,然后倒入3-5mm厚的pdms混合胶,待无气泡后放入95℃烘箱加热8min后取出。待冷却后,先用手术刀将凸柱结构所在大范围割下,再用如图3(b) 所示改进过的打孔笔打孔,将凸柱结构所在的区域打下,得到芯片6。
48.3)修饰:在芯片6的凹槽面上滴加疏水化试剂egc-1720,后置于35℃烘箱中约烘干10min。而后加入2%的聚乙二醇水溶液并在35℃烘箱中烘干。
49.4)粘合:将芯片凹槽面朝外用配好的pdms粘合在八连管的盖子上,生成如图3(c)所示芯片。
50.2、细胞取用
51.1)将a549细胞从co2培养箱中取出,吸去表面培养基,加入1ml胰酶并吹打使贴壁细胞悬浮(悬浮细胞可不需要此步骤)。
52.2)吸去胰酶消化液,用适量pbs缓冲液吹打、洗涤培养皿,之后将细胞悬浮液吸入1.5ml 离心管中。
53.3)在1000rpm下离心3min,结束之后再用pbs缓冲溶液重悬。
54.3、单细胞捕获,全程如图4所示:
55.1)向取用的细胞悬浮液中滴加1μl的钙黄绿素染剂,混匀,之后孵育10min。
56.2)在迷你离心机上用1000rpm离心3min,离心完毕后用移液枪吸掉上清液,之后用pbs 缓冲溶液洗涤沉淀,吹打混匀。重复上述操作三次完成染色剂洗涤。
57.3)将15μl质量分数为0.1%的bsa溶液滴加在八连管盖中,之后在65℃的烘箱中加
热 30min,取出。
58.4)用20μl移液枪在盖子中滴加15μlpbs缓冲溶液,之后放入真空干燥箱抽真空10min,以抽取凹槽中的气泡。
59.5)吸去芯片上pbs缓冲液,在显微镜下对芯片进行操作:吸取1μl细胞滴于芯片中央的标记处,静置1min待细胞沉降,落入凹槽。若细胞未落入凹槽,使用移液枪吹打后放至震荡孵育器震荡1min。若细胞仍未落入凹槽,继续震荡,直至落入凹槽为止,并记录重悬次数。
60.6)在捕获细胞后,用pbs缓冲溶液轻轻吹打芯片,洗去多余的细胞,最终只留下小凹槽的单细胞。
61.4、液滴生成
62.1)准备buffer d2:从冰箱中取出单细胞wga试剂盒,在冰盒上于200μl离心管中分别加入4μldtt(1m)、36μl buffer d,用移液枪吹打混匀。
63.2)细胞裂解:在细胞捕获装置中滴加1μl cell storage buffer,以及1.5μl bufferd2在盖子上,粘上高温胶布,之后放入65℃烘箱加热10min。
64.3)dna扩增:将盖子取出后拆去胶布,在八连管盖子中滴加如下试剂:1.5μl stopsolution;15μl discover-sc wga master buffer;1μl discover-sc wga enzyme mix;4μlddh2o。
65.4)组装装置:用配置好的pdms将定制的套管分别与25μm的毛细管粘起来。(也可改变毛细管孔径为20μm、50μm以及75μm)。在八连管中加入30μl液滴生成油,并按盖子、套管、八连管的顺序依次拼接,如图5(b)。
66.5)液滴生成:如图5(c),将拼接好的装置放在迷你离心机上,配平,在3500rpm下转 3min。之后在30℃下孵育2h,65℃孵育5min。
67.5、mda产物文库构建
68.1)纯化
69.a)使用移液枪将生成的液滴吸入200μl离心管,加入异丁醇使其重新破乳。
70.b)将所得产物瞬时离心,将上清液吸出滴加到600μl离心管中,如不够50μl则加超纯水至50μl。加入30μl磁珠,瞬时离心混匀。孵育7min,使磁珠和dna结合。
71.c)将离心管放至磁力架静置2min,吸去上清。加入200μl80%乙醇洗涤dna,静置30s 后吸取上清,再用80%乙醇洗涤一遍。
72.d)使磁珠干燥,刚出现裂缝时加入11μl水,瞬时离心,分散磁珠,孵育4min。将离心管放至磁力架静置2min,之后取上清液于200μl离心管。
73.e)于600μl离心管中取qubit buffer 199微升和1微升荧光染料震荡混匀。取199μl 混合溶液与1μldna混合(在薄壁管中),定量。
74.2)dna片段化
75.a)室温解冻5xttbl,混匀后备用。观察5xts是否有沉淀,若有沉淀涡旋混匀。
76.b)在灭菌离心管中配制的组分为5xttbl 4μl、5ng dna xμl、tte mix v5 5μl、ddh2o 加到20μl。
77.c)移液枪吹打20次混匀。
78.d)将反应管放入pcr仪中,在55℃下加热10min,热盖温度为105℃。
79.e)反应结束后取出产物,立刻加入5μlts,吹打混匀,室温放置5min。
80.3)pcr富集
81.a)将pcr管置于冰上,向其中加入如下体系:ddh2o 4μl、5xtab 10μl、p5-1 5μl、 tae 1μl、index 5μl
82.b)用移液枪吹打混匀,将反应物置于pcr仪中,运行如图4所示程序
83.4)扩增产物长度分选:用30μl磁珠纯化一遍,参考步骤1)。
84.下表为pcr富集时pcr仪程序。
[0085][0086]
图4为芯片捕获mrc-5细胞全过程在显微镜下的成像,明场和荧光场一一对应。(a)重悬前;(b)重悬后;(c)洗涤后。在显微镜下,我们有了惊喜的发现,本来分布均匀的细胞,在经过振荡孵育仪的重悬之后,会聚集到芯片的中央,集中分布在捕获凹槽附近,这无疑增加了细胞捕获的效率图4(b)。
[0087]
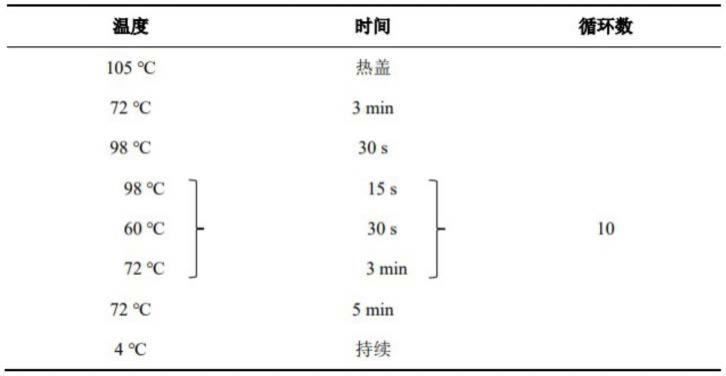
图6为单细胞捕获效率分析。(a)不同沉淀时间和细胞浓度下的捕获效率;(b)不同细胞捕获效率的比较。为了表征该细胞捕获装置,我们对该捕获结构进行了成像和计数,用以计算芯片的后期捕获效率。结果表明,随着重悬时间和细胞浓度的增加,捕获效率有着明显的提升,如图6(a)。重悬时间较长时细胞落入结构中的概率变大从而使得单细胞捕获效率增加。而当重悬时间太长时,由于细胞悬浮液蒸发,细胞不能够再流动,捕获效率便不再增加。因此我们选择3次为最佳累计重悬次数,每次重悬持续30s。当细胞悬浮液浓度达到 200个细胞/μl时,单细胞重悬3次累计捕获效率为100%。而在浓度为100个细胞/μl 时,捕获概率也能超过50%。对于只有几十个细胞而言,其捕获效率也是可以接受的,装置的下限为20个细胞/μl,而且我们认为,随着加入密封设备,循环数可进一步增加,最终捕获效率会达到100%。为了评估整个测序技术的稳定性,我们也量化了不同大小的不同细胞的捕获效率,结果显示捕获效率有着很好的相干性,如图6(b)。
[0088]
图7为微液滴表征。(a)不同孔径毛细管生成液滴的比较;(b)不同毛细管孔径和液滴直径。这里离心机选择了3500rpm、3min为实验条件,这既可以快速有效生成液滴,又不至于生成液滴的量太少。接着采用不同口径的毛细管进行了液滴生成。结果表明,液滴的大小随着毛细管口径的增大而增大,如图7(b)。同时,生成的液滴有很好的均一性,如图7 (a)。而当试图用15μm孔径的毛细管生成微液滴时,无论转速和时间怎么增加都无法做到。经过分析,我们认为是由于液体表面张力的作用。由此得出了液滴生成装置的应用范围为生成粒径大小100μm以上的液滴,并具有很好的均一性。
[0089]
图8为归一化读取深度图。采用动态分箱法归一化计算mrc-5细胞mda的拷贝数,并得出了相对应的变异系数(cv),如图8。经过计算,离心液滴mda的cv平均值为0.40,与我们查阅到的其他液滴mda方法相似,说明该方法有很好的扩增均一性。
[0090]
以上所述,仅为本发明较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。