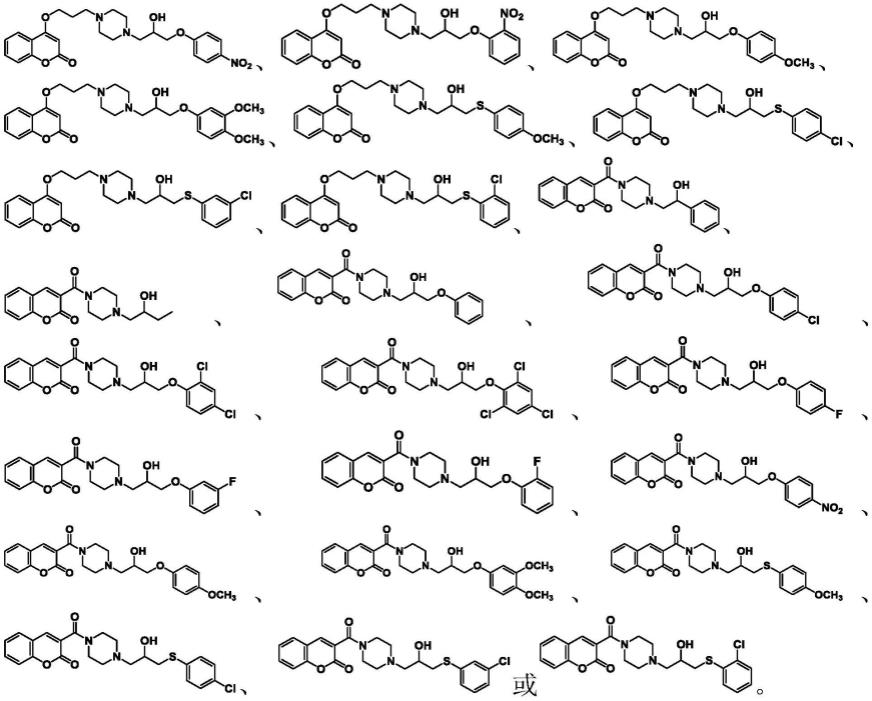
1.本发明涉及药物化学技术领域,尤其是一种含异丙醇胺结构的香豆素类化合物及其制备方法和应用。
背景技术:
2.植物细菌性和真菌性病害,如水稻白叶枯病、辣椒青枯病、白菜叶斑病、烟草青枯病、柑桔溃疡病、猕猴桃溃疡病、黄瓜灰霉病、辣椒枯萎病、油菜菌核病、小麦赤霉病、马铃薯晚疫病、蓝莓根腐病、葡萄座腔菌、火龙果炭疽病、水稻纹枯病等,是由植物病原细菌和真菌引起并影响农作物生产的几种重要病害,主要表现为坏死、枯萎、腐烂等症状。由于传统杀菌剂的使用不仅增加了植物病原微生物的抗药性而且影响环境和危害农作物安全。因此,当前迫切需要开发具有高活性、高选择性的新型杀菌剂。
3.具有生物活性的植物源天然产物是新农药创制和研发的重要资源。大多数植物源农药对哺乳动物的毒性较低甚至无毒,使用中对人畜比较安全。香豆素(coumarin)是一类广泛存在于自然界中的苯并α-吡喃酮母核的天然产物,可看作是由顺式邻羟基桂皮酸脱水形成的内酯。据文献报道,香豆素是一种来源于蛇床子、补骨脂、前胡等中药的活性成分,其具有抗癌、抗炎、抗氧化、抗菌等广泛的生物作用。另外,香豆素的合成工艺简单,操作方便,生产成本低,具有较好的工业应用前景。
4.damu等在“synthesis and bioactive evaluation of a novel series of coumarinazoles[j].bioorg.med.chem.lett.2014,24,3605-3608”报道了新型香豆素唑类化合物抗菌和抗真菌的生物活性,结果表明,含双三唑醇结构香豆素7a表现出较好的抗白色念球菌(canidia albicans)、抗大肠杆菌jm109(escherichia coli)和抗耐甲氧西林金黄色葡萄球菌(mrsa)活性。
[0005]
pan等在“design and synthesis of novel coumarin analogs and their nematicidal activity against five phytonematodes[j].chinese chem.lett.2016,27,375-379”合成了一系列新型香豆素衍生物,并测定其杀线虫的活性。通过对香豆素主链c4和c7位置进行修饰后的化合物对五种线虫均表现出较强且广谱的杀线虫活性,特别对于松材线虫的lc
50
可达到2.5μmol/l。
[0006]
yang等在“new insights into the antibacterial activity of hydroxycoumarins against ralstonia solanacearum[j].molecules,2016,21,468”研究18种植物来源的香豆素化合物对青枯雷尔菌(ralstonia solanacearum)抗菌活性以及对植物病原菌的作用机制。实验结果表明,这些化合物均能抑制青枯雷尔菌,其中活性最好的为瑞香素,抑制率在100μg/ml时可达97.4%,进一步机制研究发现该类化合物可破坏病原体的细胞膜,并抑制生物膜的形成。
[0007]
priyank等在“synthesis,antimicrobial,cytotoxic and e.coli dna gyrase inhibitory activities of coumarinyl amino alcohols[j].bioorg.chem.2017,71,120-127”研究了14种香豆酰氨基醇对大肠杆菌(escherichia coli)抗菌活性,这些化合物
表现出良好的微生物抑制作用,mic值在6.25到25μg/ml之间。
[0008]
sharma等在“synthesis,antimicrobial and chitinase inhibitory activities of 3-amidocoumarins[j].bioorg.chem.2020,98,103700”合成了一系列3-酰胺香豆素衍生物,并测试了化合物的离体抗菌活性。其中目标化合物对于铜绿假单胞菌(pseudomonas aeruginosa),大肠杆菌(escherichia coli),金黄色葡萄球菌(staphylococcus aureus)表现出良好的抗菌活性,mic值在6.25~25μg/ml之间。
[0009]
alshibl等在“synthesis and evaluation of new coumarin derivatives as antioxidant,antimicrobial,and anti-inflammatory agents[j].molecules 2020,25,3251”制备了新的吡喃香豆素和香豆素-磺酰胺衍生物,并评价了其抗氧化、抗菌和抗炎活性。大多化合物具有显著的抗氧化活性和比对照药阿司匹林更强的抗炎活性;此外,也对水肿有显著的抑制作用。
[0010]
如何继续以香豆素结构为先导化合物,寻找高效杀菌的活性目标化合物是目前亟需解决的问题。
技术实现要素:
[0011]
针对上述问题中存在的不足之处,本发明提供一种含异丙醇胺结构的香豆素类化合物。该化合物具有如通式(i)和(ii)所示的结构:
[0012][0013]
其中,r选自:氢、氘、任意取代或未取代的烷基、任意取代或未取代的烯基、任意取代或未取代的炔基、任意取代或未取代的烷氧基、任意取代或未取代的环烷基、任意取代或未取代的芳基、任意取代或未取代的胺基或杂环胺基、任意取代或未取代的巯基或杂环巯基、任意取代或未取代的杂芳基中的一个或多个。
[0014]
作为本发明进一步地改进,r选自:氢、氘、c1-c6烷基、c2-c6烯基、c2-c6炔基、c1-c6烷氧基、取代或未取代的c6-c15芳基、取代或未取代的c6-c10杂芳基中的一个或多个,其中,取代的指的是被c1-c6烷基、c1-c6烷氧基、氨基、羟基、卤素、硝基、三氟甲基中的一个或多个取代。
[0015]
作为本发明进一步地改进,r选自:氢、氘、甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基1,1-二甲基、1,5-二甲基己基、1,1-二乙醇基、丙烯基、烯丙基、甲氧基、乙氧基、丙氧基、丁氧基、取代或未取代的苯基、取代或未取代的苄基,其中,取代的指的是被c1-c6烷基、c1-c6烷氧基、氨基、羟基、卤素、硝基、三氟甲基中的一个或多个取代。
[0016]
作为本发明进一步地改进,r选自:氢、氘、甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基、1,1-二甲基、1,5-二甲基己基、1,1-二乙醇基、丙烯基、烯丙基、甲氧基、乙氧基、丙氧基、丁氧基、苯基、苄基、2-甲氧基苄基、3-甲氧基苄基、4-甲氧基苄基、2-甲基苄基、3-甲基苄基、4-甲基苄基、2-氯苄基、3-氯苄基、4-氯苄
基、2-氟苄基、3-氟苄基、4-氟苄基、2-溴苄基、3-溴苄基、4-溴苄基、2-氨基苄基、3-氨基苄基、4-氨基苄基、2-羟基苄基、3-羟基苄基、4-羟基苄基、2-硝基苄基、3-硝基苄基、4-硝基苄基、2-三氟甲基苄基、3-三氟甲基苄基、4-三氟甲基苄基、吗啉基、哌啶基、2-甲基哌啶基、3-甲基哌啶基、4-甲基哌啶基、r-3-哌啶甲酸乙酯基、s-3-哌啶甲酸乙酯基、4-哌啶甲酸甲酯基、吡咯烷基、r-3-羟基吡咯烷基、s-3-羟基吡咯烷基、哌嗪基、1-甲基哌嗪基、1-乙基哌嗪基、1-异丙基哌嗪基、1-叔丁基哌嗪基、1-乙酰基哌嗪基、1-苄基哌嗪基、1-(2-甲氧基苄基)哌嗪基、1-(3-甲氧基苄基)哌嗪基、1-(4-甲氧基苄基)哌嗪基、1-(2-甲基苄基)哌嗪基、1-(3-甲基苄基)哌嗪基、1-(4-甲基苄基)哌嗪基、1-(2-氯苄基)哌嗪基、1-(3-氯苄基)哌嗪基、1-(4-氯苄基)哌嗪基、1-(2-氟苄基)哌嗪基、1-(3-氟苄基)哌嗪基、1-(4-氟苄基)哌嗪基、1-(2-溴苄基)哌嗪基、1-(3-溴苄基)哌嗪基、1-(4-溴苄基)哌嗪基、1-(2-氨基苄基)哌嗪基、1-(3-氨基苄基)哌嗪基、1-(4-氨基苄基)哌嗪基、1-(2-羟基苄基)哌嗪基、1-(3-羟基苄基)哌嗪基、1-(4-羟基苄基)哌嗪基、1-(2-硝基苄基)哌嗪基、1-(3-硝基苄基)哌嗪基、1-(4-硝基苄基)哌嗪基、1-(2-三氟甲基苄基)哌嗪基、1-(3-三氟甲基苄基)哌嗪基、1-(4-三氟甲基苄基)哌嗪基。
[0017]
作为本发明进一步地改进,该化合物选自下述具体化合物:
[0018][0019]
本发明还提供一种制备如上述的含异丙醇胺结构的香豆素类化合物的方法,该制备方法为:
[0020][0021]
其中,r选自:氢、氘、任意取代或未取代的烷基、任意取代或未取代的烯基、任意取
代或未取代的炔基、任意取代或未取代的烷氧基、任意取代或未取代的环烷基、任意取代或未取代的芳基、任意取代或未取代的胺基或杂环胺基、任意取代或未取代的巯基或杂环巯基、任意取代或未取代的杂芳基中的一个或多个。
[0022]
作为本发明进一步地改进,在制备化合物ⅰ时,所述制备方法包括:
[0023]
步骤1-1、将4-羟基香豆素在n,n-二甲基甲酰胺中搅拌溶解,再向其中加入碳酸钾和1,3-二溴丙烷,搅拌反应,反应完成后,加入重蒸水,用乙酸乙酯萃取,合并有机相,然后水洗,干燥,除去溶剂,剩余物经柱层析纯化分离后得到4-(3-溴丙烷基)-2h-苯并吡喃-2-酮;
[0024]
步骤1-2、将4-(3-溴丙烷基)-2h-苯并吡喃-2-酮溶解于溶剂中,再向其中加入n-boc哌嗪、碳酸钾和碘化钾,回流反应,反应完成后,加入重蒸水,用乙酸乙酯萃取,合并有机相,然后水洗,干燥,除去溶剂,剩余物经柱层析纯化分离后得到叔丁基4-(3-((2-氧代-2h-苯并吡喃-4-基)氧)丙基)哌嗪-1-羧酸叔丁酯;
[0025]
步骤1-3、将叔丁基4-(3-((2-氧代-2h-苯并吡喃-4-基)氧)丙基)哌嗪-1-羧酸叔丁酯溶于溶剂中,再向其中加入三氟乙酸,搅拌反应,反应完成后,旋蒸除去溶剂,得到4-(3-(哌嗪-1-基)丙氧基)-2h-苯并吡喃-2-酮;
[0026]
步骤1-4、将4-(3-(哌嗪-1-基)丙氧基)-2h-苯并吡喃-2-酮和碳酸钾加入到含有异丙醇中,搅拌至反应物完全溶解,然后滴加加热反应,停止反应后,加入重蒸水,用乙酸乙酯萃取,合并有机相,然后水洗,干燥,除去溶剂,剩余物经柱层析纯化分离后得到化合物ⅰ。
[0027]
作为本发明进一步地改进,在制备化合物ⅱ时,所述制备方法包括:
[0028]
步骤2-1、将香豆素-3-羧酸、碳二亚胺盐酸盐、羟基苯并三唑和n,n-二异丙基乙胺溶解于溶剂中,搅拌反应,再加入n-boc哌嗪,继续搅拌反应,反应完成后,分别用饱和nacl溶液和乙酸乙酯对反应液进行萃取,合并有机相,有机相干燥,除去溶剂,剩余物经柱层析纯化分离后得到叔丁基4-(2-氧代-2h-苯并吡喃-3-羰基)哌嗪-1-羧酸叔丁酯;
[0029]
步骤2-2、将叔丁基4-(2-氧代-2h-苯并吡喃-3-羰基)哌嗪-1-羧酸叔丁酯溶于溶剂中,再向其中加入三氟乙酸,搅拌反应,反应完成后,旋蒸除去溶剂,得到3-(哌嗪-1-羰基)-2h-苯并吡喃-2-酮;
[0030]
步骤2-3、将3-(哌嗪-1-羰基)-2h-苯并吡喃-2-酮和碳酸钾加入到含有异丙醇中,搅拌至反应物完全溶解,然后滴加加热反应,停止反应后,加入重蒸水,用乙酸乙酯萃取,合并有机相,然后水洗,干燥,除去溶剂,剩余物经柱层析纯化分离后得到化合物ⅱ。
[0031]
本发明还提供一种制备如上述的含异丙醇胺结构的香豆素类化合物的方法,该制备方法为:
[0032][0033]
其中,r选自:氢、氘、任意取代或未取代的烷基、任意取代或未取代的烯基、任意取代或未取代的炔基、任意取代或未取代的烷氧基、任意取代或未取代的环烷基、任意取代或未取代的芳基、任意取代或未取代的胺基或杂环胺基、任意取代或未取代的巯基或杂环巯基、任意取代或未取代的杂芳基中的一个或多个。
[0034]
本发明还提供一种组合物,该组合物含有如上述的含异丙醇胺结构的香豆素类化合物,以及农业上可用的助剂或杀菌剂、杀虫剂或除草剂;该组合物的剂型选自:乳油(ec)、粉剂(dp)、可湿性粉剂(wp)、颗粒剂(gr)、水剂(as)、悬浮剂(sc)、超低容量喷雾剂(ulv)、可溶性粉剂(sp)、微胶囊剂(mc)、烟剂(fu)、水乳剂(ew)或水分散性粒剂(wg)。
[0035]
本发明还提供含有如上述的含异丙醇胺结构的香豆素类化合物或上述组合物的用途,该用途为将含有如上述的含异丙醇胺结构的香豆素类化合物或上述组合物用于防治农业病虫害,该农业病虫害选自:植物细菌性病害或植物真菌性病害。
[0036]
作为本发明进一步地改进,农业病虫害选自:植物叶枯病或植物溃疡病。
[0037]
作为本发明进一步地改进,农业病虫害选自:水稻白叶枯病、黄瓜白叶枯病、魔芋白叶枯病、柑橘溃疡病、烟草青枯病、葡萄溃疡病、番茄溃疡病、猕猴桃溃疡病、苹果溃疡病、黄瓜灰霉病、辣椒枯萎病、油菜菌核病、小麦赤霉病、马铃薯晚疫病、蓝莓根腐病、葡萄座腔菌、火龙果炭疽病或水稻纹枯病。
[0038]
本发明还提供了利用含有如上述的含异丙醇胺结构的香豆素类化合物或上述组合物防治农业病虫害的方法,该方法为使含有如上述的含异丙醇胺结构的香豆素类化合物或上述组合物作用于有害物或其生活环境;该农业病虫害为植物细菌性或真菌性病害。
[0039]
本发明还提供了一种保护植物免受农业病虫害侵害的方法,该方法包括其中使植物与上述的含异丙醇胺结构的香豆素类化合物或如上述的组合物接触的方法步骤。
[0040]
与现有技术相比,本发明的有益效果为:
[0041]
本发明公开了一种含异丙醇胺结构的香豆素类化合物,该化合物对植物病原细菌和真菌具有良好的抑制作用,针对病原细菌[如水稻白叶枯病菌(xanthomonas oryzae pv.oryzae,xoo)、柑橘溃疡病菌(xanthomonas axonopodis pv.citri,xac)等]均具有良好的抑制效果为新农药的研发和创制提供重要的科学基础。
具体实施方式
[0042]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0043]
本发明用到的术语“烷基”是包括具有特定数目碳原子的支链和直链饱和烃基。例如“c
1-10
烷基”(或亚烷基)目的是c1、c2、c3、c4、c5、c6、c7、c8、c9和c10烷基。另外,例如“c
1-6
烷基”表示具有1到6个碳原子的烷基。烷基可为非取代或取代的,以使一个或多个其氢原子被其它化学基团取代。烷基的实施例包括但不限于甲基(me)、乙基(et)、丙基(如正丙基和异丙基)、丁基(如正丁基、异丁基、叔丁基)、戊基(如正戊基、异戊基、新戊基)及其类似物。
[0044]“烯基”是既包括直链或支链结构的烃,且具有一个或多个出现在链中任何稳定点的碳-碳双键。例如“c
2-6
烯基”(或亚烯基)目的是包括c2、c3、c4、c5和c6烯基。烯基的实例包括但不限于乙烯基、1-丙烯基,2-丙烯基、2-丁烯基、3-丁烯基、2-戊烯基、3-戊烯基、4-戊烯基、2-己烯基、3-己烯基、4-己烯基、5-己烯基、2-甲基-2-丙烯基、4-甲基-3-戊烯基及其类似物。
[0045]“炔基”是既包括直链或支链结构的烃,且具有一个或多个出现在链中任何稳定点的碳-碳叁键。例如“c
2-6
炔基”(或亚炔基)目的是包括c2、c3、c4、c5和c6炔基;如乙炔基、丙炔基、丁炔基、戊炔基、己炔基及其类似物。
[0046]
本发明用到的术语“取代的”指的是在指定原子或基团上的任意一个或多个氢原子以选择的指定基团取代,前提是不超过指定原子的一般化合价。如果没有其它说明,取代基命名至中心结构。例如,可以理解的是当(环烷基)烷基是可能的取代基,该取代基至中心结构的连接点是在烷基部分中。此处使用的环双键是形成于两个临近环原子之间的双键(如c=c、c=n或n=n)。当提到取代时,特别是多取代时,指的是多个取代基在指定基团上的各个位置上取代,如二氯苯基指的是1,2-二氯苯基、1,3-二氯苯基、1,4-二氯苯基和2,4-二氯苯基。
[0047]
取代基和或变量的组合是允许的,仅当这些组合产生稳定的化合物或有用的合成中间体。稳定的化合物或稳定结构暗示所述化合物以有用的纯度从反应混合物分离出来时是足够稳定的,随之配制形成有效的治疗试剂。优选地,目前所述化合物不包含n-卤素、s(o)2h或s(o)h基。
[0048]
术语“芳基”指的是在环部分具有6到12个碳原子的单环或双环芳香烃基,如苯基和萘基,每个可被取代的。
[0049]
术语“卤素”或“卤素原子”指的是氯、溴、氟和碘。
[0050]
术语“卤代烷基”指的是具有一个或多个卤素取代基的取代烷基。例如“卤代烷基”包括单、双和三氟甲基;即便卤代烷基中的卤代被明确为氟、氯、溴、碘,同样指的是具有一个或多个氟、氯、溴、碘取代基的取代烷基。
[0051]
术语“杂芳基”指的是取代和非取代芳香5或6元单环基团,9-或10-元双环基团,和11到14元三环基团,在至少一个环中具有至少一个杂原子(o,s或n),所述含杂原子的环优选具有1、2或3个选自o、s和n中的杂原子。含杂原子的杂芳基的每个环可含一个或两个氧或硫原子和/或由1到4个氮原子,前提是每个环中杂原子的总数是4或更少,且每个环具有至
少一个碳原子。完成双环和三环基团的稠合环可仅含有碳原子,并可以是饱和、部分饱和或不饱和。氮和硫原子可任选被氧化且氮原子可任选被季铵化。双环或三环的杂芳基必须包括至少一个全芳香环,氮其它稠合环可为芳香性或非芳香性的。杂芳基可在任何环的任何可利用氮或碳原子上连接。当化合价允许,如果所述其它环是环烷基或杂环,其另外任选以=o(氧)取代。
[0052]
示例性单环杂芳基包括吡咯基、吡唑基、吡唑啉基、咪唑基、噁唑基、异噁唑基、噻唑基、噻二唑基、呋喃基、噻吩基、噁二唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、三嗪基及其类似物。
[0053]
示例性双环杂芳基包括吲哚基、苯并噻唑基、苯并二氧杂环戊烯基、苯并噁唑基、苯并噻吩基、喹啉基、四氢异喹啉基、异喹啉基、苯并咪唑基、苯并呋喃基、吲哚嗪基、苯并呋喃基、色酮基、香豆素基、苯并呋喃基、噌啉基、喹喔啉基、吲唑基、吡咯并吡啶基、氟代吡啶基、二氢异吲哚基、四氢喹啉基及其类似物。
[0054]
如果没有其它说明,本发明的化合物理解为包括游离态和其盐。术语“盐”表示以无机和/或有机酸和碱形成酸式和/或碱式盐。另外,术语“盐可包括两性离子(内盐),如当式i化合物含有碱性片段如胺或吡啶或咪唑环,和酸式片段如羧酸。药物上可接受的(即非毒性、生理学上可接受的)盐是优选的,如可接受的金属和胺盐,其中阳离子没有显著贡献毒性或盐的生物活性。然而,其它盐可是有用的,如在制备过程中采用分离或纯化步骤,因此也包含于本发明范围中。
[0055]c1-c
10
烷基指的是甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基及其同分异构体;c
1-c
10
烷氧基指的是甲氧基、乙氧基、丙氧基、丁氧基、戊氧基、己氧基、庚氧基、辛氧基、壬氧基、癸氧基及其同分异构体;c
2-c5烯基指的是乙烯基、丙烯基、烯丙基、丁烯基、戊烯基及其同分异构体。
[0056]
当提到取代基为烯基、炔基、烷基、卤素、芳基、杂芳基、烷氧基、环烷基、羟基、氨基、巯基、膦基时,或这些取代基具体的为某个具体的烯基、炔基、烷基、卤素、芳基、杂芳基、烷氧基、环烷基、羟基、氨基、巯基、膦基时,指的是一个到三个上述取代基。如甲基苯基指的是一个到三个甲基取代的苯基。
[0057]
实施例1-1:4-(3-溴丙烷基)-2h-苯并吡喃-2-酮的制备
[0058][0059]
在100ml圆底烧瓶中,加入4-羟基香豆素(18.51mmol)和30ml dmf搅拌溶解,再向其中加入碳酸钾(18.51mmol)和1,3-二溴丙烷(36.99mmol),室温过夜反应,tlc跟踪反应完成情况。反应完成后,加入90ml重蒸水,用30ml乙酸乙酯萃取三次,合并有机相,然后分别用50ml饱和nh4cl溶液和50ml饱和nacl溶液洗涤一次,有机相用无水naso4干燥。最后,在45℃下通过旋转蒸发浓缩有机相,经柱层析(洗脱剂(v/v):pe/ea=2/1)纯化分离后得到4-(3-溴丙烷基)-2h-苯并吡喃-2-酮,白色固体,产率86.9%,m.p.108-109℃;1h nmr(400mhz,
cdcl3)δ7.79(dd,j=7.9,1.2hz,1h,2h-chromen-2-one-5-h),7.59
–
7.52(m,1h,2h-chromen-2-one-7-h),7.30(dd,j=15.0,8.1hz,2h,2h-chromen-2-one-6-h 2h-chromen-2-one-8-h),5.72(s,1h,2h-chromen-2-one-3-h),4.30(t,j=5.8hz,2h,o-ch
2-ch
2-ch
2-br),3.62(t,j=6.3hz,2h,o-ch
2-ch
2-ch
2-br),2.46(dd,j=12.1,6.1hz,2h,o-ch
2-ch
2-ch
2-br);
13
c nmr(101mhz,cdcl3)δ165.4,162.9,153.5,132.7,124.1,123.0,117.1,115.7,91.0,66.9,31.6,29.0;hrms(esi)[m h]
calcd for c
12h11
bro3:282.9964,found:282.9968.
[0060]
实施例1-2:叔丁基4-(3-((2-氧代-2h-苯并吡喃-4-基)氧)丙基)哌嗪-1-羧酸叔丁酯的制备
[0061][0062]
在100ml圆底烧瓶中,加入4-(3-溴丙烷基)-2h-苯并吡喃-2-酮(15.89mmol)溶解于30ml乙腈中,再向其中加入n-boc哌嗪(23.84mmol)、碳酸钾(15.89mmol)和碘化钾(1.59mmol),在75℃条件下回流反应16h,tlc跟踪反应完成情况。反应完成后,在45℃下通过旋转蒸发浓缩反应物,加入90ml重蒸水,用40ml乙酸乙酯萃取两次,合并有机相,然后用50ml饱和nacl溶液洗涤两次,有机相用无水naso4干燥。最后,在45℃下用旋转蒸发仪浓缩,经柱层析(洗脱剂(v/v):dcm/meoh=20/1)纯化分离后得到叔丁基4-(3-((2-氧代-2h-苯并吡喃-4-基)氧)丙基)哌嗪-1-羧酸叔丁酯,白色固体,产率70.0%,m.p.94-94℃;1h nmr(400mhz,cdcl3)δ7.77(d,j=7.9hz,1h,2h-chromen-2-one-5-h),7.59
–
7.44(m,1h,2h-chromen-2-one-7-h),7.25(dd,j=18.9,8.3hz,2h,2h-chromen-2-one-6-h 2h-chromen-2-one-8-h),5.67(s,1h,2h-chromen-2-one-3-h),4.18(t,j=6.2hz,2h,o-ch
2-ch
2-ch
2-n),3.49
–
3.33(m,4h,tert-butyl piperazine-1-carboxylate-2-h tert-butyl piperazine-1-carboxylate-6-h),2.54(t,j=7.1hz,2h,o-ch
2-ch
2-ch
2-n),2.48
–
2.29(m,4h,tert-butyl piperazine-1-carboxylate-3-h tert-butyl piperazine-1-carboxylate-5-h),2.11
–
2.02(m,2h,o-ch
2-ch
2-ch
2-n),1.43(s,9h,-oc(ch3)3);
13
c nmr(101mhz,cdcl3)δ165.6,162.9,154.7,153.3,132.4,123.9,122.9,116.8,115.7,90.5,79.7,67.5,54.72,53.1,28.4,26.0;hrms(esi)[m h]
calcd for c
21h28
n2o5:411.1890,found:411.1899.
[0063]
实施例1-3:4-(3-(哌嗪-1-基)丙氧基)-2h-苯并吡喃-2-酮的制备
[0064][0065]
叔丁基4-(3-((2-氧代-2h-苯并吡喃-4-基)氧)丙基)哌嗪-1-羧酸叔丁酯溶于10ml二氯甲烷,再向其中加入1ml三氟乙酸,室温搅拌反应2h。旋蒸去除溶剂后,得到4-(3-(哌嗪-1-基)丙氧基)-2h-苯并吡喃-2-酮,直接进行下一步实验。
[0066]
实施例1-4:4-(3-(4-(2-羟基-取代基)哌嗪-1-基)丙氧基)-2h-苯并吡喃-2-酮的
制备
[0067][0068]
将1.0mmol的4-(3-(哌嗪-1-基)丙氧基)-2h-苯并吡喃-2-酮和1mmol的碳酸钾加入到含有5ml异丙醇的圆底烧瓶中,室温搅拌至中间体完全溶解,然后滴加2.0mmol的氧化苯乙烯,加热至60℃反应16h后,停止反应,乙酸乙酯萃取,柱层析,得到4-(3-(4-(2-羟基-取代基)哌嗪-1-基)丙氧基)-2h-苯并吡喃-2-酮,收率66.5%。
[0069]
实施例2-1:叔丁基4-(2-氧代-2h-苯并吡喃-3-羰基)哌嗪-1-羧酸叔丁酯的制备
[0070][0071]
在100ml圆底烧瓶中,加入香豆素-3-羧酸(15.78mmol)、edci(18.93mmol)、hobt(15.78mmol)和n,n-二异丙基乙胺(31.55mmol)溶解于30ml二氯甲烷中,在0℃条件下搅拌0.5h。向上述体系中加入2ml二氯甲烷溶解的n-boc哌嗪(15.78mmol),室温搅拌反应16h,tlc跟踪反应完成情况。反应完成后,在45℃下通过旋转蒸发浓缩反应物,用饱和nacl(3
×
50ml)和乙酸乙酯(30ml)萃取,合并有机相,有机相用无水naso4干燥。最后,在45℃下用旋转蒸发仪浓缩,经柱层析(洗脱剂(v/v):pe/ea=1/1)纯化分离后得到叔丁基4-(2-氧代-2h-苯并吡喃-3-羰基)哌嗪-1-羧酸叔丁酯,黄色固体,产率83.8%,m.p.94-94℃;1h nmr(400mhz,cdcl3)δ7.94(s,1h,2h-chromen-2-one-4-h),7.63
–
7.57(m,1h,2h-chromen-2-one-5-h),7.54(m,1h,2h-chromen-2-one-7-h),7.33(m,2h,2h-chromen-2-one-6-h 2h-chromen-2-one-8-h),3.73(s,2h,tert-butyl piperazine-1-carboxylate-6-h),3.60
–
3.51(m,2h,tert-butyl piperazine-1-carboxylate-2-h),3.51
–
3.45(m,2h,tert-butyl piperazine-1-carboxylate-5-h),3.35(d,j=4.8hz,2h,tert-butyl piperazine-1-carboxylate-3-h),1.46(s,9h,-oc(ch3)3);
13
c nmr(101mhz,cdcl3)δ163.8,158.1,154.6,154.3,143.8,133.2,128.7,125.1,125.0,118.4,116.9,80.5,47.2,42.3,28.5;hrms(esi)[m h]
calcd for c
19h22
n2o5:359.1602,found:359.2323.
[0072]
实施例2-2:3-(哌嗪-1-羰基)-2h-苯并吡喃-2-酮的制备
[0073][0074]
叔丁基4-(2-氧代-2h-苯并吡喃-3-羰基)哌嗪-1-羧酸叔丁酯溶于10ml二氯甲烷,再向其中加入1ml三氟乙酸,室温搅拌反应2h。旋蒸去除溶剂后,得到3-(哌嗪-1-羰基)-2h-苯并吡喃-2-酮,直接进行下一步实验。
[0075]
实施例2-3:3-(4-(2-羟基-取代基)哌嗪-1-羰基)-2h-苯并吡喃-2-酮的制备
[0076][0077]
将1.0mmol的3-(哌嗪-1-羰基)-2h-苯并吡喃-2-酮和1mmol的碳酸钾加入到含有5ml异丙醇的圆底烧瓶中,室温搅拌至中间体完全溶解,然后滴加2.0mmol的氧化苯乙烯,加热至60℃反应16h后,停止反应,乙酸乙酯萃取,柱层析,得到3-(4-(2-羟基-取代基)哌嗪-1-羰基)-2h-苯并吡喃-2-酮,收率66.5%。
[0078]
合成的含异丙醇胺结构的香豆素类化合物的结构及核磁共振氢谱和碳谱数据如表1所示,物化性质如表2所示。
[0079]
表1化合物的核磁共振氢谱、碳谱数据和高分辨质谱数据
[0080]
[0081]
[0082]
[0083]
[0084]
[0085]
[0086]
[0087]
[0088]
[0089]
[0090]
[0091][0092]
表2目标化合物的理化性质
[0093]
[0094][0095]
药理实施例1:
[0096]
ec
50
(median effective concentration)是评价植物病原菌对化合物敏感性的重要指标,同时也是对目标化合物作用机制研究时,化合物浓度设置的重要参数。在浓度梯度实验中,采用二倍稀释法设定合适的5个浓度,最后将药剂对植物病原菌的抑制率、药剂浓度换算成对数值,通过spss软件回归分析得到毒力曲线,计算出ec
50
。
[0097]
采用浊度法测试目标化合物对植物病原菌的有效中浓度ec
50
,试验对象为水稻白叶枯病菌(xoo)、柑橘溃疡病菌(xac)和水稻细菌性条斑病菌(xoc)。dmso溶解在培养基中作为空白对照。将水稻白叶枯病菌(水稻白叶枯病原菌在m210固体培养基)放到nb培养基中,在28℃、180rpm恒温摇床中振荡培养到对数生长期备用;将柑橘溃疡病菌(在m210固体培养基上)放到nb培养基中;将水稻细菌性条斑病菌(在m210固体培养基上)放到nb培养基中,在28℃、180rpm恒温摇床中振荡培养到对数生长期备用。将药剂(化合物)配置成不同浓度(例:100,50,25,12.5,6.25μg/ml)的含毒nb液体培养基5ml加入到试管中,分别加入40μl含有植病细菌的nb液体培养基,在28-30℃、180rpm恒温摇床中振荡,其中水稻白叶枯病原菌培养48h,柑橘溃疡病菌培养48h,水稻细菌性条斑病菌培养36h。将各个浓度的菌液在酶标仪上测定od
595
值,并且另外测定对应浓度的含毒无菌nb液体培养基的od
595
值。
[0098]
校正od值=含菌培养基od值-无菌培养基od值
[0099]
抑制率%=[(校正后对照培养基菌液od值-校正含毒培养基od值)/
[0100]
校正后对照培养基菌液od值]
×
100
[0101]
本发明实施例辅以说明本发明的技术方案,但实施例的内容并不局限于此,目标化合物实验结果如表3所示。
[0102]
表3含异丙醇胺结构的香豆素化合物对植物病原细菌的ec
50
[0103]
[0104][0105]
从表3中可以看出,在离体试验中,目标化合物对植物致病病原菌(如水稻白叶枯病菌、柑橘溃疡病菌和水稻细菌性条斑病)表现出了良好的抑菌活性。化合物5、6、17和22对水稻白叶枯病菌(xanthomonas oryzae pv.oryzae,xoo)表现出了极好的抑制活性,其ec
50
为6.75-22.1μg/ml;化合物5、6、8、9、14、17和22对柑橘溃疡病菌(xanthomonas axonopodis pv.citri,xac)表现出了极好的抑制活性,其ec50为3.11-14.8μg/ml;化合物5、6、10、17、22和23对猕猴桃溃疡病菌(xanthomonas oryzae pv.oryzicola,xoc)表现出了极好的抑制活性,其ec
50
为8.51-17.3μg/ml.可用于制备抗植物致病病原细菌农药。
[0106]
以上仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
