一种水相中烷烃c(sp3)
–
h官能化启动的多环喹唑啉酮衍生物制备方法
技术领域
1.本发明属于有机合成领域,涉及一种水相中烷烃c(sp3)
–
h官能化启动的多环喹唑啉酮衍生物制备方法。
背景技术:
2.多环喹唑啉酮类化合物的合成是制备具有药物和生物活性的天然产物的核心步骤。此外,该分子骨架本身具有抗抑郁、抗哮喘、抗感染等药用性。通常,多环喹唑啉酮的合成方法有多种,主要包括:1)复芳基叠氮化物的还原环化反应,2)邻氨基苯甲酸的环化反应,3)伯醇的分子内光催化反应,4)n-氰酰胺烯烃的转化反应。但是,该些制备方法有反应条件繁杂、原料制备复杂和反应程序冗长等不足。近期,经烯烃取代喹唑啉酮的直接c-2烷基化反应,独立可构建一系列多环喹唑啉酮,引起了人们的广泛关注。
技术实现要素:
3.本发明目的在于克服现有技术的不足,提供一种高效、经济、环保的水相中烷烃c(sp3)
–
h官能化启动的多环喹唑啉酮衍生物制备方法,该方法为自由基环化反应方法,以喹唑啉酮类化合物与烷烃类化合物为原料,在水相体系中能制备获得高产率的目标产物。
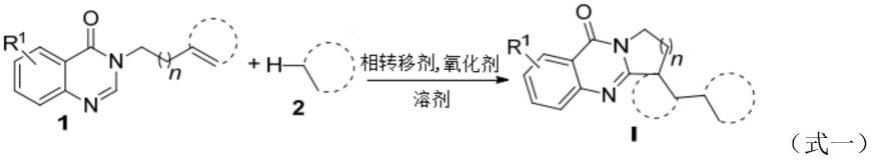
4.为达上述目的,本发明采用的技术方案是:一种水相中烷烃c(sp3)
–
h官能化启动的多环喹唑啉酮衍生物制备方法,该方法是在空气气氛下,将原料式1的喹唑啉酮类化合物和式2的烷烃、相转移剂及氧化剂加入到溶剂中,在一定反应温度下搅拌发生反应,生成式i的多环喹唑啉酮衍生物,反应式如下:
[0005][0006]
其中,式1中r1选自氢、c
1-c6的烷基、卤素或甲氧基;n=1,2或3;不饱和键部分为烯烃或芳烃;式2中选自c
5-c
14
的烷基。
[0007]
较佳的,所述式1中r1选自氢、氯、溴、甲基或甲氧基;不饱和键部分为烯烃或苯基。所述式2的烷烃选自环戊烷、环己烷、甲基环己烷、环庚烷、环辛烷、环十二烷、金刚烷或正己烷。
[0008]
较佳的,氧化剂选自过氧化二苯甲酰(bpo)、过氧化二叔丁基(dtbp)或过氧化叔丁醇(tbhp)中的一种或几种混合,优选为过氧化二叔丁基。相转移剂选自十二烷基磺酸钠(sds)、四丁基碘化铵或18-冠-6中的一种或几种混合,优选为十二烷基磺酸钠。溶剂为水与烷烃混合。
[0009]
较佳的,反应温度为85-95℃。反应初始时,喹唑啉酮类化合物用量为0.2mmol,氧化剂用量为0.4mmol,相转移剂用量为0.04mmol,水/烷烃为1.5ml/0.5ml-1.9ml/0.1ml。
[0010]
本发明提出关于烷烃的c(sp3)
–
h官能团化生成烷基自由基,再经烯烃取代喹唑啉酮的自由基环化有效合成有价值的多环喹唑啉酮的新方法。该方法在水相无金属体系中以较高产率制备获得一系列的目标产物,具有反应底物适应范围广泛、绿色、高效的优点,特别适合于工业化生产。
具体实施方式
[0011]
以下结合具体实施例,对本发明进行进一步详细的描述,但本发明并不局限于此。
[0012]
下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和原料,如无特殊说明,均可以从商业途径获得和/或根据已知的方法制备获得。
[0013]
实施例1-10为反应条件优化实验。
[0014]
实施例1
[0015][0016]
向schlenk反应瓶中加入式1a所示的喹唑啉酮类化合物40.0mg(0.2mmol)、式2a所示的环己烷0.2ml、过氧化二叔丁基58.5mg(2.0equiv)、十二烷基磺酸钠11.5mg(0.2equiv)及水1.8ml,然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1)得到目标产物(收率87%),产物结构式见式i-1,表征数据为:1h nmr(400mhz,cdcl3)δ:8.28(d,j=7.6hz,1h),7.74-7.68(m,2h),7.46-7.42(m,1h),4.31-4.25(m,1h),4.03-3.96(m,1h),3.36-3.30(m,1h),2.50-2.42(m,1h),2.10-2.02(m,1h),1.93-1.85(m,2h),1.75-1.64(m,4h),1.47(t,j=9.2hz,2h),1.30-1.21(m,3h),1.09-0.98(m,2h);
13
c nmr(100mhz,cdcl3)δ:162.4,161.1,149.3,134.0,127.0,126.3,126.1,120.7,44.7,41.4,39.7,35.5,34.4,32.0,26.7,26.5,26.4,26.2;hrms m/z(esi)calcd for c
18h23
n2o([m h]
)283.1805,found 283.1801。
[0017]
实施例2
[0018]
氧化剂用过氧化叔丁醇(tbhp)代替过氧化二叔丁基(dtbp),其余条件同实施例1,得到目标产物i-1的收率为71%。
[0019]
实施例3
[0020]
氧化剂用过氧化苯甲酰(bpo)代替二叔丁基过氧化氢(dtbp),其余条件同实施例1,得到目标产物i-1的收率为58%。
[0021]
实施例4
[0022]
氧化剂用过硫酸钾(k2s2o8)代替二叔丁基过氧化氢(dtbp),其余条件同实施例1,得不到目标产物i-1。
[0023]
实施例5
[0024]
氧化剂二叔丁基过氧化氢(dtbp)的用量为3.0当量,其余条件同实施例1,得到目标产物i-1的收率为86%。
[0025]
实施例6
[0026]
水和环己烷的用量为1.5ml/0.5ml,其余条件同实施例1,得到目标产物i-1的收率为86%。
[0027]
实施例7
[0028]
水和环己烷的用量为1.9ml/0.1ml,其余条件同实施例1,得到目标产物i-1的收率为30%。
[0029]
实施例8
[0030]
相转移剂用18-冠-6(18-crown-6)代替十二烷基磺酸钠(sds),其余条件同实施例1,得到目标产物i-1的收率为84%。
[0031]
实施例9
[0032]
相转移剂用四丁基碘化铵(tbai)代替十二烷基磺酸钠(sds),其余条件同实施例1,得到目标产物i-1的收率为82%。
[0033]
实施例10
[0034]
反应温度降低到85℃,其余条件同实施例1,得到目标产物i-1的收率为70%。
[0035]
由上述实施例1-10可以看出,最佳的反应条件为实施例1的反应条件,即氧化剂选择为dtbp(2.0equiv),相转移剂选择为sds(0.2equiv),水和烷烃的用量选择1.8ml/0.2ml,反应温度为95℃。在获得最佳反应条件的基础上,本发明进一步在该最佳反应条件下,选择不同取代基的喹唑啉酮类化合物与烷烃类化合物为原料以发展可控自由基环化反应方法。
[0036]
实施例11
[0037][0038]
向schlenk瓶中加入式1a所示的喹唑啉酮类化合物40.0mg(0.2mmol)、式2b所示的甲基环己烷0.2ml、过氧化二叔丁基58.5mg(2.0equiv)、十二烷基磺酸钠11.5mg(0.2equiv)及水1.8ml,然后将反应瓶在95℃条件下搅拌,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(76%yield,d.r.》20:1),产物结构式见式i-2,表征数据为:1h nmr(500mhz,cdcl3)δ:8.28(d,j=8.0hz,1h),7.73-7.68(m,2h),7.44-7.41(m,1h),4.33-4.27(m,1h),3.98-3.89(m,1h),3.27-3.22(m,1h),2.58-2.48(m,2h),1.99-1.90(m,2h),1.74-1.70(m,3h),1.53-1.46(m,4h),1.07(s,3h),1.02-0.99(m,1h);
13
c nmr(125mhz,cdcl3)δ:162.4,161.1,149.4,133.9,127.1,126.3,126.0,120.7,44.8,44.4,42.2,41.7,40.2,40.0,29.2,25.8,24.5,23.8;hrms m/z(esi)calcd for c
18h23
n2o([m h]
)283.1805,found 283.1809。
[0039]
实施例12
[0040][0041]
向schlenk瓶中加入式1a所示的喹唑啉酮类化合物40.0mg(0.2mmol)、式2c所示的环庚烷0.2ml、过氧化二叔丁基58.5mg(2.0equiv)、十二烷基磺酸钠11.5mg(0.2equiv)及水1.8ml,然后将反应瓶在95℃条件下搅拌,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(收率81%),目标产物结构式见式i-3,表征数据为:1h nmr(400mhz,cdcl3)δ:8.33-8.27(m,1h),7.76-7.68(m,2h),7.46-7.42(m,1h),4.31-4.25(m,1h),4.03-3.98(m,1h),3.33-3.25(m,1h),2.50-2.41(m,1h),2.15-2.08(m,1h),1.93-1.88(m,1h),1.76-1.63(m,8h),1.60-1.51(m,4h),1.49-1.46(m,2h);
13
c nmr(100mhz,cdcl3)δ:162.3,161.1,149.4,134.0,127.0,126.3,126.1,120.7,44.7,42.0,40.3,36.9,35.8,32.9,28.6,28.5,26.7,26.4,26.2;hrms m/z(esi)calcd for c
19h25
n2o([m h]
)297.1961,found 297.1955。
[0042]
实施例13
[0043][0044]
向schlenk瓶中加入式1a所示的喹唑啉酮类化合物40.0mg(0.2mmol)、式2d所示的环辛烷0.2ml、过氧化二叔丁基58.5mg(2.0equiv)、十二烷基磺酸钠11.5mg(0.2equiv)及水1.8ml,然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物,收率77%。产物结构式见式i-4,表征数据为:1hnmr(500mhz,cdcl3)δ:8.28-8.27(m,1h),7.72-7.67(m,2h),7.44-7.41(m,1h),4.29-4.24(m,1h),4.02-3.96(m,1h),3.32-3.26(m,1h),2.48-2.42(m,1h),2.13-2.08(m,1h),1.94-1.86(m,2h),1.75-1.70(m,4h),1.64-1.60(m,3h),1.53-1.37(m,8h);
13
c nmr(125mhz,cdcl3)δ:162.2,161.0,149.4,134.0,127.1,126.3,126.0,120.8,44.7,41.9,40.3,34.8,33.6,30.5,27.4,27.2,26.8,26.3,25.6,25.2;hrms m/z(esi)calcd for c
20h27
n2o([m h]
)311.2118,found 311.2112。
[0045]
实施例14
[0046][0047]
向schlenk瓶中加入式1a所示的喹唑啉酮类化合物40.0mg(0.2mmol)、式2e所示的环十二烷(0.2ml)、过氧化二叔丁基58.5mg(2.0equiv)、十二烷基磺酸钠11.5mg(0.2equiv)
及水1.8ml,然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物,收率为71%。产物结构式见式i-5,表征数据为:1h nmr(400mhz,cdcl3)δ:8.29-8.27(m,1h),7.74-7.67(m,2h),7.45-7.41(m,1h),4.31-4.25(m,1h),4.04-3.96(m,1h),3.35-3.27(m,1h),2.50-2.41(m,1h),2.09-2.02(m,1h),1.91-1.86(m,1h),1.73-1.69(m,1h),1.53-1.48(m,2h),1.45-1.34(m,21h);
13
c nmr(100mhz,cdcl3)δ:162.2,161.1,149.4,134.0,127.1,126.3,126.1,120.7,44.7,41.8,37.6,31.6,29.7,28.6,26.9,24.7(2),24.0,23.9,23.7,23.0,22.9,22.0,21.4;hrms m/z(esi)calcd for c
24h35
n2o([m h]
)367.2744,found 367.2748。
[0048]
实施例15
[0049][0050]
向schlenk瓶中加入式1a所示的喹唑啉酮类化合物40.0mg(0.2mmol)、式2f所示的金刚烷(0.2ml)、过氧化二叔丁基58.5mg(2.0equiv)、十二烷基磺酸钠11.5mg(0.2equiv)及水1.8ml,然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(52%yield),产物结构式见式i-6,表征数据为:1h nmr(500mhz,cdcl3)δ:8.27(d,j=8.0hz,1h),7.72-7.68(m,2h),7.44-7.40(m,1h),4.30-4.26(m,1h),3.96-3.90(m,1h),3.29-3.23(m,1h),2.60-2.54(m,1h),2.22-2.19(m,1h),2.03-2.00(m,3h),1.91-1.87(m,1h),1.77-1.71(m,3h),1.69-1.60(m,8h),1.38-1.26(m,2h);
13
c nmr(125mhz,cdcl3)δ:162.7,161.1,149.5,133.9,127.1,126.3,126.0,120.6,47.1,45.4,44.8,42.9,39.4,37.1,37.0,36.1,32.7,29.8,28.7;hrms m/z(esi)calcd for c
22h27
n2o([m h]
)335.2118,found 335.2112。
[0051]
实施例16
[0052][0053]
向schlenk瓶中加入式1a所示的喹唑啉酮类化合物40.0mg(0.2mmol)、式2g所示的正己烷0.2ml、过氧化二叔丁基58.5mg(2.0equiv)、十二烷基磺酸钠11.5mg(0.2equiv)及水1.8ml,然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(73%yield,d.r.》20:1),产物结构式见式i-7,表征数据为:1h nmr(500mhz,cdcl3)δ:
([m h]
)313.1911,found 313.1913。
[0060]
实施例19
[0061][0062]
向schlenk瓶中加入式1c所示的喹唑啉酮类化合物46.0mg(0.2mmol)、式2a所示的环己烷0.2ml、过氧化二叔丁基58.5mg(2.0equiv)、十二烷基磺酸钠11.5mg(0.2equiv)及水1.8ml,然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(87%yield),产物结构式见式i-10,表征数据为:1h nmr(400mhz,cdcl3)δ:8.17(d,j=8.0hz,1h),7.09(s,1h),7.01(d,j=7.6hz,1h),4.29-4.23(m,1h),4.01-3.94(m,1h),3.91(s,3h),3.35-3.28(m,1h),2.49-2.41(m,1h),2.07-2.01(m,1h),1.93-1.84(m,2h),1.78-1.68(m,4h),1.49-1.43(m,2h),1.31-1.23(m,3h),1.09-0.98(m,2h);
13
c nmr(100mhz,cdcl3)δ:164.4,163.1,160.7,151.7,127.8,116.3,114.3,107.7,55.6,44.7,41.5,39.7,35.5,34.4,32.0,26.7,26.5,26.4,26.2;hrms m/z(esi)calcd for c
19h25
n2o2([m h]
)313.1911,found 313.1904。
[0063]
实施例20
[0064][0065]
向schlenk瓶中加入式1d所示的喹唑啉酮类化合物(42.8mg,0.2mmol)、式2a所示的环己烷(0.2ml)、过氧化二叔丁基(dtbp,58.5mg,2.0equiv)、十二烷基磺酸钠(sds,11.5mg,0.2equiv)及水(1.8ml),然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(84%yield),产物结构式见式i-11,表征数据为:1h nmr(400mhz,cdcl3)δ:8.06(s,1h),7.61-7.58(m,1h),7.55-7.51(m,1h),4.26(t,j=9.2hz,1h),4.02-3.95(m,1h),3.32-3.25(m,1h),2.47(s,3h),2.44-2.33(m,1h),2.05(t,j=10.0hz,1h),1.91-1.84(m,2h),1.78-1.68(m,4h),1.50-1.43(m,2h),1.28-1.24(m,3h),1.08-0.98(m,2h);
13
c nmr(100mhz,cdcl3)δ:161.5,161.1,147.3,136.2,135.5,126.8,125.7,120.4,44.7,41.3,39.7,35.5,34.3,32.1,26.8,26.5,26.4,26.2,21.2;hrms m/z(esi)calcd for c
19h25
n2o([m h]
)297.1961,found 297.1955。
[0066]
实施例21
[0067][0068]
向schlenk瓶中加入式1e所示的喹唑啉酮类化合物(42.8mg,0.2mmol)、式2a所示的环己烷(0.2ml)、过氧化二叔丁基(dtbp,58.5mg,2.0equiv)、十二烷基磺酸钠(sds,11.5mg,0.2equiv)及水(1.8ml),然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(86%yield),产物结构式见式i-12,表征数据为:1h nmr(400mhz,cdcl3)δ:8.16(d,j=8.4hz,1h),7.49(s,1h),7.26-7.24(m,1h),4.29-4.23(m,1h),4.02-3.94(m,1h),3.34-3.26(m,1h),2.48(s,3h),2.47-2.40(m,1h),2.08-2.01(m,1h),1.93-1.85(m,2h),1.78-1.68(m,4h),1.49-1.42(m,2h),1.27-1.21(m,3h),1.11-0.98(m,2h);
13
c nmr(100mhz,cdcl3)δ:162.4,161.0,149.5,145.0,127.7,126.8,126.1,118.3,44.7,41.4,39.8,35.5,34.3,32.1,26.7,26.5,26.4,26.2,21.8;hrms m/z(esi)calcd for c
19h25
n2o([m h]
)297.1961,found 297.1953。
[0069]
实施例22
[0070][0071]
向schlenk瓶中加入式1f所示的喹唑啉酮类化合物(46.9mg,0.2mmol)、式2a所示的环己烷(0.2ml)、过氧化二叔丁基(dtbp,58.5mg,2.0equiv)、十二烷基磺酸钠(sds,11.5mg,0.2equiv)及水(1.8ml),然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(75%yield),产物结构式见式i-13,表征数据为:1hnmr(400mhz,cdcl3)δ:8.20(d,j=8.8hz,1h),7.69(d,j=2.0hz,1h),7.39-7.37(m,1h),4.29-4.23(m,1h),4.02-3.95(m,1h),3.35-3.27(m,1h),2.50-2.42(m,1h),2.07-1.99(m,1h),1.92-1.83(m,2h),1.79-1.68(m,4h),1.50-1.42(m,2h),1.25-1.21(m,3h),1.11-0.98(m,2h);
13
c nmr(100mhz,cdcl3)δ:163.7,160.4,150.4,140.2,127.8,126.7(2),119.2,44.8,41.5,39.7,35.4,34.2,32.1,26.7,26.5,26.3,26.2;hrms m/z(esi)calcd for c
18h22
cln2o([m h]
)317.1415,found 317.1417。
[0072]
实施例23
[0073][0074]
向schlenk瓶中加入式1g所示的喹唑啉酮类化合物(55.8mg,0.2mmol)、式2a所示的环己烷(0.2ml)、过氧化二叔丁基(dtbp,58.5mg,2.0equiv)、十二烷基磺酸钠(sds,11.5mg,0.2equiv)及水(1.8ml),然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(76%yield),产物结构式见式i-14,表征数据为:1h nmr(400mhz,cdcl3)δ:8.11(d,j=8.4hz,1h),7.87(d,j=1.6hz,1h),7.54-7.52(m,1h),4.29-4.22(m,1h),4.01-3.94(m,1h),3.35-3.28(m,1h),2.50-2.42(m,1h),2.06-1.99(m,1h),1.92-1.83(m,2h),1.78-1.68(m,4h),1.49-1.41(m,2h),1.34-1.24(m,3h),1.10-0.95(m,2h);
13
c nmr(100mhz,cdcl3)δ:163.6,160.5,150.4,129.8,129.4,128.7,127.8,119.6,44.8,41.5,39.7,35.4,34.2,32.1,26.7,26.5,26.3,26.2;hrms m/z(esi)calcd for c
18h22
brn2o([m h]
)361.0910,found 361.0902。
[0075]
实施例24
[0076][0077]
向schlenk瓶中加入式1h所示的喹唑啉酮类化合物(42.8mg,0.2mmol)、式2a所示的环己烷(0.2ml)、过氧化二叔丁基(dtbp,58.5mg,2.0equiv)、十二烷基磺酸钠(sds,11.5mg,0.2equiv)及水(1.8ml),然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(74%yield),产物结构式见式i-15,表征数据为:1h nmr(400mhz,cdcl3)δ:8.25(d,j=7.6hz,1h),7.73-7.69(m,1h),7.64(d,j=8.0hz,1h),7.43-7.39(m,1h),4.27-4.21(m,1h),3.99-3.92(m,1h),3.04-2.98(m,1h),2.11-1.95(m,4h),1.74-1.62(m,5h),1.54-1.47(m,2h),1.26-1.17(m,4h),1.07-0.97(m,2h);
13
c nmr(100mhz,cdcl3)δ:162.4,158.5,147.5,134.0,126.8,126.5,126.0,120.2,41.8,40.9,37.5,34.8,34.3,32.2,26.6,26.5,26.3,24.5,19.9;hrms m/z(esi)calcd for c
19h25
n2o([m h]
)297.1961,found 297.1955。
[0078]
实施例25
[0079]
[0080]
向schlenk瓶中加入式1j所示的喹唑啉酮类化合物(45.7mg,0.2mmol)、式2a所示的环己烷(0.2ml)、过氧化二叔丁基(dtbp,58.5mg,2.0equiv)、十二烷基磺酸钠(sds,11.5mg,0.2equiv)及水(1.8ml),然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(75%yield),产物结构式见式i-16,表征数据为:1h nmr(500mhz,cdcl3)δ:8.04(s,1h),7.55-7.50(m,2h),4.26-4.21(m,1h),3.97-3.91(m,1h),3.02-2.96(m,1h),2.47(s,3h),2.11-1.87(m,5h),1.77-1.61(m,6h),1.53-1.46(m,2h),1.23-1.16(m,2h),1.06-0.98(m,2h);
13
c nmr(125mhz,cdcl3)δ:162.3,157.6,145.5,136.0,135.5,126.7,125.9,119.9,41.7,40.8,37.5,34.8,34.3,32.2,26.6,26.5,26.3,24.5,21.3,20.0;hrms m/z(esi)calcd for c
20h27
n2o([m h]
)311.2118,found 311.2112。
[0081]
实施例26
[0082][0083]
向schlenk瓶中加入式1k所示的喹唑啉酮类化合物(45.7mg,0.2mmol)、式2a所示的环己烷(0.2ml)过氧化二叔丁基(dtbp,58.5mg,2.0equiv)、十二烷基磺酸钠(sds,11.5mg,0.2equiv)及水(1.8ml),然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(75%yield),产物结构式见式i-17,表征数据为:1h nmr(400mhz,cdcl3)δ:8.13(d,j=8.0hz,1h),7.44(s,1h),7.24-7.22(m,1h),4.26-4.20(m,1h),3.97-3.90(m,1h),3.01-2.96(m,1h),2.48(s,3h),2.10-1.93(m,4h),1.73-1.60(m,6h),1.53-1.46(m,2h),1.26-1.18(m,3h),1.07-0.97(m,2h);
13
c nmr(100mhz,cdcl3)δ:162.3,158.5,147.6,144.8,127.6,126.5,126.4,117.8,41.7,40.8,37.5,34.8,34.3,32.2,26.6,26.5,26.3,24.5,21.8,20.0;hrms m/z(esi)calcd for c
20h27
n2o([m h]
)311.2118,found 311.2114。
[0084]
实施例27
[0085][0086]
向schlenk瓶中加入式1l所示的喹唑啉酮类化合物(49.7mg,0.2mmol)、式2a所示的环己烷(0.2ml)、过氧化二叔丁基(dtbp,58.5mg,2.0equiv)、十二烷基磺酸钠(sds,11.5mg,0.2equiv)及水(1.8ml),然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙
酯/正已烷=7:1),得到目标产物(68%yield),产物结构式见式i-18,表征数据为:1h nmr(500mhz,cdcl3)δ:8.17(d,j=8.5hz,1h),7.64(d,j=2.0hz,1h),7.36-7.34(m,1h),4.25-4.19(m,1h),3.95-3.90(m,1h),3.01-2.96(m,1h),2.11-1.95(m,4h),1.76-1.59(m,6h),1.51-1.45(m,2h),1.29-1.25(m,3h),1.04-0.97(m,2h);
13
c nmr(125mhz,cdcl3)δ:161.7,159.9,148.5,140.1,128.1,126.6,126.4,118.6,41.9,40.8,37.6,34.8,34.2,32.2,26.6,26.4,26.2,24.5,19.9;hrms m/z(esi)calcd for c
19h24
cln2o([m h]
)331.1572,found 331.1576。
[0087]
实施例28
[0088][0089]
向schlenk瓶中加入式1m所示的喹唑啉酮类化合物(45.5mg,0.2mmol)、式2a所示的环己烷(0.2ml)、过氧化二叔丁基(dtbp,58.5mg,2.0equiv)、十二烷基磺酸钠(sds,11.5mg,0.2equiv)和水(1.8ml),然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(60%yield),产物结构式见式i-19,表征数据为:1h nmr(500mhz,cdcl3)δ:8.27-8.25(m,1h),7.72-7.68(m,1h),7.64(d,j=8.0hz,1h),7.42(t,j=7.5hz,1h),5.15-5.11(m,1h),3.78-3.73(m,1h),3.15-3.11(m,1h),2.14-2.10(m,1h),1.97-1.81(m,5h),1.73-1.64(m,5h),1.50-1.42(m,3h),1.22-1.15(m,3h),1.02-0.94(m,2h);
13
c nmr(125mhz,cdcl3)δ:162.3,160.9,147.4,133.9,127.3,126.9,126.2,120.3,41.4,41.3,40.7,35.2,34.0,33.5,32.2,27.8,27.4,26.7,26.4(2);hrms m/z(esi)calcd for c
20h27
n2o([m h]
)311.2118,found 311.2112。
[0090]
实施例29
[0091][0092]
向schlenk瓶中加入式1n所示的喹唑啉酮类化合物(52.5mg,0.2mmol)、式2a所示的环己烷(0.2ml)、过氧化二叔丁基(dtbp,58.5mg,2.0equiv)、十二烷基磺酸钠(sds,11.5mg,0.2equiv)和水(1.8ml),然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(89%yield),结构式见式i-20,表征数据为:1h nmr(500mhz,cdcl3)δ:8.63(d,j=8.0hz,1h),8.44(d,j=7.5hz,1h),7.81-7.76(m,2h),7.53-7.50(m,1h),7.46-7.42(m,1h),7.39-7.33(m,2h),2.31-2.27(m,1h),2.01-1.98(m,1h),1.58(s,3h),1.44-1.34(m,4h),1.07-1.02(m,1h),0.94-0.88(m,3h),0.83-0.76(m,2h),
0.73-0.66(m,1h);
13
c nmr(125mhz,cdcl3)δ:164.2,160.3,147.6,138.9,136.4,134.2,128.3,127.4,126.8,126.6,126.4,122.9,121.3,117.3,48.8,47.3,34.8,34.5,33.5,28.5,26.0,25.9(2);hrms m/z(esi)calcd for c
23h25
n2o([m h]
)345.1961,found 345.1953。
[0093]
实施例30
[0094][0095]
向schlenk瓶中加入式1o所示的喹唑啉酮类化合物(52.5mg,0.2mmol)、式2a所示的环己烷(0.2ml)、过氧化二叔丁基(dtbp,58.5mg,2.0equiv)、十二烷基磺酸钠(sds,11.5mg,0.2equiv)和水(1.8ml),然后将反应瓶在95℃条件下搅拌反应,经tlc监测反应进程至原料消失(反应时间为28小时)。反应停止后,用乙酸乙酯萃取对反应液进行萃取,用无水硫酸钠干燥有机相,过滤并减压浓缩除溶剂,将残余物经柱层析分离(洗脱溶剂:乙酸乙酯/正已烷=7:1),得到目标产物(87%yield),产物结构式见式i-21,表征数据为:1h nmr(500mhz,cdcl3)δ:8.62(d,j=8.0hz,1h),8.44(d,j=8.0hz,1h),7.81-7.77(m,2h),7.54-7.51(m,1h),7.46-7.43(m,1h),7.39-7.33(m,2h),2.42-2.37(m,1h),2.18-2.15(m,1h),1.62(s,3h),1.37-1.34(m,2h),1.22-1.11(m,5h),0.86-0.81(m,2h);
13
c nmr(125mhz,cdcl3)δ:164.1,160.2,147.6,139.1,136.5,134.3,128.3,127.4,126.8,126.6,126.4,122.9,121.4,117.2,49.4,46.6,37.3,33.8,32.8,27.5,24.8,24.6;hrms m/z(esi)calcd for c
22h23
n2o([m h]
)331.1805,found 331.1801。
[0096]
实施例31反应机理控制实验
[0097][0098]
向实施例1的反应中加入3.0当量的四甲基哌啶氮氧化物(tempo)或2,6-二叔丁基-4-甲基苯酚(bht)作为自由基清除剂,该反应的目标产物收率几乎为0%。控制实验表明该反应确实经过自由基反应过程。
[0099]
由此可知,本发明的反应机理推导如下式所示:
[0100][0101]
以上所述实施例仅为本发明的优选实施例,而并非本发明可行实施的穷举。对于本领域技术人员而言,在不背离本发明原理和精神的前提下,对其所作出的任何显而易见的改动,都应当被认为包含在本发明的权利要求保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
