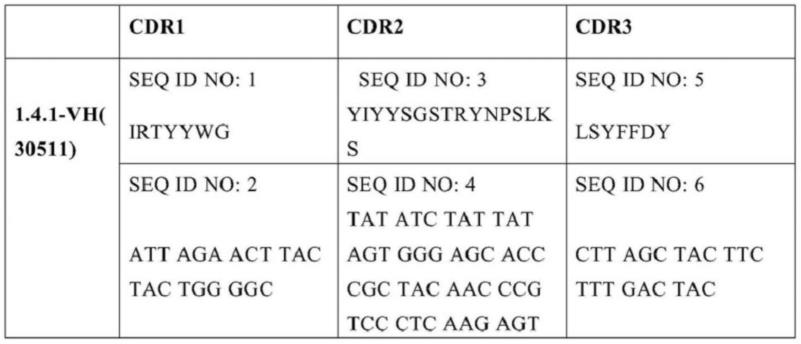
用于痴呆的glp-1受体激动剂
1.本发明涉及用于治疗所有形式和阶段的痴呆的glp-1受体激动剂。
2.背景
3.目前没有可用于积极预防痴呆或减缓痴呆进展的治疗选项,并且在过去20年中没有新的药理学疗法被批准用于治疗痴呆。据世界卫生组织称,全世界约有5000万人患有痴呆,预计到2050年这一数字将增加两倍,而阿尔茨海默病是最常见的痴呆形式,可能占病例的60-70%。迄今为止,大量的工作都未能确定任何预防、延缓或改变痴呆病程的药物治疗,包括最近专注于减少淀粉样蛋白-β的产生或增强其清除的不成功试验。因此,痴呆患者需要改进的药理学疗法。确定glp-1受体激动剂是否对人类痴呆有效果是一个悬而未决的重要问题。
技术实现要素:
4.本发明涉及针对痴呆的改进的药物疗法,其包括施用glp-1受体激动剂。
5.在一些实施方案中,本发明涉及用于治疗痴呆的方法,其中所述方法包括向有需要的受试者施用glp-1受体激动剂,所述受试者患有代谢综合征,并且所述glp-1受体激动剂包括任选地包含一个或多个置换、缺失、添加和/或修饰的glp-1(7-37)(seq id no:1)。
6.在一些实施方案中,本发明涉及用于治疗痴呆的方法,其中所述方法包括向有需要的受试者施用司美格鲁肽(semaglutide)。
附图说明
7.图1显示了在合并的rct中采用glp-1受体激动剂与安慰剂时达到痴呆的时间;在合并的rct中,15名随机接受glp-1受体激动剂的患者(0.66/1000患者-年)和32名随机接受安慰剂的患者(1.41/1000患者-年)发生痴呆。glp-1ra=glp-1受体激动剂。
8.图2显示了全国群组中glp-1受体激动剂和其他二线糖尿病治疗的暴露持续时间每增加1年的痴呆风险比。对每种治疗的暴露实施cox比例风险回归模型。估计值表示暴露持续时间增加1年的风险比。这些模型根据卒中、心肌梗死、高血压史、教育程度和糖尿病病程进行了调整。通过匹配包括性别、年龄和日历日期。
9.图3显示了根据全国群组中的亚组,glp-1受体激动剂的暴露持续时间每增加1年的痴呆风险比。对各个亚组中的glp-1暴露实施cox比例风险回归模型。估计值表示暴露持续时间增加1年的风险比。这些模型根据卒中、心肌梗死、高血压史、教育程度和糖尿病病程进行了调整。通过匹配包括性别、年龄和日历日期。
10.图4显示了全国群组中使用的研究设计。*首次二线糖尿病治疗=首次使用不包括二甲双胍的糖尿病治疗进行的治疗,合格=符合糖尿病患者群组的条件,病例日期=痴呆诊断日期,每个病例与10名无痴呆对照匹配,暴露窗口为病例日期之前的5年窗口,其中评估了累积糖尿病治疗的持续时间。
11.图5a显示了全国群组中glp-1受体激动剂和其他二线糖尿病治疗的暴露持续时间每增加1年的痴呆风险比,其中不包括病例日期前的最近2年。对每种治疗的暴露实施cox比
例风险回归模型。估计值表示暴露持续时间增加1年的风险比。这些模型根据卒中、心肌梗死、高血压史、教育程度和糖尿病病程进行了调整。通过匹配包括性别、年龄和日历日期。
12.图5b显示了全国群组中glp-1受体激动剂和其他二线糖尿病治疗的暴露持续时间每增加1年的痴呆风险比,其中糖尿病病程被定义为“自首次二甲双胍治疗或二线糖尿病治疗起的时间”。对每种治疗的暴露实施cox比例风险回归模型。估计值表示暴露持续时间增加1年的风险比。这些模型根据卒中、心肌梗死、高血压史、教育程度和糖尿病病程进行了调整。通过匹配包括性别、年龄和日历日期。
13.图6a显示了全国群组中在诊断出痴呆前3、5和10年评估的,glp-1受体激动剂的暴露持续时间每增加1年的痴呆风险比。*初步分析。对glp-1受体激动剂的暴露实施cox比例风险回归模型,并在痴呆前的3、5和10年暴露窗口期间进行评估。估计值表示暴露持续时间增加1年的风险比。这些模型根据卒中、心肌梗死、高血压史、教育程度和糖尿病病程进行了调整。通过匹配包括性别、年龄和日历日期。
14.图6b显示了通过匹配对年龄、性别和日历日期进行调整的,全国群组中glp-1受体激动剂的暴露持续时间每增加1年的痴呆风险比。对glp-1受体激动剂的暴露实施cox比例风险回归模型。估计值表示暴露持续时间增加1年的风险比。通过匹配针对性别、年龄和日历日期调整了该模型。
15.图6c显示了全国群组中glp-1受体激动剂的暴露持续时间每增加1年的死亡竞争风险的风险比。对glp-1受体激动剂的暴露实施cox比例风险回归模型。估计值表示暴露持续时间增加1年的风险比。该模型针对卒中、心肌梗死、高血压史、教育程度和糖尿病病程进行了调整。通过匹配包括性别、年龄和日历日期。
16.图7显示了与媒介物相比,司美格鲁肽施用对samp8小鼠的y-迷宫交替(alternation)行为的影响。
17.图8和图9显示了与媒介物相比,在施用司美格鲁肽后samp8小鼠的长期记忆改善,如在步入被动回避测试(step-through passive avoidance test)中所测量的,并呈现了步入潜伏期(图8)和逃避潜伏期(图9)。
18.图10显示了司美格鲁肽在脂多糖(lps)诱发的神经炎症(啮齿动物阿尔茨海默病的非遗传模型)中对海马体中小胶质细胞炎症标志物iba1的影响。
19.描述
20.本发明人惊奇地发现,胰高血糖素样肽1(glp-1)受体激动剂的施用降低了患有代谢综合征的受试者的痴呆风险。此外,发明人惊奇地发现,司美格鲁肽在动物模型中改善了痴呆。
21.在一些实施方案中,本发明涉及用于治疗痴呆的方法,其中所述方法包括向有需要的受试者施用glp-1受体激动剂并且所述受试者患有代谢综合征。在一些实施方案中,本发明涉及用于治疗痴呆的方法,其中所述方法包括向有需要的人类受试者施用glp-1受体激动剂并且所述受试者患有一种或多种选自前驱糖尿病、糖尿病、心血管疾病、肥胖症和高血压的适应症。在一些实施方案中,本发明涉及用于治疗痴呆的方法,其中所述方法包括向有需要的受试者施用司美格鲁肽。
22.在一些实施方案中,本发明涉及用于降低发生痴呆的风险的方法,其中所述方法包括向有需要的受试者施用glp-1受体激动剂并且所述受试者患有代谢综合征。在一些实
施方案中,本发明涉及用于降低发生痴呆的风险的方法,其中所述方法包括向有需要的受试者施用glp-1受体激动剂并且所述受试者患有一种或多种选自前驱糖尿病、糖尿病、心血管疾病、肥胖症和高血压的适应症。在一些实施方案中,本发明涉及用于降低发生痴呆的风险的方法,其中所述方法包括向有需要的受试者施用司美格鲁肽。
23.痴呆的严重程度各有不同。在一些实施方案中,如本文所用的术语“痴呆”是指痴呆疾病连续谱(continuum)的所有形式和阶段。在一些实施方案中,痴呆选自icd-11中定义的适应症:由阿尔茨海默病引起的痴呆;由早发型阿尔茨海默病引起的痴呆;常染色体显性阿尔茨海默病痴呆,早老蛋白1突变;常染色体显性阿尔茨海默病痴呆,早老蛋白2突变;常染色体显性阿尔茨海默病痴呆,淀粉样前体蛋白突变;由迟发型阿尔茨海默病引起的痴呆;阿尔茨海默病痴呆,混合型,伴有脑血管疾病;阿尔茨海默病痴呆,混合型,伴有其他非血管病因;非遗忘性阿尔茨海默病痴呆亚型;非遗忘性阿尔茨海默病痴呆,logopenic变型;非遗忘性阿尔茨海默病,logopenic变型,伴有原发性进行性失语症;非遗忘性阿尔茨海默病痴呆,视觉空间(visuospatial)变型;非遗忘性阿尔茨海默病,视觉空间变型,伴有后皮质萎缩;非遗忘性阿尔茨海默病痴呆,额叶变型;阿尔茨海默病痴呆,伴有精神病;阿尔茨海默病痴呆,伴有抑郁症;由脑血管疾病引起的痴呆;血管性痴呆出血亚型;血管性痴呆缺血亚型;多发性梗死性痴呆;单一关键部位梗死性痴呆;由皮层下血管性脑病引起的痴呆;由缺氧性脑病引起的痴呆;由遗传原因引起的痴呆;由中枢神经系统血管炎引起的痴呆;由高血压性脑病引起的痴呆;由脑内高血压出血引起的痴呆;由脑淀粉样蛋白血管病引起的痴呆;由路易体病引起的痴呆;额颞叶痴呆;额颞叶痴呆,行为变型;额颞叶痴呆,语言变型;额颞叶痴呆,不流利或语法失能(agrammatic)变型;额颞叶痴呆,语义变型;额颞叶痴呆,logopenic变型;额颞叶痴呆,伴有运动神经元疾病;额颞叶痴呆,伴有家族性包涵体肌病和佩吉特骨病;由遗传突变引起的额颞叶痴呆;由c9orf72突变引起的额颞叶痴呆;由mapt突变引起的额颞叶痴呆;由vcp突变引起的额颞叶痴呆;由grn突变引起的额颞叶痴呆;由chmp2b突变引起的额颞叶痴呆;由fus突变引起的额颞叶痴呆;由tardbp突变引起的额颞叶痴呆;由其他突变或新突变引起的额颞叶痴呆;由包括药物在内的精神活性物质引起的痴呆;由酗酒引起的痴呆;由使用镇静剂、催眠药或抗焦虑药引起的痴呆;致幻后知觉障碍;由使用挥发性吸入剂引起的痴呆;辐射后痴呆;由一氧化碳中毒引起的痴呆;由药物中毒引起的痴呆;由锰中毒引起的痴呆或帕金森症;由其他分类的疾病引起的痴呆;由某些特定中枢神经系统退行性疾病引起的痴呆;由帕金森病引起的痴呆;由亨廷顿病引起的痴呆;由皮质基底节变性引起的痴呆;由进行性核上麻痹引起的痴呆;由神经丝包涵体病引起的痴呆;由进行性皮质下胶质增生引起的痴呆;由多系统萎缩引起的痴呆;由脊髓小脑性共济失调引起的痴呆;由伴有脑铁积累的神经退行性变引起的痴呆;由脑白质营养不良引起的痴呆;由关岛帕金森-痴呆综合征引起的痴呆;由某些特定感染性疾病引起的痴呆;由人类免疫缺陷病毒引起的痴呆;由神经梅毒引起的痴呆;由疱疹性脑炎引起的痴呆;由锥虫病引起的痴呆;由神经囊虫病引起的痴呆;由莱姆病引起的痴呆;由惠普尔病引起的痴呆;由进行性多灶性白质脑病引起的痴呆;某些特定的原发性退行性痴呆;神经原纤维缠结性痴呆;家族性多系统tau蛋白病;嗜银颗粒病;由某些特定中枢神经系统紊乱引起的痴呆;由多发性硬化引起的痴呆;由朊病毒病引起的痴呆;由散发性克雅氏病引起的痴呆;由变异型克雅氏病引起的痴呆;由家族性克雅氏病引起的痴呆;由医源性克雅氏病引起的痴呆;由散发性致死性失眠症
引起的痴呆;由致死性家族性失眠引起的痴呆;由gerstmann-straussler-scheinker综合征引起的痴呆;由库鲁病(kuru)引起的痴呆;由急性脱髓鞘性脑脊髓炎引起的痴呆;由亚急性硬化性全脑炎引起的痴呆;由桥本脑病引起的痴呆;由副肿瘤性脑炎引起的痴呆;由自身免疫性脑炎引起的痴呆;由原发性中枢神经系统肿瘤引起的痴呆;由转移性脑瘤引起的痴呆;由癫痫引起的痴呆;由正常压力脑积水引起的痴呆;由涉及大脑的代谢紊乱引起的痴呆;由头部受伤引起的痴呆;由慢性硬膜下血肿引起的痴呆;由阻塞性脑积水引起的痴呆;由暴露于重金属和其他毒素引起的痴呆;由营养缺乏引起的痴呆;由硫胺素缺乏引起的痴呆;由维生素b12缺乏引起的痴呆;由叶酸缺乏引起的痴呆;由维生素e缺乏引起的痴呆;由缺铁引起的痴呆;由其他营养缺乏引起的痴呆;由糙皮病引起的痴呆;由代谢异常引起的痴呆;由高钙血症引起的痴呆;由获得性甲状腺功能减退症引起的痴呆;由威尔逊病引起的痴呆;由透析引起的痴呆;由肝功能衰竭引起的痴呆;由肾功能衰竭引起的痴呆;由染色体异常引起的痴呆;由唐氏综合征引起的痴呆;由脆性x染色体综合征引起的痴呆;由风湿病引起的痴呆;由结节性多发性动脉炎引起的痴呆;由系统性红斑狼疮引起的痴呆;由白塞病引起的痴呆;由某些特定原因引起的痴呆;痴呆的行为或心理障碍;痴呆的精神病症状;痴呆的情绪症状;痴呆的焦虑症状;痴呆的冷漠;痴呆的激动或攻击性;痴呆的去抑制;痴呆的游荡(wandering);终末期痴呆;退行性痴呆;早老性精神病性精神障碍;妄想型痴呆;未明确分型的早老性痴呆;老年性痴呆;和老年痴呆。在一些实施方案中,痴呆选自轻度认知障碍、阿尔茨海默病、混合型痴呆、血管性痴呆、伴有路易体病的痴呆、额颞叶痴呆、早老性痴呆和老年性痴呆。在一些实施方案中,痴呆是伴有轻度认知障碍或轻度痴呆的阿尔茨海默连续谱。在一些实施方案中,痴呆是轻度认知障碍,如阿尔茨海默类型的轻度认知障碍。在一些实施方案中,痴呆是阿尔茨海默病,如临床前阿尔茨海默病、阿尔茨海默类型的轻度认知障碍、早发型家族性阿尔茨海默病或前驱阿尔茨海默病。在一些实施方案中,痴呆是阿尔茨海默类型的轻度认知障碍。在一些实施方案中,痴呆是混合型痴呆。在一些实施方案中,痴呆是血管性痴呆。在一些实施方案中,痴呆是伴有路易体病的痴呆。在一些实施方案中,痴呆是额颞叶痴呆。在一些实施方案中,痴呆是早老性痴呆。在一些实施方案中,痴呆是老年性痴呆。
24.在一些实施方案中,如本文所用的术语“治疗”包括针对所提及的医学适应症的预防、延迟、降低发生风险、改善或治愈性治疗。治疗可以是对症治疗或改善疾病的治疗。在一些实施方案中,如本文所用的术语治疗是指预防所提及的医学适应症。在一些实施方案中,如本文所用的术语治疗是指延迟(例如延迟发作)所提及的医学适应症。在一些实施方案中,如本文所用的术语治疗是指降低发生所提及的医学适应症的风险。在一些实施方案中,如本文所用的术语治疗是指改善所提及的医学适应症。在一些实施方案中,如本文所用的术语治疗是指治愈性地治疗所提及的医学适应症。
25.亚群
26.根据本发明待施用glp-1受体激动剂的受试者可以是人,例如成年人(也称为成人)。在一些实施方案中,受试者患有代谢综合征。如本文所用的,术语“代谢综合征”是指选自前驱糖尿病、糖尿病、心血管疾病、肥胖症和高血压的一种或多种适应症。在一些实施方案中,“代谢综合征”是指选自前驱糖尿病、糖尿病、心血管疾病、肥胖症和高血压的至少两种适应症。在一些实施方案中,“代谢综合征”是指选自前驱糖尿病、糖尿病、心血管疾病、肥
胖症和高血压的至少三种适应症。在一些实施方案中,受试者患有前驱糖尿病。在一些实施方案中,受试者患有糖尿病。在一些实施方案中,糖尿病是2型糖尿病。在一些实施方案中,受试者患有肥胖症。在一些实施方案中,受试者患有心血管疾病。在一些实施方案中,受试者患有肥胖症。在一些实施方案中,肥胖症是bmi至少为25kg/m2,例如至少27kg/m2或至少30kg/m2。在一些实施方案中,受试者患有高血压。在一些实施方案中,心血管疾病包括冠状动脉疾病(如心绞痛和心肌梗死)、卒中、心力衰竭、高血压性心脏病、风湿性心脏病、心肌病、心律失常、先天性心脏病、瓣膜性心脏病、心脏炎、主动脉瘤、外周动脉疾病、血栓栓塞性疾病和静脉血栓形成中的一种或多种。在一些实施方案中,受试者先前已施用胰岛素。
27.glp-1受体激动剂
28.如本文所用的术语“glp-1受体激动剂”是指完全或部分激活人glp-1受体的化合物。在一些实施方案中,用于本发明的glp-1受体激动剂是酰化glp-1受体激动剂。与glp-1受体激动剂关联使用的术语“酰化”是指该glp-1受体激动剂共价连接有至少一个包含亲脂性部分如脂肪酸或脂肪二酸的取代基。在一些实施方案中,该取代基包含脂肪酸或脂肪二酸。在一些实施方案中,术语glp-1受体激动剂以及本文描述的具体glp-1受体激动剂还涵盖其盐形式。
29.因此,glp-1受体激动剂应表现出“glp-1活性”,glp-1活性是指该化合物(即glp-1受体激动剂)与glp-1受体结合,并启动信号转导途径,从而导致促胰岛素作用或其他本领域已知的生理效应的能力。在一些实施方案中,如通过本领域已知的方法所测量的(参见例如wo98/08871),“glp-1受体激动剂”例如以亲和常数(kd)结合glp-1受体,或以低于1μm,例如低于100nm的效力(ec
50
)激活该受体,并且表现出促胰岛素活性,其中促胰岛素活性可以通过本领域普通技术人员已知的体内或体外测定来测量。例如,可以将glp-1受体激动剂施用于血糖升高的动物(例如,使用静脉葡萄糖耐量试验(ivgtt)获得的。本领域技术人员将能够确定合适的葡萄糖剂量和合适的血液采样方案,例如,根据动物的物种,对于ivgtt),并随时间测量血浆胰岛素浓度。合适的测定已经在诸如wo2015/155151中描述。
30.术语半数最大有效浓度(ec
50
)通常是指参照剂量响应曲线,诱导基线与最大值之间的一半的响应的浓度。ec
50
用作化合物效力的量度,并且是观察到其最大效应的50%时的浓度。由于本文所述的包含取代基的glp-1受体激动剂的白蛋白结合作用,因此重要的是要注意该测定是否包括人血清白蛋白。
31.可以如wo2015/155151的实施例29(无人血清白蛋白(hsa))所述确定glp-1受体激动剂的体外效力,并确定ec
50
。ec
50
值越低,效力越好。在一些实施方案中,确定的效力(ec
50
)(无hsa)为5-1000pm,如10-750pm、10-500pm或10-200pm。在一些实施方案中,ec
50
(无hsa)至多为500pm,如至多300pm,如至多200pm。在一些实施方案中,ec
50
(无hsa)与人glp-1(7-37)相当。在一些实施方案中,ec
50
(无hsa)至多为50pm。在另一个这样的实施方案中,ec
50
至多为40pm,如至多30pm,如至多20pm,如至多10pm。在一些实施方案中,ec
50
约为10pm。
32.另外,或备选地,可以使用wo2015/155151中实施例29的包括hsa的体外效力测定来测量glp-1受体激动剂与白蛋白的结合。在血清白蛋白的存在下体外效力ec
50
值的增加反映了对血清白蛋白的亲和力。在一些实施方案中,确定的效力(ec
50
)(有1%hsa)为5-1000pm,如100-750pm、200-500pm或100-400pm。在一些实施方案中,ec
50
(有1%hsa)为至多750pm,如至多500pm,如至多400pm,如至多300pm,或如至多250pm。
33.如果需要,相对于已知glp-1受体激动剂的变化倍数可以被计算为ec
50
(测试化合物)/ec
50
(已知化合物),并且如果该比值为例如0.5-1.5或0.8-1.2,则效力被认为是等同的。在一些实施方案中,效力——ec
50
(无hsa),等于利拉鲁肽的效力。在一些实施方案中,效力——ec
50
(无hsa),等于司美格鲁肽的效力。在一些实施方案中,效力——ec
50
(有1%hsa),等于利拉鲁肽的效力。在一些实施方案中,效力——ec
50
(有1%hsa),等于司美格鲁肽的效力。
34.在一些实施方案中,所述glp-1受体激动剂包含一个或多个置换、缺失、添加和/或修饰。在一些实施方案中,修饰是共价连接的取代基。在一些实施方案中,所述glp-1受体激动剂包含作为人glp-1(glp-1(7-37))或其变体的肽。人glp-1,在本文中也称为“glp-1(7-37)”,具有序列haegtftsdv ssylegqaakefiawlvkgrg(seq id no:1)。在一些实施方案中,术语“变体”是指包含一个或多个氨基酸置换、缺失、添加和/或修饰的化合物。氨基酸残基的这种添加或缺失可以发生在该肽的n末端和/或该肽的c末端。在一些实施方案中,使用简单的命名法描述glp-1受体激动剂,例如,[aib8]glp-1(7-37)表示glp-1(7-37)受体激动剂,其中位置8的天然存在的ala已被aib置换。在一些实施方案中,与glp-1(7-37)(seq id no:1)相比,glp-1受体激动剂有最多12个氨基酸已经例如通过置换、缺失、插入和/或修饰而改变。在一些实施方案中,与glp-1(7-37)(seq id no:1)相比,glp-1受体激动剂有最多10个氨基酸已经例如通过置换、缺失、插入和/或修饰而改变。在一些实施方案中,与glp-1(7-37)(seq id no:1)相比,glp-1受体激动剂有最多9个氨基酸已经例如通过置换、缺失、插入和/或修饰而改变。在一些实施方案中,与glp-1(7-37)(seq id no:1)相比,glp-1受体激动剂有最多8个氨基酸已经例如通过置换、缺失、插入和/或修饰而改变。在一些实施方案中,与glp-1(7-37)(seq id no:1)相比,glp-1受体激动剂有最多7个氨基酸已经例如通过置换、缺失、插入和/或修饰而改变。在一些实施方案中,与glp-1(7-37)(seq id no:1)相比,glp-1受体激动剂有最多6个氨基酸已经例如通过置换、缺失、插入和/或修饰而改变。在一些实施方案中,与glp-1(7-37)(seq id no:1)相比,glp-1受体激动剂有最多5个氨基酸已经例如通过置换、缺失、插入和/或修饰而改变。在一些实施方案中,与glp-1(7-37)(seq id no:1)相比,glp-1受体激动剂有最多4个氨基酸已经例如通过置换、缺失、插入和/或修饰而改变。在一些实施方案中,与glp-1(7-37)(seq id no:1)相比,glp-1受体激动剂有最多3个氨基酸已经例如通过置换、缺失、插入和/或修饰而改变。在一些实施方案中,与glp-1(7-37)(seq id no:1)相比,glp-1受体激动剂有最多2个氨基酸已经例如通过置换、缺失、插入和/或修饰而改变。除非另有说明,否则所述glp-1仅包含l-氨基酸。
[0035]
在一些实施方案中,所述glp-1受体激动剂在glp-1(7-37)的整个长度上表现出至少60%、65%、70%、80%或90%的与glp-1(7-37)的序列同一性。作为确定两种化合物之间序列同一性的方法的实例,比对[aib8]glp-1(7-37)和glp-1(7-37)这两种肽。[aib8]glp-1(7-37)相对于glp-1(7-37)的序列同一性通过将比对的同等残基数目减去不同残基的数目再除以glp-1(7-37)中的残基总数而得出。因此,在所述实例中,序列同一性为(31-1)/31。
[0036]
在一些实施方案中,所述glp-1受体激动剂的c末端是酰胺。在一些实施方案中,所述glp-1受体激动剂是glp-1(7-37)或glp-1(7-36)酰胺。
[0037]
为了延长glp-1受体激动剂的作用,优选glp-1受体激动剂具有延长的半衰期。半衰期可以通过本领域已知的方法在合适的模型中确定,例如在wo2012/140117中描述的雄
性sprague dawley大鼠或小型猪中确定。在大鼠中的半衰期可以如实施例39中那样确定,而在小型猪中的半衰期可以如其中的实施例37中那样确定。
[0038]
在一些实施方案中,根据本发明的glp-1受体激动剂在大鼠中的半衰期超过2小时。在一些实施方案中,根据本发明的glp-1受体激动剂在大鼠中的半衰期超过4小时,如超过6小时,如超过8小时,如超过10小时,如超过12小时,或者例如超过15小时。
[0039]
在一些实施方案中,根据本发明的glp-1受体激动剂在小型猪中的半衰期超过24小时。在一些实施方案中,根据本发明的glp-1受体激动剂在小型猪中的半衰期超过30小时,如超过36小时,如超过42小时,如超过48小时,如超过54小时,或者例如超过60小时。
[0040]
在一些实施方案中,所述glp-1受体激动剂的分子量为至多12 000da,如至多7 500da,如至多5 000da。在一些实施方案中,所述glp-1受体激动剂的摩尔质量为至多10 000g/mol,如至多8 000g/mol,如至多6 000g/mol。
[0041]
在一些实施方案中,所述glp-1受体激动剂包含一个或两个共价连接至肽的取代基,并且其中所述取代基包含亲脂性部分。在一些实施方案中,该取代基包含脂肪酸或脂肪二酸。在一些实施方案中,该取代基包含c16、c18或c20脂肪酸。在一些实施方案中,该取代基包含c16、c18或c20脂肪二酸。
[0042]
在一些实施方案中,所述取代基包含式(x)
[0043]
其中n至少为13,例如n为13、14、15、16、17、18或19。在一些实施方案中,该取代基包含式(x),其中n在13至19的范围内,例如在13至17的范围内。在一些实施方案中,该取代基包含式(x),其中n为13、15或17。在一些实施方案中,该取代基包含式(x),其中n为13。在一些实施方案中,该取代基包含式(x),其中n为15。在一些实施方案中,该取代基包含式(x),其中n为17。在一些实施方案中,该取代基包含式(xia)
[0044]
hooc-(c6h4)-o-(ch2)
m-co-*(xia),其中m为6-14范围内的整数。在一些实施方案中,该取代基包含式(xib)
[0045]
其中羧基在(c6h4)基团的2、3或4位,并且其中m为8-11范围内的整数。在一些实施方案中,该取代基包含式(xia)或式(xib),其中m在6至14的范围内,例如在8至11的范围内。在一些实施方案中,该取代基包含式(xia)或式(xib),其中m为8、10或12。在一些实施方案中,该取代基包含式(xia)或式(xib),其中m为9。在一些实施方案中,该取代基包含式(xia)或式(xib),其中m为11。
[0046]
在一些实施方案中,所述取代基包含位于所述取代基中所述取代基与glp-1受体激动剂中的肽之间的连接点近端的连接体(也称为间隔区)。在一些实施方案中,所述取代基包含位于所述取代基中所述取代基与所述glp-1受体激动剂中的肽之间的连接点近端的连接体。在一些实施方案中,该取代基包含一个或多个8-氨基-3,6-二氧杂辛酸(oeg),如两个oeg。所述一个或多个oeg可以是连接体。
[0047]
在一些实施方案中,所述取代基是[2-(2-{2-[2-(2-{2-[(s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基氨基]乙氧基}乙氧基)乙酰基氨基]乙氧基}乙氧基)乙酰基]。在一些实施方案中,该取代基是[2-(2-{2-[2-(2-{2-[(s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基氨基]乙氧基}乙氧基)乙酰基氨基]乙氧基}乙氧基)乙酰基]。在一些实施方案中,该取代基是[2-(2-{2-[2-(2-{2-[(s)-4-羧基-4-({反式-4-[(19-羧基十九碳酰基氨基)甲基]环己烷羰基}氨基)丁酰基氨基]乙氧基}乙氧基)乙酰基氨基]乙氧基}乙氧基)乙酰基]。在一些实施方案中,该取代基是{2-[2-(2-{2-[2-(2-{(s)-4-羧基-4-[10-(4-羧基苯氧基)癸酰基氨基]丁酰基氨基}-乙氧基)乙氧基]乙酰基氨基}乙氧基)乙氧基]乙酰基}。在一些实施方案中,该取代基是{2-[2-(2-{2-[2-(2-{(s)-4-羧基-4-[10-(4-羧基苯氧基)癸酰基氨基]丁酰基氨基}乙氧基)乙氧基]乙酰基氨基}乙氧基)乙氧基]-乙酰基}。在一些实施方案中,该取代基是[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-[10-(4-羧基苯氧基)癸酰基氨基]-丁酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]乙氧基]乙氧基]乙酰基]。
[0048]
在一些实施方案中,所述取代基包含血清白蛋白,如人血清白蛋白。在一些实施方案中,所述取代基包含免疫球蛋白结构域或片段,如fc结构域或修饰的igg4 fc结构域。
[0049]
在一些实施方案中,所述glp-1受体激动剂选自利拉鲁肽、司美格鲁肽、化合物a和化合物b。在一些实施方案中,该glp-1受体激动剂是利拉鲁肽。利拉鲁肽是glp-1受体激动剂arg34,lys26-(n-epsilon-(gamma-l-谷氨酰基(n-alfa-十六碳酰基)))-glp-1(7-37)。利拉鲁肽可以如wo98/08871的实施例37所述制备。在一些实施方案中,该glp-1受体激动剂是司美格鲁肽。司美格鲁肽是glp-1受体激动剂n-epsilon26-[2-(2-{2-[2-(2-{2-[(s)-4-羧基-4-(17-羧基十七碳酰基氨基)丁酰基氨基]乙氧基}乙氧基)乙酰基氨基]乙氧基}乙氧基)乙酰基][aib8,arg34]glp-1-(7-37)。司美格鲁肽可以如wo2006/097537的实施例4所述制备。在一些实施方案中,所述glp-1受体激动剂是化合物a,其为二酰化[aib8,arg34,lys37]glp-1(7-37),如wo2011/080103的实施例2所示,并被命名为n
ε26
{2-[2-(2-{2-[2-(2-{(s)-4-羧基-4-[10-(4-羧基苯氧基)癸酰基氨基]丁酰基氨基}-乙氧基)乙氧基]乙酰基氨基}乙氧基)乙氧基]乙酰基},n
ε37-{2-[2-(2-{2-[2-(2-{(s)-4-羧基-4-[10-(4-羧基苯氧基)癸酰基氨基]丁酰基氨基}乙氧基)乙氧基]乙酰基氨基}乙氧基)乙氧基]-乙酰基}-[aib8,arg
34
,lys
37
]glp-1(7-37)
–
肽。在一些实施方案中,所述glp-1受体激动剂是化合物b,其为二酰化[aib8,glu22,arg26,lys27,glu30,arg34,lys36]-glp-1-(7-37)-肽基-glu-gly,如wo2012/140117的实施例31所示,并被命名为n
ε27-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-[10-(4-羧基苯氧基)癸酰基氨基]丁酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]乙氧基]乙氧基]-乙酰基],n
ε36-[2-[2-[2-[[2-[2-[2-[[(4s)-4-羧基-4-[10-(4-羧基苯氧基)癸酰基氨基]-丁酰基]氨基]乙氧基]乙氧基]乙酰基]氨基]乙氧基]乙氧基]乙酰基]-[aib8,glu22,arg26,lys27,glu30,arg34,lys36]-glp-1-(7-37)-肽基-glu-gly。在一些实施方案中,该glp-1受体激动剂是度拉糖肽或阿比鲁肽。
[0050]
在一些实施方案中,所述glp-1受体激动剂为其药学上可接受的盐、酰胺或酯的形式。在一些实施方案中,所述glp-1受体激动剂包含一种或多种药学上可接受的抗衡离子。
[0051]
药物组合物
[0052]
glp-1受体激动剂可以以药物组合物的形式来施用。该药物组合物可以是液体或固体形式。
[0053]
肠胃外给药
[0054]
所述药物组合物可包含浓度为0.1mg/ml至100mg/ml的glp-1受体激动剂。在一些实施方案中,所述药物组合物包含0.01-50mg/ml,或0.01-20mg/ml,或0.01-10mg/ml的glp-1受体激动剂。在一些实施方案中,所述药物组合物包含0.1-20mg/ml的glp-1受体激动剂。
[0055]
本文所述的药物组合物可以进一步包含一种或多种药学上可接受的辅料,例如选自缓冲体系、防腐剂、张度剂、螯合剂、稳定剂和表面活性剂的辅料。在一些实施方案中,该药物组合物包含一种或多种药学上可接受的辅料,例如选自缓冲液、等渗剂和防腐剂的一种或多种。药物活性成分与各种辅料的配制是本领域已知的,参见例如remington:the science and practice of pharmacy(例如第19版(1995)和任何后续版本)。术语“辅料”泛指除活性治疗成分例如glp-1受体激动剂以外的任何组分。辅料可以是惰性物质、无活性物质和/或非药学活性物质。
[0056]
在一些实施方案中,所述药物组合物的ph在7.0-10.0,如7.0至9.5或7.2至9.5的范围内。在一些实施方案中,所述药物组合物的ph在7.0-8.5,如7.0至7.8或7.8至8.2的范围内。在一些实施方案中,所述药物组合物的ph为7.4。在一些实施方案中,所述药物组合物的ph为8.15。在一些实施方案中,所述药物组合物包含磷酸盐缓冲液,如磷酸钠缓冲液,例如磷酸二钠。在一些实施方案中,所述药物组合物包含等渗剂,如丙二醇。在一些实施方案中,所述药物组合物包含防腐剂,如苯酚。
[0057]
所述药物组合物可以是溶液或悬浮液的形式。在一些实施方案中,所述药物组合物是水性组合物,如水溶液或水性悬浮液。术语“水性组合物”被定义为包含至少50%w/w水的组合物。类似地,术语“水溶液”被定义为包含至少50%w/w水的溶液,而术语“水性悬浮液”被定义为包含至少50%w/w水的悬浮液。水性组合物可包含至少50%w/w的水,或至少60%、70%、80%或甚至至少90%w/w的水。
[0058]
在一些实施方案中,glp-1受体激动剂以药物组合物的形式施用,该药物组合物包含约0.1-20mg/ml的glp-1受体激动剂、约2-15mm磷酸盐缓冲液、约2-25mg/ml的丙二醇,并且ph在7.0-9.0的范围内。在一些实施方案中,glp-1受体激动剂以药物组合物的形式施用,该药物组合物包含约0.1-20mg/ml的glp-1受体激动剂、约2-15mm磷酸盐缓冲液、约2-25mg/ml的丙二醇、约1-18mg/ml的苯酚,并且ph在7.0-9.0的范围内。在一些实施方案中,glp-1受体激动剂(例如司美格鲁肽)以药物组合物的形式施用,该药物组合物包含约1.34mg/ml的glp-1受体激动剂(例如司美格鲁肽)、约1.42mg/ml的磷酸二钠二水合物、约14.0mg/ml的丙二醇、约5.5mg/ml的苯酚,并且ph约为7.4。在一些实施方案中,glp-1受体激动剂(例如司美格鲁肽)以药物组合物的形式施用,该药物组合物包含1.34mg/ml的glp-1受体激动剂、1.42mg/ml的磷酸二钠二水合物、14.0mg/ml的丙二醇、5.5mg/ml的苯酚,并且ph为7.4。在一些实施方案中,glp-1受体激动剂(例如利拉鲁肽)以药物组合物的形式施用,该药物组合物包含glp-1受体激动剂(例如3-8mg/ml)、磷酸二钠二水合物、丙二醇、苯酚,并且ph约为8.0-8.3。在一些实施方案中,glp-1受体激动剂(例如利拉鲁肽)以药物组合物的形式施用,该药物组合物包含glp-1受体激动剂(例如约6.0mg/ml)、磷酸二钠二水合物、丙二醇、苯酚,并且ph约为8.15。
[0059]
口服给药
[0060]
所述固体组合物可以是适合于通过口服途径施用的固体组合物,如本文进一步描
述。在一些实施方案中,该固体组合物包含至少一种药学上可接受的辅料。如本文所用的术语“辅料”泛指除活性治疗成分或活性药物成分(api)外的任何组分。辅料可以是药学惰性物质、无活性物质和/或治疗上或医学上无活性的物质。辅料可用于多种目的,例如作为载体、媒介物、填充剂、粘合剂、润滑剂、助流剂、崩解剂、流动控制剂、结晶抑制剂、增溶剂、稳定剂、着色剂、调味剂、表面活性剂、乳化剂或其组合,并且/或者用于改善治疗活性物质或活性药物成分的给药和/或吸收。所使用的每种辅料的量可以在本领域的常规范围内变化。可用于配制口服剂型的技术和辅料在以下文献中描述:handbook of pharmaceutical excipients,第8版,sheskey等人编,american pharmaceuticals association and the pharmaceutical press,royal pharmaceutical society of great britain出版部(2017);和remington:the science and practice of pharmacy,第22版,remington和allen编,pharmaceutical press(2013)。在一些实施方案中,辅料可以选自粘合剂,如聚乙烯吡咯烷酮(聚维酮)等;填充剂,如纤维素粉末、微晶纤维素、纤维素衍生物,例如羟甲基纤维素、羟乙基纤维素、羟丙基纤维素和羟丙基甲基纤维素,磷酸氢钙、玉米淀粉、预胶化淀粉等;润滑剂和/或助流剂,如硬脂酸、硬脂酸镁、硬脂酰富马酸钠、三山萮酸甘油酯等;流动控制剂,如胶体二氧化硅、滑石等;结晶抑制剂,如聚维酮等;增溶剂,如pluronic、聚维酮等;着色剂,包括染料和颜料,如氧化铁红或氧化铁黄、二氧化钛、滑石等;ph控制剂,如柠檬酸、酒石酸、富马酸、柠檬酸钠、磷酸氢钙、磷酸氢二钠等;表面活性剂和乳化剂,如pluronic、聚乙二醇、羧甲基纤维素钠、聚乙氧基化和氢化蓖麻油等;以及两种或更多种这些辅料和/或佐剂的混合物。
[0061]
所述固体组合物可以包含粘合剂,如聚维酮;淀粉;纤维素及其衍生物,如微晶纤维素,例如来自fmc(philadelphia,pa)的avicel ph、来自dow chemical corp.(midland,mi)的羟丙基纤维素、羟乙基纤维素和羟丙基甲基纤维素methocel;蔗糖;右旋糖;玉米糖浆;多糖;和明胶。粘合剂可以选自干法制粒粘合剂和/或湿法制粒粘合剂。合适的干法制粒粘合剂是,例如,纤维素粉末和微晶纤维素,如avicel ph 102和avicel ph 200。在一些实施方案中,该固体组合物包含avicel,如aavicel ph 102。用于湿法制粒或干法制粒的合适的粘合剂是玉米淀粉、聚乙烯吡咯烷酮(聚维酮)、乙烯基吡咯烷酮-乙酸乙烯酯共聚物(共聚维酮)和纤维素衍生物,如羟甲基纤维素、羟乙基纤维素、羟丙基纤维素和羟丙基甲基纤维素。在一些实施方案中,该固体组合物包含聚维酮。
[0062]
在一些实施方案中,所述固体组合物包含填充剂,该填充剂可以选自乳糖、甘露糖醇、赤藓糖醇、蔗糖、山梨糖醇、磷酸钙如磷酸氢钙、微晶纤维素、粉状纤维素、糖果糖、可压缩糖、葡萄糖结合剂、糊精和右旋糖。在一些实施方案中,该固体组合物包含微晶纤维素,如avicel ph102或avicel ph 200。
[0063]
在一些实施方案中,所述固体组合物包含润滑剂和/或助流剂。在一些实施方案中,该组合物包含润滑剂和/或助流剂,如滑石、硬脂酸镁、硬脂酸钙、硬脂酸锌、山萮酸甘油酯、二山萮酸甘油酯、山萮酰基聚氧乙烯-8甘油酯、聚环氧乙烷聚合物、月桂基硫酸钠、月桂基硫酸镁、油酸钠、硬脂酰富马酸钠、硬脂酸、氢化植物油、二氧化硅和/或聚乙二醇等。在一些实施方案中,该固体组合物包含硬脂酸镁或二山萮酸甘油酯(如产品888ato)。
[0064]
在一些实施方案中,所述固体组合物包含崩解剂,如羟乙酸淀粉钠、波拉克林钾、
羟乙酸淀粉钠、交聚维酮、交联羧甲纤维素、羧甲基纤维素钠或干燥的玉米淀粉。该固体组合物可包含一种或多种表面活性剂,例如一种表面活性剂、至少一种表面活性剂或两种不同的表面活性剂。术语“表面活性剂”是指由水溶性(亲水性)部分与脂溶性(亲脂性)部分组成的任何分子或离子。该表面活性剂例如可选自阴离子型表面活性剂、阳离子型表面活性剂、非离子型表面活性剂和/或两性离子表面活性剂。
[0065]
所述固体组合物可进一步包含递送剂或吸收促进剂,对于本发明,该递送剂或吸收促进剂是能够增加glp-1受体激动剂的口服暴露的辅料。该递送剂可以是n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐(在本文中也称为nac的盐),其含有阴离子n-(8-(2-羟基苯甲酰基)氨基)辛酸根。n-(8-(2-羟基苯甲酰基)氨基)辛酸根的结构式在式(i)中示出。
[0066][0067]
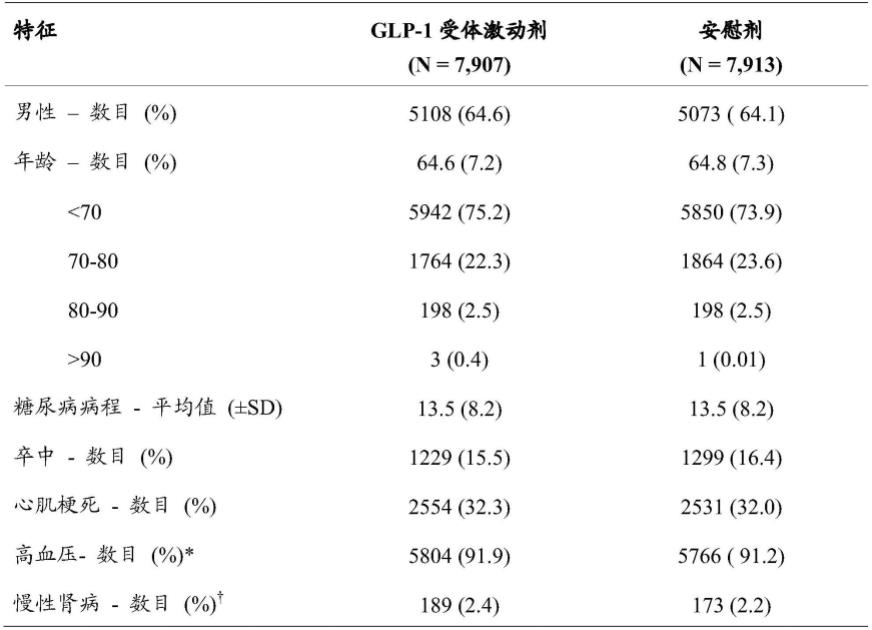
在一些实施方案中,n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐包含一个单价阳离子、两个单价阳离子或一个二价阳离子。在一些实施方案中,n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐选自n-(8-(2-羟基苯甲酰基)氨基)辛酸的钠盐、钾盐和/或钙盐。在一些实施方案中,n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐选自钠盐、钾盐和/或铵盐。在一些实施方案中,n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐是钠盐或钾盐。n-(8-(2-羟基苯甲酰基)氨基)辛酸盐可以使用例如wo96/030036、wo00/046182、wo01/092206或wo2008/028859中描述的方法来制备。n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐可以是结晶的和/或无定形的。在一些实施方案中,递送剂包括n-(8-(2-羟基苯甲酰基)氨基)辛酸盐的无水物、一水合物、二水合物、三水合物、溶剂化物或三分之一水合物,及其组合。在一些实施方案中,递送剂是如wo2007/121318中描述的n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐。在一些实施方案中,递送剂是n-(8-(2-羟基苯甲酰基)氨基)辛酸钠(在本文中称为“snac”),也称为8-(水杨酰基氨基)辛酸钠。
[0068]
在一些实施方案中,用于本发明的组合物为用于口服给药的固体组合物如片剂的形式。
[0069]
在一些实施方案中,所述固体组合物包含0.1
–
50mg,如0.5至40mg或1-30mg范围内的量的glp-1受体激动剂。在一些实施方案中,所述固体组合物包含2-20mg,如3-18mg或5-15mg范围内的量的glp-1受体激动剂。在一些实施方案中,所述固体组合物包含约3mg,如约7mg或约14mg的量的glp-1受体激动剂。
[0070]
在一些实施方案中,所述固体组合物(例如片剂)的至少30%(w/w)是n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐。在一些实施方案中,所述固体组合物(例如片剂)的至少50%(w/w)是n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐。在一些实施方案中,组合物每个剂量单位中n-(8-(2-羟基苯甲酰基)氨基)辛酸盐的量在0.20-.5mmol、0.25-1.0mmol、0.30-0.75mmol或诸如0.45-0.65mmol的范围内。在一些实施方案中,组合物中snac的量在75-600mg的范围内。在一些实施方案中,组合物中snac的量在每个剂量单位75-400mg,如80-350mg,如约100mg至约300mg的范围内。
[0071]
在一些实施方案中,所述固体组合物包含润滑剂,如硬脂酸镁。在一些实施方案
中,所述固体组合物的单位剂量包含:0.1-50mg glp-1受体激动剂,25-600mg的n-(8-(2-羟基苯甲酰基)氨基)辛酸(nac)的盐(如nac的钠盐(snac)),和0-25mg润滑剂。
[0072]
给药方案
[0073]
glp-1受体激动剂可以以治疗有效量施用,例如以治疗2型糖尿病的治疗有效量施用。glp-1受体激动剂的治疗有效量可由医生评估。glp-1受体激动剂的剂量可以在0.01至50mg,如1-30mg或3-20mg的范围内。在一些实施方案中,在当天中的任何时间施用glp-1受体激动剂。
[0074]
glp-1受体激动剂,如司美格鲁肽,可以每周一次或更频繁地施用,如每天一次。
[0075]
在一些实施方案中,glp-1受体激动剂以每周0.05-30mg范围内的量施用,如每周0.5或1.0mg,任选地每周施用一次。在一些实施方案中,glp-1受体激动剂以每周至少0.1mg的量施用,如每周至少0.5mg或每周至少1mg,任选地每周施用一次。在一些实施方案中,glp-1受体激动剂以每周不超过25mg的量施用,如每周不超过20mg或每周不超过15mg,任选地每周施用一次。在一些实施方案中,glp-1受体激动剂以每周不超过10mg的量施用,如每周不超过6mg或每周不超过3mg,任选地每周施用一次。在一些实施方案中,glp-1受体激动剂以0.5或1.0mg的量每周施用一次。
[0076]
在一些实施方案中,本发明的方法降低了死亡风险。
[0077]
在一些实施方案中,glp-1受体激动剂的施用是长期治疗,其中司美格鲁肽施用至少12个月,如至少16个月或至少18个月。
[0078]
肠胃外给药
[0079]
glp-1受体激动剂可以通过肠胃外给药,例如皮下注射来施用。glp-1受体激动剂可以使用笔式注射器,如3ml一次性笔式注射器来施用。
[0080]
在一些实施方案中,glp-1受体激动剂的剂量在0.1至5.0mg的范围内,如0.1至3.0mg的范围内。在一些实施方案中,glp-1受体激动剂的每日剂量选自0.5和1.0mg。
[0081]
口服给药
[0082]
glp-1受体激动剂可以口服施用,例如以片剂、包衣片剂、囊剂或胶囊如硬或软明胶胶囊的形式施用,并且所有这类组合物均被认为是固体口服剂型。口服给药可以是每日一次给药。在一些实施方案中,glp-1受体激动剂的剂量在1至30mg,如2至20mg或3至15mg的范围内。在一些实施方案中,glp-1受体激动剂的剂量为3、7或14mg。该组合物可以是剂量单位如片剂的形式。在一些实施方案中,单位剂量的重量在50mg至1000mg的范围内,如50-750mg或例如约100-500mg的范围内。在一些实施方案中,剂量单位的重量在75mg至350mg的范围内,如50-300mg或100-400mg的范围内。用于口服给药的片剂可包含30%(w/w)的n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐,如n-(8-(2-羟基苯甲酰基)氨基)辛酸的钠盐(snac)。在一些实施方案中,可以在压缩成片剂之前使组合物粒化。该组合物可包含颗粒部分和/或颗粒外部分,其中颗粒部分已经被粒化,并且颗粒外部分已经在粒化之后添加。glp-1受体激动剂可被包含在颗粒部分或颗粒外部分中。在一些实施方案中,颗粒外部分包含glp-1受体激动剂。在实施方案中,颗粒外部分可以进一步包含润滑剂和/或助流剂。在实施方案中,颗粒部分可以包含润滑剂和/或助流剂。在实施方案中,颗粒部分和颗粒外部分包含润滑剂和/或助流剂。
[0083]
在一些实施方案中,glp-1受体激动剂是根据本发明施用的唯一药物活性成分。在
一些实施方案中,glp-1受体激动剂与本发明中的一种或多种其他药物活性成分组合。在一些实施方案中,glp-1受体激动剂与一种或多种选自利斯的明(rivastigmin)、美金刚胺(如盐酸美金刚胺)、多奈哌齐和加兰他敏的其他药物活性成分组合。在一些实施方案中,glp-1受体激动剂与利斯的明组合。在一些实施方案中,glp-1受体激动剂与美金刚胺如盐酸美金刚胺组合。在一些实施方案中,glp-1受体激动剂与多奈哌齐组合。在一些实施方案中,glp-1受体激动剂与加兰他敏组合。
[0084]
在一些实施方案中,如本文关于glp-1受体激动剂使用的术语“长期治疗”是指以提供治疗效果的量和频率施用。在一些实施方案中,如本文关于glp-1受体激动剂使用的术语“长期治疗”是指每周一次施用0.1-3.0mg,如0.5或1.0mg glp-1受体激动剂(例如司美格鲁肽)。在一些实施方案中,如本文关于glp-1受体激动剂使用的术语“长期治疗”是指每日一次施用0.05-0.3mg,如0.05、0.1、0.2或0.3mg glp-1受体激动剂(例如司美格鲁肽)。在一些实施方案中,如本文关于glp-1受体激动剂使用的术语“长期治疗”是指每日一次施用0.1-6mg,如0.5-4mg glp-1受体激动剂(例如利拉鲁肽)。如本文所用的术语“长期治疗”可指根据规定的剂量方案(例如每周一次给药)长期(例如至少2年或至少5年)施用药物,其中最多可以遗漏10%,如最多5%的剂量;前提是遗漏的剂量不超过连续10次。
[0085]
除非另有说明,否则本文中的范围包括其端点。在一些实施方案中,术语“一”表示“一个(种)或多个(种)”。在一些实施方案中,并且除非在本说明书中另有说明,否则以单数形式呈现的术语也包括复数情况。在本文中,术语“约”是指所指代的值
±
10%,并且包括该值。
[0086]
本发明的非限制性实施方案
[0087]
本发明的非限制性实施方案包括:
[0088]
1.治疗痴呆的方法,其中所述方法包括向有需要的受试者施用glp-1受体激动剂,并且所述受试者患有代谢综合征。
[0089]
2.治疗痴呆的方法,其中所述方法包括向有需要的受试者施用司美格鲁肽。
[0090]
3.降低发生痴呆的风险的方法,其中所述方法包括向有需要的人类受试者施用glp-1受体激动剂,并且所述受试者患有一种或多种选自前驱糖尿病、糖尿病、心血管疾病、肥胖症和高血压的适应症。
[0091]
4.降低发生痴呆的风险的方法,其中所述方法包括向有需要的受试者施用glp-1受体激动剂,并且所述受试者患有代谢综合征。
[0092]
5.降低发生痴呆的风险的方法,其中所述方法包括向有需要的受试者施用glp-1受体激动剂,并且所述受试者患有一种或多种选自前驱糖尿病、糖尿病、心血管疾病、肥胖症和高血压的适应症。
[0093]
6.降低发生痴呆的风险的方法,其中所述方法包括向有需要的受试者施用司美格鲁肽。
[0094]
7.根据前述实施方案中任一项所述的方法,其中治疗是降低发生痴呆的风险。
[0095]
8.根据前述实施方案中任一项所述的方法,其中所述代谢综合征是一种或多种选自前驱糖尿病、糖尿病、心血管疾病、肥胖症和高血压的适应症。
[0096]
9.根据前述实施方案中任一项所述的方法,其中所述受试者患有前驱糖尿病。
[0097]
10.根据前述实施方案中任一项所述的方法,其中所述受试者患有糖尿病。
[0098]
11.根据前述实施方案中任一项所述的方法,其中所述受试者患有心血管疾病。
[0099]
12.根据前述实施方案中任一项所述的方法,其中所述受试者患有肥胖症。
[0100]
13.根据前述实施方案中任一项所述的方法,其中所述受试者患有高血压。
[0101]
14.根据前述实施方案中任一项所述的方法,其中所述glp-1受体激动剂包括任选地包含一个或多个置换、缺失、添加和/或修饰的glp-1(7-37)(seq id no:1)。
[0102]
15.根据前述实施方案中任一项所述的方法,其中与glp-1(7-37)(seq id no:1)相比,所述glp-1受体激动剂有最多12个氨基酸已经例如通过置换、缺失、插入和/或修饰而改变。
[0103]
16.根据前述实施方案中任一项所述的方法,其中与glp-1(7-37)(seq id no:1)相比,所述glp-1受体激动剂有最多10个氨基酸已经例如通过置换、缺失、插入和/或修饰而改变。
[0104]
17.根据前述实施方案中任一项所述的方法,其中与glp-1(7-37)(seq id no:1)相比,所述glp-1受体激动剂有最多8个氨基酸已经例如通过置换、缺失、插入和/或修饰而改变。
[0105]
18.根据前述实施方案中任一项所述的方法,其中与glp-1(7-37)(seq id no:1)相比,所述glp-1受体激动剂有最多6个氨基酸已经例如通过置换、缺失、插入和/或修饰而改变。
[0106]
19.根据前述实施方案中任一项所述的方法,其中所述glp-1受体激动剂包含一个或多个取代基。
[0107]
20.根据前述实施方案中任一项所述的方法,其中所述取代基包含连接体,如一个或多个oeg。
[0108]
21.根据前述实施方案中任一项所述的方法,其中所述连接体位于所述取代基中所述取代基与所述glp-1受体激动剂中的肽之间的连接点的近端。
[0109]
22.根据前述实施方案中任一项所述的方法,其中所述glp-1受体激动剂的ec
50
(无hsa)为至多500pm。
[0110]
23.根据前述实施方案中任一项所述的方法,其中所述glp-1受体激动剂不大于12kda。
[0111]
24.根据前述实施方案中任一项所述的方法,其中所述glp-1受体激动剂选自利拉鲁肽、司美格鲁肽、化合物a和化合物b。
[0112]
25.根据前述实施方案中任一项所述的方法,其中所述glp-1受体激动剂是利拉鲁肽。
[0113]
26.根据前述实施方案中任一项所述的方法,其中所述glp-1受体激动剂是司美格鲁肽。
[0114]
27.根据前述实施方案中任一项所述的方法,其中所述glp-1受体激动剂是化合物a。
[0115]
28.根据前述实施方案中任一项所述的方法,其中所述glp-1受体激动剂是化合物b。
[0116]
29.根据前述实施方案中任一项所述的方法,其中所述glp-1受体激动剂是度拉糖肽。
[0117]
30.根据前述实施方案中任一项所述的方法,其中所述glp-1受体激动剂是阿比鲁肽。
[0118]
31.根据前述实施方案中任一项所述的方法,其中所述受试者是人。
[0119]
32.根据前述实施方案中任一项所述的方法,其中所述痴呆是痴呆疾病连续谱中的所有形式和所有阶段。
[0120]
33.根据前述实施方案中任一项所述的方法,其中所述痴呆是轻度认知障碍。
[0121]
34.根据前述实施方案中任一项所述的方法,其中所述痴呆是阿尔茨海默病。
[0122]
35.根据前述实施方案中任一项所述的方法,其中所述痴呆选自临床前阿尔茨海默病、阿尔茨海默类型的轻度认知障碍、早发型家族性阿尔茨海默病和前驱阿尔茨海默病。
[0123]
36.根据前述实施方案中任一项所述的方法,其中所述痴呆是临床前阿尔茨海默病。
[0124]
37.根据前述实施方案中任一项所述的方法,其中所述痴呆是阿尔茨海默类型的轻度认知障碍。
[0125]
38.根据前述实施方案中任一项所述的方法,其中所述痴呆是早发型家族性阿尔茨海默病。
[0126]
39.根据前述实施方案中任一项所述的方法,其中所述痴呆是前驱阿尔茨海默病。
[0127]
40.根据前述实施方案中任一项所述的方法,其中所述glp-1受体激动剂是施用于所述受试者的唯一药物活性成分。
[0128]
41.根据前述实施方案中任一项所述的方法,其中皮下施用所述glp-1受体激动剂。
[0129]
42.根据前述实施方案所述的方法,其中所述glp-1受体激动剂以溶液或悬浮液形式的组合物施用。
[0130]
43.根据前述实施方案所述的方法,其中所述组合物包含至少90%的水。
[0131]
44.根据前述实施方案中任一项所述的方法,其中所述glp-1受体激动剂是司美格鲁肽,皮下施用,并且为包含至少90%的水且ph在7.0-9.0范围内的溶液的形式。
[0132]
45.根据前述实施方案中任一项所述的方法,其中口服施用所述glp-1受体激动剂。
[0133]
46.根据前述实施方案所述的方法,其中所述glp-1受体激动剂以片剂的形式施用。
[0134]
47.根据前述实施方案所述的方法,其中所述片剂的至少30%(w/w)为n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐。
[0135]
48.根据前述实施方案所述的方法,其中所述片剂的至少50%(w/w)为n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐。
[0136]
49.根据前述实施方案所述的方法,其中所述n-(8-(2-羟基苯甲酰基)氨基)辛酸的盐为snac。
[0137]
50.根据前述实施方案中任一项所述的方法,其中所述受试者先前已施用胰岛素。
[0138]
51.根据前述实施方案中任一项所述的方法,其中所述方法降低所述受试者的死亡风险。
[0139]
52.根据前述实施方案中任一项所述的方法,其中glp-1受体激动剂的所述施用是
长期治疗,其中司美格鲁肽施用至少12个月,如至少16个月或至少18个月。
实施例
[0140]
实施例1
–
患有代谢综合征的受试者的痴呆风险降低
[0141]
方法
[0142]
在具有长期治疗暴露的数据源中评估了glp-1受体激动剂的暴露和随后的痴呆诊断,该数据源包括三个合并的双盲随机化对照试验(rct)和一个全国糖尿病患者群组。这样做的目的是研究使用glp-1受体激动剂是否可以降低糖尿病患者的痴呆发病率。
[0143]
试验和登记册
[0144]
采用将研究设计和数据源与潜在偏差的不同关键来源相整合的三角测量方法来获得更可靠的答案。首先,从三个使用glp-1受体激动剂的大型rct合并数据;利拉鲁肽(leader;9,340名患者)、皮下司美格鲁肽(sustain-6;3,297名患者)和口服司美格鲁肽(pioneer 6;3,183名患者)。所有三项试验都是多中心、双盲、安慰剂对照的心血管结局试验。心血管疾病高风险或已确定患有心血管疾病的2型糖尿病患者以1:1的比例随机分配,除了标准医护外,还接受安慰剂或利拉鲁肽(leader)或司美格鲁肽(sustain-6;pioneer 6)。在这些试验中,根据研究者的判断,如前所述,在两组中调整或增加糖尿病治疗(不包括glp-1受体激动剂、二肽基肽酶4抑制剂(dpp4抑制剂)和普兰林肽)。在leader中测试的制剂是包含利拉鲁肽、磷酸二钠二水合物、丙二醇和苯酚的水性组合物,ph为8.15。在sustain-6中测试的制剂是包含司美格鲁肽、磷酸二钠二水合物、丙二醇和苯酚的水性组合物,ph为7.4。在pioneer中测试的制剂是包含司美格鲁肽和snac的片剂。
[0145]
接下来,我们使用了丹麦国家处方登记册(danish national prescription register),该登记册保存了自1995年1月1日以来丹麦所有已领取处方的信息(表s1),以确定接受糖尿病治疗的患者的全国群组。我们确定了在1995年1月1日至2017年12月31日期间首次开具二线糖尿病治疗处方(表s2)的所有人。
[0146]
对痴呆发作的随访始于2009年1月1日(图4),因为到那时glp-1受体激动剂可以被认为是丹麦众所周知且可用的糖尿病治疗剂。为了正确确定被首次开具二线糖尿病治疗处方的患者,我们排除了在1995年1月1日至1995年6月30日期间开具处方的患者。此外,在开始随访前已确定患有痴呆或在50岁之前已发生痴呆的患者被排除在外。
[0147]
对于主要分析,我们纳入了暴露于二线糖尿病治疗至少5年的所有患者。
[0148]
glp-1受体激动剂暴露
[0149]
3个rct的预定义治疗持续时间列于补充表s4中。在全国群组中,确定了所有已分配的glp-1受体激动剂处方(表s2),并且在整个随访期间更新了glp-1受体激动剂的累积暴露年数。如果患者领取了任何glp-1受体激动剂的至少1个处方,则他们被认为是经暴露的。暴露持续时间按6个月长的间隔累积,其中至少领取了1个处方。
[0150]
其他糖尿病治疗暴露
[0151]
在全国群组中,评估了“其他二线糖尿病治疗”,以测试glp-1受体激动剂对痴呆预防的潜在影响是否对glp-1受体激动剂治疗具有特异性。我们确定了在随访期间可作为glp-1受体激动剂的替代治疗选择的其他二线糖尿病治疗,即胰岛素、磺酰脲、dpp4抑制剂、阿卡波糖和氯茴苯酸(表s2)。暴露时间按照6个月长的间隔累积,其中至少领取了1个处方。
未评估二甲双胍单药疗法,因为这被认为是糖尿病的一线治疗,因此不是能与glp-1受体激动剂相比较的治疗选项。
[0152]
痴呆
[0153]
在rct中,使用监管活动标准化医学词典(standardized medical dictionary for regulatory activities,meddra,21.1版),用痴呆的窄范围搜索词(表s3)来确定与痴呆相关的不良事件。在全国群组中,痴呆被定义为在国家患者登记册(national patient register)中诊断出痴呆,或在国家处方登记册中首次开具经批准的痴呆特异性治疗(胆碱酯酶抑制剂和美金刚)处方(表s1和s2列出了icd10和atc代码)。
[0154]
统计分析
[0155]
对于合并的rct,使用cox回归进行意向治疗分析,其中将治疗分配作为唯一的解释变量,以确定使用glp-1受体激动剂与安慰剂时发生痴呆的风险比。我们报告了随机分配为接受glp-1受体激动剂与安慰剂的患者的痴呆风险比。使用aalen-johansen估计量计算了以死亡为竞争风险的痴呆的发生率。
[0156]
在全国群组中,我们采用了嵌套病例-对照研究设计,其中每名患者在病例日期(痴呆诊断日期)的年龄、性别和日历日期与10名没有痴呆的对照相匹配。在病例日期之前的5年暴露窗口中,使用cox回归对glp-1受体激动剂的累积暴露差异对发生痴呆的影响进行建模(图4),并报告为病例与对照的glp-1受体激动剂暴露每增加1年的风险比。报告的是持续时间每增加1年的风险比。通过匹配针对年龄、性别和日历日期,以及针对在暴露窗口开始时的糖尿病病程(自首次开具任何二线糖尿病治疗处方以来的年数)、卒中、心肌梗死、高血压、慢性肾病和教育程度的信息(表s1和s2),对该模型进行了调整。其他二线糖尿病治疗均采用了类似的cox回归模型。此外,对暴露于glp-1受体激动剂的痴呆的风险比进行了跨亚组研究,包括性别、年龄、胰岛素暴露和心血管状态,其中心血管疾病被定义为既往卒中或心肌梗死。在全国群组中,进行了预先指定的敏感性分析,以确定以下因素的影响:1)反向因果关系,其中忽略病例日期之前两年的暴露;2)糖尿病病程,被定义为“自首次二甲双胍治疗或二线糖尿病治疗起的时间”;3)缩短和延长暴露窗口(分别为3年和10年);4)仅通过匹配年龄、性别和日历日期进行调整;以及5)死亡的竞争风险。将统计显著性水平设定为5%。
[0157]
结果
[0158]
研究人群
[0159]
在合并的rct中,总共有15,820名心血管疾病高风险或已确定患有心血管疾病的患者被随机分配为接受glp-1受体激动剂或安慰剂。基线特征见表1。
[0160]
在从2009年到2017年的随访期间,在自开始二线糖尿病治疗起至少经过5年的120,054名患者的全国群组中,4,849名患者发生痴呆。病例和对照患者的特征见表2。利拉鲁肽占glp-1受体激动剂全部处方的95%。
[0161]
合并的rct中的痴呆
[0162]
在合并的rct中,15名随机分配为接受glp-1受体激动剂的患者和32名随机分配为接受安慰剂的患者在中值为3.61年的随访期间发生痴呆(表s4)。
[0163]
与随机分配为接受安慰剂的患者相比,随机分配为接受glp-1受体激动剂的患者发生痴呆的风险较低(风险比0.47;95%置信区间(ci),0.25至0.86)(图1和表s5)。glp-1受
体激动剂的有益效果在治疗12个月后变得明显(图1)。
[0164]
全国群组中的痴呆
[0165]
全国群组的随访时间中值为7.4年。嵌套在全国群组中的分析被专门设计用于通过确保至少5年的二线糖尿病疗法治疗来查看长期效果。结果是随着glp-1受体激动剂暴露持续时间的增加,痴呆的风险降低(图2)。未发现暴露于其他二线糖尿病治疗与风险比降低相关(图2)。暴露于glp-1受体激动剂的痴呆风险比的降低在按性别、年龄、共同暴露于胰岛素和心血管状态分层的亚组中相似(图3)。
[0166]
排除导致痴呆诊断的两年暴露并没有改变结果(图5a),并且当糖尿病病程被评估为“自首次二甲双胍治疗或二线糖尿病治疗起的时间”时,结果也没有改变,尽管发现ddp4抑制剂与对痴呆具有保护作用有关(图5b)。此外,在诊断痴呆前3年和10年内评估glp-1受体激动剂的暴露时,痴呆的结果保持不变(图6a)。通过匹配仅针对年龄、性别和日历日期进行调整也产生了相同的结果(图6b)。最后,将死亡作为竞争风险的分析(其在先前没有诊断痴呆的情况下评估死亡的风险比)显示,暴露于glp-1受体激动剂的死亡风险比更低(图6c)。
[0167]
总之,发现glp-1受体激动剂治疗与糖尿病患者的痴呆风险降低有关。
[0168]
表1:合并的rct中的基线特征
[0169][0170]
*不包括pioneer 6试验。慢性肾病被定义为egfr《30。
[0171]
表2:全国群组中病例和对照患者的特征
[0172][0173][0174]
*自开始二线糖尿病治疗起的时间。在5年暴露窗口开始时。在接受glp-1受体激动剂的患者中。∫424个(8.7%)病例和4934个(10.2%)对照的教育状况未知。
[0175]
表s1.数据源。
[0176]
[0177][0178]
表s2.全国群组的糖尿病治疗、痴呆和共病定义概述。
[0179]
[0180][0181]
*这些产品在与glp-1受体激动剂相同的日历期间不可用,因此不被视为glp-1受体激动剂的替代治疗选择。*2017年的最后6个月,由于登记册的可获得性,痴呆仅由痴呆治疗来定义。
[0182]
表s3.在合并的rct的事后分析中应用的痴呆(窄范围)标准化meddra查询(smq)搜索词*。
[0183]
[0184][0185]
*21.1版
[0186]
表s4.全国群组中预先指定的敏感性分析。
[0187]
敏感性分析1)反向因果关系,其中忽略病例日期之前两年的暴露2)糖尿病病程,被定义为“自首次二甲双胍治疗或二线糖尿病治疗起的时间”3)缩短和延长暴露窗口(分别为3年和10年)4)仅通过匹配年龄、性别和日历日期进行的调整5)死亡的竞争风险
[0188]
表s5.每个纳入的rct中的随访中值和痴呆率。
[0189][0190]
*在leader中,计划的最短随访时间为42个月,接受指定方案的最长随访时间为60个月,后续随访30天。在sustain-6中,计划的观察期为109周,由104周的指定方案和随后的5周随访组成。在pioneer6中,不需要预先定义的最短治疗持续时间,但需要继续随访,直到发生122起主要结局事件。
[0191]
表s6.根据痴呆亚型的合并的rct中的痴呆风险比。
[0192][0193]
实施例2-司美格鲁肽防止衰老加速倾向8(samp8)小鼠的认知能力下降
[0194]
近交衰老加速小鼠倾向8(samp8)模型是一种非转基因小鼠品系,其表现出与散发性(不是由明确的遗传原因驱动的)阿尔茨海默痴呆相关的表型,包括可测量的认知能力下降。samp8小鼠表现出加速衰老,因此也模拟与年龄相关的代谢并发症,显示出氧化应激和炎症的标志物增加。由于可以在存在明显神经病理学(例如大脑中淀粉样蛋白斑块的积累)之前在该模型中测量到认知缺陷,因此该小鼠模型允许评估药物对防止认知能力下降的影响并模拟人类疾病的早期阶段。
[0195]
在此,利用samp8小鼠来表征司美格鲁肽处理对记忆缺陷和认知能力下降的影响。两种通常用于评估啮齿动物认知缺陷的行为测试被用于测定对短期记忆(y迷宫测试)和长期记忆(步入被动回避测试)的影响。y迷宫是对短期记忆的测试,通过测量自发交替来评估空间工作记忆和探索行为,这是进入迷宫新臂而不是返回先前访问过的臂的频率(在方法中描述)。步入被动回避测试通过评估对厌恶刺激与特定环境的关联的学习来测量相关的长期记忆(在方法中描述)。随着年龄的增长,samp8小鼠在两项测试中都有可测量的缺陷。
[0196]
方法
[0197]
使用samp8小鼠采用以下处理组进行实验:samp8媒介物处理组(n=24)和samp8司美格鲁肽(30nmol/kg)处理组(n=11)。在六周龄时开始处理。每天一次皮下递送处理,其中司美格鲁肽的初始滴定期在给药的第一天为3nmol/kg,在给药的第二天为10nmol/kg,之后以30nmol/kg继续。
[0198]
y迷宫中的测试分别在8周龄和16周龄时进行,分别在处理开始后约15天和71天进行。y迷宫由灰色聚氯乙烯组成,三个臂长40cm,高13cm,底部宽3cm,顶部宽10cm,以相等的角度汇合。每只小鼠被放置在一个臂的末端,并使其在八分钟的时间里自由地穿过迷宫。监测一系列臂进入(包括可能返回到同一臂),并且交替被定义为连续进入所有三个臂。因此,最大交替次数是臂进入的总次数减去2,而交替百分比被计算为(实际交替/最大交替)x 100。
[0199]
步入被动回避表现在18周龄时进行。测试在由双隔室盒子(15
×
20
×
15cm高)组成的设备中进行,其中一个隔室用白色聚氯乙烯壁照亮,另一隔室用黑色聚氯乙烯壁和网格地板变暗。一扇闸门将隔室隔开。在实验过程中,位于设备上方40cm处的60w灯照亮白色隔
室。可以使用冲击发生器加扰器(lafayette instruments,lafayette,usa)将加扰的足底电击(0.3ma,3s)递送到网格地板。首先进行训练阶段,其中闸门最初关闭,并将每只小鼠放入白色隔室中。5秒后,闸门升起。当小鼠进入黑暗的隔室并且所有四只爪子放在网格地板上时,关闭闸门,并且递送足底电击3秒,以将暗室与足底电击相关联。训练后24小时进行记忆保持测试。将每只小鼠再次放入白色隔室中,5秒后,闸门升起。记录步入潜伏期至多300秒,其被定义为小鼠在记忆保持测试期间进入黑暗隔室所需的时间。同样记录逃避潜伏期,其被定义为在施加足底电击后在记忆保持测试中逃出暗室的时间。
[0200]
结果
[0201]
图7中的数据表明,正如预期的那样,与8周龄(平均值
±
sem:69.1%
±
1.3%)相比,媒介物处理的samp8小鼠在16周龄时(平均值
±
sem:42.8%
±
2.1%)在y-迷宫中的交替行为百分比显著减少(p《0.0001,双向anova,sidak多重比较检验)。与媒介物处理的samp8(平均值
±
sem:42.8%
±
2.1%)对照相比,16周龄的司美格鲁肽处理的samp8小鼠的交替行为显著改善(平均值
±
sem:79.1%
±
1.6%)(p《0.0001,双向anova,sidak多重比较检验)。这些数据表明,如在y迷宫测试中所测量的,司美格鲁肽对保持samp8小鼠的短期记忆功能具有积极影响。
[0202]
如在步入被动回避测试中所测量的,司美格鲁肽还改善了samp8小鼠的长期记忆(图8-9)。司美格鲁肽处理的samp8小鼠在记忆保持阶段进入暗室的步入潜伏期显著增加,这在先前与足底电击相关联(图8;samp8媒介物处理组的平均值
±
sem:109.8秒
±
5.8秒;samp8司美格鲁肽处理组的平均值
±
sem:260.5秒
±
14.5秒,p《0.0001,mann-whitney检验)。司美格鲁肽处理的samp8小鼠从暗室的逃避潜伏期也显著缩短(图9;samp8媒介物处理组的平均值
±
sem:88.8秒
±
4.6秒;samp8司美格鲁肽处理组的平均值
±
sem:19.0秒
±
3.0秒,p=0.01,非配对t检验)。
[0203]
与媒介物处理的动物相比,司美格鲁肽处理未导致体重(16周龄;samp8媒介物处理组的平均值
±
sem:31.0克
±
0.43克或相比于基线的体重变化为148.0%
±
4.6%;samp8司美格鲁肽处理组的平均值
±
sem:29.2克
±
0.7克或相比于基线的体重变化为145.4%
±
4.2%)或血糖(samp8媒介物处理组的平均值
±
sem:137.1mg/dl
±
5.6mg/dl;samp8司美格鲁肽处理组的平均值
±
sem:133.1mg/dl
±
2.2mg/dl)的差异。
[0204]
结论
[0205]
长期司美格鲁肽处理防止samp8小鼠的认知能力下降。司美格鲁肽防止y迷宫中交替行为的下降,表明与媒介物处理的samp8对照相比,短期和空间记忆得到改善。司美格鲁肽还在步入被动回避测试中延长了步入潜伏期并缩短了逃避潜伏期,这些是长期记忆表现和联想学习的积极指标。此外,这些对认知参数的积极影响似乎是司美格鲁肽的新作用,它不受血糖或体重变化的驱动。实施例2出人意料地显示,在相同的动物模型中,司美格鲁肽的效果优于已发表的利拉鲁肽的效果。
[0206]
实施例3-司美格鲁肽在脂多糖(lps)炎症小鼠模型中减轻脑部炎症(神经炎症)
[0207]
神经炎症是包括痴呆和阿尔茨海默病在内的病理学的一部分,人脑成像研究强调,在阿尔茨海默病中炎症标志物增加(例如易位蛋白18kda水平),并且人类遗传关联研究强调,与阿尔茨海默病相关的基因是炎症途径的一部分。炎症还与人类的代谢疾病(肥胖症、2型糖尿病、心血管疾病)有关,因此可能会影响患有代谢疾病的患者认知能力下降和痴
呆的进展。
[0208]
lps诱发的神经炎症被用作啮齿动物中阿尔茨海默病的非遗传模型。lps是一种来自革兰氏阴性菌的内毒素,其提供持续的炎性刺激,从而激活脑免疫细胞(神经免疫细胞)。小胶质细胞是一种由lps激活的脑免疫细胞类型,并且神经炎症的程度可以通过脑组织中小胶质细胞的面积来评估,如通过小胶质细胞特异性标志物——离子化钙结合衔接分子1(iba1)所测量的。
[0209]
在此,使用lps诱发的小鼠神经炎症来评估司美格鲁肽对减轻海马体中的脑部炎症的影响,海马体是参与记忆和学习的大脑区域,在阿尔茨海默病中恶化。
[0210]
方法
[0211]
该实验使用8-10周龄的c57bl/6小鼠进行。从研究的第1天到第28天,用司美格鲁肽(30nmol/kg,每天一次皮下施用)或媒介物处理小鼠。为了诱发炎症,在研究的第15-17天施用lps(1.0mg/kg,每天一次腹膜内施用)三天,对照动物接受媒介物。通过在第15天于lps给药后一小时测量血浆肿瘤坏死因子α水平来验证炎性细胞因子的诱导。在第19天(lps处理后第2天)或第28天(lps处理后第11天)将动物处死,以测量神经炎症的标志物。所有处理组均为n=8-12。
[0212]
处死后立即收集整个大脑用于神经炎症标志物的免疫组织化学(ihc)分析。将大脑在10%中性缓冲福尔马林中浸泡固定约48小时,然后转移到70%乙醇中并在4℃下储存,直到石蜡包埋成块。将代表背侧海马体的首尾轴(rostro-caudal axis)的连续切片切成4μm,并收集在superfrost plus载玻片上。将石蜡包埋的切片在二甲苯中脱石蜡并在一系列分级乙醇中再水化。使用iba1第一抗体(abcam,cat.ab178845)对iba1进行ihc。在抗原修复和阻断内源性过氧化物酶活性后,将载玻片与第一抗体一起孵育。使用连接体第二抗体检测第一抗体,然后使用聚合hrp-连接体抗体偶联物进行扩增。接下来,第一抗体用dab作为色原进行可视化,并在苏木精中复染。
[0213]
对iba1信号进行定量评估以测量组织切片的海马体中小胶质细胞的面积。使用vis(visiopharm,丹麦)软件以两步方案进行评估。首先,获得低放大倍率(1倍物镜)下组织的粗略检测和感兴趣区域(roi)的描绘。其次,在roi内以更高的放大倍率(10倍物镜)进行ihc阳性染色的检测。ihc阳性染色的定量估计值被计算为总组织面积的面积分数(af),其中:
[0214][0215]
结果
[0216]
司美格鲁肽降低了lps施用后海马体中的小胶质细胞炎症标志物iba1。图10中的结果显示,与给予媒介物/媒介物的对照相比,在给予lps 媒介物的小鼠中,lps在第19天显著增加了海马体iba1面积(p《0.001,dunnett检验单因素线性模型;第19天媒介物/媒介物的平均值
±
sem:8.98%
±
0.34%,第19天lps 媒介物的平均值
±
sem:14.25%
±
0.54%),表明lps诱发了神经炎症。在第28天,lps 媒介物处理的小鼠的海马体iba1面积继续显著增加(与媒介物/媒介物对照相比p《0.05,dunnett检验单因素线性模型;第28天媒介物/媒介物的平均值
±
sem:9.77%
±
0.54%,第28天lps 媒介物的平均值
±
sem:12.17%
±
0.88%),而在lps 司美格鲁肽处理的小鼠中司美格鲁肽处理显著降低了iba1面积(与lps 媒介物处理的小鼠相比p《0.01,dunnett检验单因素线性模型;第28天lps 媒介物的平均值
±
sem:12.17%
±
0.88%,第28天lps 司美格鲁肽的平均值
±
sem:8.53%
±
0.49%)。
[0217]
在第28天,给予lps 媒介物的小鼠(平均值
±
sem:23.83g
±
0.33g)与用lps 司美格鲁肽处理的小鼠(平均值
±
sem:22.98g
±
0.70g)之间的体重没有显著差异。
[0218]
结论
[0219]
在lps诱发的神经炎症模型中,如通过小胶质细胞(iba1)的面积所测量的,司美格鲁肽减少了海马体中的神经炎症。司美格鲁肽处理减少了神经炎症,表明这可能是一种新的机制,通过该机制司美格鲁肽可能对认知产生影响。
[0220]
虽然本文已经阐述并描述了本发明的某些特征,但是本领域普通技术人员现在将会想到许多修改、替换、改变和等同方案。因此,应当理解,意欲以所附权利要求书涵盖所有这些落入本发明真正范围内的修改和改变。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。