用于cll1修饰的组合物和方法
1.相关申请
2.本技术要求2019年8月28日提交的美国序列号:62/892,868和2020年1月16日提交的美国序列号:62/962,133的优先权,其每篇的全部内容通过引用并入本文。
3.序列表
4.本技术包含已经以ascii格式电子提交的序列表,并在此通过引用整体并入。所述ascii副本创建于2020年8月28日,命名为v0291_70005wo00_sl.txt,大小为54,483字节。
背景技术:
5.当向癌症患者施用抗cll1癌症疗法时,该疗法不仅可以消减cll1 癌细胞,还可以消减非癌性cll1 细胞,产生“中靶、脱瘤”效应。由于某些造血细胞通常表达cll1,非癌性cll1 细胞的丧失可能消减患者的造血系统。为了解决这种消减,可以向受试者施用在cll1基因中包含修饰的挽救细胞(例如,hsc和/或hpc)。这些cll1修饰的细胞可以对抗cll1癌症治疗有抗性,并且可以因此在抗cll1疗法期间或之后使造血系统再增殖(repopulate)。
6.发明概述
7.本公开的一些方面提供了例如在内源性cll1基因中具有修饰(例如取代、插入或缺失)的新细胞。本公开的一些方面还提供了可以用于进行此类修饰的组合物,例如grna。本公开的一些方面提供了使用本文提供的组合物的方法,例如,使用所提供的某些grna来产生经遗传工程化改造的细胞,例如,在内源性cll1基因中具有修饰的细胞的方法。本公开的一些方面提供了向有此需要的受试者施用本文提供的经遗传工程化改造的细胞,例如,在内源性cll1基因中具有修饰的细胞的方法。本公开的一些方面提供了用于治疗患有癌症并接受或需要接受抗cll1癌症疗法的患者的策略、组合物、方法和治疗方式。
8.列举的实施方案
9.1.grna,其包含结合表1的靶域(例如,seq id no:1-20或40-43中任一个的靶域)的靶向域。
10.2.grna,其包含能够指导切割或编辑表1的靶域(例如,seq id no:1-20或40-43中任一个的靶域)的靶向域。
11.3.grna,其包含结合seq id no:1-3或5-10或seq id no:11-13或15-20中任一个的靶域的靶向域。
12.4.grna,其包含结合seq id no:4的靶域的靶向域。
13.5.grna,其包含结合靶域seq id no:14的靶向域,其中所述靶向域不包含seq id no:4。
14.6.grna,其包含结合靶域seq id no:14的靶向域,其中所述靶向域的长度为至少21个核苷酸。
15.7.前述实施方案中任一项的grna,其中所述靶向域与所述靶域的至少10、11、12、13、14、15、16、17、18、19或20个核苷酸碱基配对或互补,或其中所述靶向域包含0、1、2或3个与所述靶域的错配。
16.8.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:31的至少16(例如,17、18、19、20、21、22、23、24、25或26)个连续核苷酸。
17.9.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:31的至少16(例如,17、18、19、20、21、22、23、24、25或26)个连续核苷酸,并且与所述靶域的至少10、11、12、13、14、15、16、17、18、19或20个核苷酸碱基配对或互补。
18.10.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:46的至少16(例如,17、18、19、20、21、22、23、24、25或26)个连续核苷酸。
19.11.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:46的至少16(例如,17、18、19、20、21、22、23、24、25或26)个连续核苷酸,并且与所述靶域的至少10、11、12、13、14、15、16、17、18、19或20个核苷酸碱基配对或互补。
20.12.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:270的至少16(例如,17、18、19、20、21、22、23、24、25或26)个连续核苷酸。
21.13.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:270的至少16(例如,17、18、19、20、21、22、23、24、25或26)个连续核苷酸,并且与所述靶域的至少10、11、12、13、14、15、16、17、18、19或20个核苷酸碱基配对或互补。
22.14.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:271的至少16(例如,17、18、19、20、21、22、23、24、25或26)个连续核苷酸。
23.15.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:271的至少16(例如,17、18、19、20、21、22、23、24、25或26)个连续核苷酸,并且与所述靶域的至少10、11、12、13、14、15、16、17、18、19或20个核苷酸碱基配对或互补。
24.16.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:272的至少16(例如,17、18、19、20、21、22、23、24、25或26)个连续核苷酸。
25.17.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:272的至少16(例如,17、18、19、20、21、22、23、24、25或26)个连续核苷酸,并且与所述靶域的至少10、11、12、13、14、15、16、17、18、19或20个核苷酸碱基配对或互补。
26.18.前述实施方案中任一项的grna,其中所述靶向域被配置为在靶域内,例如,紧接地在所述靶域的核苷酸位置10、11、12、13、14、15、16、17、18、19或20之后,提供切割事件(例如,单链断裂或双链断裂)。
27.19.grna,其包含靶向域,其中所述靶向域包含seq id no:21的序列。
28.20.grna,其包含靶向域,其中所述靶向域包含seq id no:22的序列。
29.21.grna,其包含靶向域,其中所述靶向域包含seq id no:23的序列。
30.22.grna,其包含靶向域,其中所述靶向域包含seq id no:24的序列。
31.23.grna,其包含靶向域,其中所述靶向域包含seq id no:25的序列。
32.24.grna,其包含靶向域,其中所述靶向域包含seq id no:26的序列。
33.25.grna,其包含靶向域,其中所述靶向域包含seq id no:27的序列。
34.26.grna,其包含靶向域,其中所述靶向域包含seq id no:28的序列。
35.27.grna,其包含靶向域,其中所述靶向域包含seq id no:29的序列。
36.28.grna,其包含靶向域,其中所述靶向域包含seq id no:30的序列。
37.29.grna,其包含靶向域,其中所述靶向域包含seq id no:44的序列。
38.30.grna,其包含靶向域,其中所述靶向域包含seq id no:45的序列。
39.31.grna,其包含靶向域,其中所述靶向域包含seq id no:119的序列。
40.32.grna,其包含靶向域,其中所述靶向域包含seq id no:98的序列。
41.33.grna,其包含靶向域,其中所述靶向域包含表2或6的序列。
42.34.grna,其包含靶向域,其中所述靶向域包含表8(例如,seq id no:1-10、40、42、98或119中任一个)的序列。
43.35.grna,其包含能够指导切割或编辑表2的靶域(例如,seq id no:1-10、40或42中任一个的靶域)的靶向域。
44.36.grna,其包含能够指导切割或编辑表6的靶域(例如,seq id no:67-177中任一个的靶域)的靶向域。
45.37.grna,其包含能够指导切割或编辑表8的靶域(例如,seq id no:1-10、40、42、98或119中任一个的靶域)的靶向域。
46.38.前述实施方案中任一项的grna,其中所述靶域在seq id no:31的cll1序列的外显子1、外显子2、外显子3、外显子4、外显子5或外显子6中。
47.39.前述实施方案中任一项的grna,其中所述靶域在seq id no:46的cll1序列的外显子1、外显子2、外显子3、外显子4、外显子5、外显子6或外显子7中。
48.40.前述实施方案中任一项的grna,其中所述靶域在seq id no:270的cll1序列的外显子1、外显子2、外显子3、外显子4、外显子5、外显子6或外显子7中。
49.41.前述实施方案中任一项的grna,其中所述靶域在seq id no:271的cll1序列的外显子1、外显子2、外显子3、外显子4、外显子5或外显子6中。
50.42.前述实施方案中任一项的grna,其中所述靶域在seq id no:272的cll1序列的外显子1、外显子2、外显子3、外显子4或外显子5中。
51.43.前述实施方案中任一项的grna,其是单一向导rna(sgrna)。
52.44.前述实施方案中任一项的grna,其中所述靶向域的长度为16个核苷酸或更长。
53.45.前述实施方案中任一项的grna,其中所述靶向域的长度为16、17、18、19、20、21、22、23、24、25或26个核苷酸。
54.46.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:1-10、21-30、40、42、44或45中任一个的序列或其反向互补序列,或与前述任一项具有至少90%或95%同一性的序列,或相对于前述任一项具有不超过1、2或3个突变的序列。
55.47.实施方案46的grna,其中所述2个突变彼此不相邻。
56.48.实施方案46的grna,其中所述3个突变中没有一个是彼此相邻的。
57.49.实施方案46-48中任一项的grna,其中所述1、2或3个突变是取代。
58.50.实施方案46-48中任一项的grna,其中所述突变中的一个或多个是插入或缺失。
59.51.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:1-10、40或42中任一个的序列。
60.52.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:1的序列。
61.53.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:2的序列。
62.54.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:3的序列。
63.55.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:4的序列。
64.56.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:5的序列。
65.57.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:6的序列。
66.58.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:7的序列。
67.59.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:8的序列。
68.60.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:9的序列。
69.61.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:10的序列。
70.62.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:40的序列。
71.63.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:42的序列。
72.64.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:119的序列。
73.65.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:98的序列。
74.66.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:1-10、40、42、98或119中任一个的序列。
75.67.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:67-177中任一个的序列。
76.68.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:21-30或44-45中任一个的序列。
77.69.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:21的序列。
78.70.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:22的序列。
79.71.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:23的序列。
80.72.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:24的序列。
81.73.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:25的序列。
82.74.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:26的序列。
83.75.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:27的序列。
84.76.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:28的序列。
85.77.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:29的序列。
86.78.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:30的序列。
87.79.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:44的序列。
88.80.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:45的序列。
89.81.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:239的序列。
90.82.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:257的序列。
91.83.前述实施方案中任一项的grna,其中所述靶向域包含seq id no:216-268中任一个的序列。
92.84.前述实施方案中任一项的grna,其包含一个或多个化学修饰(例如,对核碱基、糖或主链部分的化学修饰)。
93.85.前述实施方案中任一项的grna,其包含,例如,在本文所述的位置处的一个或多个2’o-甲基核苷酸。
94.86.前述实施方案中任一项的grna,其包含,例如,在本文所述的位置处的一个或多个硫代磷酸酯或硫代pace联结。
95.87.前述实施方案中任一项的grna,其结合cas9分子。
96.88.前述实施方案中任一项的grna,其中所述靶向域的长度为约18-23,例如20个核苷酸。
97.89.实施方案1-88中任一项的grna,其与tracrrna结合。
98.90.实施方案1-88中任一项的grna,其包含支架序列。
99.91.前述实施方案中任一项的grna,其包含以下的一个或多个(例如,以下的全部):
100.第一互补域;
101.连接域;
102.与所述第一互补域互补的第二互补域;
103.近端域;和
104.尾域。
105.92.前述实施方案中任一项的grna,其包含第一互补域。
106.93.前述实施方案中任一项的grna,其包含连接域。
107.94.实施方案92或93的grna,其包含与所述第一互补域互补的第二互补域。
108.95.前述实施方案中任一项的grna,其包含近端域。
109.96.前述实施方案中任一项的grna,其包含尾域。
110.97.实施方案91-96中任一项的grna,其中所述靶向域与以下的一个或多个(例如,以下的全部)异源:
111.第一互补域;
112.连接域;
113.与所述第一互补域互补的第二互补域;
114.近端域;和
115.尾域。
116.98.前述实施方案中任一项的grna,其中所述grna具有如通过ice所测量的70-100,例如75-100、80-100、85-100、90-100或95-100,或至少70、至少75、至少80、至少85、至少90、至少95、至少99或至少100的编辑频率。
117.99.实施方案1-97中任一项的grna,其中所述grna具有如通过ice所测量的10-90,例如20-70、25-70、30-70、35-70、40-70、45-70、50-70、55-70、60-70、65-70,或至少10、至少20、至少25、至少30、至少35、至少40、至少45、至少50、至少55、至少60、至少65或至少70的编辑频率。
118.100.前述实施方案中任一项的grna,其中所述grna具有如通过ice所测量的至少80的编辑频率。
119.101.前述实施方案中任一项的grna,其中所述grna具有如通过ice所测量的0.8-1,例如0.85-1、0.9-1、0.95-1,或至少0.8,至少0.85、至少0.9、至少0.95、至少0.98、至少0.99、或至少1的编辑频率的r2值。
120.102.前述实施方案中任一项的grna,其中所述grna具有如通过ice所测量的至少0.85的编辑频率的r2值。
121.103.前述实施方案中任一项的grna,其中所述grna具有如通过ice所测量的至少
80的编辑频率和如通过ice所测量的至少0.85的编辑频率的r2值。
122.104.前述实施方案中任一项的grna,其中所述grna具有,例如,如通过sanger测序,随后ice或tide分析所测量的70-100,例如75-100、80-100、85-100、90-100、95-100,或至少70、至少75、至少80、至少85、至少90、至少95、至少99、或至少100的编辑频率。
123.105.前述实施方案中任一项的grna,其中所述grna具有,例如,如通过下一代靶向扩增子测序(扩增子测序)所测量的70-100,例如75-100、80-100、85-100、90-100、95-100,或至少70、至少75、至少80、至少85、至少90、至少95、至少99、或至少100的编辑频率。
124.106.试剂盒或组合物,其包括:
125.a)实施方案1-105中任一项的grna,或编码所述grna的核酸,和
126.b)第二grna,或编码所述第二grna的核酸。
127.107.实施方案106的试剂盒或组合物,其中所述第一grna包含靶向域,靶向域包含ggtggctattgtttgcagtg(seq id no:4)的序列。
128.108.实施方案106或107的试剂盒或组合物,其中所述第二grna靶向谱系特异性细胞表面抗原。
129.109.实施方案106-108中任一项的试剂盒或组合物,其中所述第二grna靶向除cll1之外的谱系特异性细胞表面抗原。
130.110.实施方案106-109中任一项的试剂盒或组合物,其中所述第二grna靶向cd33,例如,其中第二grna包括包含ccccaggactactcactcct(seq id no:64)的序列的靶向域。
131.111.实施方案106-110中任一项的试剂盒或组合物,其中所述第二grna靶向cd123(例如,其中所述第二grna包括包含tttcttgagctgcagctggg(seq id no:65)或agttcccacatcctggtgcg(seq id no:66)的序列的靶向域)。
132.112.实施方案106-111中任一项的试剂盒或组合物,其中所述第二grna包括包含tttcttgagctgcagctggg(seq id no:65)的序列的靶向域。
133.113.实施方案106-112中任一项的试剂盒或组合物,其中所述第二grna包括包含agttcccacatcctggtgcg(seq id no:66)的序列的靶向域。
134.114.实施方案106-113中任一项的试剂盒或组合物,其中所述第二grna包括包含表a的序列的靶向域。
135.115.实施方案106-114中任一项的试剂盒或组合物,其中所述第一grna包括包含ggtggctattgtttgcagtg(seq id no:4)的序列的靶向域,并且所述第二grna包括包含ccccaggactactcactcct(seq id no:64)的序列的靶向域。
136.116.实施方案106-115中任一项的试剂盒或组合物,其中所述第一grna包括包含ggtggctattgtttgcagtg(seq id no:4)的序列的靶向域,并且所述第二grna包括包含tttcttgagctgcagctggg(seq id no:65)的序列的靶向域。
137.117.实施方案106-116中任一项的试剂盒或组合物,其中所述第一grna包括包含ggtggctattgtttgcagtg(seq id no:4)的序列的靶向域,并且所述第二grna包括包含agttcccacatcctggtgcg(seq id no:66)的序列的靶向域。
138.118.实施方案106-117中任一项的试剂盒或组合物,其进一步包含第三grna或编码所述第三grna的核酸。
139.119.实施方案118的试剂盒或组合物,其中所述第三grna靶向谱系特异性细胞表
面抗原。
140.120.实施方案118的试剂盒或组合物,其中所述第三grna靶向cd33、cll-1或cd123。
141.121.实施方案118-120中任一项的试剂盒或组合物,其中所述第一grna包括包含ggtggctattgtttgcagtg(seq id no:4)的序列的靶向域,所述第二grna包括包含tttcttgagctgcagctggg(seq id no:65)的序列的靶向域,并且所述第三grna包括包含agttcccacatcctggtgcg(seq id no:66)的序列的靶向域。
142.122.实施方案118-120中任一项的试剂盒或组合物,其中所述第一grna包括包含ggtggctattgtttgcagtg(seq id no:4)的序列的靶向域,所述第二grna包括包含ccccaggactactcactcct(seq id no:64)的序列的靶向域,并且所述第三grna包括包含agttcccacatcctggtgcg(seq id no:66)的序列的靶向域。
143.123.实施方案118-120中任一项的试剂盒或组合物,其中所述第一grna包括包含ggtggctattgtttgcagtg(seq id no:4)的序列的靶向域,所述第二grna包括包含tttcttgagctgcagctggg(seq id no:65)的序列的靶向域,并且所述第三grna包括包含ccccaggactactcactcct(seq id no:64)的序列的靶向域。
144.124.实施方案118-123中任一项的试剂盒或组合物,其进一步包含第四grna或编码所述第四grna的核酸。
145.125.实施方案124的试剂盒或组合物,其中所述第四grna靶向谱系特异性细胞表面抗原。
146.126.实施方案124的试剂盒或组合物,其中所述第四grna靶向cd33、cll-1或cd123。
147.127.实施方案124-126中任一项的试剂盒或组合物,其中(a)的所述grna包括包含ggtggctattgtttgcagtg(seq id no:4)的序列的靶向域,所述第二grna包括包含tttcttgagctgcagctggg(seq id no:65)的序列的靶向域,所述第三grna包括包含agttcccacatcctggtgcg(seq id no:66)的序列的靶向域,并且所述第四grna包括包含ccccaggactactcactcct(seq id no:64)的序列的靶向域。
148.128.实施方案124-127中任一项的试剂盒或组合物,其中将(a)的所述grna、所述第二grna、所述第三grna和所述第四grna混合。
149.129.实施方案124-127中任一项的试剂盒或组合物,其中(a)的所述grna、所述第二grna、所述第三grna和所述第四grna在分开的容器中。
150.130.实施方案106-129中任一项的试剂盒或组合物,其中将(a)和(b)混合。
151.131.实施方案106-129中任一项的试剂盒或组合物,其中(a)和(b)在分开的容器中。
152.132.实施方案106-131中任一项的试剂盒或组合物,其中(a)的所述核酸和(b)的所述核酸是相同核酸的部分。
153.133.实施方案106-131中任一项的试剂盒或组合物,其中(a)的所述核酸和(b)的所述核酸是分开的核酸。
154.134.经遗传工程化改造的造血细胞(例如,造血干细胞或祖细胞),其包括:
155.(a)在表1的靶域(例如,seq id no:1-20或40-43中任一个的靶域)处的突变;和
156.(b)编码除cll1以外的谱系特异性细胞表面抗原的基因的第二突变。
157.135.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在seq id no:1的靶域处。
158.136.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在seq id no:2的靶域处。
159.137.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在seq id no:3的靶域处。
160.138.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在seq id no:4的靶域处。
161.139.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在seq id no:5的靶域处。
162.140.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在seq id no:6的靶域处。
163.141.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在seq id no:7的靶域处。
164.142.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在seq id no:8的靶域处。
165.143.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在seq id no:9的靶域处。
166.144.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在seq id no:10的靶域处。
167.145.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在seq id no:40的靶域处。
168.146.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在seq id no:42的靶域处。
169.147.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在seq id no:98的靶域处。
170.148.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在seq id no:119的靶域处。
171.149.实施方案134的经遗传工程化改造的造血细胞,其中(a)的所述突变在表2或6中任一个的靶域处。
172.150.实施方案134-149中任一项的经遗传工程化改造的造血细胞,其中(a)的所述突变包括插入、缺失或取代(例如,单核苷酸变体)。
173.151.实施方案134-149中任一项的经遗传工程化改造的造血细胞,其包含cll1中1nt的插入,或1nt、2nt、3nt或4nt的缺失。
174.152.实施方案134-151中任一项的经遗传工程化改造的造血细胞,其包含如本文所述的插入/缺失,例如由本文所述的grna(例如,grna d、grna f、grna g、grna o2或grna p2中的任何)产生或可由本文所述的grna产生的插入/缺失。
175.153.实施方案134-152中任一项的经遗传工程化改造的造血细胞,其包含由本文
所述的crispr系统产生或可由本文所述的crispr系统产生的插入/缺失,例如实施例1、2、3、4或5的方法。
176.154.实施方案150-153中任一项的经遗传工程化改造的细胞,其中所述缺失完全在seq id no:1-10中任一个的靶域内。
177.155.实施方案154的经遗传工程化改造的细胞,其中所述缺失的长度为1、2、4、5、7、8、10、11、13、14、16或17个核苷酸。
178.156.实施方案150-153中任一项的经遗传工程化改造的细胞,其中所述缺失具有在seq id no:1-10中任一个的靶域之外的一个或两个端点。
179.157.实施方案134-156中任一项的经遗传工程化改造的细胞,其中所述突变导致移码。
180.158.实施方案134-157中任一项的经遗传工程化改造的造血细胞,其中所述第二突变包括插入、缺失或取代(例如,单核苷酸变体)。
181.159.实施方案1-105中任一项的grna或实施方案106-133中任一项的组合物或试剂盒的grna用于使用crispr/cas9系统降低造血干细胞或祖细胞样品中cll1表达的用途。
182.160.crispr/cas9系统用于降低造血干细胞或祖细胞样品中cll1表达的用途,其中所述crispr/cas9系统的grna是实施方案1-105中任一项的grna,或实施方案106-133中任一项的组合物或试剂盒的grna。
183.161.产生经遗传工程化改造的细胞的方法,其包括:
184.(i)提供细胞(例如,造血干细胞或祖细胞,例如,野生型造血干细胞或祖细胞),和
185.(ii)将(a)实施方案1-105中任一项的向导rna(grna)或实施方案106-133中任一项的组合物或试剂盒的grna;和(b)结合所述grna的内切核酸酶(例如cas9分子)引入所述细胞,
186.从而产生所述经遗传工程化改造的细胞。
187.162.产生经遗传工程化改造的细胞的方法,其包括:
188.(i)提供细胞(例如,造血干细胞或祖细胞,例如,野生型造血干细胞或祖细胞),和
189.(ii)将(a)实施方案1-105中任一项的grna或实施方案106-133中任一项的组合物或试剂盒的grna;和(b)结合所述grna的cas9分子引入所述细胞,
190.从而产生所述经遗传工程化改造的细胞。
191.163.实施方案159-162中任一项的方法或用途,其导致所述经遗传工程化改造的造血干细胞或祖细胞与野生型对应细胞相比具有降低的cll1表达水平。
192.164.实施方案159-163中任一项的方法或用途,其导致所述经遗传工程化改造的造血干细胞或祖细胞具有降低的cll1表达水平,其低于野生型对应细胞中cll1水平的20%。
193.165.实施方案159-164中任一项的方法或用途,其在多个造血干细胞或祖细胞上进行。
194.166.实施方案159-165中任一项的方法或用途,其在包含多个造血干细胞和多个造血祖细胞的细胞群上进行。
195.167.实施方案159-166中任一项的方法或用途,其产生根据实施方案285-383中任一项的细胞群。
196.168.实施方案161-167中任一项的方法,其中(a)和(b)的所述核酸在引入所述细胞中的一个载体上编码。
197.169.实施方案168的方法,其中所述载体是病毒载体。
198.170.实施方案169的方法,其中将(a)和(b)作为预先形成的核糖核蛋白复合物引入所述细胞中。
199.171.实施方案170的方法,其中所述核糖核蛋白复合物通过电穿孔引入所述细胞。
200.172.实施方案161-168中任一项的方法,其中通过将编码所述内切核酸酶的核酸分子(例如,mrna分子或病毒载体,例如,aav)递送到所述细胞中来将所述内切核酸酶(例如,cas9分子)引入所述细胞中。
201.173.实施方案161-172中任一项的方法,其中所述细胞(例如,造血干细胞或祖细胞)是cd34 。
202.174.实施方案161-173中任一项的方法,其中在将所述grna引入所述细胞后48小时,所述细胞群的细胞存活力是对照细胞(例如,模拟电穿孔细胞)的细胞存活力的至少80%、90%、95%或98%。
203.175.实施方案161-174中任一项的方法,其中在将所述grna引入所述细胞后48小时,所述群体中至少80%、85%、90%、95%或98%的细胞是可存活的。
204.176.实施方案161-175中任一项的方法,其中所述造血干细胞或祖细胞来自受试者的骨髓细胞或外周血单个核细胞(pbmc)。
205.177.实施方案161-176中任一项的方法,其中所述受试者患有造血病症,例如造血恶性病,例如白血病,例如aml。
206.178.实施方案161-176中任一项的方法,其中所述受试者患有血液病症,例如癌前状况,例如骨髓增生异常、骨髓增生异常综合征(mds)或白血病前期。
207.179.实施方案161-177中任一项的方法,其中所述受试者患有癌症,其中所述癌症的细胞表达cll1(例如,其中至少多个癌细胞表达cll1)。
208.180.实施方案159-179中任一项的方法或用途,其导致与野生型对应细胞相比引起cll1表达水平降低的突变。
209.181.实施方案159-180中任一项的方法或用途,其导致与野生型对应细胞相比引起野生型cll1表达水平降低的突变。
210.182.实施方案159-181中任一项的方法或用途,其产生与野生型对应细胞相比具有降低的cll1表达水平的经遗传工程化改造的造血干细胞或祖细胞。
211.183.实施方案159-182中任一项的方法或用途,其产生与野生型对应细胞相比具有降低的野生型cll1表达水平的经遗传工程化改造的造血干细胞或祖细胞。
212.184.经遗传工程化改造的造血干细胞或祖细胞,其通过实施方案159-183中任一项的方法产生。
213.185.编码实施方案1-105中任一项的grna的核酸(例如dna)。
214.186.经遗传工程化改造的细胞(例如,造血干细胞或祖细胞),其包含在表1的靶域(例如,seq id no:1-20中任一个的靶域)处的突变,例如,其中所述突变是遗传工程的结果。
215.187.经遗传工程化改造的细胞(例如,造血干细胞或祖细胞),其包含在表8的靶域
(例如,seq id no:1-10、40、42、98或119中任一个的靶域)处的突变,例如,其中所述突变是遗传工程的结果。
216.188.经遗传工程化改造的细胞(例如,造血干细胞或祖细胞),其包含在表6的靶域(例如,seq id no:67-177中任一个的靶域)处的突变,例如,其中所述突变是遗传工程的结果。
217.189.经遗传工程化改造的细胞(例如,造血干细胞或祖细胞),其包含在表1的靶域(例如,seq id no:1-20或40-43中任一个的靶域)的(上游或下游)100、90、80、70、60、50、40、30、20或10个核苷酸内的突变。
218.190.经遗传工程化改造的细胞(例如,造血干细胞或祖细胞),其包含在表6的靶域(例如,seq id no:67-177中任一个的靶域)的(上游或下游)100、90、80、70、60、50、40、30、20或10个核苷酸内的突变。
219.191.经遗传工程化改造的细胞(例如,造血干细胞或祖细胞),其包含在表8的靶域(例如,seq id no:1-10、40、42、98或119中任一个的靶域)的(上游或下游)100、90、80、70、60、50、40、30、20或10个核苷酸内的突变。
220.192.实施方案198的经遗传工程化改造的细胞,其中所述突变在seq id no:4、6或7中任一个的(上游或下游)100、90、80、70、60、50、40、30、20或10个核苷酸内。
221.193.实施方案198的经遗传工程化改造的细胞,其中所述突变在seq id no:4的下游100、90、80、70、60、50、40、30、20或10个核苷酸内。
222.194.实施方案198的经遗传工程化改造的细胞,其中所述突变在seq id no:4的上游100、90、80、70、60、50、40、30、20或10个核苷酸内。
223.195.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:1的靶域处的突变。
224.196.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:1的靶域处的突变,其中与野生型对应细胞相比,所述突变导致cll1的表达水平降低。
225.197.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:1的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞中cll1水平的20%。
226.198.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:2的靶域处的突变。
227.199.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:2的靶域处的突变,其中与野生型对应细胞相比,所述突变导致cll1的表达水平降低。
228.200.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:2的靶域处的突变,其中突变导致降低的cll1表达水平,其低于野生型对应细胞中cll1水平的20%。
229.201.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:3的靶域处的突变。
230.202.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:3的靶域处的突变,其中与野生型对应细胞相比,所述突变导致cll1的表达水平降低。
231.203.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:3的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞中cll1水平的
20%。
232.204.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:4的靶域处的突变。
233.205.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:4的靶域处的突变,其中与野生型对应细胞相比,所述突变导致cll1的表达水平降低。
234.206.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:4的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞中cll1水平的20%。
235.207.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:5的靶域处的突变。
236.208.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:5的靶域处的突变,其中与野生型对应细胞相比,所述突变导致cll1的表达水平降低。
237.209.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:5的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞中cll1水平的20%。
238.210.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:6的靶域处的突变。
239.211.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:6的靶域处的突变,其中与野生型对应细胞相比,所述突变导致cll1的表达水平降低。
240.212.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:6的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞中cll1水平的20%。
241.213.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:7的靶域处的突变。
242.214.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:7的靶域处的突变,其中与野生型对应细胞相比,所述突变导致cll1的表达水平降低。
243.215.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:7的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞中cll1水平的20%。
244.216.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:8的靶域处的突变。
245.217.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:8的靶域处的突变,其中与野生型对应细胞相比,所述突变导致cll1的表达水平降低。
246.218.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:8的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞中cll1水平的20%。
247.219.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:9的靶域处的突变。
248.220.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:9的靶域处
的突变,其中与野生型对应细胞相比,所述突变导致cll1的表达水平降低。
249.221.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:9的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞中cll1水平的20%。
250.222.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:10的靶域处的突变。
251.223.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:10的靶域处的突变,其中与野生型对应细胞相比,所述突变导致cll1的表达水平降低。
252.224.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:10的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞中cll1水平的20%。
253.225.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:40的靶域处的突变。
254.226.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:40的靶域处的突变,其中与野生型对应细胞相比,所述突变导致cll1的表达水平降低。
255.227.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:40的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞中cll1水平的20%。
256.228.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:42的靶域处的突变。
257.229.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:42的靶域处的突变,其中与野生型对应细胞相比,所述突变导致cll1的表达水平降低。
258.230.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:42的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞中cll1水平的20%。
259.231.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:119的靶域处的突变。
260.232.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:119的靶域处的突变,其中与野生型对应细胞相比,所述突变导致cll1的表达水平降低。
261.233.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:119的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞中cll1水平的20%。
262.234.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:98的靶域处的突变。
263.235.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:98的靶域处的突变,其中与野生型对应细胞相比,所述突变导致cll1的表达水平降低。
264.236.经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:98的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞中cll1水平的20%。
265.237.实施方案186-236中任一项的经遗传工程化改造的细胞,包含预测的脱靶位点,其相对于cll1基因编辑之前的所述位点的序列不包含突变或序列变化。
266.238.实施方案186-237中任一项的经遗传工程化改造的细胞,包含两个预测的脱靶位点,其相对于cll1基因编辑之前的所述位点的序列不包含突变或序列变化。
267.239.实施方案186-238中任一项的经遗传工程化改造的细胞,其包含至少3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个预测的脱靶位点,其相对于cll1基因编辑之前的所述位点的序列不包含突变或序列变化。
268.240.前述实施方案中任一项的经遗传工程化改造的细胞,其不包含在任何预测的脱靶位点中的突变,例如相对于所述靶域具有1、2、3或4个错配的人基因组中的任何位点。
269.241.前述实施方案中任一项的经遗传工程化改造的细胞,其不包含相对于所述靶域具有1个错配的人基因组中的任何位点中的突变。
270.242.前述实施方案中任一项的经遗传工程化改造的细胞,其不包含相对于所述靶域具有1或2个错配的人基因组中的任何位点中的突变。
271.243.前述实施方案中任一项的经遗传工程化改造的细胞,其不包含相对于所述靶域具有1、2或3个错配的人基因组中的任何位点中的突变。
272.244.前述实施方案中任一项的经遗传工程化改造的细胞,其不包含相对于所述靶域具有1、2、3或4个错配的人基因组中的任何位点中的突变。
273.245.实施方案184或186-244中任一项的经遗传工程化改造的细胞,其中所述突变包括插入、缺失或取代(例如,单核苷酸变体)。
274.246.实施方案245的经遗传工程化改造的细胞,其中所述缺失完全在seq id no:1-20、40-43、98或119中任一个的靶域内。
275.247.实施方案246的经遗传工程化改造的细胞,其中所述缺失的长度为1、2、4、5、7、8、10、11、13、14、16或17个核苷酸。
276.248.实施方案167的经遗传工程化改造的细胞,其中所述缺失具有在seq id no:1-20、40-43、98或119中任一个的靶域之外的一个或两个端点。
277.249.实施方案184或186-248中任一项的经遗传工程化改造的细胞,其中所述突变导致移码。
278.250.实施方案184或186-249中任一项的经遗传工程化改造的细胞(例如,造血干细胞或祖细胞),其中与野生型对应细胞相比,所述突变导致野生型cll1的表达水平降低(例如,低于所述野生型对应细胞中水平的50%、40%、30%、20%、15%、10%或5%)。
279.251.实施方案184或186-250中任一项的经遗传工程化改造的细胞,其中与野生型对应细胞相比,所述细胞具有降低的野生型cll1蛋白水平(例如,低于所述野生型对应细胞中水平的50%、40%、30%、20%、15%、10%或5%)。
280.252.实施方案184或186-251中任一项的经遗传工程化改造的细胞,其不表达cll1。
281.253.前述实施方案中任一项的经遗传工程化改造的细胞(例如,造血干细胞或祖细胞),其中所述突变导致cll1的表达缺乏。
282.254.前述实施方案中任一项的经遗传工程化改造的细胞(例如,造血干细胞或祖细胞),其表达低于20%的野生型对应细胞所表达的cll1。
283.255.前述实施方案中任一项的经遗传工程化改造的细胞(例如,造血干细胞或祖细胞),其中表达水平降低的cll1在从所述造血干细胞或祖细胞分化(例如,终末分化)的细胞中,并且所述野生型对应细胞是从野生型造血干细胞或祖细胞分化(例如,终末分化)的细胞。
284.256.实施方案255的经遗传工程化改造的细胞(例如,造血干细胞或祖细胞),其中所述从造血干细胞或祖细胞分化的细胞是成髓细胞、单核细胞或髓样树突状细胞。
285.257.实施方案184或186-256中任一项的经遗传工程化改造的细胞,其是cd34 。
286.257.实施方案184或186-257中任一项的经遗传工程化改造的细胞,其来自受试者的骨髓细胞或外周血单个核细胞。
287.259.实施方案258的经遗传工程化改造的细胞,其中所述受试者是患有造血恶性病例如aml的人患者。
288.260.实施方案258的经遗传工程化改造的细胞,其中所述受试者是患有血液病症,例如,癌前状况,例如骨髓增生异常、骨髓增生异常综合征(mds)或白血病前期的人患者。
289.261.实施方案258-260中任一项的经遗传工程化改造的细胞,其中所述受试者患有癌症,其中所述癌症的细胞表达cll1(例如,其中至少多个癌细胞表达cll1)。
290.262.实施方案258的经遗传工程化改造的细胞,其中所述受试者是健康人供体(例如,hla匹配供体)。
291.263.实施方案184或186-262中任一项的经遗传工程化改造的细胞,其进一步包含选自crispr内切核酸酶、锌指核酸酶(zfn)、基于转录激活因子样效应物的核酸酶(talen)或大范围核酸酶的核酸酶,或编码所述核酸酶的核酸(例如,dna或rna),其中任选地,所述核酸酶对cll1具有特异性。
292.264.实施方案184或186-263中任一项的经遗传工程化改造的细胞,其进一步包含对cll1具有特异性的grna(例如,单一向导rna),或编码所述grna的核酸。
293.265.实施方案264的经遗传工程化改造的细胞,其中所述grna是本文所述的grna,例如实施方案1-105中任一项的grna。
294.266.实施方案184或186-265中任一项的经遗传工程化改造的细胞,其通过包括使所述细胞与选自crispr内切核酸酶、锌指核酸酶(zfn)、基于转录激活因子样效应物的核酸酶(talen)或大范围核酸酶的核酸酶接触的过程(例如,通过使所述细胞与所述核酸酶或编码所述核酸酶的核酸接触)来制备。
295.267.实施方案184或186-266中任一项的经遗传工程化改造的细胞,其通过包括使所述细胞与切口酶或无催化活性的cas9分子(dcas9)(例如,与功能域融合)接触的过程(例如,通过使所述细胞与所述核酸酶或编码所述核酸酶的核酸接触)来制备。
296.268.实施方案184或186-267中任一项的经遗传工程化改造的细胞,其中cll1的两个拷贝均是突变的。
297.269.实施方案286的经遗传工程化改造的细胞,其中cll1的两个拷贝具有相同的突变。
298.270.实施方案286的经遗传工程化改造的细胞,其中cll1的拷贝具有不同的突变。
299.271.实施方案184或186-186中任一项的经遗传工程化改造的细胞,其包含具有第一突变的cll1的第一拷贝和具有第二突变的cll1的第二拷贝,其中所述第一和第二突变不
id no:2的靶域处的突变。
318.290.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其在seq id no:2的靶域处包含突变,其中与野生型对应细胞群相比,所述突变导致cll1的表达水平降低。
319.291.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:2的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞群中cll1水平的20%。
320.292.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:3的靶域处的突变。
321.293.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其在seq id no:3的靶域处包含突变,其中与野生型对应细胞群相比,所述突变导致cll1的表达水平降低。
322.294.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:3的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞群中cll1水平的20%。
323.295.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:4的靶域处的突变。
324.296.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其在seq id no:4的靶域处包含突变,其中与野生型对应细胞群相比,所述突变导致cll1的表达水平降低。
325.297.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:4的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞群中cll1水平的20%。
326.298.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:5的靶域处的突变。
327.299.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其在seq id no:5的靶域处包含突变,其中与野生型对应细胞群相比,所述突变导致cll1的表达水平降低。
328.300.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:5的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞群中cll1水平的20%。
329.301.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:6的靶域处的突变。
330.302.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其在seq id no:6的靶域处包含突变,其中与野生型对应细胞群相比,所述突变导致cll1的表达水平降低。
331.303.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:6的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞群中cll1水平的20%。
332.304.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:7的靶域处的突变。
333.305.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其在seq id no:7的靶域处包含突变,其中与野生型对应细胞群相比,所述突变导致cll1的表达水平降低。
334.306.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:7的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞群中cll1水平的20%。
335.307.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:8的靶域处的突变。
336.308.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其在seq id no:8的靶域处包含突变,其中与野生型对应细胞群相比,所述突变导致cll1的表达水平降低。
337.309.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:8的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞群中cll1水平的20%。
338.310.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:9的靶域处的突变。
339.311.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其在seq id no:9的靶域处包含突变,其中与野生型对应细胞群相比,所述突变导致cll1的表达水平降低。
340.312.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:9的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞群中cll1水平的20%。
341.313.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:10的靶域处的突变。
342.314.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其在seq id no:10的靶域处包含突变,其中与野生型对应细胞群相比,所述突变导致cll1的表达水平降低。
343.315.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:10的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细胞群中cll1水平的20%。
344.316.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:40的靶域处的突变。
345.317.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其在seq id no:40的靶域处包含突变,其中与野生型对应细胞群相比,所述突变导致cll1的表达水平降低。
346.318.细胞群,其包含多个经遗传工程化改造的造血干细胞或祖细胞,其包含在seq id no:40的靶域处的突变,其中所述突变导致降低的cll1表达水平,其低于野生型对应细
5%、5-10%、10-15%或15-20%的细胞是cll1纯合野生型,例如,是cll1纯合野生型的造血干细胞或祖细胞。
362.334.实施方案285-333中任一项的细胞群,其进一步包含是cll1杂合的一个或多个细胞,例如,包含cll1的一个野生型拷贝和cll1的一个突变拷贝。
363.335.实施方案285-334中任一项的细胞群,其中所述群体中约0-1%、1-2%、2-5%、5-10%、10-15%或15-20%的细胞是cll1的杂合野生型,例如,是包含cll1的一个野生型拷贝和cll1的一个突变拷贝的造血干细胞或祖细胞。
364.336.实施方案285-335中任一项的细胞群,其中所述群体中至少40%、50%、60%、70%、75%、80%、85%、90%或95%的cll1拷贝是突变的。
365.337.实施方案285-336中任一项的细胞群,其包含多个不同的cll1突变,例如,其包含至少2、3、4、5、6、7、8、9或10个不同的突变。
366.338.实施方案285-337中任一项的细胞群,其包含至少2、3、4、5、6、7、8、9或10个不同的突变。
367.339.实施方案285-338中任一项的细胞群,其包含2、3、4、5、6、7、8、9或10个不同的插入。
368.340.实施方案285-339中任一项的细胞群,其包含多个插入和多个缺失。
369.341.实施方案285-340中任一项的细胞群,其表达低于20%的由野生型对应细胞群所表达的cll1。
370.342.实施方案285-341中任一项的细胞群,其中表达水平降低的cll1在从所述造血干细胞或祖细胞分化(例如,终末分化)的细胞中,并且所述野生型对应细胞是从野生型造血干细胞或祖细胞分化(例如,终末分化)的细胞。
371.343.实施方案342的细胞群,其中所述从造血干细胞或祖细胞分化的细胞是成髓细胞、单核细胞或髓样树突状细胞。
372.344.实施方案285-343中任一项的细胞群,其当施用于受试者时,在所述受试者中产生hcd45 细胞,例如,当在施用后16周测定时。
373.345.实施方案344的细胞群,其产生的hcd45 细胞的水平与用cll1野生型的其他方面相似细胞群产生的hcd45 细胞的水平相当。
374.346.实施方案344或345的细胞群,其产生的hcd45 细胞的水平是由cll1野生型的其他方面相似的细胞群产生的hcd45 细胞的水平的至少70%、80%、85%、90%或95%。
375.347.实施方案285-346中任一项的细胞群,其当施用于受试者时,在所述受试者中产生hcd34 细胞,例如,当在施用后16周测定时。
376.348.实施方案347的细胞群,其产生的hcd34 细胞的水平与用cll1野生型的其他方面相似细胞群产生的hcd34 细胞的水平相当。
377.349.实施方案347或348的细胞群,其产生的hcd34 细胞的水平是由cll1野生型的其他方面相似的细胞群产生的hcd34 细胞的水平的至少70%、80%、85%、90%或95%。
378.350.实施方案285-349中任一项的细胞群,其在施用于受试者时,在所述受试者中产生肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞、普通树突状细胞(cdc)、浆细胞样树突状细胞(pdc)、嗜中性粒细胞、单核细胞、t细胞、b细胞或其任何组合,例如,当在施用后16周测定时。
379.351.实施方案350的细胞群,其产生的肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞、普通树突状细胞(cdc)、浆细胞样树突状细胞(pdc)、嗜中性粒细胞、单核细胞、t细胞、b细胞或其任何组合的水平与由cll1野生型的其他方面相似细胞群产生的所述细胞类型的水平相当。
380.352.实施方案350或351的细胞群,其产生的肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞、普通树突状细胞(cdc)、浆细胞样树突状细胞(pdc)、嗜中性粒细胞、单核细胞、t细胞、b细胞或其任何组合的水平是由cll1野生型的其他方面相似细胞群产生的所述细胞类型的水平的至少70%、80%、85%、90%或95%。
381.353.实施方案350-352中任一项的细胞群,其中在从所述受试者获得的血液样品、骨髓样品或脾样品中检测产生的细胞。
382.354.实施方案285-353中任一项的细胞群,其当施用于受试者时,在所述受试者中持续至少8、12或16周。
383.355.实施方案285-354中任一项的细胞群,其在施用于受试者时提供多谱系造血重建(multilineage hematopoietic reconstitution)。
384.356.实施方案285-355中任一项的细胞群,其产生cd14 细胞,例如,当在遗传工程后7或14天测定时。
385.357.实施方案356的细胞群,其产生的cd14 细胞的水平与用cll1野生型的其他方面相似细胞群产生的cd14 细胞的水平相当。
386.358.实施方案356或357的细胞群,其产生的cd14 细胞的水平是由cll1野生型的其他方面相似的细胞群产生的cd14 细胞的水平的至少70%、80%、85%、90%或95%。
387.359.实施方案356-358中任一项的细胞群,其中在髓样分化培养基中体外培养后测定cd14 水平。
388.360.实施方案285-359中任一项的细胞群,其产生cd11b 细胞,例如,当在遗传工程后7或14天测定时。
389.361.实施方案360的细胞群,其产生的cd11b 细胞的水平与用cll1野生型的其他方面相似细胞群产生的cd11b 细胞的水平相当。
390.362.实施方案360或361的细胞群,其产生的cd11b 细胞的水平是由cll1野生型的其他方面相似的细胞群产生的cd11b 细胞的水平的至少70%、80%、85%、90%或95%。
391.363.实施方案356-362中任一项的细胞群,其中在髓样分化培养基中体外培养后测定cd15 水平。
392.364.实施方案285-362中任一项的细胞群,其产生cd15 细胞,例如,当在遗传工程后7或14天测定时。
393.365.实施方案364的细胞群,其产生的cd15 细胞的水平与用cll1野生型的其他方面相似细胞群产生的cd11b 细胞的水平相当。
394.366.实施方案364或365的细胞群,其产生的cd15 细胞的水平是由cll1野生型的其他方面相似的细胞群产生的cd15 细胞的水平的至少70%、80%、85%、90%或95%。
395.367.实施方案356-366中任一项的细胞群,其中在髓样分化培养基中体外培养后测定cd15 水平。
396.368.实施方案285-367中任一项的细胞群,其中所述细胞群中cll1中最丰富的突
变是缺失,例如1nt、2nt、3nt或4nt的缺失。
397.369.实施方案285-367中任一项的细胞群,其中所述细胞群中cll1中最丰富的突变是插入,例如1nt的插入。
398.370.实施方案285-368中任一项的细胞群,其中cll1中seq id no:16的序列内的所述细胞群中最丰富的突变是缺失,例如1nt的缺失。
399.371.实施方案285-370的细胞群,其进一步包含cll1拷贝中seq id no:16的序列内的2nt缺失或1nt插入之一或两者。
400.372.实施方案285-368中任一项的细胞群,其中cll1中seq id no:14序列内的所述细胞群中最丰富的突变是插入,例如1nt的插入。
401.373.实施方案285-368或224aa的细胞群,其进一步包含cll1拷贝中seq id no:14的序列内的1nt缺失。
402.374.实施方案188-368中任一项的细胞群,其中cll1中seq id no:17序列内的所述细胞群中最丰富的突变是缺失,例如2nt的缺失。
403.375.实施方案285-368或374的细胞群,其进一步包含cll1拷贝中seq id no:17的序列内的1nt插入。
404.376.实施方案285-368中任一项的细胞群,其中cll1中seq id no:17的序列内的所述细胞群中最丰富的突变是插入,例如1nt的插入。
405.377.实施方案285-368或376的细胞群,其进一步包含cll1拷贝中seq id no:40的序列内的2nt缺失。
406.378.实施方案285-368中任一项的细胞群,其中cll1中seq id no:43的序列内的所述细胞群中最丰富的突变是缺失,例如1nt的缺失。
407.379.实施方案285-368或378的细胞群,其进一步包含cll1拷贝中seq id no:43的序列内的1nt插入。
408.380.实施方案285-379中任一项的细胞群,其包含造血干细胞和造血祖细胞。
409.381.实施方案285-380中任一项的细胞群,其中所述群体中至少80%、85%、90%、95%或98%的细胞是可存活的。
410.382.实施方案285-381中任一项的细胞群,其中cll1的至少50%、60%、70%、80%或90%的拷贝包含突变。
411.383.实施方案285-382中任一项的细胞群,其中所述群体中至少50%、60%、65%、70%、75%、80%、85%、90%或95%的细胞对cll1的细胞表面表达呈阴性,例如,使用对cll1细胞表面表达的流式细胞术测定。
412.384.药物组合物,其包含实施方案184或186-284中任一项的经遗传工程化改造的造血干细胞或祖细胞。
413.385.药物组合物,其包含实施方案285-383中任一项的细胞群。
414.386.混合物,例如反应混合物,其包含:
415.a)实施方案1-105中任一项的grna或实施方案106-133中任一项的组合物或试剂盒的grna;和
416.b)细胞,例如造血细胞,例如hsc或hpc,例如实施方案184或186-284中任一项的经遗传工程化改造的细胞。
417.387.实施方案386的混合物,其中所述细胞是野生型细胞或在cll1中具有突变的细胞。
418.388.试剂盒,包含以下的任何两种或更多种(例如,三种或全部):
419.a)实施方案1-105中任一项的grna,或实施方案106-133中任一项的组合物或试剂盒的grna;
420.b)细胞,例如造血细胞,例如hsc或hpc,例如实施方案184或186-284中任一项的经遗传工程化改造的细胞;
421.c)cas9分子;和
422.d)靶向cll1的药剂,例如,如本文所述的药剂。
423.389.实施方案388的试剂盒,其包含(a)和(b)、(a)和(c)、(a)和d)、(b)和(c)、(b)和(d),或(c)和(d)。
424.390.制备实施方案184或186-284中任一项的经遗传工程化改造的细胞(例如,造血干细胞或祖细胞)或实施方案285-383中任一项的细胞群的方法,其包括:
425.(i)提供细胞(例如,造血干细胞或祖细胞,例如,野生型造血干细胞或祖细胞),和
426.(ii)将切割所述靶域的核酸酶(例如,内切核酸酶)引入所述细胞中,
427.从而产生经遗传工程化改造的造血干细胞或祖细胞。
428.391.实施方案390的方法,其中(ii)包括将结合所述靶域的grna(例如实施方案1-105中任一项的grna)和结合所述grna的内切核酸酶引入所述细胞。
429.392.实施方案390的方法,其中所述内切核酸酶是zfn、talen或大范围核酸酶。
430.393.向受试者供应hsc、hpc或hspc的方法,其包括向所述受试者施用实施方案184或186-284中任一项的多个细胞,或实施方案285-383中任一项的细胞群。
431.394.方法,其包括向有此需要的受试者施用实施方案184或186-284中任一项的多个细胞,或实施方案285-383中任一项的细胞群。
432.395.实施方案393或394的方法,其中所述受试者患有癌症,其中所述癌症的细胞表达cll1(例如,其中至少多个癌细胞表达cll1)。
433.396.实施方案393-395中任一项的方法,其进一步包括向所述受试者施用有效量的靶向cll1的药剂,并且其中所述药剂包含结合cll1的抗原结合片段。
434.397.实施方案396的方法,其中所述靶向cll1的药剂是表达嵌合抗原受体(car)的免疫细胞,其包含所述结合cll1的抗原结合片段。
435.398.实施方案184或186-284中任一项的经遗传工程化改造的造血干细胞或祖细胞或实施方案285-383中任一项的细胞群,其用于治疗造血病症,其中所述治疗包括向有此需要的受试者施用有效量的所述经遗传工程化改造的造血干细胞或祖细胞或所述细胞群,并且进一步包括向所述受试者施用有效量的靶向cll1的药剂,其中所述药剂包含结合cll1的抗原结合片段。
436.399.靶向cll1的药剂,其中所述药剂包含结合cll1的抗原结合片段,其用于治疗造血病症,其中所述治疗包括向有此需要的受试者施用有效量的所述靶向cll1的药剂,并且进一步包括向所述受试者施用有效量的实施方案184或186-284中任一项的经遗传工程化改造的造血干细胞或祖细胞或实施方案285-383中任一项的细胞群。
437.400.实施方案184或186-284中任一项的经遗传工程化改造的造血干细胞或祖细
胞或实施方案285-383中任一项的细胞群和靶向cll1的药剂的组合,其中所述药剂包含结合cll1的抗原结合片段,其用于治疗造血病症,其中所述治疗包括向有此需要的受试者施用有效量的所述经遗传工程化改造的造血干细胞或祖细胞或所述细胞群,和所述结合cll1的药剂。
438.401.实施方案184或186-284中任一项的经遗传工程化改造的造血干细胞或祖细胞或实施方案285-384中任一项的细胞群,其用于癌症免疫疗法。
439.402.实施方案184或186-284中任一项的经遗传工程化改造的造血干细胞或祖细胞或实施方案285-384中任一项的细胞群,其用于癌症免疫疗法,其中所述受试者患有造血病症。
440.403.实施方案184或186-284中任一项的经遗传工程化改造的造血干细胞或祖细胞或实施方案285-384中任一项的细胞群,其用于患有造血病症的受试者的造血再增殖。
441.404.实施方案184或186-284中任一项的经遗传工程化改造的造血干细胞或祖细胞或实施方案285-384中任一项的细胞群,其用于治疗造血病症的方法,由此本文所述的经遗传工程化改造的造血干细胞或祖细胞或本文所述的细胞群使所述受试者再增殖。
442.405.实施方案184或186-284中任一项的经遗传工程化改造的造血干细胞或祖细胞或实施方案285-384中任一项的细胞群,其用于降低免疫疗法中靶向cll1的药剂的细胞毒性作用。
443.406.实施方案184或186-284中任一项的经遗传工程化改造的造血干细胞或祖细胞或实施方案285-384中任一项的细胞群,其用于使用靶向cll1的药剂的免疫治疗方法,由此本文所述的经遗传工程化改造的造血干细胞或祖细胞或本文所述的细胞群降低靶向cll1的药剂的细胞毒性作用。
444.407.实施方案285-384中任一项的方法、细胞、药剂或组合,其中所述经遗传工程化改造的造血干细胞或祖细胞或所述细胞群与所述靶向cll1的药剂同时施用。
445.408.实施方案393-407中任一项的方法、细胞、药剂或组合,其中在所述靶向cll1的药剂之前施用所述经遗传工程化改造的造血干细胞或祖细胞或所述细胞群。
446.409.实施方案393-408中任一项的方法、细胞、药剂或组合,其中在所述经遗传工程化改造的造血干细胞或祖细胞或所述细胞群之前施用所述靶向cll1的药剂。
447.410.实施方案393-409中任一项的方法、细胞、药剂或组合,其中所述免疫细胞是t细胞。
448.411.实施方案393-410中任一项的方法、细胞、药剂或组合,其中所述免疫细胞、所述经遗传工程化改造的造血干细胞和/或祖细胞或两者是同种异体的。
449.412.实施方案393-411中任一项的方法、细胞、药剂或组合,其中所述免疫细胞、所述经遗传工程化改造的造血干细胞和/或祖细胞或两者是自体的。
450.413.实施方案393-412中任一项的方法、细胞、药剂或组合,其中所述嵌合受体中的抗原结合片段是特异性结合人cll1的单链抗体片段(scfv)。
451.414.实施方案393-412中任一项的方法、细胞、药剂或组合,其中所述造血病症是癌症,并且其中所述癌症中的至少多个癌细胞表达cll1。
452.415.实施方案393-414中任一项的方法、细胞、药剂或组合,其中所述受试者患有造血恶性病,例如选自霍奇金淋巴瘤、非霍奇金淋巴瘤、白血病(例如急性髓样白血病、急性
淋巴样白血病、慢性髓性白血病、急性淋巴母细胞性白血病或慢性淋巴母细胞性白血病和慢性淋巴样白血病)或多发性骨髓瘤的造血恶性病。
453.416.实施方案393-415中任一项的方法、细胞、药剂或组合,其中所述受试者患有血液病症,例如癌前状况,例如骨髓增生异常、骨髓增生异常综合征(mds)或白血病前期。
454.以上概述旨在以非限制性方式说明本文所公开的技术的一些实施方案、优点、特征和用途。本文所公开的技术的其他实施方案、优点、特征和用途将从详述、附图、实施例和权利要求中显而易见。
455.附图简述
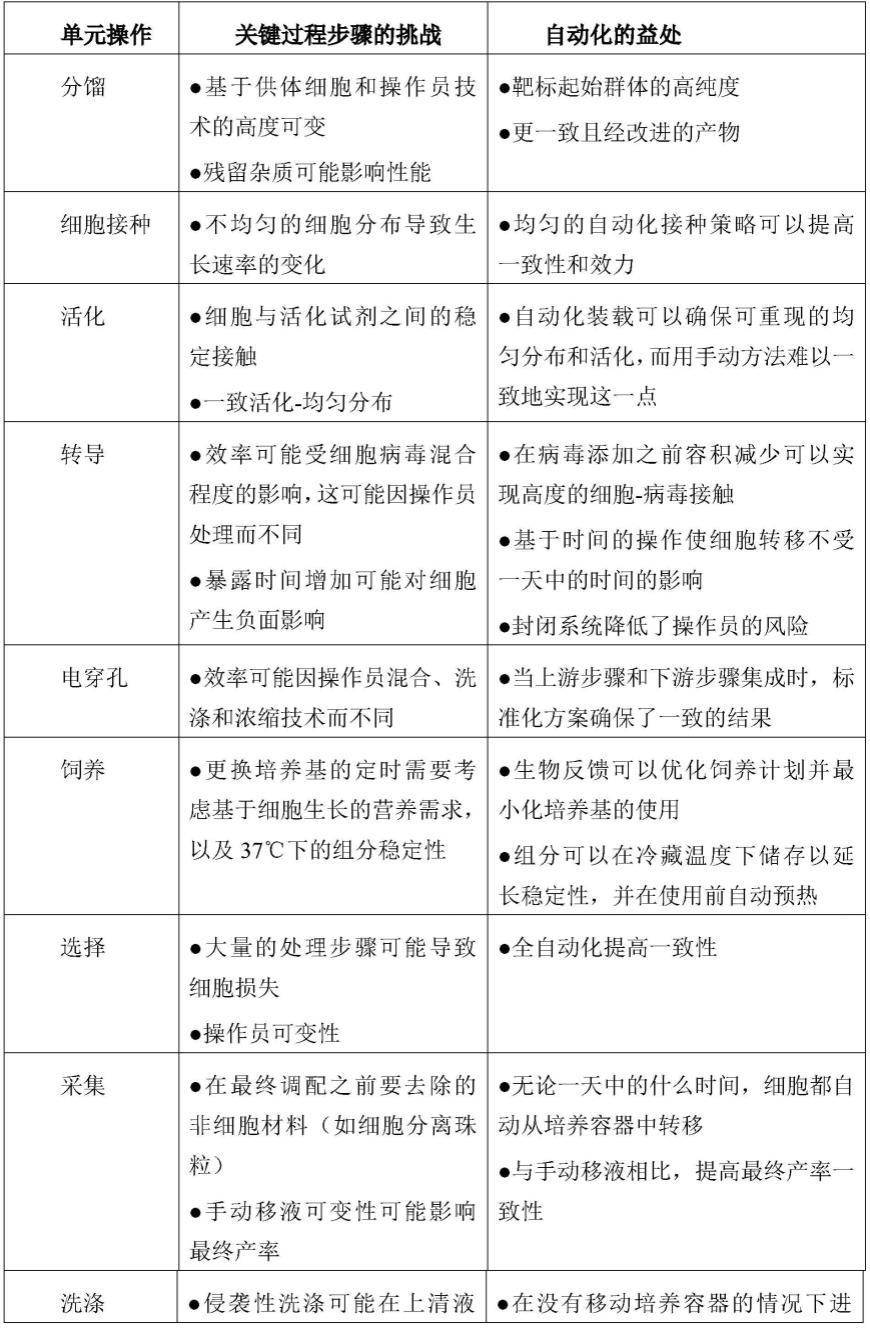
456.图1的图显示了cd34
细胞上的cll1 grna筛选。用cas9蛋白和靶向cll1的grna(在y轴上列出)对人cd34
细胞进行电穿孔。在x轴上显示的clec12a基因座的编辑效率通过sanger测序和tide分析来测定。
457.图2a-2d是一系列图,显示了cll1编辑的cd34
细胞的存活和分化。(a)显示实验工作流程的示意图。用cas9蛋白和靶向cll1的grna对人cd34
细胞进行电穿孔,然后通过tide和cfu测定分析编辑效率以评估体外分化。(b)电穿孔后48小时测量细胞存活力。使用无cas9 rnp组作为对照。(c)通过sanger测序和tide分析测定clec12a基因座的编辑效率。(d)电穿孔后2天将对照或cll1编辑的cd34
细胞铺板到methocult中,并在14天后对集落形成进行评分。bfu-e:爆发形成单位-红系;cfu-gm:集落形成单位-粒细胞/巨噬细胞;cfu-gemm:多能髓样祖细胞(生成粒细胞、红细胞、单核细胞和巨核细胞)的集落形成单位。使用学生t检验。
458.图3显示了aml细胞系上的靶标表达。通过流式细胞术分析测定molm-13和thp-1细胞和未染色对照中cd33、cd123和cll1的表达。x轴表示抗体染色的强度,并且y轴对应于细胞数目。
459.图4显示了cd33和cll1修饰的hl-60细胞。通过流式细胞术评估野生型(wt)、cd33-/-、cll1-/-和cd33-/-cll1-/-hl-60细胞中cd33和cll1的表达。为了生成cd33-/-或cll1-/-hl-60细胞,用靶向cd33或cll1的rnp对wt hl-60细胞进行电穿孔,然后对cd33或cll1阴性细胞进行流式细胞术分选。通过用靶向cll1的rnp对cd33-/-细胞进行电穿孔生成cd33-/-cll1-/-hl-60细胞,并对cll1阴性群体进行分选。x轴表示抗体染色的强度,并且y轴对应于细胞数目。
460.图5显示了cd33和cll1 car-t的体外细胞毒性测定。将抗cd33car-t和抗cll1 car-t与野生型(wt)、cd33-/-、cll1-/-和cd33-/-cll1-/-hl-60细胞温育,并通过流式细胞术评估细胞毒性。使用未转导的t细胞作为模拟car-t对照。carpool组由1:1的抗cd33和抗cll1 car-t细胞的合并组合组成。使用学生t检验。ns=不显著;*p《0.05;**p《0.01,***p《0.001,****p《0.0001。y轴表示特异性杀伤的百分比。
461.图6显示了cd34 细胞的基因编辑效率。用cas9蛋白和靶向cd33、cd123或cll1的grna(单独或组合)对人cd34 细胞进行电穿孔。通过sanger测序和tide分析测定cd33、cd123或cll1基因座的编辑效率。y轴表示编辑效率(通过tide的%)。
462.图7a-7c显示基因编辑的cd34 细胞的体外集落形成。电穿孔后2天,将对照或cd33、cd123、cll-1修饰的cd34 细胞铺板到methocult中,并在14天后对集落形成进行评分。bfu-e:爆发形成单位-红系;cfu-gm:集落形成单位-粒细胞/巨噬细胞;cfu-gemm:多能
髓样祖细胞(生成粒细胞、红细胞、单核细胞和巨核细胞)的集落形成单位。使用学生t检验。
463.图8显示了cd34 细胞的基因编辑频率。用由cas9蛋白和x轴上所示的靶向cll1的grna组成的核糖核蛋白(rnp)复合物对人cd34 细胞进行电穿孔,所述grna的序列见表8。通过sanger测序测定cll1基因座的编辑频率。y轴表示编辑频率。
464.图9显示了cd34 细胞的基因编辑频率。用cas9蛋白和x轴上所示的靶向cll1的grna,具体地从左到右,grna d、f、g、o2和p2对人cd34 细胞进行电穿孔。通过sanger测序测定cll1基因座的编辑频率。y轴表示编辑频率。图9中的所有grna导致编辑频率≥80%。
465.图10显示了用靶向cll1的grna,具体地grna d(左上)、grna f(左中)、grna g(左下)、grna o2(右上))和grna p2(右中)编辑的人cd34 细胞的indel(插入/缺失)分布。x轴表示indel的大小,并且y轴表示混合物中特定indel的百分比。
466.图11是用于在nbsgw小鼠中对cll1编辑的hspc进行体内表征的方案和实验规程/时间线的示意图和概述。
467.图12a-12d描绘了植入未经编辑的对照细胞或cll1 ko细胞后16周,小鼠骨髓中cll1编辑的细胞的长期谱系植入。图12a显示了在植入对照细胞(ep ctrl)或用grna f编辑的cll1 ko细胞后第16周,计算为人cd45 (hcd45 )细胞在骨髓中总cd45 细胞群(人和小鼠cd45 细胞的总和)中的百分比的人白细胞嵌合性。图12b显示了在植入对照细胞(ep ctrl)或用grna f编辑的cll1 ko细胞后第16周,骨髓中对人cd34也呈阳性(hcd34 )的hcd45 细胞的百分比。图12c显示了在植入对照细胞(ep ctrl)或用grna f编辑的cll1 ko细胞后第16周,骨髓中作为b细胞、t细胞、单核细胞、嗜中性粒细胞、常规树突状细胞(cdc)、浆细胞样树突状细胞(pdc)、嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞的hcd45 细胞的百分比。图12d显示了在植入对照细胞(ep ctrl)或用grna f编辑的cll1 ko细胞后第16周,骨髓中也经cll1 定量的hcd45 细胞的百分比。
468.图13a显示了如通过fac测量的体外cll1的细胞表面表达,从上到下为未经编辑的对照细胞、由grna f(通过tide测量的编辑频率为79.2%)编辑的cll1 ko细胞和fmo(荧光减一)对照。图13b显示了体外培养的未经编辑的对照细胞(ep ctrl)或由grna f编辑的cll1 ko细胞随时间产生的定量粒细胞。图13c显示了体外培养的未经编辑的对照细胞(ep ctrl)或由grna f编辑的cll1 ko细胞随时间产生的定量单核细胞。
469.图14a显示了体外培养的未经编辑的对照细胞(ep cntrl)或由grna f编辑的cll1 ko细胞随时间产生的cll1 粒细胞(上)或单核细胞(下)的百分比。图14b显示了在编辑和培养未经编辑的对照细胞或由grna f编辑的cll1ko细胞后第0、7和14天,定量的cd15 (左上)或cd11b 阳性粒细胞(右上)的百分比或cd14 (左下)或cd11b 阳性单核细胞(右下)的百分比。
470.图15显示了在由未经编辑的对照细胞(ep ctrl)或由grna f编辑的cll1ko细胞产生的粒细胞(上)或单核细胞(下)中测量的吞噬作用百分比。
471.图16a显示了由未受刺激、受lps刺激或受r848刺激的,未经编辑的对照细胞(ep ctrl)或由grna f编辑的cll1 ko细胞产生的粒细胞产生的以pg/ml为单位的il-6(右)或以pg/ml为单位的tnf-α(左)。图16b显示了由未受刺激、受lps刺激或受r848刺激的,未经编辑的对照细胞(ep ctrl)或由grna f编辑的cll1 ko细胞产生的单核细胞产生的以pg/ml为单位的il-6(右)或以pg/ml为单位的tnf-α(左)。
472.图17a-17b显示了基因编辑的cd34 细胞的体外集落形成。在电穿孔后铺板对照或cll1修饰的cd34 细胞,并在14天后对集落形成进行评分。bfu-e:爆发形成单位-红系;cfu-gm:集落形成单位-粒细胞/巨噬细胞;cfu-gemm:多能髓样祖细胞(生成粒细胞、红细胞、单核细胞和巨核细胞)的集落形成单位。图17a显示了由未经编辑的细胞(ep ctrl)或由grna f(编辑频率为79.2%)编辑的cll1 ko细胞产生的bfu-e、cfu-g/m/gm或cfu-gemm的集落计数。图17b显示了未经编辑细胞(ep ctrl)或由grna f编辑的cll1 ko细胞产生的bfu-e、cfu-g/m/gm或cfu-gemm的百分比集落分布。
473.发明详述
474.定义
475.如本文所用,关于grna与靶域相互作用的术语“结合”是指grna分子和靶域形成复合物。复合物可以包含形成双链体结构的两条链,或形成多链复合物的三条或更多链。结合可以构成更广泛过程中的步骤,诸如通过cas内切核酸酶切割靶域。在一些实施方案中,grna以完全互补性与靶域结合,并且在其他实施方案中,grna以部分互补性与靶域结合,例如,具有一个或多个错配。在一些实施方案中,当grna与靶域结合时,grna的完整靶向域与靶向域碱基配对。在其他实施方案中,靶域的仅部分和/或靶向域的仅部分与另一个碱基配对。在实施方案中,相互作用足以介导靶域介导的切割事件。
476.如本文所用,术语“cas9分子”是指可以与grna相互作用并且与grna一致地归巢或定位于包含靶域的位点的分子或多肽。cas9分子包括天然存在的cas9分子和工程化的、改变的或修饰的cas9分子,它们与天然存在的cas9分子在例如至少一个氨基酸残基上有所不同。
477.术语“grna”和“向导rna”自始至终可互换使用,并且是指促进grna/cas9分子复合物特异性靶向或归巢至靶核酸的核酸。grna可以是单分子的(具有单个rna分子),在本文中有时称为sgrna,或者是模块化的(包括一个以上,且通常是两个单独的rna分子)。grna可以与宿主细胞基因组中的靶域结合。grna可以包含可以与靶域部分或完全互补的靶向域。grna还可以包含“支架序列”(例如,tracrrna序列),其将cas9分子募集到与grna序列结合的靶域(例如,通过grna序列的靶向域)。支架序列可以包含至少一个茎环结构并募集内切核酸酶。示例性支架序列可以在例如jinek,et al.science(2012)337(6096):816-821,ran,et al.nature protocols(2013)8:2281-2308、pct申请号wo2014/093694和pct申请号wo2013/176772中找到。
478.如本文所用,术语“突变”是指与参考序列(例如,相应的野生型核酸)相比,核酸中的遗传变化(例如,插入、缺失或取代)。在一些实施方案中,对基因的突变使该基因产生的蛋白质去靶。在一些实施方案中,去靶化(detargetized)的cll1蛋白不与,或以较低水平与靶向cll1的药剂结合。
479.grna的“靶向域”与靶核酸上的“靶域”互补。包含与grna的核心域互补的核苷酸序列的靶核酸的链在本文中称为靶核酸的“互补链”。关于选择靶向域的指导可以在例如fu y et al,nat biotechnol 2014(doi:10.1038/nbt.2808)和sternberg sh et al.,nature 2014(doi:10.1038/naturel3011)中找到。
480.核酸酶
481.在一些实施方案中,使用本文所述的核酸酶制备本文所述的细胞(例如,hsc或
hpc)。示例性核酸酶包括cas分子(例如,cas9、talen、zfn和大范围核酸酶。在一些实施方案中,核酸酶与本文所述的cll1 grna组合使用(例如,根据表2、6或8)。
482.cas9分子
483.在一些实施方案中,本文所述的cll1 grna与cas9分子复合。可以使用各种cas9分子。在一些实施方案中,选择具有期望pam特异性的cas9分子以将grna/cas9分子复合物靶向cll1中的靶域。在一些实施方案中,对细胞进行遗传工程还包括将一种或多种(例如,1、2、3或更多种)cas9分子引入细胞。
484.多种物种的cas9分子可以用于本文所述的方法和组合物中。在实施方案中,cas9分子属于或衍生自酿脓链球菌(s.pyogenes)(spcas9)、金黄色葡萄球菌(s.aureus)(sacas9)或嗜热链球菌(s.thermophilus)。其他合适的cas9分子包括属于或衍生自以下的那些:金黄色葡萄球菌(staphylococcus aureus)、脑膜炎奈瑟氏菌(neisseria meningitidis)(nmcas9)、燕麦食酸菌(acidovorax avenae)、胸膜肺炎放线杆菌(actinobacillus pleuropneumoniae)、产琥珀酸放线杆菌(actinobacillus succinogenes)、猪放线杆菌(actinobacillus suis)、放线菌属种(actinomyces sp.)、反硝化嗜环菌(cycliphilus denitrificans)、嗜氨单胞菌(aminomonas paucivorans)、蜡状芽孢杆菌(bacillus cereus)、史氏芽孢杆菌(bacillus smithii)、苏云金芽孢杆菌(bacillus thuringiensis)、拟杆菌属种(bacteroides sp.)、滨海芽生螺旋菌(blastopirellula marina)、慢生根瘤菌属种(bradyrhizobium sp.)、侧孢短芽孢杆菌(brevibacillus laterosporus)、大肠弯曲杆菌(campylobacter coli)、空肠弯曲杆菌(campylobacter jejuni)(cjcas9)、红嘴鸥弯曲杆菌(campylobacter lari)、candidatus puniceispirillum、解纤维梭菌(clostridium cellulolyticum)、产气荚膜梭菌(clostridium perfringens)、拥挤棒杆菌(corynebacterium accolens)、白喉棒状杆菌(corynebacterium diphtheria)、马氏棒状杆菌(corynebacterium matruchotii)、dinoroseobacter shibae、长真杆菌(eubacterium dolichum)、γ变形菌(gamma proteobacterium)、固氮葡萄糖乙酸杆菌(gluconacetobacter diazotrophicus)、副流感嗜血杆菌(haemophilus parainfluenzae)、痰嗜血杆菌(haemophilus sputorum)、加拿大幽门螺杆菌(helicobacter canadensis)、同性恋螺杆菌(helicobacter cinaedi)、鼬鼠螺杆菌(helicobacter mustelae)、多营养型泥杆菌(ilyobacter polytropus)、金格杆菌(kingella kingae)、卷曲乳杆菌(lactobacillus crispatus)、依氏利斯特菌(listeria ivanovii)、单核细胞增多性李斯特氏菌(listeria monocytogenes)、李斯特氏菌科(listeriaceae)细菌、甲基孢子菌属种(methylocystis sp.)、甲基弯曲菌(methylosinus trichosporium)、羞怯动弯杆菌(mobiluncus mulieris)、杆菌状奈瑟菌(neisseria bacilliformis)、灰色奈瑟球菌(neisseria cinerea)、金黄奈瑟氏球菌(neisseria flavescens)、乳糖奈瑟氏球菌(neisseria lactamica)、脑膜炎奈瑟氏菌(neisseria meningitidis)、奈瑟氏菌属种(neisseria sp.)、瓦兹沃氏奈瑟菌(neisseria wadsworthii)、亚硝化单胞菌属种(nitrosomonas sp.)、parvibaculum lavamentivorans、多杀性巴氏杆菌(pasteurella multocida)、琥珀酸嗜酸杆菌(phascolarctobacterium succinatutens)、梅毒雷氏菌(ralstonia syzygii)、沼泽红假单胞菌(rhodopseudomonas palustris)、小红卵菌属种(rhodovulum sp.)、米氏西蒙斯氏菌(simonsiella muelleri)、
鞘氨醇单胞菌属种(sphingomonas sp.)、葡萄芽孢杆菌(sporolactobacillus vineae)、表皮葡萄球菌(staphylococcus lugdunensis)、链球菌属种(streptococcus sp.)、罕见小球菌属种(subdoligranulum sp.)、运动替斯崔纳菌(tistrella mobilis)、密螺旋体属种(treponema sp.)或艾森氏蠕形杆菌(verminephrobacter eiseniae)。
485.在一些实施方案中,cas9分子是天然存在的cas9分子。在一些实施方案中,cas9分子是工程化的、改变的或修饰的cas9分子,其与参考序列例如最相似的天然存在的cas9分子或wo2015157070(其通过引用整体并入本文)的表50的序列的不同在于例如至少一个氨基酸残基。在一些实施方案中,cas9分子包含cpf1或其片段或变体。
486.天然存在的cas9分子通常包含两个叶(lobe):识别(rec)叶和核酸酶(nuc)叶;其中的每一个进一步包括描述于例如wo2015157070中,例如其中的图9a-9b(该申请通过引用整体并入本文)的域。
487.rec叶包括富含精氨酸的桥螺旋(bh)、rec1域和rec2域。rec叶似乎是cas9特异性功能域。bh域是长的α螺旋和富含精氨酸的区域,并且包含酿脓链球菌的cas9序列的氨基酸60-93。rec1域涉及重复:抗重复双链体,例如grna或tracrrna的识别。rec1域在酿脓链球菌cas9序列的氨基酸94至179和308至717处包含两个rec1基序。这两个rec1域虽然在线性一级结构中由rec2域分开,但在三级结构中组装以形成rec1域。rec2域或其部分也可能在重复:抗重复双链体的识别中发挥作用。rec2域包含酿脓链球菌cas9序列的氨基酸180-307。
488.nuc叶包含ruvc域(本文也称为ruvc样域)、hnh域(本文也称为hnh样域)和pam相互作用(pi)域。ruvc域与逆转录病毒整合酶超家族成员共享结构相似性,并切割单链,例如靶核酸分子的非互补链。ruvc域由分别在酿脓链球菌cas9序列的氨基酸1-59、718-769和909-1098处的三个分裂的ruvc基序(ruvci、ruvcii和ruvciii,在本领域中通常称为ruvci域,或n端ruvc域、ruvcii域和ruvciii域)组装。与rec1域类似,三个ruvc基序在一级结构中由其他域线性分开,但在三级结构中,三个ruvc基序组装并形成ruvc域。hnh域与hnh内切核酸酶共享结构相似性,并切割单链,例如靶核酸分子的互补链。hnh域位于ruvcii-iii基序之间,并且包含酿脓链球菌cas9序列的氨基酸775-908。pi域与靶核酸分子的pam相互作用,并且包含酿脓链球菌cas9序列的氨基酸1099-1368。
489.已经确定了天然存在的细菌cas9分子(jinek et al.,science,343(6176):1247997,2014)和具有向导rna(例如crrna和tracrrna的合成融合)的酿脓链球菌cas9(nishimasu et al.,cell,156:935-949,2014;和anders et al.,nature,2014,doi:10.1038/naturel3579)的晶体结构。
490.在一些实施方案中,本文所述的cas9分子具有核酸酶活性,例如双链断裂活性。在一些实施方案中,cas9分子已经修饰以使内切核酸酶的催化残基之一失活。在一些实施方案中,cas9分子是切口酶并且产生单链断裂。参见,例如,dabrowska et al.frontiers in neuroscience(2018)12(75)。已经显示,酶的ruvc和hnh催化域中的一个或多个突变可以提高cas9效率。参见,例如,sarai et al.currently pharma.biotechnol.(2017)18(13)。在一些实施方案中,cas9分子融合至第二域,例如修饰dna或染色质的域,例如脱氨酶或脱甲基酶域。在一些此类实施方案中,cas9分子经修饰以消除其内切核酸酶活性。
491.在一些实施方案中,本文所述的cas9分子与用于同源定向修复(hdr)的模板一起施用。在一些实施方案中,本文所述的cas9分子在没有hdr模板的情况下施用。
492.在一些实施方案中,cas9分子经修饰以增强酶的特异性(例如,减少脱靶效应、维持稳健的中靶切割)。在一些实施方案中,cas9分子是增强的特异性cas9变体(例如,espcas9)。参见,例如,slaymaker et al.science(2016)351(6268):84-88。在一些实施方案中,cas9分子是高保真cas9变体(例如,spcas9-hf1)。参见,例如,kleinstiver et al.nature(2016)529:490-495。
493.各种cas9分子是本领域已知的并且可以从各种来源获得和/或工程化改造/修饰以调控酶的一种或多种活性或特异性。在一些实施方案中,cas9分子已经被工程化改造/修饰以识别一个或多个pam序列。在一些实施方案中,cas9分子已经被工程化改造/修饰以识别一种或多种pam序列,该pam序列不同于cas9分子在没有工程化改造/修饰的情况下识别的pam序列。在一些实施方案中,cas9分子已经被工程化改造/修饰以降低酶的脱靶活性。
494.在一些实施方案中,编码cas9分子的核苷酸序列经进一步修饰以改变内切核酸酶活性的特异性(例如,减少脱靶切割、降低内切核酸酶活性或在细胞中的寿命、增加同源定向重组和减少非同源末端连接)。参见,例如,komor et al.cell(2017)168:20-36。在一些实施方案中,编码cas9分子的核苷酸序列经修饰以改变内切核酸酶的pam识别。例如,cas9分子spcas9识别pam序列ngg,而包含内切核酸酶的一种或多种修饰的spcas9松弛变体(例如,vqr spcas9、eqr spcas9、vrer spcas9)可以识别pam序列nga、ngag、ngcg。如果与未经修饰的cas9分子相比,cas9分子识别更多潜在的pam序列,则认为修饰的cas9分子的pam识别是“松弛的”。例如,cas9分子sacas9识别pam序列nngrrt,而包含一个或多个修饰的sacas9的松弛变体(例如,kkh sacas9)可以识别pam序列nnnrrt。在一个实例中,cas9分子fncas9识别pam序列nng,而包含内切核酸酶的一种或多种修饰的fncas9松弛变体(例如,rha fncas9)可以识别pam序列yg。在一个实例中,cas9分子是包含取代突变s542r和k607r并且识别pam序列tycv的cpf1内切核酸酶。在一个实例中,cas9分子是包含取代突变s542r、k607r和n552r并且识别pam序列tatv的cpf1内切核酸酶。参见,例如,gao et al.nat.biotechnol.(2017)35(8):789-792。
495.在一些实施方案中,使用多于一种(例如,2、3或更多种)cas9分子。在一些实施方案中,cas9分子的至少一种是cas9酶。在一些实施方案中,cas分子的至少一种是cpf1酶。在一些实施方案中,cas9分子的至少一种衍生自酿脓链球菌。在一些实施方案中,cas9分子的至少一种衍生酿脓链球菌,并且cas9分子的至少一种衍生不是酿脓链球菌的生物体。在一些实施方案中,cas9分子是碱基编辑器。碱基编辑内切核酸酶通常包含与功能域融合的无催化活性的cas9分子。参见,例如,eid et al.biochem.j.(2018)475(11):1955-1964;rees et al.nature reviews genetics(2018)19:770-788。在一些实施方案中,无催化活性的cas9分子是dcas9。在一些实施方案中,内切核酸酶包含与一个或多个尿嘧啶糖基化酶抑制剂(ugi)域融合的dcas9。在一些实施方案中,内切核酸酶包含与腺嘌呤碱基编辑器(abe),例如从rna腺嘌呤脱氨酶tada进化而来的abe融合的dcas9。在一些实施方案中,内切核酸酶包含与胞苷脱氨酶(例如,apobec脱氨酶、pmcda1、活化诱导的胞苷脱氨酶(aid))融合的dcas9。在一些实施方案中,无催化活性的cas9分子具有降低的活性并且是ncas9。在一些实施方案中,无催化活性的cas9分子(dcas9)与一个或多个尿嘧啶糖基化酶抑制剂(ugi)域融合。在一些实施方案中,cas9分子包含与腺嘌呤碱基编辑器(abe),例如从rna腺嘌呤脱氨酶tada进化而来的abe融合的ncas9。在一些实施方案中,cas9分子包含与胞苷脱氨酶(例如
apobec脱氨酶、pmcda1、活化诱导的胞苷脱氨酶(aid))融合的ncas9。
496.碱基编辑器的示例包括但不限于be1、be2、be3、hf-be3、be4、be4max、be4-gam、ye1-be3、ee-be3、ye2-be3、yee-ce3、vqr-be3、vrer-be3、sabe3、sabe4、sabe4-gam、sa(kkh)-be3、target-aid、target-aid-ng、xbe3、ea3a-be3、be-plus、tam、crispr-x、abe7.9、abe7.10、abe7.10*、xabe、abesa、vqr-abe、vrer-abe、sa(kkh)-abe和crispr-skip。碱基编辑器的其他示例可以在例如美国公开号2018/0312825a1、美国公开号2018/0312828a1和pct公开号wo2018/165629a1中找到,其引用整体并入本文。
497.在一些实施方案中,已经进一步修饰碱基编辑器以抑制靶位点的碱基切除修复并诱导细胞错配修复。本文所述的任何cas9分子可以融合到gam域(噬菌体mu蛋白)以保护cas9分子免于降解和外切核酸酶活性。参见,例如,eid et al.biochem.j.(2018)475(11):1955-1964。
498.在一些实施方案中,cas9分子属于cas内切核酸酶的2类v型。2类v型cas内切核酸酶可以进一步分为v-a型、v-b型、v-c型和v-u型。参见,例如,stella et al.nature structural&molecular biology(2017)。在一些实施方案中,cas分子是v-a型cas内切核酸酶,诸如cpf1核酸酶。在一些实施方案中,cacas9分子是v-b型cas内切核酸酶,诸如c2c1内切核酸酶。参见,例如,shmakov et al.mol cell(2015)60:385-397。在一些实施方案中,cas分子是mad7。可替代地或另外地,cas9分子是cpf1核酸酶或其变体。如本领域技术人员将理解的,cpf1核酸酶也可以称为cas12a。参见,例如,strohkendl et al.mol.cell(2018)71:1-9。在一些实施方案中,本文所述的组合物或方法涉及或宿主细胞表达衍生自provetella spp.或弗朗西丝氏菌属种(francisella spp.)、氨基酸球菌属种(acidaminococcus sp.)(ascpf1)、毛螺菌科细菌(lachnospiraceae bacterium)(lpcpf1)或直肠真杆菌(eubacterium rectale)的cpf1核酸酶。在一些实施方案中,编码cpf1核酸酶的核苷酸序列可以经密码子优化以在宿主细胞中表达。在一些实施方案中,编码cpf1内切核酸酶的核苷酸序列经进一步修饰以改变蛋白质的活性。
499.在一些实施方案中,根据本文所述的方法使用cas分子(例如cas9或cas12a)的无催化活性变体。cpf1(cas12a)的无催化活性变体可以称为dcas12a。如本文所述,cpf1的无催化活性变体可以与功能域融合以形成碱基编辑器。参见,例如,rees et al.nature reviews genetics(2018)19:770-788。在一些实施方案中,无催化活性的cas9分子是dcas9。在一些实施方案中,内切核酸酶包含与一个或多个尿嘧啶糖基化酶抑制剂(ugi)域融合的dcas12a。在一些实施方案中,cas9分子包含与腺嘌呤碱基编辑器(abe),例如从rna腺嘌呤脱氨酶tada进化而来的abe融合的dcas12a。在一些实施方案中,cas分子包含与胞苷脱氨酶(例如apobec脱氨酶、pmcda1、活化诱导的胞苷脱氨酶(aid))融合的dcas12a。
500.可替代地或另外地,cas9分子可以是cas14内切核酸酶或其变体。cas14内切核酸酶衍生自古细菌,并且往往体积较小(例如,400-700个氨基酸)。此外,cas14内切核酸酶不需要pam序列。参见,例如,harrington et al.science(2018)。
501.可以调控本文所述的任何cas9分子以在期望时间调节cas9分子的表达水平和/或活性。例如,在细胞周期的特定阶段增加cas9分子的表达水平和/或活性可能是有利的。已经证明同源定向修复的水平在细胞周期的g1期期间降低,因此在s期、g2期和/或m期期间增加cas9分子的表达水平和/或活性可能增加cas内切核酸酶编辑后的同源定向修复。在一些
实施方案中,cas9分子的表达水平和/或活性在细胞周期的s期、g2期和/或m期期间增加。在一个实例中,cas9分子与人geminin的n端区域融合。参见,例如,gutschner et al.cell rep.(2016)14(6):1555-1566。在一些实施方案中,cas9分子的表达水平和/或活性在g1期期间降低。在一个实例中,cas9分子经修饰,使得它在g1期期间具有降低的活性。例如,参见lomova et al.stem cells(2018)。
502.可替代地或另外地,本文所述的任何cas9分子可以融合至表观遗传修饰物(例如,染色质修饰酶,例如,dna甲基化酶、组蛋白脱乙酰酶)。参见,例如,kungulovski et al.trends genet.(2016)32(2):101-113。与表观遗传修饰物融合的cas9分子可以称为“表观效应物”,并且可以允许暂时和/或瞬时的内切核酸酶活性。在一些实施方案中,cas9分子是与染色质修饰酶融合的dcas9。
503.锌指核酸酶
504.在一些实施方案中,本文所述的细胞或细胞群是使用锌指(zfn)技术产生的。在一些实施方案中,zfn识别本文所述的例如表1中的靶域。一般而言,锌指介导的基因组编辑涉及使用锌指核酸酶,其通常包含锌指dna结合域和核酸酶域。锌指结合域可以经工程化改造以识别和结合至任何感兴趣的靶域,例如,可以设计为识别范围为约3个核苷酸到约21个核苷酸长度,或约8到约19个核苷酸长度的dna序列。锌指结合域通常包含至少三个锌指识别区域(例如锌指)。
505.能够序列特异性结合至dna(在识别位点处)并在结合位点处或附近切割dna的限制性内切酶(限制性酶)是本领域已知的并且可以用于形成zfn以用于基因组编辑。例如,iis型限制性内切酶在远离识别位点的位点切割dna,并具有可分离的结合和切割域。在一个实例中,dna切割域可以衍生自foki内切核酸酶。
506.talen
507.在一些实施方案中,本文所述的细胞或细胞群是使用talen技术产生的。在一些实施方案中,talen识别本文所述的,例如表1中的靶域。通常,talen是工程化限制性酶,其可以特异性结合和切割期望的靶dna分子。talen通常包含与dna切割域融合的转录激活因子样效应物(tale)dna结合域。dna结合域可以含有高度保守的33-34个氨基酸序列,在位置12和13具有相异的2个氨基酸rvd(重复可变二肽基序)。rvd基序决定了与核酸序列的结合特异性,并且可以经工程化改造以特异性结合期望的dna序列。在一个实例中,dna切割域可以衍生自foki内切核酸酶。在一些实施方案中,foki域以二聚体发挥功能,使用具有独特dna结合域的两个构建体用于靶基因组中具有适当方向和间距的位点。
508.可以在细胞内使用对感兴趣的靶基因具有特异性的talen来产生双链断裂(dsb)。如果修复机制通过非同源末端连接不正确地修复断裂,则可以在断裂位点引入突变。例如,不正确的修复可能引入移码突变。可替代地,可以将具有期望序列的外源dna分子与talen一起引入细胞中。根据外源dna的序列和染色体序列,该过程可以用于纠正缺陷或将dna片段引入感兴趣的靶基因,或将此类缺陷引入内源性基因,从而降低靶基因的表达.
509.上文已经描述了适合与本文提供的向导rna和遗传工程方法结合使用的内切核酸酶和核酸酶变体的一些示例性、非限制性实施方案。基于本公开和本领域知识,其他合适的核酸酶和核酸酶变体对于本领域技术人员将是显而易见的。本公开在这方面不受限制。
510.grna序列和配置
511.一般grna配置
512.grna可以包含多个域。在实施方案中,单分子sgrna或嵌合grna包含,例如,从5’到3’:
513.靶向域(其与靶基因中,例如cll1基因中的靶核酸序列互补或部分互补;
514.第一互补域;
515.连接域;
516.第二互补域(其与第一互补域互补);
517.近端域;和
518.任选地,尾域。
519.现在更详细地描述这些域中的每一个。
520.靶向域可以包含与靶核酸上的靶序列互补,例如至少80、85、90或95%互补,例如完全互补的核苷酸序列。靶向域是rna分子的部分,并且将因此通常包含碱基尿嘧啶(u),而编码grna分子的任何dna将包含碱基胸腺嘧啶(t)。尽管不希望受理论束缚,但在实施方案中,据信靶向域与靶序列的互补性有助于grna/cas9分子复合物与靶核酸相互作用的特异性。应当理解,在靶向域和靶序列对中,靶向域中的尿嘧啶碱基将与靶序列中的腺嘌呤碱基配对。在实施方案中,靶域本身在5’到3’方向包括任选的二级域和核心域。在实施方案中,核心域与靶序列完全互补。在实施方案中,靶向域的长度为5至50个核苷酸。靶向域的长度可以在15-25个核苷酸、18-22个核苷酸或19-21个核苷酸之间。在一些实施方案中,靶向域的长度为15、16、17、18、19、20、21、22、23、24或25个核苷酸。在一些实施方案中,靶向域的长度为10-30之间或15-25之间个核苷酸。
521.在一些实施方案中,靶向域包括核心域和二级靶向域,例如,如国际申请wo2015157070中所述,其通过引用整体并入。在实施方案中,核心域包含距靶向域的3’末端约8至约13个核苷酸(例如,靶向域的最3’的8到13个核苷酸)。在实施方案中,二级域定位于核心域的5’。在许多实施方案中,核心域与靶序列的相应区域具有精确互补性。在其他实施方案中,核心域可以具有与靶序列的相应核苷酸不互补的1个或多个核苷酸。
522.第一互补域与第二互补域互补,并且在实施方案中,与第二互补域具有足够的互补性以在至少一些生理条件下形成双链体区域。在实施方案中,第一互补域的长度为5至30个核苷酸。在实施方案中,第一互补域包括3个亚域,其在5’至3’方向上是:5’亚域、中心亚域和3’亚域。在实施方案中,5’亚域的长度为4至9个,例如4、5、6、7、8或9个核苷酸。在实施方案中,中心亚域的长度为1、2或3个,例如1个核苷酸。在实施方案中,3’亚域的长度为3至25个,例如4至22、4至18、或4至10、或3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个核苷酸。第一互补域可以与天然存在的第一互补域共享同源性或衍生自天然存在的第一互补域。在实施方案中,它与酿脓链球菌、金黄色葡萄球菌或嗜热链球菌的第一互补域具有至少50%的同源性。
523.上述域的序列和位置在wo2015157070中有更详细的描述,其通过引用整体并入本文,包括其中的p.88-112。
524.连接域用于连接单分子grna的第一互补域和第二互补域。连接域可以共价或非共价连接第一和第二互补域。在实施方案中,连接是共价的。在实施方案中,连接域是或包含插入在第一互补域和第二互补域之间的共价键。在一些实施方案中,连接域包含一个或多
个,例如,2、3、4、5、6、7、8、9或10个核苷酸。在一些实施方案中,连接域包含至少一个非核苷酸键,例如,如wo2018126176中所公开的,其全部内容通过引用并入本文。
525.第二互补域与第一互补域至少部分互补,并且在实施方案中,与第二互补域具有足够的互补性以在至少一些生理条件下形成双链体区域。在实施方案中,第二互补域可以包括与第一互补域缺乏互补性的序列,例如从双链体区域环出的序列。在实施方案中,第二互补域的长度为5至27个核苷酸。在实施方案中,第二互补域比第一互补区域长。在实施方案中,互补域的长度为5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个核苷酸。在实施方案中,第二互补域包括3个亚域,其在5’至3’方向上是:5’亚域、中心亚域和3’亚域。在实施方案中,5’亚域的长度为3至25个,例如4至22、4至18、或4至10、或3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个核苷酸。在实施方案中,中心亚域的长度为1、2、3、4或5个,例如3个核苷酸。在实施方案中,3’亚域的长度为4至9个,例如4、5、6、7、8或9个核苷酸。在实施方案中,第一互补域的5’亚域和3’亚域分别与第二互补域的3’亚域和5’亚域互补,例如完全互补。
526.在实施方案中,近端域的长度为5至20个核苷酸。在实施方案中,近端域可以与天然存在的近端域共享同源性或衍生自天然存在的近端域。在实施方案中,它与酿脓链球菌、金黄色葡萄球菌或嗜热链球菌的近端域具有至少50%的同源性。
527.广谱的尾域适用于grna。在实施方案中,尾域的长度为0(不存在)、1、2、3、4、5、6、7、8、9或10个核苷酸。在一些实施方案中,尾域核苷酸来自天然存在的尾域的5’末端的序列或与其共享同源性。在实施方案中,尾域包括彼此互补并且在至少一些生理条件下形成双链体区域的序列。在实施方案中,尾域不存在或长度为1至50个核苷酸。在实施方案中,尾域可以与天然存在的近端尾域共享同源性或衍生在天然存在的近端尾域。在实施方案中,它与酿脓链球菌、金黄色葡萄球菌或嗜热链球菌的尾域具有至少50%的同源性。在实施方案中,尾域包括与体外或体内转录方法相关的在3’末端的核苷酸。
528.在一些实施方案中,模块化grna包括:
529.第一链,其包含,例如从5’到3’:
530.靶向域(其与cll1基因中的靶核酸互补)和
531.第一互补域;和
532.第二链,其包含,优选地从5’至3’:
533.任选地,5’延伸域;
534.第二互补域;
535.近端域;和
536.任选地,尾域。
537.在一些实施方案中,grna经化学修饰。例如,grna可以包含选自硫代磷酸酯主链修饰、2
’‑
o-me-修饰的糖(例如,在3’和5’端之一或两者处)、2’f-修饰的糖、用双环核苷酸-cet替换核糖、3’硫代pace(msp)或其任何组合的一种或多种修饰。合适的grna修饰描述于例如rahdar et al.pnas december 22,2015 112(51)e7110-e7117和hendel et al.,nat biotechnol.2015sep;33(9):985
–
989,其每篇均通过引用整体并入本文。在一些实施方案中,本文所述的grna包含一个或多个2
’‑
o-甲基-3
’‑
硫代磷酸酯核苷酸,例如至少2、3、4、5或6个2
’‑
o-甲基-3
’‑
硫代磷酸酯核苷酸。在一些实施方案中,本文所述的grna包含在三个
端位置和5’末端和/或在三个端位置和3’末端的修饰的核苷酸(例如,2
’‑
o-甲基-3
’‑
硫代磷酸酯核苷酸)。在一些实施方案中,grna可以包含一种或多种修饰的核苷酸,例如,如描述于国际申请wo/2017/214460、wo/2016/089433和wo/2016/164356中,其通过引用整体并入。
538.在一些实施方案中,本文所述的grna经化学修饰。例如,grna可以包含一种或多种2
’‑
o修饰的核苷酸,例如2
’‑
o-甲基核苷酸。在一些实施方案中,grna包含2
’‑
o修饰的核苷酸,例如在grna的5’末端处的2
’‑
o-甲基核苷酸。在一些实施方案中,grna包含2
’‑
o修饰的核苷酸,例如在grna的3’末端处的2
’‑
o-甲基核苷酸。在一些实施方案中,grna包含2
’‑
o-修饰的核苷酸,例如在grna的5’和3’末端两者处的2
’‑
o-甲基核苷酸。在一些实施方案中,grna是2
’‑
o-修饰的,例如在grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸和grna的5’末端起的第三个核苷酸处是2
’‑
o-甲基修饰的。在一些实施方案中,grna是2
’‑
o-修饰的,例如在grna的3’末端处的核苷酸、grna的3’末端起的第二个核苷酸和grna的3’末端起的第三个核苷酸处是2
’‑
o-甲基修饰的。在一些实施方案中,grna是2
’‑
o-修饰的,例如在grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸、grna的5’末端起的第三个核苷酸、grna的3’末端处的核苷酸,grna的3’末端起的第二个核苷酸和grna的3’末端起的第三个核苷酸处是2
’‑
o-甲基修饰的。在一些实施方案中,grna是2
’‑
o-修饰的,例如在grna的3’末端起的第二个核苷酸、grna的3’末端起的第三个核苷酸和grna的3’末端起的第四个核苷酸处是2
’‑
o-甲基修饰的。在一些实施方案中,grna的3’末端处的核苷酸未经化学修饰。在一些实施方案中,grna的3’末端处的核苷酸不具有化学修饰的糖。在一些实施方案中,grna是2
’‑
o-修饰的,例如在grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸、grna的5’末端起的第三个核苷酸、grna的3’末端起的第二个核苷酸、grna的3’末端起的第三个核苷酸,以及grna的3’末端起的第四个核苷酸处是2
’‑
o-甲基修饰的。在一些实施方案中,2
’‑
o-甲基核苷酸包含与相邻核苷酸的磷酸联结。在一些实施方案中,2
’‑
o-甲基核苷酸包含与相邻核苷酸的硫代磷酸酯联结。在一些实施方案中,2
’‑
o-甲基核苷酸包含与相邻核苷酸的硫代pace联结。
539.在一些实施方案中,grna可以包含一种或多种2
’‑
o-修饰的和3’磷修饰的核苷酸,例如2
’‑
o-甲基3’硫代磷酸酯核苷酸。在一些实施方案中,grna在grna的5’末端包含2
’‑
o-修饰的和3’磷修饰的,例如2
’‑
o-甲基3’硫代磷酸酯核苷酸。在一些实施方案中,grna在grna的3’末端包含2
’‑
o-修饰的和3’磷修饰的,例如2
’‑
o-甲基3’硫代磷酸酯核苷酸。在一些实施方案中,grna在grna的5’和3’末端包含2
’‑
o-修饰和3’磷修饰的,例如,2
’‑
o-甲基3’硫代磷酸酯核苷酸。在一些实施方案中,grna包含其中一个或多个非桥接氧原子已经由硫原子替换的主链。在一些实施方案中,grna是2
’‑
o-修饰的和3’磷修饰的,例如,在grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸和grna的5’末端起的第三个核苷酸处是2
’‑
o-甲基3’硫代磷酸酯修饰的。在一些实施方案中,grna是2
’‑
o-修饰的和3’磷修饰的,例如,在grna的3’末端处的核苷酸、grna的3’末端起的第二个核苷酸和grna的3’末端起的第三个核苷酸处是2
’‑
o-甲基3’硫代磷酸酯修饰的。在一些实施方案中,grna是2
’‑
o-修饰的和3’磷修饰的,例如,在grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸、grna的5’末端起的第三个核苷酸、grna的3’末端处的核苷酸、grna的3’末端起的第二个核苷酸,以及grna的3’三个核苷酸处是2
’‑
o-甲基3’硫代磷酸酯修饰的。在一些实施方案中,grna是2
’‑
o-修饰的和3’磷修饰的,例如,在grna的3’末端起的第二个核苷酸、grna的3’末端起的
第三个核苷酸和grna的3’末端起的第四个核苷酸处是2
’‑
o-甲基3’硫代磷酸酯修饰的。在一些实施方案中,grna的3’末端处的核苷酸未经化学修饰。在一些实施方案中,grna的3’末端处的核苷酸不具有化学修饰的糖。在一些实施方案中,grna是2
’‑
o-修饰的和3’磷修饰的,例如,在grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸、grna的5’末端起的第三个核苷酸、grna的3’末端起的第二个核苷酸、grna的3’末端起的第三个核苷酸,以及grna的3’末端起的第四个核苷酸处是2
’‑
o-甲基3’硫代磷酸酯修饰的。
540.在一些实施方案中,grna可以包含一种或多种2
’‑
o-修饰的和3
’‑
磷修饰的,例如2
’‑
o-甲基3’硫代pace核苷酸。在一些实施方案中,grna在grna的5’末端包含2
’‑
o-修饰的和3’磷修饰的,例如2
’‑
o-甲基3’硫代pace核苷酸。在一些实施方案中,grna在grna的3’末端包含2
’‑
o-修饰的和3’磷修饰的,例如2
’‑
o-甲基3’硫代pace核苷酸。在一些实施方案中,grna在grna的5’和3’末端包含2
’‑
o-修饰的和3’磷修饰的,例如2
’‑
o-甲基3’硫代pace核苷酸。在一些实施方案中,grna包含其中一个或多个非桥接氧原子已经由硫原子替换且一个或多个非桥接氧原子已经由乙酸酯基团替换的主链。在一些实施方案中,grna是2
’‑
o-修饰的和3’磷修饰的,例如,在grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸和grna的5’末端起的第三个核苷酸处是2
’‑
o-甲基3’硫代pace修饰的。在一些实施方案中,grna是2
’‑
o-修饰的和3’磷修饰的,例如,在grna的3’末端处的核苷酸、grna的3’末端起的第二个核苷酸和grna的3’末端起的第三个核苷酸处是2
’‑
o-甲基3’硫代pace修饰的。在一些实施方案中,grna是2
’‑
o-修饰的和3’磷修饰的,例如,在grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸、grna的5’末端起的第三个核苷酸、grna的3’末端处的核苷酸、grna的3’末端起的第二个核苷酸,以及grna的3’末端起的第三个核苷酸处是2
’‑
o-甲基3’硫代pace修饰的。在一些实施方案中,grna是2
’‑
o-修饰的和3’磷修饰的,例如,在grna的3’末端起的第二个核苷酸、grna的3’末端起的第三个核苷酸和grna的3’末端起的第四个核苷酸处是2
’‑
o-甲基3’硫代pace修饰的。在一些实施方案中,grna的3’末端处的核苷酸未经化学修饰。在一些实施方案中,grna的3’末端处的核苷酸不具有化学修饰的糖。在一些实施方案中,grna是2
’‑
o-修饰的和3’磷修饰的,例如,在grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸、grna的5’末端起的第三个核苷酸、grna的3’末端起的第二个核苷酸、grna的3’末端起的第三个核苷酸,以及grna的3’末端起的第四个核苷酸处是2
’‑
o-甲基3’硫代pace-修饰的。
541.在一些实施方案中,grna包含化学修饰的主链。在一些实施方案中,grna包含硫代磷酸酯联结。在一些实施方案中,一个或多个非桥接氧原子已经由硫原子替换。在一些实施方案中,grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸和grna的5’末端起的第三个核苷酸各自包含硫代磷酸酯联结。在一些实施方案中,grna的3’末端处的核苷酸、grna的3’末端起的第二个核苷酸和grna的3’末端起的第三个核苷酸各自包含硫代磷酸酯联结。在一些实施方案中,grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸、grna的5’末端起的第三个核苷酸、grna的3’末端处的核苷酸、grna的3’末端起的第二个核苷酸和grna的3’末端起的第三个核苷酸各自包含硫代磷酸酯联结。在一些实施方案中,grna的3’末端起的第二个核苷酸、grna的3’末端起的第三个核苷酸和grna的3’末端起的第四个核苷酸各自包含硫代磷酸酯联结。在一些实施方案中,grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸、grna的5’末端起的第三个核苷酸、grna的3’末端起的第二个
核苷酸、grna的3’末端起的第三个核苷酸和grna的3’末端起的第四个核苷酸各自包含硫代磷酸酯联结。
542.在一些实施方案中,grna包含硫代pace联结。在一些实施方案中,grna包含其中一个或多个非桥接氧原子已经由硫原子替换且一个或多个非桥接氧原子已经由乙酸酯基团替换的主链。在一些实施方案中,grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸和grna的5’末端起的第三个核苷酸各自包含硫代pace联结。在一些实施方案中,grna的3’末端处的核苷酸、grna的3’末端起的第二个核苷酸和grna的3’末端起的第三个核苷酸各自包含硫代pace联结。在一些实施方案中,grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸、grna的5’末端起的第三个核苷酸、grna的3’末端处的核苷酸、grna的3’末端起的第二个核苷酸和grna的3’末端起的第三个核苷酸各自包含硫代pace联结。在一些实施方案中,grna的3’末端起的第二个核苷酸、grna的3’末端起的第三个核苷酸和grna的3’末端起的第四个核苷酸各自包含硫代pace联结。在一些实施方案中,grna的5’末端处的核苷酸、grna的5’末端起的第二个核苷酸、grna的5’末端起的第三个核苷酸、grna的3’末端起的第二个核苷酸、grna的3’末端起的第三个核苷酸和grna的3’末端起的第四个核苷酸各自包含硫代pace联结。
543.上文已经描述了适合与本文提供的向导rna和遗传工程方法结合使用的修饰,例如化学修饰的一些示例性、非限制性实施方案。基于本公开和本领域知识,其他合适的修饰,例如化学修饰,对于本领域技术人员将是显而易见的,其包括但不限于在hendel,a.et al.,nature biotech.,2015,vol 33,no.9中;在wo/2017/214460中;在wo/2016/089433中;和/或在wo/2016/164356中描述的那些;其中的每一篇均通过引用整体并入本文。
544.靶向cll1的grna
545.本公开提供了许多有用的grna,它们可以将内切核酸酶靶向人cll1。下面的表1说明了人内源性cll1中可以由本文所述的grna结合的靶域。表1.本文描述了由各种grna结合的人cll1的示例性靶域。对于每个靶域,第一序列代表对应于可以由合适的grna靶向的靶域序列的20个核苷酸的dna序列,其可以包含等同的rna靶向域序列(包含rna核苷酸而不是以下提供的序列中的dna核苷酸),并且第二序列是它的反向互补序列。粗体表示该序列存在于以下如seq id no:31所示的人cll1 cdna序列中。
[0546][0547][0548]
表2.本文提供了由各种grna结合的人cll1的示例性靶域序列。对于每个靶域,第一序列代表与人cll1基因组序列中合适的pam相邻的dna靶序列,第二序列代表示例性的合适grna靶向域序列。
[0549][0550][0551]
表6.本文提供了由各种grna结合的人cll1的示例性靶域序列。对于每个靶域,提供了与人cll1基因组序列中合适的pam相邻的dna靶序列。本文提供的靶向靶域的grna可以包含在其靶向域内的等同rna序列。
[0552]
[0553]
[0554]
[0555]
[0556]
[0557][0558]
cll1(nm_138337.6)cdna序列在下面提供为seq id no:31。下划线、粗体或斜体表示与grna a、b、c、d、e、f、g、h、i、j或o3(或其反向互补物)互补的区域。在两个或更多个此类区域之间有重叠的地方使用粗体和斜体。
[0559][0560]
另外的cll1同等型(enst00000355690.8)cdna提供如下:
[0561]
ggaagaacagcctttcaaatttgacttctgcatgtggatagatttctttacatattcatcaatgtctgaagaagttacttatgcagatcttcaattccagaactccagtgagatggaaaaaatcccagaaattggcaaatttggggaaaaagcacctccagctccctctcatgtatggcgtccagcagccttgtttctgactcttctgtgccttctgttg
ctcattggattgggagtcttggcaagcatgtttcacgtaactttgaagatagaaatgaaaaaaatgaacaaactacaaaacatcagtgaagagctccagagaaatatttctctacaactgatgagtaacatgaatatctccaacaagatcaggaacctctccaccacactgcaaacaatagccaccaaattatgtcgtgagctatatagcaaagaacaagagcacaaatgtaagccttgtccaaggagatggatttggcataaggacagctgttatttcctaagtgatgatgtccaaacatggcaggagagtaaaatggcctgtgctgctcagaatgccagcctgttgaagataaacaacaaaaatgcattggaatttataaaatcccagagtagatcatatgactattggctgggattatctcctgaagaagattccactcgtggtatgagagtggataatataatcaactcctctgcctgggttataagaaacgcacctgacttaaataacatgtattgtggatatataaatagactatatgttcaatattatcactgcacttataaaaaaagaatgatatgtgagaagatggccaatccagtgcagcttggttctacatattttagggaggcatgaggcatcaatcaaatacatttaaggagtgtagggggtgggggttctaggctataggtaaatttaaatattttctggttgacaattagttgagtttgtctgaagacctgggattttatcatgcagatgaaacatccaggtagcaagcttcagagagaatagactgtgaatgttaatgccagagaggtataatgaagcatgtcccacctcccactttccatcatggcctgaaccctggaggaagaggaagtccattcagatagttgtggggggccttcgaattttcattttcatttacgttcttccccttctggccaagatttgccagaggcaacatcaaaaaccagcaaattttaattttgtcccacagcgttgctagggtggcatggctccccatctcgggtccatcctatacttccatgggactccctatggctgaaggccttatgagtcaaaggacttatagccaattgattgttctaggccaggtaagaatggatatggacatgcatttattacctcttaaaattattattttaagtaaaagccaataaacaaaaacgaaaaggcaa(seq id no:46)
[0562]
另外的cll1同等型(nm_001207010.2)cdna提供如下:
[0563]
ctatttagcattgctgctgccagccccaaccacatttctgattgcctaggaagaacagcctttcaaatttgacttctgcatgtggatagatttctttacatattcatcaatgtctgaagaagttacttatgcagatcttcaattccagaactccagtgagatggaaaaaatcccagaaattggcaaatttggggaaaaagcacctccagctccctctcatgtatggcgtccagcagccttgtttctgactcttctgtgccttctgttgctcattggattgggagtcttggcaagcatgtttcacgtaactttgaagatagaaatgaaaaaaatgaacaaactacaaaacatcagtgaagagctccagagaaatatttctctacaactgatgagtaacatgaatatctccaacaagatcaggaacctctccaccacactgcaaacaatagccaccaaattatgtcgtgagctatatagcaaagaacaagagcacaaatgtaagccttgtccaaggagatggatttggcataaggacagctgttatttcctaagtgatgatgtccaaacatggcaggagagtaaaatggcctgtgctgctcagaatgccagcctgttgaagataaacaacaaaaatgcattggaatttataaaatcccagagtagatcatatgactattggctgggattatctcctgaagaagattccactcgtggtatgagagtggataatataatcaactcctctgcctgggttataagaaacgcacctgacttaaataacatgtattgtggatatataaatagactatatgttcaatattatcactgcacttataaaaaaagaatgatatgtgagaagatggccaatccagtgcagcttggttctacatattttagggaggcatgaggcatcaatcaaatacatttaaggagtgtagggggtgggggttctaggctataggtaaatttaaatattttctggttgacaattagttgagtttgtctgaagacctgggattttatcatgcagatgaaacatccaggtagcaagcttcagagagaatagactgtgaatgttaatgccagagaggtataatgaagcatgtcccacctcccactttccatcatggcctgaaccctggaggaagaggaagtccattcagatagttgtggggggccttcgaattttcattttcatttacgttcttccccttctggccaagatttgccagaggcaacatcaaaaaccagcaaattttaattttgtcccacagcgttgctagggtggcatggctccccatctcgggtccatcctatacttccatgggactccctatggctgaaggccttatgagtcaaaggacttatagccaattgattgttctaggccaggtaagaatggatatggacatgcatttattacctcttaaaattattattttaagtaaaagccaataaacaaaaacgaaaaggcaa(seq id no:270)
[0564]
另外的cll1同等型(nm_001300730.2)cdna提供如下:
[0565]
ggctcatttgcagacatatgggtgattggtacagtaggtttataaacagaagtttaaacttgtaagcttaagcttccgtttataaacagaagtttaaaattataggtcctgtttaacattcagctctgttaactcactcatctttttgtgtttttacactttgtcaagatttctttacatattcatcaatgtctgaagaagttacttatgcagatcttcaattccagaactccagtgagatggaaaaaatcccagaaattggcaaatttggggaaaaagcacctccagctccctctcatgtatggcgtccagcagccttgtttctgactcttctgtgccttctgttgctcattggattgggagtcttggcaagcatgtttcacgtaactttgaagatagaaatgaaaaaaatgaacaaactacaaaacatcagtgaagagctccagagaaatatttctctacaactgatgagtaacatgaatatctccaacaagatcaggaacctctccaccacactgcaaacaatagccaccaaattatgtcgtgagctatatagcaaagaacaagagcacaaatgtaagccttgtccaaggagatggatttggcataaggacagctgttatttcctaagtgatgatgtccaaacatggcaggagagtaaaatggcctgtgctgctcagaatgccagcctgttgaagataaacaacaaaaatgcattggaatttataaaatcccagagtagatcatatgactattggctgggattatctcctgaagaagattccactcgtggtatgagagtggataatataatcaactcctctgcctgaaaatatcaaacgaagaaagaaaccagagtctcaacctgctggacactattggaagtccatcatttaacacgtttttagtatatacttttagcaggagacagctctgagtcaactgtgttgaggtgccaccacagcgagtttaggcactcagatccctgcatactcatcacattgggccataatggcaaatagaattttttgttttgttttgtttgtttgctttttctttcacatagaaatagtaagtgtaggagtgtgggtcagaaagaaaaggtggccctacctctgatggttggcaatgataggatacaatgggagataagctatctacaaatggagtggagaaggatatatatttcaaaggcctaatttgtagtgaaagactagagacaaaggtaatgtgtgtgtcaggagagagtacagatggaatcttgttttgcaaacgtagaatatgtatgtgtttgtaattattgcaaatggaatggtaatctataatggaatggaaaacattgtagatattttcagttatcaaaaagaaaactgaaaaagtatataataattgtatgtatgatatatatatgtgtgtgtgtgtgtatatatatcttcactttataactctgtgttgttttggggtttgtttctgaaagggggttgtaataaatgacatctgtactatgtcaccacaaataaatctcattcttaaacatttaattgatgaactta(seq id no:271)
[0566]
另外的cll1同等型(nm_201623.4)cdna提供如下:
[0567]
ggctcatttgcagacatatgggtgattggtacagtaggtttataaacagaagtttaaacttgtaagcttaagcttccgtttataaacagaagtttaaaattataggtcctgtttaacattcagctctgttaactcactcatctttttgtgtttttacactttgtcaagatttctttacatattcatcaatgtctgaagaagttacttatgcagatcttcaattccagaactccagtgagatggaaaaaatcccagaaattggcaaatttggggaaaaagttcacgtaactttgaagatagaaatgaaaaaaatgaacaaactacaaaacatcagtgaagagctccagagaaatatttctctacaactgatgagtaacatgaatatctccaacaagatcaggaacctctccaccacactgcaaacaatagccaccaaattatgtcgtgagctatatagcaaagaacaagagcacaaatgtaagccttgtccaaggagatggatttggcataaggacagctgttatttcctaagtgatgatgtccaaacatggcaggagagtaaaatggcctgtgctgctcagaatgccagcctgttgaagataaacaacaaaaatgcattggaatttataaaatcccagagtagatcatatgactattggctgggattatctcctgaagaagattccactcgtggtatgagagtggataatataatcaactcctctgcctgggttataagaaacgcacctgacttaaataacatgtattgtggatatataaatagactatatgttcaatattatcactgcacttataaaaaaagaatgatatgtgagaagatggccaatccagtgcagcttggttctacatattttagggaggcatgaggcatcaatcaaatacatttaaggagtgtagggggtgggggttctaggctataggtaaatttaaatattttctggttgacaattagttgagtttgtctgaagacctgggattttatcatgcagatgaaacatccaggtagcaagcttcagagagaatagactgtgaatgttaatgccagagaggtataatgaagcatgtcccacctcccactttccatcatggcctgaaccctggaggaagaggaagtccattcagatagttgtggggggccttcgaattttcattttcatttacgttcttccccttctggccaagatttgccagaggcaacatcaaaaaccagcaaattttaattttgtcccacagcgttgctagggtggcatggctccccatctc
gggtccatcctatacttccatgggactccctatggctgaaggccttatgagtcaaaggacttatagccaattgattgttctaggccaggtaagaatggatatggacatgcatttattacctcttaaaattattattttaagtaaaagccaataaacaaaaacgaaaaggcaa(seq id no:272)
[0568]
双grna组合物及其用途
[0569]
在一些实施方案中,本文所述的grna(例如,表2、6或8的grna)可以与第二grna组合使用,例如,用于将核酸酶引导至基因组中的两个位点。例如,在一些实施方案中,期望产生缺乏cll1和第二谱系特异性细胞表面抗原的造血细胞,例如,使得细胞可以对两种药剂具有抗性:抗cll1药剂和靶向第二谱系特异性细胞表面抗原的药剂。在一些实施方案中,期望使细胞与靶向cll1的不同区域的两种不同grna接触,以便进行两次切割并在两个切割位点之间创建缺失。因此,本公开提供了grna的各种组合。
[0570]
在一些实施方案中,混合本文所述的两种或更多种(例如,3、4或更多种)grna。在一些实施方案中,每种grna在单独的容器中。在一些实施方案中,本文所述的试剂盒(例如,包含根据表2、6或8的一种或多种grna的试剂盒)还包含cas9分子或编码cas9分子的核酸。
[0571]
在一些实施方案中,第一和第二grna是根据表2、6、8的grna或其变体。
[0572]
在一些实施方案中,第一grna是本文所述的cll1 grna(例如,表2、6、8的grna或其变体)并且第二grna靶向选自以下的谱系特异性细胞表面抗原:bcma、cd19、cd20、cd30、ror1、b7h6、b7h3、cd23、cd38、c型凝集素样分子-1、cs1、il-5、l1-cam、psca、psma、cd138、cd133、cd70、cd7、cd13、nkg2d、nkg2d配体、clec12a、cd11、cd123、cd56、cd34、cd14、cd66b、cd41、cd61、cd62、cd235a、cd146、cd326、lmp2、cd22、cd52、cd10、cd3/tcr、cd79/bcr和cd26。
[0573]
在一些实施方案中,第一grna是本文所述的cll1 grna(例如,根据表2、6、8的grna或其变体),并且第二grna靶向与特定癌症类型相关的谱系特异性细胞表面抗原,该癌症诸如但不限于cd20、cd22(非霍奇金淋巴瘤、b细胞淋巴瘤、慢性淋巴细胞白血病(cll))、cd52(b细胞cll)、cd33(急性髓细胞性白血病(aml))、cd10(gp100)(常见(前b)急性淋巴细胞白血病和恶性黑色素瘤)、cd3/t细胞受体(tcr)(t细胞淋巴瘤和白血病)、cd79/b细胞受体(bcr)(b细胞淋巴瘤和白血病)、cd26(上皮和淋巴恶性病)、人白细胞抗原(hla)-dr、hla-dp和hla-dq(淋巴恶性病)、rcas1(妇科癌、胆管腺癌和胰腺导管腺癌)以及前列腺特异性膜抗原。
[0574]
在一些实施方案中,第一grna是本文所述的cll1 grna(例如,根据表2、6、8的grna或其变体)并且第二grna靶向选自以下的谱系特异性细胞表面抗原:cd7、cd13、cd19、cd22、cd20、cd25、cd32、cd38、cd44、cd45、cd47、cd56、96、cd117、cd123、cd135、cd174、cll-1、叶酸受体β、il1rap、muc1、nkg2d/nkg2dl、tim-3或wt1。
[0575]
在一些实施方案中,第一grna是本文所述的cll1 grna(例如,根据表2、6、8的grna或其变体)并且第二grna靶向选自以下的谱系特异性细胞表面抗原:cd1a、cd1b、cd1c、cd1d、cd1e、cd2、cd3、cd3d、cd3e、cd3g、cd4、cd5、cd6、cd7、cd8a、cd8b、cd9、cd10、cd11a、cd11b、cd11c、cd11d、cdw12、cd13、cd14、cd15、cd16、cd16b、cd17、cd18、cd19、cd20、cd21、cd22、cd23、cd24、cd25、cd26、cd27、cd28、cd29、cd30、cd31、cd32a、cd32b、cd32c、cd34、cd35、cd36、cd37、cd38、cd39、cd40、cd41、cd42a、cd42b、cd42c、cd42d、cd43、cd44、cd45、cd45ra、cd45rb、cd45rc、cd45ro、cd46、cd47、cd48、cd49a、cd49b、cd49c、cd49d、cd49e、cd49f、cd50、cd51、cd52、cd53、cd54、cd55、cd56、cd57、cd58、cd59、cd60a、cd61、cd62e、
cd62l、cd62p、cd63、cd64a、cd65、cd65s、cd66a、cd66b、cd66c、cd66f、cd68、cd69、cd70、cd71、cd72、cd73、cd74、cd75、cd75s、cd77、cd79a、cd79b、cd80、cd81、cd82、cd83、cd84、cd85a、cd85c、cd85d、cd85e、cd85f、cd85g、cd85h、cd85i、cd85j、cd85k、cd86、cd87、cd88、cd89、cd90、cd91、cd92、cd93、cd94、cd95、cd96、cd97、cd98、cd99、cd99r、cd100、cd101、cd102、cd103、cd104、cd105、cd106、cd107a、cd107b、cd108、cd109、cd110、cd111、cd112、cd113、cd114、cd115、cd116、cd117、cd118、cd119、cd120a、cd120b、cd121a、cd121b、cd121a、cd121b、cd122、cd123、cd124、cd125、cd126、cd127、cd129、cd130、cd131、cd132、cd133、cd134、cd135、cd136、cd137、cd138、cd139、cd140a、cd140b、cd141、cd142、cd143、cd14、cdw145、cd146、cd147、cd148、cd150、cd152、cd152、cd153、cd154、cd155、cd156a、cd156b、cd156c、cd157、cd158b1、cd158b2、cd158d、cd158e1/e2、cd158f、cd158g、cd158h、cd158i、cd158j、cd158k、cd159a、cd159c、cd160、cd161、cd163、cd164、cd165、cd166、cd167a、cd168、cd169、cd170、cd171、cd172a、cd172b、cd172g、cd173、cd174、cd175、cd175s、cd176、cd177、cd178、cd179a、cd179b、cd180、cd181、cd182、cd183、cd184、cd185、cd186、cd191、cd192、cd193、cd194、cd195、cd196、cd197、cdw198、cdw199、cd200、cd201、cd202b、cd203c、cd204、cd205、cd206、cd207、cd208、cd209、cd210a、cdw210b、cd212、cd213a1、cd213a2、cd215、cd217、cd218a、cd218b、cd220、cd221、cd222、cd223、cd224、cd225、cd226、cd227、cd228、cd229、cd230、cd231、cd232、cd233、cd234、cd235a、cd235b、cd236、cd236r、cd238、cd239、cd240、cd241、cd242、cd243、cd244、cd245、cd246、cd247、cd248、cd249、cd252、cd253、cd254、cd256、cd257、cd258、cd261、cd262、cd263、cd264、cd265、cd266、cd267、cd268、cd269、cd270、cd272、cd272、cd273、cd274、cd275、cd276、cd277、cd278、cd279、cd280、cd281、cd282、cd283、cd284、cd286、cd288、cd289、cd290、cd292、cdw293、cd294、cd295、cd296、cd297、cd298、cd299、cd300a、cd300c、cd300e、cd301、cd302、cd303、cd304、cd305、cd306、cd307a、cd307b、cd307c、cd307d、cd307e、cd309、cd312、cd314、cd315、cd316、cd317、cd318、cd319、cd320、cd321、cd322、cd324、cd325、cd326、cd327、cd328、cd329、cd331、cd332、cd333、cd334、cd335、cd336、cd337、cd338、cd339、cd340、cd344、cd349、cd350、cd351、cd352、cd353、cd354、cd355、cd357、cd358、cd359、cd360、cd361、cd362或cd363。
[0576]
在一些实施方案中,第一grna是本文所述的cll1 grna(例如,根据表2、6、8的grna或其变体)并且第二grna靶向选自以下的谱系特异性细胞表面抗原:cd19;cd123;cd22;cd30;cd171;cs-1(也称为cd2子集1、cracc、slamf7、cd319和19a24);c型凝集素样分子-1(clecl1);表皮生长因子受体变体iii(egfrviii);神经节苷脂g2(cd2);神经节苷脂gd3(aneu5ac(2-8)aneu5ac(2-3)bdgalp(1-4)bdglep(1-1)cer);tnf受体家族成员b细胞成熟(bcma)、tn抗原((tnag)或(galnac.alpha.-ser/thr));前列腺特异性膜抗原(psma);受体酪氨酸激酶样孤儿受体1(ror1);fms样酪氨酸激酶3(flt3);肿瘤相关糖蛋白72(tag72);cd38;cd44v6;癌胚抗原(cea);上皮细胞粘附分子(epcam);b7h3(cd276);kit(cd117);白细胞介素13受体亚基α-2(il-13ra2或cd213a2);间皮素;白细胞介素11受体α(il-11ra);前列腺干细胞抗原(psca);蛋白酶丝氨酸21(睾蛋白或prss21);血管内皮生长因子受体2(vegfr2);lewis(y)抗原;cd24;血小板衍生生长因子受体β(pdgfr-β);阶段特异性胚胎抗原4(ssea-4);cd20;叶酸受体α;受体酪氨酸蛋白激酶erbb2(her2/neu);粘蛋白1,细胞表面相关(muc1);表皮生长因子受体(egfr);神经细胞粘附分子(ncam);前列腺酶;前列腺酸性
磷酸酶(pap);延伸因子2突变(elf2m);肝配蛋白b2;成纤维细胞活化蛋白α(fap);胰岛素样生长因子i受体(igf-i受体)、碳酸酐酶ix(caix)、蛋白酶体(前体、巨蛋白因子)亚基,β9型(lmp2);糖蛋白100(gp100);由断点簇区(bcr)和abelson鼠白血病病毒癌基因同源物1(abl)组成的癌基因融合蛋白(bcr-abl);酪氨酸酶;肝配蛋白a型受体2(epha2);岩藻糖基gm1;唾液酸化lewis粘附分子(sle);神经节苷脂gm3(aneu5ac(2-3)bdgalp(1-4)bdglcp(1-1)cer);转谷氨酰胺酶5(tgs5);高分子量黑色素瘤相关抗原(hmwmaa);o-乙酰基-gd2神经节苷脂(oacgd2);叶酸受体β;肿瘤内皮标志物1(tem1/cd248);肿瘤内皮标志物7相关(tem7r);封闭蛋白6(cldn6);促甲状腺激素受体(tshr);g蛋白偶联受体c类5组,成员d(gprc5d);x染色体开放阅读框61(cxorf61);cd97;cd179a;间变性淋巴瘤激酶(alk);聚唾液酸;胎盘特异性1(plac1);globoh甘神经酰胺(globoh)的六糖部分;乳腺分化抗原(ny-br-1);尿溶蛋白2(upk2);甲型肝炎病毒细胞受体1(havcr1);肾上腺素受体β3(adrb3);泛连接蛋白3(panx3);g蛋白偶联受体20(gpr20);淋巴细胞抗原6复合物;基因座k 9(ly6k);嗅觉受体51e2(or51e2);tcrγ替代阅读框蛋白(tarp);肾母细胞瘤蛋白(wt1);癌症/睾丸抗原1(ny-eso-1);癌症/睾丸抗原2(lage-1a);黑色素瘤相关抗原1(mage-a1),ets易位变异基因6,位于染色体12p(etv6-aml);精子蛋白17(spa17);x抗原家族,成员1a(xage1);血管生成素结合细胞表面受体2(tie2);黑色素瘤癌睾丸抗原-1(mad-ct-1);黑色素瘤癌睾丸抗原-2(mad-ct-2);fos相关抗原1;肿瘤蛋白p53(p53);p53突变体;prostein;surviving;端粒酶;前列腺癌肿瘤抗原-1(pcta-1或半乳凝素8),由t细胞识别的黑色素瘤抗原1(melana或mart1);大鼠肉瘤(ras)突变体;人端粒酶逆转录酶(htert);肉瘤易位断点;黑色素瘤细胞凋亡抑制剂(ml-1ap);erg(跨膜蛋白酶,丝氨酸2(tmprss2)ets融合基因);n-乙酰葡糖胺转移酶v(na17);配对盒蛋白pax-3(pax3);雄激素受体;细胞周期蛋白b1;v-myc禽髓细胞瘤病病毒癌基因神经母细胞瘤衍生同源物(mycn);ras同源家族成员c(rhoc);酪氨酸酶相关蛋白2(trp-2);细胞色素p4501b1(cyp1b1);ccctc-结合因子(锌指蛋白)样(boris或印迹位点调节物的兄弟),t细胞识别的鳞状细胞癌抗原3(sart3);配对盒蛋白pax-5(pax5);原顶体结合蛋白sp32(oy-tes1);淋巴细胞特异性蛋白酪氨酸激酶(lck);激酶锚定蛋白4(akap-4);滑膜肉瘤,x断点2(ssx2);晚期糖基化终产物受体(rage-1);肾泛素1(ru1);肾泛素2(ru2);豆荚蛋白;人乳头瘤病毒e6(hpve6);人乳头瘤病毒e7(hpve7);肠羧酸酯酶;热休克蛋白70-2突变(mut hsp70-2);cd79a;cd79b;cd72;白细胞相关免疫球蛋白样受体1(lair1);iga受体的fc片段(fcar或cd89);白细胞免疫球蛋白样受体亚家族a成员2(lilra2);cd300分子样家族成员f(cd300lf);c型凝集素域家族12成员a(clec12a);骨髓基质细胞抗原2(bst2);含有egf样模块的粘蛋白样激素受体样2(emr2),淋巴细胞抗原75(ly75);磷脂酰肌醇蛋白聚糖-3(gpc3);fc受体样5(fcrl5);和免疫球蛋白λ样多肽1(igll1)。
[0577]
在一些实施方案中,第一grna是本文所述的cll1 grna(例如,根据表2、6、8的grna或其变体)并且第二grna靶向选自以下的谱系特异性细胞表面抗原:cd11a、cd18、cd19、cd20、cd31、cd34、cd44、cd45、cd47、cd51、cd58、cd59、cd63、cd97、cd99、cd100、cd102、cd123、cd127、cd133、cd135、cd157、cd172b、cd217、cd300a、cd305、cd317、cd321和cll1。
[0578]
在一些实施方案中,第一grna是本文所述的cll1 grna(例如,根据表2、6、8的grna或其变体)并且第二grna靶向选自以下的谱系特异性细胞表面抗原:cd123、cll1、cd38、
cd135(flt3)、cd56(ncam1)、cd117(c-kit)、frβ(folr2)、cd47、cd82、tnfrsf1b(cd120b)、cd191、cd96、ptprj(cd148)、cd70、lilrb2(cd85d)、cd25(il2rα)、cd44、cd96、nkg2d配体、cd45、cd7、cd15、cd19、cd20、cd22、cd37和cd82。
[0579]
在一些实施方案中,第一grna是本文所述的cll1 grna(例如,根据表2、6、8的grna或其变体)并且第二grna靶向选自以下的谱系特异性细胞表面抗原:cd7、cd11a、cd15、cd18、cd19、cd20、cd22、cd25、cd31、cd34、cd37、cd38、cd44、cd45、cd47、cd51、cd56、cd58、cd59、cd63、cd70、cd82、cd85d、cd96、cd97、cd99、cd100、cd102、cd117、cd120b、cd123、cd127、cd133、cd135、cd148、cd157、cd172b、cd191、cd217、cd300a、cd305、cd317、cd321、cll1、frβ(folr2)或nkg2d配体。
[0580]
在一些实施方案中,第一grna是本文所述的cll1 grna(例如,根据表2、6、8的grna或其变体)并且第二grna靶向cd33。在一些实施方案中,第一grna是本文所述的cll1 grna(例如,根据表2、6、8的grna或其变体)并且第二grna靶向cd123。
[0581]
在一些实施方案中,第一grna是本文所述的cll1 grna(例如,根据表2、6、8的grna或其变体)并且第二grna包含来自表a的序列。在一些实施方案中,第一grna是包含靶向域的cll1 grna,其中靶向域包含seq id no:1-10、40或42中任一个的序列,并且第二grna包含对应于表a序列的靶向域。在一些实施方案中,第一grna是包含靶向域的cll1 grna,其中靶向域包含seq id no:9的序列,并且第二grna包含对应于表a序列的靶向域。在一些实施方案中,第一grna是包含靶向域的cll1 grna,其中靶向域包含seq id no:10的序列,并且第二grna包含对应于表a序列的靶向域。在一些实施方案中,第一grna是包含靶向域的cll1 grna,其中靶向域包含seq id no:11的序列,并且第二grna包含对应于表a序列的靶向域。在一些实施方案中,第一grna是包含靶向域的cll1 grna,其中靶向域包含seq id no:12的序列,并且第二grna包含对应于表a序列的靶向域。在一些实施方案中,第二grna是wo2017/066760、wo2019/046285、wo/2018/160768或borot et al.pnas june 11,2019 116(24)11978-11987中任一篇中公开的grna,其中每篇均通过引用整体并入本文。
[0582]
表a.示例性人cd33靶序列。某些靶序列后面是pam序列,由文本中的空格表示。结合所提供的靶序列的合适的grna将通常包含靶向域,该靶向域包含与相应的靶序列等同的rna核苷酸序列(并且不包括pam)。
[0583]
[0584]
[0585][0586]
包含两个或多个突变的细胞
[0587]
在一些实施方案中,本文所述的工程化细胞包含两个或更多个突变。在一些实施方案中,本文所述的工程化细胞包含两个突变,第一突变在cll1中,并且第二突变在第二谱系特异性细胞表面抗原中。在一些实施方案中,此类细胞可以对两种药剂具有抗性:抗cll1药剂和靶向第二谱系特异性细胞表面抗原的药剂。在一些实施方案中,可以使用本文所述的两种或更多种grna,例如表2的grna和第二grna来产生此类细胞。在一些实施方案中,可以使用本文所述的两种或更多种grna,例如表6的grna和第二grna来产生此类细胞。在一些实施方案中,可以使用本文所述的两种或更多种grna,例如表8的grna和第二grna来产生此类细胞。在一些实施方案中,可以使用例如zfn或talen来产生细胞。本公开还提供了包含本文所述的细胞的群体。
[0588]
在一些实施方案中,第二突变在编码谱系特异性细胞表面抗原的基因处,例如,在前面部分中列出的一个。在一些实施方案中,第二突变位于表a中列出的位点。
[0589]
通常,由本文提供的方法和组合物引起的突变,例如靶基因(诸如,例如cll1和/或本公开中提到的任何其他靶基因)中的突变,导致由靶基因编码的基因产物功能丧失,例如,在cll1基因突变的情况下,导致cll1蛋白功能丧失。在一些实施方案中,功能丧失是基因产物表达水平的降低,例如,降低至较低的表达水平,或基因产物表达的完全消除。在一些实施方案中,突变导致基因产物的非功能性变体的表达。例如,在编码序列中生成过早终止密码子的突变的情况下,突变截短的基因产物,或在生成无义或错义突变的突变的情况下,导致特征在于改变的氨基酸序列的基因产物,这使得基因产物无功能。在一些实施方案中,基因产物的功能是结合或识别结合配偶。在一些实施方案中,基因产物(例如cll1、第二谱系特异性细胞表面抗原或两者)的表达降低为小于或等于50%、小于或等于40%,小于或等于30%、小于或等于20%、小于或等于10%、小于或等于5%、小于或等于2%、小于或等于1%的野生型或非工程化改造的对应细胞中的水平。
[0590]
在一些实施方案中,通过本文提供的方法和/或使用本文提供的组合物生成的细胞群中至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%的cll1的拷贝具有突变。在一些实施方案中,细胞群中至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%的第二谱系特异性
细胞表面抗原的拷贝具有突变。在一些实施方案中,细胞群中至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%的cll1和第二谱系特异性细胞表面抗原的拷贝具有突变。在一些实施方案中,群体包含一种或多种野生型细胞。在一些实施方案中,群体包括包含cll1的一种野生型拷贝的一种或多种细胞。在一些实施方案中,群体包括包含第二谱系特异性细胞表面抗原的一种野生型拷贝的一种或多种细胞。
[0591]
细胞
[0592]
在一些实施方案中,使用本文所述的核酸酶和/或grna制备具有cll1修饰的细胞(例如,hsc或hpc)。在一些实施方案中,使用本文所述的核酸酶和/或grna制备具有cll1修饰和第二谱系特异性细胞表面抗原修饰的细胞(例如,hsc或hpc)。应当理解,可以通过使细胞本身与核酸酶和/或grna接触来制备细胞,或者细胞可以是与核酸酶和/或grna接触的细胞的子细胞。在一些实施方案中,本文所述的细胞(例如,hsc)能够重建受试者的造血系统。在一些实施方案中,本文所述的细胞(例如,hsc)能够进行以下中的一种或多种(例如,所有):植入人受试者,产生髓样谱系细胞和产生淋巴谱系细胞。
[0593]
在一些实施方案中,本文所述的细胞是在cll1的外显子2中具有突变的人细胞。在一些实施方案中,本文所述的细胞是在cll1的外显子4中具有突变的人细胞。
[0594]
在一些实施方案中,本文所述的细胞群包含造血干细胞(hsc)、造血祖细胞(hpc)或两者(hspc)。在一些实施方案中,细胞是cd34 。
[0595]
在一些实施方案中,细胞仅包含一种遗传修饰。在一些实施方案中,细胞仅在cll1基因座经遗传修饰。在一些实施方案中,细胞在第二个基因座经遗传修饰。在一些实施方案中,细胞不包含转基因蛋白质,例如,不包含car。
[0596]
在一些实施方案中,本文所述的修饰细胞基本上不包含cll1蛋白。在一些实施方案中,本文所述的修饰细胞基本上不包含野生型cll1蛋白,但包含突变cll1蛋白。在一些实施方案中,突变cll1蛋白不由用于治疗目的的靶向cll1的药剂结合。
[0597]
在一些实施方案中,细胞是造血细胞,例如造血干细胞。造血干细胞(hsc)通常能够产生髓样和淋巴祖细胞两者,其进一步分别产生髓样细胞(例如,单核细胞、巨噬细胞、中性粒细胞、嗜碱性粒细胞、树突状细胞、红细胞、血小板等)和淋巴细胞(例如,t细胞、b细胞、nk细胞)。hsc的特征在于可以用于识别和/或分离hsc的细胞表面标志物cd34(例如cd34 )的表达,并且不存在与细胞谱系相关的细胞表面标志物。
[0598]
在一些实施方案中,本文所述的细胞群包含多个造血干细胞;在一些实施方案中,本文所述的细胞群包含多个造血祖细胞;并且在一些实施方案中,本文所述的细胞群包含多个造血干细胞和多个造血祖细胞。
[0599]
在一些实施方案中,hsc获得自受试者,例如人受试者。获得hsc的方法描述于例如pct/us2016/057339中,其通过引用整体并入本文。在一些实施方案中,hsc是外周血hsc。在一些实施方案中,哺乳动物受试者是非人灵长类、啮齿动物(例如小鼠或大鼠)、牛、猪、马或家畜。在一些实施方案中,hsc获得自人受试者,例如患有造血恶性病的人受试者。在一些实施方案中,hsc获得自健康供体。在一些实施方案中,hsc获得自随后将向其施用表达嵌合受体的免疫细胞的受试者。施用给从其获得细胞的相同受试者的hsc称为自体细胞,而从不是将施用细胞的受试者的受试者获得的hsc称为同种异体细胞。
[0600]
在一些实施方案中,细胞群中至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、或至少95%的cll1的拷贝具有突变。举例来说,群体可以包含多个不同的cll1突变,并且多个突变中的每个突变对具有突变的细胞群中cll1的拷贝的百分比有贡献。
[0601]
在一些实施方案中,将经遗传工程化改造的造血细胞上cll1的表达与天然存在的造血细胞(例如野生型对应物)上cll1的表达进行比较。在一些实施方案中,与在天然存在的造血细胞(例如,野生型对应物)上cll1的表达相比,遗传工程导致cll1的表达水平降低至少50%、至少60%、至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%。例如,在一些实施方案中,与天然存在的造血细胞(例如,野生型对应物)相比,经遗传工程化改造的造血细胞表达少于20%、少于19%、少于18%、少于17%、少于16%、少于15%、少于14%、少于13%、少于12%、少于11%、少于10%、少于9%、少于8%、少于7%、少于6%、少于5%、少于4%、少于3%、少于2%或少于1%的cll1。
[0602]
在一些实施方案中,与天然存在的造血细胞(例如,野生型对应物)上的野生型cll1的表达水平相比,遗传工程导致野生型cll1的表达水平降低至少50%、至少60%、至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%。也就是说,在一些实施方案中,与天然存在的造血细胞(例如,野生型对应物)相比,经遗传工程化改造的造血细胞表达少于20%、少于19%、少于18%、少于17%、少于16%、少于15%、少于14%、少于13%、少于12%、少于11%、少于10%、少于9%、少于8%、少于7%、少于6%、少于5%、少于4%、少于3%、少于2%或少于1%的cll1。
[0603]
在一些实施方案中,与合适的对照(例如,一个细胞或多个细胞)相比,遗传工程导致野生型谱系特异性细胞表面抗原(例如cll1)的表达水平降低至少50%、至少60%、至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%。在一些实施方案中,合适的对照包括在来自相同受试者的多个非工程化改造的细胞中测量或预期的野生型谱系特异性细胞表面抗原的水平。在一些实施方案中,合适的对照包括在来自健康受试者的多个细胞中测量或预期的野生型谱系特异性细胞表面抗原的水平。在一些实施方案中,合适的对照包括在来自健康个体库(例如,10、20、50或100个个体)的细胞群中测量或预期的野生型谱系特异性细胞表面抗原的水平。在一些实施方案中,合适的对照包括在需要本文所述治疗,例如抗cll1疗法的受试者中测量或预期的野生型谱系特异性细胞表面抗原的水平,例如其中受试者患有癌症,其中癌症细胞表达cll1。
[0604]
治疗和施用的方法
[0605]
在一些实施方案中,将有效数量的本文所述的cll1修饰的细胞联合抗cll1疗法(例如抗cll1癌症疗法)施用于受试者。在一些实施方案中,包含修饰的cll1和修饰的第二谱系特异性细胞表面抗原的有效数量的细胞联合抗cll1疗法例如抗cll1癌症疗法施用。在一些实施方案中,抗cll1疗法包括抗体、双特异性t细胞衔接器、adc或表达car的免疫细胞。
[0606]
应当理解,当联合施用药剂(例如,cll1修饰的细胞和抗cll1疗法)时,可以在相同时间或时间接近的不同时间施用药剂。此外,这些药剂可以混合或为单独的体积。例如,在
一些实施方案中,联合施用包括在相同治疗过程中,例如,在用抗cll1疗法治疗癌症的过程中施用,可以同时或相继,例如,在用抗cll1疗法治疗之前、期间或之后,施用受试者有效数量的cll1修饰的细胞。
[0607]
在一些实施方案中,如本文所述的靶向cll1的药剂是表达嵌合受体的免疫细胞,该嵌合受体包含能够与cll1结合的抗原结合片段(例如,单链抗体)。免疫细胞可以是例如t细胞(例如cd4 或cd8 t细胞)或nk细胞。
[0608]
嵌合抗原受体(car)可以包含重组多肽,该重组多肽至少包含胞外抗原结合域、跨膜域和包含功能性信号传导域,例如衍生自刺激分子的信号传导域的细胞质信号传导域。在一些实施方案中,细胞质信号传导域进一步包含一个或多个功能性信号传导域,其衍生自至少一种共刺激分子,诸如4-1bb(即cd137)、cd27和/或cd28或这些分子的片段。car的胞外抗原结合域可以包含结合cll1的抗体片段。抗体片段可包含一个或多个cdr、可变区(或其部分)、恒定区(或其部分)、或前述的任何的组合。
[0609]
下面提供了抗人cll1抗体的示例性重链可变区和轻链可变区的氨基酸和核酸序列。cdr序列在氨基酸序列中以粗体显示。
[0610]
抗cll1重链可变区的氨基酸序列(seq id no:32)
[0611][0612][0613]
抗cll1轻链可变区的氨基酸序列(seq id no:33)
[0614][0615]
其他的抗cll1序列例如在us8536310中找到,其通过引用整体并入本文。
[0616]
用于构建如本文所述的靶向cll1的药剂的抗cll1抗体结合片段可以包含与seq id no:32和seq id no:33中的重链和/或轻链cdr区相同的重链和/或轻链cdr区。此类抗体可以包含框架区中的一个或多个中的氨基酸残基变异。在一些情况下,抗cll1抗体片段可以包含与seq id no:32共享至少70%序列同一性(例如,75%、80%、85%、90%、95%或更高)的重链可变区和/或可以包含与seq id no:33共享至少70%序列同一性(例如75%、80%、85%、90%、95%或更高)的轻链可变区。
[0617]
示例性嵌合受体组分序列在下表3中提供。
[0618]
表3:嵌合受体的示例性组分
[0619][0620][0621]
在一些实施方案中,car包含4-1bb共刺激域(例如,如表3所示)、cd8α跨膜域和cd8α的胞外域的部分(例如,如表3所示),以及cd3ζ细胞质信号传导域(例如,如表3所示)。
[0622]
施用于哺乳动物(例如人)的细胞,例如免疫细胞或造血细胞的典型数量可以是例如范围为一百万至一千亿个细胞;然而,低于或高于该示例性范围的量也在本公开的范围内。
[0623]
在一些实施方案中,靶向cll1的试剂是抗体-药物缀合物(adc)。adc可以是包含与毒素或药物分子缀合的抗体或其抗原结合片段的分子。抗体或其片段与相应抗原的结合允许将毒素或药物分子递送至在其细胞表面呈递抗原的细胞(例如靶细胞),从而导致靶细胞
死亡。
[0624]
在一些实施方案中,抗体-药物缀合物的抗原结合片段具有与由seq id no:32提供的重链可变区相同的重链cdr和与由seq id no:33提供的轻链可变区相同的轻链cdr。在一些实施方案中,抗体-药物缀合物的抗原结合片段具有由seq id no:32提供的重链可变区和由seq id no:33提供的相同轻链可变区。
[0625]
用于抗体-药物缀合物的相容毒素或药物是本领域已知的并且对于本领域普通技术人员来说是显而易见的。参见,例如,peters et al.biosci.rep.(2015)35(4):e00225;beck et al.nature reviews drug discovery(2017)16:315-337;marin-acevedo et al.j.hematol.oncol.(2018)11:8;elgundi et al.advanced drug delivery reviews(2017)122:2-19。
[0626]
在一些实施方案中,抗体-药物缀合物可以进一步包含附接抗体和药物分子的接头(例如,肽接头,诸如可切割接头)。
[0627]
抗体-药物缀合物的实例包括但不限于维布妥昔单抗(brentuximab vedotin)、格巴妥木单抗(glembatumumab vedotin)/cdx-011、玛汀-迪妥昔珠单抗(depatuxizumab mafodotin)/abt-414、psma adc、维汀-泊洛妥珠单抗(polatuzumab vedotin)/rg7596/dcds4501a、玛汀-地宁妥珠单抗(denintuzumab mafodotin)/sgn-cd19a、ags-16c3f、cdx-014、rg7841/dlye5953a、rg7882/dmuc406a、rg7986/dcds0780a、sgn-liv1a、维汀-恩弗妥单抗(enfortumab vedotin)/asg-22me、ag-15me、ags67e、维汀-特立妥珠单抗(telisotuzumab vedotin)/abbv-399、abbv-221、abbv-085、gsk-2857916、维汀-替索妥单抗(tisotumab vedotin)/humax-tf-adc、humax-axl-adc、维汀-匹那妥珠单抗(pinatuzumab veodtin)/rg7593/dcdt2980s、维汀-利法妥珠单抗(lifastuzumab vedotin)/rg7599/dnib0600a、维汀-英度妥单抗(indusatumab vedotin)/mln-0264/tak-264、维汀-万多妥珠单抗(vandortuzumab vedotin)/rg7450/dstp3086s、维汀-索非妥珠单抗(sofituzumab vedotin)/rg7458/dmuc5754a、rg7600/dmot4039a、rg7336/dedn6526a、me1547、pf-06263507/adc 5t4、恩美曲妥珠单抗(trastuzumab emtansine)/t-dm1、索星-米妥昔单抗(mirvetuximab soravtansine)/imgn853、雷星-考妥昔单抗(coltuximab ravtansine)/sar3419、恩星-那妥昔单抗(naratuximab emtansine)/imgn529、雷英妥昔单抗(indatuximab ravtansine)/bt-062、雷星-阿奈妥单抗(anetumab ravtansine)/bay 94
–
9343、sar408701、sar428926、amg 224、pca062、hkt288、ly3076226、sar566658、莫星-洛沃妥珠单抗(lorvotuzumab mertansine)/imgn901、莫坎妥珠单抗(cantuzumab mertansine)/sb-408075、雷星-坎妥珠单抗(cantuzumab ravtansine)/imgn242、恩星-拉妥昔单抗(laprituximab emtansine)/imgn289、imgn388、莫比瓦妥单抗(bivatuzumab mertansine)、ave9633、biib015、mln2704、amg 172、amg 595、lop 628、他立林-伐达妥昔单抗(vadastuximab talirine)/sgn-cll1a、sgn-cd70a、sgn-cd19b、sgn-cd123a、sgn-cd352a、特司林-洛伐妥珠单抗(rovalpituzumab tesirine)/sc16ld6.5、sc-002、sc-003、adct-301/humax-tac-pbd、adct-402、medi3726/adc-401、imgn779、imgn632、吉妥珠单抗奥唑米星(gemtuzumab ozogamicin)、inotuzumab ozogamicin/cmc-544、pf-06647263、cmd-193、cmb-401、多-曲妥珠单抗(trastuzumab duocarmazine)/syd985、bms-936561/mdx-1203、戈维替康-赛妥珠单抗(sacituzumab govitecan)/immu-132、戈维替康-拉贝妥珠单
抗(labetuzumab govitecan)/immu-130、ds-8201a、u3-1402、milatuzumab doxorubicin/immu-110/hll1-dox、bms-986148、rc48-adc/hertuzumab-vc
–
mmae、pf-06647020、pf-06650808、pf-06664178/rn927c、阿汀-鲁帕妥单抗(lupartumab amadotin)/bay1129980、伊汀-阿普卢妥单抗(aprutumab ixadotin)/bay1187982、arx788、ags62p1、xmt-1522、abgn-107、medi4276、dsta4637s/rg7861。在一个实例中,抗体-药物缀合物是吉妥珠单抗奥唑米星。
[0628]
在一些实施方案中,抗体-药物缀合物与细胞表面谱系特异性蛋白的表位的结合诱导抗体-药物缀合物的内化,并且药物(或毒素)可以在细胞内释放。在一些实施方案中,抗体-药物缀合物与细胞表面谱系特异性蛋白质的表位的结合诱导毒素或药物的内化,其允许毒素或药物杀伤表达谱系特异性蛋白质的细胞(靶细胞)。在一些实施方案中,抗体-药物缀合物与细胞表面谱系特异性蛋白质的表位的结合诱导毒素或药物的内化,其可以调节表达谱系特异性蛋白质的细胞(靶细胞)的活性。本文所述的抗体-药物缀合物中使用的毒素或药物的类型不限于任何特定类型。
[0629]
cll1相关疾病和/或病症
[0630]
本公开特别提供了用于治疗与cll1的表达相关的疾病或与表达cll1的细胞相关的病症的方法、组合物和方法,其包括例如增殖性疾病,诸如癌症或恶性病(例如,造血恶性病),或癌前状况,诸如骨髓增生异常、骨髓增生异常综合征或白血病前期。
[0631]
在一些实施方案中,造血恶性病或血液病症与cll1表达相关。已经将造血恶性病描述为涉及造血细胞(例如,血细胞,包括祖细胞和干细胞)的恶性异常。造血恶性病的实例包括但不限于霍奇金淋巴瘤、非霍奇金淋巴瘤、白血病或多发性骨髓瘤。示例性白血病包括但不限于急性髓样白血病、急性淋巴样白血病、慢性髓性白血病、急性淋巴母细胞性白血病或慢性淋巴母细胞性白血病和慢性淋巴样白血病。
[0632]
在一些实施方案中,参与造血恶性病的细胞对用于治疗恶性病的常规或标准疗法具有抗性。例如,细胞(例如癌细胞)可能对用于治疗恶性病的化疗剂和/或car t细胞具有抗性。
[0633]
在一些实施方案中,白血病是急性髓样白血病(aml)。aml的特征为异质性、克隆性、赘生性疾病,其起源于转化细胞,这些转化细胞逐渐获得破坏关键分化和生长调节途径的关键遗传变化。(dohner et al.,nejm,(2015)373:1136)。不希望受理论束缚,在一些实施方案中相信,cll1在骨髓性白血病细胞以及正常髓样和单核细胞前体上表达,并且是aml疗法的有吸引力的靶标。
[0634]
在某些情况下,受试者可能最初对治疗(例如,用于造血恶性病)有响应,并随后出现复发。可以使用本文所述的任何方法或经遗传工程化改造的造血细胞群以减少或预防造血恶性病的复发。可替代地或另外地,本文所述的任何方法可以涉及施用本文所述的任何经遗传工程化改造的造血细胞群和靶向与造血恶性病相关的细胞的免疫治疗剂(例如,细胞毒剂),并在造血恶性病复发时进一步施用一种或多种另外的免疫治疗药物。在一些实施方案中,在施用一种或多种先前疗法后,受试者具有或易患造血恶性病(例如,aml)的复发。在一些实施方案中,本文所述的方法降低了受试者的复发的风险或复发的严重性。
[0635]
在一些实施方案中,与cll1相关的造血恶性病或血液病症是癌前状况,诸如骨髓增生异常、骨髓增生异常综合征或白血病前期。骨髓增生异常综合征(mds)是血液学医疗状
况,其特征在于无序和无效的造血或血液生成。因此,造血细胞的数目和质量不可逆转地下降。一些mds患者可能出现严重贫血,而另一些则无症状。mds的分类方案是本领域已知的,其标准指定特定血细胞类型例如成髓细胞、单核细胞和红细胞前体的比率或频率。mds包括难治性贫血、难治性贫血伴环状铁粒幼细胞、难治性贫血伴原始细胞过多、难治性贫血伴转化中原始细胞过多、慢性粒单核细胞白血病(cml)。在一些实施方案中,mds可以进展为急性髓样白血病(aml)。
实施例
[0636]
实施例1:人细胞中cll1的基因编辑
[0637]
sgrna构建体的设计
[0638]
通过人工检查与靶区域非常接近的spcas9 pam(5
’‑
ngg-3’)设计表4中所示的sgrna,并通过使用在线搜索算法(例如,benchling算法,doench et al 2016,hsu et al 2013)最小化人基因组中潜在的脱靶位点,根据预测的特异性进行优先级排序。产生所有设计的合成sgrna,在5’和3’末端的三个端位置具有化学修饰的核苷酸。修饰的核苷酸含有2
’‑
o-甲基-3
’‑
硫代磷酸酯(缩写为“ms”)并且ms-sgrna经hplc纯化。cas9蛋白购自aldervon。
[0639]
表4:可以由合适的grna结合的人cll1的靶域的序列。相应的grna通常将包括可以包含等同rna序列的靶向域。
[0640]
grna名称序列pam外显子grna acccagaaattggcaaatttg(seq id no:1)ggg外显子2grna battccagaactccagtgaga(seq id no:2)tgg外显子2grna cgagctatatagcaaagaaca(seq id no:3)agg外显子4grna dggtggctattgtttgcagtg(seq id no:4)tgg外显子4grna ettgtttgcagtgtggtggag(seq id no:5)agg外显子4grna ftagctcacgacataatttgg(seq id no:6)tgg外显子4grna gggctattgtttgcagtgtgg(seq id no:7)tgg外显子4grna hggagaggttcctgatcttgt(seq id no:8)tgg外显子4grna itgaatatctccaacaagatc(seq id no:9)agg外显子4grna jgttgtagagaaatatttctc(seq id no:10)tgg外显子4
[0641]
人cd34 细胞培养和电穿孔
[0642]
冷冻保存的人cd34 细胞购自hemacare,并根据制造商的说明解冻。人cd34 细胞在补充有人细胞因子(flt3、scf和tpo,均购自peprotech)的gmp scgm培养基(cellgenix)中培养2天。在电穿孔之前,将cas9蛋白和ms-sgrna(重量比为1:1)混合并在室温下温育10分钟。使用lonza 4d-nucleofector和p3原代细胞试剂盒(程序ca-137),用cas9核糖核蛋白复合物(rnp)对cd34 细胞进行电穿孔。细胞在37℃下培养直至分析。通过cellometer和viastain aopi染色(nexcelom biosciences)测量细胞存活力。
[0643]
基因组dna分析
[0644]
使用prepgem dna提取试剂盒(zygem)在电穿孔后2天从细胞中提取基因组dna。通过pcr扩增感兴趣的基因组区域。
[0645]
通过sanger测序(genewiz)分析pcr扩增子,并使用tide(通过分解追踪插入/缺失(tracking of indels by decomposition))计算等位基因修饰频率。体外集落形成单位(cfu)测定
[0646]
电穿孔后两天,将500个cd34 细胞一式两份地铺板在6孔板上的1.1ml的甲基纤维素(methocult h4034 optimum,stem cell technologies)中,并培养两周。然后使用stem vision(stem cell technologies)对集落进行计数和评分。
[0647]
结果
[0648]
如上所述,用cas9蛋白和指定的靶向cll1的grna对人cd34 细胞进行电穿孔。
[0649]
通过由tide评估的%indel(图1和2c)确定编辑百分比。
[0650]
如图1所示,grna d、f和g显示出高比例的插入/缺失,在约80-100%的细胞范围内。相比之下,grna a和h的插入/缺失比例要低得多,在约10-20%的细胞范围内。grna b、c、e和i显示出中间比例的插入/缺失,在约30-60%的细胞范围内。
[0651]
进一步评估了cll1 grna d的细胞存活力和体外分化(图2a)。如图2b所示,在电穿孔后48小时,用grna d电穿孔的细胞显示出与阴性对照细胞相当的存活力。这些细胞还显示出强大的cll1/clec12a基因座编辑效率,插入/缺失百分比为约70%(图2c)。此外,如图2d所示,用grna d电穿孔的细胞能够在体外分化。特别是,大量bfu-e和cfu-g/m/gm集落由接受grna d的细胞形成。在grna d电穿孔细胞中也观察到较低水平的cfu-gemm集落形成。
[0652]
实施例2:针对两种细胞表面抗原编辑的细胞的生成和评估
[0653]
结果
[0654]
通过流式细胞术在未经编辑的molm-13细胞和thp-1细胞(均为人aml细胞系)中测量cd33、cd123和cll1(clec12a)的细胞表面水平。molm-13细胞具有高水平的cd33和cd123,以及中低水平的cll1。hl-60细胞具有高水平的cd33和cll1,以及低水平的cd123(图3)。
[0655]
使用如本文所述的grna和cas9在hl-60细胞中突变cd33和cll1,通过流式细胞术分选纯化cd33和cll1修饰的细胞,并测量cd33和cll1的细胞表面水平。野生型hl-60细胞中cd33和cll1水平高;编辑cd33仅导致低cd33水平;编辑cll1仅导致低cll1水平,编辑cd33和cll1导致低水平的cd33和cll1(图4。然后使用如本文所述的体外细胞毒性测定法测试经编辑的细胞对cart效应细胞的抗性。在模拟car对照条件下,所有四种细胞类型(野生型、cd33-/-、cll1-/-和cd33-/-cll1-/-)均经历了低水平的特异性杀伤(图5,最左侧的一组条形图)。cd33 car细胞有效地杀伤野生型和cll1-/-细胞,而cd33-/-和cd33-/-cll1-/-细胞显示对cd33 car具有统计上显著的抗性(图5,第二组条形图)。cll1 car细胞有效地杀伤野生型和cd33-/-细胞,而cll1-/-和cd33-/-cll1-/-细胞显示对cll1 car具有统计上显著的抗性(图5,第三组条形图)。cd33 car和cll1 car细胞库有效地杀伤野生型细胞、cd33-/-细胞和cll1-/-细胞,而cd33-/-cll1-/-细胞显示对car细胞库具有统计上显著的抗性(图5,最右侧的一组条形图)。该实验表明,敲除两种抗原(cd33和cll1)保护细胞抵抗靶向两种抗原的car细胞。此外,经编辑的细胞群含有足够高比例的在两种抗原的两个等位基因上经编辑的细胞,并且具有足够低的细胞表面抗原的细胞表面水平,从而实现了对两种类型的car细胞具有统计上显著的抗性。
[0656]
使用如本文所述的tide分析对人cd34 细胞中基因编辑的效率进行量化。在内源性cd33基因座处,当单独或与cd123或cll1组合靶向cd33时,观察到约70-90%的编辑效率
(图6,左图)。在内源性cd123基因座,当单独或与cd33或cll1组合靶向cd123时,观察到约60%的编辑效率(图6,中心图)。在内源性cll1基因座,当单独或与cd33或cd123组合靶向cll1时,观察到约40-70%的编辑效率(图6,右图)。该实验表明,人cd34 细胞可以在两个细胞表面抗原位点进行高频率编辑。
[0657]
通过如本文所述的集落形成测定法测量基因编辑的人cd34 细胞的分化潜能。对cd33、cd123或cll1进行编辑的细胞,单独或以所有成对组合产生bfu-e集落,显示细胞在该测定中保留了显著的分化潜能(图7a)。经编辑的细胞还产生了cfu-g/m/gm集落,显示细胞在该测定中保留了分化潜能,其与未经编辑的对照在统计学上无法区分(图7b)。经编辑的细胞还产生可检测的cfu-gemm集落(图7c)。集落形成单位(cfu)-g/m/gm集落是指cfu-g(粒细胞)、cfu-m(巨噬细胞)和cfu-gm(粒细胞/巨噬细胞)集落。cfu-gemm(粒细胞/红系/巨噬细胞/巨核细胞)集落来自分化程度较低的细胞,该细胞是产生cfu-gm集落的细胞的前体。总之,分化测定表明,在两个基因座编辑的人cd34 细胞保留了分化成多种细胞类型的能力。
[0658]
材料和方法
[0659]
aml细胞系
[0660]
人aml细胞系hl-60从美国典型培养物保藏中心(atcc)获得。hl-60细胞在补充有20%热灭活hyclone胎牛血清(ge healthcare)的iscove改良dulbecco培养基(imdm,gibco)中培养。人aml细胞系molm-13从addexbio technologies获得。molm-13细胞在补充有10%热灭活hyclone胎牛血清(ge healthcare)的rpmi-1640培养基(atcc)中培养。
[0661]
向导rna设计
[0662]
所有sgrna均是通过人工检查与靶区域非常接近的spcas9 pam(5
’‑
ngg-3’)设计的,并通过用在线搜索算法(benchling,doench et al 2016,hsu et al 2013)最小化人基因组中潜在的脱靶位点,根据预测的特异性进行优先级排序。所有设计的合成sgrna均购自synthego,在5’和3’末端的三个端位置具有化学修饰的核苷酸。修饰的核苷酸含有2
’‑
o-甲基-3
’‑
硫代磷酸酯(缩写为“ms”)并且ms-sgrna经hplc纯化。cas9蛋白购自aldevron。通常,本文实施例中描述的grna是包含20个核苷酸(nt)的靶向域序列、12nt的crrna重复序列、4nt的四环序列和64nt的tracrrna序列的sgrna。
[0663]
表5:可以由合适的grna结合的人cd33、cd123或cll-1的靶域的序列。还提供了相邻的pam序列。合适的grna通常包含靶向域,该靶向域可以包含与靶域序列等同的rna序列。
[0664][0665]
aml细胞系电穿孔
[0666]
在电穿孔之前,将cas9蛋白和ms-sgrna(重量比为1:1)混合并在室温下温育10分钟。使用具有程序thp-1和opt-3的maxcyte atx电穿孔系统,用cas9核糖核蛋白复合物(rnp)分别对molm-13和hl-60细胞进行电穿孔。细胞在37℃下温育5-7天,直到流式细胞术分选。
[0667]
人cd34 细胞培养和电穿孔
[0668]
冷冻保存的人cd34 细胞购自hemacare,并根据制造商的说明解冻。人cd34 细胞在补充有人细胞因子(flt3、scf和tpo,均购自peprotech)的gmp scgm培养基(cellgenix)中培养2天。使用lonza 4d-nucleofector和p3原代细胞试剂盒(程序ca-137),用cas9 rnp(重量比为1:1的cas9蛋白和ms-sgrna)对cd34 细胞进行电穿孔。对于双ms-sgrna的电穿孔,添加等量的每种ms-sgrna。细胞在37℃下培养直至分析。
[0669]
基因组dna分析
[0670]
使用prepgem dna提取试剂盒(zygem)在电穿孔后2天从细胞中提取基因组dna。通过pcr扩增感兴趣的基因组区域。
[0671]
通过sanger测序(genewiz)分析pcr扩增子,并使用可在万维网tide.deskgen.com上获得的tide(通过分解追踪插入/缺失)软件计算等位基因修饰频率。
[0672]
体外集落形成单位(cfu)测定
[0673]
电穿孔两天后,将500个cd34 细胞一式两份地铺板在6孔板上的1.1ml的甲基纤维素(methocult h4034 optimum,stem cell technologies)中,并培养两周。然后使用stem vision(stem cell technologies)对集落进行计数和评分。
[0674]
流式细胞术分析和分选
[0675]
针对人cd33(p67.6)、cd123(9f5)和cll1(rea431)的荧光染料缀合抗体分别购自biolegend、bdbiosciences和miltenyibiotec。所有抗体均用它们各自的同种型对照进行了测试。在人trustain fcx存在下,通过在冰上用特异性抗体温育细胞30分钟来进行细胞表面染色。对于所有染色,通过dapi(biolegend)染色将死细胞从分析中排除。用attunenxt流式细胞仪(thermofisher scientific)和flowjo软件(treestar)采集和分析所有样品。
[0676]
对于流式细胞术分选,细胞用荧光染料缀合抗体染色,然后用moflowastrios细胞
分选仪(beckman coulter)分选。
[0677]
car构建体和慢病毒生产
[0678]
构建第二代car以靶向cd33和cll-1,用于cd33/cll-1多重细胞毒性实验的抗cd33 car-t除外。每个car由细胞外scfv抗原结合域,使用cd8α信号肽、cd8α铰链和跨膜区、4-1bb共刺激域和cd3ξ信号传导域组成。抗cd33 scfv序列从克隆p67.6(mylotarg)获得,并且cll-1scfv序列从克隆1075.7获得。抗cd33使用scfv的从重到轻的方向,且抗cll1 car构建体使用从轻到重的方向。重链和轻链通过(gggs)3接头(seq id no:63)连接。将每个靶标的car cdna序列亚克隆到pcdh-ef1α-mcs-t2a-gfp表达载体的多克隆位点,并按照制造商的方案(system biosciences)生成慢病毒。使用lipofectamine 3000(thermofisher)通过瞬时转染293tn细胞(system biosciences)可以生成慢病毒。通过将抗cd33 scfv的轻链和重链(克隆my96)至cd8α铰链域、icos跨膜域、icos信号传导域、4-1bb信号传导域和cd3ξ信号传导域克隆到慢病毒质粒phiv-zsgreen中来生成car构建体。
[0679]
car转导和扩增
[0680]
根据制造商的方案(stem cell technologies),使用抗cd4和抗cd8微珠通过磁珠分离从leukopak(stem cell technologies)分离人原代t细胞。纯化的cd4 和cd8 t细胞1:1混合,并使用抗cd3/cd28偶联dynabeads(thermofisher)以1:1的珠与细胞比率活化。使用的t细胞培养基是补充有免疫细胞血清替代物、l-谷氨酰胺和glutamax(全部购自thermofisher)和100iu/ml的il-2(peprotech)的cts optimizer t细胞扩增培养基。在聚凝胺(sigma)存在下通过离心接种(spinoculation)在活化后24小时进行t细胞转导。car-t细胞在冷冻保存前培养9天。在所有实验之前,将t细胞解冻并在37℃下静置4-6小时。
[0681]
基于流式细胞术的car-t细胞毒性测定
[0682]
通过比较靶细胞的存活相对于阴性对照细胞的存活来测量靶细胞的细胞毒性。对于cd33/cll1多重细胞毒性测定,使用野生型和crispr/cas9编辑的hl60细胞作为cd33/cll-1多重细胞毒性测定的靶细胞。使用野生型raji细胞系(atcc)作为两个实验的阴性对照。根据制造商的说明,靶细胞和阴性对照细胞分别用celltrace violet(ctv)和cfse(thermofisher)进行染色。染色后,靶细胞和阴性对照细胞以1:1混合。
[0683]
使用抗cd33或cll1 car-t细胞作为效应t细胞。使用未转导t细胞(模拟car-t)作为对照。对于carpool组,适当的car-t细胞以1:1混合。将效应t细胞与靶细胞/阴性对照细胞混合物以1:1的效应物与靶标比率共培养,一式两份。包括一组没有效应t细胞的单独的靶细胞/阴性对照细胞混合物作为对照。在流式细胞术分析之前,将细胞在37℃下温育24小时。使用碘化丙啶(thermofisher)作为存活力染料。对于特异性细胞裂解的计算,使用了活靶细胞与活阴性对照细胞的级分(称为靶级分)。特异性细胞裂解计算为((没有效应细胞的靶级分-有效应细胞的靶级分)/(没有效应器的靶级分))
×ꢀ
100%。
[0684]
实施例3:设计和筛选用于在人细胞中编辑cll1的grna
[0685]
sgrna构建体的设计
[0686]
本实施例中研究的grna是通过检查与靶区域非常接近的spcas9pam设计的。提取在3’末端具有spcas9pam(5
’‑
ngg-3’)的编码区的所有20bp序列。使用这些方法,设计了如表2和表6中所述的总共123个靶向人cll1靶域的grna。
[0687]
在thp-1细胞中筛选grna
[0688]
根据脱靶预测算法(基于错配的数目)过滤123个grna,该算法鉴定了66个grna用于在thp-1细胞中进一步研究。人aml细胞系thp-1从美国典型培养物保藏中心(atcc)获得。培养thp-1细胞,并用由cas9蛋白和grna(以1:1的重量比混合)组成的核糖核蛋白rnp复合物进行电穿孔。从细胞中提取基因组dna,并通过pcr对所研究的所有66个grna扩增感兴趣的基因组区域。然后通过sanger测序分析pcr扩增子,以计算两次复制品中的编辑频率(ice,或crispr编辑的干扰),其显示于表7。在第一复制品中,获得了经扩增和测序的所有grna的编辑频率。在第二复制品中,获得了42/66个grna的编辑频率,并且每个grna的结果在两个复制品中相当。如表7所示,研究的grna中的20个具有≥80的ice值或编辑频率。
[0689]
表7.设计用于靶向thp-1细胞中人cll1的grna的编辑频率
[0690]
[0691]
[0692][0693]
在原代cd34 人干细胞和祖细胞(hspc)中筛选grna
[0694]
培养原代人cd34 hspc并用由cas9蛋白和表8中列出的14个grna之一组成的核糖核蛋白rnp复合物进行电穿孔。筛选的这14个grna包括选自在thp-1细胞中进行的筛选的那些和/或具有有利脱靶谱的那些grna。
[0695]
表8.在人cd34 细胞中筛选的cll1 grna的靶域的序列。相应的grna包含由等同rna序列组成的靶向域。靶区域命名法基于cll1同等型enst00000355690.8。
[0696]
grnaseq id no:序列pam靶区域
grna a1cccagaaattggcaaatttgggg外显子2grna b2attccagaactccagtgagatgg外显子2grna c3gagctatatagcaaagaacaagg外显子4grna d4ggtggctattgtttgcagtgtgg外显子4grna e5ttgtttgcagtgtggtggagagg外显子4grna f6tagctcacgacataatttggtgg外显子4grna g7ggctattgtttgcagtgtggtgg外显子4grna h8ggagaggttcctgatcttgttgg外显子4grna i9tgaatatctccaacaagatcagg外显子4grna j10gttgtagagaaatatttctctgg外显子4grna k2119cctgaagaagattccactcgtgg外显子6grna o240atataatcaactcctctgcctgg外显子6grna p198cttgtccaaggagatggatttgg外显子5grna p242aatagacacttaccaggcagagg外显子6
[0697]
计算了这些grna在原代人cd34 hspc中的编辑频率,并在图8和图9中进行了描绘。在测试的14个grna中,5个显示出超过80%的编辑效率(图8和图9)。这些grna包括grna d、grna f、grna g、grna o2和grna p2,并其计算的平均编辑效率显示于表9。
[0698]
表9.在原代人cd34 hspc中筛选的grna的平均编辑效率
[0699][0700][0701]
量化了在原代人cd34 细胞中评估的grna d、grna f、grna g、grna o2和grna p2的indel(插入/缺失)分布,并显示于图10。每个grna导致indel范围为-21到 1。grna d产生不同大小,包括-21、-9、-7、-5、-1、0和 1的indel,其中 1的indel以最高频率出现。grna f产生不同大小,包括-3、-2、-1、0和 1的indel,其中-1的indel以最高频率出现。grna g导致不同大小,包括-10、-7、-5、-2、-1和 1的indel,其中-2的indel以最高频率出现。grna o2导致不同大小,包括-6、0和 1的indel,其中 1的indel以最高频率出现。grna p2导致不同大小,包括-6、-4、-3、-2、-10和 1的indel,其中-4的indel以最高频率出现。
[0702]
还预测了grna d、grna f、grna g、grna o2和grna p2的脱靶效应,如表10所示。基于最小化脱靶效应对grna进行优先级排序。这些脱靶预测基于序列互补性,在pam和靶标之间允许多达1个核苷酸错配,或者在向导和靶标之间允许多达3个核苷酸错配或间隙。
[0703]
表10.靶向人cll1的grna的脱靶预测
[0704][0705]
在本实施例中研究的其他靶向人cll1的grna中,三种grna (grna d、grna f和grna o2)在原代人cd34 hspc中表现出特别有效的中靶编辑,低水平的预测脱靶效应,以及期望的indel分布。
[0706]
实施例4:体内评估cll1 ko cd34 细胞
[0707]
在cd34 人hspc中进行编辑
[0708]
如实施例1和实施例3中所述设计grna(synthego)。然后使用靶向cll1的向导rna f,通过如实施例1中所述的crispr/cas9编辑人cd34 hspc。还生成了未经编辑的电穿孔对照(ep ctrl)hpsc。
[0709]
在离体编辑后,从细胞中收获基因组dna,用在靶区域侧翼的引物进行pcr扩增,纯化,并分析,以确定它们在cd34 hspc中的编辑效率。如表11所示,grna f具有较高编辑效率,分别为75.4%。
[0710]
表11.cll1 grna的基因编辑效率
[0711]
cd34
hspc编辑效率仅ep对照n/a经cll1 grna f编辑75.4%(tide)
[0712]
研究cll1 ko cd34 hspc在体内的植入效率和持久性
[0713]
用经grna f编辑或未经编辑(ep ctrl)的cll1 ko hspc植入雌性未照射nod,b6.scidil2rγ-/-kit(w41/w41)(nbsgw)小鼠(n=15)(图11)。在植入后第8周和第12周,从每只小鼠收集外周血用于通过fac分析测量植入。在植入后第16周,处死小鼠并收集血液、脾和骨髓用于facs分析多谱系分化(图11)。
[0714]
从植入动物的骨髓中获得的细胞样本的结果
[0715]
在植入后第16周,将小鼠中人白细胞嵌合性的比率计算为接受未经编辑的对照细胞(ep ctrl)或由grnaf编辑的cll1 ko细胞的小鼠的两个组(n=15只小鼠/组)中,人cd45 (hcd45 )细胞在总cd45 细胞群(人和小鼠cd45 细胞的总和)中的百分比(图12a)。如图12a所示,骨髓嵌合性在对照组和cll1 ko组中是等同的,表明有核骨髓频率没有损失。
[0716]
此外,在植入后第16周,量化了骨髓中对人cd34(hcd34 )也呈阳性的hcd45 细胞百分比(图12b)。如图12b所示,同样表达hcd34 的hcd45 细胞的百分比在对照组或cll1 ko组中是等同的。
[0717]
在植入后第16周,在骨髓中量化了为b细胞、t细胞、单核细胞、中性粒细胞、常规树突状细胞(cdc)、浆细胞样树突状细胞(pdc)、嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞的
hcd45 细胞的百分比(图12c)。这些不同免疫细胞亚型的百分比在对照组和cll1 ko组之间是等同的。这些数据表明小鼠中来自经编辑的cll1 ko细胞的多谱系人造血重建。
[0718]
在植入后第16周,在对照和植入cll1 ko细胞的小鼠的骨髓中量化了为hcd45 的cll1 ko细胞的百分比(图12d)。与对照组相比,由grna f编辑的cll1 ko细胞中hcll1 hcd45 细胞的百分比显著更低,表明这些组中来自有核血细胞的cll1的损失。这些数据还证明了cll1 ko hsc在nbsgw小鼠骨髓中的长期持久性。
[0719]
实施例5:体外评估cll1 ko cd34 细胞
[0720]
在cd34 人hspc中进行编辑
[0721]
如实施例1和实施例3中所述设计grna (synthego)。然后使用靶向cll1的向导rna f,通过如实施例1中所述的crispr/cas9编辑人cd34 hspc,以及未经编辑的电穿孔对照(ep ctrl)。
[0722]
在离体编辑后,从细胞中收获基因组dna,用在靶区域侧翼的引物进行pcr扩增,纯化,并通过tide分析,以确定在cd34 hspc中的编辑频率。如图13a所示,grna f显示出79.2%的编辑频率。在经grna f编辑的cll1 ko细胞、未经编辑的对照(ep ctrl)或fmo(荧光减一)对照中通过fac也量化cll1的细胞表面表达。与未经编辑的对照(ep ctrl)相比,经grna f编辑的cd34 hspc表现出较低的cll1表达(图13a)。
[0723]
用髓样分化培养基培养未经编辑的对照细胞(ep ctrl)或经grna f编辑的cll1 ko细胞,诱导粒细胞(图13b)或单核细胞(图13c)谱系,并且随着时间的推移对细胞数目进行量化。cll1 ko细胞在粒细胞(图13b)和单核细胞(图13c)分化培养物中表现出与未经编辑的对照细胞相当的细胞生长。
[0724]
此外,在编辑和培养未经编辑的对照细胞或由grna f编辑的cll1 ko细胞后第0、7和14天,对粒细胞分化中cll 细胞(图14a,上)或单核细胞分化中cll1 细胞(图14a,下)的百分比进行量化。与未经编辑的对照细胞相比,由cll1 ko细胞生成的粒细胞和单核细胞随着时间的推移表现出持续的cll1表达丧失(图14a)。还评估了cll1 ko细胞在体外分化成髓样细胞的能力。在编辑和培养未经编辑的对照细胞或由grna f编辑的cll1 ko细胞后第0、7和14天,量化了cd15 (图14b,左上)或cd11b 阳性粒细胞(图14b,右上)的百分比。这些粒细胞标志物的表达不受cll1损失的影响。在编辑和培养未经编辑的对照细胞或由grna f编辑的cll1 ko细胞后第0、7和14天,也量化了cd14 (图14b,左下)或cd11b 阳性单核细胞(图14b,右下)的百分比。与粒细胞标志物相似,这些单核细胞标志物的表达不受cll1损失的影响。cll1破坏也没有改变cd33(髓样细胞的标志物)和hla-dr(抗原呈递)的表达。这些数据表明cll1的损失不影响体外髓样分化。
[0725]
也在体外评估了cll1 ko细胞的功能。在对照细胞群和cll1 ko细胞群中量化了粒细胞(图15,上)和单核细胞(图15,下)进行的吞噬作用的百分比。对于粒细胞和单核细胞两者,对照细胞和cll1 ko细胞之间的吞噬活性等同,表明cll1 ko细胞保留了吞噬活性(图15)。还评估了cll1 ko细胞在刺激后产生炎性细胞因子的能力。未经刺激或用lps或r848刺激由未经编辑的对照细胞或由grna f编辑的cll1 ko细胞产生的粒细胞(图16a)和单核细胞(图16b)。随后量化了il-6(图16a或16b,左)和tnf-α(图16a或16b,右)的水平。cll1 ko粒细胞和单核细胞在tlr激动剂刺激后表现出完整的炎性细胞因子产生,并且细胞因子的产生与未经编辑的对照细胞等同。cll1破坏也没有改变其他细胞因子的产生,包括il-1β和
mip-1α。总之,这些数据表明cll1的损失不影响体外髓样细胞功能。
[0726]
经grna f编辑的基因编辑的cd34 cll1 ko细胞的分化潜能也通过集落形成(formulation)测定来测量。电穿孔后,将cd34 编辑的细胞铺板并培养两周。然后使用stemvision(stem cell technologies)对集落进行计数和评分。与未经编辑的对照细胞相比,由grna f(编辑频率为79.2%)编辑的cll1细胞产生的bfu-e、cfu-g/m/gm和cfu-gemm集落更少(图17a)。然而,编辑cll1的细胞产生了与未经编辑的对照细胞相似的bfu-e集落(爆发形成单位-红系)、cfu-g/m/gm集落和cfu-gemm集落的分布和百分比,显示cll1编辑的细胞在该测定中保留了显著的分化潜能(图17b)。集落形成单位(cfu)-g/m/gm集落是指cfu-g(粒细胞)、cfu-m(巨噬细胞)和cfu-gm(粒细胞/巨噬细胞)集落。cfu-gemm(粒细胞/红系/巨噬细胞/巨核细胞)集落来自分化程度较低的细胞,该细胞是产生cfu-gm集落的细胞的前体。总之,分化测定表明在cll1基因座编辑的人cd34 细胞保留了分化成多种细胞类型的能力。
[0727]
实施例6:cll1编辑的细胞对cart效应细胞的抗性的评估
[0728]
本实施例描述了cll1编辑的细胞对靶向cll1的cart效应细胞的抗性的评估。如通过本文所述的测定法测量的,与野生型cll1 细胞相比,缺乏cll1表达的cll1 ko细胞对cll1 car杀伤具有抗性。
[0729]
在cd34 人hspc中进行编辑
[0730]
如实施例3中所述设计grna(synthego)。然后使用cll1靶向grna,例如表2、6或8的cll1靶向grna,通过如实施例1中所述的crispr/cas9编辑人cd34 hspc。
[0731]
car构建体和慢病毒生产
[0732]
构建第二代car以靶向cll1。car由细胞外scfv抗原结合域,使用cd8α信号肽、cd8α铰链和跨膜区、4-1bb或cd28共刺激域和cd3ξ信号传导域组成。抗cll1 car以轻链到重链的方向使用来自克隆1075.7的cll-1scfv序列。重链和轻链通过(gggs)3接头(seq id no:63)连接。将cll1 car cdna序列亚克隆到pcdh-ef1α-mcs-t2a-gfp表达载体的多克隆位点,并按照制造商的方案(system biosciences)生成慢病毒。使用lipofectamine 3000(thermofisher)瞬时转染293tn细胞(system biosciences)可以生成慢病毒。
[0733]
car转导和扩增
[0734]
根据制造商的方案(stem cell technologies),使用抗cd4和抗cd8微珠通过磁珠分离从leukopak(stem cell technologies)中分离人原代t细胞。纯化的cd4 和cd8 t细胞1:1混合,并使用抗cd3/cd28偶联dynabeads(thermofisher)以1:1的珠与细胞比率活化。t细胞培养基是补充有免疫细胞血清替代物、l-谷氨酰胺和glutamax(全部购自thermofisher)和100iu/ml的il-2(peprotech)的cts optimizer t细胞扩增培养基。在聚凝胺(sigma)存在下通过离心接种在活化后24小时进行t细胞转导。car-t细胞在冷冻保存前培养9天。在所有实验之前,将t细胞解冻并在37℃下静置4-6小时。
[0735]
基于流式细胞术的car-t细胞毒性测定
[0736]
通过比较靶细胞的存活相对于阴性对照细胞的存活来测量靶细胞的细胞毒性。对于cll1测定,使用野生型和crispr/cas9编辑的人cd34 hspc作为靶细胞。使用野生型raji细胞系(atcc)作为阴性对照。根据制造商的说明,靶细胞和阴性对照细胞分别用celltrace violet(ctv)和cfse(thermofisher)染色。染色后,靶细胞和阴性对照细胞以1:1混合。
[0737]
使用抗cll1 car-t细胞作为效应t细胞。使用未转导t细胞(模拟car-t)作为对照。将效应t细胞与靶细胞/阴性对照细胞混合物以1:1的效应与靶的比例共培养,一式两份。包括一组没有效应t细胞的单独的靶细胞/阴性对照细胞混合物作为对照。在流式细胞术分析之前,将细胞在37℃下温育24小时。使用碘化丙啶(thermofisher)作为存活力染料。对于特异性细胞裂解的计算,使用了活靶细胞与活阴性对照细胞的分数(称为靶分数)。特异性细胞裂解计算为(((没有效应细胞的靶分数-有效应细胞的靶分数)/(没有效应细胞的靶分数))
×ꢀ
100%。
[0738]
上述分析表明,cll1 ko hpsc(及其后代)对抗cll1 car-t介导的杀伤具有抗性,而未经编辑的对照hpsc(及其后代)对抗cll1 car-t介导的杀伤易感。
[0739]
实施例7:血液疾病的治疗
[0740]
提供了使用本文所述的方法、细胞和药剂用于急性髓样白血病或mds的示例性治疗方案。简而言之,鉴定作为接受造血干细胞植入(hsct)候选者的患有aml或mds的受试者。鉴定合适的hsc供体,例如hla匹配的供体,并从供体获得hsc,或者如果合适,获得来自受试者的自体hsc。
[0741]
根据方案并使用本文提供的策略和组合物,例如,靶向表2、6或8中任一个中描述的靶向cll1靶域的合适的向导rna编辑如此获得的hsc。在示例性实施方案中,使用包含本文所述的针对grna d、grna f或grna o2的靶向域的grna来实现编辑。简而言之,使用合适的向导rna和合适的rna引导的核酸酶,例如cas9核酸酶,通过crispr基因编辑引入cll1的靶向修饰(缺失、截短、取代),导致在至少80%的经编辑的hsc群中的cll1表达损失。
[0742]
患有aml或mds的受试者可以根据临床护理标准进行预处理,这可以包括例如输注化疗剂(例如依托泊苷、环磷酰胺)和/或照射。然而,根据受试者的健康状态和受试者的疾病进展状态,可以省略这种预处理。
[0743]
向受试者施用靶向cll1的免疫疗法,例如靶向cll1的car-t细胞疗法。将来自供体的经编辑的hsc或来自受试者的经编辑的hsc施用于受试者,并监测受试者中将hsc的植入、存活和/或分化成造血谱系的成熟细胞。cll1靶向免疫疗法选择性地靶向并杀伤表达cll1的恶性或恶性前细胞,并且也可能靶向受试者中一些表达cll1的健康细胞,但不靶向受试者中经编辑的hsc或其后代,因为这些细胞对通过cll1靶向免疫疗法的靶向和杀伤具有抗性。
[0744]
在施用免疫疗法和经编辑的hsc后,定期监测受试者的健康状态和疾病进展,以确认表达cll1的恶性或恶性前细胞的负荷减少,并确认经编辑的hsc及其后代的成功植入。
[0745]
等同物和范围
[0746]
本领域的技术人员将认识到或能够仅仅使用常规实验来确定本文所述的示例性实施方案的许多等同物。本公开的范围不旨在限于以上描述。
[0747]
诸如“一个”、“一种”和“该”的冠词可以意指一个或多于一个,除非有相反的说明或从上下文中以其他方式明显。如果存在一个、多于一个或所有的组成员,则认为在组的两个或多个成员之间包含“或”的权利要求或描述被满足,除非有相反的说明或从上下文中以其他方式明显。在两个或多个组成员之间包括“或”的组的公开提供了其中恰好存在该组的一个成员的实施方案、其中存在该组的多个成员的实施方案以及其中存在所有组成员的实施方案。出于简洁的目的,这些实施方案在本文中没有单独说明,但应当理解,这些实施方
案中的每一个在本文中提供并且可以被具体地要求或放弃。
[0748]
应当理解,本发明涵盖所有变化、组合和排列,其中将来自一项或多项权利要求或来自描述的一个或多个相关部分的一个或多个限制、元素、条款或描述性术语引入另一项权利要求。例如,可以修改从属于另一权利要求的权利要求以包括在从属于同一基本权利要求的任何其他权利要求中找到的一个或多个限制。此外,当权利要求列举组合物时,应理解,包括根据本文公开的任何制备或使用方法或根据本领域已知的方法(如果有的话)来制备或使用该组合物的方法,除非另有说明或除非对于本领域的普通技术人员来说,显然会出现矛盾或不一致。
[0749]
在元素以列表形式呈现的情况下,应当理解,每个可能的单个元素或元素的子组也被公开,并且任何元素或元素的子组均可以从组中除去。还应注意,术语“包括”旨在是开放的并且允许包括额外的元素、特征或步骤。应当理解,一般而言,在将实施方案称为包括特定元件、特征或步骤的情况下,也提供了由或基本上由此类元件、特征或步骤组成的实施方案。出于简洁的目的,这些实施方案在本文中没有单独说明,但应当理解,这些实施方案中的每一个在本文中提供并且可以被具体地要求或放弃。
[0750]
在给出范围的地方,包括端点。此外,要理解的是,除非另有说明或从上下文和/或本领域普通技术人员的理解中以其他方式明显,表示为范围的值可以假定在一些实施方案中的指定范围内的任何特定值,至范围下限的单位的十分之一,除非上下文另有明确规定。为简洁起见,每个范围内的值在本文中并未单独拼出,但应理解,这些值中的每一个均在本文中提供并且可以被具体要求或放弃。还应理解的是,除非另有说明或从上下文和/或本领域普通技术人员的理解中以其他方式明显,表示为范围的值可以假定给定范围内的任何子范围,其中子范围的端点表示为与范围下限单位的十分之一相同的精确度。
[0751]
本文提及的所有出版物、专利申请、专利和其他参考文献(例如,序列数据库参考号)通过引用整体并入。例如,本文,例如,在本文的任何表中提及的所有genbank、unigene和entrez序列,均通过引用并入。除非另有说明,本文,包括在本文的任何表中指定的序列登录号,指的是截至2019年8月28日当前的数据库条目。当一个基因或蛋白质引用多个序列登录号时,涵盖所有序列变体。
[0752]
此外,应当理解,本发明的任何特定实施方案可以明确地排除在权利要求的任何一项或多项之外。在给出范围的情况下,范围内的任何值可以明确地排除在权利要求的任何一项或多项之外。为简洁起见,其中排除一个或多个元件、特征、目的或方面的所有实施方案均未在本文中明确阐述。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。