1.本发明涉及一种止血、防止粘连及伤口治愈用创伤敷料及其制备方法。更具体地说,本发明涉及一种创伤敷料的制备方法,该制备方法在制备创伤敷料时,通过调节透明质酸(hyaluronic acid,ha)及胶原蛋白的配合比及冻结干燥条件,能够制备出不仅有最佳的创伤治愈促进效果及防止粘连效果,还具有优异的经济性及商业性的创伤敷料。
背景技术:
2.创伤(wound)是指组织的连续性被外部压力破坏的状态。创伤的治愈过程一般分为炎症步骤、增殖步骤及成熟步骤等三个步骤,为治疗创伤,需使用理想的敷料(dresssing)来阻止创伤部位暴露于外部环境,从而预防感染,抑制炎症反应。作为用于创伤治疗的生物敷料材料,正在开发许多以真皮中的胶原蛋白、弹性蛋白等物质为原料的敷料材料,这些物质相当于人体皮肤的组成部分。就胶原蛋白而言,它作为构成人体骨骼和皮肤等组织的主要蛋白质发挥着重要作用,皮肤的70%由胶原蛋白组成,其在组织重构(remodeling)和创伤治愈中起着重要的生理作用。此外,各项研究表明,胶原蛋白可有效治愈创伤。作为这些生物敷料材料的例子,韩国专利申请公开号第10-2010-0009305号公开了通过将疏水性脂肪酸基团与壳聚糖结合而增加细胞粘附蛋白的粘附性能的壳聚糖海绵及使用其的创伤敷料材料。
3.此外,透明质酸是由n-乙酰-d-氨基葡萄糖(n-acetyl-d-glucosamine)和d-葡萄糖醛酸(d-glucuronic acid)组成,且上述重复单元呈线形连接的生物高分子物质,多存在于眼球的玻璃液、关节的滑液及鸡冠中。透明质酸因其优异的生物相容性和粘弹性被开发并用于各种用途,如术后防粘连剂、皱纹改善剂、整形辅助材料、关节功能改善剂、药物递送(drug delivery)载体及细胞培养支架(scaffold)等(f.manna,m.dentini,p.desider,o.de pita,e.mortilla,b.maras,journal of european academy of dermatology and venereology,13(1999)183-192)。
4.而关于使用胶原蛋白和透明质酸的创伤敷料,韩国公开专利第2013-0009651号公开了一种软骨细胞治疗剂,其包含胶原蛋白、透明质酸衍生物及源自哺乳动物脐带的干细胞,但它是只单纯混合胶原蛋白和透明质酸的方式,存在不使用化学交联物质就无法为达到其目的剂型化的问题。此外,还存在可以使用的剂型只能为干燥相剂型的缺点,因此具有在使用领域及使用方法方面无法提供多种方法的局限性。
技术实现要素:
5.发明要解决的问题
6.对此,本发明的发明人为开发能够大幅度提高创伤敷料的质量和可靠性的产品而进行了努力,结果发现了通过调节透明质酸钠及胶原蛋白的配合比及冻结干燥条件,不仅可以具有最佳的创伤治愈促进效果及防止粘连效果,还可具有优异的经济性及商业性,从而完成了本发明。
7.用于解决问题的手段
8.本发明的目的是提供止血及伤口治愈用创伤敷料的制备方法。
9.本发明的目的是提供一种创伤敷料的制备方法,所述制备方法包括以下步骤:
10.(a)混合含有0.4至1重量百分比的透明质酸或其盐、0.1至0.5重量百分比的胶原蛋白、及0.3至0.6重量百分比的氯化钠的水溶液的步骤;
11.(b)将所述水溶液的ph调节至6至8的步骤;
12.(c)对所述水溶液进行冻结干燥,使其变成片状的步骤;
13.(d)使所述冻结干燥的片保持不变或通过压缩调节厚度的步骤;以及
14.(d)对已完成所述冻结干燥及厚度调节的片进行环氧乙烷气体、伽马射线或电子束灭菌的步骤。
15.发明的效果
16.根据本发明的创伤敷料可以表现出最佳的创伤治愈促进效果及防止粘连效果。
附图说明
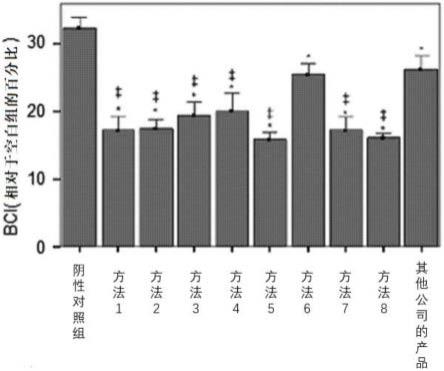
17.图1显示根据本发明的创伤敷料的体外止血效果测试的结果。
18.图2显示根据本发明的创伤敷料的利用大鼠的体内止血效果测试过程。
19.图3显示根据本发明的创伤敷料的利用大鼠的体内3分钟止血成功率。
20.图4显示根据本发明的创伤敷料的利用大鼠的体内止血效果测试中的总出血时间。
21.图5显示根据本发明的创伤敷料的防止粘连效果。
22.图6显示根据本发明的创伤敷料的防止粘连效果的组织病理学观察结果。
23.图7显示根据本发明的创伤敷料的产品质量评价结果。
具体实施方式
24.本发明的目的是提供止血及伤口治愈用创伤敷料的制备方法。
25.本说明书中所使用的术语“透明质酸”作为将透明质酸本身和透明质酸盐都包括在内的含义来使用。因此,以下使用的术语“透明质酸水溶液”是将透明质酸水溶液、透明质酸盐水溶液、及透明质酸和透明质酸盐的混合水溶液都包括在内的概念。所述透明质酸盐包括透明质酸钠、透明质酸钾、透明质酸钙、透明质酸镁、透明质酸锌、透明质酸钴等无机盐;以及透明质酸四丁基铵(tetrabuty lammonium)等有机盐。根据情况,它们中的两种或更多种可以组合使用。
26.本发明的目的是提供一种创伤敷料的制备方法,所述创伤敷料包括以下步骤:
27.(a)混合含有0.4至1重量百分比的透明质酸或其盐、0.1至0.5重量百分比的胶原蛋白、及0.3至0.6重量百分比的氯化钠的水溶液的步骤;
28.(b)将所述水溶液的ph调节至6至8的步骤;
29.(c)对所述水溶液进行冻结干燥,使其变成片(pad)状的步骤;
30.(d)使所述冻结干燥的片保持不变或通过压缩调节厚度的步骤;以及
31.(d)对已完成所述冻结干燥及厚度调节的片进行环氧乙烷气体气体(eo gas)、伽马射线或电子束灭菌的步骤。
sulfonate)或氨甲环酸(tranexamic acid)。所述阿片类镇痛剂可以包括盐酸吗啡(morphine hcl)或硫酸吗啡(morphine sulfate)。所述磺胺类药物可以包括柳氮磺胺吡啶(salazosulfapyridine)、磺胺嘧啶(sulfadiazine)、磺胺嘧啶银(silver sulfadiazine)、磺胺二甲氧嗪(sulfadimethoxine)、磺胺甲噻二唑(sulfamethizole)、磺胺甲恶唑(sulfamethoxazole)、磺胺间甲氧嘧啶(sulfamonomethoxine)、磺胺二甲基异嘧啶(sulfisomidine)或磺胺二甲异嘧啶钠(sulfisomidine sodium)。所述抗生素可以包括盐酸万古霉素(vancomycin hcl)、盐酸林可霉素(lincomycin hcl)、克林霉素(clindamycin)、替考拉宁(teicoplanin)、苯氧乙基青霉素钾(phenethicillin potassium)、青霉素钾(benzylpenicillin potassium)、苄星青霉素(benzathine benzylpenicillin)、莫匹罗星钙(二水合物)(mupirocin calcium hydrate)、阿贝卡星硫酸盐(arbekacin sulfate)、氨曲南(aztreonam)、盐酸大观霉素(spectinomycin hydrochloride)、盐酸匹美西林(pivmecillinam hydrochloride)、卡鲁莫南钠(carumonam sodium)、粘杆菌素甲基磺酸钠(colistin sodium methanesulfonate)、头孢磺啶钠(cefsulodin sodium)、头孢布烯(ceftibuten)、妥布霉素(tobramycin)、硫酸阿米卡星(amikacin sulfate)、硫酸异帕米星(isepamicin sulfate)、硫酸卡那霉素(kanamycin sulfate)、硫酸新霉素(fradiomycin sulfate)、硫酸多粘菌素b(polymyxin b sulfate)、阿扑西林(aspoxicillin)、阿莫西林(amoxicillin)、氨苄西林(ampicillin)、氨苄西林钠(ampicillin sodium)、盐酸头孢他美酯(cefetamet pivoxil hydrochloride)、盐酸头孢吡肟(cefepime hydrochloride)、盐酸头孢唑兰(cefozopran hydrochloride)、盐酸头孢替安(cefotiam hydrochloride)、盐酸头孢替安酯(cefotiam hexetil hydrochloride)、盐酸头孢卡品酯(cefcapene pivoxil hydrochloride)、盐酸头孢甲肟(cefmenoxime hydrochloride)、盐酸酞氨西林(talampicillin hydrochloride)、盐酸巴坎西林(bacampicillin hydrochloride)、盐酸仑氨西林(lenampicillin hydrochloride)、环己西林(ciclacillin)、磺苄西林钠(sulbenicillin sodium)、头孢克洛(cefaclor)、头孢唑啉钠(cefazolin sodium)、头孢曲嗪丙二醇(cefatrizine propylene glycol)、头孢羟氨苄(cefadroxil)、头孢匹林钠(cephapirin sodium)、头孢孟多钠(cefamandole sodium)、头孢氨苄(cefalexin)、头孢噻吩钠(cephalothin sodium)、头孢噻啶(cefaloridine)、头孢克肟(cefixime)、头孢西丁钠(cefoxitine sodium)、头孢他啶钠(ceftazidime sodium)、头孢噻肟钠(cefotaxime sodium)、头孢替坦钠(cefotetan sodium)、头孢哌酮钠(cefoperazone sodium)、头孢妥仑匹酯(cefditoren pivoxil)、头孢地尼(cefdinir)、头孢他啶(ceftazidime)、头孢唑肟钠(ceftizoxime sodium)、头孢替唑钠(ceftezole sodium)、头孢特仑新戊酯(cefteram pivoxil)、头孢曲松钠(ceftriaxone sodium)、头孢匹胺钠(cefpiramide sodium)、头孢拉宗钠(cefbuperazone sodium)、头孢泊肟酯(cefpodoxime proxetil)、头孢米诺钠(cefminox sodium)、头孢美唑钠(cefmetazole sodium)、头孢拉定(cefradine)、头孢沙定(cefroxadine)、头孢呋辛酯(cefuroxime axetil)、头孢呋辛钠(cefuroxime sodium)、替卡西林钠(ticarcillin sodium)、托西酸舒他西林(sultamicillin tosylate)、哌拉西林钠(piperacillin sodium)、法罗培南钠(faropenem sodium)、氟氧头孢钠(flomoxef sodium)、磷霉素(fosfomycin)、美洛培南三水合物(meropenem trihydrate)、拉氧头孢钠(latamoxef sodium)、硫酸阿司米星
(astromicin sulfate)、硫酸庆大霉素(gentamicin sulfate)、硫酸西索米星(sisomicin sulfate)、地贝卡星硫酸盐(dibekacin sulfate)、硫酸头孢噻利(cefoselis sulfate)、硫酸头孢匹罗(cefpirome sulfate)、硫酸奈替米星(netilmicin sulfate)、卡那霉素b硫酸盐(bekanamycin sulfate)、硫酸小诺霉素(micronomicin sulfate)、硫酸核糖霉素(ribostamycin sulfate)、乙酰吉他霉素(acetylkitasamycin)、乙酰螺旋霉素(acetylspiramycin)、琥乙红霉素(erythromycin ethyl succinate)、红霉素(erythromycin)、依托红霉素(erythromycin estolate)、吉他霉素(kitasamycin)、克拉霉素(clarithromycin)、乙酰麦迪霉素(midecamycin acetate)、酒石酸吉他霉素(kitasamycin tartrate)、交沙霉素(josamycin)、硬脂酸红霉素(erythromycin stearate)、丙酸交沙霉素(josamycin propionate)、麦迪霉素(midecamycin)、乳糖酸红霉素(erythromycin lactobionate)、罗红霉素(roxithromycin)、罗他霉素(rokitamycin)、盐酸四环素(tetracycline hydrochloride)、盐酸去甲金霉素(demethylchlortetracycline hydrochloride)、盐酸多西环素(doxycycline hyclate)、盐酸米诺环素(minocycline hydrochloride)、氯霉素(chloramphenicol)、琥珀酸钠氯霉素(chloramphenicol sodium succinate)、氯霉素棕榈酸酯(chloramphenicol palmitate)、环丝氨酸(cycloserine)、利福平(rifampicin)、硫酸恩维霉素(enviomycin sulfate)、硫酸链霉素(streptomycin sulfate)、氧四环素盐酸盐(oxytetracycline hydrochloride)、盐酸短杆菌肽s(gramicidin s hydrochloride)、四环素(tetracycline)、那氟沙星(nadifloxacin)、杆菌肽(bacitracin)、夫西地酸钠(fusidate sodium)或硫酸粘杆菌素(colistin sulfate)。
48.【具体实施例】
49.下面,将呈现多种实施例以帮助理解本发明。这些实施例仅为便于理解本发明而提供,本发明的范围不局限于这些实施例。
50.《实施例》
51.实施例1:按照透明质酸(ha)、胶原蛋白及氯化钠的配合比制备创伤敷料
52.将透明质酸钠、缺端胶原(atelo collagen)(猪i型胶原蛋白,porcine typeⅰcollagen)及氯化钠按下表1所示的配合比搅拌制成水溶液,将各水溶液以13.5g
±
2%的比例分装在5
×
5cm的模具中。然后,根据表4中所述的步骤进行冻结干燥,并评价所生成的创伤敷料的质地。
53.【表1】
64.②
抗凝血(anti-coagulated blood)(柠檬酸化全血,citrated whole blood)的制备
65.从实验用兔子的动脉中抽取血液。以9:1(v/v)的比例将抽取的血液和酸式柠檬酸葡萄糖(acid citrated dextrose)进行稀释,以抑制血液凝固。
66.③
实验过程
67.将每个样本切成1.0
×
1.0cm(横
×
纵)的大小,放入聚丙烯管(polypropylene tube)(50ml的锥形离心管)中,在37℃下放置10分钟。除空白试验外,每支试管中加入0.2ml的200mmcacl2,充分混合,并在37℃下放置5分钟。向每支试管加入25ml的蒸馏水,使未凝固的红细胞溶血。每种实验物质重复进行四次试验,并使用以下公式进行分析。
68.*凝血指数(blood clotting index,bci,%)=实验组的吸光度
÷
空白试液的平均吸光度
×
100
69.④
统计分析
70.试验结果服从正态分布时,通过单因素方差分析(one-way anova)中的tukey法确认统计学显著性。
[0071]-*p《0.05与阴性对照组比较、与其他公司的产品比较
[0072]
2)实验结果
[0073]
凝血指数越低,评价为止血效果越好,结果见下表3。
[0074]
【表3】
[0075]
[0076][0077]
其结果,与阴性对照组相比,确认了根据方法1至8的创伤敷料及其他公司的产品的凝血指数显著偏低,而且与其他公司的产品相比,除方法6以外的所有方法1至5、7及8的创伤敷料的凝血指数均显著偏低(图1)。
[0078]
实施例3:按照ha、胶原蛋白及氯化钠的配合比评价创伤敷料的止血效果(体内(in vivo))
[0079]
对于根据所述实施例1的创伤敷料进行如下实验:使大鼠肝脏诱发出血,并适用方法1、2及7的创伤敷料和其他公司的产品来评价止血效果。
[0080]
1)实验方法
[0081]
①
试验物质:阴性对照组(纱布)、根据方法1、2及7的创伤敷料、其他公司的产品
[0082]
②
麻醉:肌肉注射舒泰(zoletil)(30mg/kg)、龙朋(rompun)(20mg/kg),保持麻醉
后进行实验。
[0083]
③
适用方法:露出肝左叶,用3mm的活检穿孔器(biopsy punch)切出3~4mm深的伤口,以圆柱状将相应部位切除来诱导出血。将各实验物质切成2
×
2cm,并适用于出血部位(图2)。
[0084]
④
评价方法
[0085]
止血时间:粘贴试验物质后,每隔3、5、6、9分钟确认是否止血,确认各实验组的3分钟止血成功率。
[0086]
⑤
检验统计显著性
[0087]
结果值服从正态分布时,通过单因素方差分析中的tukey法确认统计学显著性。
[0088]-*p《0.05与阴性对照组比较、与其他公司的产品比较
[0089]
2)结果
[0090]
针对阴性对照组、方法1、2及7的创伤敷料及其他公司的产品确认了3分钟止血成功率,其结果分别显示出0%、40%、60%、70%及20%的3分钟止血成功率(图3)。此外,确认总出血时间的结果,阴性对照组、根据方法1、2及7的创伤敷料及其他公司产品分别为7.8分钟、4.2分钟、3.8分钟、3.8分钟及6分钟,尤其是根据方法2及7的创伤敷料与其他公司的产品相比,总出血时间在统计学上显著变短(图4)。
[0091]
实施例4:按照ha、胶原蛋白及氯化钠的配合比的创伤敷料的防止粘连评价
[0092]
对于根据所述实施例1的创伤敷料,适用于大鼠的腹腔内来评价了防止粘连性能。
[0093]
1)实验方法
[0094]
①
试验物质:阴性对照组(纱布)、根据实施例1的创伤敷料中的方法2的创伤敷料、其他公司的产品
[0095]
②
麻醉:肌肉注射舒泰(30mg/kg)、龙朋(10mg/kg),保持麻醉后进行实验。
[0096]
③
适用方法:在盲肠和腹壁的缺损部位的结扎诱导之前,将实验物质在无菌状态下切成1.5
×
1.5cm,适用于诱导粘连的组织之间。
[0097]
④
评价方法
[0098]
使用二氧化碳室对大鼠实施安乐死,确认适用于腹腔内的实验物质,肉眼评价了诱发粘连的部位。如下表,将粘连程度进行分数化,并计算各组的平均值。
[0099]
【表4】
[0100][0101]
⑤
统计显著性检验结果值服从正态分布时,通过单因素方差分析中的tukey法确认统计学显著性。
[0102]
⑥
组织病理学观察
[0103]
采集包括粘连诱发部位及正常组织在内的组织样本,采集的组织用10%的福尔马林固定后,经过修整,利用组织预处理器在酒精中脱水,进行预处理,以使石蜡更容易渗透。利用包埋机,在包埋盒中利用石蜡将其固定,制备组织块,用微型切割机进行切割并修整。制备组织片,用染色机进行he(haematoxylin&eosin)染色,并在显微镜下观察。
[0104]
2)结果
[0105]
①
组织粘连评价
[0106]
根据本发明的方法2的创伤治疗剂的情况下,表现出20%的粘连率,确认了其与阴性对照组的87%及市售产品的40%相比,具有明显改善的防止粘连效果(图5)。
[0107]
【表5】
[0108][0109]
②
组织病理学观察评价
[0110]
对于阴性对照组而言,大部分由于肉芽组织(granulation tissue)的形成,腹膜和盲肠之间发生了粘连,但是根据本发明的方法2的创伤治疗剂,未观察到肉芽组织,并确认无粘连痕迹(图6)。
[0111]
实施例5:根据冻结干燥条件的产品性能评价
[0112]
综合考虑根据实施例1至3的创伤敷料的经济性、质感及止血效果的结果,最终选择了方法2的创伤敷料,并评价了根据下表6所示的冻结干燥条件的产品状态。
[0113]
【表6】
[0114]
[0115][0116]
根据其结果,确认了在1号(no.1)的条件下进行冻结干燥时,冻结干燥的收率小于50%,冻结干燥进行期间的冻结不良(裂纹(crack))大于50%,在2号(no.2)的条件下进行冻结干燥时,冻结干燥的收率小于70%,冻结干燥进行期间的冻结不良(裂纹)大于30%。另一方面,在3号(no.3)的条件下进行冻结干燥时,冻结干燥的收率大于90%,冻结干燥进行期间的冻结不良(裂纹)小于10%(图7)。
[0117]
实施例6:评价根据方法2的创伤敷料的特性
[0118]
5-1.评价根据实施例1制备的方法2的创伤敷料中的eto及ech残留量,其结果发现方法2的创伤敷料具有小于25mg/kg的eto残留量及小于25mg/kg的ech残留量。
[0119]
【表7】
[0120][0121]
5-2.评价根据实施例1制备的方法2的创伤敷料的吸收能力,结果发现其具有约670%的吸收能力。
[0122]
【表8】
[0123]
检测项目单位结果值吸收能力%672.5
[0124]
以上对本发明的特定部分进行了详细描述,对于本领域的普通技术人员而言,这些具体技术仅是优选的实施例,并非对本发明范围的限制。因此,本发明的实质范围应由所附权利要求及其等同物来定义。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
