用于atp再生的无细胞组合物及其用途
相关申请的交叉引用
1.本技术要求2019年2月12日提交的美国临时专利申请序列号62/804,448的优先权,其公开通过引用全文纳入本文。
技术领域
2.本发明一般涉及用于再生三磷酸腺苷(atp)的无细胞系统,三磷酸腺苷(atp)广泛用于各种生物介导反应,如肽和蛋白质的合成。
背景技术:
3.无细胞合成现在被认为是一种通过生物过程生产有价值的商业化合物的有效方法,无需进行经典发酵;还描述了各种再生atp的方法,以允许无细胞系统执行需要atp的操作,如肽合成中的氨基酸偶联。(“合成生物学的原核生物无细胞系统开发”;abel c.chiao,richard m.murray,zachary z.sim,doi:http://dx.doi.org/10.1101/048710)。
4.在无细胞系统中构建所需代谢途径后,主要的实践问题是提供驱动所需代谢途径所需的化学势能。这种化学势能通常以常见的天然三磷酸腺苷(atp)形式提供。为无细胞系统提供atp源是一个可观的实践问题,其严重限制了无细胞系统的应用。
5.最简单的是,atp可作为纯化的化合物以化学计量量直接提供给无细胞系统。这即使在实验室规模也是极其昂贵的,在商业规模上经济不可行。
6.向无细胞系统提供atp可通过包括附加代谢途径以及无细胞系统所需的代谢途径来实现。这些附加途径使用较便宜的试剂(如葡萄糖、丙酮酸、琥珀酸、谷氨酸或其他化合物,以化学计量量添加到整个无细胞系统中)在无细胞系统内从adp再生atp。这些试剂起到“牺牲底物”的作用,并通过添加到最初存在于无细胞系统中的途径的附加途径发挥作用。但这些附加途径通常不是直接提供无细胞系统所需产物的无细胞系统的途径的一部分。因此,这些附加途径给整个无细胞系统带来了额外的复杂性,随之而来的是低效率和费用。
7.因此,需要改进用于体外atp再生的无细胞系统和方法。
技术实现要素:
8.在一个方面,本文提供了一种用于再生三磷酸腺苷(atp)的无细胞组合物,包括:用于向电子受体传递电子的还原的化学物质,其中所述还原的化学物质由电化学装置电化学产生;包含电子受体和etc复合物iv的电子传输链(etc),其中电子受体选自etc复合物i、etc复合物ii、etc复合物iii、泛醌和细胞色素c,其中所述etc能够在脂质双层上产生质子梯度;atp合酶,能够利用跨脂质双层的质子梯度从二磷酸腺苷(adp)产生atp;和脂质体,由脂质双层包封以在脂质体内保留质子,其中etc和atp合酶与脂质双层联合。
9.另一方面涉及一种用于再生三磷酸腺苷(atp)的装置,包括:包含在阳极室中的阳极和包含在阴极室中的阴极;阳极室中与阳极接触的去离子水;分离阳极室和阴极室的质子透性膜;阴极室中与阴极连续接触的液相,所述液相包括能够经历循环还原和氧化的电子转移介体(etm),其中,一旦在阴极处还原,etm被还原成可将电子转移到电子传输链(etc)的电子受体的还原化学物质;其中所述电子受体选自etc复合物i、etc复合物ii、etc复合物iii、泛醌和细胞色素c;其中etc包含电子受体和etc复合物iv;合成线粒体,其包括包封的脂质双层、etc和atp合酶;其中所述etc能够在脂质双层上产生质子梯度;其中所述atp合酶能够利用跨脂质双层的质子梯度从二磷酸腺苷(adp)产生atp;其中所述包封的脂质双层能够在其中保留质子;工艺流,包含能够使用产生的atp生产所需产品的底物;和在阳极和阴极之间提供电压的外部电源。
10.在一些实施方式中,还原化学物质可包括nadh2、nadph2、fmnh2、fadh2和/或泛醇中的一种或多种。在某些实施方式中,还原化学物种为nadh2、nadph2和/或fmnh2中的一种或多种,且电子受体为etc复合物i。在某些实施例中,还原化学物质为fadh2,电子受体为etc复合物ii。在某些实施方式中,还原化学物质为泛醇,电子受体为etc复合物iii。
11.在某些实施方式中,etc已重建到脂质体中,以至少部分嵌入脂质双层中,且电子受体可接触到存在于脂质体外部的还原化学物质。在某些实施方式中,atp合酶已重建到脂质体中以至少部分嵌入脂质双层中,其中atp合酶可接触存在于脂质体外部的adp。在一些实施方式中,将etc和atp合酶重建为与脂质双层相联合,优选至少部分嵌入其中。
12.在某些实施方式中,脂质双层对质子不可透过。在某些实施方案中,脂质体是人工制备的。在某些实施方式中,重组产生etc和/或atp合酶。
13.在一些实施方式中,装置可包括位于阴极和工艺流之间的膜,其中所述膜支持合成的线粒体并允许液相和工艺流之间的界面接触,同时防止液相和工艺流的实质性混合,并防止工艺流实质性接触阴极。在一些实施方式中,膜配置成与合成线粒体部分联合。在一些实施方式中,膜配置成使得合成线粒体部分或完全嵌入膜内。
14.本文还提供了使用本文公开的组合物和装置在体外再生atp的方法。附图简要说明
15.图1说明了通过nadh2的电化学再生向etc提供电子与从其他化合物和代谢途径提供还原等价物相比的相对简单性。
16.图2以示意图的形式说明了生物膜或制备的脂质体膜所包含的电子传输链(etc)和atp合酶的组分。
17.图3以示意图形式说明了nad电化学还原为nadh2,并将nadh2提供给合成线粒体,该线粒体利用nadh2通过etc和atp合酶将adp转化为atp。
18.图4以示意图形式说明了nad电化学还原为nadh2以及nadh2提供给包含在膜基质中的合成线粒体。
硬酯酰-磷酯酰乙醇胺,1-棕榈酰-2-油酰磷酯酰乙醇胺,1-硬酯酰-2-油酰-磷酯酰乙醇胺和琥珀酰-二油酰-磷酯酰乙醇胺;磷酯酰丝氨酸,例如1,2-二油酰磷酯酰丝氨酸,1,2-二棕榈酰-磷酯酰丝氨酸,1,2-二肉豆蔻酰磷酯酰丝氨酸,1,2-二硬酯酰-磷酯酰丝氨酸,1-油酰-2-棕榈酰磷酯酰丝氨酸,1-油酰-2-硬酯酰-磷酯酰丝氨酸,1-棕榈酰-2-油酰磷酯酰丝氨酸和1-硬酯酰-2-油酰-磷酯酰丝氨酸;磷酯酰甘油,例如1,2-二油酰-磷酯酰甘油,1,2-二棕榈酰-磷酯酰甘油,1,2-二肉豆蔻酰-磷酯酰甘油,1,2-二硬酯酰-磷酯酰甘油,1-油酰-2-棕榈酰-磷酯酰甘油,1-油酰-2-硬酯酰-磷酯酰甘油,1-棕榈酰-2-油酰-磷酯酰甘油和1-硬酯酰-2-油酰-磷酯酰甘油;聚乙二醇化脂类;聚乙二醇化磷脂,例如磷酯酰乙醇胺-n-[甲氧基(聚乙二醇)-1000],磷酯酰乙醇胺-n-[甲氧基(聚乙二醇)-2000],磷酯酰乙醇胺-n-[甲氧基(聚乙二醇)-3000],磷酯酰乙醇胺-n-[甲氧基(聚乙二醇)-5000];聚乙二醇化神经酰胺,例如n-辛酰鞘氨醇-1-{琥珀酰[甲氧基(聚乙二醇)1000]},n-辛酰-鞘氨醇-1-{琥珀酰[甲氧基(聚乙二醇)2000]},n-辛酰-鞘氨醇-1-{琥珀酰[甲氧基(聚乙二醇)3000]},n-辛酰-鞘氨醇-1-{琥珀酰[甲氧基(聚乙二醇)5000]};溶血磷酯酰胆碱、溶血磷酯酰乙醇胺、溶血磷酯酰甘油、溶血磷酯酰丝氨酸、神经酰胺;鞘脂;糖脂,例如神经节苷脂gm1;葡糖脂;硫苷脂;磷脂酸,如二-棕榈酰-甘油磷脂酸;棕榈基脂肪酸;硬脂脂肪酸;花生四烯脂肪酸;月桂脂肪酸;肉豆蔻脂肪酸;月桂烯酸脂肪酸;抹香鲸脂肪酸;肉豆蔻烯脂肪酸;棕榈烯脂肪酸;芹子脂肪酸;油酸脂肪酸;异月桂脂肪酸;异肉豆蔻脂肪酸;异硬脂脂肪酸;甾醇和甾醇衍生物,如胆固醇、胆固醇半琥珀酸盐、胆固醇硫酸盐和胆固醇基-(4-三甲基氨)-丁酸、麦角甾醇、羊毛甾醇;聚氧乙烯脂肪酸酯和聚氧乙烯脂肪酸醇;聚氧乙烯脂肪酸醇醚;聚氧乙基山梨醇酐脂肪酸酯、甘油聚乙二醇氧基-硬脂酸酯;蓖麻酸甘油聚乙二醇酯;乙氧基化大豆甾醇;乙氧基化蓖麻油;聚氧乙烯-聚氧丙烯脂肪酸聚合物;聚氧乙烯硬脂酸酯;二油酰-sn-甘油;二棕榈酰-琥珀酰甘油;1,3-二棕榈酰-2-琥珀酰甘油;1-烷基-2酰基-磷酯酰胆碱,例如1-十六烷基-2-棕榈酰磷酯酰胆碱;1-烷基-2-酰基-磷酯酰乙醇胺,例如1-十六烷基-2-棕榈酰-磷酯酰乙醇胺;1-烷基-2-酰基-磷酯酰丝氨酸,例如1-十六烷基-2-棕榈酰-磷酯酰丝氨酸;1-烷基-2-酰基-磷酯酰甘油,例如1-十六烷基-2-棕榈酰-磷酯酰甘油;1-烷基-2-烷基-磷酯酰胆碱,例如1-十六烷基-2-十六烷基-磷酯酰胆碱;1-烷基-2-烷基磷酯酰乙醇胺,例如1-十六烷基-2-十六烷基磷酯酰乙醇胺;1-烷基-2-烷基-磷酯酰丝氨酸,例如1-十六烷基-2-十六烷基-磷酯酰丝氨酸;1
–
烷基-2
–
烷基-磷酯酰甘油,例如1-十六烷基-2-十六烷基-磷酯酰甘油;n-琥珀酰-二十八烷基胺;棕榈酰高半胱氨酸;十二烷基三甲基溴化铵;十六烷基三甲基溴化铵;十四烷基三甲基溴化铵;和聚二甲基硅氧烷-接枝聚环氧乙烷(pdms-g-peo)。
[0031]“电子传输链”(etc)是一系列复合物,通过氧化还原(同时发生还原和氧化)反应将电子从电子供体转移到电子受体,并将此电子转移与质子(h 离子)跨膜转移耦联。这产生了电化学质子梯度,驱动atp合酶合成三磷酸腺苷(atp)。
[0032]
如本文所用,术语跨越脂质体膜或脂质双层的“质子梯度”是指脂质体膜一侧的溶液与脂质体膜另一侧的溶液之间的质子浓度差。
[0033]
如本文所用,术语“电子转移介体”或“etm”指能够自身接受一个或多个电子,然后将电子转移到另一分子(包括将电子转移到酶分子)的分子。典型且众所周知的etm为中性红(neutral red),其也用作ph指示剂。其它可作为etm的化合物包括亚甲基蓝、甲基紫精和
醌。通常,可以使用还原电位比nad更负的化合物,这包括通常称为氧化还原染料的各种化合物。例如,在前述的情况下,中性红通过促进电子从阴极向nad辅因子移动而充当电子传输介体,从而促进nad还原产生nadh2。
[0034]
术语“电子传输介体”或“etm”可包括促进电子转移到酶分子的分子,因此在广义上辅因子(例如nadh2、fmn、fad、铁氧还蛋白等)也可被视为电子传输介体。然而,在一些例子中,术语“电子传输介体”或etm意欲仅描述促进电子转移的那些分子,但其通常不被认为是氧化还原酶系统的天然存在的辅因子,例如nadh、fmn、fad、铁氧还蛋白等。
[0035]
在本发明中,描述符“nad(p)”表示烟酰胺腺嘌呤二核苷酸的磷酸化和非磷酸化形式的氧化态,而描述符“nad(p)h2”表示烟酰胺腺嘌呤二核苷酸的磷酸化和非磷酸化形式的还原态。etc和atp产生
[0036]
为了产生atp,电子经过一系列细胞组分,其统称为电子传输链(etc),其本身嵌入膜中。电子通过etc形成跨膜的质子浓度梯度。然后,质子梯度用于驱动从二磷酸腺苷(adp)再生atp的反应。然后,atp可用于任何代谢过程,该代谢过程可能是所需无细胞系统的一部分,例如,合成蛋白质的无细胞系统,特别是在本示例中,激活结合到对该氨基酸特异性的trna的氨基酸的反应,使其形成酰胺键,从而在蛋白质合成过程中延伸氨基酸链。其他需要atp的生物反应,如碳水化合物分子的磷酸化,也利用由etc形成的质子梯度产生的atp。
[0037]
通常由称为生物还原性等价物的分子对etc提供电子。它们通常是烟酰胺腺嘌呤二核苷酸(nad)、黄素腺嘌呤二核苷酸(fad)和泛醌。为了使etc产生从adp生成atp所需的质子梯度,这些分子必须以其化学还原形式,即分别以nadh2,fadh2和泛醇形式提供。每个化学还原的分子,即生物还原性等价物,都被etc的不同部分接受,但在所有情况下,etc均将产生质子梯度,并允许atp合酶从adp产生atp。
[0038]
etc本身是一组膜内包含或嵌入膜内的蛋白质,通过能够形成etc的蛋白质的作用将产生跨该膜的质子梯度。这些蛋白质通常为:
·
nadh-泛醌氧化还原酶,也称为“复合物i”·
琥珀酸-泛醌氧化还原酶,也称为“复合物ii”·
泛醌-细胞色素c氧化还原酶,也称为“复合物iii”·
细胞色素c,也称为“cyt c”·
细胞色素c氧化酶,也称为“复合物iv”[0039]
在复合物i(nadh:泛醌氧化还原酶、nadh-coq还原酶或nadh脱氢酶;ec 1.6.5.3)中,从nadh移除两个电子,并最终转移到脂溶性载体泛醌(uq)上。还原产物泛醇(uqh2)在膜内自由扩散,复合物i将四个质子(h )转运通过膜,从而产生质子梯度。复合物i是电子过早泄漏到氧的主要位点之一,因此是产生超氧物的主要位点之一。电子的途径如下:通过一个双电子步骤将黄素单核苷酸还原为fmnh2来使nadh氧化为nad 。然后,fmnh2通过半醌中间物在双单电子步骤中氧化。因此,每个电子从fmnh2转移到fe-s簇,从fe-s簇转移到泛醌(q)。第一个电子的转移导致自由基(半醌)形式的q,第二个电子的转移将半醌形式还原为泛醇形式qh2。在该过程中,四个质子从线粒体基质转移到膜间空间。随着电子在整个复合物中不断氧化还原,在膜内复合物的180埃宽度处产生电子流。该电流为nadh中每两个电子向膜间空间主动传输四个质子提供动力。
[0040]
在复合物ii(琥珀酸脱氢酶或琥珀酸-coq还原酶;ec 1.3.5.1)中,其它电子被送入源自琥珀酸的醌池(q),并(通过黄素腺嘌呤二核苷酸(fad))转移到q。复合物ii由四个蛋白亚基组成:琥珀酸脱氢酶(sdha);琥珀酸脱氢酶[泛醌]铁硫亚基,线粒体,(sdhb);琥珀酸脱氢酶复合物亚基c(sdhc)和琥珀酸脱氢酶复合物亚基d(sdhd)。其他电子供体(如脂肪酸和3-磷酸甘油)也将电子导入q(通过fad)。复合物ii是与复合物i平行的电子传输途径,但与复合物i不同,在该途径中没有质子被传输到膜间空间。因此,通过复合物ii的途径对整个电子传输链过程贡献的能量较少。
[0041]
在复合物iii(细胞色素bc1复合物或coqh2细胞色素c还原酶;ec1.10.2.2)中,q-循环通过不对称吸收/释放质子来形成质子梯度。从qh2上在qo位点移除两个电子,并依次转移到细胞色素c的两个分子上,细胞色素c是位于膜间空间内的水溶性电子载体。另外两个电子依次穿过蛋白质到达q位点,在那里泛醌的醌部分被还原为醌醇。质子梯度通过一个醌醇在q0位点氧化以在q位点形成一个醌来形成。
[0042]
在复合物iv(细胞色素c氧化酶;ec 1.9.3.1)中,有时称为细胞色素aa3,从四个细胞色素c分子中去除四个电子并转移到分子氧(02),产生三个水分子。同时,从线粒体基质中移出八个质子(尽管只有四个质子转移通过膜),从而形成质子梯度。
[0043]
atp合酶是一种蛋白质,它利用etc形成的跨膜质子梯度驱动adp形成atp。etc可以接受来自复合物i的nadh2、复合物ii的fadh2或复合物iii的泛醇(也称为辅酶q10)的电子。atp合酶本身不接受来自etc的电子。它与etc嵌入在同一膜中,并利用etc产生的跨膜质子梯度。
[0044]
可通过化学计量量的合适试剂(如二硫苏糖醇(dtt))将泛醌还原为泛醇,所得泛醇用于向etc提供电子。(《朝向人工线粒体:模拟聚合物和杂化膜中的氧化磷酸化》(toward artificial mitochondrion:mimicking oxidative phosphorylation in polymer and hybrid membranes);lado otrin等人,nano lett.2017,17,6816-6821;通过引用并入本文。)
[0045]
电子从复合物i或从复合物ii传递到复合物iii,然后通过细胞色素c(cyt c)穿梭到复合物iv。质子被驱动通过膜,其在复合物i、复合物iii、cyt c和复合物iv处含有etc和atp合酶。在复合物iv中,电子离开etc,用于将氧还原为水。(“快速生物合成途径定型和酶发现的无细胞框架”(a cell-free framework for rapid biosynthetic pathway prototyping and enzyme discovery),ashty s.karim,michael c.jewett;metabolic engineering 36(2016)116-126;通过引用并入本文。)
[0046]
本领域技术人员将认识到,可对复合物ii提供琥珀酸盐,在复合物ii中,琥珀酸盐被氧化为富马酸盐,同时fad还原为fadh2。本领域技术人员还将认识到,复合物i包括生物电子载体黄素单核苷酸(fmn),其也将以其还原形式fmnh2存在,而复合物iii可包括细胞色素b,并且cyt c是相对较小的可与etc复合物iii或etc复合物iv松散联合的水溶性组分。用ebm和合成线粒体再生atp
[0047]
传统上,体外无细胞系统中的atp再生可以通过包括附加代谢途径来实现。添加的代谢途径包括足够的酶,以从添加的化学试剂中产生还原等价物(例如nadh2或nadph2),这些化学现在是14点52分。因此提供构成线粒体膜中etc的一系列组分。
[0048]
虽然包括用于进行atp再生的etc缓解了向所需无细胞系统提供化学计量量的非
常昂贵的外源atp的问题,但它仍然需要化学计量的试剂,即牺牲底物,以及甚至更多的代谢途径。这些进一步的附加途径对于将较便宜的化学计量试剂(如葡萄糖、丙酮酸、琥珀酸或谷氨酸)转化为还原等价物是必不可少的,必须产生还原等价物将电子携带到etc。这些附加途径使整个无细胞系统更加复杂,导致不稳定性和其他实际问题,例如产生还原等价物的酶反应的中间产物和最终产物的存在,以及需要纯化无细胞系统的所需产物除去这些产物。
[0049]
因此,本发明通过直接向etc提供必要的生物还原性等价物nadh2、fmnh2、fadh2和泛醇,而无需供给化学计量量的昂贵atp或牺牲底物(或底物混合物),如葡萄糖、丙酮酸盐,dtt、琥珀酸盐或谷氨酸盐,无需提供额外的代谢途径,以从这些牺牲底物物质生成etc所需的nadh2、fmnh2、fadh2和泛醇。这将使整个无细胞系统更简单、更稳定,并且构建和操作成本更低。
[0050]
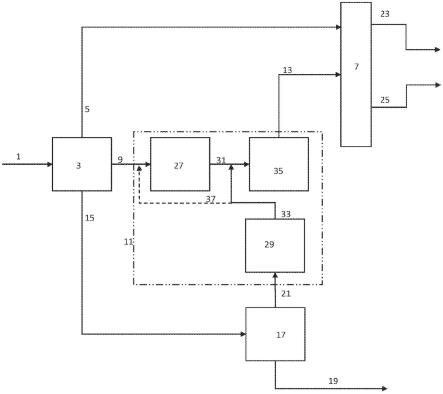
因此,通过本文公开的电化学方法提供etc所需的生物还原性等价物,以产生通过atp合酶将adp转化为atp所需的质子梯度是有利的,因为其不需要使用化学计量牺牲底物或附加代谢途径或酶。
[0051]
这可以通过电化学方法提供生物还原性等价物来实现,如pct出版公开号wo2017160793a1、wo2016137976a1、w02016070168a1和wo2014039767a1中公开的方法,所有这些方法均通过引用并入本文。这种方法不再需要包括代谢途径以在无细胞系统中生成生物还原性等价物。
[0052]
更具体地说,本发明涉及用于再生atp的电化学生物反应器模块(ebm)的用途。atp再生是通过对合成或人工制备的膜提供还原等价物来实现的,该膜含有atp合酶和通常在线粒体中发现的电子传输链(etc)的其他组分。etc的组分利用提供的还原等价物产生跨膜质子梯度,使atp合酶再生atp。由此生成的atp可通过交换一个或两个侧链磷酸基团来生成其他核苷三磷酸。这是无细胞系统的一个独特和新颖的优势,它寻求在不使用整个细胞代谢机制的情况下进行有价值的代谢过程。
[0053]
图1说明了通过nadh的电化学再生向etc提供电子与从其他化合物和代谢途径提供还原等价物相比的相对简单性。
[0054]
在一些实施方式中,本发明涉及一种电化学装置或系统的用途,该装置或系统与atp合酶联合,从而能够使用电化学产生的生物还原性等价物提供的电子产生atp,以向etc提供电子。具体而言,电子由nadh2、nadph2、fadh2或电化学生成的还原形式的泛醌提供给etc。虽然这些生物还原性等价物在本文中用作举例,但只要提供给合成线粒体的还原物质具有足够的氧化还原电位以至少将电子转移到etc复合物iv,即可建立质子梯度,如otrin等人使用dtt所示。
[0055]
在一个实施方式中,无细胞系统用于生产所需物质,例如蛋白质或其他需要atp的分子,以提供其合成的化学势能。该系统需要atp才能操作,在此过程中atp转换为adp。
[0056]
在本实施方式中,atp由etc组分复合物i、复合物ii、复合物iii、cyt c和复合物iv以及atp合酶产生。它们排列在囊泡(也称为“合成线粒体”)的脂质双层中,因此当电子沿着etc移动时,etc将质子从囊泡外部泵送到囊泡内部,产生质子梯度,atp合酶利用该梯度从adp产生atp。所需电子由nadh2提供给etc,nadh2由nad电化学产生。在向etc输送电子时,nadh2被氧化为nad,并且nad再次通过ebm转化为nadh2。再生的nadh2再次向etc传递电子,
etc再次在囊泡上产生跨膜质子梯度,使atp合酶能够从adp中再生atp,而adp是在生产蛋白质的过程中消耗atp的结果。在该实施方式中,可选地,可以存在fad并将其还原为fadh2,将电子传递到etc复合物ii。
[0057]
因此,在本实施方式中,不需要化学计量量的生物还原性等价物来向etc提供电子,也不需要从牺牲底物生成还原性等价物的任何其他代谢步骤。只要电化学装置的阴极提供电子,就会产生atp,无细胞系统将获得产生所需产物所需的化学势能。
[0058]
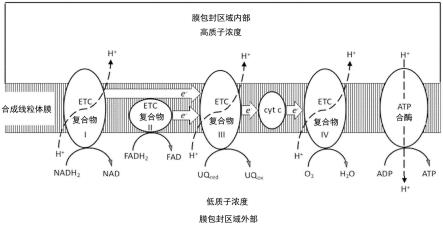
如图2所示,etc和atp合酶的组分可包含在生物膜(例如,从生物来源提取的脂膜)或人工制备的非天然脂质体(与“合成线粒体”互换使用)的脂质双层内。标出了电子可能传递到etc的位置,以及能够传递电子的辅因子(nadh2、fadh2、还原的泛醌、uqred)。还显示了电子通过etc和质子跨生物膜或制备的脂质体膜的一般流动,以产生质子梯度。
[0059]
在某些实施方式中,仅存在etc复合物i、etc复合物iii、cyt c和etc复合物iv,而atp合酶存在于合成线粒体的膜中。电子从nadh2传递到etc复合物i,然后再传递到etc复合物iii。
[0060]
在另一个实施方式中,合成线粒体仅具有atp合酶和仅由复合物iii、cyt c和复合物iv组成的etc。泛醌电化学还原为泛醇提供了必要的生物还原性等价物,其将电子传递给简化的etc。产生的泛醌通过ebm,再生泛醇。
[0061]
通过安排etc由复合物i、复合物ii、复合物iii和复合物iv(加上细胞色素b和c)组的不同成员组成,来自ebm的电子可通过不同的生物还原性等价物传递:例如nadh2,或fadh2或泛醇。
[0062]
由于这些不同的生物还原性等价物可以在ebm中的不同阴极电位下产生,因此整个系统具有操作优势,因为可以选择生物还原性等价物向etc传递电子,以在阴极电位下产生atp,从而防止不必要的非生物电化学反应。
[0063]
在一些实施例中,合成线粒体可包括任何脂质体或本领域已知的类似脂质双层容器或纳米容器,如klara等人,j.am.中chem.soc.2016,138,28-31;de vocht等人,controlled release 2009,137,246-254;stoenescu等人,macromol.biosci.2004,4,930-935;kumar等人proc.natl.acad.sci.u.s.a,2007,104,20719-20724;jabhrek等人,circ.res.2006,99,878-883;nordlund等人,nat.commun.2014,5,4303;von ballmoos等人,biochim.biophys.acta,bioenerg.2016,1857,321-323;choi等人,nano lett.2005,5,2538-2542;otrin等人,nano lett.2017,17,6816-6821;所有内容通过引用并入本文。
[0064]
在一些实施方式中,脂质双层可包括各种脂质,例如磷脂酰胆碱;磷脂酰乙醇胺;磷脂酰丝氨酸;磷脂酰甘油;聚乙二醇化脂质;聚乙二醇化磷脂;聚乙二醇化神经酰胺;溶血磷脂酰胆碱、溶血磷脂酰乙醇胺、溶血磷脂酰甘油、溶血磷脂酰丝氨酸、神经酰胺;鞘脂;糖脂,如神经节苷脂gm1;葡糖脂;硫脂;磷脂酸;棕榈脂肪酸;硬脂脂肪酸;花生四烯脂肪酸;月桂脂肪酸;肉豆蔻脂肪酸;月桂烯脂肪酸;抹香鲸脂肪酸;肉豆蔻烯脂肪酸;棕榈烯酸;芹子脂肪酸;油酸脂肪酸;异月桂脂肪酸;异肉豆蔻脂肪酸;异硬脂脂肪酸;甾醇和甾醇衍生物,如胆固醇、胆固醇半琥珀酸盐、胆固醇硫酸盐和胆固醇基-(4-三甲基氨)-丁酸、麦角甾醇、羊毛甾醇;聚氧乙烯脂肪酸酯和聚氧乙烯脂肪酸醇;聚氧乙烯脂肪酸醇醚;聚氧乙基山梨醇酐脂肪酸酯、甘油聚乙二醇氧基-硬脂酸酯;蓖麻酸甘油聚乙二醇酯;乙氧基化大豆甾醇;乙氧基化蓖麻油;聚氧乙烯-聚氧丙烯脂肪酸聚合物;聚氧乙烯硬脂酸酯;二油酰-sn-甘油;二
棕榈酰-琥珀酰甘油;1,3-二棕榈酰-2-琥珀酰甘油;1-烷基-2酰基-磷酯酰胆碱,例如1-十六烷基-2-棕榈酰磷酯酰胆碱;1-烷基-2-酰基-磷酯酰乙醇胺,例如1-十六烷基-2-棕榈酰-磷酯酰乙醇胺;1-烷基-2-酰基-磷酯酰丝氨酸,例如1-十六烷基-2-棕榈酰-磷酯酰丝氨酸;1-烷基-2-酰基-磷酯酰甘油,例如1-十六烷基-2-棕榈酰-磷酯酰甘油;1-烷基-2-烷基-磷酯酰胆碱,例如1-十六烷基-2-十六烷基-磷酯酰胆碱;1-烷基-2-烷基磷酯酰乙醇胺,例如1-十六烷基-2-十六烷基磷酯酰乙醇胺;1-烷基-2-烷基-磷酯酰丝氨酸,例如1-十六烷基-2-十六烷基-磷酯酰丝氨酸;1
–
烷基-2
–
烷基-磷酯酰甘油,例如1-十六烷基-2-十六烷基-磷酯酰甘油;n-琥珀酰-二十八烷基胺;棕榈酰高半胱氨酸;十二烷基三甲基溴化铵;十六烷基三甲基溴化铵;十四烷基三甲基溴化铵;和聚二甲基硅氧烷-接枝聚环氧乙烷(pdms-g-peo)。
[0065]
在一些实施方式中,选择脂类以制备足够紧密且质子不透性的脂质双层,从而保留etc产生的质子梯度。在一些实施方式中,脂质双层具有足够的流动性,以便促进atp合酶的旋转运动以及通过etc(从脂质体的外部到内部)和atp合酶(从脂质体的内部到外部)的质子转移。
[0066]
脂质体可使用本领域已知的方法制备,如akbarzadeh等人在nanoscale res lett 2013;8(1):102;choi等人,nano lett。2005,5,2538-2542;otrin等人,nano lett。2017,17,6816-6821中所公开的方法;所有内容通过引用并入本文。
[0067]
在各种实施方案中,合成线粒体的蛋白质成分(例如etc复合物、atp合酶)可重组产生。这些蛋白质可以是跨膜蛋白质,可以组装入脂质体,使其横跨整个脂质双层的宽度。在一些实施方式中,一种或多种蛋白质至少部分嵌入脂质双层中。在某些实施方式中,可通过顺序或同时重建来实现蛋白质的装配。例如,预先形成的脂质体可在诸如胆酸钠、去氧胆酸钠、辛基葡萄糖苷或上述任何组合的适当洗涤剂存在下与atp合酶和/或etc混合。所有洗涤剂的广泛浓度范围(例如,0.2-0.8%,递增0.2%)可用于筛选最佳重建条件。重建混合物可在温和搅拌下温育,然后采用各种去污剂去除方法,如使用尺寸排阻柱、bio-bead或透析。
[0068]
在各种实施方式中,功能性重建蛋白质。“功能性”是指蛋白质在重建后,应具有跨脂质双层的正确朝向,以便其可接近其底物。例如,etc和/或atp合酶可以适当的方向重组到脂质体中,以便etc可以与脂质体外部存在的还原化学物质(例如nadh2)和氧反应,而脂质体外部存在的adp可以接近atp合酶。此外,etc需要将质子泵入脂质体中,以在脂质体内部建立具有更高质子浓度的质子梯度。质子梯度需要足够高才能驱动atp合酶。因此,在一个实施方案中,可使用每个脂质体约1个atp合酶和1-10、2-10或5个功能性etc组分的蛋白质/脂质体比率。在一些实施方式中,考虑重建etc的随机朝向,可将过量的酶整合到脂质体中(例如,每个脂质体2-20个etc组分)。
[0069]
一个脂质体可以具有一个或多个atp合酶和一个或多个etc组分。随着每个囊泡中蛋白质数量的增加,可以实现更高的atp合成速率。用于atp再生的装置
[0070]
本文还提供了各种用于atp再生的装置。在一些实施方式中,装置可包括:包含在阳极室中的阳极和包含在阴极室中的阴极;阳极室中与阳极接触的去离子水;
分离阳极室和阴极室的质子透性膜;阴极室中与阴极连续接触的液相,所述液相包括能够经历循环还原和氧化的电子转移介体(etm),其中,一旦在阴极处还原,etm被还原成可将电子转移到电子传递链(etc)的电子受体的还原化学物质;其中所述电子受体选自etc复合物i、etc复合物ii、etc复合物iii、泛醌和细胞色素c;其中etc包含电子受体和etc复合物iv;合成线粒体,其包括包封的脂质双层、etc和atp合酶;其中所述etc能够在脂质双层上产生质子梯度;其中所述atp合酶能够利用跨脂质双层的质子梯度从二磷酸腺苷(adp)产生atp;其中所述包封的脂质双层能够在其中保留质子;工艺流,包含能够使用产生的atp生产所需产品的底物;和在阳极和阴极之间提供电压的外部电源。
[0071]
在一些实施方式中,该装置可包括pct出版物公开号wo2017160793a1、wo2016137976a1、w02016070168a1和wo2014039767a1中公开的电化学生物反应器模块(ebm),所有这些均通过引用并入本文。在一些实施方式中,该装置的质子透性膜可以是经改良的nafion(商标e.i dupont)膜,其允许质子(作为氢离子,h30 )穿过该膜。质子透性膜可在阳极侧负载或包含用于产生氧气的催化剂。
[0072]
在一些实施方式中,装置还可包括位于阴极和工艺流之间的膜,其中所述膜支持合成的线粒体并允许液相和工艺流之间的界面接触,同时防止液相和工艺流的实质性混合,并防止工艺流实质性接触阴极。膜可以是亲水性的,并且可以具有从膜的一个表面延伸到另一个表面的孔。膜可以是任何合适的厚度,例如,从大约50微米到500微米。膜的物质组成可以是聚砜(ps)、聚乙烯砜(pes)、聚丙烯酰胺(pa)、聚丙烯腈(pan)。膜可以是表面修饰以赋予亲水性的聚砜(ps)(alenazi等人,designed monomers and polymers,2017年第20卷,第1期,532-546,通过引用并入)。
[0073]
该膜可以是“不对称的”,因为孔的大小可以在膜的一侧(例如,面向本体反应相的一侧)比另一侧(例如,面向阴极的一侧)有更大的开口。孔的大小可以表示为分子量截止值。例如,膜可称为10kda膜,这意味着膜的孔径较小侧的孔径尺寸使得分子量大于10kda(千道尔顿)的分子实质上通不过膜。在一些实施方式中,孔可在面向阴极的膜的第一表面上具有第一开口,其中第一开口足够小以基本防止分子量大于100kda的分子(例如,大于100kda、大于80kda、大于60kda、大于50kda、大于40kda、大于30kda、大于20kda、大于20kda、大于10kda、大于5kda或大于1kda)通过。这些孔还可以在膜的第二表面上具有面向工艺流的第二开口。在一些实施方式中,如图3中的膜801,第二开口足够小,仅允许nad/nadh2通过膜。在一些实施方式,例如图4中的膜300中,第二开口足够大,以允许孔内包含的合成线粒体的至少一部分与工艺流中的底物接触。第二开口可以比第一开口大或小,或者大小大致相同。在一些实施方式中,孔足够大以容纳其中的脂质体。
[0074]
图3以示意图形式说明了nad电化学还原为nadh2,并将nadh2提供给合成线粒体,该线粒体利用nadh2通过etc和atp合酶将adp转化为atp。由此形成的atp被无细胞系统用于生产所需产物。合成线粒体包括atp合酶和etc的至少一种其他组分,其足以在合成线粒体的生物膜或制备的脂质体膜上产生跨膜质子梯度,从而为atp合酶提供动力。合成线粒体通过可透过nadh2,但不可透过形成无细胞系统的酶,也不可透过合成线粒体的的膜与通过阴
极室再循环的工艺流分离。
[0075]
图3图例:100 电化学生物反应器模块(ebm)系统101 阳极102 质子透性膜(pem)103 阴极200 含有离开阴极室的nad和返回阴极室的nadh2的第一再循环回路800 第二再循环回路,其转移合成线粒体产生的atp并将其提供给需要atp的无细胞系统600,并将无细胞系统产生的adp转移回合成线粒体,以再生atp801 将第一再循环回路200与第二再循环回路800分离的第一膜802 含有etc组分和atp合酶的合成线粒体,存在于第一再循环回路800中803 提供的氧气,在etc(etc复合物iv)末端捕获电子并形成水803 第二再循环回路800中存在的adp、无机磷酸盐和atp500 将无细胞系统600与第二再循环回路800分离的可选的第二膜600 需要atp的无细胞系统700 包含输入到无细胞系统600的起始物质和由无细胞系统生产的产物的工艺流
[0076]
图4在示意图中说明了nad电化学还原为nadh2,并将nadh2提供给合成线粒体,该线粒体包含在膜基质中,其可被nadh2透过,但不能被形成无细胞系统的酶透过。合成的线粒体利用nadh2从adp中再生atp,由此形成的atp被无细胞系统利用以生成所需的产物。
[0075]
图4图例:100 电化学生物反应器模块(ebm)系统101 阳极102 质子透性膜(pem)103 阴极200 含有离开阴极室的nad和返回阴极室的nadh2的第一再循环回路,300a 将第一再循环回路200与第二再循环回路800分离的第一膜301 含有etc组分和atp合酶的合成线粒体,其位于膜300的基质内302 提供氧气,以在etc(etc复合物iv)末端捕获电子并形成水400 第二再循环回路,其转移合成线粒体产生的atp并将其提供给需要atp的无细胞系统600,并将无细胞系统产生的adp转移回合成线粒体,以再生atp500 将无细胞系统与第二再循环回路分离的可选的第二膜600 需要atp的无细胞系统700 包含输入到无细胞系统600的起始物质和由无细胞系统生产的产物的工艺流实施例实施例1.脂质、聚合物和杂化脂质体的制备
[0078]
可由溶于2:1氯仿-甲醇(v/v)中的大豆l-α-磷脂酰胆碱(95%,avantipolar lipids)制备脂质体,并在-20℃下储存直至使用。首先,将10mg溶解的脂质沉降在一个圆底玻璃瓶中,然后在温和的氮气流下蒸发溶剂。可以用含有20mm hepes(ph 7.5)、2.5mm mgs04、50mg/ml蔗糖的囊泡缓冲液再水化脂质薄膜,并通过温和涡旋以10mg/ml的最终脂质
浓度再悬浮。对多层膜囊泡(mlv)的悬液进行7次冻融循环(在液氮中1分钟,然后在35℃水浴中,直到完全解冻,然后进行30秒涡旋)。最后,通过100nm孔(聚碳酸酯膜,whatman)挤出(21次)悬液,可匀化悬液中脂质体的大小和分层数。
[0079]
可由30mol%大豆pc和70mol%聚合物组成的脂质/聚合物混合物制备杂化脂质体的薄膜。然后可根据上述脂质体方案形成杂化脂质体。
[0080]
聚合物脂质体可由溶解于2:1氯仿-甲醇(v/v)中的pdms-g-peo制备,并在室温下储存。在氮气下通过溶剂蒸发可形成聚合物薄膜,并且聚合物可在囊泡缓冲液(补充胆酸钠、脱氧胆酸钠或辛基葡萄糖苷)中以10mg/ml的聚合物浓度作为聚合物/去污剂多分散脂质体的形式重悬浮。可省略冻融循环。可通过100nm孔挤压(21次)形成单分散混合的聚合物/去污剂脂质体。实施例2.蛋白质共重建进入脂质体、聚合物和杂化脂质体
[0081]
膜蛋白重建的优化方案如下。简言之,为了约1个atp合酶和2-10个etc的理论蛋白质/脂质体比率,在0.4%胆酸钠存在下,可将0.14mm预先形成的脂质体(100pl)与0.14mm atp合酶和0.70mm etc混合。重建混合物可在室温下温和搅拌孵育30分钟,然后使用预填充的尺寸排阻柱(pd minitrap g-25,ge healthcare)去除去污剂。为了确定能量再生系统的生产下限,每个脂质体可重建1个atp合酶。随着每个囊泡中酶数量增加,可轻易实现更高的atp合成速率。考虑重建etc的随机朝向,可以将过量的酶整合到纳米容器中(每个脂质体5个)。
[0082]
为了适应为杂化脂质体和聚合物脂质体开发的重建方案的特殊性,脂质体可以另外与两种其他调理性去污剂(脱氧胆酸钠和辛基葡萄糖苷)重建。所有洗涤剂的广泛浓度范围(0.2-0.8%,递增量0.2%)可用于筛选最佳重建条件。此外,还可以测试替代的去污剂去除方法,即通过bio-bead(生物珠)sn-2(bio-rad)和透析去除去污剂。对于通过生物珠去除去污剂,在30分钟孵育期后,可在一个步骤中向重建混合物补充100毫克的珠,并可在室温下在振摇平台上孵育2小时。然后,可以沉淀珠,并收集上清液(蛋白脂质体)。可以在quixsep透析胶囊(carl roth)中进行透析。透析膜(spectra/por 7,8kda)可在透析胶囊上延展,样品可在4℃下与补充有100mm kc1的100ml囊泡缓冲液透析过夜。生物珠去除去污剂后,两种重建酶的活性最高,因此可用于所有后续实验。
[0083]
杂化脂质体可按照上述方案共同重建,以形成蛋白质脂质体,只需稍加改动。预先形成的杂化脂质体可以代替预先形成的脂质体用于重建混合物。可通过生物珠去除去污剂,但在重建混合物中,可随后添加3次珠,每次添加15mg,然后在室温下在振摇平台上孵育30分钟。
[0084]
聚合体的共同重建可能不同于脂质体和杂化体的共同重建,其应明确遵循,以获得最高活性的atp合酶(etc在两种描述的方案中保持高度活性)。首先,可以将0.14mm atp合酶添加到预先形成的聚合物/去污剂混合脂质体中,并且可以在室温下孵育重建混合物15分钟,偶尔轻轻搅拌。然后,可添加0.70mm etc,并在相同条件下将混合物再孵育20分钟。可通过生物珠以与上述杂化脂质体相同的方式去除去污剂。实施例3.呼吸驱动atp产生的测定
[0085]
可按如下方式测量呼吸驱动的atp产生。
在包含480μl测量缓冲液(20mm tris-p04(ph7.5),10μl荧光素/荧光素酶实验(clsii,根据厂商方案制备),2μ1adp(8.45mm储液,超纯)和1μl dtt(1m储液)的溶液中可加入10pl脂质体,并可记录基线。可通过添加1μl泛醌q1(10mm储液)开始反应,并可记录atp的合成。在每次测量结束时,可添加3μlatp(5mm储液),以根据确定的atp量对信号进行标准化。atp生产率可报告为至少3种单独制备物的均值(每种重复测量3次)和标准偏差。实施例4.各种atp再生系统实施例4a
[0086]
作为非限制性示例,电化学生物反应器包括通过阴极室再循环的nad第一溶液。在再循环回路中,提供第一膜,其具有足以允许nad和nadh2透过第一膜的孔。任选地,也可提供fad用于电化学还原为fadh2。在第一膜的另一侧,存在第二再循环工艺流。
[0087]
可根据本领域已知的方法制备合成线粒体,例如基于接枝共聚物聚(二甲基硅氧烷)-接枝-聚(环氧乙烷)(pdms-g-peo)的脂质体,如otrin等人(nano eett.2017,17,6816-6821)所披露,通过引用整体并入本文,并添加到第二再循环工艺流中。这种合成线粒体包含图2所示的四种etc组分,以及atp合酶。制备用于从单个氨基酸生产肽的无细胞系统,并将其添加到第二再循环工艺流中。个体氨基酸与adp一起提供给第二循环工艺流。对电化学生物反应器充能,将第一再循环流中的nad还原为nadh2。nadh2透过第一膜,并与第二工艺流中的合成线粒体相互作用,对合成线粒体etc提供还原等价物。因此,nadh2被氧化为nad,以相反方向透过第一膜,并返回到第一再循环工艺流中,在其中进入阴极室并还原为nadh2形式。第二再循环工艺流中的合成线粒体被nadh2充电并产生质子梯度,将adp转化为atp。由此产生的atp分布在第二工艺流中,为无细胞系统的肽合成组分提供必要的化学势能,并在该工艺中转化回adp。无细胞系统的肽合成组分压缩第二工艺流中存在的个体氨基酸以形成所需肽产物。合成线粒体将adp转化回atp。在合成线粒体附近提供氧气,以接受来自复合物iv处etc末端的电子。
[0088]
如实施例1所述制备该系统,但合成线粒体中不存在etc复合物ii,且未向该系统提供fad/fadh2。可以使用其他还原化学物质,如nad(p)h2和fmnh2。实施例4b
[0089]
系统的制备如实施例1所示,但没有etc复合物i或etc复合物ii。电化学生成的nadh2用于将泛醌或其他合适的醌还原为还原的泛醇物质种,从而将电子转移到etc复合物iii。实施例4c
[0090]
该系统如实施例1所述制备,但合成线粒体仅包含etc复合物iv和atp合酶。可用包含nadh2、醌醇和能够氧化的硫醇(例如二硫苏糖醇(dtt))中的至少一种的电子载体或电子载体的混合物以任何比例提供电子。电子通过至少一个电子载体转移到etc复合物iv。
[0091]
生物反应器设计领域的技术人员将明白,在给出的每个实施例中,可以提供一系列再循环回路,每个回路通过适当透性膜与相邻的再循环回路接触。
[0092]
电化学领域的技术人员很清楚,只要所提供的电子载体的还原态的氧化还原电位足以直接或通过etc的其他组分向etc复合物iv提供电子,就可以提供不同的电子载体。还明白所提供的电子载体的这种灵活性允许在系统中的电化学电池中使用不同的电压。。
[0093]
合成生物学领域的技术人员,尤其是无细胞系统的技术人员将清楚地知道,提供
用于驱动atp再生的还原等价物可用于驱动其他需要atp的反应,例如,糖或脂类的磷酸化,用于生产表面活性剂或其他有商业价值的物质。
[0094]
本领域技术人员还将认识到,可通过使用二磷酸核苷激酶(ndk)酶从atp生成不同的三磷酸核苷,从而产生其它三磷酸核苷,而留下adp作为副产物。例如,三磷酸核苷gtp可通过ndk的作用产生,在过程中消耗atp,因此:atp gdp
→
adp gtp而本发明将adp再循环为atp。这允许使用相同的atp再生系统来产生gtp,用于糖磷酸化或需要通过三磷酸核苷进行磷酸化的其他反应,但特定的磷酸化酶不使用atp的情形。等同形式
[0095]
除此以外,本发明还提供了用于提供生物系统的还原等价物的新方法和装置。虽然已经讨论了本主题公开的特定实施方式,但是以上说明书是说明性的而非限制性的。在阅读本说明书后,本公开的许多变化对于本领域技术人员而言将变得显而易见。本公开的全部范围应该通过参考权利要求及其等同物的全部范围和说明书以及这些变化来确定。援引纳入
[0096]
以上引用的所有出版物、专利和专利申请均以引用方式全部并入本文,用于所有目的,其程度与每个单独的出版物或专利申请均明确表示以引用方式并入的程度相同。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。