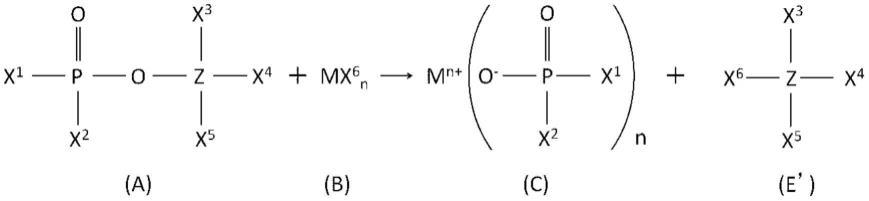
一种糖基化外泌体pd-l1的检测方法
技术领域
1.本发明涉及一种糖基化外泌体pd-l1的检测方法。
背景技术:
2.外泌体pd-l1(exopd-l1)已被证明是肿瘤进展和免疫治疗反应的预测生物标志物,现有的exopd-l1研究方法主要采用elisa检测体液中的exopd-l1。临床研究表明,exopd-l1的水平与肿瘤患者的基础病理情况不一致,以exopd-l1水平区分肿瘤患者以及健康人存在假阳性和假阴性,并且exopd-l1水平无法预测部分患者的免疫治疗反应。因此需发展高灵敏的、精准有效的exopd-l1检测方法。已有研究表明exopd-l1是高度糖基化的,exopd-l1的糖基化是exopd-l1与pd-1识别的结构基础,并且能抑制cd8
t细胞的增殖。因此,检测糖基化的exopd-l1有望提高基于exopd-l1的免疫治疗疗效预测的灵敏度。
3.目前研究外泌体蛋白糖基化的方法主要为使用凝集素阵列富集糖蛋白以及质谱法表征糖蛋白组信息,这些方法操作复杂,并且需要分离糖蛋白,不适用于游离的外泌体。糖代谢标记法需在培养细胞时加入特定官能团修饰的非天然单糖,待单糖转运至细胞膜后泌出具有特定标记的外泌体。由于此方法需要在培养细胞时加入特定的非天然单糖底物,因此仅适用于培养的细胞或组织体系,限制其在其他生物学体系中的应用。
技术实现要素:
4.本发明的主要目的,在于提供一种糖基化外泌体pd-l1的检测方法。
5.本发明解决其技术问题的所采用的技术方案是:
6.一种糖基化外泌体pd-l1的检测方法,包括如下步骤:
7.1)分离外泌体;
8.2)连接第一偶合物与第一dna,所述的第一偶合物能够与外泌体的糖基结合;
9.3)在分离的外泌体中加入第一偶合物和第一dna的偶联产物,得到溶液一;
10.4)在溶液一中加入pd-l1适配体,得到溶液二;
11.5)加入连接臂dna,所述的连接臂dna的第一段能够与第一dna的至少一部分结合,连接臂dna的第二段能够与pd-l1适配体的至少一部分结合,三者形成第一dna-连接臂dna-pd-l1适配体产物;在dna连接酶的作用下,连接臂dna连接第一dna与pd-l1适配体;
12.6)对与连接臂互补的第一dna与pd-l1适配体连接部分进行扩增,检测扩增信号。
13.在本发明的优选实施例中,步骤2)中所述的第一偶合物包括凝集素、硼酸类化合物中的至少一种。所述的凝集素包括动物凝集素和植物凝集素,植物凝集素例如刀豆素a(conconvalina,cona)、麦胚素(wheat germ agglutinin,wga)、花生凝集素(peanut agglutinin,pna)和大豆凝集素(soybean agglutinin,sba)等。动物凝集素按分子结构分为c-型凝集素、s-型凝集素、p-型凝集素、i-型凝集素和正五聚蛋白(pentraxins)等。硼酸类化合物包括芳香族和非芳香族硼酸类化合物。
14.优选地,步骤2)中,所述的连接,其方式为化学偶联。
15.优选地,步骤2)中,未偶联dna的第一偶合物被去除。
16.优选地,步骤5)加入连接臂dna之前,先对溶液二进行稀释。
17.优选地,溶液二的稀释为稀释5-15倍。
18.优选地,第一dna的长度范围为5个碱基-100个碱基。
19.优选地,pd-l1适配体的长度范围为20-100个碱基。
20.优选地,连接臂dna的第一段与第一dna的匹配长度范围为5-30个碱基。
21.优选地,连接臂dna的第二段与pd-l1适配体的匹配长度范围为5-30个碱基。
22.本技术方案与背景技术相比,具有如下优点:
23.凝集素阵列法及质谱法操作繁琐,需分离糖蛋白,破坏外泌体的完整性和活性。而糖代谢标记法需在培养细胞时加入非天然的单糖,因此应用范围有限。
24.本发明采用适配体识别pd-l1蛋白,具有比抗体更高的亲和力,且识别效率不受pd-l1蛋白的糖基化修饰的影响。第一偶合物-第一dna与pd-l1适配体同时和邻位识别使反应具有快速的动力学,免除清洗游离探针的步骤,简化操作步骤。本发明方法特异性检测糖基化的外泌体pd-l1,无需分离释放糖蛋白,检测灵敏度高,检测限为1.09pg/ml,适用于多种生物体系。
附图说明
25.下面结合附图和实施例对本发明作进一步说明。
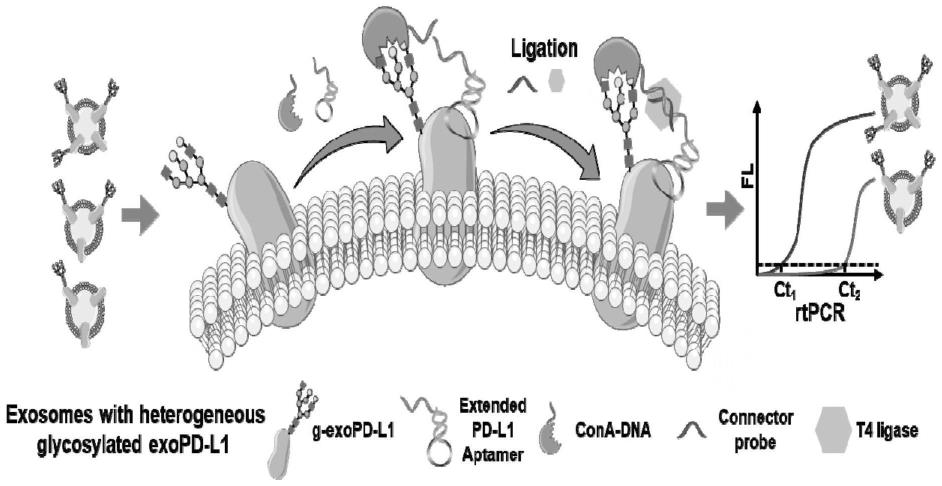
26.图1为本发明的原理示意图。
27.图2为cona与dna偶联原理。
28.图3为cona-dna纯化原理。
29.图4为cona与dna偶联结果。
30.图5为邻位连接表征。
31.图6为邻位连接扩增产物表征。
32.图7为糖基化外泌体pd-l1检测线性范围
33.图8为糖基化外泌体pd-l1检测特异性
具体实施方式
34.本发明的原理如下:参见图1,在外泌体样本中加入偶联一段寡核苷酸序列的凝集素cona(刀豆素a,conconvalina)以识别外泌体表面的糖,用结合pd-l1的适配体识别pd-l1,使用连接臂以及在t4连接酶的作用下,将核酸适体及cona上的dna邻位连接,并通过荧光定量pcr对连接部分信号放大输出,实现外泌体中糖基化pd-l1定量检测。
35.实施例1
36.外泌体的提取与分离。使用差速离心法纯化外泌体。将a375黑色素瘤细胞培养72h后收集培养基,以3000g,20min离心去除细胞碎片;将上清收集,以16500g,45min离心除去大囊泡,收集上清后以100,000g,2h离心收集外泌体,并用pbs缓冲液于100,000g,2h离心清洗外泌体。
37.偶联cona与dna。使用化学试剂sm(peg)6偶联cona和dna(5
’‑
tcgaggcgtagaattcccccgatgcgcgctgttct-3’,seq id no:1)。通过sm(peg)6上的马来酰亚胺基团与sh修饰的
dna反应,琥珀酰亚胺与cona上的nh2反应,从而将cona与dna偶联(图2)。具体实验步骤如下:用pbs溶解100μg cona使其浓度为2mg/ml,以20倍当量加入dmf(n,n-二甲基甲酰胺)溶解的sm(peg)6,室温下反应1h。用zeba脱盐柱除去未反应的sm(peg)6。接着加入7.5nmol sh修饰的dna,4℃反应过夜,30kd超滤管超滤清洗3遍,除去未反应的dna。
38.纯化cona-dna偶联产物。由于cona与dna偶联后会残留部分未反应的cona,影响后续pla反应,因此需将未偶联dna的cona除去。其原理如图3所示,将生物素修饰的捕获dna(生物素化c-b*,5
’‑
gaattctacgcctcgataaactaaatcccgc-3’seq id no:2)连接到链霉亲和素微球上,通过dna碱基互补配对与cona-dna偶联物结合。再用与c-b*互补的dna(b-c*,5
’‑
gcgggatttagtttatcgaggcgtagaattc-3’,seq id no:3)将cona-dna置换,从而将cona-dna纯化。
39.具体操作步骤如下:
40.a.取用链霉亲和素微球35μl,加入10μl 1mm生物素化的dna c-b*室温反应1.5h,去上清。
41.c.加入200μl封闭缓冲液(0.2%triton x-100(v/v)in pbs)以及cona-dna偶联物,4℃反应2h。
42.d.4℃,500g,1min离心去除上清,并用封闭缓冲液清洗微球3次。
43.e.加入200μl封闭缓冲液至微球中,加入20μl 1mm的dna b-c*,室温反应3h,500g,1min离心取上清,并用300μl封闭缓冲液清洗两次,收集上清。
44.偶联及纯化结果表明,dna被成功偶联至cona,并且未偶联的cona被除去(图4)。
45.pd-l1适配体与cona-dna邻位连接表征。使用流式细胞术表征pd-l1适体、cona-dna与外泌体的结合情况。用bca法定量外泌体的总蛋白浓度,将10μg外泌体与4μl乳胶醛珠于室温孵育2h,加入110μl 1m甘氨酸及20%bsa(牛血清白蛋白)溶液,室温孵育30min封闭,于6000rpm,3min离心去除上清,再用缓冲液(含0.5%bsa的pbs)离心清洗两次,重悬获得外泌体-乳胶醛珠复合物。将外泌体-乳胶醛珠复合物与cy3标记的pd-l1适体(5
’‑
tacaggttctggggggtgggtggggaacctgtttgtggtctatgtcgtcgttcgctagtagttcc tgggctgcac-3’,seq id no:4)和cy5标记的con a-dna于室温孵育30min,并用缓冲液清洗后于流式细胞术检测荧光强度(图5)。与对照组(不加cy3标记的pd-l1适体或者不加con a-dna)相比荧光共振能量转移强度明显增强,因此pd-l1适体、cona-dna可与a375外泌体上的pd-l1蛋白及其糖基结合。
46.邻位连接扩增产物表征
47.a.邻位连接。按上述制备外泌体-乳胶醛珠复合物后与200nm pd-l1适配体室温反应30min,清洗后与10μg cona-dna,4℃反应10min,用缓冲液清洗3次,用8μl pbs(0.55mm mgcl2)重悬。加入5%t4连接酶、200nm连接臂5
’‑
aaatacgcctcgagtgcagcccattt-3’seq id no:5,置于pcr仪中16℃反应30min;95℃反应15min,置于4℃(对照组为只加外泌体/不加cona-dna/不加pd-l1适配体/不加cona-dna和pd-l1适配体/不加连接臂)。
48.使用激光共聚焦对连接臂诱导的pd-l1适体及con a-dna的邻位连接进行成像(图5)。结果表明同时在加入连接臂之后,由于连接臂将pd-l1-aptamer-cy3和cona-dna-cy5拉近,导致的荧光共振能量转移信号增强,因此,连接臂可诱导pd-l1适体及cona-dna的邻位连接。
49.c.扩增。在邻位连接产物中加入dntp、前向引物(5
’‑
tgtggtctatgtcgtcgttcg-3’,
seq id no:6)、反向引物(5
’‑
gtagtgagaacagcgcgcatc-3’,seq id no:7)、dna聚合酶,并于pcr仪中扩增,扩增后用琼脂糖凝胶电泳表征扩增产物。
50.结果表明仅当同时加入pd-l1适配体、cona-dna以及连接臂才有扩增产物(图6),因此该方法可特异性扩增pd-l1适配体、cona-dna的邻位连接dna片段。
51.实施例2
52.非清洗体系下糖基化exopd-l1检测
53.将200pm pd-l1适配体(序列与实施例1相同)与1.09pg/ml-400pg/ml外泌体pd-l1(实施例1分离得到)室温孵育30min,再与20ng/ml cona-dna(制备方法同实施例1)4℃反应10min。接着用pbs稀释10倍,并加入t4连接酶、连接臂(序列同实施例1)进行邻位连接(同实施例1)及荧光定量pcr扩增,荧光定量pcr结果显示糖基化的外泌体pd-l1浓度与扩增的邻位连接产物的拷贝数高度相关(r2=0.97),表明该策略可以定量检测糖基化的外泌体pd-l1(图7)。该方法对糖基化外泌体pd-l1的检测限为1.09pg/ml。
54.使用荧光定量pcr法考察该方法对糖基化外泌体pd-l1特异性检测。将200pm pd-l1适配体与300pg/ml pd-l1阳性的a375外泌体及pd-l1阴性的mrc-5外泌体室温孵育30min,再与20ng/ml cona-dna 4℃反应10min。接着进行邻位连接及荧光定量pcr扩增(对对照组为只加外泌体、不加cona-dna、不加pd-l1适配体、以及不加连接臂dna)。结果表明只有pd-l1阳性的a375外泌体同时与pd-l1适体、cona-dna以及连接臂反应时才有邻位连接扩增产物信号(图8a)。用pngase f酶去除外泌体pd-l1糖基后邻位连接扩增产物信号减弱(图8b)。以上结果表明,该方法可特异性检测糖基化的外泌体pd-l1。
55.以上所述,仅为本发明较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。