二硫化合物及其合成与在制备铜绿假单胞菌群体感应抑制剂中的应用
(一)技术领域
1.本发明属于医药技术领域,尤其涉及二硫化合物的合成方法及其在制备铜绿假单胞菌群体感应生物被膜抑制剂中的应用。
(二)
背景技术:
2.抗生素是人类对抗病菌的重要武器,是20世纪最伟大的成就之一,自发现以来挽救了无数患者的生命。但由于抗生素的不合理使用、滥用和细菌的自然选择,不可避免地产生了抗生素耐药性问题,甚至出现了一大批多重耐药菌株,现有抗生素的治疗效果大打折扣,对人类公共卫生安全来说是一项重大的挑战。为了更好地解决抗生素耐药性问题,急需开发新型抗生素药物或新的治疗方法。
3.细菌群体感应(quorum sensing,qs)是一种细菌个体与个体间的密度依赖性交流机制,当菌体分泌的某些信号分子达到一定浓度阈值后,信号分子与相应的受体蛋白结合,启动特定基因的表达,调控细菌的多种生理功能,使得细菌群体能够更好地适应环境,在更严苛的条件下生存。因此,以qs为靶点的新型抗细菌感染药物的研究成为近年来的热点之一。
4.铜绿假单胞菌(pseudomonas aeruginosa,pa)原称绿脓杆菌,是一种需氧的革兰氏阴性菌,其分布广泛且存在于正常人体中,是最严重的临床机会致病菌之一,当患者抵抗力低下时,易反复感染,难以根治,且死亡率较高。它具有急性感染和慢性感染两种形式:急性感染情况下,具有高毒力、高运动性等特征,可在宿主体内扩散进而造成严重的组织感染;而慢性感染情况下,毒力和运动水平有所降低,但在宿主体内固着生长,形成胞外多糖包裹的细菌群体,即生物被膜(biofilm),大大提高了菌体的附着力、稳定性和抗免疫杀伤能力。一旦发展为慢性感染,极难治愈。研究表明,铜绿假单胞菌群体感应系统由las、rhl、pqs、iqs系统组成,它们之间协同参与调控铜绿假单胞菌生物被膜的形成和毒力因子(弹性蛋白酶、鼠李糖脂、绿脓菌素)的释放等多种生理活动,干扰或阻断qs系统后,形成生物被膜的能力明显削弱,释放毒力因子的水平显著下降,进而降低其致病性和耐药性。因此,群体感应系统抑制剂(quorum sensing inhibitors,qsis),尤其是能够影响生物被膜形成的抑制剂,是目前解决抗生素耐药性的新策略之一。
5.二硫化合物是一类具有活性有机硫化物(r1ssr2)的统称,其气味独特且具有广泛的生物活性,如抗微生物、抗氧化、抗癌、抗糖尿病和抗肿瘤等活性。制备合成方法简单、结构新颖的二硫化合物并对其生物活性进行探究,有望发掘新型铜绿假单胞菌群体感应生物被膜抑制剂。
(三)
技术实现要素:
6.本发明目的是提供一种二硫化合物及其合成与在制备铜绿假单胞菌群体感应抑制剂中的应用,有效降低了铜绿假单胞菌致病毒力因子的表达水平和慢性感染的概率,在
解决铜绿假单胞菌耐药性问题方面具有潜在的应用前景。
7.本发明的技术方案如下:
8.本发明提供一种式(ⅰ)所示二硫化合物:
[0009][0010]
式(i)中,r1=r2或r1≠r2,r1或r2各自独立为各自独立为
[0011]
所述r3、r4、r5分别为单取代或多取代,各自独立为氢、卤素、甲氧基、x为s、o、nh。
[0012]
进一步,所述r3独立为h、5-氯基或6-甲氧基。
[0013]
进一步,所述r4独立为4-氟基或4-甲氧基。
[0014]
进一步,所述r5独立为4-氯基或4-甲氧基。
[0015]
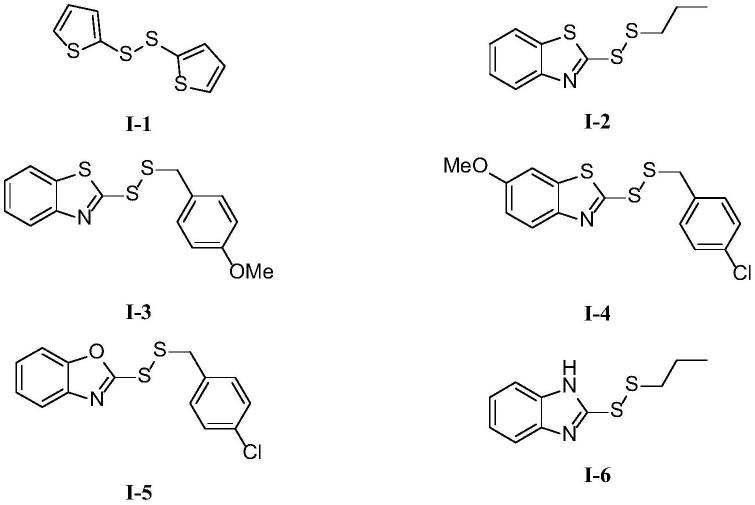
更进一步,式(ⅰ)所示二硫化合物为下列之一:
[0016]
[0017][0018]
本发明还提供一种式(ⅰ)所示二硫化合物的合成方法,所述方法按如下步骤进行:
[0019]
将式(ii)和/或(iii)所示化合物作为底物依次加入到二氯甲烷中,置于冰浴0℃条件下搅拌5min,缓慢加入2,3-二氯-5,6-二氰基苯醌(ddq),冰浴0℃条件下继续搅拌30min,反应液加入100~200目硅胶粉干法拌样,减压旋转蒸发除去溶剂后装柱进行硅胶柱层析,以体积比为20-50:1的石油醚/乙酸乙酯为洗脱剂进行硅胶柱层析,洗脱速度为2~3ml/min,洗脱2~3个柱体积,以体积比为10-30:1的石油醚/乙酸乙酯为展开剂进行薄层层析监测,收集rf值为0.4-0.6的组分,得式(ⅰ)所示化合物;所述式(ii)所示化合物为(ii-1)、(ii-2)、(ii-3)、(ii-4)或(ii-5)中的一种;所述式(iii)所示化合物为(iii-1)、(iii-2)、(iii-3)或(iii-4)中的一种;所述硅胶粉用量与底物总质量比为2-3:1;
[0020][0021]
式(
ⅱ‑
2)中,r3独立为氢、5-氯基或6-甲氧基;(
ⅱ‑
4)中r4独立为4-氟基或4-甲氧基;(iii-2)r5独立为4-氯基或4-甲氧基;
[0022]
式(i)中,r1=r2或r1≠r2,r1或r2各自独立为各自独立为其中r3同式(
ⅱ‑
2)中r3;r4同
式(
ⅱ‑
4)中r4;r5同式(iii-2)中r5。
[0023]
进一步,式(ii)和/或(iii)所示化合物是指式(ii)和(iii)所示化合物选择一种或两种的方式加入,可以选择一种或两种式(ii)所示化合物,也可以同时选择式(ii)所示化合物和式(iii)所示化合物,其中两种式(ii)所示化合物或者式(ii)与(iii)所示化合物的物质的量之比均为1:1;所述2,3-二氯-5,6-二氰基苯醌(ddq)化合物与底物总的物质的量之比为0.5~1.5:1(优选0.5:1);所述二氯甲烷体积加入量以底物总的物质的量计为1-5ml/mmol(优选1ml/mmol)。
[0024]
本发明还提供一种所述二硫化合物在制备铜绿假单胞菌群体感应抑制剂中的应用;所述抑制剂为铜绿假单胞菌生物被膜形成抑制剂。所述铜绿假单胞菌为铜绿假单胞菌(pseudomonas aeruginosa)pao1。
[0025]
与现有技术相比,本发明的有益效果主要体现在:
[0026]
本发明提供了一系列结构新颖的二硫化合物,该类化合物合成方法简单且方便大规模生产;该类化合物对野生型的铜绿假单胞菌的生物被膜具有良好的抑制作用,同时发现两种可能的铜绿假单胞菌生物被膜抑制机理:直接抑制铜绿假单胞菌生长和或在不影响菌体生长的条件下抑制铜绿假单胞菌生物被膜形成。本发明化合物(i-1)-(i-11)对野生型的铜绿假单胞菌的生物被膜的抑制率至少是阳性对照药物的3倍,其中化合物(i-6)、(i-9)能直接抑制细菌生长,100μmol下生长抑制效果分别为96.89%、96.93%;化合物(i-1)、化合物(i-5)、化合物(i-7)、化合物(i-11)在不抑制细菌生长的前提下,对野生型铜绿假单胞菌的生物被膜具有较好的抑制作用,其中实施例化合物(i-7)的抑制作用最为显著,100μmol下生物被膜抑制率高达87.70%。
(四)附图说明
[0027]
图1是实施例1-11制备的二硫化合物的核磁氢谱图,a到k代表实施例1-11制备的二硫化合物。
[0028]
图2是实施例1-11得到的化合物对pao1菌株的生长抑制效果图。
[0029]
图3是实施例1-11得到的化合物对野生型铜绿假单胞菌pao1生物被膜的抑制效果图。
(五)具体实施方式
[0030]
以下通过实施例对本发明的上述内容做进一步详细说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。
[0031]
本发明实施例所用铜绿假单胞菌(pseudomonas aeruginosa)pao1,由华南农业大学群体微生物中心的廖立胜教授惠赠。
[0032]
本发明实施例中硅胶柱层析采用2
×
30cm欣维尔玻璃柱;市售300~400目硅胶粉。
[0033]
实施例1、化合物i-1的制备
[0034][0035]
在反应瓶中,把式(
ⅱ‑
1)所示2-噻吩硫醇581.1mg(5.0mmol)加入到二氯甲烷(10ml)中,置于冰浴0℃条件下搅拌5min,缓慢加入2,3-二氯-5,6-二氰基苯醌(ddq)590.2mg(2.6mmol),冰浴0℃条件下继续搅拌30min,反应液加入2.5g的100~200目硅胶粉干法拌样,减压旋转蒸发除去溶剂后装柱(样品层高0.8cm,直径2.0cm;硅胶层高18cm,直径2.0cm)进行硅胶柱层析,以体积比为30:1的石油醚/乙酸乙酯为洗脱剂,流速2ml/min,洗脱2个柱体积,以体积比为10:1的石油醚/乙酸乙酯为展开剂进行薄层层析监测,收集rf值为0.4-0.5的组分,得式(
ⅰ‑
1)所示1,2-二(噻吩-2-基)二硫烷344.9mg。核磁氢谱图见图1中a-1所示,核磁碳谱图见图1中a-2所示。
[0036]1h nmr(600mhz,chloroform-d)δ7.49(dd,j=5.3,1.3hz,2h),7.15(dd,j=3.6,1.3hz,2h),7.01(dd,j=5.4,3.6hz,2h).
13
c nmr(151mhz,chloroform-d)δ135.74,135.66,132.29,127.77.hrms(esi)m/z 229.9339[m h]
calcd for c8h6s4,229.9352.
[0037]
实施例2、化合物i-2的制备
[0038][0039]
在反应瓶中,把式(
ⅱ‑
2-1)所示2-巯基苯并噻唑836.3mg(5.0mmol)和式(
ⅲ‑
1)所示丙硫醇380.8mg(5.0mmol)依次加入到二氯甲烷(10ml)中,置于冰浴0℃条件下搅拌5min,缓慢加入2,3-二氯-5,6-二氰基苯醌(ddq)1157.7mg(5.1mmol),冰浴0℃条件下继续搅拌30min,反应液加入3.0g的100~200目硅胶粉干法拌样,减压旋转蒸发除去溶剂后装柱(样品层高1.2cm,直径2.0cm;硅胶层高18cm,直径2.0cm)进行硅胶柱层析,以体积比为50:1的石油醚/乙酸乙酯为洗脱剂,流速2ml/min,洗脱2个柱体积,以体积比为10:1的石油醚/乙酸乙酯为展开剂进行薄层层析监测,收集rf值为0.5-0.6的组分,得式(
ⅰ‑
2)所示2-(丙基二硫基)苯并[d]噻唑723.1mg。核磁氢谱图见图1中b所示。
[0040]1h nmr(600mhz,chloroform-d)δ7.87(dt,j=8.2,0.9hz,1h),7.79(ddd,j=8.0,1.3,0.7hz,1h),7.42(ddd,j=8.3,7.2,1.3hz,1h),7.32(ddd,j=8.3,7.3,1.2hz,1h),2.93(t,2h),1.84
–
1.76(m,2h),1.03(t,j=7.4hz,3h).
[0041]
实施例3、化合物i-3的制备
[0042][0043]
在反应瓶中,把式(
ⅱ‑
2-1)所示2-巯基苯并噻唑836.3mg(5.0mmol)和式(
ⅲ‑
2-1)
所示4-甲氧基苄硫醇771.1mg(5.0mmol)依次加入到二氯甲烷(10ml)中,置于冰浴0℃条件下搅拌5min,缓慢加入2,3-二氯-5,6-二氰基苯醌(ddq)1157.7mg(5.1mmol),冰浴0℃条件下继续搅拌30min,反应液加入3.0g的100~200目硅胶粉干法拌样,减压旋转蒸发除去溶剂后装柱(样品层高1.2cm,直径2.0cm;硅胶层高18cm,直径2.0cm)进行硅胶柱层析,以体积比为30:1的石油醚/乙酸乙酯为洗脱剂,流速2ml/min,洗脱2个柱体积,以体积比为10:1的石油醚/乙酸乙酯为展开剂进行薄层层析监测,收集rf值为0.5-0.6的组分,得式(
ⅰ‑
3)所示2-((4-甲氧基苄基)二硫烷基)苯并[d]噻唑957.1mg。核磁氢谱图见图1中c所示。
[0044]1h nmr(600mhz,chloroform-d)δ7.87(dt,j=8.2,0.9hz,1h),7.79(dt,j=7.9,1.1hz,1h),7.43(ddd,j=8.3,7.3,1.3hz,1h),7.33(ddd,j=8.3,7.3,1.2hz,1h),7.29
–
7.24(m,2h),6.84
–
6.78(m,2h),4.14(s,2h),3.73(s,3h).
[0045]
实施例4、化合物i-4的制备
[0046][0047]
在反应瓶中,把式(
ⅱ‑
2-2)所示6-甲氧基-2-巯基苯并噻唑986.4mg(5.0mmol)和式(
ⅲ‑
2-2)所示4-氯苄硫醇793.2mg(5.0mmol)依次加入到二氯甲烷(10ml)中,置于冰浴0℃条件下搅拌5min,缓慢加入2,3-二氯-5,6-二氰基苯醌(ddq)1157.7mg(5.1mmol),冰浴0℃条件下继续搅拌30min,反应液加入3.0g的100~200目硅胶粉干法拌样,减压旋转蒸发除去溶剂后装柱(样品层高1.2cm,直径2.0cm;硅胶层高18cm,直径2.0cm)进行硅胶柱层析,以体积比为30:1的石油醚/乙酸乙酯为洗脱剂,流速2ml/min,洗脱2个柱体积,以体积比为10:1的石油醚/乙酸乙酯为展开剂进行薄层层析监测,收集rf值为0.5-0.6的组分,得式(
ⅰ‑
4)所示2-((4-氯苄基)二硫烷基)-6-甲氧基苯并[d]噻唑1058.9mg。核磁氢谱图见图1中d所示。
[0048]1h nmr(600mhz,chloroform-d)δ7.79(d,j=8.9hz,1h),7.29(s,5h),7.06(dd,j=8.9,2.6hz,1h),4.14(s,2h),3.89(s,3h).
[0049]
实施例5、化合物i-5的制备
[0050][0051]
在反应瓶中,把式(
ⅱ‑
2-3)所示2-巯基苯并噁唑928.2mg(5.0mmol)和式(
ⅲ‑
2-2)所示4-氯苄硫醇793.2mg(5.0mmol)依次加入到二氯甲烷(10ml)中,置于冰浴0℃条件下搅拌5min,缓慢加入2,3-二氯-5,6-二氰基苯醌(ddq)1157.7mg(5.1mmol),冰浴0℃条件下继续搅拌30min,反应液加入3.0g的100~200目硅胶粉干法拌样,减压旋转蒸发除去溶剂后装柱(样品层高1.2cm,直径2.0cm;硅胶层高18cm,直径2.0cm)进行硅胶柱层析,以体积比为30:1的石油醚/乙酸乙酯为洗脱剂,流速2ml/min,洗脱2个柱体积,以体积比为10:1的石油
醚/乙酸乙酯为展开剂进行薄层层析监测,收集rf值为0.5-0.6的组分,得式(
ⅰ‑
5)所示2-((4-氯苄基)二硫烷基)苯并[d]恶唑920.9mg。核磁氢谱图见图1中e所示。
[0052]1h nmr(600mhz,chloroform-d)δ7.72
–
7.65(m,1h),7.51
–
7.44(m,1h),7.37
–
7.32(m,2h),7.30
–
7.27(m,2h),7.26
–
7.22(m,2h),4.19(s,2h).
[0053]
实施例6、化合物i-6的制备
[0054][0055]
在反应瓶中,把式(
ⅱ‑
2-4)所示2-巯基苯并咪唑751.0mg(5.0mmol)和式(
ⅲ‑
1)所示丙硫醇380.8mg(5.0mmol)依次加入到二氯甲烷(10ml)中,置于冰浴0℃条件下搅拌5min,缓慢加入2,3-二氯-5,6-二氰基苯醌(ddq)1157.7mg(5.1mmol),冰浴0℃条件下继续搅拌30min,反应液加入2.5g的100~200目硅胶粉干法拌样,减压旋转蒸发除去溶剂后装柱(样品层高0.8cm,直径2.0cm;硅胶层高18cm,直径2.0cm)进行硅胶柱层析,以体积比为50:1的石油醚/乙酸乙酯为洗脱剂,流速2ml/min,洗脱2个柱体积,以体积比为10:1的石油醚/乙酸乙酯为展开剂进行薄层层析监测,收集rf值为0.5-0.6的组分,得式(
ⅰ‑
6)所示2-(丙基二硫烷基)-1h-苯并[d]咪唑672.1mg。核磁氢谱图见图1中f所示。
[0056]1h nmr(600mhz,chloroform-d)δ7.56(s,2h),7.27
–
7.22(m,4h),2.85(t,2h),1.82
–
1.70(m,2h),0.98(t,j=7.3hz,3h).
[0057]
实施例7、化合物i-7的制备
[0058][0059]
在反应瓶中,把式(
ⅱ‑
3)所示2-巯基吡啶555.8mg(5.0mmol)和式(
ⅲ‑
3)所示1-癸硫醇871.7mg(5.0mmol)依次加入到二氯甲烷(10ml)中,置于冰浴0℃条件下搅拌5min,缓慢加入2,3-二氯-5,6-二氰基苯醌(ddq)1157.7mg(5.1mmol),冰浴0℃条件下继续搅拌30min,反应液加入3.0g的100~200目硅胶粉干法拌样,减压旋转蒸发除去溶剂后装柱(样品层高1.2cm,直径2.0cm;硅胶层高18cm,直径2.0cm)进行硅胶柱层析,以体积比为20:1的石油醚/乙酸乙酯为洗脱剂,流速2ml/min,洗脱2个柱体积,以体积比为10:1的石油醚/乙酸乙酯为展开剂进行薄层层析监测,收集rf值为0.5-0.6的组分,得式(
ⅰ‑
7)所示2-(癸基二硫烷基)吡啶840.4mg。核磁氢谱图见图1中g所示。
[0060]1h nmr(600mhz,chloroform-d)δ8.45(d,j=5.0hz,1h),7.73(d,j=8.0hz,1h),7.63(td,j=7.8,1.9hz,1h),7.06(dd,j=7.5,4.8hz,1h),2.82
–
2.74(m,2h),1.68(p,j=7.3hz,2h),1.37(p,j=6.7hz,2h),1.31
–
1.15(m,12h),0.87(t,j=6.8hz,3h).
[0061]
实施例8、化合物i-8的制备
[0062][0063]
在反应瓶中,把式(
ⅱ‑
4-1)所示4-氟苯硫酚640.9mg(5.0mmol)和式(
ⅲ‑
4)所示环己基硫醇581.1mg(5.0mmol)依次加入到二氯甲烷(10ml)中,置于冰浴0℃条件下搅拌5min,缓慢加入2,3-二氯-5,6-二氰基苯醌(ddq)1157.7mg(5.1mmol),冰浴0℃条件下继续搅拌30min,反应液加入2.5g的100~200目硅胶粉干法拌样,减压旋转蒸发除去溶剂后装柱(样品层高0.8cm,直径2.0cm;硅胶层高18cm,直径2.0cm)进行硅胶柱层析,以体积比为30:1的石油醚/乙酸乙酯为洗脱剂,流速2ml/min,洗脱2个柱体积,以体积比为30:1的石油醚/乙酸乙酯为展开剂进行薄层层析监测,收集rf值为0.4-0.5的组分,得式(
ⅰ‑
8)所示1-环己基-2-(4-氟苯基)二硫烷726.2mg。核磁氢谱图见图1中h所示。
[0064]1h nmr(600mhz,chloroform-d)δ7.55
–
7.40(m,2h),7.06
–
6.95(m,2h),2.79(tt,j=10.7,3.7hz,1h),2.09
–
1.95(m,2h),1.75(ddd,j=12.2,5.4,3.1hz,2h),1.64
–
1.54(m,1h),1.38
–
1.20(m,4h).
[0065]
实施例9、化合物i-9的制备
[0066][0067]
在反应瓶中,把式(
ⅱ‑
5)所示5-甲基-1,3,4-噻二唑-2-硫醇661.1mg(5.0mmol)和式(
ⅲ‑
4)所示环己基硫醇581.1mg(5.0mmol)依次加入到二氯甲烷(10ml)中,置于冰浴0℃条件下搅拌5min,缓慢加入2,3-二氯-5,6-二氰基苯醌(ddq)1157.7mg(5.1mmol),冰浴0℃条件下继续搅拌30min,反应液加入2.5g的100~200目硅胶粉干法拌样,减压旋转蒸发除去溶剂后装柱(样品层高0.8cm,直径2.0cm;硅胶层高18cm,直径2.0cm)进行硅胶柱层析,以体积比为30:1的石油醚/乙酸乙酯为洗脱剂,流速2ml/min,洗脱2个柱体积,以体积比为10:1的石油醚/乙酸乙酯为展开剂进行薄层层析监测,收集rf值为0.4-0.5的组分,得式(
ⅰ‑
9)所示2-(环己基二硫烷基)-5-甲基-1,3,4-噻二唑738.1mg。核磁氢谱图见图1中i所示。
[0068]1h nmr(600mhz,chloroform-d)δ3.01(tt,j=10.9,3.7hz,1h),2.73(s,3h),2.06(dt,j=12.5,4.0hz,2h),1.80(dt,j=12.8,3.8hz,2h),1.68
–
1.59(m,1h),1.49
–
1.15(m,5h).
[0069]
实施例10、化合物i-10的制备
[0070][0071]
在反应瓶中,把式(
ⅱ‑
2-5)所示5-氯-2-巯基苯并噁唑928.2mg(5.0mmol)和式(
ⅱ‑
1)所示2-噻吩硫醇581.1mg(5.0mmol)依次加入到二氯甲烷(10ml)中,置于冰浴0℃条
件下搅拌5min,缓慢加入2,3-二氯-5,6-二氰基苯醌(ddq)1157.7mg(5.1mmol),冰浴0℃条件下继续搅拌30min,反应液加入3.0g的100~200目硅胶粉干法拌样,减压旋转蒸发除去溶剂后装柱(样品层高1.2cm,直径2.0cm;硅胶层高18cm,直径2.0cm)进行硅胶柱层析,以体积比为50:1的石油醚/乙酸乙酯为洗脱剂,流速2ml/min,洗脱2个柱体积,以体积比为10:1的石油醚/乙酸乙酯为展开剂进行薄层层析监测,收集rf值为0.4-0.5的组分,得式(
ⅰ‑
10)所示5-氯-2-(噻吩-2-基二硫烷基)苯并[d]恶唑896.8mg。核磁氢谱图见图1中j所示。
[0072]1h nmr(600mhz,chloroform-d)δ7.69(s,1h),7.56
–
7.41(m,3h),7.31(dt,j=8.6,4.3hz,1h),7.02(ddd,j=5.3,3.6,1.6hz,1h).
[0073]
实施例11、化合物i-11的制备
[0074][0075]
在反应瓶中,把式(
ⅱ‑
2-3)所示2-巯基苯并噁唑928.2mg(5.0mmol)和式(
ⅱ‑
4-2)所示4-甲氧基苯硫酚701.1mg(5.0mmol)依次加入到二氯甲烷(10ml)中,置于冰浴0℃条件下搅拌5min,缓慢加入2,3-二氯-5,6-二氰基苯醌(ddq)1157.7mg(5.1mmol),冰浴0℃条件下继续搅拌30min,反应液加入3.0g的100~200目硅胶粉干法拌样,减压旋转蒸发除去溶剂后装柱(样品层高1.2cm,直径2.0cm;硅胶层高18cm,直径2.0cm)进行硅胶柱层析,以体积比为50:1的石油醚/乙酸乙酯为洗脱剂,流速2ml/min,洗脱2个柱体积,以体积比为10:1的石油醚/乙酸乙酯为展开剂进行薄层层析监测,收集rf值为0.4-0.5的组分,得式(
ⅰ‑
11)所示2-((4-甲氧基苯基)二硫烷基)苯并[d]恶唑867.1mg。核磁氢谱图见图1中k所示。
[0076]1h nmr(600mhz,chloroform-d)δ7.73
–
7.65(m,3h),7.55
–
7.43(m,1h),7.42
–
7.29(m,2h),6.91
–
6.81(m,2h),3.80(s,3h).
[0077]
实施例12、式(ⅰ)所示化合物对野生型铜绿假单胞菌pao1菌株生长的抑制作用
[0078]
(1)将实施例1-11制备的式(ⅰ)所示化合物分别用二甲基亚砜溶解,配成终浓度为10mm的化合物母液。
[0079]
(2)将野生型铜绿假单胞菌(pseudomonas aeruginosa)pao1菌株冻存管菌液接种在lb固体培养基中,37℃生化培养箱培养19~21小时进行活化,挑取单菌落传代,传递两代,获得活化菌株。
[0080]
将活化菌株接种在lb液体培养基中,37℃、140rpm培养14~15h,测得原始菌液595nm下吸光度为0.8361,培养物用lb液体培养基稀释10000倍,获得细菌悬浮液。
[0081]
lb固体培养基组成:10g/l蛋白胨,5g/l酵母提取物,5g/l氯化钠,20g/l琼脂,溶剂为去离子水。121℃灭菌20min。
[0082]
lb液体培养基组成:10g/l蛋白胨,5g/l酵母提取物,5g/l氯化钠,溶剂为去离子水。121℃灭菌20min。
[0083]
(3)在96孔板的每孔中加入198μl的细菌悬浮液、2μl化合物母液至每孔总体积200μl,使实施例1-11制备的各个化合物在孔中的最终浓度均为100μm。同时,在同一个96孔板上分别设置空白对照组和阳性对照组,空白对照组加入200μl的细菌悬浮液,阳性对照组加入198μl的细菌悬浮液、2μl 10mm的2-氨基苯并咪唑化合物母液(溶剂为二甲基亚砜)。添加
完化合物后将孔板移至生化培养箱内,37℃静置培养24h。最后在595nm下测量吸光度。所有测试化合物和对照的抑制率测定均一式三份进行。
[0084]
生长抑制率计算公式如下:
[0085]
铜绿假单胞菌生长抑制率=(od
595
control-od
595
test)/od
595
control
×
100%。注:control为空白对照组;test为阳性对照组和实施例1-11制备的式(ⅰ)所示化合物。
[0086]
实施例1-11中化合物对野生型pao1生长抑制效果图见图2所示。图2中化合物(
ⅰ‑
6,2-(丙基二硫烷基)-1h-苯并[d]咪唑)、化合物(
ⅰ‑
9,2-(环己基二硫烷基)-5-甲基-1,3,4-噻二唑)对pao1的生长具有明显的抑制作用,菌株几乎不生长。化合物(
ⅰ‑
2,2-(丙基二硫基)苯并[d]噻唑)、化合物(
ⅰ‑
3,2-((4-甲氧基苄基)二硫烷基)苯并[d]噻唑、化合物(
ⅰ‑
4,2-((4-氯苄基)二硫烷基)-6-甲氧基苯并[d]噻唑)、化合物(
ⅰ‑
8,1-环己基-2-(4-氟苯基)二硫烷)、化合物(
ⅰ‑
10,5-氯-2-(噻吩-2-基二硫烷基)苯并[d]恶唑)对pao1的生长具有一定的抑制作用,菌株生长受限。化合物(
ⅰ‑
1,1,2-二(噻吩-2-基)二硫烷)、化合物(
ⅰ‑
5,2-((4-氯苄基)二硫烷基)苯并[d]恶唑)、化合物(
ⅰ‑
7,2-(癸基二硫烷基)吡啶)、化合物(
ⅰ‑
11,2-((4-甲氧基苯基)二硫烷基)苯并[d]恶唑)对pao1的生长几乎无影响。
[0087]
实施例13、式(ⅰ)所示化合物对野生型铜绿假单胞菌pao1生物被膜形成的抑制作用
[0088]
(1)实施例1-11制备的式(ⅰ)所示化合物分别用二甲基亚砜溶解,配成终浓度为10mm的化合物母液。
[0089]
(2)将野生型铜绿假单胞菌(pseudomonas aeruginosa)pao1的细菌悬浮液的制备同实施例12。
[0090]
(3)在圆底96孔板的每孔中加入198μl的细菌悬浮液、2μl化合物母液至每孔总体积200μl,使实施例1-11制备的化合物在每孔中的最终浓度均为100μm。添加完化合物后将孔板移至生化培养箱内,37℃静置培养24h。培养完毕后使用移液枪吸取出细菌悬浮菌液,每孔加入200μl的pbs缓冲液洗涤,随后吸取出pbs缓冲液,重复上述操作2~3次以除去孔内非生物被膜的其它生物组织。随后再将孔板置于37℃烘箱内烘干脱水,将生物被膜固定于孔板内。烘干的孔板每孔用200μl 0.1%结晶紫染色液进行染色20min,去离子水洗后,37℃烘箱内烘干并用200μl无水乙醇重新溶解被结晶紫染色的生物被膜,静置20min,最后在595nm下测量吸光度。同样条件下,以2-氨基苯并咪唑作为阳性对照。
[0091]
生物被膜抑制率计算公式如下:
[0092]
铜绿假单胞菌生物被膜抑制率=(od
595
control-od
595
test)/od
595
control
×
100%。注:control为空白对照组;test为阳性对照组和实施例1-11制备的式(ⅰ)所示化合物。
[0093]
实施例1-11中化合物对野生型pao1生物被膜抑制效果图见图3所示,pao1生物被膜的形成和运动行为能力由qs系统参与调控。我们发现,化合物化合物(
ⅰ‑
6,2-(丙基二硫烷基)-1h-苯并[d]咪唑)、化合物(
ⅰ‑
9,2-(环己基二硫烷基)-5-甲基-1,3,4-噻二唑)通过直接抑制野生型pao1菌株的生长来抑制生物被膜的形成,而化合物(
ⅰ‑
7,2-(癸基二硫烷基)吡啶)在不影响野生型pao1菌株生长的情况下也能显著抑制生物被膜的形成,且其它实施例化合物对野生型pao1生物被膜的形成也有明显的抑制作用,远超阳性对照(2-氨基苯并噻唑)的抑制率,实验结果进一步验证了二硫化合物对pao1群体感应生物被膜的形成有
抑制作用。
[0094]
以上实施例描述了本发明的基本原理、主要特征及优点,本行业的技术人员应该了解,本发明不应受上述实施例的限制,上述实施例和说明书中描述的内容只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种优化和改进,这些优化和改进均落入本发明保护的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。