1.本技术属于药物制剂领域,具体涉及一种布洛芬酯衍生物及其乳状制剂。
背景技术:
2.布洛芬(ibuprofen)是一种芳基丙酸类非甾体抗炎药,最早于1968年在英国上市,是一种非选择性环氧化酶抑制剂,它通过抑制环氧化酶,减少前列腺素的合成产生镇痛、抗炎作用;通过下丘脑体温调节中枢而发挥解热作用。因其消炎、镇痛、解热效果好,且不良反应小,故被认为是最安全的非甾体抗炎药(nsaid)之一,目前己被广泛投入临床使用。其中,布洛芬的首个治疗疼痛和发热的静脉注射制剂—布洛芬注射液,由坎伯兰药物制剂有限公司开发,并于2009年获批上市。
3.然而布洛芬注射液在临床使用中存在一些问题:
4.1、由于布洛芬化合物本身具有一定的血管刺激性,故在临床使用前必须稀释到4mg/ml或者更低,然而在该低剂量的给药浓度下仍有患者静脉炎发生的报道,患者顺应性较差;
5.2、布洛芬注射液使用精氨酸作为增溶剂,临床使用配伍稀释时布洛芬容易析出,不利于临床应用的安全性;
6.3、在临床使用中,布洛芬注射液仅可采用输注的给药方式,且输注时长须大于30分钟,不可采用静脉推注,极大地限制了其退热的临床应用;
7.4、市售布洛芬注射液的ph值偏高,碱性的环境易使以盐酸吗啡为代表的阿片类药物在pca联用中析出,故而限制了实现其与阿片类药物联用来减少阿片类药物用量的作用。
8.布洛芬结构中含有一个手性碳,市场上常用的布洛芬为消旋布洛芬,消旋布洛芬中含50%左旋布洛芬和50%右旋布洛芬(即s-布洛芬)。研究表明左旋布洛芬抗炎解热镇痛的作用弱,右旋布洛芬比左旋布洛芬抗炎活性强28倍。新近研究表明,只需要消旋布洛芬一半剂量的右旋布洛芬,就可以得到与前者相同的临床疗效,可有效降低毒副作用。目前,国内已有多家药企的右旋布洛芬盐注射液完成临床批件申请,尚未有成熟的注射剂通过临床、上市。该注射液虽然通过用活性右旋体代替消旋化合物,降低了药品规格和使用剂量,然而并未从根本上解决其血管刺激性大、临床使用易析出的安全性问题。
技术实现要素:
9.本技术提供了一种布洛芬酯衍生物及其乳状制剂。
10.本技术通过对消旋布洛芬或s-布洛芬的羧基进行衍生化,得到化合物n9及其右旋对映异构体n9(s),并进一步将其制成乳状制剂,克服了现有布洛芬/右布洛芬注射液临床应用中存在的一些安全性和患者顺应性问题,达到了降低血管刺激性、增加临床使用方法、提高临床应用中制剂稳定性等目的。
11.第一方面,本技术提供一种布洛芬酯衍生物,即结构式(1)所示的化合物,其消旋体、立体异构体、药学上可接受的盐或溶剂合物,或者其药学上可接受的盐的溶剂合物,
[0012][0013]
根据本技术实施方案,其中,结构式(1)所示的化合物选自其右旋对映异构体,即1位碳是s构型的异构体,其结构如下所示:
[0014][0015]
根据本技术实施方案,其中,结构式(i)所示的化合物其右旋对映异构体n9(s)为以下化合物n9(s)a和n9(s)b的任意比的混合物:
[0016][0017]
第二方面,本技术提供结构式(1)所示的化合物、其消旋体、立体异构体、药学上可接受的盐或溶剂合物或者药学上可接受的盐的溶剂合物的制备方法,其包括化合物1与结构式(2)所示化合物反应的步骤:
[0018][0019]
其中,x为氯、溴或碘;化合物1为消旋的、s构型或r构型的布洛芬,即为(
±
)-2-(4-异丁基苯基)丙酸、(s)-2-(4-异丁基苯基)丙酸或(r)-2-(4-异丁基苯基)丙酸。
[0020]
根据本技术的实施方案,上述结构式(1)所示的化合物的制备方法在缚酸剂的存在下进行。
[0021]
根据本技术的实施方案,反应温度可以为-5~80℃,反应时间可以为0.5~24h;所用缚酸剂可以为无机碱如naoh、koh、k2co3、khco3、na2co3、nahco3或有机碱如三乙胺、吡啶、dmap、diea、dbu中的一种、两种或更多种;反应溶剂可以为丙酮、二氯甲烷、三氯甲烷、四氯化碳、四氢呋喃、甲苯、乙酸乙酯、乙腈、dmf、dmac或乙醚中的一种、两种或更多种。
[0022]
第三方面,本技术还提供了结构式(2)所示的卤代有机碳酸酯(x为碘)的制备方
法,所述方法包括以下步骤:
[0023][0024]
步骤1:三光气与正丙醛在冰盐浴中反应,吡啶作碱,二氯甲烷作溶剂,最终减压蒸馏得到m01;
[0025]
步骤2:m01与乙醇在冰浴下反应,吡啶作碱,二氯甲烷作溶剂,最终减压蒸馏得到m02;
[0026]
步骤3:m02与nai、tbab、氯化钙混合加热反应,甲苯作溶剂,最终通过减压蒸馏得到m03;以及
[0027]
步骤4:m03与布洛芬在室温反应,三乙胺作碱,乙酸乙酯作溶剂,最终减压蒸馏得到n9。
[0028]
第四方面,本技术提供了上述结构式(1)所示的化合物、其消旋体、立体异构体、药学上可接受的盐或溶剂合物、或其药学上可接受的盐的溶剂合物在制备药物中的应用。
[0029]
根据本技术的实施方案,所述药物可用于治疗一种或更多种以下的疾病:类风湿关节炎、腰痛症、偏头痛、神经痛、肩关节周围炎、骨性关节炎,颈肩腕综合征的消炎和/或镇痛,手术后、外伤后或拔牙后的镇痛和/或消炎、急性上呼吸道炎解热和/或镇痛。
[0030]
根据本技术的实施方案,所述药物为非甾体抗炎药物。
[0031]
第五方面,本技术还提供一种含布洛芬酯衍生物的乳状制剂,其包含:
[0032]
(a)结构式(1)所示的化合物n9,其消旋体、立体异构体、药学上可接受的盐或溶剂合物,或者其药学上可接受的盐的溶剂合物:
[0033][0034]
(b)乳化剂;以及
[0035]
(c)油。
[0036]
根据本技术实施方案,所述乳状制剂总重量计为100%,活性成分的质量百分比为0.1-10%,优选为5-10%。
[0037]
根据本技术实施方案,结构式(1)所示的化合物选自其右旋对映异构体,即1位碳是s构型的异构体,其结构如下所示:
[0038][0039]
适合用于本技术的乳化剂选自卵磷脂及其衍生物,如大豆卵磷脂、蛋黄卵磷脂、氢化卵磷脂、饱和和不饱和c
12-18
脂肪酰磷脂酰胆碱中的一种、两种或更多种的组合;蛋黄卵磷脂和/或大豆磷脂。
[0040]
根据本技术实施方案,所述乳化剂选自蛋黄卵磷脂或/和大豆卵磷脂,质量百分比为0.5-15%,优选为1.2-10%。
[0041]
适合用于本技术的油为可注射用油酯,选自大豆油、红花油、棉籽油、橄榄油、芝麻油、椰子油、蓖麻油、沙棘油、月见草油、玉米油、鸦胆子油、紫苏油、葡萄籽油、茶油、棕榈油、花生油、中链油(中链甘油三酯)、长链甘油三酯、油酸乙酯、乙酰化单甘油酯、丙二醇双酯、亚油酸甘油酯或聚乙二醇月桂酸甘油酯,或其中两种或更多种的组合。
[0042]
根据本技术实施方案,所述油选自芝麻油、中链甘油三酸酯、大豆油、葵花仁油、花生油的一种或几种,质量百分比为0.1-15%,优选0.5-5%。
[0043]
根据本技术实施方案,所述乳状制剂还包括稳定剂,所述稳定剂选自油酸或/和油酸钠,质量百分比为0.01-1%。
[0044]
根据本技术实施方案,所述乳状制剂还包括等渗调节剂,所述等渗调节剂选自蔗糖、葡萄糖、山梨醇、木糖醇、氯化钠、甘油中的一种或几种。
[0045]
根据本技术实施方案,所述乳状制剂还包括ph调节剂,所述ph调节剂选自枸橼酸、盐酸、柠檬酸、富马酸、赖氨酸、酒石酸、组氨酸、枸橼酸钠、氢氧化钠、柠檬酸钠、磷酸二氢钠、磷酸氢二钠中的一种或几种。
[0046]
根据本技术实施方案,所述乳状制剂还包括助乳化剂,所述助乳化剂选自kolliphor hs15、聚山梨酯80、乙醇、丙二醇等小分子醇类中的一种或几种。
[0047]
根据本技术实施方案,本技术所述的乳状制剂其平均粒径大小在10-1000nm范围,例如10-800nm范围,10-550nm范围,50-350nm范围,50-200nm范围,50-150nm范围等。
[0048]
第六方面,本技术还提供一种含布洛芬酯衍生物的乳状制剂的制备方法,包括以下步骤:
[0049]
(1)油相制备:向油中加入布洛芬酯衍生物、乳化剂、稳定剂,高速剪切使其混合均匀;
[0050]
(2)水相制备:向注射用水中加入等渗调节剂、稳定剂,必要时加入ph调节剂、助乳化剂,搅拌溶解;
[0051]
(3)初乳制备:将步骤(1)油相加入步骤(2)水相中,于水浴保温下高速剪切分散,形成初乳;
[0052]
(4)终乳制备:对步骤(3)所得初乳进行高压均质,得终乳;以及
[0053]
(5)充氮,灌封,灭菌,即得含布洛芬酯衍生物的乳状制剂。
[0054]
根据本技术实施方案,本技术所述的乳状制剂为脂肪乳注射剂或纳米乳注射剂。
[0055]
其中,脂肪乳注射剂的制备可采用以下方法:
[0056]
分别称取处方量油相和水相,用高速分散机对油相剪切分散,对水相磁力搅拌使其混合均匀。对水相进行60~65℃水浴保温,于高速分散机在15000rpm转速剪切下,将油相加入水相中,加入完全后继续高速剪切,得初乳。将初乳于800-860bar之间的压力均质3个循环,得到不同乳化剂制备的终乳,所得终乳于121℃灭菌12分钟。制备得到的脂肪乳注射剂其平均粒径为100-550nm范围,进一步优选为150-300nm范围。
[0057]
其中,纳米乳注射剂的制备可采用以下方法:
[0058]
分别称取处方量油相和水相,用高速分散机对油相剪切分散,对水相磁力搅拌使其混合均匀。对水相进行60~65℃水浴保温,于高速分散机在20000rpm转速剪切下,将水相加入油相中,加入完全后继续高速剪切,得初乳。将初乳于800-860bar之间的压力均质3个循环,得到不同乳化剂制备的终乳,所得终乳于121℃灭菌12分钟或者用0.22μm孔径滤膜过滤灭菌。制备得到的纳米乳注射剂其平均粒径为50-200nm范围,进一步优选为50-150nm范围。
[0059]
本技术制备的乳状制剂适宜于以肠胃外给药方式给药,肠胃外给药包括静脉内、动脉内、皮下、腹膜内或肌内注射或输注;或颅内例如鞘内或脑室内给药。可按单次大剂量形式肠胃外给药,或可通过例如连续灌注泵给药。或颅内例如鞘内或脑室内给药;注射剂常用容器有玻璃安瓿、西林瓶、塑料安瓿、预充针等。
[0060]
本技术具有如下有益效果:
[0061]
1、本技术通过对消旋布洛芬的羧基进行衍生化,得到化合物n9及其右旋对映异构体n9(s),克服了布洛芬注射液半衰期短、稳定性差、刺激性和配伍容易析出等方面存在的问题。本技术化合物经体外、体内血浆试验表明具有良好的药代动力学性质,且化合物本身的理化稳定性较高,例如在高温试验(60℃放置5~10天)中化合物纯度基本保持不变。
[0062]
2、布洛芬的主要药理活性来源于右旋布洛芬,本技术以右旋布洛芬为原料定向合成了(1s)构型的右旋布洛芬酯衍生物n9(s),其在人体内代谢的副产物为丙醛和乙醇,副产物毒性小,且同时具有较快的代谢速率;此外,研究发现n9(s)相比n9(r)在血浆中的水解速率更快,可生更多的右旋布洛芬。本领域知晓左旋布洛芬抗炎解热镇痛的作用弱,右旋布洛芬(s构型)比左旋布洛芬(r构型)药效强28倍,且左旋布洛芬能引起胃肠道毒性、水钠潴留、肾灌注降低及过敏反应等多种不良反应。因此,研究并制备s构型的布洛芬酯衍生物即本技术结构式(1)所示的化合物的右旋对映异构体具有重大意义。
[0063]
3、本技术通过研究活性成分的理化性质,综合考虑其体内外代谢试验,进一步研究其制剂处方,从而获得了一种高效、安全、稳定的含布洛芬酯衍生物的乳状制剂,采用本技术实验方法可制备具有良好粒径分布的脂肪乳注射剂和纳米乳注射剂。避免传统布洛芬等非甾体抗炎药对消化道黏膜的损伤,从而增加药物的生物利用度。
附图说明
[0064]
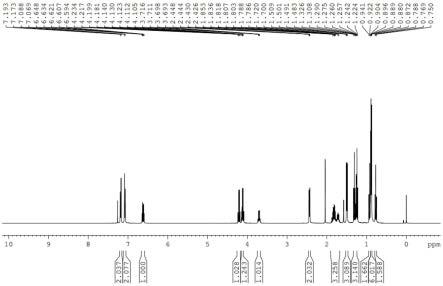
图1为本技术化合物n9(s)的氢谱图谱。
[0065]
图2为本技术化合物n9(s)的质谱图谱。
[0066]
图3为本技术化合物n9(s)在人血浆中降解的液相色谱图。
[0067]
图4为右布洛芬和右布洛芬酯衍生物n9(s)注射溶液血药浓度-时间曲线。
[0068]
图5为右布洛芬、右布洛芬酯衍生物n9(s)、侧链手性化合物n9(s)a、n9(s)b注射溶液血药浓度-时间曲线。
[0069]
图6为右布洛芬衍生物n9(s)的peg400增溶液、乳状注射液和右布洛芬精氨酸溶液血药浓度-时间曲线。
[0070]
图7为本技术脂肪乳制剂灭菌前后的粒度分布图。
[0071]
图8为本技术脂肪乳制剂灭菌前后zeta电位测定结果。
具体实施方式
[0072]
下面结合具体实施例和附图对本技术作进一步详述,以下实施例只是描述性的,不是限定性的,不能以此限定本技术的保护范围,如无特别说明,所用原料均可通过市售或自制获得。
[0073]
本技术中涉及的主要检测方法:
[0074]
一、ph测定:
[0075]
照ph值测定法(中国药典2020版通则0631)测定。
[0076]
二、粒度、zeta电位测定:
[0077]
取本品乳状注射液约20μl稀释于10ml经过滤的纯化水中,振摇使其混合均匀,得供试品混合物。照粒度和粒度分布测定法(中国药典2020版通则0982第三法),采用基于瑞利散射理论的动态光散射光学粒度分析仪pss nicomp z3000,采用下列参数:光学强度300khz;折射角90
°
;折射率1.333;粘度0.933cp;时间5分钟进行粒度和zeta电位检测。记录粒径的高斯分布图,并对平均粒径、pi、zeta电位等数据进行分析。
[0078]
实施例1:化合物n9的合成
[0079][0080]
步骤1:称取三光气(1000.0g,3.37mol)于5l三颈反应瓶中,加入2l无水二氯甲烷,反应瓶用n2置换3次,将反应瓶移至-35℃低温恒温反应浴中不断搅拌。控制反应液温度《-15℃,量取py(45.2g,0.57mol)滴加到反应瓶中。控制反应液温度《-15℃,称取正丙醛(460.2g,7.92mol)滴加入反应瓶中,滴毕,将低温恒温反应浴温度设置为-2℃,继续温度过夜。直接蒸馏得到无色油状物910.0g,收率为73.2%。
[0081]
步骤2:称取m01(910.0g,5.80mol)于干燥的三颈反应瓶中,加入无水dcm 10ml不断搅拌,称取乙醇(400.2g,8.68mol)加入到上述反应瓶中,将反应瓶移至低温恒温反应浴中不断搅拌,称取三乙胺(720.0g,7.88mmol)加入到上述反应容器中,滴毕,将反应瓶移至室温过夜。抽滤,滤饼用500ml
×
2二氯甲烷洗涤,滤液用5%khso4洗至ph=3~4,然后再用1.5l
×
2水洗,再用饱和食盐水洗,无水硫酸钠干燥2h。减压浓缩得到无色油状物,蒸馏得
800.0g无色油状物,收率83.1%。
[0082]
步骤3:称取m02(800.0g,4.8mol)、cacl2(319.6g,2.9mol)、tbab(46.4g,50.8mmol)于5l的三颈反应瓶中,加入甲苯3.2l,待水浴升温至70℃,加入nai(1438.6g,9.6mmol)反应1h。抽滤,滤液用1l水洗,加入1.6l 5%硫代硫酸钠水溶液洗涤,800ml水洗2次,800ml饱和食盐水洗,适量无水硫酸钠干燥,浓缩得黄色油状物,蒸馏得淡黄色油状物720.2g。
[0083]
步骤4:称取布洛芬(508.8g,2.47mol)于干燥的单口反应瓶中,加入10ml乙酸乙酯搅拌溶解,加入1-碘丙基乙基碳酸酯(720.2g,2.79mol),再在冰浴下缓慢滴加稀释过的三乙胺(345.24g,3.4mol),将反应移至30℃反应过夜。抽滤,加入600ml水洗,600ml饱和食盐水洗,干燥,浓缩。蒸馏,得513.4g淡黄色油状物即n9。
[0084]1h nmr(400mhz,cdcl3)δ7.19-7.07(m,4h),6.65-6.59(m,1h),4.24-4.09(m,2h),3.73-3.68(m,1h),2.45-2.43(m,2h),1.89-1.68(m,3h),1.51-1.48(m,3h),1.33-1.23(m,3h),0.94-0.75(m,9h);
[0085]
esi-ms m/z=359.2,[m na]
.
[0086]
实施例2:化合物n9(s)的合成
[0087][0088]
实验方法与实施例1相同,区别在于将布洛芬替换为s-布洛芬。
[0089]1h nmr(400mhz,cdcl3)δ7.19-7.07(m,4h),6.65-6.59(m,1h),4.24-4.09(m,2h),3.73-3.68(m,1h),2.45-2.43(m,2h),1.89-1.68(m,3h),1.51-1.48(m,3h),1.33-1.23(m,3h),0.94-0.75(m,9h);
[0090]
esi-ms m/z=359.2,[m na]
.
[0091]
试验例1:化合物高温稳定性研究
[0092]
试验方案:将本技术制备的化合物n9适量置于西林瓶中,在高温(60℃)条件下遮光放置,分别于0、5、10天取样,考察化合物纯度及有关物质(布洛芬)变化情况,结果如下表所示:
[0093]
表1纯度测定
[0094][0095]
由试验结果可知,本技术的化合物在高温(60℃)条件下遮光放置10天后,纯度在98%以上说明稳定性良好。
[0096]
试验例2:本技术化合物在人血浆中的代谢研究
[0097]
前体药物是通过在体内酶解释放出的原药发挥疗效,因此,前药在血浆中的代谢速率与生成速率与其能否有效发挥疗效及延长半衰期密切相关。本技术通过建立体外人体
血浆代谢模型对化合物n9及其异构体的转化特性进行评价,实验方案如下:
[0098]
(1)分别配制40mm的化合物n9、n9(s)、n9(r)的纯乙腈贮备液,配制40mm的布洛芬纯乙腈贮备液;
[0099]
(2)取25μl布洛芬贮备液1ml的人血浆中混合,涡旋30s,取样200μl加入800μl乙腈沉降蛋白,涡旋1min终止反应,作为布洛芬对照;40mm的化合物n9、n9(s)、n9(r)贮备液分别稀释200倍作为前药对照;
[0100]
(4)取100μl化合物n9、n9(s)、n9(r)纯乙腈贮备液分别加入4ml的人血浆中混合,涡旋30s,置于37℃恒温振荡水浴加热器中200rpm振荡;
[0101]
(5)在不同时间点(0,15,30,60,120min)取样200μl,每个时间点取样3次,加入800μl乙腈沉降蛋白,涡旋1min终止反应;并同法做空白血浆对照;
[0102]
(6)12000rpm,4℃离心10min,取上清液,(过滤膜)进样30μl,记录峰面积变化;
[0103]
(7)观察并分析化合物n9、n9(s)、n9(r)的水解速率。化合物n9、n9(s)、n9(r)经血浆代谢120min后,实验结果如下表所示:
[0104]
表2化合物n9、n9(s)和n9(r)的代谢
[0105][0106]
由试验结果可知:化合物n9的s型异构体n9(s)代谢速率相比消旋体n9的代谢速率要快,即右旋布洛芬酯前药相比消旋布洛芬酯前药在血浆中的水解速率更快,在体外人血浆中能够比传统消旋布洛芬酯前药更迅速转化为活性代谢物发挥其药理活性作用。
[0107]
同时,发明人在研究中还意外的发现,化合物n9(s)包含的2个峰,如图3所示,说明右布洛芬酯衍生物化合物n9(s)除了主链布洛芬处存在手性中心,侧链连接处也存在一个手性中心,且在人血浆中的羧酸酯酶对n9(s)中的2个异构体的水解速率不同。
[0108]
试验例3:本技术化合物在大鼠体内药动学研究
[0109]
本技术右布洛芬酯衍生物n9(s)(通过peg400增溶)和右布洛芬(精氨酸盐溶液)对大鼠进行等摩尔剂量尾静脉注射给药后,于给药后5、10、15、30、60、120、240、360、480和720min,眼底静脉取血于肝素处理的试管中。将全血8000rpm离心5min,分取血浆样品置于-80℃下保存,分析测定血浆中右布洛芬(ibu)的浓度。考察大鼠血浆中右布洛芬与时间的变化关系,图4为右布洛芬和右布洛芬酯衍生物n9(s)注射溶液血药浓度-时间曲线;经药代动力学软件分析,得药代动力学参数如下表所示:
[0110]
供试品药液配制:大鼠尾静脉给药体积均为0.25ml/100g。
[0111]
受试物右布洛芬:配制含右布洛芬20mg/ml的右布洛芬精氨酸溶液,用移液枪取200μl于10ml ep管中,使用分液枪取4800μl生理盐水加入管中,涡旋混匀,得到浓度为0.8mg/ml,体积为5ml的给药溶液。
[0112]
受试物n9:称取右布洛芬酯衍生物n9 20mg于15ml ep管中,使用分液枪取10ml的
peg 400加入管中,涡旋混匀,得到浓度为2mg/ml的化合物peg溶液。用移液枪取3250μl的n9 peg溶液于10ml ep管中,使用分液枪取1750μl生理盐水加入管中,涡旋混匀,配置浓度为1.3mg/ml,体积为5ml的给药溶液。
[0113]
表3给药方案
[0114][0115]
表4药代动力学参数
[0116][0117][0118]
由试验结果可知:右布洛芬酯类衍生物前药n9在大鼠体内转化为右布洛芬与右布洛芬盐溶液直接注射后的药时曲线基本重合,auc
0-t
无明显差异,可见该酯类前药在大鼠体内能够较快代谢成为具有抗炎活性的右布洛芬,并在大鼠体内整体暴露量一致。药代动力学参数显示,注射类制剂中使用酯类前药代替右布洛芬盐,可以延长右布洛芬的半衰期和平均滞留时间,降低其消除速度,增大表观分布容积。因此,本技术于临床应用中,在达到相同药效的基础上,延长了药物在体内作用时间。
[0119]
试验例4:
[0120]
由于右布洛芬衍生物化合物n9(s)除了主链布洛芬处存在手性中心,侧链连接处也存在一个手性中心,故比较了右布洛芬衍生物化合物n9(s)侧链消旋化合物、侧链手性化合物n9(s)a、n9(s)b的peg400增溶液与右布洛芬(精氨酸盐水溶液)在等摩尔剂量下尾静脉给药后,监控大鼠血浆中右布洛芬的生成与时间的变化关系,以考察主链右旋两个酯侧链异构的药物代谢动力学(前药转化)区别,经药代动力学软件分析,图5为右布洛芬、右布洛芬酯衍生物n9(s)、侧链手性化合物n9(s)a、n9(s)b注射溶液血药浓度-时间曲线。
[0121]
供试品溶液配制方法:分别称取右布洛芬衍生物化合物n9(s)、侧链异构体n9(s)a、侧链异构体n9(s)b 20mg于15ml ep管中,用分液枪取10ml的peg400分别加入管中,涡旋混匀,制成浓度为2mg/ml的化合物peg溶液。用移液枪取3250μl的供试化合物peg溶液于
10ml ep管中,使用分液枪取1750μl生理盐水加入管中,涡旋混匀,制成浓度为1.3mg/ml,体积为5ml的给药溶液。
[0122]
右布洛芬配制方法:配制含右布洛芬20mg/ml的右布洛芬精氨酸溶液,用移液枪取200μl于10ml ep管中,使用分液枪取4800μl生理盐水加入管中,涡旋混匀,得到浓度为0.8mg/ml,体积为5ml的给药溶液。
[0123]
表5给药方案
[0124][0125][0126]
化合物n9(s)a和n9(s)b是通过将化合物n9(s)通过反相c18色谱柱制备分离得到;具体结构式如下:
[0127][0128]
药代动力学研究结果表明:右布洛芬的三个供试化合物在等摩尔给药剂量下,均能够快速代谢。
[0129]
试验例5:
[0130]
分别使用peg增溶的、用乳状注射液(见后续实施例9)作为载体的右布洛芬酯衍生物n9(s)和右布洛芬精氨酸注射液,在等摩尔给药剂量下尾静脉给药后,大鼠血浆中转化为右布洛芬药物代谢动力学上的区别,经药代动力学软件分析,图6为右布洛芬衍生物n9(s)的peg400增溶液、乳状注射液和右布洛芬精氨酸溶液血药浓度-时间曲线。
[0131]
表6给药方案
[0132][0133]
备注:上述受试物除右布洛芬酯衍生物peg生理盐水溶液按给药浓度现配现用外,乳状注射液和精氨酸溶液均采用生理盐水稀释至所需给药体积。
[0134]
n9(s)(peg生理盐水)供试品溶液配制方法:称取右布洛芬衍生物化合物n9(s)20mg于15mlep管中,用分液枪取10ml的peg 400加入管中,涡旋混匀,制成浓度为2mg/ml的化合物peg溶液。用移液枪取3250μl的供试化合物peg溶液于10ml ep管中,使用分液枪取1750μl生理盐水加入管中,涡旋混匀,制成浓度为1.3mg/ml,体积为5ml的给药溶液。
[0135]
n9(s)(乳状注射液)供试品溶液配制方法:取含n9(s)化合物含量为60mg/ml的乳状注射液215μl于15ml的ep管中,用分液枪取10ml的生理盐水加入管中制成浓度为1.3mg/ml,体积为5ml的给药溶液。
[0136]
右布洛芬精氨酸溶液配制方法:取含右布洛芬20mg/ml的右布洛芬精氨酸溶液,用移液枪取200μl于10ml ep管中,使用分液枪取4800μl生理盐水加入管中,涡旋混匀,得到浓度为0.8mg/ml,体积为5ml的给药溶液。
[0137]
药代动力学研究结果表明:对大鼠等摩尔的给药剂量下,右布洛芬酯衍生物n9(s)的peg400增溶液、乳状注射液和右布洛芬精氨酸溶液经大鼠尾静脉注射后,体内右布洛芬的药时曲线基本重合,显示出乳状注射液的剂型对前药的释放和转化为抗炎活性物没有明显影响。
[0138]
试验例6:油相筛选
[0139]
采用不同的油制备乳状注射液,处方组成见下表:
[0140]
表7乳状注射液处方
[0141][0142]
其中,油选自花生油、中链甘油三酸酯、稻米油、蓖麻油、葵花仁油、芝麻油、葵花仁
油、茶油、玉米胚芽油、大豆油。
[0143]
实验方法:
[0144]
分别称取处方量油相和水相,用高速分散机对油相剪切10分钟,对水相磁力搅拌使其混合均匀。对水相进行65℃水浴保温,于高速分散机在15000rpm转速剪切下,将油相加入水相中,加入完全后继续高速剪切10分钟,得初乳。将初乳于800-860bar之间的压力均质3个循环,得到不同油制备的终乳,所得终乳于121℃灭菌12分钟。测定其平均粒径、zeta电位及pi。
[0145]
表8平均粒径、zeta电位及pi的测定
[0146][0147]
上述试验结果表明:由于实施例1、2、5、6、9有较低的平均粒径、绝对值更大的zeta电位和更低的pi值,故本技术脂肪乳剂优选的油相为芝麻油、中链甘油三酸酯、大豆油、葵花仁油、花生油。考虑到目前广泛应用于临床的载药乳状注射液、纳米乳多采用大豆油作为油相添加,后续实施例仅考察大豆油用做油相对乳状注射液对制剂稳定性的影响。
[0148]
试验例7:乳化剂筛选
[0149]
采用不同的乳化剂制备乳状注射液,处方组成见下表:
[0150]
表9乳状注射液处方
[0151][0152]
其中,乳化剂选自天然蛋黄卵磷脂、氢化蛋黄卵磷脂、天然大豆卵磷脂、氢化大豆卵磷脂、鞘磷脂、磷脂酰胆碱。
[0153]
实验方法:
[0154]
分别称取处方量油相和水相,用ika t10高速分散机对油相剪切10分钟,对水相磁力搅拌使其混合均匀。对水相进行65℃水浴保温,于ika t25高速分散机在15000rpm转速剪切下,将油相加入水相中,加入完全后继续高速剪切10分钟,得初乳。将初乳于800-860bar之间的压力均质3个循环,得到不同乳化剂制备的终乳,所得终乳于121℃灭菌12分钟。测定其平均粒径、zeta电位及pi。
[0155]
表10平均粒径、zeta电位及pi的测定
[0156]
[0157][0158]
上述试验结果表明:由于实施例10、12有更低的平均粒径、绝对值更大的zeta电位和更低的pi值,故本技术脂肪乳剂优选的乳化剂为蛋黄卵磷脂和天然大豆卵磷脂。考虑到目前广泛应用于临床的载药乳状注射液、纳米乳多采用天然蛋黄卵磷脂作为乳化剂添加,后续实施例仅考察天然蛋黄卵磷脂用做乳化剂对乳状注射液对制剂稳定性的影响。
[0159]
试验例8:乳化剂用量筛选
[0160]
采用不同用量的乳化剂制备乳状注射液,处方组成见下表:
[0161]
表11乳状注射液处方
[0162][0163][0164]
其中,乳化剂选用天然蛋黄卵磷脂,用量选自0.5%~15%。
[0165]
实施例16~18实验方法:
[0166]
分别称取处方量油相和水相,用ika t10高速分散机对油相剪切10分钟,对水相磁
力搅拌使其混合均匀。对水相进行65℃水浴保温,于ika t25高速分散机在15000rpm转速剪切下,将油相加入水相中,加入完全后继续高速剪切10分钟,得初乳。将初乳于800-860bar之间的压力均质3个循环,得到不同乳化剂制备的终乳,所得终乳于121℃灭菌12分钟。测定其平均粒径、zeta电位及pi。
[0167]
表12平均粒径、zeta电位及pi的测定
[0168][0169]
实施例19~20实验方法:
[0170]
分别称取处方量油相和水相,用ika t10高速分散机对油相剪切10分钟,对水相磁力搅拌使其混合均匀。对水相进行60℃水浴保温,于ika t25高速分散机在20000rpm转速剪切下,将水相加入油相中,加入完全后继续高速剪切3分钟,得初乳。将初乳于800-860bar之间的压力均质3个循环,得到不同乳化剂制备的终乳,所得终乳于121℃灭菌12分钟或者用0.22μm孔径滤膜过滤灭菌。测定其平均粒径、zeta电位及pi。
[0171]
表13平均粒径、zeta电位及pi的测定
[0172][0173][0174]
上述试验结果表明:实施例17、18、19有更低的平均粒径和较高的zeta电位,故本
申请天然蛋黄卵磷脂用量优选在1.2~10%。
[0175]
试验例9:大豆油用量筛选
[0176]
采用不同用量的乳化剂制备乳状注射液,处方组成见下表:
[0177]
表14乳状注射液处方
[0178][0179]
其中,大豆油用量选自0%~15%。
[0180]
实施例21~22实验方法:
[0181]
分别称取处方量油相和水相,用ika t10高速分散机对油相剪切10分钟,对水相磁力搅拌使其混合均匀。对水相进行60℃水浴保温,于ika t25高速分散机在20000rpm转速剪切下,将水相加入油相中,加入完全后继续高速剪切3分钟,得初乳。将初乳于800-860bar之间的压力均质3个循环,得到不同乳化剂制备的终乳,所得终乳于121℃灭菌12分钟或者用0.22μm孔径滤膜过滤灭菌。测定其平均粒径、zeta电位及pi。
[0182]
表15平均粒径、zeta电位及pi的测定
[0183][0184]
实施例23~25实验方法:
[0185]
分别称取处方量油相和水相,用ika t10高速分散机对油相剪切10分钟,对水相磁力搅拌使其混合均匀。对水相进行65℃水浴保温,于ika t25高速分散机在15000rpm转速剪切下,将油相加入水相中,加入完全后继续高速剪切10分钟,得初乳。将初乳于800-860bar之间的压力均质3个循环,得到不同乳化剂制备的终乳,所得终乳于121℃灭菌12分钟。测定其平均粒径、zeta电位及pi。
[0186]
表16平均粒径、zeta电位及pi的测定
[0187][0188][0189]
上述试验结果表明:实施例21、22、23有更低的平均粒径和较高的zeta电位,故本技术大豆油用量优选在0.5~5%。
[0190]
实施例27~40
[0191]
采用不同比例的api(n9(s))、油、乳化剂、稳定剂、助乳化剂、等渗调节剂、ph调节剂制备乳状注射液,处方组成见下表:
[0192]
表17乳状注射液处方
[0193]
[0194]
[0195][0196]
试验方法:
[0197]
(1)油相制备:向油中加入活性成分n9(s)、乳化剂、稳定剂,高速剪切使其混合均匀,即得;
[0198]
(2)水相制备:向注射用水中加入等渗调节剂、稳定剂,必要时加入ph调节剂、助乳化剂,搅拌溶解,即得;
[0199]
(3)分别称取处方量油相和水相,用ika t10高速分散机对油相剪切10分钟,对水相磁力搅拌使其混合均匀。对水相进行65℃水浴保温,于ika t25高速分散机在15000rpm转速剪切下,将油相加入水相中,加入完全后继续高速剪切10分钟,得初乳,用ph调节剂溶液将ph调节至4.0-9.0范围内;
[0200]
(4)将初乳于800-860bar之间的压力均质3个循环,得到终乳。并对成品乳状注射液进行25℃稳定性留样,于0天、30天进行外观性状的观察,具有代表性的进行显微镜观察,结果见下表:
[0201]
1、上述实施例均采用对应的ph调节剂将ph调节至4.0-9.0左右。
[0202]
2、上述实施例均采用注射用水补充至100ml。
[0203]
表18外观性状
[0204]
[0205][0206]
结论:除实施例30外,各实施例均在留样条件下保持较好的外观形状。由此可见,脂肪乳含药量可选自0.1-10%;另外,各稳定剂、助乳化剂、等渗调节剂、ph调节剂在处方中均表现良好。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。