一种肿瘤抗原/mhc-i复合物及其制备方法和用途
技术领域
1.本发明涉及免疫学领域,尤其涉及一种肿瘤抗原/mhc-i复合物及其制备方法和在体外富集cd8
t细胞、刺激相同来源肿瘤浸润淋巴细胞的活化、增殖和/或制备治疗肿瘤的药物中的用途;还涉及一种体外富集cd8
t细胞的方法及所得的cd8
t细胞、一种体外刺激相同来源肿瘤浸润淋巴细胞的活化、增殖的方法及所得的肿瘤浸润淋巴细胞、相应的药物组合物,以及肿瘤的治疗方法。
背景技术:
2.免疫系统与肿瘤之间的关系错综复杂:一方面,免疫系统能够通过多种免疫效应机制杀伤或清除肿瘤细胞;另一方面,肿瘤细胞也能通过多种机制抵抗或逃避免疫系统对其的杀伤和清除。肿瘤初期,免疫系统尝试清除被认为是“外源性”的肿瘤细胞,然而肿瘤细胞通过抗原缺失、减少自身抗原提呈、抗原调变、共刺激信号缺乏以及分泌免疫抑制性物质等方式,建立免疫抑制状态,逃脱机体免疫识别。因此,如何通过肿瘤细胞表达的肿瘤抗原诱导t淋巴细胞的抗肿瘤免疫应答是肿瘤免疫治疗研究的关键。
3.所谓肿瘤抗原是指细胞癌变过程中出现的新抗原(neoantigen)或肿瘤细胞异常表达或过表达的抗原物质。t细胞能够区分肿瘤细胞和正常细胞,是通过特异性的识别肿瘤细胞表达的独特的肿瘤抗原而引发免疫反应。尽管肿瘤细胞表达肿瘤抗原,但大多数肿瘤细胞的免疫原性比较弱,难以诱导机体产生针对这些抗原的特异性免疫应答。与此同时,肿瘤细胞通过下调或关闭主要组织相容性复合体(mhc)的表达,或者直接下调肿瘤抗原的产生,使mhc递呈肿瘤抗原的能力下降,导致体内针对肿瘤抗原应有的免疫应答缺乏特异性或能力不足以清除肿瘤细胞,造成肿瘤患者产生的免疫应答常不能有效清除肿瘤细胞。
4.肿瘤过继细胞治疗(adoptive cell therapy,act)是将经体外扩增和激活处理的自体或异体免疫细胞(主要是自体细胞)过继回输入肿瘤患者体内,以增强患者免疫功能,达到治疗目的的方法。在过继性t细胞治疗过程中,t淋巴细胞是杀伤肿瘤细胞的最终执行者,其中,细胞毒性t淋巴细胞(cytotoxic tlymphocytes,ctls)是抗肿瘤免疫的主要效应细胞,介导特异性抗肿瘤免疫反应。在体内,这一作用过程依赖细胞间接触,在抗原呈递的过程中,肿瘤抗原可以递呈在mhc i类分子上,供t细胞识别,诱导cd8
细胞毒性t细胞的激活,启动适应性免疫应答。
5.人的mhc又称为人类白细胞抗原(hla)基因复合体,作为抗原提呈分子参与适应性免疫应答,决定了t细胞识别抗原的mhc限制性。ctl细胞中cd8
t细胞可以识别mhc i类分子提呈的内源性抗原肽被激活,通过快速且精准的控制过程靶向肿瘤细胞,直接将肿瘤细胞杀死。但由于突变细胞或肿瘤细胞表面的mhc i类分子缺失或表达降低,致使肿瘤细胞不能有效提呈肿瘤抗原,以致不能有效的激活特异性cd8
ctl以杀伤肿瘤细胞,造成肿瘤免疫逃逸。
6.act治疗的特异性在很大程度上取决于对特异性肿瘤抗原的识别,尤其是对新抗原的识别。越来越多的证据表明,act治疗的成功可能归因于新抗原特异性t细胞,这一策略
已被证明可以成功地诱发肿瘤消退,甚至使转移性癌症患者得到完全缓解。因此,采用这些新抗原特异性的t细胞的act将非常有前途。在各种act中,肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,til)在肿瘤治疗中已经被证明是一种非常成功的方法。由肿瘤组织中分离得到的til含有多种具有不同受体的肿瘤特异性t细胞,这些肿瘤特异性t细胞主要识别由癌细胞基因突变引起的新抗原,并可以对多种肿瘤抗原产生反应,应对肿瘤的异质性。越来越多的研究注意力已经转移到识别和选择新抗原特异性t细胞上,这种“精准靶向”策略对新抗原特异性t细胞的鉴定和分离提出了巨大的挑战。如何从til中有效地识别和分离肿瘤抗原特异性t细胞并有效识别由癌细胞基因突变引起的新抗原,很大程度上决定了til细胞靶向肿瘤细胞及杀伤肿瘤细胞的能力。
7.长期以来,研究人员一直试图从输注的til中分离肿瘤抗原特异性t细胞亚群,并为此开发了许多方法。目前已知分离肿瘤抗原特异性t细胞的策略包括:1)通过全外显子测序,肿瘤细胞cdna文库测序及与hla i类分子分型分析结合的生信分析,推测肿瘤特异性抗原序列,合成预测的抗原肽池筛选肿瘤抗原特异性t细胞;2)通过全外显子测序,筛选编码患者肿瘤突变的微小基因串联库(tandem minigene,tmg),可以从治疗性til中识别肿瘤新抗原特异性t细胞;3)使用表面标记物或t细胞受体(tcr)序列分析及大数据分析的方法,预测肿瘤抗原特异性t细胞,等等。然而,这些尝试在不同程度上均存在短板,有的方法需要建立自体肿瘤细胞系,因此需要面临建立自体肿瘤细胞系成功率的挑战;如果使用单一细胞表面标记物,有些肿瘤抗原特异性t细胞就会被遗漏;尤其目前最广泛应用的通过测序及生信分析的方法需要较多的肿瘤组织、复杂的设备、数月的时间及昂贵的费用,同时也存在计算机算法可能引入的不准确性及不确定性,与此同时,对于大多数已经发生肿瘤转移的患者来说,这个时间范围是不可接受的,加之巨额的费用,使这些方法的应用面临极大的限制。
8.此外,人工抗原呈递细胞(aapc)目前作为可能的替代品,在癌症免疫疗法的生产中得以应用。目前采用的aapc是一种仅限于确定和经选择的肽-mhc复合物的方法,无法应用于未知的肿瘤新抗原的情况。也有研究人员在磁珠上结合已知的、基因工程合成的肽-mhc复合物以富集/刺激t细胞,但这一过程需要预先鉴定免疫原性肿瘤抗原和体外合成相应的患者特异性mhc-i类分子结构,同样限制了这个方法在肿瘤免疫治疗临床中的广泛应用。
技术实现要素:
9.本发明提供一种肿瘤细胞来源的肿瘤抗原/mhc-i复合物及其制备方法,以最大程度地俘获肿瘤细胞中的特异性肿瘤抗原,可用于富集肿瘤抗原特异性cd8
t细胞、刺激相同来源肿瘤浸润淋巴细胞的活化、增殖和肿瘤杀伤功能,以解决肿瘤抗原特异性t细胞的“精准靶向”问题。
10.本发明提供了一种肿瘤抗原/mhc-i复合物的制备方法,其包括:
11.对肿瘤细胞进行裂解,得到肿瘤细胞裂解物,所述肿瘤细胞裂解物含有肿瘤抗原/mhc-i复合物;
12.将负载有抗体的载体与所述肿瘤细胞裂解物混合处理,得到所述肿瘤抗原/mhc-i复合物;其中,所述肿瘤抗原/mhc-i复合物负载于所述载体上,所述抗体与所述肿瘤抗原/
mhc-i复合物中的mhc-i特异性结合。
13.在一些实施方案中,所述肿瘤抗原/mhc-i复合物的制备方法还包括从负载有所述肿瘤抗原/mhc-i复合物的载体中分离所述肿瘤抗原/mhc-i复合物的步骤。
14.在一些实施方案中,以细胞裂解液对所述肿瘤细胞进行裂解。
15.在一些优选实施方案中,所述细胞裂解液包括3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐([(3-cholanidopropyl)dimethylammonio]-1-propanesulfonate,以下简称chaps)、tris缓冲液和nacl。
[0016]
在一些实施方案中,所述抗体为mhc-iβ链抗体。
[0017]
在一些优选实施方案中,所述抗体标记有第一标记物,所述第一标记物选自生物素和/或第一化学偶联物。
[0018]
在一些实施方案中,所述载体为磁珠和/或量子点荧光微球。
[0019]
在一些优选实施方案中,所述载体标记有第二标记物,所述第二标记物选自亲和素和/或第二化学偶联物。
[0020]
本发明还提供了一种肿瘤抗原/mhc-i复合物,其通过本发明提供的所述肿瘤抗原/mhc-i复合物的制备方法制备得到。
[0021]
本发明还提供了所述肿瘤抗原/mhc-i复合物在体外富集肿瘤抗原特异性cd8
t细胞、刺激相同来源肿瘤浸润淋巴细胞的活化、增殖和/或制备治疗肿瘤的药物中的用途。
[0022]
本发明还提供了一种体外富集肿瘤抗原特异性cd8
t细胞的方法,其包括:
[0023]
将本发明提供的所述肿瘤抗原/mhc-i复合物与相同来源的肿瘤浸润淋巴细胞接触,所述肿瘤浸润淋巴细胞中的肿瘤抗原特异性cd8
t细胞与所述肿瘤抗原/mhc-i复合物结合,得到结合物,所述结合物富集有所述肿瘤抗原特异性cd8
t细胞。
[0024]
在一些实施方案中,所述肿瘤抗原/mhc-i复合物与标记有生物素的抗体结合并共同负载于标记有亲和素的载体上,并且,在所述肿瘤抗原/mhc-i复合物与相同来源的肿瘤浸润淋巴细胞接触之前,所述肿瘤浸润淋巴细胞中添加有亲和素。
[0025]
在一些实施方案中,在所述肿瘤抗原/mhc-i复合物与相同来源的肿瘤浸润淋巴细胞接触之前,所述肿瘤浸润淋巴细胞还添加有酪氨酸激酶抑制剂;优选地,所述酪氨酸激酶抑制剂为达沙替尼。
[0026]
在一些优选实施方案中,所述酪氨酸激酶抑制剂为达沙替尼。
[0027]
在一些实施方案中,所述体外富集肿瘤抗原特异性cd8
t细胞的方法还包括从所述结合物中分离所述肿瘤抗原特异性cd8
t细胞的步骤。
[0028]
本发明还提供了一种肿瘤抗原特异性cd8
t细胞,其是通过本发明提供的体外富集肿瘤抗原特异性cd8
t细胞的方法制备得到。
[0029]
本发明还提供了一种体外刺激相同来源肿瘤浸润淋巴细胞的活化、增殖的方法,其包括:
[0030]
将本发明提供的所述肿瘤抗原/mhc-i复合物与相同来源的肿瘤浸润淋巴细胞接触。
[0031]
在一些实施方案中,将本发明提供的所述肿瘤抗原/mhc-i复合物与相同来源的肿瘤浸润淋巴细胞接触的步骤中,还添加有细胞因子。
[0032]
在一些优选实施方案中,所述细胞因子选自4-1bb、il-2、il-21中的至少一种。
[0033]
本发明还提供了一种活化的肿瘤浸润淋巴细胞,其是通过本发明提供的体外刺激相同来源肿瘤浸润淋巴细胞的活化、增殖的方法制备得到。
[0034]
本发明还提供了一种药物组合物,所述药物组合物包括有效成分和药学上可接受的载体,所述有效成分包括本发明提供的所述肿瘤抗原特异性cd8
t细胞和/或所述活化的肿瘤浸润淋巴细胞。
[0035]
本发明还提供了一种肿瘤的治疗方法,其包括:
[0036]
将有效量的所述肿瘤抗原特异性cd8
t细胞、所述活化的肿瘤浸润淋巴细胞和/或所述药物组合物与所述肿瘤接触;其中,所述肿瘤抗原特异性cd8
t细胞、所述活化的肿瘤浸润淋巴细胞以及所述药物组合物中的有效成分来源于所述肿瘤。
[0037]
本发明还提供了一种鉴定肿瘤抗原的方法,其包括:
[0038]
将本发明提供的所述肿瘤抗原特异性cd8
t细胞进行tcr测序或蛋白质质谱分析,鉴定其序列。
[0039]
本发明具有如下有益效果:
[0040]
首先,本发明提供的肿瘤抗原/mhc-i复合物的制备方法是基于鸟枪法(shot gun)的设计原理,利用抗体与mhc-i特异性结合的特性,从肿瘤细胞裂解物中一次性无差别抓取(pull-down)肿瘤细胞表达的肿瘤抗原与mhc-i的复合物。该方法可最大程度地抓取肿瘤细胞裂解物中的肿瘤抗原/mhc-i复合物,无需预先对免疫原性肿瘤抗原进行鉴定,适用范围更广,步骤更加简便,成本也更低。
[0041]
其次,本发明提供的肿瘤抗原/mhc-i复合物可以特异性富集肿瘤浸润淋巴细胞中的cd8
t细胞,并能够诱导刺激肿瘤浸润淋巴细胞及其中的cd8
t细胞的活化和增殖,例如使干细胞样肿瘤抗原特异性t细胞的比例提升、使cd8
t细胞分泌ifn-γ的能力提升等,解决了肿瘤抗原特异性t细胞的“精准靶向”问题,增强肿瘤浸润淋巴细胞对肿瘤细胞的杀伤功能,对肿瘤疾病的治疗以及act方法的优化具有重大实践意义。
附图说明
[0042]
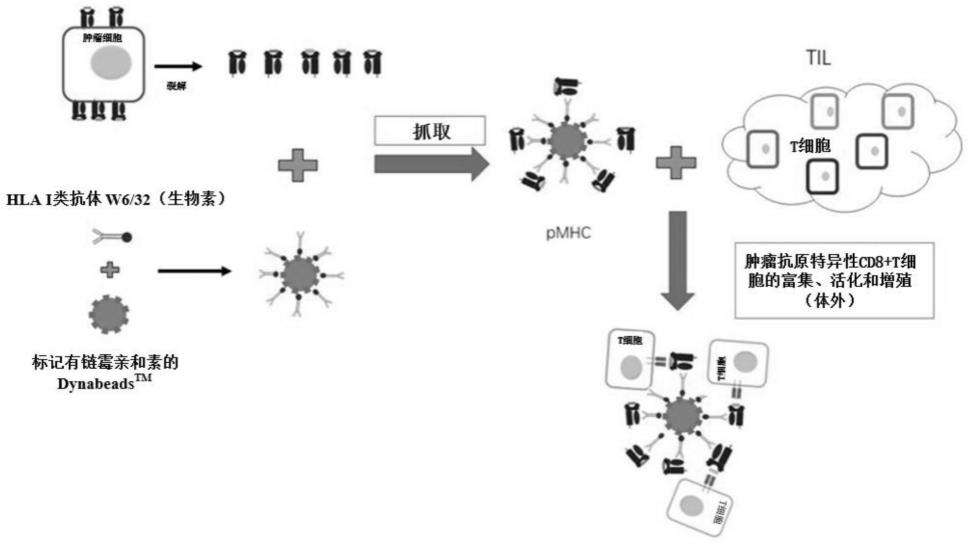
图1是本发明基于鸟枪法的设计原理所提供的肿瘤抗原/mhc-i复合物的制备方法,以及所得肿瘤抗原/mhc-i复合物的用途的流程示意图;
[0043]
图2是本发明实施例1提供的肿瘤抗原/mhc-i复合物的制备方法对于抓取肿瘤抗原/mhc-i复合物效果的蛋白免疫印迹检测结果;其中,1为蛋白梯度;2为肿瘤细胞裂解物混悬液;3为肿瘤抗原/mhc-i复合物混悬液;
[0044]
图3是本发明实施例2中,将肿瘤抗原/mhc-i复合物与til细胞共孵育后的cd8
t细胞比例示意图(n=3;****表示p<0.0001);其中,空白对照组为til细胞,阴性对照组为til细胞与20μl包被有hla i类抗体[w6/32](抗体标记有生物素)且标记有链霉亲和素的磁珠dynabeads
tm
的混合物;实验组为til细胞与pmhc复合物的混合物(此时pmhc复合物负载在包被有hla i类抗体[w6/32](标记有生物素)和标记有链霉亲和素的磁珠dynabeads
tm
上);
[0045]
图4是本发明实施例2中,将肿瘤抗原/mhc-i复合物与til细胞共孵育后的流式细胞荧光分析图,显示了cd8
t细胞和cd4
t细胞的比例;其中,a为空白对照组中同一肿瘤样本来源的til细胞;b为阴性对照组中上清中的细胞;c为实验组中与肿瘤抗原/mhc-i复合物结合的细胞;
[0046]
图5是本发明实施例3中,以肿瘤抗原/mhc-i复合物刺激相同肿瘤组织样本来源的til细胞48小时后,空白对照组、阴性对照组与实验组各自的上清ifn-γ浓度统计结果(n=3;*表示p<0.05;**表示p<0.01);
[0047]
图6是本发明实施例3中,以肿瘤抗原/mhc-i复合物刺激相同肿瘤组织样本来源的til细胞后,各组的tscm(记忆干性t细胞)比例(n=3;*表示p<0.05);
[0048]
图7是本发明实施例3中,以肿瘤抗原/mhc-i复合物刺激相同肿瘤组织样本来源的til细胞后,各组cd-107a/ifn-γ双阳细胞比例分析结果(n=3;*表示p<0.05;ns表示p>0.05);
[0049]
图5至图7中,空白对照组为til细胞,不添加包被有hla i类抗体[w6/32](标记有生物素)和标记有链霉亲和素的磁珠dynabeads
tm
,阴性对照组按实验组的同等比例在til细胞中加入包被有hlai类抗体[w6/32](标记有生物素)和标记有链霉亲和素的磁珠dynabeads
tm
,实验组是在til细胞中加入负载在包被有hla i类抗体[w6/32](标记有生物素)和标记有链霉亲和素的磁珠dynabeads
tm
上的pmhc复合物。
具体实施方式
[0050]
下面将结合实施例对本发明作进一步阐述,但这些实施例不对本发明构成任何限制。
[0051]
本发明提供了一种肿瘤抗原/mhc-i复合物的制备方法,其包括:
[0052]
(11)对肿瘤细胞进行裂解,得到肿瘤细胞裂解物,所述肿瘤细胞裂解物含有肿瘤抗原/mhc-i复合物;
[0053]
(12)将负载有抗体的载体与所述肿瘤细胞裂解物混合处理,得到所述肿瘤抗原/mhc-i复合物;其中,所述肿瘤抗原/mhc-i复合物负载于所述载体上,所述抗体与所述肿瘤抗原/mhc-i复合物中的mhc-i特异性结合。
[0054]
具体地,步骤(11)中,肿瘤细胞是指从肿瘤组织中获取的肿瘤细胞。本发明对于从肿瘤组织中获取肿瘤细胞的方法,以及对肿瘤细胞进行裂解的方法不作限制,可采用本领域常规的方法。
[0055]
肿瘤抗原与mhc-i在肿瘤细胞中已经处于结合状态,即,肿瘤抗原与mhc-i以“肿瘤抗原/mhc-i复合物(pmhc)”的状态存在于肿瘤细胞裂解物中。
[0056]
在一些实施方案中,使用细胞裂解液对肿瘤细胞进行裂解。通过细胞裂解液对肿瘤细胞进行裂解,不仅可以使肿瘤细胞表面的抗原与mhc-i形成的肿瘤抗原/mhc-i复合物存在于肿瘤细胞裂解物中,还可以使肿瘤细胞内部抗原(即,原本不存在于肿瘤细胞表面的那部分抗原)与mhc-i形成的肿瘤抗原/mhc-i复合物也存在于肿瘤细胞裂解物中,从而使肿瘤细胞裂解物中具有更多的肿瘤抗原用于被抓取。
[0057]
在一些优选实施方案中,所述细胞裂解液为条件性肿瘤细胞裂解液(lysis buffer),其包括chaps、tris缓冲液和nacl。其中,chaps的浓度优选1~25mg/ml,进一步优选为2.5mg/ml;tris缓冲液的浓度优选25mm;nacl的浓度优选150mm,以更好地维持肿瘤细胞裂解时的酸碱度和渗透压。采用该条件性肿瘤细胞裂解液,从而释放更多的肿瘤抗原与mhc-i形成的肿瘤抗原/mhc-i复合物用于被抓取;同时,所述条件性肿瘤细胞裂解液的裂解条件温和,可以更好地保护所述肿瘤抗原/mhc-i复合物。
[0058]
进一步地,优选在加入所述细胞裂解液裂解所述肿瘤细胞时,还加入了蛋白酶抑制剂。蛋白酶抑制剂可以保护所述肿瘤抗原/mhc-i复合物,避免在肿瘤细胞裂解过程中的所述肿瘤细胞自身蛋白酶对所述肿瘤抗原/mhc-i复合物产生降解作用。
[0059]
步骤(12)中,所述负载有抗体的载体中,所述抗体可以与肿瘤细胞裂解物中的mhc-i特异性结合。因此,将负载有抗体的载体与所述肿瘤细胞裂解物混合处理时,所述抗体通过与肿瘤细胞裂解物中的mhc-i特异性结合,进而对存在于肿瘤细胞裂解物中的肿瘤抗原/mhc-i复合物进行无差别抓取,得到负载有肿瘤抗原/mhc-i复合物的载体。此时,所述抗体也负载在载体上。因此,在一些实施方案中,还包括从所述负载有肿瘤抗原/mhc-i复合物的载体中分离所述肿瘤抗原/mhc-i复合物的步骤。分离方法可采用本领域的常规方法。
[0060]
在一些实施方案中,所述抗体为mhc-iβ链抗体。mhc-i类分子是由重链(α链)和轻链(β链)组成的异源二聚体。其中,重链的氨基酸序列个体之间存在较大差异,而轻链的氨基酸序列高度保守,在不同物种之间的差别极小。因此,选择mhc-i轻链抗体可适用于从不同个体的肿瘤组织中制备相应的肿瘤抗原/mhc-i复合物。在一些具体实施例中,所述抗体为hla(人白细胞抗原)i类抗体[w6/32],该抗体特异性识别mhc-i轻链,可用于对人肿瘤抗原/mhc-i复合物的抓取。可以理解的是,当期望抓取的肿瘤抗原/mhc-i复合物来源于人以外的生物时,可使用相应可特异性识别该生物的mhc-i轻链的抗体。
[0061]
将所述抗体负载于所述载体上的方法可采用本领域的常规方法。在一些优选实施方案中,所述抗体标记有第一标记物,所述第一标记物选自生物素和/或第一化学偶联物。相应地,所述载体标记有第二标记物,所述第二标记物可以与第一标记物结合,进而使所述抗体负载于所述载体上。所述第二标记物选自亲和素和/或第二化学偶联物,所述第二化学偶联物可与所述第一化学偶联物结合。优选地,所述第一标记物为生物素,所述第二标记物为链霉亲和素。生物素与链霉亲和素具有较强的结合力,且结合稳定性好、专一性强,不受试剂浓度、ph环境、蛋白变性剂等有机溶剂的影响。
[0062]
本发明所述载体可选择本领域常用的载体,包括但不限于磁珠、量子点荧光微球等。在一些实施方案中,选择磁珠作为载体。磁珠载体不仅容易获得,而且在本发明中可以模拟细胞膜上的抗原肽/mhc-i复合物的支撑结构。在一些具体实施例中,选择标记有链霉亲和素的磁珠dynabead
tm
。
[0063]
在一些实施方案中,由于步骤(12)中获得的肿瘤抗原/mhc-i复合物负载于所述载体上,因此还包括从负载所述载体中分离所述肿瘤抗原/mhc-i复合物的步骤。由于在后文中,还涉及将所得肿瘤抗原/mhc-i复合物用于富集肿瘤抗原特异性cd8
t细胞,以及刺激相同来源肿瘤浸润淋巴细胞的活化、增殖,为了避免所述肿瘤抗原/mhc-i复合物以游离状态存在,且便于获得肿瘤抗原特异性cd8
t细胞(游离状态不利于tcr的识别与结合),优选将步骤(12)所得负载有肿瘤抗原/mhc-i复合物的载体用于富集肿瘤抗原特异性cd8
t细胞,而不将所述肿瘤抗原/mhc-i复合物从所述载体上分离出来。然而可以理解的是,本领域技术人员也可以根据实际需要,选择先将所述肿瘤抗原/mhc-i复合物从所述载体中分离出来,然后将所述肿瘤抗原/mhc-i复合物用于富集肿瘤抗原特异性cd8
t细胞;或者,先将所述肿瘤抗原/mhc-i复合物从所述载体中分离出来,然后将所述肿瘤抗原/mhc-i复合物负载于另外的载体上,再用于富集并获得肿瘤抗原特异性cd8
t细胞。
[0064]
本发明还提供了一种肿瘤抗原/mhc-i复合物,其通过本发明提供的所述肿瘤抗
原/mhc-i复合物的制备方法制备得到。
[0065]
本发明还提供了所述肿瘤抗原/mhc-i复合物在体外富集肿瘤抗原特异性cd8
t细胞、刺激相同来源肿瘤浸润淋巴细胞的活化、增殖和/或制备治疗肿瘤的药物中的用途。
[0066]
从肿瘤组织中分离得到的肿瘤浸润淋巴细胞含有多种具有不同受体的肿瘤特异性t细胞,这些肿瘤特异性t细胞主要识别由癌细胞基因突变引起的抗原,因此可以对多种肿瘤抗原产生反应,应对肿瘤的异质性。然而,现有技术中,难以实现对肿瘤细胞的抗原实现有效识别和分离,因此产生的肿瘤特异性t细胞普遍存在特异性较差、靶向性不强的问题,影响肿瘤的治疗效果。针对该问题,结合图1,本发明提供的肿瘤抗原/mhc-i复合物的制备方法基于“鸟枪法”的设计原理,可无需对肿瘤细胞抗原进行事先鉴定,通过简单的细胞裂解使肿瘤抗原(包括肿瘤新抗原)充分释放到裂解物中,利用抗体与mhc-i特异性结合且mhc-i呈递肿瘤抗原的特性,从肿瘤细胞裂解物中一次性无差别抓取肿瘤抗原/mhc-i复合物。该制备方法可在体外抓取的肿瘤抗原/mhc-i复合物中的肿瘤抗原数量更多,种类更丰富,更有利于获得对肿瘤抗原(肿瘤新抗原)具有特异性的cd8
t细胞,并可选择性地诱导这些细胞的活化和增殖,从而增加这些细胞对肿瘤细胞的特异性杀伤功能,实现肿瘤细胞的“精准靶向”。
[0067]
本发明还提供了一种体外富集肿瘤抗原特异性cd8
t细胞的方法,其包括:
[0068]
将本发明提供的所述肿瘤抗原/mhc-i复合物与相同来源的肿瘤浸润淋巴细胞接触,所述肿瘤浸润淋巴细胞中的肿瘤抗原特异性cd8
t细胞与所述肿瘤抗原/mhc-i复合物结合,得到结合物,所述结合物富集有所述肿瘤抗原特异性cd8
t细胞。
[0069]
通过该方法,可以简便地从肿瘤浸润淋巴细胞中分离肿瘤抗原特异性t细胞亚群(cd8
t细胞),而无需实现对肿瘤抗原的序列或肿瘤抗原特异性t细胞进行分析。同时,该方法还避免了使用单一细胞表面标记物时导致的部分抗原特异性t细胞被遗漏的问题。
[0070]
本发明中,术语“接触”包括但不限于将所述肿瘤抗原/mhc-i复合物与所述肿瘤浸润淋巴细胞混合处理等方式。在一些具体实施例中,采用将所述肿瘤抗原/mhc-i复合物与所述肿瘤浸润淋巴细胞混合孵育的方式实现接触。
[0071]
本发明中,用于与相同来源的肿瘤浸润淋巴细胞接触的所述肿瘤抗原/mhc-i复合物,可以是本发明上述肿瘤抗原/mhc-i复合物的制备方法步骤(12)中所得的负载于载体上的肿瘤抗原/mhc-i复合物,也可以是从负载有所述肿瘤抗原/mhc-i复合物的载体上分离出来的肿瘤抗原/mhc-i复合物。在一些实施方案中,为了便于将cd8
t细胞从肿瘤浸润淋巴细胞中分离出来,选择负载于载体上的肿瘤抗原/mhc-i复合物与相同来源的肿瘤浸润淋巴细胞接触。此时,肿瘤浸润淋巴细胞中的cd8
t细胞通过t细胞受体(tcr)识别肿瘤抗原/mhc-i复合物,从而结合在肿瘤抗原/mhc-i复合物上形成结合物,并且该结合物负载于载体上,实现cd8
t细胞与肿瘤浸润淋巴细胞的分离。
[0072]
本发明中,“相同来源的肿瘤浸润淋巴细胞”指的是所述肿瘤浸润淋巴细胞与所述肿瘤抗原/mhc-i复合物的来源相同。即,所述肿瘤抗原/mhc-i复合物的制备方法中,步骤(11)中的所述肿瘤细胞所源自的肿瘤,与所述肿瘤浸润淋巴细胞所源自的肿瘤相同,均来自同一患有肿瘤疾病的个体中的同一肿瘤。
[0073]
在一些实施方案中,还包括将cd8
t细胞从所述结合物中分离出来的步骤。分离方法可采用本领域的常规方法。
[0074]
由于肿瘤细胞自身会表达生物素,且在肿瘤细胞培养过程中培养液也会存在少量的生物素,此时,当抗体上标记有第一标记物,且第一标记物为生物素,同时载体上标记有第二标记物,且第二标记物为亲和素时,细胞自身表达的生物素或培养液中的生物素会对抗体上的生物素与载体上的亲和素的结合带来干扰。因此,在一些实施方案中,为了避免上述干扰问题的出现,在所述肿瘤抗原/mhc-i复合物与相同来源的肿瘤浸润淋巴细胞接触之前,所述肿瘤浸润淋巴细胞中添加有亲和素,以与细胞自身表达的生物素或培养液中的生物素结合,避免干扰。在一些具体实施方案中,相对于1*106的肿瘤浸润淋巴细胞而言,加入亲和素的量为0.5微克。
[0075]
cd8
t细胞通过t细胞受体(tcr)与所述肿瘤抗原/mhc-i复合物中的mhc-i结合。然而,tcr在与同源抗原接触后将会被触发发生内化,tcr内化会导致cd8
t细胞无法识别或结合肿瘤抗原/mhc-i复合物,并且在cd8
t细胞的检测实验中还会导致对cd8
t细胞的染色失败。为了避免该问题,在一些实施方案中,在所述肿瘤抗原/mhc-i复合物与相同来源的肿瘤浸润淋巴细胞接触之前,所述肿瘤浸润淋巴细胞中还添加有酪氨酸激酶抑制剂。酪氨酸激酶抑制剂具有抑制t细胞受体内化的作用,保证了cd8
t细胞对肿瘤抗原/mhc-i复合物的识别和结合。此外,通过加入酪氨酸激酶抑制剂,还可以在以流式细胞术对cd8
t细胞富集效果的检测实验中,降低背景干扰信号,显示出清晰的分群结果。在一些优选实施方案中,酪氨酸激酶抑制剂为达沙替尼(dasatinib)。在一些具体实施例中,以混合物的方式添加,所述混合物由50nm达沙替尼、5g/l人血清白蛋白(hsa)与ph7.4的pbs缓冲液组成。其中,hsa主要起到维持渗透压、ph缓冲等作用。
[0076]
本发明还提供了一种肿瘤抗原特异性cd8
t细胞,其是通过本发明提供的体外富集肿瘤抗原特异性cd8
t细胞的方法制备得到。该肿瘤抗原特异性cd8
t细胞对肿瘤细胞中的多种肿瘤抗原(肿瘤新抗原)具有特异性,对肿瘤具有更有效、特异性更强的杀伤作用。
[0077]
本发明提供的所述肿瘤抗原特异性cd8
t细胞还可以用于鉴定肿瘤抗原。相应地,本发明提供了一种鉴定肿瘤抗原的方法,其包括:
[0078]
将本发明提供的所述肿瘤抗原特异性cd8
t细胞进行tcr测序或蛋白质质谱分析,鉴定其序列。
[0079]
本发明还提供了一种体外刺激相同来源肿瘤浸润淋巴细胞的活化、增殖的方法,其包括:
[0080]
将本发明提供的所述肿瘤抗原/mhc-i复合物与相同来源的肿瘤浸润淋巴细胞接触。
[0081]
本发明提供的所述肿瘤抗原/mhc-i复合物通过与相同来源的肿瘤浸润淋巴细胞接触,可以激活肿瘤抗原特异性t细胞克隆,促进肿瘤浸润淋巴细胞的活化、增殖,使干细胞样肿瘤抗原特异性t细胞的比例提升,cd8
t细胞分泌ifn-γ的能力提升等,增强对肿瘤细胞的杀伤功能。
[0082]
本发明中,用于与相同来源的肿瘤浸润淋巴细胞接触的所述肿瘤抗原/mhc-i复合物,可以是本发明上述肿瘤抗原/mhc-i复合物的制备方法步骤(12)中所得的负载于载体上的肿瘤抗原/mhc-i复合物,也可以是从负载有所述肿瘤抗原/mhc-i复合物的载体上分离出来的肿瘤抗原/mhc-i复合物。
[0083]
在一些实施方案中,将所述肿瘤抗原/mhc-i复合物与相同来源的肿瘤浸润淋巴细
胞接触的步骤中,还添加有细胞因子。这是因为肿瘤组织来源的肿瘤浸润淋巴细胞多数处于偏耗竭状态,细胞数量较低,导致肿瘤浸润淋巴细胞的活化和增殖可能存在潜在的不利影响。通过加入细胞因子,可以保障肿瘤浸润淋巴细胞的正常增殖及其干细胞性。
[0084]
在一些优选实施方案中,细胞因子选自4-1bb、il-2、il-21中的至少一种。
[0085]
本发明还提供了一种活化的肿瘤浸润淋巴细胞,其是通过本发明提供的体外刺激相同来源肿瘤浸润淋巴细胞的活化、增殖的方法制备得到。本发明提供的活化的肿瘤浸润淋巴细胞中,具有干细胞样肿瘤抗原特异性t细胞的比例提升,cd8
t细胞分泌ifn-γ的能力提升等特点,可增强对肿瘤的杀伤作用。
[0086]
本发明还提供了一种药物组合物,所述药物组合物包括有效成分和药学上可接受的载体,所述有效成分包括本发明提供的所述肿瘤抗原特异性cd8
t细胞和/或所述活化的肿瘤浸润淋巴细胞。其中,所述药物上可接受的载体可以是本领域常规使用的载体。
[0087]
所述药物组合物中,对有效成分和药学上可接受的载体的含量没有特别要求,可以是各组分常规的含量。
[0088]
在一些实施方案中,所述药物组合物中还可以包含药学上可接受的其它辅料,该辅料可以是本领域常规采用的各种制剂或化合物中的一种或多种。例如,所述药学上可接受的其它辅料可以包括ph缓冲液、保护剂、渗透压调节剂中的至少一种。
[0089]
在一些实施方案中,所述药物组合物可以为液体制剂,例如注射液。所述液体制剂包括但不限于用于皮下、肌肉或静脉注射给药。在一些具体实施例中,所述药物组合物用于静脉注射给药。
[0090]
本发明还提供了一种肿瘤的治疗方法,其包括:
[0091]
将有效量的所述肿瘤抗原特异性cd8
t细胞、所述活化的肿瘤浸润淋巴细胞和/或所述药物组合物与所述肿瘤接触;其中,所述肿瘤抗原特异性cd8
t细胞、所述活化的肿瘤浸润淋巴细胞以及所述药物组合物中的有效成分来源于所述肿瘤。
[0092]
本发明中,术语“接触”包括但不限于有效量的所述肿瘤抗原特异性cd8
t细胞、所述活化的肿瘤浸润淋巴细胞和/或所述药物组合物与所述肿瘤混合处理,或者将有效量的所述肿瘤抗原特异性cd8
t细胞、所述活化的肿瘤浸润淋巴细胞和/或所述药物组合物通过静脉注射给药等方式与所述肿瘤接触。在一些具体实施例中,采用将有效量的所述肿瘤抗原特异性cd8
t细胞、所述活化的肿瘤浸润淋巴细胞和/或所述药物组合物与所述肿瘤(肿瘤细胞)在体外混合孵育的方式实现接触。在另一些具体实施例中,采用将有效量的所述肿瘤抗原特异性cd8
t细胞、所述活化的肿瘤浸润淋巴细胞和/或所述药物组合物与所述肿瘤浸润淋巴细胞通过静脉注射给药,在体内经循环与所述肿瘤实现接触。
[0093]
为使本发明上述实施细节和操作能清楚地被本领域技术人员理解,以及本发明实施例肿瘤抗原/mhc-i复合物及其制备方法和用途的进步性能显著的体现,以下通过多个实施例来举例说明上述技术方案。
[0094]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
[0095]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0096]
实施例1
[0097]
1.肿瘤组织细胞裂解
[0098]
1.1以肺癌肿瘤组织样本开展验证实验,通过无菌操作将肿瘤组织剪成1mm3大小
组织碎块,加入生理盐水,并用巴氏吸管通过70μm滤网收集组织细胞;
[0099]
1.2收集到的组织细胞以400g、室温,离心5min;
[0100]
1.3离心后,收集细胞以生理盐水重悬,进行细胞计数,剩余细胞以完全培养基重悬待用;
[0101]
1.4将细胞置于试管中,使每管中有4*106个细胞并进行裂解;裂解前以1ml预冷的pbs(ph7.4)清洗,共清洗2次,每次清洗完以400g、4℃离心5min,然后收集细胞;
[0102]
1.5收集的细胞加入条件性细胞裂解液(lysis buffer:2.5mg/ml chaps、25mm tris缓冲液和150mm nacl)300μl,充分混匀后,冰上放置10min进行裂解,期间轻轻混匀几次;以14000g、4℃离心15min,将上清转移至新试管中,即为肿瘤细胞裂解物;
[0103]
1.6浓度测定:采用bca试剂盒测定每管收集的肿瘤细胞裂解物中总蛋白浓度,以此计算获得的肿瘤细胞蛋白总量。
[0104]
2.抓取(pull-down)肿瘤抗原/mhc-i复合物(pmhc复合物)
[0105]
利用生物素-链霉亲和素法分离提取肿瘤抗原/mhc-i复合物:
[0106]
2.1取25μl标记有链霉亲和素的磁珠dynabeads
tm
(dynabeads
tm
myone
tm
streptavidin t1,购自invitrogen公司),平衡准备后:分为两份,其中:
[0107]
第一份:取20μl标记有链霉亲和素的磁珠dynabeads
tm
(0.2mg)置于试管中,加入8μl hlai类抗体[w6/32](标记有生物素)(ab110665,购自abcam公司)抗体,试管置于样品混匀器(hula mixer)上轻轻旋转,室温下孵育30min;取下试管,置于磁力架上,静置2min后,加入100μl pbs(1g/l hsa 2.5mg/ml chaps,ph 7.4)洗掉结合不稳定的抗体,置于磁力架上,静置2min,去上清,共重复3次,得到包被有hla i类抗体[w6/32](抗体标记有生物素)且标记有链霉亲和素的磁珠dynabeads
tm
。
[0108]
第二份:取5μl标记有链霉亲和素的磁珠dynabeads
tm
与肿瘤细胞裂解物(其体积根据bca测定浓度计算,总蛋白浓度需达到0.15μg)混匀,试管置于样品混匀器上,室温孵育30min,取下试管,置于磁力架上,静置2min,收集上清。
[0109]
2.2将第二份所收集的上清,加入第一份的试管中混匀,置于样品混匀器上轻轻旋转,4℃孵育过夜。
[0110]
2.3次日早上将试管置于磁力架上静置10min,转移上清到一个新的试管中以留样,蛋白免疫印迹检测抓取效果。
[0111]
2.4用100μl的pbs(1g/l hsa 2.5mg/ml chaps,ph 7.4)重悬pmhc复合物,试管置于磁力架上,静置2min,移去上清,再以100μl的pbs(1g/lhsa 2.5mg/ml chaps,ph 7.4)轻柔地重悬pmhc复合物(即包被有hlai类抗体[w6/32](标记有生物素)且标记有链霉亲和素的磁珠dynabeads
tm
与pmhc结合的产物),重悬过程中避免与管壁结合的蛋白质共洗脱,共重复2次。
[0112]
2.5从重悬的pmhc复合物混悬液中取出1/10置于另一试管中,以2
×
上样缓冲液(loading buffer)轻轻重悬,50℃加热10min;将试管置于磁力架上,取上清转移至新试管,待蛋白免疫印迹检测。
[0113]
2.6蛋白免疫印迹检测:
[0114]
为验证抓取效果,对肿瘤细胞裂解物和pmhc复合物混悬液分别以上样缓冲液重
悬,50℃水浴加热后,以等质量上样进行蛋白免疫印迹检测,验证标记有链霉亲和素的磁珠上结合肿瘤抗原/hlai复合物的情况。
[0115]
sds-page电泳结束后,采用一抗mhc i类抗体 hlaa hla b抗体(ab134189,购自abcam公司)(兔单克隆抗体[epr1394y]针对mhc i类分子 hlaa hlab,检测片段大小约41kda);山羊抗兔igg h&l(标记有辣根过氧化物酶hrp)为二抗,进行蛋白免疫印迹检测。结果如图2所示。
[0116]
通过图2可以看出,利用标记有链霉亲和素的磁珠作为载体结合生物素标记的抗体,可以有效地抓取肿瘤细胞裂解物中的肿瘤抗原/hla i复合物(pmhc)。
[0117]
实施例2
[0118]
pmhc复合物对相同肿瘤样本来源til细胞中cd8
t细胞的特异性富集效果验证实验:
[0119]
1.相同肺癌肿瘤组织来源的til细胞经细胞计数后,以1*106/管,离心去上清;以1mlpbs(10g/lhsa,ph7.4)洗1次;400g、4℃离心5min去上清,以100μl pbs(5g/lhsa,ph7.4)重悬。
[0120]
2.为除去干扰背景,重悬后的细胞每管加入0.5u亲和素,室温孵育10min;加入1mlpbs(5g/l hsa,ph7.4),400g,4℃离心5min去上清;再以1ml pbs(5g/l hsa,ph7.4)悬浮细胞并离心,重复两次。
[0121]
3.为增强pmhc复合物与相同来源的til细胞结合及降低流式染色及检测分析时的干扰背景,加入达沙替尼(50nm,5g/l hsa,pbs ph7.4),37℃孵育30min,400g、4℃离心5min去上清,清洗一次后以pbs/5g/lhsa重悬至100μl。
[0122]
4.根据细胞数量加入fc受体阻断剂,室温反应10min,加入900μlpbs/5g/l hsa洗细胞一次。以100μl pbs/5g/l hsa重悬后开展cd8
t细胞富集。
[0123]
5.以til细胞作为空白对照组(blank),将til细胞与20μl包被有hla i类抗体[w6/32](抗体标记有生物素)且标记有链霉亲和素的磁珠dynabeads
tm
混匀作为阴性对照组(negative),将til细胞与pmhc复合物(此时pmhc复合物负载在包被有hlai类抗体[w6/32](标记有生物素)和标记有链霉亲和素的磁珠dynabeads
tm
上)混匀作为实验组,试管置于样品混匀器上轻轻旋转,室温孵育1h。
[0124]
6.孵育完成后,取下试管置于磁力架上,静置10min,分别收集上清及pmhc/细胞(上一步骤中,负载在包被有hla i类抗体[w6/32](标记有生物素)和标记有链霉亲和素的磁珠dynabeads
tm
上的pmhc复合物与细胞结合的产物),待检测。
[0125]
7.上清及pmhc/细胞分别以100μl pbs(5g/l hsa/50nm达沙替尼/2mm edta,ph7.4)洗1次,100μl pbs(5g/l hsa/50nm达沙替尼/2mm edta,ph7.4)重悬,流式分析cd45、cd4、cd8表达情况。评价各组中cd45
cd8
细胞群比例变化,评价pmhc复合物对cd8
t细胞的特异性富集效果,结果如图3和图4所示。
[0126]
通过图3和图4可以看出,实验组中cd8
t细胞的比例明显高于阴性对照组和空白对照组,说明pmhc复合物能够有效选择性结合cd8
t细胞,达到对cd8
t细胞的富集效果。
[0127]
实施例3
[0128]
1.相同肿瘤样本分离获得的细胞(包括肿瘤组织细胞以及til)以cd45磁珠(人cd45 microbeads,购自mitenyi biotec公司)进行分选,收集cd45
细胞(即,til),以完全
培养基(rpmi 1640 10%ab血清 青霉素和链霉素)重悬,并调整细胞密度1*106/ml,置于96孔板每孔100μl细胞悬液,并补充3000u/ml il-2。
[0129]
2.细胞铺板过夜稳定后,按比例加入负载在包被有hlai类抗体[w6/32](标记有生物素)和标记有链霉亲和素的磁珠dynabeads
tm
上的pmhc复合物作为实验组,磁珠dynabeads
tm
颗粒数:细胞为0.5:1(根据磁珠dynabeads
tm
颗粒数计算),对照组设置空白对照组(blank,不添加包被有hla i类抗体[w6/32](标记有生物素)和标记有链霉亲和素的磁珠dynabeads
tm
)及阴性对照组(negative,按同等比例加入包被有hla i类抗体[w6/32](标记有生物素)和标记有链霉亲和素的磁珠dynabeads
tm
);在空白对照组、阴性对照组和实验组中分别补充il-2(3000u/ml)、il-21(25ng/ml)和4-1bb(5μg/ml);所有含包被有hlai类抗体[w6/32](标记有生物素)和标记有链霉亲和素的磁珠dynabeads
tm
颗粒的样品加入细胞共培养前,均需以完全培养基重悬后补充加入,确保每孔终体积为200μl。
[0130]
3.细胞静置培养48h后,进行第一次半换液(完全培养基仅加入3000u/ml il-2),吸取100μl上清,400g离心5min,保留上清进行elisa检测,分析各组ifn-γ分泌情况。
[0131]
4.待细胞扩增翻倍进行扩孔;每次扩孔时注意留取上清样本,elisa检测分析各组ifn-γ分泌情况。
[0132]
5.观察细胞状态,细胞扩增翻倍,进行细胞计数后,取7.5*105细胞进行流式检测,分析记忆表型细胞群比例,结果如图6所示。
[0133]
6.观察细胞状态,进行细胞计数,以1*106/ml密度,转入24孔板继续扩增培养,维持细胞密度小于2*106/ml。
[0134]
7.以完全培养基加入3000u/ml il-2维持细胞培养,在各组中分别取2*106细胞进行杀伤双染实验,流式检测分析cd 107a/ifn-γ双阳细胞群比例变化,结果如图5和图7所示。
[0135]
通过图6可以看出,pmhc复合物可以刺激肿瘤抗原特异性t细胞,提升记忆干性t细胞的比例。
[0136]
通过图5和图7可以看出,经pmhc复合物刺激,ifn-γ的释放增加,细胞毒性功能增强,提示了更优的细胞毒性t细胞的活化效果。
[0137]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
