1.本发明属于细胞工程和基因工程技术领域,具体涉及羊卵巢成熟相关的基因及其应用。
背景技术:
2.羊作为我国重要的经济动物,不仅提供了大量的肉制品,还是许多皮毛产品的重要来源。随着人们生活水平的提高,对羊的需求量和产品质量要求越来越高,但现有的生产水平不能满足日益增长的需求,供需差异越来愈大。因此在保证羊肉质量的同时,提高羊繁殖能力,增加羊肉及毛制品产量,能成功的缓解当下供需不足的紧张情况,具有较好的实际意义和发展前景。生育和繁殖能力是影响绵羊养殖场经济的重要因素,世界绵羊品种繁多,但具有高繁殖率的品种很少,绝大多数只生产单只羔羊,多胎品种少之又少。湖羊是我国重要的绵羊品种之一,品种特点是繁殖力高、性成熟较早,也是研究控制绵羊卵巢发育和产仔数的遗传机制的理想资源。
3.已有研究发现lncrna虽然不具有编码蛋白质的性质,但是能在转录和转录后水平影响基因发挥功能,其作为一类新的重要调节因子广泛参与各种生理和病理过程。对卵母细胞分化和成熟、卵巢内各种细胞发育、以及激素分泌和卵巢功能的发挥具有重要的调控作用。此外还与多囊卵巢综合征(pcos)等卵巢发育相关疾病的产生和治疗有关,因此lncrna表达失调常常导致多种疾病。
4.本技术选取中国本土湖羊品种为实验对象,采用rna-seq技术对卵巢组织中的lncrna进行测序分析,比较3月龄、8月龄的湖羊卵巢组织中lncrna的差异表达情况,利用生物信息学方法筛选出两个阶段差异表达的lncrna及其调控基因,从而筛选出调控卵巢成熟的lncrna及其靶基因,探索lncrna影响卵巢成熟的调控机制,为增强繁殖能力和繁殖速度提供有力依据,为家畜的生物育种提供理论基础。
技术实现要素:
5.一种与羊卵巢成熟相关的lncrna,所述lncrna为loc105610626,序列与seq id no.1具有90%以上序列同源性。
6.优选的,loc105610626序列与seq id no.1具有95%以上序列同源性;更优选的,长链非编码rna序列为seq id no.1。
7.loc105610626用于制备检测卵巢成熟水平试剂中的应用。
8.优选的,通过测序技术、核酸杂交技术或核酸扩增技术检测loc105610626基因的表达水平。
9.优选的,核酸扩增技术采用一对特异性引物扩增loc105610626基因;核酸杂交包括与igfbp2基因的核酸序列杂交的探针。
10.优选的,卵巢为羊卵巢。
11.一种检测羊卵巢成熟的试剂,试剂包含用于核酸扩增的引物对,检测
loc105610626基因的表达水平。
12.优选的,用于核酸扩增的引物对序列为seq id no.2和seq id no.3。
13.优选的,试剂检测的样本为组织。
14.本发明提供igfbp2在制备检测卵巢发育水平试剂中的应用。
15.优选的,通过测序技术、核酸杂交技术或核酸扩增技术检测igfbp2基因的表达水平。
16.优选的,核酸扩增技术采用一对特异性引物扩增igfbp2基因;核酸杂交包括与igfbp2基因的核酸序列杂交的探针。
17.优选的,通过免疫方法检测igfbp2基因表达产物的表达水平。
18.优选的,通过elisa检测试剂盒和/或胶体金检测试剂盒检测igfbp2基因达产物的表达水平。
19.优选的,卵巢为羊卵巢。
附图说明
20.图1为总rna琼脂糖凝胶电泳结果;
21.图2为卵巢组织差异表达mrna kegg pathway富集分析(h3vs h8)图
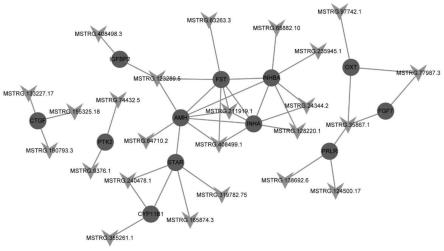
22.图3为3月龄vs8月龄卵巢组织差异表达lncrna和mrna共表达网络图,三角形节点代表lncrna,圆形节点代表mrna;
23.图4为差异表达基因qrt-pcr验证结果图。
具体实施方式
24.下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。
25.实施例1样品的采集剂rna提取
26.1.1样品的采集
27.将3月龄和8月龄的羊屠宰后,将两侧的卵巢组织摘除,剪成小块组织样后迅速放入冻存管中并投入液氮中保存,组织样温度维持低温后放入-80℃冰箱中保存,整个过程保持无菌环境,所有器具消毒处理。试验设置为3组,采集3月龄、8月龄的湖羊卵巢组织,进行3月龄湖羊卵巢组织与8月龄湖羊卵巢组织(h3 vs h8)差异的lncrna和mrna的鉴定,每个组安排3个生物学重复。
28.1.2样本rna的提取和质量检测
29.每个样品分别取出等量的卵巢组织用来提取rna,保证无菌环境,并将得到的所有rna在-80℃低温保存。
30.提取rna后,用nanodrop 2000紫外分光光度计对所提rna的纯度和浓度进行检测,在1.5%琼脂糖凝胶上监测rna降解和污染,尤其是dna污染,测定rna的完整性。使用bioanalyzer 2100检测样品rna的质量情况,测定rin值。建库测序的要求是rna总量不少于
steroidogenesis)、tgf-β信号通路、雌激素信号通路(estrogen signaling pathway)、mapk信号通路(mapk signaling pathway)、nf-κb信号通路(nf-kappa b signaling pathway)等通路中,每个通路对应的差异基因数目如图所示。
40.对3、8月龄湖羊卵巢中差异表达的mrna进行kegg富集分析,如图2所示,差异表达基因富集在细胞周期(cell cycle)、卵巢类固醇生成(ovarian steroidogenesis)、p53信号通路(p53signaling pathway)、孕酮介导的卵母细胞成熟(progesterone-mediated oocyte maturation)、vegf信号通路(vegf signaling pathway)等信号通路,其中富集在卵巢类固醇生成通路的显著性值q-value=0.0092,且有11个基因富集在此通路中。孕酮介导的卵母细胞成熟通路的q-value=0.019,14个基因富集在此通路。通过kegg分析,发现差异mrna富集在多个与卵母细胞成熟、类固醇激素生成等通路中。
41.组间差异表达lncrna靶基因预测:lncrna靶基因预测共有两种方式,一种是基于位置关系的cis靶基因预测,另一种是基于表达量关系的trans靶基因预测。lncrna能够调控其邻近基因的表达,主要根据lncrna和基因的位置预测,在lncrna基因组位置上下游100kb范围内的mrna预测为cis作用靶基因即顺式调控靶基因。通过分析lncrna和mrna的表达量是否具有相关性来确定lncrna靶向的远距离蛋白编码基因,即trans反式作用靶基因。采用pearson相关系数法分析样本间lncrna与mrna的相关性,以相关性绝对值|pcc|≥0.9和显著性p≤0.01为阈值筛选反式作用靶基因。
42.将差异mrna进行功能注释后,筛选出与卵巢发育相关通路的go条目,这些条目中对应的差异mrna即可能参与卵巢生长过程的调节,也是研究卵巢发育的关键基因。将差异表达lncrna的靶基因进行功能注释,并筛选差异lncrna对应的差异靶基因,两者均差异表达。结合差异mrna和差异lncrna靶基因功能注释结果,经过筛选发现几个与卵巢发育密切相关的基因差异表达。3月龄和8月龄差异表达基因参与减数分裂i、卵母细胞发育、卵子发生、胰岛素样生长因子结合等过程和胰岛素样生长因子受体信号通路、jak-stat信号通路等途径,并筛选到几个lncrna通过cis和trans调控作用靶向其中的一些基因,结果如图3所示。loc105610626及其调控的基因igfbp2成为我们的候选基因,他们参与了卵巢的成熟过程(3月到8月)。
43.实施例3 qrt-pcr检测验证
44.3.1测序结果的可靠性验证
45.本实验在两个组(h3vs h8)之间随机选择差异表达的lncrna和mrna进行pcr检测,每个基因3个重复,验证每个lncrna和mrna的表达趋势,主要方法如下:
46.反转录
47.将低温保存的rna样品取出,解冻后在pcr管中配置反转录体系。在体系中加入以下试剂:
48.rna样品
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.5μg
[0049]4×
gdna wiper mix
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2μl
[0050]
nuclease-free h2o
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5.5μl
[0051]
在42℃条件下反应2min,再加入5
×
hiscript ii q rt supermix iia,2μl,以上共10μl。设置反应条件为25℃10min,50℃30min,85℃5min,全部完成后低温-20℃保存备用。
[0052]
pcr反应设置
[0053]
pcr反应体系如下表,按步骤加入如下组分进行反应
[0054][0055]
表1 pcr体系中组分和体积
[0056][0057][0058]
pcr数据分析及结果
[0059]
利用2
‑△△
ct
法计算所有基因在各个样本间的相对表达量,数据表示为平均数
±
标准差(mean
±
sd),p《0.05表示该基因在两组间差异显著。结果表明,fst、inhba、inha、mstrg.123289.5显著下调,star、mstrg.77987.3在显著上调(图4)说明与测序结果一致,测序结果可靠。
[0060]
表2 3月龄和8月龄湖羊卵巢差异表达基因验证结果
[0061][0062]
3.2候选基因的验证
[0063]
本实验收集18只3月龄、18只8月龄的湖羊,在两个组(h3 vs h8)之间对差异表达的lncrna和mrna进行pcr检测,每个基因3个重复,验证loc105610626及其调控的基因igfbp2差异表达情况,实验步骤同3.1。
[0064]
pcr数据分析及结果,利用2
‑△△
ct
法计算loc105610626及基因igfbp2在各个样本间的相对表达量,数据表示为平均数
±
标准差(mean
±
sd),p《0.05表示该基因在两组间差异显著。结果表明,相对于3月龄组,igfbp2在8月龄组卵巢中显著下表达,loc105610626在8月龄中的表达量显著低于3月龄的表达。
[0065]
表3
[0066][0067]
igfbp2是igfbp家族一员,能抑制fsh诱导的颗粒细胞中雌激素的生成,减弱甚至抑制卵泡中igf的生物学效应和活性,从而阻止它们与特异性受体的相互作用。有研究表明在绵羊卵巢中,卵泡内igfbp2水平从1至2mm直径的卵泡显著降低,在闭锁卵泡中表达水平显著增加,因此igfbp2在卵泡发育过程中表达下降,igf作用力降低,呈现负调控卵泡发育的作用。本研究中8月龄卵巢中igfbp2水平与3月龄相比显著降低,loc105610626靶向igfbp2,表达趋势相同,因此lncrna可能通过作用于igfbp2调控卵泡的发育。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。