一种靶向抑制egfr的递送系统及其应用
技术领域
1.本技术涉及生物医学技术领域,特别涉及一种靶向抑制egfr的递送系统及其应用。
背景技术:
2.肺癌是发病率和死亡率最高、对人群健康和生命威胁最大的恶性肿瘤之一。近50年来许多国家都报道肺癌的发病率和死亡率均明显增高,男性肺癌发病率和死亡率均占所有恶性肿瘤的第一位,女性发病率占第二位,死亡率占第二位。针对肺癌开发特效靶向药对临床治疗意义重大。
3.表皮生长因子受体(egfr)是原癌基因c-erbb-1的表达产物,是一种跨膜蛋白,是表皮生长因子受体家族第1个成员。egfr蛋白的突变与大约50%的中晚期非小细胞肺癌密切相关,是一个非常有应用前景的肺癌治疗靶点。目前临床针对egfr突变型肺癌的治疗药物都是酪氨酸激酶抑制剂(tki),其作用方式以蛋白为靶点,在临床治疗中常常伴随着继发性耐药问题,无法彻底治愈egfr突变型肺癌。
4.目前,根据肺癌的基因型选择分子靶向药物的“个体化治疗”已成为临床上常用的治疗手段。而如何提高针对突变基因的疗效、减少毒副作用也已经是肺癌治疗研究的主要方向。随着研究的深入,新型靶向药物的开发和应用层出不穷,但大部分egfr-tki治疗有效的肺癌患者,9~14月后都会出现egfr-tki治疗耐药。尽管一些研究表明,联合治疗手段(如阿法替尼联合曲妥珠单抗(cetuxumab))能够对这些耐药型nsclc取得治疗效果,但是由于无法根本解决耐药性问题,且具有非常明显的副作用,大大限制了其临床应用潜力,成为了亟待解决的问题。
技术实现要素:
5.有鉴于此,本技术实施例提供了一种靶向抑制egfr的递送系统及其应用,以解决现有技术中存在的技术缺陷。
6.本技术的一个发明点为提供一种靶向抑制egfr的递送系统,所述递送系统包括:能够抑制egfr基因表达的rna和递送载体;
7.携带能够抑制egfr基因表达的rna的递送载体与靶向元件在哺乳动物的器官组织中自组装形成复合结构,所述复合结构通过所述靶向元件寻找并将能够抑制egfr基因表达的rna送入目标组织,抑制目标组织中egfr的表达。
8.进一步地,所述能够抑制egfr基因表达的rna包括:启动子元件以及能够抑制egfr基因表达的sirna、编码sirna中的至少一种。
9.进一步地,所述能够抑制egfr基因表达的sirna的核苷酸序列为:
[0010]5’‑
tgttgcttctgttaattcct-3’;
[0011]
所述能够抑制egfr基因表达的编码sirna正义链核苷酸序列为:
[0012]5’‑
ggatcctggaggcttgctgaaggctgtatgctgaattctgttgcttctcttaattcctgttttgg
ccactgactgacaggaattaagaagcaacaaccggtcaggacacaaggcctgttactagcactcacatggaacaaatggcccagatctggccgcactcgag-3’;
[0013]
所述能够抑制egfr基因表达的编码sirna反义链核苷酸序列为:
[0014]5’‑
ctcgagtgcggccagatctgggccatttgttccatgtgagtgctagtaacaggccttgtgtcctgaccggttgttgcttcttaattcctgtcagtcagtggccaaaacaggaattaagagaagcaacagaattcagcatacagccttcagcaagcctccaggatcc-3’。
[0015]
进一步地,所述复合结构为外泌体。
[0016]
进一步地,所述靶向元件包括一条、两条或多条靶向序列。
[0017]
进一步地,若所述靶向元件包括一条靶向序列,则所述靶向序列选自ge11序列;
[0018]
若所述靶向元件包括两条靶向序列,则所述靶向序列选自ge11序列和靶向性ptp1b sirna编码序列的组合。
[0019]
进一步地,所述靶向性ptp1b sirna编码序列选自seq id no:1。
[0020]
进一步地,所述递送载体选自质粒载体和病毒载体。
[0021]
进一步地,所述病毒载体包括逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体中的至少一种。
[0022]
本技术的另一个发明点为提供一种如上任意一段所述的靶向抑制egfr的递送系统在制备抗肿瘤产品中的应用。
[0023]
进一步地,所述抗肿瘤产品包括抑制癌细胞或阻止egfr基因表达的试剂、对肿瘤具有预防和/或治疗作用的药物。
[0024]
进一步地,所述肿瘤包括乳腺癌、肺癌、胃癌、肠癌、膀胱癌、卵巢癌中的至少一种。
[0025]
本技术的技术效果为:
[0026]
本技术提供的靶向抑制egfr的递送系统,其包括能够抑制egfr基因表达的rna和递送载体,递送载体携带能够抑制egfr基因表达的rna与靶向元件在哺乳动物的器官组织中自组装形成复合结构,所述复合结构通过所述靶向元件寻找并将能够抑制egfr基因表达的rna送入目标组织,抑制目标组织中egfr的表达。
[0027]
该递送系统以合成生物学元件为基础,利用哺乳动物自身器官作为天然生物反应器,将靶向元件与能够抑制egfr基因表达的rna在哺乳动物体内自组装为能够靶向治疗egfr突变型疾病的复合结构,并分泌至循环系统,并且该复合结构在靶向元件的作用下将rna定向运输到肿瘤细胞等急需治疗的细胞中,发挥治疗效果,治疗效率高、效果好,特别是对egfr突变型肺癌具有治疗效果极佳。
[0028]
本技术提供的靶向抑制egfr的递送系统借助了天然存在的分泌机制,因此能够避免采用其他载体造成的毒性。靶向元件能够高效的将rna递送到需要治疗的组织,递送效率高,几乎无副反应。
[0029]
本技术提供的靶向抑制egfr的递送系统基于质粒载体建立,易于工业化生产和大批量纯化,相对于其他sirna递送方式,大大降低了生产难度和生产成本。
[0030]
本技术提供的靶向抑制egfr的递送系统应用于抗肿瘤产品中,无毒无副作用,起效快,疗效好,适于大规模推广和使用。此外,还可以根据不同疾病治疗的需要,对靶向元件、靶向基因进行调整,以针对不同疾病提供个性化治疗。
附图说明
[0031]
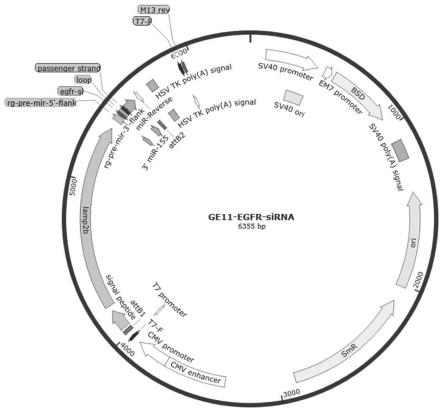
图1是本技术一实施例提供的质粒骨架图;
[0032]
图2是本技术一实施例提供的相关rna、蛋白表达水平对比图;
[0033]
图3是本技术一实施例提供的sirna在小鼠体内的代谢分布图;
[0034]
图4是本技术一实施例提供的不同递送系统对小鼠肺癌模型的治疗效果对比图;
[0035]
图5是本技术一实施例提供的小鼠肺组织病理分析及蛋白表达量检测图;
[0036]
图6是本技术一实施例提供的小鼠体内外泌体示踪图;
[0037]
图7是本技术一实施例提供的不同递送系统对小鼠肺癌模型的治疗效果对比图;
[0038]
图8是本技术一实施例提供的给药安全性对比图。
具体实施方式
[0039]
下面结合附图对本技术的具体实施方式进行描述。
[0040]
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的试剂、材料和操作步骤均为相应领域内广泛使用的试剂、材料和常规步骤。
[0041]
实施例1
[0042]
本实施例提供一种靶向抑制egfr的递送系统,所述递送系统包括:能够抑制egfr基因表达的rna和递送载体。
[0043]
携带能够抑制egfr基因表达的rna的递送载体与靶向元件在哺乳动物的器官组织中自组装形成复合结构,所述复合结构通过所述靶向元件寻找并将所需递送rna(能够抑制egfr基因表达的rna)送入目标组织,抑制目标组织中egfr的表达。
[0044]
具体地,递送载体携带能够抑制egfr基因表达的rna,且能够在哺乳动物的器官组织中富集,在所述哺乳动物器官组织中内源性地自发形成含有所上述rna和靶向元件的复合结构,该复合结构通过靶向元件寻找并结合目标组织,将所需递送rna送入目标组织,进而抑制抑制egfr的表达。
[0045]
其中,上述复合结构优选为外泌体,上述目标组织优选为发生egfr突变/具有egfr表达的癌细胞。
[0046]
能够抑制egfr基因表达的rna包括启动子元件以及能够抑制egfr基因表达的sirna、编码sirna中的至少一种。比如上述rna可以为启动子元件 能够抑制egfr基因表达的sirna,还可以为启动子元件 能够抑制egfr基因表达的编码sirna。
[0047]
其中,所述能够抑制egfr基因表达的sirna的核苷酸序列优选为:
[0048]5’‑
tgttgcttctgttaattcct-3’。
[0049]
所述能够抑制egfr基因表达的编码sirna正义链核苷酸序列为:
[0050]5’‑
ggatcctggaggcttgctgaaggctgtatgctgaattctgttgcttctcttaattcctgttttggccactgactgacaggaattaagaagcaacaaccggtcaggacacaaggcctgttactagcactcacatggaacaaatggcccagatctggccgcactcgag-3’;
[0051]
所述能够抑制egfr基因表达的编码sirna反义链核苷酸序列为:
[0052]5’‑
ctcgagtgcggccagatctgggccatttgttccatgtgagtgctagtaacaggccttgtgtcctgaccggttgttgcttcttaattcctgtcagtcagtggccaaaacaggaattaagagaagcaacagaattcagcatac
agccttcagcaagcctccaggatcc-3’。
[0053]
上述的sirna/编码sirna能够特异性的与egfr mrna结合并使之降解,进而起到抑制egfr表达的作用。
[0054]
所述靶向元件可以包括一条、两条或多条靶向序列。若所述靶向元件包括一条靶向序列,则所述靶向序列优选为ge11序列;若所述靶向元件包括两条靶向序列,则所述靶向序列优选为ge11序列和靶向性ptp1b sirna编码序列的组合。所述靶向性ptp1b sirna编码序列如seq id no:1所示。
[0055]
所述递送载体选自质粒载体和病毒载体。其中病毒载体包括逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体中的至少一种。
[0056]
递送载体优选为质粒载体,在递送载体为质粒载体的情况下,上述递送系统可以视为质粒分子。
[0057]
具体地,质粒携带能够抑制egfr基因表达的sirna,此质粒分子能够在哺乳动物的器官组织中富集,并与靶向元件ge11或ge11 编码ptp1b sirna在所述哺乳动物器官组织中内源性地自发形成外泌体,该外泌体通过靶向元件ge11或ge11 编码ptp1b sirna将sirna递送入发生egfr突变的细胞,进而抑制抑制egfr的表达。
[0058]
基于质粒载体形成的递送系统,更加易于大规模的工业化生产和纯化,相对于其他sirna递送系统,生产难度和生产成本得以大幅降低。
[0059]
在实际应用中,我们分别构建了针对egfr基因的递送系统(质粒分子),将启动子元件与能够抑制egfr基因表达的sirna串联,构建了sire并分别连入骨架载体,该ge11-sire质粒骨架结构如图1所示。
[0060]
按照图1所示方法构建不同干扰序列的质粒,将质粒分子转染人胚肾细胞293t细胞系中,36小时后利用qrt-pcr和western blotting实验检测细胞中egfr基因的mrna和蛋白质表达水平。在此我们设置mock对照组、nc对照组、sire试验组和ge11-sire试验组,结果如图2所示。
[0061]
图2a为四组相关egfr sirna表达水平对比图,从图2a中可看出mock对照组和nc对照组检测不出相关egfr sirna的表达,而其他两组中,ge11-sire试验组的相关egfr sirna表达水平高于sire试验组。
[0062]
图2b为四组相关ge11 mrna表达水平对比图,从图2b中可看出mock对照组、nc对照组和sire试验组均检测不出相关相关ge11 mrna的表达,仅有ge11-sire试验组存在ge11 mrna,且ge11靶向肽的表达水平较高。
[0063]
图2c为四组相关egfr mrna表达水平对比图,从图2c中可看出四组相关egfr mrna表达水平的排序为:nc对照组>mock对照组>sire试验组>ge11-sire试验组。
[0064]
图2d为能够表示四组egfr蛋白表达水平的western blot图,从图2d中可看出四组egfr蛋白表达水平的排序为:mock对照组>nc对照组>sire试验组>ge11-sire试验组。
[0065]
可见,图2的结果表明本技术提供的靶向抑制egfr的递送系统能够在细胞系中有效抑制egfr基因的表达。
[0066]
因此,本实施例提供的靶向抑制egfr的递送系统,以合成生物学元件为基础,利用哺乳动物自身器官作为天然生物反应器,将靶向元件与能够抑制egfr基因表达的rna在哺乳动物体内自组装为能够靶向治疗egfr突变型疾病的外泌体,并分泌至循环系统,并且该
外泌体在靶向元件的作用下将rna定向运输到肿瘤细胞等待治疗的细胞中,发挥治疗效果,治疗效果好,效率高。
[0067]
尤其是对于egfr突变型肺癌,此递送系统能够精准快速的将相关rna靶向运输至癌细胞内,抑制癌细胞内egfr的表达,进而起到抑制肿瘤的效果,效果极佳。
[0068]
实施例2
[0069]
在实施例1的基础上,本实施例提供一种靶向抑制egfr的递送系统在制备抗肿瘤产品中的应用。
[0070]
进一步地,所述抗肿瘤产品包括抑制癌细胞或阻止egfr基因表达的试剂、对肿瘤具有预防和/或治疗作用的药物。
[0071]
其中,本实施例的药物在包括上述递送系统的基础上,还可以包括药学上可以接受的载体,该载体包括但不限于稀释剂、缓冲剂、乳剂、包囊剂、赋形剂、填充剂、粘合剂、喷雾剂、透皮吸收剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、着色剂、矫味剂、佐剂、干燥剂、吸附载体等。
[0072]
本实施例提供的药物的剂型可以为片剂、胶囊剂、粉剂、颗粒剂、丸剂、栓剂、软膏剂、溶液剂、混悬剂、洗剂、凝胶剂、糊剂等。
[0073]
本实施例的药物对肿瘤及肿瘤相关疾病具有良好的治疗效果。肿瘤相关疾病可以是肿瘤形成过程/治疗过程中产生的疾病或肿瘤引起的并发症、后遗症等与肿瘤具有一定相关性的疾病。
[0074]
进一步地,所述肿瘤包括乳腺癌、肺癌、胃癌、肠癌、膀胱癌、卵巢癌中的至少一种。
[0075]
本实施例的药物还可以与其他具有抗肿瘤效果的治疗药物或治疗手段联合使用对抑郁症患者进行治疗,以提高治疗效果。
[0076]
比如,若肿瘤为乳腺癌,则可与紫杉醇、环磷酰胺、氟尿嘧啶、他莫昔芬、来曲唑、赫赛汀等药物联用;若肿瘤为肺癌,则可与易瑞沙、特罗凯等药物联用;若肿瘤为胃癌,则可与赫赛汀、阿帕替尼等药物联用;若肿瘤为肠癌,则可与爱必妥、表阿霉素、阿霉素、柔红霉素、丝裂霉素、氟脲嘧啶脱氧核等药物联用;若肿瘤为膀胱癌,则可与表阿霉素、阿霉素、吡柔比星、丝裂霉素、羟基喜树碱、吉西他滨、卡介苗、干扰素、白介素-2、吉西他滨、顺铂、紫杉醇、多西他赛等药物联用;若肿瘤为卵巢癌,则可与顺铂、卡铂、紫杉醇、环磷酰胺等药物联用。此外,在使用药物治疗的同时,还可以同时进行手术治疗、放射治疗等,以增强疗效。
[0077]
本技术提供的靶向抑制egfr的递送系统应用于抗肿瘤产品中,无毒无副作用,起效快,疗效好,适于大规模推广和使用。
[0078]
试验例1
[0079]
本试验例设置sire试验组、ge11-sire试验组和scrr试验组。上述三个试验组分别将表达sirna的基因环路(sire、ge11-sire和scrr)按照10mg/kg的剂量对相同数量的正常小鼠进行尾静脉注射。
[0080]
分别在注射1、3、6、9、12、24、48小时后,在每组中随机选取一只小鼠,取其血清检测sirna表达量,结果如图3a所示。在图3a中可以看出,sire试验组、ge11-sire试验组和scrr试验组小鼠在注射sire、ge11-sire和scrr后,其血清sirna表达无甚差异。
[0081]
在注射9小时后,每组中随机选取一只小鼠处死,并取小鼠肺组织检测sirna水平,结果如图3b所示。从图3b中可以看出,scrr试验组小鼠的肺组织中未检测到相关sirna,
ge11-sire试验组小鼠的肺组织中sirna的表达量远高于sire试验组。
[0082]
上述结果表明,在向小鼠体内注射能够表达sirna的基因环路(sire、ge11-sire和scrr)后,小鼠血清中能检测到sirna,且主要以外泌体包裹的形式存在,注射后9小时血清sirna浓度达到峰值。而加装ge11靶向元件的基因环路(ge11-sire),能够使小鼠肺组织sirna表达水平明显上升。
[0083]
试验例2
[0084]
为了进一步确认靶向抑制egfr的递送系统在体内的治疗效果,我们利用b6/jgpt-h11
em1cin(cag-lsl-egfr-(exon19 del))
/gpt转基因肺癌小鼠模型作为实验对象(dox诱导30天后,肺部会自发产生肿瘤),确认ge11-sire递送系统对肺部肿瘤的治疗效果。
[0085]
我们将造模成功的小鼠随机分为4组——pbs组、scrr组、sire组、ge11-sire组,分别按照10mg/kg的剂量注射pbs对照质粒、scrr质粒、sire质粒、ge11-sire质粒进行治疗。每两天给药一次,共治疗10次,为期20天。治疗前后分别利用ct成像的方式检测肺部肿瘤变化情况,并统计小鼠的生存情况。
[0086]
如图4所示,图4a为治疗前后小鼠肺部肿瘤ct对比图,图4b为治疗前后小鼠肺部肿瘤体积变化对比图(图4b中,“pre”表示治疗前,“post”表示治疗后)。结果表明,在治疗前后,注射ge11-sire质粒的小鼠肺部肿瘤体积明显减小,注射sire质粒的小鼠肺部肿瘤体积增长缓慢,而pbs以及scrr两组小鼠肿瘤体积明显增大。
[0087]
对治疗后的四组小鼠的肺组织进行he染色、ihc-egfr/pakt/perk以及蛋白表达量分析检测,结果如图5所示。图5a为四组小鼠he染色结果对比图,可以看出ge11-sire组小鼠肺组织情况最好。图5b和图5c是小鼠egfr蛋白表达量检测及统计分析对比图,可以看出,pbs组小鼠和scrr组小鼠的egfr蛋白表达水平最高,其次为sire组,此组小鼠egfr蛋白表达水平较低,ge11-sire组小鼠egfr蛋白表达水平最低,与正常小鼠相当。图5d是四组小鼠egfr、磷酸化akt、磷酸化erk的免疫组化结果,可见,唯有ge11-sire组小鼠的情况最好。上述结果进一步证实了ge11-sire治疗组的良好治疗效果。
[0088]
试验例3
[0089]
本试验例分别将pkh26染色后的外泌体sire、ge11-sire注射至野生型小鼠和egfr过表达的小鼠体内,再取小鼠肺组织进行冰冻切片,检测荧光信号。结果如图6所示,从图6中可以看出,ge11改造后的外泌体ge11-sire相对于未加入靶向元件的外泌体sire而言,能够更高效的传输至egfr高表达的肺组织。
[0090]
试验例4
[0091]
本试验例研究ge11-sire质粒对b6/jgpt-h11
em1cin(cag-lsl-egfr(t790m l858r))
/g pt转基因肺癌小鼠模型(dox诱导60天后,肺部会自发产生肿瘤)的治疗效果,验证ge11-sire递送系统对耐药性突变型小鼠肺癌的治疗效果。
[0092]
我们利用ct成像验证该转基因小鼠造模成功后,将小鼠随机分为4组——pbs组、scrr组、sire组、ge11-sire组,分别按照10mg/kg的剂量注射pbs、scrr和ge11-sire递送系统(质粒)。每两天给药一次,共治疗20天,治疗前后分别利用ct成像的方式检测肺部肿瘤变化情况,并统计小鼠的生存情况。
[0093]
如图7所示,图7a为治疗前后小鼠肺部肿瘤ct对比图,图7b为治疗前后小鼠肺部肿瘤体积变化对比图(图7b中,“pre”表示治疗前,“post”表示治疗后)。结果表明,在治疗前
后,注射ge11-sire质粒的小鼠肺部肿瘤体积明显减小,注射sire质粒和scrr质粒的小鼠肺部肿瘤体积均有部分增长,而pbs组小鼠肿瘤体积明显增大。
[0094]
为了检测该治疗手段的安全性,对pbs组、sire组、ge11-sire组小鼠血清中谷丙转氨酶、谷草转氨酶、总胆红素、尿素、碱性磷酸酶和肌酐等生化指标的水平进行检测。结果如图8所示,图8a为各组小鼠血清中谷丙转氨酶(alt)、谷草转氨酶(ast)、总胆红素(tbil)、总尿素氮(bun)、血清碱性磷酸酶(alp)、肌酐(crea)的含量对比图,注射sire、ge11-sire质粒分子的小鼠上述指标与对照组没有明显差异;图8b为各组小鼠的组织结构染色图。可见,对小鼠的肝、肺、肾、脾的切片表明尾静脉注射sire、ge11-sire质粒不会造成组织损伤,是一种安全的给药方式。
[0095]
在本文中,“上”、“下”、“前”、“后”、“左”、“右”等仅用于表示相关部分之间的相对位置关系,而非限定这些相关部分的绝对位置。
[0096]
在本文中,“第一”、“第二”等仅用于彼此的区分,而非表示重要程度及顺序、以及互为存在的前提等。
[0097]
在本文中,“相等”、“相同”等并非严格的数学和/或几何学意义上的限制,还包含本领域技术人员可以理解的且制造或使用等允许的误差。
[0098]
除非另有说明,本文中的数值范围不仅包括其两个端点内的整个范围,也包括含于其中的若干子范围。
[0099]
上面结合附图对本技术优选的具体实施方式和实施例作了详细说明,但是本技术并不限于上述实施方式和实施例,在本领域技术人员所具备的知识范围内,还可以在不脱离本技术构思的前提下做出各种变化。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。