1.本发明属于医药技术领域,特别涉及一种磷脂双分子层内侧或磷脂双分子层外侧、或者磷脂双分子层内侧和外侧同时修饰有修饰物的膜融合脂质体及其在细胞膜修饰上的应用。
背景技术:
2.细胞的膜结构主要是由磷脂构成的富有弹性的半透性膜,膜厚7~8nm,对于动物细胞来说,磷脂双分子层外侧与外界环境相接触。其主要功能是选择性地交换物质,吸收营养物质,排出代谢废物,分泌与运输蛋白质。因为分隔了水相和疏水相的界面,细胞与周围环境发生的必要信息、物质与能量的交换,以及生理功能的实现都需要通过细胞膜结构完成。因此,通过对细胞膜结构的功能化修饰,对于引导细胞行为,以及细胞功能的研究具有重要意义。功能化dna序列结构同时基于dna的探针具有识别核酸和非核酸靶标的能力,易于合成和化学修饰,易于与信号放大方案接口,以及固有的生物相容性,以此为基础可以构建生物测量的多功能平台,是一种理想的功能化修饰工具。传统的细胞膜修饰方法依靠的是化学接枝或者直接疏水端插入的方法,化学接枝细胞毒性较大,而直接疏水端插入效率较低,室温及体温环境下同时伴有大量的dna内吞进入细胞质情况。通过设计引入膜融合脂质体并将带有疏水末端的dna序列负载在脂质体上。借助脂质体与细胞膜的电性吸引,将dna序列带到细胞膜结构上,并通过脂质体膜与细胞膜结构的融合,使得dna序列更有效的锚定在细胞膜结构的表面,在保持dna结构与功能的基础之上,同时还能将dna序列结合在细胞磷脂双分子层内侧磷脂双分子层内侧侧膜结构上。将dna序列与膜融合脂质体相结合,使得用于细胞内外膜结构上的分子运输、流动催化、能量传导检测等应用成为可能。
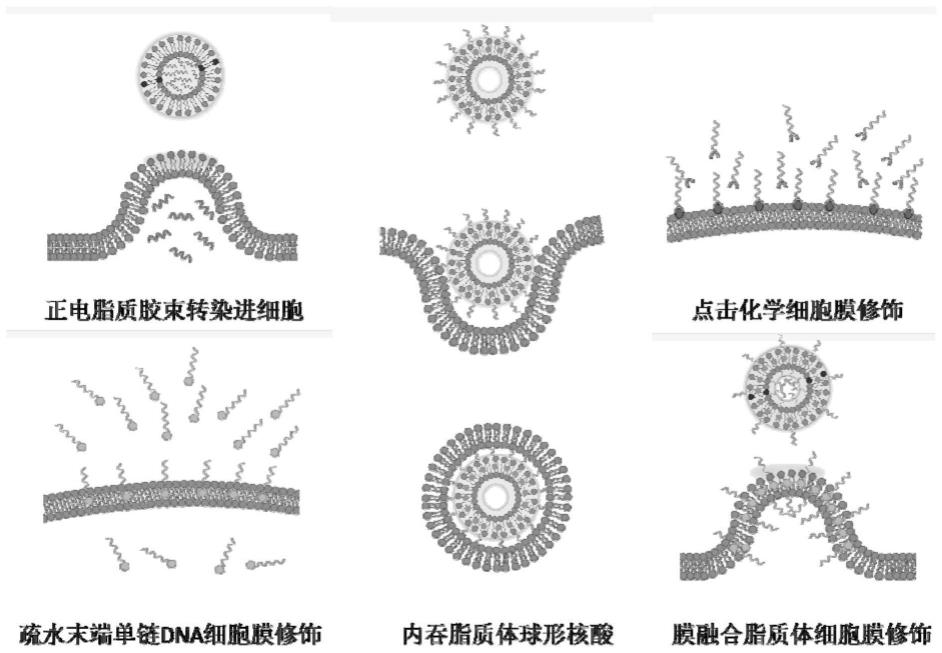
3.当前已报道的负载有dna的脂质体有以下几种,如图1所示,1)基于正电脂质,能与细胞膜相互吸引并融合,但是与dna作用弱,主要是将dna序列转染进入细胞磷脂双分子层内侧磷脂双分子层内侧部的,转染试剂类的脂质胶束;2)基于dna疏水末端与脂质体之间的强相互作用,以及dna与细胞之间的亲和作用,引导脂质体内吞进细胞的脂质体球形核酸sna(spherical nucleic acid);3)通过细胞表面糖代谢,修饰上带有叠氮基团的糖蛋白并与末端修饰有dbco的dna序列通过点击化学反应,从而将dna序列接枝到细胞膜表面的点击化学方法,这种方法步骤繁琐,且在过程中容易产生化学毒性伤害细胞。4)将dna末端进行疏水修饰并直接将其与细胞进行孵育,从而借助疏水末端直接将dna序列插入到细胞膜表面,这种方法室温下效率较低,需要高工作浓度的dna环境,同时在锚定在细胞表面的同时细胞会大量内吞dna序列进入细胞质中,特异性较差。
4.由于现有的技术要么无法控制dna序列可控的锚定在细胞上,单纯的通过脂质体将dna与细胞结合,dna递送不对细胞膜具有选择性;要么借助化学反应接枝,步骤繁琐且具有细胞毒性;要么简单将带有疏水末端的dna序列与细胞混合,室温下效率较低,需要高工作浓度的dna环境,同时在锚定在细胞表面的同时细胞会大量内吞dna序列进入细胞质中,特异性较差;且以上方法都无法将dna序列高效率、高选择性修饰到细胞膜的内膜结构上。
技术实现要素:
5.本发明的目的在于通过设计合成与细胞膜比例类似的含有正电的膜融合脂质体,与带有疏水末端的dna序列相结合,实现将dna锚定在细胞膜结构内表面、外表面或者同时内外表面的同时,保证dna功能和性质不发生改变,生物相容性合适,室温下可操作,膜融合效率可调性。
6.为了实现上述发明目的,本发明提供以下技术方案:一种膜融合脂质体,所述膜融合脂质体的磷脂双分子层内侧或者磷脂双分子层外侧修饰有修饰物,或者磷脂双分子层内侧和外侧同时修饰有修饰物,所述修饰物为含有疏水端基的修饰物;所述含有疏水端基的修饰物为含有疏水端基的dna序列、含有疏水结构的蛋白、含有疏水端的催化剂或者其混合物。
7.优选的,上述磷脂双分子层外侧修饰有修饰物的膜融合脂质体的制备方法,包括以下步骤:将饱和磷脂、不饱和磷脂、正电磷脂、胆固醇混合,形成混合脂质,孵育,挤压得到膜融合脂质体,在形成的脂质体中加入修饰物,二次孵育,得到磷脂双分子层外侧修饰有修饰物的膜融合脂质体;所述修饰物为含有疏水端基的修饰物;所述含有疏水端基的修饰物为含有疏水端基的dna序列、含有疏水结构的蛋白、含有疏水端的催化剂或者其混合物。
8.优选的,含有疏水端基的修饰物为含有疏水端基的dna序列。
9.优选的,所述孵育温度为45-55℃。
10.优选的,所述二次孵育温度为37℃。
11.优选的,膜融合脂质体通过聚碳酸酯薄膜反复挤压得到。
12.优选的,二次孵育之后,利用尺寸排阻色谱去除去多余的修饰物,再得到磷脂双分子层外侧修饰有修饰物的膜融合脂质体。
13.优选的,上述磷脂双分子层内侧磷脂双分子层内侧和外侧同时修饰有修饰物的膜融合脂质体的制备方法,包括以下步骤:将饱和磷脂、不饱和磷脂、正电磷脂、胆固醇混合,形成混合脂质,孵育,得到脂质,在形成的脂质中加入修饰物,二次孵育,得到磷脂双分子层内侧磷脂双分子层内侧和磷脂双分子层外侧同时修饰有修饰物的膜融合脂质体;所述修饰物为含有疏水端基的修饰物;所述含有疏水端基的修饰物为含有疏水端基的dna序列、含有疏水结构的蛋白、含有疏水端的催化剂或者其混合物。
14.优选的,上述磷脂双分子层内侧修饰有修饰物的膜融合脂质体的制备方法,包括以下步骤:将饱和磷脂、不饱和磷脂、正电磷脂、胆固醇混合,形成混合脂质,孵育,得到脂质,在形成的脂质中加入修饰物,二次孵育,然后使用试剂去掉磷脂双分子层外侧的修饰物,从而得到磷脂双分子层内侧修饰有修饰物的膜融合脂质体。
15.所述修饰物为含有疏水端基的修饰物;
所述含有疏水端基的修饰物为含有疏水端基的dna序列、含有疏水结构的蛋白、含有疏水端的催化剂或者其混合物。
16.优选的,混合脂质中,按摩尔比计,饱和磷脂占混合脂质不超过50%。
17.饱和磷脂可以起到保持脂质体尺寸结构稳定不易融合成更大的脂质体,过多的饱和磷脂会使得脂质体刚性过强,从而内吞进入细胞中,影响脂质体膜融合效率。
18.优选的,混合脂质中,按摩尔比计,不饱和磷脂占混合脂质不超过50%。
19.不饱和脂质体起到增强脂质体的流动性,并且为修饰物在脂质体膜结构中的插入留下缝隙,从而更好的将修饰物的疏水端插入脂质体膜中,但过多的不饱和脂质体会影响脂质体对现有尺寸结构的保持,在融合在细胞膜之前就融合成更大的脂质体,从而使融合不顺利。
20.优选的,混合脂质中,按摩尔比计,胆固醇占混合脂质不超过60%。
21.胆固醇是构成细胞膜的重要组成成分,细胞膜包围在人体每一细胞外,胆固醇为它的基本组成成分,占质膜脂类的20%以上。胆固醇可以起到增强脂质体膜结构的流动性的作用,温度高时,胆固醇能阻止双分子层的无序化;温度低时又可干扰其有序化,阻止液晶的形成,保持其流动性,促进不同饱和度的脂质形成稳定的脂质体结构。但是过多的胆固醇将影响脂质体双层磷脂膜结构的形成。
22.优选的,混合脂质中,按摩尔比计,正电磷脂占混合脂质不超过20%。
23.进一步优选的,混合脂质中,按摩尔比计,正电磷脂占混合脂质为5%。
24.由于细胞膜表面呈现负电性,正电脂质体起到促进膜融合脂质体与细胞膜结合并融合的作用,但是过高的正电含量会破坏细胞膜的稳定性,从而降低细胞活性。甚至产生细胞毒性杀死细胞。
25.优选的,混合脂质中,按摩尔比计,饱和磷脂、不饱和磷脂、胆固醇、正电脂质为1: 1:1:2:0.25。
26.综合每种脂质的特性以及实验筛选,饱和磷脂、不饱和磷脂、胆固醇、正电脂质为1: 1:1:2:0.25效果最优。
27.优选的,所述饱和磷脂为1,2-双十六酰基-sn-甘油-3-磷酰胆碱(dppc)、1,2-二棕榈酰基-sn-丙三基-3-磷酸乙醇胺(dppe)、二硬脂酰基磷脂酰乙醇胺(dspe)中的一种或者几种。
28.优选的,所述饱和磷脂为1,2-双十六酰基-sn-甘油-3-磷酰胆碱(dppc)。
29.优选的,所述不饱和磷脂为2-二-(9z-十八烯酰基)-sn-甘油-3-磷酸胆碱(dopc1)、1,2-二-(9z,12z-十八碳二烯酰基)-sn-甘油-3-磷酸胆碱(dlpc)、二油酰磷脂酰乙醇胺(dope)。
30.优选的,所述不饱和磷脂为2-二-(9z-十八烯酰基)-sn-甘油-3-磷酸胆碱(dopc1)。
31.优选的,所述正电磷脂为(2,3-二油酰基-丙基)-三甲基氯化铵(dotap),dotma(氯化三甲基-2, 3-二油烯氧基丙基铵),dc-chol(3β-[n-(n’,n
’‑
二甲基胺乙基)胺基甲酰基]胆固醇)。
[0032]
优选的,所述正电磷脂为(2,3-二油酰基-丙基)-三甲基氯化铵(dotap)。
[0033]
优选的,所述挤压为通50nm-500nm孔径的聚碳酸酯薄膜,来回挤压数次得到尺寸
均一的膜融合脂质体。
[0034]
优选的,所述挤压为通200nm孔径的聚碳酸酯薄膜。
[0035]
过小的尺寸孔径挤出的脂质体内吞作用强烈影响膜融合效率,过大尺寸的脂质体,难以维持单室球形结构容易崩塌影响膜融合效率。
[0036]
优选的,修饰物的加入与脂质的摩尔比约为1:100-100000。
[0037]
进一步优选的,修饰物的加入与脂质的摩尔比约为1:10000。
[0038]
过高的修饰物的加入无法完全插入到脂质体膜上,同时也会掩蔽正电脂质对细胞膜的吸附作用,而过低的修饰物加入会使得单位脂质体膜上无法分配到足够修饰物,从而影响修饰物发挥作用与功能。
[0039]
优选的,含有疏水端基的修饰物为含有疏水端基的dna时,使用dnase i 酶在mg离子存在下切可以除脂质体磷脂双分子层外侧的dna。
[0040]
优选的,含有疏水端基的修饰物为含有疏水端基的dna时,使得外膜上这段dna序列失去原有功能的其他方法也可以,如加入互补配对的dna序列。
[0041]
优选的,含有疏水结构的蛋白可通过特定的蛋白酶水解,或特定金属离子使得磷脂双分子层外侧的蛋白失去活性。
[0042]
优选的,含有疏水端的催化剂可以使用特定的螯合剂如edta等,使得磷脂双分子层外侧的催化剂成分被中和或者钝化。
[0043]
优选的,含有疏水端基的dna为带胆固醇或dspe端基的dna。
[0044]
胆固醇端基dna商用成熟可直接购买。
[0045]
优选的,带dspe端基的dna的制备方法包括:将带有叠氮的dspe(二硬脂酰基磷脂酰乙醇胺)脂质与带有dbco(聚乙二醇马来酰亚胺)的dna序列混合,加入溶液,反应过夜,除杂,得到带dspe端基的dna溶液。
[0046]
优选的,带有叠氮的dspe(二硬脂酰基磷脂酰乙醇胺)脂质与带有dbco(聚乙二醇马来酰亚胺)的dna序列的质量比为1:3。
[0047]
点击化学反应一般dbco基团和叠氮基团1:1反应,过量加入含有dbco基团的dna序列可以使得dspe上的叠氮都接上dna。且带有叠氮的dspe成本一般极高,这样可以降低成本。
[0048]
优选的,除杂为通过氯仿和水混合萃取除杂。
[0049]
优选的,所述含有疏水端基的dna携带atp响应荧光dna序列。
[0050]
本发明还提供了所述膜融合脂质体在修饰细胞膜上的应用,步骤包括,将所述膜融合脂质体与细胞混合,37下孵育15-300min。
[0051]
优选的,所述磷脂双分子层内侧或者磷脂双分子层外侧修饰有修饰物的膜融合脂质体会分别将修饰物修饰到细胞膜的磷脂双分子层内侧或者磷脂双分子层外侧。
[0052]
优选的,所述磷脂双分子层内侧和磷脂双分子层外侧同时修饰有修饰物的膜融合脂质体会将修饰物同时修饰到细胞膜的磷脂双分子层内侧和磷脂双分子层外侧。
[0053]
本发明还提供了一种组装细胞的方法,将上述外膜或者内外膜同时修饰有dna序列的膜融合脂质体、需要组装的细胞、互补dna序列共孵育,得到组装好的细胞。
[0054]
优选的,所述dna序列如seq id no.1所示,seq id no.1:5'-gtcagtcagttttttttttt-chol-3'。
[0055]
优选的,互补dna为2条。
[0056]
互补dna也可以为多条,只要不同的细胞接上互补dna中的一条,然后与其他的dna进行互补连接。
[0057]
优选的,互补dna中其中一条序列为actgactgacttttttttttttttttttttttttttttttttttttttttttggttgg-3'(seq id no.2)。
[0058]
优选的,互补dna中另一条为actgactgacttttttttttttttttttttttttttttttttttttttttccaaccaa-3'(seq id no.3)。
[0059]
序列ii (seq id no.3)与锚定在细胞膜上的序列seq id no.1互补配对并暴露出粘性末端,同样,序列i(seq id no.2)与锚定在细胞膜上的序列seq id no.1互补配对并暴露出另一个粘性末端,利用两个粘性末端互补配对使不同的细胞形成细胞组装体结构。
[0060]
优选的,一种组装细胞的方法,还可以是,将上述外膜或者内外膜同时修饰有其中一条或几条互补dna序列的膜融合脂质体与需要组装的细胞孵育,得到外膜修饰有其中一条或几条互补dna序列的细胞;然后将外膜或者内外膜同时修饰有其他互补dna序列的膜融合脂质体与其余的细胞共孵育,得到外膜修饰有其他互补dna序列的另一组细胞,然后将两组细胞共孵育,得到组装好的细胞。
[0061]
本发明还提供了上述内膜或者内外膜同时修饰有dna序列的膜融合脂质体在制备检测atp的试剂中的应用。
[0062]
本发明还提供了上述修饰有催化剂的膜融合脂质体在细胞内催化反应中的应用。
[0063]
优选的,细胞内催化反应为原位合成、蛋白质修饰、本发明还提供了上述修饰有蛋白的膜融合脂质体在制备检测细胞内小分子的试剂中的应用。
[0064]
优选的,所述细胞内小分子为乳酸。
[0065]
下面对本发明做进一步的解释:利用dna序列的疏水末端与脂质体膜之间的相互作用实现dna序列在脂质体上的锚定;利用与细胞膜接近的脂质成分dopc,dppc,胆固醇制备脂质体便于与细胞膜融合,提高生物相容性;利用带有正电的脂质dotap加入脂质体中使得脂质体能更好的与带有负电的细胞膜接触并实现膜融合;通过脂质体将带有疏水末端的dna序列封装成一个整体,并通过脂质体与细胞膜融合的过程,将dna序列锚定在细胞膜表面,从而避免了胞吞造成的dna序列进入细胞;借助脂质体的双层膜结构,预先将dna序列锚定在脂质体磷脂双分子层内侧侧,可以在脂质体膜融合的过程中实现将dna序列锚定在细胞磷脂双分子层内侧侧表面。
[0066]
与现有技术相比,本发明的创新性为:1、本发明制备的膜融合脂质体具有和细胞膜相同的双层膜结构,可以灵活的将修饰物序列可控的选择性的修饰到到细胞磷脂双分子层外侧膜或者内膜结构表面。
[0067]
2、本发明制备的膜融合脂质体为组装细胞和制备人工组织领域提供了一种新的思路。
[0068]
3、本发明制备的膜融合脂质体为细胞内催化反应、制备检测细胞内小分子的试剂提供了一种新的思路。
附图说明
[0069]
图1现有的正电脂质胶束转染细胞,内吞脂质体球形核酸,点击化学细胞膜修饰方法, dna疏水端插入细胞膜修饰方法,以及本发明的膜融合脂质体dna细胞膜修饰方法示意图。
[0070]
图2为本发明的膜融合脂质体的所使用的脂质结构;图3为本发明中疏水末端dna以及膜融合脂质体的制备方法示意图;图4为膜融合脂质体的透射电子显微镜及原子力显微镜图像;图5为膜融合脂质体的动态光散射dls的结果和zeta电位的表征结果;图6为内外膜同时修饰有dna序列的膜融合脂质体示意图;图7为外膜同时修饰有dna序列的膜融合脂质体示意图;图8为内膜同时修饰有dna序列的膜融合脂质体示意图;图9为通过互补配对荧光序列检测dna序列插入在细胞膜表面示意图;图10为通过膜融合脂质体检测细胞内atp的示意图;图11为通过dnase i酶切证明膜融合脂质体将荧光dna序列接到细胞磷脂双分子层内侧侧示意图;图12为带有荧光dna序列的膜融合脂质体与细胞膜融合并将荧光dna序列带到细胞膜上(左),通过dnase i酶切除磷脂双分子层外侧dna序列(右),比例尺寸10μm;图13为通过atp荧光探针序列检测细胞膜上atp分子,通过膜融合脂质体将内外膜上都修饰有atp荧光探针序列的脂质体与细胞膜融合的细胞膜荧光照片(a),通过膜融合脂质体将细胞膜荧光序列融合脂质体与hela细胞孵育,然后用dnase i处理依然可以观察到绿色荧光(b),游离疏水寡核苷酸荧光孵育hela细胞可以少量的观察到细胞磷脂双分子层外侧的atp(c),游离疏水寡核苷酸荧光孵育hela细胞,然后用dnase i处理无法观察到荧光(d),比例尺寸20μm。
[0071]
图14为通过膜融合脂质体将带有荧光dna序列修饰到细胞膜上,通过膜融合脂质体将内外膜上都修饰有荧光dna序列的脂质体与细胞膜融合的细胞膜荧光照片(a);通过膜融合脂质体将细胞膜荧光序列融合脂质体与hela细胞孵育,然后用dnase i处理依然可以观察到红色荧光说明在细胞磷脂双分子层内侧膜上修饰有荧光dna序列(b);游离的疏水寡核苷酸荧光孵育hela细胞可以观察到部分序列插入在细胞膜上并伴有部分序列内吞(c);游离疏水寡核苷酸荧光孵育hela细胞,然后用dnase i处理无法观察到荧光(d),比例尺寸20μm。
[0072]
图15为随着doatp含量增加膜融合效率以及细胞活性的变化。
[0073]
图16为通过融合在细胞膜上的dna序列互补配对将两种细胞组装在一起,huvecs细胞(红)与cem细胞(绿)组装在一起(上),非互补配对dna序列对照组没有形成组装体,比例尺寸20μm。
[0074]
图17为图16 huvecs细胞与cem细胞组装示意图。
[0075]
图18为cem细胞与huvecs细胞形成的组装体显著提高了huvecs细胞的mmp-2分泌水平。
[0076]
图19为内外不对称荧光dna修饰的细胞的共聚焦荧光成像结果。
具体实施方式
[0077]
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0078]
相关技术术语的名词解释脂质体(liposome)是一种人工膜。在水中磷脂分子亲水头部插入水中,脂质体疏水尾部伸向空气,搅动后形成双层脂分子的球形脂质体,直径25~1000nm不等。脂质体可用于转基因,或制备的药物,利用脂质体可以和细胞膜融合的特点,将药物送入细胞内部生物学定义:当两性分子如磷脂和鞘脂分散于水相时,分子的疏水尾部倾向于聚集在一起,避开水相,而亲水头部暴露在水相,形成具有双分子层结构的的封闭囊泡,称为脂质体。药剂学定义脂质体 (liposome): 系指将药物包封于类脂质双分子层内而形成的微型泡囊体。
[0079]
dbco: 二苯并环辛炔酸,酸官能化的环辛炔衍生物。环辛炔可用于应变促进的无铜叠氮化物-炔烃点击化学反应。该氮杂二苯并环辛炔可与叠氮官能化化合物或生物分子发生反应,而不需要cu(i) 催化剂以产生稳定的三唑键。
[0080]
dls:动态光散射,用于粒径测量。
[0081]
zeta电位:zeta电位(zeta potential)是指剪切面(shear plane)的电位,又叫电动电位或电动电势(ζ-电位或ζ-电势),是表征胶体分散系稳定性的重要指标。
[0082]
dopc: 1,2-二油酰-sn-甘油-3-磷酸胆碱。常用于制备脂质囊泡。
[0083]
dppc: 1,2-双十六酰基-sn-甘油-3-磷酰胆碱。常用于制备脂质囊泡。
[0084]
dotap: 1,2-二烯烃-3-三甲胺-丙烷)是一种阳离子脂质结构,用于体内外核酸和蛋白质的递送。
[0085]
atp: 腺苷三磷酸(atp adenosine triphosphate)是由腺嘌呤、核糖和3个磷酸基团连接而成,水解时释放出能量较多,是生物体内最直接的能量来源。
[0086]
核酸适配体: 核酸适配体是一小段经体外筛选得到的寡核苷酸序列或者短的多肽,能与相应的配体进行高亲和力和强特异性的结合,它的出现为化学生物学界和生物医学界提供了一种新的高效快速识别的研究平台,并在许多方面展示了良好的应用前景。
[0087]
dnase i酶: 脱氧核糖核酸酶即是dna酶,用于从蛋白样品中去除dna。
[0088]
hela细胞: 海拉细胞系是源自一位美国妇女海瑞塔
‧
拉克斯(henrietta lacks)的宫颈癌细胞的细胞系。一位外科医生从她的肿瘤上取下组织样本,并在实验室中进行培养,至今仍被不间断的培养。
[0089]
huvecs细胞: 人脐静脉内皮细胞(英human umbilical vein endothelial cells,huvec)在进行血管内皮细胞实验时,通常选用的细胞模型为人脐静脉内皮细胞(human umbilical vein endothelial cells,简称huvecs)。
[0090]
cem细胞: 人急性淋巴白血病细胞。
[0091]
vegf: 血管内皮生长因子(vascular endothelial growth factor ,vegf)。
[0092]
mmp-2: 基质金属蛋白酶(matrix metalloproteinase)ii。
[0093]
实施例1磷脂双分子层外侧修饰有dna的膜融合脂质体实现细胞膜的磷脂双分子层外侧侧
dna修饰1)末端疏水的dna序列合成:如图3所示,将带有叠氮的dspe(二硬脂酰基磷脂酰乙醇胺)脂质与带有dbco(聚乙二醇马来酰亚胺)的dna序列以1:3的物质的量比例置于ep管中,加入适量的水和乙醇的1:1混合溶液,70℃下反应过夜,粗产物通过氯仿和水混合萃取除去多余的杂质,收集dna序列在氯仿中的溶液。
[0094]
2)混合脂质的制备:dppc(二棕榈酰磷脂酰胆碱)(4.8mg, 24%)溶解于100 μl 氯仿溶液中,dopc(二油酰基卵磷脂)(5.1mg,24%)溶解于100 μl 氯仿溶液中,dotap((2,3-二油酰基-丙基)-三甲胺)(0.9mg,5%)溶解于100 μl 氯仿溶液中,胆固醇(5mg,47%)溶解于100 μl 氯仿溶液中氯仿溶液中混合溶液转移到2毫升石英玻璃小瓶内。过夜通风蒸发溶剂后,在瓶底形成脂质薄膜,放入真空干燥箱中进一步去除剩余氯仿,-20℃保存。
[0095]
3)制备膜融合脂质体:将制备好的混合脂质膜,于磷酸缓冲溶液pbs中45℃孵育1小时。如图3所示,超声分散后,通过200nm孔径的聚碳酸酯薄膜,来回挤压11次可以得到尺寸均一的膜融合脂质体, 加入10nmol的含有疏水末端的dna序列,并于37℃中继续孵育过夜。充分混合均匀后,通过尺寸排阻色谱去除未附着在脂质体上的dna序列,得到外膜修饰有dna序列的膜融合脂质体,制备过程如图2所示。制备的外膜修饰有dna序列的膜融合脂质体结构如图7所示。对外膜修饰有dna序列的膜融合脂质体进行透射电子显微镜及原子力显微镜检测,结果如图4所示。结果显示:透射电镜图像显示,脂质体的直径约为500 nm左右为球形, afm图像显示脂质体的高度约为12.5 nm。颗粒高度在z轴上的减少可能是由于脂质体在干燥过程中平铺在基质上。200-600nm的尺寸保持了较低的表面能,同时在缓冲液中保持分散,因此在环境中可以长时间保持形状,而不是进一步融合成更大的脂质体。
[0096]
对外膜修饰有dna序列的膜融合脂质体进行动态光散射dls和zeta电位的表征,如图5所示,结果显示:动态光散射(dls)进一步证实了膜融合脂质体的水合粒径约为496.0
±
71.8nm。zeta电位的结果表明与传统带有dna序列的内吞脂质体带有-24mv的负电性不同的是膜融合脂质体表现出 26mv的正电性,与含有dotap的无修饰膜融合脂质体(约 55 mv)相比,所修饰的dna序列降低了脂质体的总体正电性。适当的正电性有助于脂质体于带有负电荷的细胞膜相互吸引并最终膜融合在一起。
[0097]
4)修饰细胞膜:将外膜修饰有dna序列的膜融合脂质体(0.1μm)与hela细胞在37℃下共孵育2小时,磷酸盐缓冲溶液(pbs)冲洗数次,更换培养基,如图9所示,加入与修饰dna序列互补配对的荧光dna序列(1μm)孵育30分钟,去除培养基,磷酸盐缓冲溶液(pbs)冲洗数次,多聚甲醛固定细胞后在激光共聚焦显微镜下观察,可追踪到细胞膜上明亮的荧光信号(红色)。借助膜融合脂质体实现了dna序列在细胞磷脂双分子层外侧膜上的有效修饰。
[0098]
实施例2磷脂双分子层内侧和外侧同时修饰有修饰物的膜融合脂质体实现细胞膜的内侧和外侧的同时修饰1)末端疏水的dna序列合成:将带有叠氮的dspe(二硬脂酰基磷脂酰乙醇胺)脂质与带有dbco(聚乙二醇马来酰亚胺)的dna序列以1:3的物质的量比例置于ep管中,加入适量的水和乙醇的1:1混合溶液,70℃下反应过夜,粗产物通过氯仿和水混合萃取除去多余的杂质,收集dna序列在氯仿中的溶液。
[0099]
2)混合脂质的制备:dppc(二棕榈酰磷脂酰胆碱)(4.8mg, 24%)溶解于100 μl 氯
仿溶液中,dopc(二油酰基卵磷脂)(5.1mg,24%)溶解于100 μl 氯仿溶液中,dotap((2,3-二油酰基-丙基)-三甲胺)(0.9mg,5%)溶解于100 μl 氯仿溶液中,胆固醇(5mg,47%)溶解于100 μl 氯仿溶液中氯仿溶液中混合溶液转移到2毫升石英玻璃小瓶内。过夜通风蒸发溶剂后,在瓶底形成脂质薄膜,放入真空干燥箱中进一步去除剩余氯仿,-20℃保存。
[0100]
3)制备膜融合脂质体:将制备好的混合脂质膜,于磷酸缓冲溶液pbs中45℃孵育1小时。超声分散后混合均匀后加入1 nmol带有疏水端基的修饰物的atp响应荧光dna序列,37℃孵育反复挤压通过200nm孔径的聚碳酸酯薄膜,来回挤压11次可以得到尺寸均一的内外膜都修饰有atp响应荧光dna序列的膜融合脂质体,其结构示意图如图6所示。其中,荧光响应序列由三段序列组合在一起,分别为atp适配体,膜修饰荧光链,荧光屏蔽链。atp适配体如seq id no.4所示。seq id no.4:5'-ttttttactcatctgtgaagagaacctggg ggagtattgcggaggaaggt-3',atp适配体负责与atp结合。膜修饰荧光链如seq id no.5所示。seq id no.5:5'-fam-tcacagatgagtaaaaaa-aaaaaaaaaaaaaaa-chole-3',膜修饰荧光链锚定在脂质体膜上与atp aptamer互补配对并在信号读出时负责发出绿色荧光。荧光屏蔽链如seq id no.6所示。seq id no.6:5'-cccaggttctct-bhq1-3',relea-bhq与atp aptamer互补配对并在没有atp信号的时负责掩蔽fam-lipo-chole序列的荧光。
[0101]
4)修饰细胞膜:将内外膜都修饰有atp响应荧光dna序列的融合脂质体(0.1μm)与hela细胞在37℃下共孵育2小时,磷酸盐缓冲溶液(pbs)冲洗数次,更换培养基,去除培养基,磷酸盐缓冲溶液(pbs)冲洗数次,多聚甲醛固定细胞后在激光共聚焦显微镜下观察。
[0102]
实施例3磷脂双分子层内侧修饰有dna的膜融合脂质体实现细胞膜的内侧修饰1)末端疏水的dna序列合成:将带有叠氮的dspe(二硬脂酰基磷脂酰乙醇胺)脂质与带有dbco(聚乙二醇马来酰亚胺)的dna序列以1:3的物质的量比例置于ep管中,加入适量的水和乙醇的1:1混合溶液,70℃下反应过夜,粗产物通过氯仿和水混合萃取除去多余的杂质,收集dna序列在氯仿中的溶液。
[0103]
2)混合脂质的制备:dppc(二棕榈酰磷脂酰胆碱)(4.8mg, 24%)溶解于100 μl 氯仿溶液中,dopc(二油酰基卵磷脂)(5.1mg,24%)溶解于100 μl 氯仿溶液中,dotap((2,3-二油酰基-丙基)-三甲胺)(0.9mg,5%)溶解于100 μl 氯仿溶液中,胆固醇(5mg,47%)溶解于100 μl 氯仿溶液中氯仿溶液中混合溶液转移到2毫升石英玻璃小瓶内。过夜通风蒸发溶剂后,在瓶底形成脂质薄膜,放入真空干燥箱中进一步去除剩余氯仿,-20℃保存。
[0104]
3)制备膜融合脂质体:将制备好的混合脂质膜,于磷酸缓冲溶液pbs中45℃孵育1小时。超声分散后混合均匀后加入1 nmol带有混合均匀后加入带有疏水端基的修饰物的荧光dna序列,37℃孵育后,反复挤压通过200nm孔径的聚碳酸酯薄膜,来回挤压11次得到内外膜都修饰有荧光dna的膜融合脂质体,使用dnase i 酶切除脂质体磷脂双分子层外侧的dna序列,通过尺寸排阻色谱得到内膜修饰有荧光dna的膜融合脂质体,其结构示意图如图8所示。
[0105]
4)如图11所示,将内膜修饰有dna序列的膜融合脂质体(0.1μm)与hela细胞在37℃下共孵育2小时,磷酸盐缓冲溶液(pbs)冲洗数次,更换培养基,使用dnase i 酶切除细胞磷脂双分子层外侧的所有dna,去除培养基,磷酸盐缓冲溶液(pbs)冲洗数次,多聚甲醛固定细胞后在激光共聚焦显微镜下观察,如图14和图12所示,通过膜融合脂质体将带有荧光dna序
列修饰到细胞膜上,通过膜融合脂质体将磷脂双分子层内侧和外侧同时都修饰有荧光dna序列的脂质体与细胞膜融合的细胞膜荧光照片(a);通过膜融合脂质体将细胞膜荧光序列融合脂质体与hela细胞孵育,然后用dnase i处理依然可以观察到红色荧光说明在细胞磷脂双分子层内侧膜上修饰有荧光dna序列(b);游离的疏水寡核苷酸荧光孵育hela细胞可以观察到部分序列插入在细胞膜上并伴有部分序列内吞(c);游离疏水寡核苷酸荧光孵育hela细胞,然后用dnase i处理无法观察到荧光(d)。膜融合脂质体通过将dna序列修饰在脂质体磷脂双分子层内侧,实现了在膜融合后对细胞内膜的有效修饰,并解决了细胞膜环境对dna序列活性的干扰的情况。
[0106]
实施例4dna介导的细胞组装:如图17所示,将实施例1制备的磷脂双分子层外侧或者实施例2制备的磷脂双分子层内侧和外侧同时修饰有如seq id no.1所示的dna序列的膜融合脂质体(0.1μm)与huvecs细胞与cem细胞分别在37℃下共孵育2小时,seq id no.1:5'-gtcagtcagttttttttttt-chol-3',磷酸盐缓冲溶液(pbs)冲洗数次,更换培养基,huvecs细胞加入如seq id no.2所示的序列ⅰ,seq id no.2:5'-actgactgacttttttttttttttttttttttttttttttttttttttttttggttgg-3',与锚定在细胞膜上的序列互补配对并暴露出于如seq id no.3所示的序列ii互补配对的粘性末端,中间的碱基可以控制细胞之间的距离,cem细胞加入序列ii。seq id no.3:5'-actgactgacttttttttttttttttttttttttttttttttttttttttccaaccaa-3',序列ii与锚定在细胞膜上的序列互补配对并暴露出如seq id no.2所示的于序列i互补配对的粘性末端,中间的碱基可以控制细胞之间的距离,更换培养基后分别将huvecs(红)与cem染色(绿)之后将cem细胞加入到huvecs细胞中共孵育过夜。形成利用序列i与序列ii的粘性末端互补配对使两种细胞形成组装体结构,其检测结果如图16所示。而非互补配对dna序列对照组则没有形成组装体。使用mmp-2试剂盒检测huvecs细胞在培养基中的mmp-2分泌水平,其结果如图18所示,结果表明通过cem细胞的组装极大的提高了huvecs细胞在培养基中的mmp-2分泌,远远高于单独cem细胞、单独huvecs细胞、单纯cem细胞和huvecs细胞共培养、以及内皮细胞培养基。利用膜融合脂质体将互补配对的dna序列带到细胞膜表面促进细胞之间的组装可以进一步的应用在人工组织培养研究上。
[0107]
实施例5基于dna传感器的细胞内atp检测:检测atp的过程如图10所示。将内外膜、或者内膜或外膜修饰有atp响应荧光dna序列的融合脂质体(0.1μm)与hela细胞在37℃下共孵育2小时,磷酸盐缓冲溶液(pbs)冲洗数次,更换培养基,去除培养基,磷酸盐缓冲溶液(pbs)冲洗数次,多聚甲醛固定细胞后在激光共聚焦显微镜下观察,结果如图13所示,通过atp荧光探针序列检测细胞膜上atp分子,通过膜融合脂质体将磷脂双分子层内侧和外侧同时都修饰有atp荧光探针序列的脂质体与细胞膜融合的细胞膜荧光照片(a),通过膜融合脂质体将细胞膜荧光序列融合脂质体与hela细胞孵育,然后用dnase i酶处理依然可以观察到绿色荧光(b),游离疏水寡核苷酸荧光孵育hela细胞可以少量的观察到细胞磷脂双分子层外侧的atp(c),游离疏水寡核苷酸荧光孵育hela细胞,然后用dnase i处理无法观察到荧光(d)。发现不论是否使用dnase i酶处理都能在细胞膜上观察到明亮荧光(绿色),说明借助膜融合脂质体锚定在细胞膜表面的dna序列
检测到了细胞膜表面的atp成分,且即使dnase i去除了外膜上的dna序列造成荧光强度有所降低,细胞磷脂双分子层内侧atp成分依然被锚定在内侧的dna序列所检测。这是一般直接插入疏水dna序列不能完成的。
[0108]
我们使用激光共聚焦显微镜拍摄了atp检测荧光所在细胞位置的照片,并通过流式细胞术测量了膜融合脂质体锚定的atp适配体与单纯的atp适配体与hela细胞孵育后的荧光强度区别。根据荧光显微镜以及流式细胞术检测结果可知,磷脂双分子层内侧和外侧同时都修饰有atp适配体的膜融合脂质体荧光最强烈(a);通过dnase i 酶处理后的只有磷脂双分子层内侧上载有atp适配体的膜融合脂质体在与hela细胞孵育后也能在细胞膜上找到绿色荧光(b);仅有磷脂双分子层外侧修饰有atp适配体的膜融合脂质体在与hela细胞孵育后能在细胞膜上找到微弱的绿色荧光,但这是对细胞外吐出来的到溶液中细胞微环境中atp响应,但无法检测细胞内的atp,固信号很弱(c);而单纯的atp适配体与hela细胞孵育几乎没有发现绿色荧光(d)。流式结果也与荧光显微镜结果相符,膜融合脂质体的荧光强度远远高于单独适配体与hela细胞孵育的强度。
[0109]
实施例6确定dna序列锚定的位置本方法中所制备的膜融合脂质体,可以融合在hela细胞的细胞膜上。为了确定dna序列锚定的位置。我们使用激光共聚焦显微镜拍摄了三种脂质体与细胞融合后,dna荧光所在细胞位置的照片,并通过流式细胞术测量了膜融合脂质体锚定的dna序列以及游离ssdna序列与hela细胞孵育后的荧光强度区别。根据荧光显微镜以及流式细胞术检测结果可知,磷脂双分子层内侧和外侧都修饰有dna的膜融合脂质体荧光最强烈(a);通过dnase i 酶处理后的只有磷脂双分子层内侧上载有荧光dna序列的膜融合脂质体在与hela细胞孵育后也能在细胞膜上找到红色荧光(b);游离的ssdna序列在与hela细胞孵育后也能在细胞膜上找到红色荧光(c);游离的ssdna序列在与hela细胞孵育后再与dnase i酶孵育后荧光明显减弱(d)。流式结果也与荧光显微镜结果相符,说明通过膜融合脂质体与细胞孵育不仅可以将dna序列锚定在细胞外膜也可以将dna序列锚定在细胞内膜上,这是一种灵活而高效的细胞膜表面dna序列修饰方法。
[0110]
实施例7修饰有dna的膜融合脂质体在dotap含量不超过10%具有较好的生物相容性,不具有显著的细胞毒性。结果证明5%的dotap具有较好生物相容性的情况下具有较好的融合性能。
[0111]
1)末端疏水的dna序列合成:将带有叠氮的dspe(二硬脂酰基磷脂酰乙醇胺)脂质与带有dbco(聚乙二醇马来酰亚胺)的dna序列以1:3的物质的量比例置于ep管中,加入适量的水和乙醇的1:1混合溶液,70℃下反应过夜,粗产物通过氯仿和水混合萃取除去多余的杂质,收集dna序列在氯仿中的溶液。
[0112]
2)饱和磷脂dppc、不饱和磷脂dopc、胆固醇、正电脂质dotap以1:1:2:0.1;1:1:2:0.25;1:1:2:0.5;1:1:2:1摩尔比例混合,形成混合脂质,50℃孵育,混合均匀后加入带有疏水端基的修饰物的dna序列,混合脂质的制备:dppc(二棕榈酰磷脂酰胆碱)(4.8mg, 24%)溶解于100 μl 氯仿溶液中,dopc(二油酰基卵磷脂)(5.1mg,24%)溶解于100 μl 氯仿溶液中,dotap((2,3-二油酰基-丙基)-三甲胺)(不大于4mg,0-20%)溶解于100 μl 氯仿溶液中,胆
固醇(5mg,47%)溶解于100 μl 氯仿溶液中氯仿溶液中混合溶液转移到2毫升石英玻璃小瓶内。过夜通风蒸发溶剂后,在瓶底形成脂质薄膜,放入真空干燥箱中进一步去除剩余氯仿,-20℃保存。
[0113]
将磷脂双分子层内侧和外侧都修饰有atp响应荧光dna序列的融合脂质体(0.1μm)与hela细胞在37℃下共孵育24小时。并通过cck-8试剂盒孵育,通过酶标仪检测450nm处的紫外吸收,检验细胞活性,从而检测膜融合脂质体的细胞毒性。结果如图15所示,通过调整正电脂质dotap的比例我们证实含有5%的dotap的膜融合脂质体在保持足够细胞亲和力的同时,生物相容性出色,基本没有细胞毒性。
[0114]
实施例8借助脂质体融合的细胞膜内外侧不对称荧光修饰1)末端疏水的dna序列合成:将带有叠氮的dspe(二硬脂酰基磷脂酰乙醇胺)脂质与带有dbco(聚乙二醇马来酰亚胺)的dna序列以1:3的物质的量比例置于ep管中,加入适量的水和乙醇的1:1混合溶液,70℃下反应过夜,粗产物通过氯仿和水混合萃取除去多余的杂质,收集dna序列在氯仿中的溶液。
[0115]
2)混合脂质的制备:dppc(二棕榈酰磷脂酰胆碱)(4.8mg, 24%)溶解于100 μl 氯仿溶液中,dopc(二油酰基卵磷脂)(5.1mg,24%)溶解于100 μl 氯仿溶液中,dotap((2,3-二油酰基-丙基)-三甲胺)(0.9mg,5%)溶解于100 μl 氯仿溶液中,胆固醇(5mg,47%)溶解于100 μl 氯仿溶液中氯仿溶液中混合溶液转移到2毫升石英玻璃小瓶内。过夜通风蒸发溶剂后,在瓶底形成脂质薄膜,放入真空干燥箱中进一步去除剩余氯仿,-20℃保存。
[0116]
3)制备内膜修饰脂质体:将制备好的混合脂质膜,于磷酸缓冲溶液pbs中45℃孵育1小时。超声分散后混合均匀后加入1 nmol带有混合均匀后加入带有疏水端基的修饰物的cy3荧光dna序列seq id no.7:5'-cy3-gtc agt cag ttt ttt ttt tt-chol-3',37℃孵育后,37℃孵育反复挤压通过200nm孔径的聚碳酸酯薄膜,来回挤压11次得到内外膜都修饰有cy3荧光dna的膜融合脂质体,使用dnase i 酶切除脂质体膜外的dna序列,通过尺寸排阻色谱得到内膜修饰有cy3荧光dna的膜融合脂质体。
[0117]
4)制备内外膜不对称修饰脂质体将制备好的内膜cy3修饰脂质体与1 nmol 带有混合均匀后加入带有疏水端基的修饰物的fam荧光dna序列seq id no.8:5'-fam-tca cag atg agt aaa aaa aaa aaa aaa aaa aaa-chol-3',37℃孵育过夜后通过尺寸排阻色谱得到内膜修饰有cy3荧光dna外膜不对称修饰有fam荧光dna的膜融合脂质体。
[0118]
5)修饰细胞膜:将内膜修饰有cy3荧光dna外膜不对称修饰有fam荧光dna的膜融合脂质体(0.1μm)与hela细胞在37℃下共孵育2小时,磷酸盐缓冲溶液(pbs)冲洗数次,多聚甲醛固定细胞后在激光共聚焦显微镜下观察,如图19a所示,可追踪到细胞膜上明亮的cy3荧光信号(红色)以及fam荧光信号(绿色)。借助膜融合脂质体实现了dna序列在细胞膜外膜上的有效修饰。dnase i处理去除细胞膜外侧的荧光序列仍能观察到细胞膜内测修饰的红色荧光,说明该方法实现了对细胞膜内外侧的不对称dna荧光修饰。这是一般直接插入疏水dna序列不能完成的。
[0119]
6)dna序列不对称修饰编程:通过改变制备顺序将内膜修饰的外膜修饰有疏水端基的修饰物的fam荧光dna序列seq id seq id no.7:5'-fam
‑ꢀ
tca cag atg agt aaa aaa aaa aaa aaa aaa aaa-chol-3'的内膜修饰脂质体与1 nmol 带有混合均匀后加入带有疏
水端基修饰物的cy3荧光dna序列seq id seq id no.6:5'-cy3-gtc agt cag ttt ttt ttt tt-chol-3',37℃孵育过夜后通过尺寸排阻色谱得到内膜修饰有fam荧光dna外膜不对称修饰有cy3荧光dna的膜融合脂质体。将内膜修饰有fam荧光dna外膜不对称修饰有cy3荧光dna的膜融合脂质体(0.1μm)与hela细胞在37℃下共孵育2小时,磷酸盐缓冲溶液(pbs)冲洗数次,多聚甲醛固定细胞后在激光共聚焦显微镜下观察,如图19b所示,可追踪到细胞膜上明亮的cy3荧光信号(红色)以及fam荧光信号(绿色)。借助膜融合脂质体实现了dna序列在细胞膜外膜上的有效修饰。dnase i处理去除细胞膜外侧的荧光序列仍能观察到细胞膜内测修饰的绿色荧光,说明该方法实现了空间方向可控的细胞膜内外侧的不对称dna荧光修饰且这种修饰,这种修饰方法可以人为不对称设计内外侧的dna序列,且不对称修饰结果不受到dna序列本身的影响。为空间控制细胞膜两侧的工程奠定了基础,极大地扩展了研究、模拟和操纵质膜内特别是质膜内表面生化功能的能力。这种在细胞表面呈现具有方向控制的正交官能团的能力将为代谢物传感、跨膜传递和细胞内催化等应提供技术支持。
[0120]
不同于以往只能在细胞膜外侧的实现dna修饰,本发明中所制备的膜融合脂质体,可以实现细胞膜内外侧的同时修饰,并能实现在内外膜上修饰不同的正交dna序列,并对所修饰的dna序列实现精准的内外膜空间控制。通过共聚焦荧光成像,表征dna修饰的细胞,结果如图19所示。图19(a)显示了在细胞膜外侧修饰绿色荧光dna,细胞膜内侧修饰红色荧光dna,并可以通过dnase i酶处理去除绿色荧光dna。图19(b)显示了在细胞膜外侧修饰红色荧光dna,细胞膜内侧修饰绿色荧光dna,并可以通过dnase i酶处理去除红色荧光dna。这个实施例验证了膜融合脂质体可以实现细胞内外表面dna的选择性修饰。
[0121]
以上八个例子证明了开发的膜融合脂质体材料具有生物相容性与细胞膜结构修饰的灵活性,有望应用于细胞膜性能修饰等应用。
[0122]
尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。