sirna分子、shrna分子及其应用
技术领域
1.本发明涉及分子生物技术领域,特别是涉及一种sirna分子、shrna分子及其应用。
背景技术:
2.高尿酸血症是指在正常嘌呤饮食状态下,非同日两次空腹血尿酸水平男性高于420μmol/l,女性高于360μmol/l,即称为高尿酸血症。长期血尿酸升高会导致患者体内尿酸的沉积,进而发展为痛风。可致高尿酸血症和痛风的危险因素包括:家庭病史、饮酒过度、使用利尿剂、慢性肾病、饮食因素(过量摄入果糖、海鲜、肉和富含嘌呤的蔬菜)、升高体重指数、年龄和性别等。高尿酸血症男性患病率为1.4%~32.1%,女性患病率为1.3%~21.8%,约有5%~12%的高尿酸血症患者最终发展为痛风。高尿酸血症是因体内尿酸生成过多和(或)排泄过少所致,其中又可分为原发性和继发性两大类。原发性高尿酸血症:(1)尿酸排泄减少。90%原发性痛风患者高尿酸血症的原因与尿酸排泄减少有关,其可能机制有:
①
肾小球滤过减少;
②
肾小管重吸收增加;
③
肾小管分泌减少。(2)尿酸生成过多。内源性尿酸产生过多的定义是:在低嘌呤饮食(《17.9μmol/d),超过5天后,尿中尿酸排出量仍大于3.58mmol。10%原发性痛风患者高尿酸血症的原因与尿酸生成过多有关。其机制可能是内源性尿酸生成过多。与促进尿酸生成过程中的一些酶数量与活性增加和(或)抑制尿酸生成的一些酶的数量和活性降低有关。酶的缺陷与基因变异有关,可为多基因,也可为单基因。遗传方式可分为常染色体隐性、常染色显性遗传和性连锁遗传。继发性高尿酸血症:(1)肾尿酸排泄减少。
①
肾病变如肾小球病变导致尿酸滤过减少和肾小管病变导致尿酸分泌减少;
②
利尿剂特别是噻嗪类利尿剂,其他药物如阿司匹林、吡嗪酰胺、左旋多巴、乙胺丁醇、乙醇等也可干扰肾小管对尿酸的重吸收;
③
体内有机酸增加如酮酸、乳酸可竞争性抑制肾小管尿酸分泌。(2)尿酸产生过多。多见于骨髓和淋巴增生性疾病。在白血病、淋巴瘤化疗、放疗过程中,由于大量的细胞破坏,可导致核酸代谢加速,进而导致继发性高尿酸血症。
3.痛风(gout)是一种常见且复杂的关节炎类型,各个年龄段均可能罹患本病,男性发病率高于女性。痛风患者经常会在夜晚出现突然性的关节疼,发病急,关节部位出现严重的疼痛、水肿、红肿和炎症,疼痛感慢慢减轻直至消失,持续几天或几周不等。痛风发作与体内尿酸浓度有关,痛风会在关节腔等处形成尿酸盐沉积,激活机体自身的免疫系统,进而引发急性关节疼痛。而夜间人体处于相对缺水状态下,从而使尿酸更容易沉积并在关节等部位聚集,引起痛风。饮随低食物是比较普遍和健康的治疗方法。限制饮酒,酒精在发酵过程中会消耗人体大量水分并产生大量嘌呤,人体内嘌呤含量越多,代谢产生的尿酸就越多,同时酒精刺激肝脏也会产生尿酸,而这会增加痛风的发病率和痛风对人体的危害。痛风与嘌呤代谢紊乱及尿酸排泄减少所致的高尿酸血症直接相关,属代谢性风湿病范畴。痛风可并发肾脏病变,严重者可出现关节破坏、肾功能损害,常伴发高脂血症、高血压病、糖尿病、动脉硬化及冠心病等。因此,高尿酸血症是痛风发生的基础。
4.人体中尿酸的排泄途径有两条:经肾脏排泄和经肠道排泄,其中肾脏对尿酸的排泄约占其排泄的三分之二。肾脏排泄尿酸的分子机制为肾组织的顶端膜和基底外侧膜上表
达多种尿酸转运体,其作用为介导尿酸的转运及重吸收,主要包括两类:一类是促进尿酸重吸收的尿酸阴离子转运体1(urat1)、有机阴离子转运体(oats)中的oat4及葡萄糖转运体9(glut9);另一类是促尿酸排泄转运体,包括oat1、oat3、腺苷三磷酸结合盒转运蛋白g2(abcg2)。urat1是oat家族的成员,是一种完整的膜蛋白,主要存在于肾脏近端小管的上皮细胞中。由于初次经肾小球过滤的尿酸90%会被肾小管重吸收,而urat1是尿酸阴离子重吸收的重要转运蛋白之一,因而urat1在尿酸的排泄中起重要作用,成为开发高尿酸血症及痛风治疗药物的重要靶点之一。
5.目前,高尿酸血症及痛风的治疗策略包括抑制尿酸生成和促进尿酸排泄。
①
黄嘌呤氧化酶抑制剂(xois):别嘌呤醇、非布司他和托匹司他,通过抑制尿酸合成来达到降低血清尿酸浓度的目的;
②
促进尿酸排泄的药物:丙磺舒、苯溴马隆和lesinurad,主要作用于urat1,其作用机制为抑制尿酸在近端肾小管中的再摄取,从而增加尿酸的排泄量,治疗高尿酸血症;
③
可注射的尿酶,通过将血尿酸降解为可溶性的尿囊素和氢过氧化来发挥降尿酸作用。在rnai治疗方面,仅arrowhead pharmaceuticals与horizon therapeutics联合开发以xdh(黄嘌呤氧化酶)为靶点的aro-xdh,通过抑制尿酸的合成发挥降低血尿酸浓度的作用,用于治疗对当前疗法没有应答,症状失控的痛风患者,该药物处于临床前研发状态。但是,目前针对urat1为靶点开发的sirna药物仍未有报道。
技术实现要素:
6.基于此,有必要提供一种能够有效抑制urat1基因表达的sirna分子。
7.一种sirna分子,包括正义链和反义链,所述正义链和反义链互补共同形成rna二聚体,所述反义链的核苷酸序列如seq id no:1~11中的任一种所示。
8.在其中一个实施例中,所述反义链的核苷酸序列如seq id no:2、seq id no:3以及seq id no:5~11中的任一种所示。
9.在其中一个实施例中,所述正义链和/或所述反义链包括经化学修饰的核苷酸。
10.在其中一个实施例中,所述经化学修饰的核苷酸选自脱氧核糖核苷酸、2
’‑
o-甲基核糖核苷酸和2
’‑
氟代核糖核苷酸中的一种或多种。
11.本发明还提供了一种shrna分子,所述shrna分子包含正义链片段和反义链片段,以及连接所述正义链片段和反义链片段的茎环结构,所述正义链片段和所述反义链片段的序列互补,并且所述反义链片段的序列包含seq id no:1~11中所示的序列任一种。
12.本发明还提供了一种重组载体,所述重组载体含有如上所述的shrna分子的核苷酸序列。
13.本发明还提供了如上所述的sirna分子、shrna分子或重组载体在制备药物中的应用,所述药物用于治疗和/或预防因血尿酸偏高导致的疾病。
14.在其中一个实施例中,所述疾病包括高尿酸血症和痛风。
15.本发明还提供了一种用于抑制urat1基因表达的试剂盒,其包括如上所述的sirna分子、shrna分子或重组载体。
16.本发明还提供了一种用于防治因血尿酸偏高导致的疾病的药物,其包括如上所述的sirna分子、shrna分子或重组载体,以及药学上可接受的辅料。
17.本发明筛选得到的sirna分子能够有效地抑制urat1基因的表达,可以通过抑制肾
小管urat1介导尿酸的重吸收,从而调节血尿酸浓度,实现对高尿酸血症及痛风等相关疾病的治疗,能够成为潜在的因血尿酸偏高导致的疾病的治疗药物。通过实验证明,本发明的sirna分子对靶基因urat1的抑制率较高,尤其是其中rb-2的抑制率高达99%,抑制效果十分优异。可以理解,也可以将上述sirna构建成shrna分子,通过病毒或细菌整合进染色体中,从而源源不断产生shrna,进而实现长时间的抑制作用。
附图说明
18.图1为本发明实施例1中urat1过表达质粒的酶切鉴定图;其中,左图的泳道1为dna分子量标准,泳道2为urat1基因的pcr扩增产物;右图的泳道1为dna分子量标准,泳道2为重组urat1基因表达载体,泳道3为重组urat1基因表达载体双酶切鉴定;
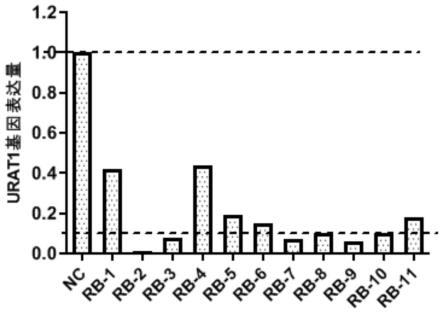
19.图2为本发明实施例1中各组sirna序列对靶基因urat1表达量的影响结果图,可见各组sirna对靶基因urat1的抑制率均较高,其中rb-2对靶基因urat1的抑制率高达99%,rb-3、rb-7和rb-9对靶基因urat1的抑制率>90%。
具体实施方式
20.为了便于理解本发明,下面将对本发明进行更全面的描述,并给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
21.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
22.本发明一实施例的sirna分子,其包括正义链和反义链,正义链和反义链互补共同形成rna二聚体,反义链的核苷酸序列如seq id no:1~11中的任一种所示。
23.本发明筛选得到的sirna分子能够有效地抑制urat1基因的表达,可以通过抑制肾小管urat1介导尿酸的重吸收,从而调节血尿酸浓度,实现对高尿酸血症及痛风等相关疾病的治疗,能够成为潜在的因血尿酸偏高导致的疾病的治疗药物。通过实验证明,本发明的sirna分子对靶基因urat1的抑制率较高,尤其是其中rb-2的抑制率高达99%,抑制效果十分优异。可以理解,也可以将上述sirna构建成shrna分子,通过病毒或细菌整合进染色体中,从而源源不断产生shrna,进而实现长时间的抑制作用。
24.可以理解,从概念上说转录时作为mrna合成模板的那条单链叫做模板链或反义链,而转录时不能作为mrna合成模板的那条单链叫有义链,现今通常将mrna看作是有义分子,而将与mrna序列一致的单链标为有义链。病毒基因、人工转入基因、转座子等外源性基因随机整合到宿主细胞基因组内,并利用宿主细胞进行转录时,常产生一些dsrna。宿主细胞对这些dsrna迅即产生反应,其胞质中的核酸内切酶dicer将dsrna切割成多个具有特定长度和结构的小片段rna(大约21~23bp),即sirna。sirna在细胞内rna解旋酶的作用下解链成正义链和反义链,继之由反义链再与体内一些酶(包括内切酶、外切酶、解旋酶等)结合形成rna诱导的沉默复合物(rna-induced silencing complex,risc)。risc与外源性基因表达的mrna的同源区进行特异性结合,risc具有核酸酶的功能,在结合部位切割mrna,导致
特定基因沉默,切割位点即是与sirna中反义链互补结合的两端。被切割后的断裂mrna随即降解,从而诱发宿主细胞针对这些mrna的降解反应。
25.在一个具体示例中,反义链的核苷酸序列如seq id no:2、seq id no:3以及seq id no:5~11中的任一种所示,其具有更好的抑制urat1基因表达的效果。
26.在一个具体示例中,正义链的核苷酸序列如seq id no:12~22中的任一种所示。在一个具体示例中,正义链的核苷酸序列如seq id no:13、seq id no:14以及seq id no:16~22中的任一种所示。
27.在一个具体示例中,正义链和/或反义链包括经化学修饰的核苷酸。可以理解,为了提高它们在治疗条件中的有效性,可以进行化学修饰。例如,可以为了使其对酶降解不太敏感、提高其药物动力学/药效谱,或促进其通过细胞膜,对核苷酸进行修饰。化学修饰可以采用公知的方法,这些修饰包括但不限于2
’‑
o-甲氧基乙基、2
’‑
o-甲基、2
’‑
氟单体、3'p、5'p、5-硝基吲哚、2-氨基嘌呤、8-氨基-2'-脱氧腺苷、c-5丙炔基-脱氧胞苷、c-5丙炔基-脱氧尿苷、2-氨基-2'-脱氧腺苷-5'-三磷酸、2,6-二氨基嘌呤(2-氨基-da)、反向dt、反向二脱氧-t、羟甲基dc、异-dc、5-甲基dc、氨基乙基-吩噁嗪-脱氧胞苷和锁核酸(lna’s)等。
28.在一个具体示例中,上述经化学修饰的核苷酸选自脱氧核糖核苷酸、2
’‑
o-甲基核糖核苷酸和2
’‑
氟代核糖核苷酸中的一种或多种。
29.在一个具体示例中,正义链的修饰方式为:从5’末端到3’末端的方向,第3、4位和倒数第4位的核苷酸为2
’‑
氟代核糖核苷酸。在一个具体示例中,反义链的修饰方式为:从5’末端到3’末端的方向,第1位和倒数第1位、倒数第2位、倒数第7位、倒数第8位核苷酸为2
’‑
o-甲基核糖核苷酸。可以理解,修饰方式不限于此,可根据需要调整。
30.本发明一实施例的shrna分子,包含正义链片段和反义链片段,以及连接正义链片段和反义链片段的茎环结构,正义链片段和反义链片段的序列互补,并且反义链片段的序列包含seq id no:1~11中所示的序列任一种。
31.在一个具体示例中,反义链片段的核苷酸序列如seq id no:2、seq id no:3以及seq id no:5~11中的任一种所示,其具有更好的抑制urat1基因表达的效果。
32.本发明一实施例的重组载体,其含有如上所述的shrna分子的核苷酸序列。
33.在一个具体示例中,重组载体基于慢病毒载体构建得到。可以理解,载体类型包括但不限于:质粒;噬菌粒;柯斯质粒;人工染色体,例如酵母人工染色体(yac)、细菌人工染色体(bac)或p1来源的人工染色体(pac);噬菌体如λ噬菌体或m13噬菌体及动物病毒等。可用作载体的动物病毒包括但不限于,逆转录酶病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如sv40)。
34.本发明一实施例的如上所述的sirna分子、shrna分子或重组载体在制备药物中的应用,其药物用于治疗和/或预防因血尿酸偏高(男性》420μmol/l;女性》360μmol/l)导致的疾病。
35.在一个具体示例中,上述疾病包括高尿酸血症和痛风。可以理解,由于上述sirna分子、shrna分子或重组载体能够有效地抑制urat1基因的表达,通过抑制肾小管urat1介导尿酸的重吸收,从而调节血尿酸浓度,因此对于因血尿酸偏高导致的疾病均有一定的治疗效果。
36.本发明一实施例的用于抑制urat1基因表达的试剂盒,其包括如上所述的sirna分
子、shrna分子或重组载体。可以理解,试剂盒中可以只包括具体的一种上述sirna分子、shrna分子或重组载体,也可以同时包括多种上述sirna分子、shrna分子或重组载体,从而通过组合使用加强抑制效果。
37.本发明一实施例用于防治因血尿酸偏高导致的疾病的药物,其包括如上所述的sirna分子、shrna分子或重组载体,以及药学上可接受的辅料。可以理解,药物中可以只包括具体的一种上述sirna分子、shrna分子或重组载体,也可以同时包括多种上述sirna分子、shrna分子或重组载体,从而通过组合使用加强治疗效果。
38.在一个具体示例中,辅料包括稀释剂、防腐剂、缓冲剂、崩解剂、抗氧剂、助悬剂、着色剂和赋形剂中的一种或多种。
39.在一个具体示例中,稀释剂选自聚乙二醇、丙二醇、植物油和矿物油中的一种或多种。在一个具体示例中,防腐剂选自山梨酸、山梨酸甲酯、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、对羟基苯甲酸丁酯、对羟基苯甲酸苄酯、对羟基苯甲酸甲酯钠、苯甲酸和苯甲醇中的一种或多种。在一个具体示例中,缓冲剂选自磷酸氢钠、磷酸二氢钠、枸橼酸钠、酒石酸钠和醋酸钠中的一种或多种。在一个具体示例中,崩解剂选自交联羧甲基纤维素钠、羧甲基淀粉钠、交联聚乙烯吡咯烷酮或低取代羟丙基纤维素中的一种或多种。在一个具体示例中,抗氧剂选自乙二胺四乙酸、乙二胺四乙酸二钠盐、二丁基羟基甲苯、甘氨酸、肌醇、抗坏血酸、抗坏血酸钠、卵磷脂、苹果酸、氢醌、枸橼酸、琥珀酸和焦亚硫酸钠中的一种或多种。在一个具体示例中,助悬剂选自蜂蜡、乙基羟乙基纤维素、甲壳素、甲壳糖、甲基纤维素、羧甲基纤维素、琼脂、羟丙基甲基纤维素和黄原胶中的一种或多种。在一个具体示例中,着色剂选自炭黑、铁黑、铁棕、铁红和二氧化钛中的一种或多种。在一个具体示例中,赋形剂选自甘露醇、葡萄糖、乳糖、葡聚糖、右旋糖苷和氯化钠中的一种或多种。
40.下面将结合具体实施例和附图对本发明的实施方案进行详细描述。
41.实验材料:
42.细胞:人肝癌细胞系mhcc97h,购自beyotime,产品目录编号为c6585。细胞培养试剂:dmem(dulbecco’s modified eagle media)培养基、胎牛血清(fetal bovine serum,fbs)、2.5%胰蛋白酶-edta、opti-mem培养基,以上均购自gibco公司,pbs(phosphate buffered saline)缓冲液购自吉诺生物医药技术有限公司。
43.其他主要试剂:ribofecttm cp转染试剂、riboscripttm reverse transcription kit、ribotm mrna/lncrna qrt-pcr starter kit,oligo dt购自广州市锐博生物科技有限公司,magzol reagent购自angen biotech,taq dna polymerase、t4dna ligase、pcr 10
×
buffer、10
×
ligation buffer、bamhⅰ、hindⅲ、10
×
fast digest buffer购自thermo scientific,感受态细胞、高纯度质粒小提试剂盒购自天根生化科技有限公司,dnase i酶购自takara公司。
44.urat1过表达质粒:由厦门大学韩家淮实验室提供,以pcr的方法直接从菌液中扩增目的片段。经pcr产物纯化,使用ta克隆的方法将该片段与线性ta克隆载体相连接,经转化后涂布氨苄抗生素平板以及单克隆的提取鉴定完成了对urat1基因的克隆。再经过bamhⅰ和hindⅲ双酶切,回收片段后与同样经过同两种酶双酶切后的pcdna3.1质粒相连接,经转化后涂布氨苄抗生素平板,挑取单克隆并提取鉴定,再经过一代测序对目的片段的具体序列进行验证,最终获得urat1基因的过表达质粒,鉴定结果见图1。图1中,左图的泳道1为dna
分子量标准,泳道2为urat1基因的pcr扩增产物;右图的泳道1为dna分子量标准,泳道2为重组urat1基因表达载体,泳道3为重组urat1基因表达载体双酶切鉴定。
45.仪器:生物安全柜(airtech,bsc-1600ii a2)、细胞培养箱(memmert,inc246)、冷冻离心机(eppendorf,5417r)、恒温水浴锅(上海一恒科技有限公司,dk-80),pcr仪(bio-rad,c1000touch)、实时荧光定量pcr仪(bio-rad,cfx connect)、倒置显微镜(olympus,ckx41)、制冰机(scotsman,af100)、微量移液器(eppendorf,research plus)电子天平(mettler toledo,ml1602)、超纯水系统(pall corporation cascada-bio,mk2)、旋涡混合器(qilinbeier,vortex-5)、通风橱(keda-a2)、超微量分光光度计(北京凯奥,k5500)。
46.实施例1
47.一、实验设计
48.设计sirna以确定靶向于urat1基因的sirna,并进行生物信息筛选,确保序列对于urat1序列是特异性的且对于来自任何其他基因的序列是非特异性的。共选择11个序列,如表1所示。细胞转染同时设置阴性对照组(nc,nc为随机非特异sirna,即非针对urat1所设计的sirna)。每组设置两个生物样本重复,共进行三次平行实验。
49.表1 sirna序列
[0050][0051][0052]
二、细胞转染
[0053]
使用dmem培养基(含10%fbs)培养mhcc97h细胞;转染前16h铺入24孔板,每孔4
×
104个细胞。
[0054]
当mhcc97h细胞生长至对数期(即生长达70%融合成片)时,按照ribofecttm cp转染试剂(广州市锐博生物科技有限公司)说明书操作,转染体系的总体积为500μl,sirna转染浓度为100nm,urat1质粒浓度6.25ng/孔,转染试剂3μl,按照上述体系将各组对应的sirna转染mhcc97h细胞。
[0055]
三、转染后48h收集细胞,trizol法提取各组细胞的总rna。
[0056]
细胞加trizol后,室温静置10min后收集各组裂解液到1.5ml离心管中。按200μl氯仿/ml trizol加入氯仿,振荡混匀后室温放置15min。4℃12000g离心15min。吸取上层水相,至另一离心管中。按0.5ml异丙醇/ml trizol加入异丙醇混匀,室温放置5~10min。4℃12000g离心10min,弃上清,rna沉于管底。按1ml 75%乙醇/ml trizol加入75%乙醇,温和振荡离心管,悬浮沉淀。4℃8000g离心5min,尽量弃上清。室温晾干或真空干燥5~10min。rna样品不要过于干燥,否则很难溶解。可用50μl h2o,te buffer或0.5%sds溶解rna样品,55~60℃,5~10min。h2o、te或0.5%sds均须用depc处理。测od值定量rna浓度。
[0057]
四、将各组的rna反转录为cdna,以各组的cdna为模板,以f和r为引物,进行实时荧光定量pcr,以gapdh为内参基因。引物如下:
[0058]
urat1 f:5'tctccacgttgtgctggttc 3'(seq id no:23)
[0059]
urat1 r:5'ggatgtccacgacaccaatga 3'(seq id no:24)
[0060]
gapdh f:5'gaacgggaagctcactgg 3'(seq id no:25)
[0061]
gapdh r:5'gcctgcttcaccaccttct 3'(seq id no:26)
[0062]
五、实验结果
[0063]
检测结果如表2和图2所示,对靶基因urat1的抑制率均较高,其中rb-2对靶基因urat1的抑制率高达99%,rb-3、rb-7和rb-9对靶基因的抑制率>90%,表明上述sirna序列均表现出较好的基因沉默效果。
[0064]
表2 sirna序列对urat1基因表达量的影响
[0065]
双链编号mrna表达量nc1.00rb-10.42rb-20.01rb-30.08rb-40.44rb-50.19rb-60.15rb-70.07rb-80.10rb-90.06rb-100.10rb-110.18
[0066]
综上所述,本发明的sirna分子对靶基因urat1的抑制率较高,其中rb-2的抑制率
高达99%。上述sirna分子可成为潜在的高尿酸血症及痛风的治疗药物,通过抑制肾小管urat1介导尿酸的重吸收,从而调节血尿酸浓度,实现对高尿酸血症及痛风的治疗。
[0067]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0068]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。