1.本发明属于基因工程技术领域,具体涉及一种猪胰蛋白酶原突变体及其在毕赤酵母中的表达。
背景技术:
2.胰蛋白酶(trypsin,ec 3.4.21.4)是广泛存在的丝氨酸蛋白酶类,尤其是存在于哺乳动物消化系统及昆虫体内。哺乳动物由胰腺分泌胰蛋白酶,以酶原的形式存在,经过小肠分泌的肠激酶作用将胰蛋白酶原分解为具有活性的消化酶,主要作用于精氨酸或赖氨酸羧基端的肽键,同时还能限制分级糜蛋白酶原、羧肽酶原、磷脂酶原等酶原前体。
3.胰蛋白酶在医学上可以对脓胸,血胸,溃疡,外科炎症以及外科创伤性损伤等都具有一定的临床作用,对毒蛇咬伤也有一定的缓解作用,还常用于动物细胞培养前对组织的处理。临床上用于脓胸、血胸、外科炎症、溃疡、创伤性损伤等所产生的局部水肿、血肿及脓肿等。除此之外在工业生产中,胰蛋白酶尤其在重组人胰岛素以及胰岛素类似物的生产过程中尤为重要,且是能够决定胰岛素收率的一个重要因素之一。
4.目前制备胰蛋白酶的方法主要有两类:一是提取自动物如牛、猪、羊等的胰脏,因其来源广,制备方法相对简单被广泛采用。但是该方法因不能完全去除其它蛋白质,且提取的动物源病毒如口蹄疫病毒、疯牛病病毒等都不能完全去除,因此其在医药应用上存在对人体的免疫原性危害。第二种是以基因重组的方法生产动物来源的胰蛋白酶,多以猪源性胰蛋白酶为主,且基因工程宿主多为大肠杆菌,但大肠杆菌表达常出现包涵体,大肠杆菌毒性较大而表达量较低。
5.采用醇氧化酶aox1启动子表达目的基因,需要采用甲醇作为碳源和诱导剂,但是甲醇易燃且有毒,有可能带来环境污染和消防隐患,使产品可能残留甲醇。目前尚没有利用p
gap
启动子在毕赤酵母x33中表达猪胰蛋白酶的报道,本专利弥补了这一不足之处。
技术实现要素:
6.针对现有技术的不足,本发明目的提供一种猪胰蛋白酶原突变体基因,以及其编码的猪胰蛋白酶原突变体,含有该基因的重组表达载体、基因工程菌及其制备方法。
7.本发明解决其技术问题采用的技术方案是:
8.本发明首先请求保护一种猪胰蛋白酶原突变体基因,其核苷酸序列选自(a1)或(a2):
9.(a1)如seq id no.1所示;
10.(a2)由seq id no.1中所示的核苷酸序列经过取代、缺失或者添加一个或者几个核苷酸且编码猪胰蛋白酶原的由seq id no.1衍生的基因。
11.本发明还保护上述猪胰蛋白酶原突变体基因编码的蛋白。
12.具体的,所述蛋白的氨基酸序列选自(b1)或(b2):
13.(b1)由seq id no.2所示氨基酸序列组成的蛋白质;
14.(b2)由seq id no.2所示氨基酸序列经过取代、缺失或者添加一个或者几个氨基酸且能够生成具有酶活性的猪胰蛋白酶由seq id no.2衍生的蛋白质。
15.本发明还请求保护一种包含前文所述基因的生物材料,所述生物材料为重组表达载体、表达盒、转基因细胞系或基因工程菌。
16.所述重组表达载体可通过本领域常规方法将所述猪胰蛋白酶原突变体基因的核苷酸序列连接于各种载体上构建而成。所述的载体可以为本领域常规的能够用以表达外源蛋白的穿梭载体,这些能够用以表达外援蛋白的穿梭载体均含有表达外援蛋白所需要的分泌信号肽,优选以pgapzα为基础改造的载体。进一步地,所述酵母表达载体为具有筛选标记的酵母表达载体,优选地,所述酵母表达载体的筛选标记为zeocin,本发明优选的实施方式为pgapzα以及zeocin筛选标记。
17.本方法以p
gap
为启动子,避免了添加甲醇诱导,减少了甲醇的危害和对环境的污染,安全方便。
18.本发明还保护一种包含本发明的猪胰蛋白酶原突变体基因或其重组表达载体的基因工程菌,优选的为酵母菌,进一步优选为毕赤酵母,更优选为毕赤酵母x33。
19.本发明还保护一种利用上述基因工程菌制备猪胰蛋白酶原突变体的方法,包括构建该基因工程菌,筛选得到该基因工程菌,发酵培养该基因工程菌,以及收集和制备猪胰蛋白酶原突变体。
20.优选的,具体步骤如下:
21.(1)将前文所述的猪胰蛋白酶原突变体基因插入质粒构成重组表达载体,并连接到含有对应筛选标记的酵母表达载体中,并将载体转化至对应酵母宿主中;
22.(2)诱导上述酵母宿主表达猪胰蛋白酶原突变体;
23.(3)通过肠激酶处理上述猪胰蛋白酶原,生成猪胰蛋白酶;
24.(4)纯化上述猪胰蛋白酶。
25.其中,步骤(1)中使用ecori、noti双酶切猪胰蛋白酶原突变体和具有筛选标记zeocin的酵母表达载体,优选的为pgapzα质粒,用t4连接酶连接得到重组质粒。
26.将步骤(1)得到的重组表达载体转化到酿酒酵母、毕赤酵母或假丝酵母等酵母菌中。所述酵母宿主作为一种真核表达系统,能够直接表达构象正确的目的蛋白,因此本发明中更为优选的为毕赤酵母菌株pichia pastoris x33,得到重组毕赤酵母菌进行表达。
27.步骤(3)中采用猪胰蛋白酶原常用的肠激酶激活方式。
28.步骤(4)中的纯化猪胰蛋白酶突变体,本发明的纯化方法优选采用苯甲醚亲和纯化进行,并通过使用甘氨酸溶液进行梯度洗脱。
29.本发明中的重组酵母菌种以酵母粉、葡萄糖作为生长碳源,利用p
gap
启动子,宿主菌分泌表达猪胰蛋白酶突变体过程中不需要添加甲醇等诱导剂,通过肠激酶处理上述猪胰蛋白酶突变体,生成活性猪胰蛋白酶,以苯甲醚亲和层析纯化所得活性较高的猪胰蛋白酶。
30.有益效果
31.本发明相对于现有技术的有益效果为:
32.(1)采用酵母表达猪胰蛋白酶原避免大肠杆菌包涵体变复性制备困难的缺点;
33.(2)本发明使用启动子p
gap
能利用多种碳源,克服p
aox1
启动子的缺陷,高水平组成型表达外源蛋白,不需要补加甲醇进行诱导,避免了上述危害,不但简化了操作,提高了效
率,而且更适合大规模连续表达外源蛋白,应用前景广阔;
34.(3)本发明通过所述猪胰蛋白酶原突变体基因转化形成一株高产胰蛋白酶工程菌株,发酵工艺和纯化工艺简单、表达效率高、产量高;生成的猪胰蛋白酶突变体转化的猪胰蛋白酶保留了胰蛋白酶原有的空间结构,以及有较高的活性;
35.(4)本方法以毕赤酵母为宿主制备猪胰蛋白酶,优势在于:毕赤酵母的真核表达体系所产生的胰蛋白酶避免了变复性操作复杂的缺点,且保留其原始结构,能够以分泌表达的方式外分泌于培养基中,毕赤酵母外分泌蛋白较少,有利于目的胰蛋白酶的纯化。
附图说明
36.图1为重组猪胰蛋白酶原发酵液上清蛋白sds-page电泳图;
37.图2为重组猪胰蛋白酶苯甲醚亲和层析纯化图注:a为纯化洗脱峰;
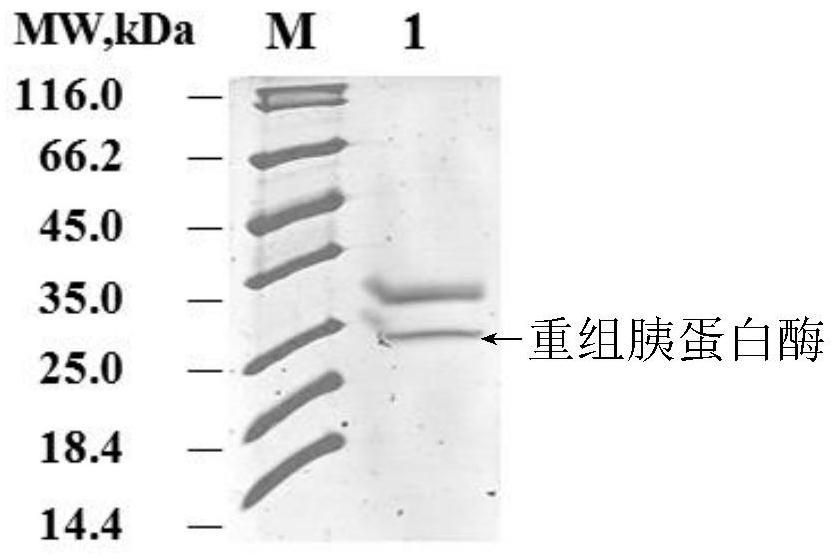
38.图3为纯化后重组猪胰蛋白酶与野生型胰蛋白酶sds-page电泳对比图;其中,m:marker;1:重组胰蛋白酶;2:野生型胰蛋白酶;
39.图4为重组猪胰蛋白酶与野生型胰蛋白酶活性对比图;
40.图5为重组猪胰蛋白酶与野生型胰蛋白酶hplc对比图。
具体实施方式
41.以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
42.材料:
43.菌种和质粒:克隆菌种escherichia coli dh5α是基因工程常用菌种;巴斯德毕赤酵母pichia pastoris x33;质粒pgapzα购自于invitrogen公司。
44.酶和试剂:
45.实施例中设计分子生物学操作所用的限制性内切酶购自于newengland biolabs公司,相应的操作步骤完全按照相关的产品说明书进行。
46.dna片段纯化试剂盒购自takara公司,质粒提取试剂盒购自北京天根生物科技有限公司,质粒中抽试剂盒购自macherey-nagel公司,相应的操作步骤完全按照相关的产品说明书进行。
47.实施例中所涉及的编码猪胰蛋白酶原的核苷酸序列的合成由南京金斯瑞生物科技有限公司完成。
48.培养基:
49.lb、低盐lb、ypd、抗性培养基为相应培养基加相应抗生素,如:zeocin。
50.实施例1含有猪胰蛋白酶原重组质粒的构建与富集
51.重组质粒委托南京金斯瑞公司合成,收到质粒粉后使用cacl2化学转化法转化入大肠杆菌escherichia coli dh5α感受态细胞中,操作步骤如下:
52.用接种环挑取少量大肠杆菌,用划线法接种到lb培养基上,在37℃恒温培养箱内过夜培养,从平板上挑单菌落接种到新配制的lb液体培养基中,用37℃、200r/min的摇床培养,使用紫外分光光度计检测菌悬液的od
600
值,当od
600
值在0.2-0.5之间时,放置冰中中止
生长。用移液枪取上述大肠杆菌悬液1ml置于离心管中,4℃,4000r/min条件下离心5min,弃上清液;向离心管中分别加入100μl预冷的0.1mol/l cacl2,用移液枪吹吸混匀,切勿剧烈振荡,4000r/min,4℃条件下离心5min,弃上清液;
53.向离心管中分别加入预冷的100μl 0.1mol cacl2,用移液枪吹打混匀沉淀,不可剧烈振荡,将酶切后的质粒和猪胰蛋白酶原序列冰浴20min后,42℃热击45s,并使用lb培养基后培养1h后,转化涂布于含有zeocin(25μg/ml)lb平板中,提取质粒双酶切并验证构建的重组质粒。
54.实施例2猪胰蛋白酶酵母工程菌的构建
55.将毕赤酵母表达质粒使用限制性内切酶avrⅱ线性化,电击转化入pichia pastoris x33感受态细胞中,具体方法如下:
56.将划线平板上的单菌落毕赤酵母x33接种到10ml ypd液体培养基中,在30℃、250r/min的条件下培养18~22h;
57.使用紫外分光光度计检测菌悬液的od
600
值,将50ml ypd液体培养基置于250ml锥形瓶内,按下式计算转接量转接毕赤酵母x33菌液,在30℃、250r/min的条件下震荡培养18~22h;
[0058][0059]
式中:od
始
为起始od
600
值;v1为转接体积;v2为培养基体积;t为培养时间;od
末
为培养结束时的od
600
值。例如:测得od
始
=16,将50ml ypd液体培养基置于250ml锥形瓶内,在30℃、250r/min的条件下震荡培养18h使od
末
=1.3,计算转接毕赤酵母x33菌液为8μl;
[0060]
当od
600
=1.3-1.5时,将菌液于4℃、1500
×
g条件下离心5min,收集细胞;
[0061]
用等体积(50ml)预冷无菌水洗涤细胞,在4℃、1500
×
g条件下离心5min收集细胞,丢弃离心上清液;
[0062]
用1/2体积(25ml)的预冷无菌水悬浮细胞,在4℃、1500
×
g条件下离心5min,丢弃离心上清液。
[0063]
加入25ml预冷的1mol/l山梨糖醇重悬菌体,置冰上放置20min,然后经过1500
×
g,5min离心收集集菌体。
[0064]
加入50-200μl预冷的1mol/l山梨糖醇重悬菌体,然后各取80μl电转感受态进行电转化。
[0065]
注:根据转化个数,确定加入1mol/l山梨糖醇的量。
[0066]
取5-10μg线性化的重组质粒与上述80μl感受态细胞混合,冰上静止10min后将上述混合物加如预冷的无菌电转杯(0.2cm),1500v、25μf、200ω电击转化,电击后加入1ml 1mol/l山梨醇。取上述溶液150μl,350μl,500μl涂布于含100μg/ml zeocin的ypd平板上,30℃培养2-4天直至长出白色菌落。挑选白色单菌落点用于摇瓶发酵。
[0067]
实施例3重组猪胰蛋白酶酵母工程菌的表达
[0068]
将上述重组工程菌按照2%接种量接种于10ml ypd液体培养基中,30℃250r/min培养,待菌体生长起来后,将其按照1%接种量接种于50ml ypd液体培养基中,30℃250r/min培养,表达48h。重组猪胰蛋白酶原被分泌表达至液体培养基中,采用sds-page检测重组猪胰蛋白酶表达情况,结果见图1(m为marker,1:重组胰蛋白酶菌体发酵液上清蛋白),经过
表达后的分泌液中在23kda左右出现了较为明显的表达条带。
[0069]
实施例4重组猪胰蛋白酶原的酶切激活
[0070]
将表达后的工程菌培养基离心,取上清液,测定蛋白浓度,计算蛋白质含量按照蛋白总量:肠激酶量为500:1的比例(w:w),室温下酶切4h,得到活化后的重组猪胰蛋白酶。
[0071]
实施例5重组猪胰蛋白酶的纯化
[0072]
将上述酶切产物使用苯甲醚亲和层析柱进行纯化,首先使用缓冲液a(含50mmol/l kh2po4与0.5mol/l氯化钠,ph7.0)进行洗脱以出去杂蛋白,然后用缓冲液b(0.1mol/l甘氨酸,ph2.7)洗脱重组胰蛋白酶,收集组分峰,得到含有重组胰蛋白酶的溶液,纯化图谱见图2,可以获得单一的洗脱峰。将上述溶液使用sds-page检测,结果见图3(m为marker,1:纯化后的重组猪胰蛋白酶,2:野生型胰蛋白酶),经过纯化后可以获得胰蛋白酶。
[0073]
实施例6重组猪胰蛋白酶酶活的测定
[0074]
胰蛋白酶酶活测定方法:本发明中以苯甲酰l-精氨酸乙酯盐酸盐(英文缩写为baee)为底物,采用紫外吸光光度法进行测定。
[0075]
取光程1cm的2个石英比色皿,分别加入25℃预热过的3ml底物溶液。其中一只比色皿中加入200μl 0.001mol/l hcl溶液,作为空白,校正仪器在253nm处光吸收零点。再在另一比色皿中加入200μl待测酶液,立即混匀并扫描吸光度变化曲线共5min。控制
△
a253/min在0.03-0.036左右为宜。
[0076]
胰蛋白酶活力单位的定义规定为以baee为底物反应液,25℃,反应体积3ml,光径1cm的条件下,测定
△
a253/min,每分钟使
△
a253改变0.003,反应液中所加入的酶量为一个单位,计算公式如下:
[0077][0078]
式中p为每1mg供试品中含胰蛋白酶的量,单位;
[0079]
a1为直线上终止的吸光度;
[0080]
a2为直线上开始的吸光度;
[0081]
t为a1至a2读数的时间,分钟;
[0082]
w为测定液中供试品的量,ml;
[0083]
结果如图4所示,经测定,每毫升发酵液中重组猪胰蛋白酶活性为13044u/ml,而野生型胰蛋白酶为2600u/ml,因此突变体提高了活性。
[0084]
实施例7重组猪胰蛋白酶的hplc分析
[0085]
色谱条件:流动相a:超纯水 0.1%甲酸,有机系0.45μm滤膜过滤;流动相b:acn 0.1%甲酸,有机系0.45μm滤膜过滤;色谱柱:sepax bio-c18,4.6
×
250mm,5μm,流速:1.0ml/min,柱温:35℃,进样盘温度:5℃,检测波长:214nm。
[0086]
洗脱梯度:
[0087]
[0088][0089]
结果如图5所示,获得的重组猪胰蛋白酶比野生型胰蛋白酶的稳定性更好。
[0090]
本发明的保护内容不局限于以上实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求为保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。