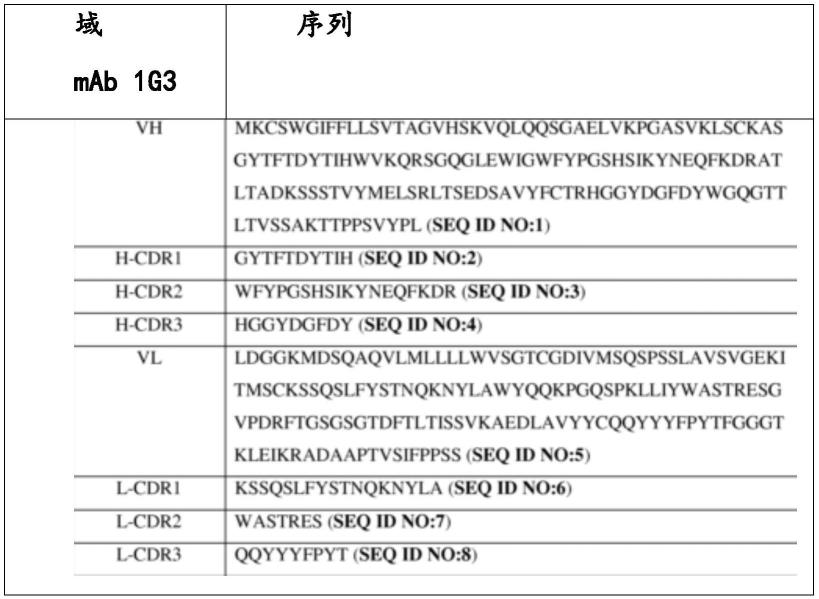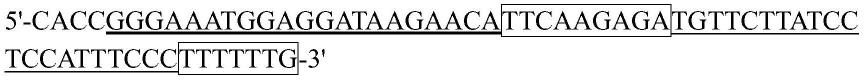
1.本发明属于生物技术领域,具体而言,涉及包含用于改善免疫疗法的重组溶瘤腺病毒及其用途、包含重组溶瘤腺病毒和免疫治疗药物的治疗剂及其用途、治疗肿瘤和/或癌症的方法。
背景技术:
2.肿瘤治疗研究发展至今,人类干预肿瘤发展的手段经历了手术、放疗、化疗、靶向治疗和生物治疗等五个阶段,前面四种治疗手段相互结合,在大多数种类的肿瘤治疗上形成了较为成熟的治疗方案,在很大程度上能够遏制肿瘤的发展,但是一旦复发转移,临床医生将陷于束手无策的状态。
3.随着近些年来生物医学技术的迅猛发展,以细胞治疗和免疫治疗为主的生物治疗手段的出现,让肿瘤病人再一次看到了新的希望。car-t技术的悄然出现和日益成熟代表着世界上最先进的细胞治疗手段,尤其它在血液系统肿瘤治疗领域取得的巨大成功让临床医生们备受鼓舞。但是car-t细胞过继性输注治疗血液瘤后仍旧会有大比例复发,以及当人们尝试利用car-t细胞来治疗实体瘤时也收效甚微。经过大量研究发现,前者血液系统肿瘤在经过过继性car-t细胞治疗后复发的主要原因在于肿瘤的异质性,例如在利用cd19 car-t细胞治疗非霍奇金淋巴瘤或急性淋巴细胞白血病时,并不是所有的肿瘤细胞都高表达cd19,在高表达cd19的肿瘤细胞被cd19 car-t细胞清除掉后,低表达或者不表达cd19的肿瘤细胞就会慢慢地扩增出来,从而导致复发;而后者在利用car-t细胞治疗实体瘤时收效甚微,一方面用作car-t细胞靶标的肿瘤细胞表面特异性蛋白不易获得,还有不容小觑的另一个原因就是肿瘤细胞来源的免疫检查点蛋白对免疫细胞产生的免疫抑制很大程度上限制了肿瘤周围免疫细胞的活性,甚至能够抑制病人整个免疫系统的活性。除car-t细胞治疗之外,目前也已开发了其它靶向cd19的免疫治疗药物及方法,包括双抗、adc、fc工程化抗体等,在临床试验中取得了令人鼓舞的结果;但对于实体瘤的治疗,仍尚未看到明确的临床疗效。
4.溶瘤病毒疗法属于生物治疗的范畴。溶瘤病毒是指感染肿瘤细胞后能够选择性地在靶细胞内复制,最终导致肿瘤细胞裂解和死亡的一类病毒。这类病毒依靠其本身的特异性在肿瘤细胞中复制来裂解肿瘤细胞,细胞裂解后释放出来的病毒又可以进一步感染周围的肿瘤细胞,同时对正常细胞和组织则没有破坏作用,或影响较小。溶瘤病毒一般分为二类:一类为野生型病毒和自然变异的弱毒病毒株,这类病毒天然就对某些肿瘤细胞有亲和力,如呼肠孤病毒、新城疫病毒以及自主复制的细小病毒等,这些病毒能够在某些肿瘤细胞中繁殖并裂解细胞,具有天然的特异性溶瘤活性;另一类是对病毒基因组进行改造后,只能在肿瘤细胞内复制的病毒。目前人们已经通过基因工程方法改造了腺病毒、单纯疱疹病毒、流感病毒和人牛痘病毒等。其中腺病毒是溶瘤病毒研究开展相对较早溶瘤机理研究相对较为清楚的,腺病毒中又以5型腺病毒研究得更为清楚。我国在2006年批准上市了上海三维生物技术有限公司研发的一种具有溶瘤作用的重组人5型腺病毒h101(一种删除了e1b55k和
e3基因的溶瘤腺病毒)(nda号为:国药准字s20060027),可以实现在p53突变型的肿瘤细胞中特异性复制并溶解肿瘤细胞。溶瘤腺病毒日益成为恶性肿瘤治疗的一种新手段。
5.目前在肿瘤和/或癌症的免疫治疗中,仍然需要更加有效的治疗方案和由此开发出的药物。
技术实现要素:
6.为解决上述现有技术中所存在的问题,本发明提供了分离的重组溶瘤腺病毒及其用途、包含重组溶瘤腺病毒和免疫细胞的治疗剂及其用途、治疗肿瘤和/或癌症的方法。
7.具体而言,本发明提供了:
8.(1)一种分离的重组溶瘤腺病毒,其中该重组溶瘤腺病毒为选择复制型溶瘤腺病毒,该重组溶瘤腺病毒的基因组中携带有能够在肿瘤细胞和/或癌细胞中抑制pdl1表达的外源shrna的编码序列,并且携带有外源抗原的编码序列;其中所述外源抗原为包含cd19抗原表位的蛋白,并且所述外源抗原能够经表达而修饰在所述肿瘤细胞和/或癌细胞的表面,并能被靶向所述外源抗原的免疫治疗药物特异性识别。
9.(2)根据(1)所述的重组溶瘤腺病毒,其中所述包含cd19抗原表位的蛋白不具有cd19胞内信号传导功能,并且所述包含cd19抗原表位的蛋白包括:截短的cd19蛋白、包含cd19的至少一个c2ig样结构域的融合蛋白、或包含cd19抗原表位的融合蛋白。
10.(3)根据(1)所述的重组溶瘤腺病毒,其中所述外源抗原的氨基酸序列如seq id no.32所示,或者具有与seq id no.32所示氨基酸序列至少97%、优选至少98%、更优选至少99%的一致性。
11.(4)根据(1)所述的重组溶瘤腺病毒,其中所述外源shrna的编码序列如seq id nos.7、10和13中的任一者所示。
12.(5)根据(1)所述的重组溶瘤腺病毒,其中所述免疫治疗药物包括:靶向cd19的嵌合抗原受体修饰的免疫细胞,和/或靶向cd19的抗体;其中,所述靶向cd19的抗体包括:靶向cd19的双特异性抗体,靶向cd19的抗体偶联药物,和/或靶向cd19的fc工程化抗体。
13.(6)根据(5)所述的重组溶瘤腺病毒,其中所述的嵌合抗原受体修饰的免疫细胞包括原始t细胞或其前体细胞,nkt细胞,t细胞株或nk细胞。
14.(7)一种药物组合物,其中该药物组合物包括作为活性成分的根据(1)-(6)中任一项所述的重组溶瘤腺病毒,及可药用辅料。
15.(8)一种用于制备(1)-(6)中任一项所述的重组溶瘤腺病毒的载体,其中所述载体包含在启动子控制下的外源shrna编码序列,以及在启动子控制下的外源抗原的编码序列,所述shrna编码序列如seq id nos.7、10和13中的任一者所示,所述外源抗原的编码序列如seq id no.20所示。
16.(9)一种含有(8)所述的载体的宿主细胞。
17.(10)根据(1)-(6)中任一项所述的重组溶瘤腺病毒在制备用于治疗肿瘤和/或癌症的药物中的用途;优选的是,所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨
肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
18.(11)一种用于治疗肿瘤和/或癌症的治疗剂,包含:
19.(a)第一组合物,其中该第一组合物包含位于第一可药用载体中的第一活性成分,该第一活性成分包括或含有用于导入肿瘤细胞和/或癌细胞的根据(1)-(6)中任一项所述的重组溶瘤腺病毒;和
20.(b)第二组合物,其中该第二组合物包含位于第二可药用载体中的第二活性成分,该第二活性成分包含根据(1)-(6)中任一项所述的免疫治疗药物。
21.(12)根据(11)所述的治疗剂在制备用于治疗肿瘤和/或癌症的药物中的用途;优选的是,所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
22.(13)一种治疗肿瘤和/或癌症的方法,包括:
23.对肿瘤和/或癌症患者施用根据(11)所述的治疗剂中的第一组合物;和
24.对所述肿瘤和/或癌症患者施用根据(11)所述的治疗剂中的第二组合物。
25.(14)根据(13)所述的方法,包括以下依次进行的步骤:
26.1)对所述肿瘤和/或癌症患者施用所述第一组合物;和
27.2)在施用所述第一组合物之后,对所述肿瘤和/或癌症患者施用所述的治疗剂中的第二组合物。
28.本发明与现有技术相比具有以下优点和积极效果:
29.本发明首次提出一种新型的选择复制型重组溶瘤腺病毒,该重组溶瘤腺病毒既能够解除或减弱肿瘤细胞对免疫细胞(包括体内免疫细胞和过继免疫细胞)的抑制作用,还能够与特异性的免疫治疗药物联合治疗肿瘤和/或癌症,显示出多重的显著的协同效果。
30.具体而言,本发明的重组溶瘤腺病毒能够选择性地在肿瘤细胞中复制,并且表达能够在肿瘤细胞中抑制pdl1表达的shrna,以及表达外源抗原,该外源抗原为包含cd19抗原表位的蛋白,经表达修饰在所述肿瘤细胞和/或癌细胞的表面。首先,这使得本发明的溶瘤腺病毒显示出较强的杀瘤能力,并且在正常细胞中的复制能力远远低于其在肿瘤细胞中的复制能力,因此对正常细胞的毒性小,提高了安全性;进而该病毒所表达的shrna能够显著降低肿瘤细胞内的pdl1蛋白表达水平,从而降低了肿瘤细胞对免疫细胞(包括t淋巴细胞和nk细胞)的免疫抑制,因此增强了免疫细胞的抗肿瘤免疫杀伤作用。从而本发明的重组溶瘤
病毒的溶瘤杀伤作用和免疫细胞的抗肿瘤免疫刺激作用产生协同效果。当本发明的重组溶瘤腺病毒与特异性的靶向cd19的免疫治疗药物联用时,所述免疫治疗药物能特异性识别被所述外源抗原标记的肿瘤细胞和/或癌细胞,并杀伤这些肿瘤细胞和/或癌细胞。当靶向cd19的免疫治疗药物为靶向cd19的嵌合抗原受体修饰的免疫细胞或能够招募体内免疫细胞的其它靶向cd19的免疫治疗药物时,本发明既能解除或减弱肿瘤细胞和/或癌细胞对体内本身的免疫细胞的免疫抑制,也能解除或减弱肿瘤细胞对通过过继转输进入体内的、靶向cd19的嵌合抗原受体修饰的免疫细胞的免疫抑制,或解除或减弱肿瘤细胞和/或癌细胞对其它靶向cd19的免疫治疗药物所招募的体内免疫细胞的免疫抑制。这使得这些免疫治疗药物能够更好地发挥其杀伤肿瘤细胞和/或癌细胞的作用,更有效地针对实体瘤进行治疗。
31.本发明进一步对所述外源抗原序列进行了筛选,其为包含cd19抗原表位的蛋白,且不具有cd19胞内信号传导功能,所述包含cd19抗原表位的蛋白包括截短的cd19蛋白、包含cd19的至少一个c2ig样结构域的融合蛋白、或包含cd19抗原表位的融合蛋白。所得到的本发明的重组溶瘤腺病毒能够更加稳定、高效、安全地表达所述shrna和所述外源抗原,适合于工业化生产,满足药品制备要求。
32.定义
33.在本发明中,词语“肿瘤”、“癌症”、“肿瘤细胞”、“癌细胞”、“t细胞”、“nk细胞”、“抗原”、“抗原表位多肽”、“同源序列”、“编码”、“重组dna表达载体”、“启动子”、“互补序列”、“转染”、“自体”、“异体”、“特异性识别”、“car-免疫细胞疗法”、“car-t疗法”、“car-nk疗法”、“双特异性抗体”、“抗体偶联药物”、“fc工程化抗体”等涵盖本领域通常认为的含义。
34.本文所用的词语“溶瘤病毒”是指能够选择性地在肿瘤细胞中复制并裂解肿瘤细胞的病毒。
35.本文所用的词语“治疗有效量”是指功能药剂或药物组合物能够表现出可检测的治疗效果或抑制效果的量,或者起到抗肿瘤效果的量。所述效果可以通过本领域任何已知的检验方法检测。
36.本文所用的词语“给药”或“施用”是指向受试者提供化合物、复合物或组合物(包括病毒和细胞)。
37.本文所用的词语“患者”是指人或非人类生物。因此,本文所述的方法和组合物适用于人类疾病和兽类疾病。在一些实施方案中,患者患有肿瘤。在一些例子中,患者同时患有一种或多种类型的癌症。
38.本文所用的词语“协同效果”是指两种或多种药剂共同起到的效果,该效果大于其中各药剂的单独效果的总和。
39.本文所用的术语“pfu”、“pfu”或“蚀斑形成单位”(plague forming unit)是指:产生一个蚀斑的病毒量称为一个蚀斑形成单位(pfu)。
40.本文所用的术语“vp”是指病毒颗粒的个数。
41.本文所用的术语“vp/kg”是指病毒颗粒数/千克患者体重。
42.本文所用的术语“moi”或“感染复数”(multiplicityofinfection)也即,病毒与细胞个数比,是指用以起始病毒感染的每个细胞感染病毒颗粒的粒数。moi=pfu/细胞,即细胞个数
×
moi=总pfu。
附图说明
43.图1示出pcr扩增5型腺病毒的e1a基因的凝胶电泳图;其中泳道m为dna分子量标记,泳道1为以h101基因组dna为模板的pcr产物。
44.图2示出pshuttle-e1a质粒阳性克隆的pcr筛选结果;其中泳道m为dna分子量标记,泳道1-3为候选克隆。
45.图3示出pshuttle-e1a质粒的构建过程和所构建的质粒的图谱。
46.图4示出从pshuttle-e1a质粒pcr扩增e1a表达框的示意图(左图)和凝胶电泳图(右图);其中泳道m为dna分子量标记,泳道1-2为pcr产物。
47.图5示出pshuttle-mcs-e1a候选质粒的pcr筛选结果;其中泳道m为dna分子量标记,泳道1-13为候选质粒,泳道nc为pcr系统阴性对照(即,模板为水的pcr产物),泳道pc为pcr系统阳性对照(即,模板为包含目的片段的pshuttle-e1a质粒dna)。
48.图6示出pshuttle-mcs-e1a候选质粒的bglii酶切鉴定结果;其中泳道m为dna分子量标记,样品1-3为候选质粒,每种样品两条泳道,分别为:泳道n为未酶切的候选质粒,泳道b为bglii酶切后的候选质粒。
49.图7示出pshuttle-mcs-e1a质粒的构建过程和所构建的质粒的图谱。
50.图8示出本发明的一个实施方案的三种shpdl1对u251和h460细胞中人pdl1 mrna的抑制情况。横坐标轴表示利用4种shrna处理u251和h460细胞后分别在24h和48h收取的4组细胞样品,纵坐标表示每种shrna处理细胞后细胞中pdl1 mrna的表达水平与对照shrna处理细胞后其中pdl1 mrna的表达水平的比率。
51.图9示出本发明的一个实施方案的三种shpdl1对293t细胞中外源hpdl1表达的抑制情况。左图为蛋白质印迹法(western blot)结果,表示不同shpdl1处理细胞后细胞样品中hpdl1(含flag标签)的表达变化情况和细胞内的蛋白内参β-actin(β肌动蛋白)的表达情况;右图为根据western blot结果,以蛋白内参β-actin作为标准化对照获得的hpdl1条带的灰度扫描值,横坐标表示不同shpdl1处理后的293细胞样品组,“对照”是指仅转染pcdna3.3-hpdl1-flag表达hpdl1(含flag标签)的对照组,纵坐标为利用β-actin标准化后的目的蛋白的灰度扫描值。
52.图10示出pshuttle-u6-shpdl1-cmv-e1a质粒的构建过程和所构建的质粒的图谱。
53.图11示出pshuttle-u6-shpdl1-cmv-e1a质粒的酶切鉴定结果;其中泳道m为dna分子量标记,泳道c为kpni/hindiii酶切后的对照质粒(pshuttle-mcs-e1a),泳道1-7为kpni/hindiii酶切后的候选质粒。
54.图12示出pshuttle-u6-shpdl1-ef1a-cd19m-bpa-cmv-e1a候选质粒的pcr筛选结果;其中泳道m为dna分子量标记,泳道1-10为候选质粒,泳道nc为pcr系统阴性对照(即,模板为水的pcr产物),泳道pc为pcr系统阳性对照(即,包含bghpa的质粒)。
55.图13示出pshuttle-u6-shpdl1-ef1a-cd19m-bpa-cmv-e1a质粒的图谱。
56.图14示出本发明重组溶瘤腺病毒的一个实施方案的基因组结构示意图。
57.图15示出本发明实施例1中重组溶瘤腺病毒oad-shpdl1-cd19m和靶向cd19的car-t对人卵巢癌细胞株skov3的体外联合杀伤结果。图15a为实时杀伤的结果,横坐标为肿瘤细胞铺板后(即实验开始后)的时间,以小时(h)计,纵坐标为归一细胞存活指数,图中垂直向下的箭头所指分别为加入oad-shpdl1-cd19m以及对照t(即“mock-t”)或car-t的时间点。图
15b是对图15a实验中间点(66小时)各组的细胞指数进行分析,计算出的肿瘤生长抑制率,横坐标为不同实验组,纵坐标为肿瘤细胞生长抑制率ir(%)。
具体实施方式
58.以下通过具体实施方式的描述并参照附图对本发明作进一步说明,但这并非是对本发明的限制,本领域技术人员根据本发明的基本思想,可以做出各种修改或改进,但是只要不脱离本发明的基本思想,均在本发明的范围之内。
59.人体是一个复杂的系统,它是由呼吸、循环、消化等十大系统组成,这些系统协调配合,使人体内各种复杂的生命活动能够正常进行。当肿瘤发生后,机体可通过多种免疫效应机制发挥抗肿瘤作用,机体的抗肿瘤机制包括细胞免疫和体液免疫两个方面。它们联系密切,相互影响,涉及多种免疫效应分子和效应细胞。一般认为,细胞免疫在抗肿瘤过程中起到主导作用,体液免疫在某些情况下起协同作用。本发明提出利用溶瘤腺病毒选择性地在肿瘤细胞中复制并杀伤肿瘤细胞的特点,同时使其携带能够在肿瘤细胞中抑制pdl1表达的外源shrna的编码序列以及外源抗原的编码序列,从而使重组的溶瘤腺病毒协同发挥选择性溶瘤和增强机体抗肿瘤免疫效应的作用,并能与靶向所述外源抗原的免疫治疗药物联合,这大大增加了靶向所述外源抗原的免疫治疗药物的适应症范围,并能解除或减弱肿瘤细胞对免疫细胞的抑制,进而增强靶向所述外源抗原的免疫治疗药物的疗效,从多个方面显著改善免疫疗法。
60.基于该构思,本发明的发明人通过实验研究和理论摸索,发现同时使溶瘤腺病毒的e1b19k基因、e1b55k基因、和全部e3基因的编码区缺失,并在基因组中携带所述外源shrna的编码序列以及所述外源抗原的编码序列,能够很好地实现上述协同作用。
61.在本发明描述的溶瘤腺病毒中,除了删除e3区外,也同时删除了e1b55k和e1b19k两个基因,因此该类病毒比现有技术中的溶瘤腺病毒在肿瘤细胞中的选择复制性更好,在正常细胞中的复制能力更低,对正常细胞的安全性更好。
62.pd-l1(也称pdl1或b7-h1)属于b7家族,具有igv和igc样区、跨膜区及胞浆区。该分子具有广泛的组织表达谱,在一些肿瘤细胞系上有较高的表达,许多研究均表明其与肿瘤的免疫逃逸机制相关。肿瘤部位的微环境可诱导肿瘤细胞上的pd-l1的表达,且表达广泛,表达的pd-l1有利于肿瘤的发生和生长。肿瘤细胞以及肿瘤微环境中的apcs表达的pd-l1与免疫细胞上的受体pd1相互作用经pd-1/pd-l1信号通路抑制免疫细胞(包括肿瘤抗原特异性t细胞)的活化,下调免疫细胞(包括t细胞)介导的肿瘤免疫应答。另外也有研究表明通过阻断pd-l1/pd-1信号通路可以促进肿瘤抗原特异性t细胞的增殖、上调浸润cd8
t细胞ifn-γ的分泌和有效抑制肿瘤生长,表明pd-1/pd-l1信号通路的阻断在以诱导免疫应答为目的的肿瘤免疫应答中发挥重要的作用。而且还有实验证明选择抗pd-l1单抗配合肿瘤疫苗进行肿瘤免疫治疗可有效加强肿瘤疫苗的免疫激活作用,减弱肿瘤微环境对疗效的影响。
63.cd19是b细胞的生物标志物,并且是目前car-t免疫治疗的热门靶点。人cd19属于免疫球蛋白(ig)超家族,是一种95kd跨膜糖蛋白,含有556个氨基酸。在小鼠和人之间表现出广泛的保守性。cd19为i型跨膜蛋白,具有单个跨膜结构域、胞内c末端和胞外n末端。胞外段含有两个c2型ig样结构域。胞内结构域高度保守,由242个氨基酸组成,在c末端附近有9个酪氨酸残基。cd19的表达在大多数b细胞肿瘤中高度保守,在大多数急性淋巴细胞白血病
(all),慢性淋巴细胞白血病(cll)和b细胞淋巴瘤中表达。cd19在b细胞活化以及信号传到中起协同受体作用,调节b细胞活化及增殖,参与b细胞的信号传导功能,并介导t细胞对靶细胞杀伤。
64.基于以上的理论研究和探索,本发明的溶瘤腺病毒除了改构溶瘤病毒基因组构成使其具备更高的溶瘤杀伤能力以外,还加入了可以表达shpdl1(抑制pdl1表达的shrna)的编码框,以及可以表达外源抗原的编码框,该外源抗原为包含cd19抗原表位的蛋白,经表达修饰在所述肿瘤细胞和/或癌细胞的表面。一方面,本发明期望借助shpdl1可以高效降解细胞内pdl1的mrna实现其基因沉默,进而降低肿瘤细胞内pdl1的表达,减弱pd1/pdl1信号通路向免疫细胞抑制信号的传递,加强免疫细胞对肿瘤的杀伤作用。因此,本发明的溶瘤病毒既可以单独作为溶瘤剂,又可以作为shpdl1的编码框的有效载体,使shpdl1伴随病毒复制而大量表达,同时发挥病毒治疗和基因治疗的双重功能。另一方面,当本发明的重组溶瘤腺病毒与特异性的靶向cd19的免疫治疗药物联用时,所述免疫治疗药物能特异性识别被所述外源抗原标记的肿瘤细胞和/或癌细胞,并杀伤这些肿瘤细胞和/或癌细胞。当靶向cd19的免疫治疗药物为靶向cd19的嵌合抗原受体修饰的免疫细胞或能够招募体内免疫细胞的其它靶向cd19的免疫治疗药物时,本发明既能解除或减弱肿瘤细胞和/或癌细胞对周围的体内本身的免疫细胞的免疫抑制,也能解除或减弱肿瘤细胞对通过过继转输进入体内的、靶向cd19的嵌合抗原受体修饰的免疫细胞的免疫抑制,或解除或减弱肿瘤细胞和/或癌细胞对其它靶向cd19的免疫治疗药物所招募的体内免疫细胞的免疫抑制。这使得这些免疫治疗药物能够更有效地针对实体瘤进行治疗。
65.在一个方面,本发明提供一种分离的重组溶瘤腺病毒,其中该重组溶瘤腺病毒为选择复制型溶瘤腺病毒,该重组溶瘤腺病毒的基因组中携带(整合)有能够在肿瘤细胞和/或癌细胞中抑制pdl1表达的外源shrna的编码序列,并且携带(整合)有外源抗原的编码序列;其中所述外源抗原为包含cd19抗原表位的蛋白,并且所述外源抗原能够经表达而修饰在所述肿瘤细胞和/或癌细胞的表面,并能被靶向所述外源抗原的免疫治疗药物特异性识别。
66.在一些实施方案中,所述外源shrna的编码序列以及外源抗原的编码序列各自独立地在外源启动子的控制下,并分别与外源启动子可操作地连接。所述外源shrna的编码序列的外源启动子包括:u6启动子。所述外源抗原的外源启动子包括:ef1α启动子、cmv启动子、pkg启动子、e2f启动子、afp启动子和tert启动子。
67.在一些实施方案中,所述外源抗原具有可操作地连接的胞外抗原决定区、间隔部分和跨膜部分,能够经表达而修饰在所述肿瘤细胞和/或癌细胞的表面;所述胞外抗原决定区的氨基酸序列可以含有一个或多个cd19抗原表位多肽的氨基酸序列,例如可以含有有1-3个cd19抗原表位多肽的氨基酸序列。
68.在一些实施方案中,所述包含cd19抗原表位的蛋白不具有cd19胞内信号传导功能,并且所述包含cd19抗原表位的蛋白包括:截短的cd19蛋白、包含cd19的至少一个c2ig样结构域的融合蛋白、或包含cd19抗原表位的融合蛋白。优选的是,所述cd19来源于哺乳动物;还优选的是,所述哺乳动物选自人、小鼠或兔。
69.人cd19的全长氨基酸序列是已知的,可为(例如):genebank编号:aah06338.1;ncbi reference sequence(ncbi参考序列):np_001761.3等(参见https://
www.ncbi.nlm.nih.gov)。
70.优选的是,所述包含cd19抗原表位的蛋白为截短的cd19,其具有cd19的胞外区、cd19的跨膜结构域,而不具有cd19的胞内区或仅具有cd19的部分胞内区,从而缺失cd19胞内信号传导功能。在一些优选实施方案中,截短的cd19为截短的人cd19。在一些优选实施方案中,截短的人cd19的氨基酸序列长为316个aa,具体序列如下所示(seq id no.32):mppprllffllfltpmevrpeeplvvkveegdnavlqclkgtsdgptqqltwsresplkpflklslglpglgihmrplaiwlfifnvsqqmggfylcqpgppsekawqpgwtvnvegsgelfrwnvsdlgglgcglknrssegpsspsgklmspklyvwakdrpeiwegeppclpprdslnqslsqdltmapgstlwlscgvppdsvsrgplswthvhpkgpksllslelkddrpardmwvmetglllprataqdagkyychrgnltmsfhleitarpvlwhwllrtggwkvsavtlaylifclcslvgilhlqra。其核苷酸序列如seq id no.20所示。
71.在一些优选实施方案中,所述外源抗原的氨基酸序列如seq id no.32所示,或者具有与seq id no.32所示氨基酸序列至少97%、优选至少98%、更优选至少99%的一致性;进一步地,或者具有与seq id no.32所示氨基酸序列至少99.1%、99.4%、99.7%的一致性。
72.在一些优选实施方案中,所述外源shrna的编码序列如seq id nos.7、10和13中的任一者所示。
73.优选地,所述重组溶瘤腺病毒的基因组中缺失了e1b19k基因、e1b55k基因、和全部e3区基因。
74.溶瘤病毒进入肿瘤细胞后导致肿瘤细胞裂解的可能作用机制还有:(1)病毒蛋白的直接细胞毒作用:如腺病毒产生的死亡蛋白?和晚期蛋白都能有效地介导肿瘤细胞裂解。(2)产生抗肿瘤免疫反应:一方面,病毒可通过增强肿瘤细胞对多种细胞因子的敏感性而起到杀瘤作用,如腺病毒通过在感染的肿瘤细胞内复制和表达e1a蛋白,增强肿瘤坏死因子所介导的杀瘤作用;另一方面当肿瘤细胞被病毒感染后,肿瘤细胞表面的病毒抗原与主要组织相容性复合体ⅰ类抗原形成复合物,很容易被细胞毒性t淋巴细胞所识别,从而介导对病毒感染的肿瘤细胞的特异性攻击。(3)增强肿瘤细胞对放化疗的敏感性:腺病毒e1a基因表达的产物就是一种强有力的化学增敏剂,在肿瘤细胞中e1a基因的表达产物可诱导p53蛋白的高水平表达,并以此增强化疗和放疗对dna的损伤作用。
75.因此,优选地,所述重组溶瘤腺病毒的基因组中包含e1a基因编码序列。还优选地,所述e1a基因编码序列是在cmv启动子控制下的,从而通过增加e1a的表达来增强其对肿瘤细胞的溶瘤杀伤效果。
76.优选地,所述重组溶瘤腺病毒是对5型腺病毒进行基因改造而得到的。5型腺病毒的一个例子为h101。
77.在一个优选实施方案中,所述溶瘤腺病毒基因组在es序列后整合了包括u6启动子和人pdl1shrna(shpdl1)的编码框,以及包括ef1α启动子和截短的人cd19编码序列的编码框,还包括cmv启动子、e1a编码区及其部分3’端utr区和sv40polya在内的e1a表达框。
78.本发明的重组溶瘤腺病毒对多种人肿瘤细胞(例如人卵巢癌skov3细胞、人神经胶质细胞瘤细胞u251、人肺癌细胞a549、人宫颈癌细胞hela、人大细胞肺癌h460、人结直肠癌细胞hct116、人胰腺癌细胞panc1、人结肠癌细胞ht29等)具有较强的杀伤能力。该病毒在人正常原代细胞中的复制能力远远低于其在人肿瘤细胞中的复制能力(相差约2个数量级)。
该病毒所表达的人shpdl1能够显著降低人肿瘤细胞内高表达的pdl1蛋白水平。
79.该溶瘤腺病毒具有较强的杀瘤能力,并且在正常细胞中的复制能力远远低于其在肿瘤细胞中的复制能力,因此对正常细胞的毒性小,提高了安全性。
80.根据本发明,所述外源抗原能够经表达而修饰在肿瘤细胞和/或癌细胞的表面,并能被靶向所述外源抗原的免疫治疗药物特异性识别。在一些实施方案中,所述免疫治疗药物包括:靶向cd19的嵌合抗原受体修饰的免疫细胞,和/或靶向cd19的抗体;其中所述靶向cd19的抗体包括:靶向cd19的双特异性抗体,靶向cd19的抗体偶联药物,和/或靶向cd19的fc工程化抗体。所述靶向cd19的抗体能够招募体内免疫细胞。还优选的是,所述靶向cd19的抗体包括:靶向cd19的双特异性抗体,和/或靶向cd19的fc工程化抗体。
81.在一些实施方案中,所述的嵌合抗原受体修饰的免疫细胞包括原始t细胞或其前体细胞,nkt细胞,t细胞株或nk细胞。
82.所述嵌合抗原受体包括可操作地连接的、依次串联的抗原结合结构域、间隔区、跨膜区和胞内结构域,所述抗原结合结构域能够特异性识别并结合所述标记性多肽的所述胞外抗原决定区,所述间隔区用于间隔抗原结合结构域和跨膜区,所述胞内结构域用于信号传递。
83.本发明所述术语“抗原结合结构域”、“间隔区”、“跨膜区”、“胞内结构域”的定义可参考“《免疫学导论》,于善谦,高等教育出版社,2008”;以及“《immunobiology》,第七版,kenneth murphy,paul travers,mark walport等”。
84.所述抗原结合结构域优选是包括轻链和重链的单链抗体(scfv),该轻链和重链可以通过一段连接子彼此连接。在本发明的一个实施方案中,抗cd19car的抗原结合结构域为本领域已知的人cd19的鼠源抗体(fmc63)scfv序列。
85.所述嵌合抗原受体对免疫细胞的修饰可以通过慢病毒感染和mrna电转。
86.在一些实施方案中,所述靶向cd19的嵌合抗原受体修饰的免疫细胞包括(但不限于):已获批上市的car-t产品:诺华(novartis)的kymriah(主要用于b细胞急性淋巴性白血病的治疗),吉利德(kite)的yescarta(主要用于b细胞非霍奇金淋巴瘤治疗),和tecartus(用于复发或难治性套细胞淋巴瘤治疗);以及其它已上市或尚未上市的靶向cd19的car-t产品以及car-nk产品。
87.在一些实施方案中,所述靶向cd19的抗体包括靶向cd19的双特异性抗体。双特异性抗体(bispecific antibodies,bsabs)是一种可以与相同或不同抗原上的不同表位结合的抗体结构。目前双特异性抗体被广泛应用于肿瘤治疗领域,比如将抗cd3抗体与肿瘤靶向抗体进行组合,所构建的双特异性抗体可招募t细胞接近肿瘤细胞,起到介导t细胞杀伤肿瘤细胞的作用。在一些实施方案中,靶向cd19的抗体包括靶向cd19和靶向cd3的双特异性抗体。所述靶向cd19和靶向cd3的双特异性抗体包括(但不限于):已获批上市的美国amgen公司的blincyto(blinatumomab);以及其它已上市或尚未上市的靶向cd19和靶向cd3的双特异性抗体。
88.在一些实施方案中,所述靶向cd19的抗体包括靶向cd19的抗体偶联药物。所述靶向cd19的抗体偶联药物包括(但不限于):immunogen公司的sar3419;adc therapeutics公司的loncastuximab tesirine;以及其它已上市或尚未上市靶向cd19的抗体偶联药物。
89.在一些实施方案中,所述靶向cd19的抗体包括靶向cd19的fc工程化抗体。mab的抗
癌作用主要由fcγ受体介导的细胞毒性作用(adcc)、补体依赖的细胞毒性作用(cdc)或抗体依赖细胞吞噬作用。因此对抗体fc段进行修饰可提高抗体的细胞毒性作用。在一些实施方案中,靶向cd19的fc工程化抗体包括(但不限于):morphosys公司的cd19抗体tafasitamab;astrazeneca公司的cd19抗体medi-551;以及其它已上市或尚未上市的靶向cd19的fc工程化抗体。tafasitamab是一种靶向cd19的人源化fc增强单克隆抗体,其fc结构域进行了修饰(包含2个氨基酸取代s239d和i332e),通过提高对效应细胞上激活型fcγriiia的亲和力,来增强抗体依赖性细胞介导的细胞毒性(adcc)和抗体依赖性细胞吞噬(adcp)效应。medi-551是fc段糖基化修饰的人源化抗cd19单克隆抗体,通过除去fc段n端多聚糖区的核心海藻糖的方法增加对fcγriiia的亲和力。
90.在另一个方面,本发明提供一种药物组合物,其中该药物组合物包括作为活性成分的所述的重组溶瘤腺病毒,及可药用辅料。
91.在一些实施方案中,所述药物组合物包含5
×
10
7-5
×
10
12
vp的所述重组溶瘤腺病毒。
92.在一些实施方案中,所述重组溶瘤腺病毒通过瘤内注射给药、腹膜内给药、蛛网膜下腔内给药、或静脉给药。
93.在另一个方面,本发明提供一种用于制备本发明所述的重组溶瘤腺病毒的载体,其中所述载体包含在启动子控制下的外源shrna编码序列,该shrna编码序列如seq id nos.7、10和13中的任一者所示。所述载体还包含在启动子控制下的外源抗原的编码序列,所述外源抗原的编码序列如seq id no.20所示。
94.在一些实施方案中,所述载体采用pshuttle作为基本骨架,并且在该基本骨架中依次包含可操作地连接的、控制所述外源shrna编码序列表达的启动子及所述外源shrna编码序列、控制所述外源抗原编码序列表达的启动子及所述外源抗原的编码序列、控制所述e1a基因编码序列表达的启动子及所述e1a基因编码序列。其中,控制所述外源抗原编码序列表达的启动子及所述外源抗原的编码序列可与控制所述外源shrna编码序列表达的启动子及所述外源shrna编码序列反向连接。
95.在另一个方面,本发明提供一种含有本发明所述的载体的宿主细胞。优选地,所述宿主细胞稳定表达所述载体。
96.在另一个方面,本发明还提供了所述重组溶瘤腺病毒用于制备用于治疗肿瘤和/或癌症的药物中的用途。
97.在一些实施方案中,所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
98.在另一个方面,本发明提供一种用于治疗肿瘤和/或癌症的治疗剂,包含:
99.(a)第一组合物,其中该第一组合物包含位于第一可药用载体中的第一活性成分,该第一活性成分包括或含有用于导入肿瘤细胞和/或癌细胞的本发明所述的重组溶瘤腺病毒;和
100.(b)第二组合物,其中该第二组合物包含位于第二可药用载体中的第二活性成分,该第二活性成分包含本发明所述的免疫治疗药物。
101.优选地,在本发明的治疗剂中,所述第一组合物和所述第二组合物各自独立地存在于所述治疗剂中而互不混合。
102.在一些实施方案中,所述第一可药用载体和第二可药用载体是相同的。在另一些实施方案中,所述第一可药用载体和第二可药用载体是不同的。
103.在一些情况下,所述治疗剂也可以理解为药物的组合。
104.优选地,所述第一组合物包含治疗有效量的所述重组溶瘤腺病毒(优选地,所述第一组合物包含5
×
10
7-5
×
10
12
vp/天剂量的所述重组溶瘤腺病毒,更优选包含5
×
107至1.5
×
10
12
vp/天剂量的所述重组溶瘤腺病毒,更优选包含5
×
108至1
×
10
12
vp/天剂量的所述重组溶瘤腺病毒,更优选包含1
×
109至5
×
10
11
vp/天剂量的所述重组溶瘤腺病毒,还更优选包含3
×
10
10
至3
×
10
11
vp/天剂量的所述重组溶瘤腺病毒)。
105.在一些实施方案中,所述第一药物组合物的活性成分为所述重组溶瘤腺病毒。
106.所述重组溶瘤腺病毒可采用本领域通常所采用的给药方式给药,例如可配制成通过瘤内注射给药、腹膜内给药、蛛网膜下腔内给药、或静脉给药。
107.所述第二组合物包含治疗有效量的所述免疫治疗药物。
108.优选地,所述第二组合物包含治疗有效量的本发明所述的免疫细胞(嵌合抗原受体修饰的免疫细胞)。优选地,所述第二组合物包含每个疗程总剂量范围为1
×
10
3-1
×
109个细胞/kg体重的所述免疫细胞。
109.所述免疫细胞可以配制成通过经动脉、静脉、皮下、皮内、瘤内、淋巴管内、淋巴结内、蛛网膜下腔内、骨髓内、肌肉内和腹膜内给药。
110.优选地,所述治疗剂由所述第一组合物和所述第二组合物组成。
111.本领域的技术人员可以理解,本发明的治疗剂还可包含合适的可药用的辅料,包括药用或生理载体、赋形剂、稀释剂(包括生理盐水、pbs溶液)、以及各种添加剂,包括糖类、脂类、多肽、氨基酸、抗氧化剂、佐剂、保鲜剂等。
112.在另一个方面,本发明还提供了所述的治疗剂在制备用于治疗肿瘤和/或癌症的药物中的用途。
113.所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
114.在另一个方面,本发明还提供了一种用于治疗肿瘤和/或癌症的具有协同作用的联合药物的药盒,包括:
115.第一容器,该第一容器装有根据本发明所述的治疗剂中的第一组合物;
116.第二容器,该第二容器装有根据本发明所述的治疗剂中的第二组合物,其中所述第一容器和所述第二容器是独立的;以及
117.载明给药时机和给药方式的说明书。
118.本发明还提供了所述的药盒在制备用于治疗或预防肿瘤和/或癌症的药物中的用途。
119.所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
120.在另一个方面,本发明还提供了一种治疗肿瘤和/或癌症的方法,包括:
121.对肿瘤和/或癌症患者施用根据本发明所述的治疗剂中的第一组合物;和
122.对所述肿瘤和/或癌症患者施用根据本发明所述的治疗剂中的第二组合物。
123.所述治疗剂中的第一组合物和第二组合物可以同时(例如,作为混合物同时瘤内注射)、分开但同时(例如,分别通过瘤内和静脉注射给药)或依次施用(例如,首先施用第一组合物,然后施用第二组合物;或者首先施用第二组合物,然后施用第一组合物)。
124.优选地,所述方法包括以下依次进行的步骤:
125.1)对所述肿瘤和/或癌症患者施用所述第一组合物;和
126.2)在施用所述第一组合物之后,对所述肿瘤和/或癌症患者施用所述的治疗剂中的第二组合物。
127.优选地,在首先施用所述第一组合物之后的第1-30天,对所述肿瘤和/或癌症患者施用所述的治疗剂中的第二组合物。
[0128]“在首先施用所述第一组合物之后的第1-30天,对所述肿瘤和/或癌症患者施用所述的治疗剂中的第二组合物”是指首次第二组合物的施用与首次第一组合物施用的时间间隔为1-30天(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30天),或首次第二组合物的施用与在其之前最相邻一次的所述第一组合物施用的时间间隔为1-30天(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30天)。优选地,首次第二组合物的施用与在其之前最相邻一次的所述第一组合物施用的时间间隔为1-14天(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14天)。
[0129]
在一些优选实施方案中,所述重组溶瘤腺病毒的施用剂量为5
×
10
7-5
×
10
12
vp/天,每天1-2次,连续施用1-7天,或上述范围间的任何值。
[0130]
在一些优选实施方案中,所述免疫细胞(嵌合抗原受体修饰的免疫细胞)的施用剂量为,每个疗程总剂量范围为1
×
10
3-1
×
109个细胞/kg体重。优选地,1天施用1-3次,连续施用1-7天。
[0131]
在某些实施方案中,所述治疗肿瘤和/或癌症的方法还包括对患者施用其它用于治疗肿瘤和/或癌症的药物,和/或用于调节患者免疫系统的药物,以增强所述免疫细胞在体内的数量和功能。所述其它用于治疗肿瘤和/或癌症的药物包括但不限于:化疗药物,例如环磷酰胺、氟达拉滨(fludarabine);放疗药物;免疫抑制剂,例如环孢素、硫唑嘌呤、甲氨蝶呤、麦考酚酯(mycophenolate)、fk50;抗体,例如抗cd3、il-2、il-6、il-17、tnfα的抗体。
[0132]
所述重组溶瘤腺病毒可配制成通过瘤内注射给药、腹膜内给药、蛛网膜下腔内给药、或静脉给药。
[0133]
所述免疫细胞可配制成通过经动脉、静脉、皮下、皮内、瘤内、淋巴管内、淋巴结内、蛛网膜下腔内、骨髓内、肌肉内和腹膜内给药。
[0134]
所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
[0135]
以下通过例子的方式进一步解释或说明本发明的内容,但这些例子不应被理解为对本发明的保护范围的限制。
[0136]
例子
[0137]
以下除非特别说明,否则以下例子中所用实验方法均使用生物工程领域的常规实验流程、操作、材料和条件进行。
[0138]
以下除非特别说明,否则各试剂的百分浓度(%)均指该试剂的体积百分浓度(%(v/v))。
[0139]
材料和方法
[0140]
细胞ad293、293t、mrc-5、hela、a549、u251、hct116、panc1、ht29、h460、mda-mb-231、skov3购自atcc;huvec购自澳赛尔斯生物技术(上海)有限公司。
[0141]
溶瘤腺病毒h101购自上海三维生物技术有限公司。
[0142]
小鼠购自北京维通利华实验动物技术有限公司。
[0143]
pbs配方:8mm na2hpo4、136mm nacl、2mm kh2po4、2.6mm kcl,ph7.2-7.4。
[0144]
细胞株用rpmi-1640完全培养基(lonza,cat#12-115f)维持培养,rpmi-1640完全培养基中加入10%小牛血清fbs(atcc30-2020),2mmol/l l-谷氨酸,100μg/ml青霉素和100μg/ml链霉素。
[0145]
外周血:试验所用人外周血制品来自于健康供者。
[0146]
培养板来源:各例子中采用的6孔细胞培养板(每孔培养基体积为2ml)、12孔细胞
培养板(每孔培养体积1ml)、16孔细胞培养板(每孔培养体积200μl)、24孔细胞培养板(每孔培养体积500μl)、96孔细胞培养板(每孔培养体积100μl)均得自corning公司。
[0147]
制备例1:e1a基因表达载体构建
[0148]
根据ncbi(即,美国国立生物技术信息中心,网址:https://www.ncbi.nlm.nih.gov)的genbank中的人5型腺病毒(ad5)基因组dna序列(accession:ac_000008)设计两条pcr引物(p1:ggaagatctggactgaaaatgag(seq id no.1),p2:tgaggtcagatgtaaccaagatta(seq id no.2);注:引物p1的5’端加入了bglii酶切位点,下划线标出);提取上海三维生物技术有限公司生产的溶瘤病毒(h101)基因组dna做为模板,进行高保真pcr扩增ad5基因组dna上551-1714之间1164bp的序列,实际大小为1173bp(见图1),该段序列包括e1a基因的编码区(不包括e1a启动子序列)和部分的3’utr区。利用bglii酶切获得的pcr产物,并将其克隆至载体pshuttle-cmv(购自agilent公司)上多克隆位点区(mcs)中的bglii和ecorv位点之间,获得中间载体pshuttle-e1a,所得pshuttle-e1a阳性克隆用p1和p2进行pcr筛选确认,结果见图2,构建过程见图3。对获得阳性克隆进行测序,测序结果与ad5基因组dna上的对应序列完全一致。
[0149]
再次设计pcr引物p3和p4(p3:cgcgtcgactactgtaatagtaatcaattacgg(seq id no.3)和p4:gacgtcgactaagatacattgatgagtttggac(seq id no.4);注:两条引物的5’端均加入了sali酶切位点,下划线标出),以获得的pshuttle-e1a阳性克隆为模板进行高保真pcr扩增,pcr产物包含cmv启动子、e1a基因片段和sv40polya在内的e1a表达框,pcr产物大小为2017bp(图4)。
[0150]
将获得的e1a表达框的pcr产物进行sali酶切后克隆到pshuttle载体(购自agilent公司)上mcs区中的sali位点中,利用p3和p4引物进行pcr筛选插入e1a表达框的阳性克隆(图5),并用bglii进行酶切进行确认,e1a表达框正向插入的克隆经bglii酶切后将产生7200bp和1400bp两条片段,e1a表达框反向插入的克隆经bglii酶切后将产生7970bp和630bp两条片段(图6),选择图6中#2质粒进行后续试验。最终获得中间载体pshuttle-mcs-e1a,构建过程见图7。对获得的pshuttle-mcs-e1a阳性克隆进行测序,结果与预期序列完全一致。
[0151]
制备例2:shrna表达载体构建
[0152]
根据ncbi网站上genbank中的人pdl1variant1序列(accession:nm_014143)设计了分别靶向其编码区mrna的168-190、430-452和589-611三个区域的三条shrna序列(shpdl1-1(或称shpdl1-#1)、shpdl1-2(或称shpdl1-#2)和shpdl1-3(或称shpdl1-#3),分别为seq id no.7、seq id no.10、seq id no.13),除此之外,还设计了一个与人pdl1mrna无关的一个阴性对照序列shpdl1-nc。序列如下:
[0153]
(1)shpdl1-1
[0154]
合成正义序列(seq id no.5):
[0155][0156]
合成反义序列(seq id no.6):
[0157][0158]
shrna dna(seq id no.7):
[0159][0160]
(2)shpdl1-2
[0161]
合成正义序列(seq id no.8):
[0162][0163]
合成反义序列(seq id no.9):
[0164][0165]
shrna dna(seq id no.10):
[0166][0167]
(3)shpdl1-3
[0168]
合成正义序列(seq id no.11):
[0169][0170]
合成反义序列(seq id no.12):
[0171][0172]
shrna dna(seq id no.13):
[0173][0174]
(4)shpdl1-nc
[0175]
合成nc正义序列(seq id no.14):
[0176][0177]
合成nc反义序列(seq id no.15):
[0178][0179]
shnc dna(seq id no.16):
[0180]
[0181]
利用shrna序列两端预留的可以与bbsi和hindiii互补的粘性末端将四段序列连接到psgu6/gfp/neo载体(购自上海生工生物技术有限公司)上的bbsi和hindiii位点之间获得四个可以表达shpdl1的载体(psgu6/gfp/neo-shpdl1-nc、psgu6/gfp/neo-shpdl1-1、psgu6/gfp/neo-shpdl1-2和psgu6/gfp/neo-shpdl1-3)。
[0182]
试验例1:shpdl1的抑制效果检测
[0183]
在u251和h460细胞中检测shpdl1对hpdl1 mrna(人pdl1 mrna)的抑制效果。首先在12孔板中以每孔2
×
105个细胞提前12小时接种u251和h460,每个孔以4μl lipofectamin 2000:1.6μg shrna表达载体dna的比例关系转染u251和h460,分别在24小时和48小时收取两份细胞样品,提取总rna并进行反转录后以gapdh基因的mrna水平作为对照进行real-time pcr检测细胞中人pdl1 mrna的表达水平,结果显示与对照相比shpdl1-#1、2、3均在一定时间内产生对hpdl1 mrna的抑制作用,其中shpdl1-#1对hpdl1 mrna的抑制效果最显著(图8)。
[0184]
另外也在蛋白水平上对三个shpdl1的抑制效果进行了检测。将4个质粒psgu6/gfp/neo-shpdl1-nc(即“psgu6-shrna-nc”)、psgu6/gfp/neo-shpdl1-1(即“psgu6-shpdl1#1”)、psgu6/gfp/neo-shpdl1-2(即“psgu6-shpdl1#2”)和psgu6/gfp/neo-shpdl1-3(即“psgu6-shpdl1#3”)分别与pcdna3.3-hpdl1-3
×
flag等摩尔比(1:1)瞬间转染293t细胞,其中质粒pcdna3.3-hpdl1-3
×
flag可以表达融合了3
×
flag标签的人pdl1蛋白。48小时后收取细胞样品,裂解后进行western blot分析,结果(见图9)证明shpdl1-#1能够显著降低过表达的hpdl1。
[0185]
上述pcdna3.3-hpdl1-3
×
flag质粒的构建过程如下:首先根据ncbi中人pdl1基因的mrna序列设计两条引物(p13:cgcgtcgacatgaggatatttgctgtctttat(seq id no.17),p14:ccgctcgagcgtctcctccaaatgtgtatcac(seq id no.18)),利用trizol提取u251细胞的总rna,以该rna为模板进行rt-pcr获得hpdl1cdna并将其克隆至pshuttle-ires-hrgfp-1载体(购自agilent公司)中,使hpdl1与下游的flag标签融合表达,获得中间载体pshuttle-hpdl1-ires-hrgfp-1。再次设计一条引物(p15:cgcctattacacccactcgtgcag(seq id no.19))与p13联合扩增pshuttle-hpdl1-ires-hrgfp-1上的一段包括hpdl1cdna-flag-ires-hrgfp的序列,将该段片段克隆至pcdna3.3-topo载体(购自invitrogen公司)上,最后获得pcdna3.3-hpdl1-flag载体。插入的片段经过测序确认序列完全正确。
[0186]
制备例3:shrna和外源抗原的表达载体构建
[0187]
1.在确定了shpdl1的抑制效果后,将包括u6启动子和shpdl1全部序列在内的编码框克隆到pshuttle-mcs-e1a中。首先利用saci酶切psgu6/gfp/neo-shpdl1载体,然后利用t4dna聚合酶将saci酶切后形成的粘性末端进行切平处理后进行乙醇/乙酸铵沉淀回收,最后再用kpni酶切后回收包括u6启动子和shpdl1序列在内的编码框序列;同时利用kpni和ecorv双酶切pshuttle-mcs-e1a载体并回收,最后将3个shpdl1编码框分别连接到pshuttle-mcs-e1a载体上得到最终的载体pshuttle-u6-shpdl1-cmv-e1a,过程见图10。选取几个菌落提取质粒后进行kpni/hindiii酶切鉴定,正确克隆将产生一条大小为370bp的条带(见图11)。选取酶切正确的pshuttle-u6-shpdl1-cmv-e1a质粒进行测序,测序结果完全正确。
[0188]
2.根据ncbi网站上genbank中的人cd19的cdna序列(accession:bc006338.2)选取
其中对应cd19蛋白胞外区、跨膜区和部分胞内区的cdna序列(cd19m)(seq id no.20),与人延伸因子α启动子(ef1α)序列(seq id no.21)和牛生长激素polya序列(bghpa)(seq id no.22)通过重叠延伸pcr方法(所用引物为p5-p10)组成包含三者序列的表达框(ef1α cd19m bghpa)(seq id no.23),最后通过表达框两侧预留的noti酶切位点将其亚克隆至pshuttle-u6-shpdl1-cmv-e1a中唯一的noti中,通过菌落pcr方法(所用引物为p11-p12)筛选有表达框序列插入的转化子(图12),选取其中的3个pcr鉴定阳性克隆进行测序,最后挑选测序结果正确且表达框反向插入的质粒pshuttle-u6-shpdl1-ef1a-cd19m-bpa-cmv-e1a(图13)进行后面的质粒重组和病毒包装。
[0189]
本步骤中需要用到的引物序列和ef1α cd19m bghpa表达框序列如下:
[0190]
引物序列如下:
[0191]
p5:5’gcggccgcggctccggtgcccgtcagtgg3’(seq id no.24)
[0192]
p6:5’gcggccgcccatagagcccaccgcatccc3’(seq id no.25)
[0193]
p7:
[0194]5’
ccatttcaggtgtcgtgatctagagctagcgaattcccatgccacctcct cgcctcctc3’(seq id no.26)
[0195]
p8:
[0196]5’
gaggaggcgaggaggtggcatgggaattcgctagctctagatcacgaca cctgaaatgg 3’(seq id no.27)
[0197]
p9:
[0198]5’
attcttcatcttcaaagagcctgatgtgccttctagttgccagccatc3’(seq id no.28)
[0199]
p10:
[0200]5’
gatggctggcaactagaaggcacatcaggctctttgaagatgaagaat3’(seq id no.29)
[0201]
p11:5’ccatagagcccaccgcatccccagc3’(seq id no.30)
[0202]
p12:5’tgactgtgccttctagttgccagc3’(seq id no.31)
[0203]
制备例4:溶瘤腺病毒(oad-shpdl1-cd19m)的基因组dna的制备
[0204]
将根据制备例3的方法获得的质粒pshuttle-u6-shpdl1-ef1a-cd19m-bpa-cmv-e1a利用pmei酶切将其线性化后转入bj5183菌中,与其中包含ad5腺病毒基因组dna(缺失e1和e3区)的padeasy-1质粒进行同源重组,从而获得可以表达目的基因(cd19m和pdl1shrna)的并能进行复制的溶瘤腺病毒oad-shpdl1-cd19m的基因组dna(padeasy-u6-shpdl1-ef1ap-cd19m-bpa-cmv-e1a)。对获得的阳性克隆中的插入序列(shpdl1编码框、cd19m表达框和e1a表达框)进行测序,测序结果显示插入序列完全正确。图14示出所得的溶瘤腺病毒oad-shpdl1-cd19m的基因组的结构示意图。
[0205]
制备例5:溶瘤腺病毒(oad-shpdl1-cd19m)的包装与扩增
[0206]
(1)包装溶瘤腺病毒(oad-shpdl1-cd19m)的基因组dna的准备
[0207]
取2μg padeasy-u6-shpdl1-ef1ap-cd19m-bpa-cmv-e1a质粒dna,加入2μl paci酶,37℃反应2小时后进行乙醇乙酸铵沉淀dna,70%乙醇漂洗后将dna沉淀溶解于10μl洁净的ddh2o中,然后进行ad293细胞转染。
[0208]
(2)溶瘤腺病毒(oad-shpdl1-cd19m)的包装
[0209]
提前一天将生长状态良好的ad293细胞接种于6孔板中,细胞接种数量以第二天进
行转染实验时细胞覆盖率60-70%为宜。将准备好的约2μg线性化dna与qiagen公司的6μl attractene转染试剂混匀后加入ad293细胞中,十字混匀后放入细胞培养箱(37℃,5%co2)中继续培养约10-14天,中间每隔2-3天观察细胞病变情况。待出现小片细胞变为“念珠状”,范围逐渐扩大直至细胞大量脱落即可轻轻吹打细胞回收细胞和培养上清,保存于-80℃冰箱或直接进行进一步扩增。
[0210]
(3)溶瘤腺病毒(oad-shpdl1-cd19m)的扩增
[0211]
同样提前一天将生长状态良好的ad293细胞接种于6cm细胞培养皿中,细胞接种数量以第二天进行转染实验时细胞覆盖率70-80%为宜。每个6cm细胞培养皿加入前面收集的病毒上清800-1000μl,同样十字混匀后放回细胞培养基继续培养。通常48小时后可见细胞大量变圆并脱落,此时可收集细胞和培养上清。接下来继续放大在10cm细胞培养皿中扩增病毒,接种病毒时细胞密度同样以约70%为宜,每个10cm细胞培养皿加入前面收集的病毒上清1200-1500μl,同样48小时后应该可见细胞大量病变脱落,回收细胞和上清。最终放大到15cm培养皿中扩增病毒,细胞密度约为70%时加入10cm培养皿收集的病毒培养上清2ml,混匀后继续培养48小时收集细胞和培养上清。后面可在15cm培养皿中循环扩增病毒至所需病毒量。
[0212]
(4)溶瘤腺病毒(oad-shpdl1-cd19m)滴度的测定
[0213]
采用hexon染色计数法测定获得的病毒上清中的活性病毒颗粒数(单位:pfu/ml)。本发明纯化后的溶瘤腺病毒(oad-shpdl1-cd19m)的滴度达到3.38
×
10
11
pfu/ml。
[0214]
实施例1:溶瘤腺病毒(oad-shpdl1-cd19m)的体外功能验证
[0215]
本实施例从两个方面检测按照制备例5所述方法获得的溶瘤腺病毒oad-shpdl1-cd19m的功能:不同感染复数(moi)的溶瘤腺病毒oad-shpdl1-cd19m在肿瘤细胞中cd19m的表达效率和对肿瘤细胞的杀伤能力;oad-shpdl1-cd19m与靶向cd19的car-t细胞对肿瘤细胞的联合杀伤效果的检测。
[0216]
a.不同感染复数的溶瘤腺病毒oad-shpdl1-cd19m感染肿瘤细胞时cd19m的表达效率和对肿瘤细胞的杀伤能力。
[0217]
在实验前12h将处于对数生长期的人卵巢癌细胞株skov3和人胰腺癌细胞株panc1分别接种于两套24孔板中,细胞接种数量为1
×
104个。第二天早上分别使用不同感染复数(moi)的oad-shpdl1-cd19m(moi分别为10moi、20moi、50moi和100moi)接种于培养孔中,继续共培养48h后用胰酶消化并收集细胞,加入apc-anti humancd19抗体(bd公司,货号:555415)和fixable viability dye(fvs)680(bd公司货号:565388)两种抗体与收集的细胞共孵育,而后进行流式检测分析,结果见表1。结果显示,不同moi的oad-shpdl1-cd19m感染两种肿瘤细胞48hr,表达的cd19m可以呈现在肿瘤细胞的细胞膜上,表达率随着moi的升高呈现剂量依赖关系,并且对两种肿瘤细胞的杀伤随着moi的升高呈现剂量依赖关系。
[0218]
表1 溶瘤腺病毒oad-shpdl1-cd19m感染肿瘤细胞时cd19m的表达效率和对肿瘤细胞的杀伤能力
[0219][0220]
b.oad-shpdl1-cd19m与靶向cd19的car-t细胞对肿瘤细胞的联合杀伤效果的检测。
[0221]
mock-t细胞(“对照t”)(即,未做任何处理的t细胞,作为阴性对照t细胞)由pbmc诱导分化制备得到,靶向cd19的car-t细胞由表达抗cd19car的慢病毒感染诱导分化后的pbmc制备得到,表达抗cd19car的慢病毒由抗cd19car慢病毒质粒包装后获得。具体制备方法可参照中国专利申请公开no.cn110856724a中制备例2和8所述的方法,其中抗cd19car的抗原结合结构域为本领域已知的人cd19的鼠源抗体(fmc63)scfv序列。
[0222]
按照表2中所示,第0天,将处于对数生长期的人卵巢癌细胞株skov3接种于细胞实时杀伤检测仪(即xcelligence rtca s16实时无标记细胞功能分析仪,购自acea bio公司)适用的16孔细胞培养板中,每孔细胞接种量为5000个,第
①
组中只接种5000个skov3细胞;第
②
组中,在第1天加入1.5
×
105pfu的oad-shpdl1-cd19m病毒(moi=30);第
③
组中,在第2天加入1.5
×
104pfu的mock-t细胞(e:t=3:1);第
④
组中,在第2天加入1.5
×
104pfu的靶向cd19的car-t细胞(e:t=3:1);第
⑤
组中,在第1天加入1.5
×
105pfu的oad-shpdl1-cd19m病毒(moi=30),在第2天加入1.5
×
104pfu的mock-t细胞(e:t=3:1);第
⑥
组中,在第1天加入1.5
×
105pfu的oad-shpdl1-cd19m病毒(moi=30),在第2天加入1.5
×
104pfu的靶向cd19的car-t细胞(e:t=3:1);表2各组中标记
“‑”
处分别加入与oad-shpdl1-cd19m病毒对应的洁净无菌的病毒保存液(即,含1mm mgcl2和10%甘油的10mm tris溶液(ph7.4))或与mock-t/car-t细胞对应的洁净无菌的pbs溶液,培养板加完病毒和免疫细胞外均应及时放回co2培养箱中并连接到检测设备上记录细胞的生长情况,实验结果见图15。
[0223]
表2 联合杀伤实验各组给药方案
[0224][0225]
如图15a所示,在单独使用oad-shpdl1-cd19m(moi=30)感染skov3(第
②
组)和单
独使用mock-t(第
③
组)或靶向cd19的car-t细胞(第
④
组)与skov3共培养(效靶比e:t=3:1)时与对照组(第
①
组)比较均能对skov3形成一定程度的杀伤;由于skov3细胞表面没有cd19分子,所以靶向cd19的car-t细胞不能对其形成有效的杀伤;当oad-shpdl1-cd19m感染肿瘤细胞一段时间后,其携带的可表达cd19m的表达框能够在skov3细胞表面呈现出cd19m分子,而且oad-shpdl1-cd19m所表达的pdl1shrna可以降低肿瘤表面的pdl1分子水平从而可以减弱由于肿瘤细胞表面pdl1与免疫细胞表面pd1的结合产生的免疫抑制,因此在第
⑤
组中使用oad-shpdl1-cd19m和mock-t先后处理skov3细胞后,oad-shpdl1-cd19m减弱肿瘤来源的免疫抑制后mock-t产生了比单独使用过病毒或免疫细胞更强的杀伤效果,但在第
⑥
组中使用oad-shpdl1-cd19m和靶向cd19的car-t细胞先后处理skov3细胞后,oad-shpdl1-cd19m减弱肿瘤来源的免疫抑制后而且在肿瘤细胞表面呈现了cd19m分子,更加增强了靶向cd19的car-t细胞的杀伤作用,因此产生更加迅速、更加显著的杀伤效果。并且,oad-shpdl1-cd19m与靶向cd19的car-t细胞对肿瘤细胞的联合杀伤效果在给药后一段时间内保持大于oad-shpdl1-cd19m对肿瘤细胞得杀伤效果与靶向cd19的car-t细胞对肿瘤细胞得杀伤效果的叠加效果,显示出了优异的协同效果。举例而言,对实验中间点66h时的细胞生长指数进行分析,计算肿瘤细胞生长抑制率(ir%),公式为:100%
×
(实验组细胞指数-skov3细胞指数)/skov3细胞指数(细胞指数(cell index)由rtca仪得到)。结果如图15b所示,重组溶瘤腺病毒oad-shpdl1-cd19m(第
②
组)、mock-t(第
③
组)或靶向cd19的car-t(第
④
组)单独作用,仅对skov3细胞的生长产生了较弱的抑制作用,重组溶瘤腺病毒oad-shpdl1-cd19m和mock-t联合作用组(第
⑤
组)对skov3细胞的生长产生了更大的抑制作用,而重组溶瘤腺病毒oad-shpdl1-cd19m和靶向cd19的car-t联合作用组(第
⑥
组)可以显著减少skov3细胞的数量,其杀伤的效果大于重组溶瘤腺病毒(第
②
组)和靶向cd19的car-t(第
④
组)单独作用的效果的叠加(如图15b中横虚线所示),因此产生了协同杀伤的效果。
[0226]
实施例2:溶瘤腺病毒(oad-shpdl1-cd19m)的体内功能验证
[0227]
通过将按照制备例5所述方法获得的溶瘤腺病毒oad-shpdl1-cd19m与按照实施例1所述方法获得的人靶向cd19的car-t细胞联合施加于ncg小鼠皮下接种的人卵巢癌细胞(skov3),验证两者在模拟人体环境的动物体内对人肿瘤细胞的联合杀伤作用。
[0228]
从江苏集萃公司购买60只ncg重度免疫缺陷小鼠,每只右前肢背部皮下接种3
×
106个生长状态良好的skov3细胞,等待7-10天左右,选取皮下肿瘤体积在90-110mm3的30只ncg小鼠分成6组(每组5只)进行体内实验。第1组为对照组,分别在第0天、第4天和第8天瘤内注射100μl溶瘤腺病毒保存液(即,含1mm mgcl2和10%甘油的10mm tris溶液(ph7.4)),分别在第2天、第6天和第10天静脉内注射100μl生理盐水;第2组为溶瘤腺病毒单独处理组,分别在第0天、第4天和第8天瘤内注射100μl溶瘤腺病毒(病毒数量为3
×
108pfu),分别在第2天、第6天和第10天静脉内注射100μl生理盐水;第3组为对照t细胞单独处理组,分别在第0天、第4天和第8天瘤内注射100μl溶瘤腺病毒保存液,分别在第2天、第6天和第10天静脉内注射100μl对照t细胞混悬液(细胞数量为5
×
106个);第4组为靶向cd19的car-t细胞单独处理组,分别在第0天、第4天和第8天瘤内注射100μl溶瘤腺病毒保存液,分别在第2天、第6天和第10天静脉内注射100μl靶向cd19的car-t细胞混悬液(细胞数量为5
×
106个);第5组为溶瘤腺病毒和对照t细胞联合处理组,分别在第0天、第4天和第8天瘤内注射100μl溶瘤腺病毒(病毒数量为3
×
108pfu),分别在第2天、第6天和第10天静脉内注射100μl对照t细胞混悬
液(细胞数量为5
×
106个);第6组为溶瘤腺病毒和靶向cd19的car-t细胞联合处理组,分别在第0天、第4天和第8天瘤内注射100μl溶瘤腺病毒(病毒数量为3
×
108pfu),分别在第2天、第6天和第10天静脉内注射100μl靶向cd19的car-t细胞混悬液(细胞数量为5
×
106个)。分别在第2、3、6、7、10和11天给所有组动物的颈部皮下注射10万iu的il-2。从动物分组当天开始计算,每周两次测量所有组动物皮下肿瘤的大小并记录。
[0229]
本发明设计并生产的溶瘤腺病毒是对腺病毒进行基因改造使其具有更高的肿瘤细胞复制特异性、能够敲低或沉默产生免疫抑制的关键蛋白从而减弱免疫抑制、能够表达一段截短型膜蛋白使被感染的肿瘤细胞易于为针对该类蛋白的免疫细胞所识别和杀伤,这样三重特性的一类溶腺病毒。该类溶瘤腺病毒的成功开发首先自身能够更大程度地溶解杀伤肿瘤细胞,另外在减弱免疫抑制和为肿瘤细胞人为添加靶标后募集并活化病人体内原有免疫细胞或过继性输注的基因修饰的淋巴细胞到肿瘤周围发挥双重的杀瘤作用,因此该种溶瘤腺病毒的成功开发非常有望在实体瘤治疗上实现一个实质性的突破。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。