人巨细胞病毒的ul18对t细胞应答的调节
1.相关申请的交叉引用
2.本技术要求于2019年8月20日提交的美国临时申请第62/889,310号的权益,所述美国临时申请特此通过全文引用的方式并入。
3.关于联邦赞助的研究和开发的声明
4.本发明是根据美国国家过敏和传染病研究所(national institute of allergy and infectious disease)授予的授权号ro1 ai059457和u19 a1128741在政府支持下进行的。政府拥有本发明的某些权利。
5.对以电子方式提交的序列表的引用
6.随申请一起提交的以ascii文本文件(名称:4153_013pc01_seqlisting_st25;大小:11,029字节;以及创建日期:2020年8月19日)以电子方式提交的序列表的内容通过全文引用的方式并入本文中。
背景技术:
7.先前已经证明,恒河猴巨细胞病毒(rhcmv)的病毒株68-1引起cd8 t细胞,所述细胞识别由mhc-ii和mhc-e而非常规的mhc-i呈递的肽。这种效应在食蟹猴cmv(cycmv)中得到了重现,因此证明需要使hcmv ul128、ul130、ul146和ul147的rhcmv和cycmv同源物缺失才能诱导mhc-e限制性cd8 t细胞(wo 2016/130693,wo 2018/075591)。另外,这些载体引起mhc-ii限制性cd8 t细胞。然而,将内皮细胞特异性微rna(mir)126的靶向位点插入到这些载体的基本病毒基因中消除了对mhc-ii限制性cd8 t细胞的诱导,从而产生了专门引起mhc-e限制性cd8 t细胞的“仅mhc-e”载体(wo 2018/075591)。相比之下,将骨髓细胞特异性mir142-3p插入到68-1rhcmv中可防止诱导mhc-e限制性cd8 t细胞,从而产生引起专门受mhc-ii限制的cd8 t细胞的载体(wo 2017/087921)。类似地,ul40同源物rh67的缺失可防止mhc-e限制性cd8 t细胞的诱导,从而产生“仅mhc-ii的载体”(wo2016/130693)。
技术实现要素:
8.本公开涉及一种重组人cmv(hcmv)载体,所述重组hcmv载体包括编码异源抗原的核酸序列,其中所述重组hcmv载体不表达ul18。
9.在一些实施例中,所述重组hcmv载体不表达ul128。在一些实施例中,所述重组hcmv载体不表达ul130。在一些实施例中,所述hcmv载体不表达ul128和ul130。
10.本公开还涉及一种hcmv载体,所述hcmv载体包括编码异源抗原的核酸序列,其中所述重组hcmv载体不表达ul18、ul128、ul130、ul146和ul147。
11.在一些实施例中,所述重组hcmv载体由于编码ul18、ul128、ul130、ul146或ul147的核酸序列中存在一个或多个突变而不表达ul18蛋白、ul128蛋白、ul130蛋白、ul146蛋白和ul147蛋白或其直系同源物。在一些实施例中,编码ul18、ul128、ul130、ul146或ul147的所述核酸序列中的所述突变选自由以下组成的组:点突变、移码突变、截短突变和编码病毒蛋白的整个核酸序列的缺失。
12.在一些实施例中,所述重组hcmv载体进一步包括编码ul40或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体进一步包括编码us28或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体不表达ul82(pp71)或其直系同源物。在一些实施例中,所述重组hcmv载体不表达us11或其直系同源物。
13.在一些实施例中,所述重组hcmv载体进一步包括编码微rna(mirna)识别元件(mre)的核酸序列,其中所述mre含有在内皮细胞中表达的微rna的靶位点。在一些实施例中,在内皮细胞中表达的所述mre是mir126、mir-126-3p、mir-130a、mir-210、mir-221/222、mir-378、mir-296和mir-328。
14.在一些实施例中,所述重组hcmv载体进一步包括编码微rna(mirna)识别元件(mre)的核酸序列,其中所述mre含有在骨髓细胞中表达的微rna的靶位点。在一些实施例中,在骨髓细胞中表达的所述mre是mir-142-3p、mir-223、mir-27a、mir-652、mir-155、mir-146a、mir-132、mir-21和mir-125。
15.在一些实施例中,所述异源抗原是病原体特异性抗原、肿瘤抗原、组织特异性抗原或宿主自身抗原。在一些实施例中,所述病原体特异性抗原选自由以下组成的组:人免疫缺陷病毒(hiv)、1型单纯疱疹病毒、2型单纯疱疹病毒、乙型肝炎病毒、丙型肝炎病毒、乳头瘤病毒、疟原虫(plasmodium parasite)和结核分枝杆菌(mycobacterium tuberculosis)。
16.在一些实施例中,病原体特异性抗原是mhc-e超表位(supertope)。在一些实施例中,所述mhc-e超表位是hiv表位。在一些实施例中,所述mhc-e超表位与以下至少80%、至少85%、至少90%、至少95%或100%相同:ldawekirlrpggkk(seq id no:13);dawekirlr(seq id no:14);kkaqqaaadtgnssq(seq id no:15);kaqqaaadt(seq id no:16);qmvhqaisprtlnaw(seq id no:17);hqaisprtl(seq id no:18);ntmlntvgghqaamq(seq id no:19);vgghqaamq(seq id no:20);stlqeqigwmtnnpp(seq id no:21);stlqeqigw(seq id no:22);ivrmyspvsildirq(seq id no:23);rmyspvsil(seq id no:24);qkqepidkelyplas(seq id no:25);kqepidkel(seq id no:26);sfsfpqitlwqrplv(seq id no:27);vrqydqilieicgkk(seq id no:28);epfrkqnpdiviyql(seq id no:29):yvdgaanretklgka(seq id no:30):eehekysnwramas(seq id no:31);或ildlwvyhtqgyfpd(seq id no:32)。
17.在一些实施例中,所述肿瘤抗原与选自由以下组成的组的癌症有关:急性髓性白血病、急性髓性白血病、慢性髓性白血病、骨髓增生异常综合征、急性淋巴细胞性白血病、慢性淋巴细胞性白血病、非霍奇金淋巴瘤、多发性骨髓瘤、恶性黑色素瘤、乳腺癌、肺癌、卵巢癌、前列腺癌、胰腺癌、结肠癌、肾细胞癌(rcc)和生殖细胞肿瘤。
18.在一些实施例中,所述宿主自身抗原是源自t细胞受体(tcr)可变区的抗原或是源自b细胞受体的可变区的抗原。
19.本公开涉及一种药物组合物,所述药物组合物包括所述重组hcmv载体和药学上可接受的载体。
20.本公开涉及一种免疫原性组合物,所述免疫原性组合物包括所述重组hcmv载体和药学上可接受的载体。
21.本公开还涉及一种在受试者中产生对至少一种异源抗原的免疫应答的方法,所述方法包括以有效引起对所述至少一种异源抗原的cd8 t细胞应答的量向所述受试者施用所述重组hcmv载体。
22.本公开还涉及所述重组hcmv载体在制造用于在受试者中产生免疫应答的药物中的用途。
23.本公开还涉及所述重组hcmv载体,其用于在受试者中产生免疫应答。
24.本公开还涉及一种治疗或预防受试者的癌症的方法,所述方法包括以有效引起对至少一种异源抗原的cd8 t细胞应答的量施用所述重组hcmv载体。
25.本公开还涉及所述重组hcmv载体在制造用于治疗或预防受试者的癌症的药物中的用途。
26.本公开还涉及所述重组hcmv载体,其用于治疗或预防受试者的癌症。
27.本公开还涉及一种治疗或预防受试者的病原体感染的方法,所述方法包括以有效引起对至少一种异源抗原的cd8 t细胞应答的量向所述受试者施用所述重组hcmv载体。
28.本公开还涉及所述重组hcmv载体在制造用于治疗或预防受试者的病原体感染的药物中的用途。
29.本公开还涉及所述重组hcmv载体,其用于治疗或预防受试者的病原体感染。
30.本公开还涉及一种治疗受试者的自身免疫性疾病或病症的方法,所述方法包括以有效引起对至少一种异源抗原的cd8 t细胞应答的量向所述受试者施用所述重组hcmv载体。
31.本公开还涉及所述重组hcmv载体在制造用于治疗或预防受试者的自身免疫性疾病或病症的药物中的用途。
32.本公开还涉及所述重组hcmv载体,其用于治疗或预防受试者的自身免疫性疾病或病症。
33.在一些实施例中,由所述重组hcmv载体引起的cd8 t细胞中至少10%受mhc-e或其直系同源物的限制。在一些实施例中,由所述重组hcmv载体引起的cd8 t细胞中至少20%、至少30%、至少40%、至少50%、至少60%、至少75%、至少80%、至少85%、至少90%或至少95%受mhc-e或其直系同源物的限制。
34.在一些实施例中,由所述重组hcmv载体引起的cd8 t细胞中至少10%受mhc-ii或其直系同源物的限制。在一些实施例中,由所述重组hcmv载体引起的cd8 t细胞中至少20%、至少30%、至少40%、至少50%、至少60%或至少75%受mhc-ii或其直系同源物的限制。
35.在一些实施例中,由所述重组hcmv载体引起的cd8 t细胞中少于10%、少于20%、少于30%、少于40%或少于50%受mhc-ia类或其直系同源物的限制。在一些实施例中,在一些实施例中,由所述重组hcmv载体引起的cd8 t细胞中至少10%受mhc-ia类或其直系同源物的限制。在一些实施例中,由所述重组hcmv载体引起的至少20%、至少30%、至少40%、至少50%、至少60%、至少75%、至少80%、至少85%、至少90%、至少95%或cd8 t细胞受mhc-ia类或其直系同源物的限制。
36.在一些实施例中,从由所述重组hcmv载体引起的cd8 t细胞中鉴定cd8 tcr,其中所述cd8 tcr识别mhc-ii/异源抗原源性肽复合物。在一些实施例中,从由所述hcmv载体引起的cd8 t细胞中鉴定cd8 tcr,其中所述cd8 tcr识别mhc-e/异源抗原源性肽复合物。在一些实施例中,从由所述hcmv载体引起的cd8 t细胞中鉴定cd8 tcr,其中所述cd8 tcr识别mhc-ia类/异源抗原源性肽复合物。
37.在一些实施例中,所述cd8 tcr是通过dna或rna测序鉴定的。
38.在一些实施例中,cd8 tcr识别mhc-ii超表位。
39.在一些实施例中,cd8 tcr识别mhc-e超表位。在一些实施例中,所述mhc-e超表位是人免疫缺陷病毒表位。在一些实施例中,所述mhc-e超表位与以下的氨基酸序列至少80%、至少85%、至少90%、至少95%或100%相同:ldawekirlrpggkk(seq id no:13);dawekirlr(seq id no:14);kkaqqaaadtgnssq(seq id no:15);kaqqaaadt(seq id no:16);qmvhqaisprtlnaw(seq id no:17);hqaisprtl(seq id no:18);ntmlntvgghqaamq(seq id no:19);vgghqaamq(seq id no:20);stlqeqigwmtnnpp(seq id no:21);stlqeqigw(seq id no:22);ivrmyspvsildirq(seq id no:23);rmyspvsil(seq id no:24);qkqepidkelyplas(seq id no:25);kqepidkel(seq id no:26);sfsfpqitlwqrplv(seq id no:27);vrqydqilieicgkk(seq id no:28);epfrkqnpdiviyql(seq id no:29);yvdgaanretklgka(seq id no:30);eehekysnwramas(seq id no:31);或ildlwvyhtqgyfpd(seq id no:32)。
40.本公开还涉及一种产生识别mhc-e肽复合物的tcr-转基因cd8 t细胞的方法,所述方法包括:(a)以有效产生识别mhc-e/肽复合物的一组cd8 t细胞的量向第一受试者施用重组hcmv载体;(b)从所述一组cd8 t细胞中鉴定第一cd8 tcr,其中所述第一cd8 tcr识别mhc-e/异源抗原源性肽复合物;(c)从第二受试者中分离一个或多个cd8 t细胞;以及(d)将所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-e肽复合物的一个或多个cd8 t细胞,其中所述表达载体包括编码第二cd8 tcr的核酸序列和与编码所述第二cd8 tcr的所述核酸序列可操作地连接的启动子,其中所述第二cd8 tcr包括所述第一cd8 tcr的cdr3α和cdr3β。在一些实施例中,所述重组hcmv载体不表达ul18、ul128、ul130、ul146和/或ul147。在一些实施例中,所述重组hcmv载体由于编码ul18、ul128、ul130、ul146或ul147的核酸序列中存在一个或多个突变而不表达ul18蛋白、ul128蛋白、ul130蛋白、ul146蛋白和ul147蛋白或其直系同源物。在一些实施例中,编码ul18、ul128、ul130、ul146或ul147的所述核酸序列中的所述突变选自由以下组成的组:点突变、移码突变、截短突变和编码病毒蛋白的整个核酸序列的缺失。在一些实施例中,所述重组hcmv载体进一步包括编码ul40或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体进一步包括编码us28或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体进一步包括编码微rna(mirna)识别元件(mre)的核酸序列,其中所述mre含有在内皮细胞中表达的mirna的靶位点。在一些实施例中,在内皮细胞中表达的所述mirna是mir126、mir-126-3p、mir-130a、mir-210、mir-221/222、mir-378、mir-296或mir-328。在一些实施例中,所述异源抗原是病原体特异性抗原、肿瘤抗原、组织特异性抗原或宿主自身抗原。在一些实施例中,所述病原体特异性抗原是人免疫缺陷病毒(hiv)、1型单纯疱疹病毒、2型单纯疱疹病毒、乙型肝炎病毒、丙型肝炎病毒、乳头瘤病毒、疟原虫或结核分枝杆菌。
41.本公开还涉及一种产生识别mhc-e肽复合物的tcr-转基因cd8 t细胞的方法,所述方法包括:(a)从一组cd8 t细胞中鉴定第一cd8 tcr,其中所述一组cd8 t细胞由根据权利要求5到10、12到13或16到17中任一项所述的重组hcmv载体产生,其中所述第一cd8 tcr识别mhc-e/异源抗原源性肽复合物;(b)从第二受试者中分离一个或多个cd8 t细胞;以及(c)将所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-e肽复合物的一
个或多个tcr-转基因cd8 t细胞,其中所述表达载体包括编码第二cd8 tcr的核酸序列和与编码所述第二cd8 tcr的所述核酸序列可操作地连接的启动子,其中所述第二cd8 tcr包括所述第一cd8 tcr的cdr3α和cdr3β。在一些实施例中,所述重组hcmv载体不表达ul18、ul128、ul130、ul146和/或ul147。在一些实施例中,所述重组hcmv载体由于编码ul18、ul128、ul130、ul146或ul147的核酸序列中存在一个或多个突变而不表达ul18蛋白、ul128蛋白、ul130蛋白、ul146蛋白和ul147蛋白或其直系同源物。在一些实施例中,编码ul18、ul128、ul130、ul146或ul147的所述核酸序列中的所述突变选自由以下组成的组:点突变、移码突变、截短突变和编码病毒蛋白的整个核酸序列的缺失。在一些实施例中,所述重组hcmv载体进一步包括编码ul40或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体进一步包括编码us28或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体进一步包括编码微rna(mirna)识别元件(mre)的核酸序列,其中所述mre含有在内皮细胞中表达的mirna的靶位点。在一些实施例中,在内皮细胞中表达的所述mirna是mir126、mir-126-3p、mir-130a、mir-210、mir-221/222、mir-378、mir-296或mir-328。在一些实施例中,所述异源抗原是病原体特异性抗原、肿瘤抗原、组织特异性抗原或宿主自身抗原。在一些实施例中,所述病原体特异性抗原是人免疫缺陷病毒(hiv)、1型单纯疱疹病毒、2型单纯疱疹病毒、乙型肝炎病毒、丙型肝炎病毒、乳头瘤病毒、疟原虫或结核分枝杆菌。
42.在一些实施例中,所述第一cd8 t细胞识别mhc-e超表位。在一些实施例中,所述mhc-e超表位包括人免疫缺陷病毒表位。在一些实施例中,所述mhc-e超表位与以下的氨基酸序列至少80%、至少85%、至少90%、至少95%或100%相同:ldawekirlrpggkk(seq id no:13);dawekirlr(seq id no:14);kkaqqaaadtgnssq(seq id no:15);kaqqaaadt(seq id no:16);qmvhqaisprtlnaw(seq id no:17);hqaisprtl(seq id no:18);ntmlntvgghqaamq(seq id no:19);vgghqaamq(seq id no:20);stlqeqigwmtnnpp(seq id no:21);stlqeqigw(seq id no:22);ivrmyspvsildirq(seq id no:23);rmyspvsil(seq id no:24);qkqepidkelyplas(seq id no:25);kqepidkel(seq id no:26);sfsfpqitlwqrplv(seq id no:27);vrqydqilieicgkk(seq id no:28);epfrkqnpdiviyql(seq id no:29);yvdgaanretklgka(seq id no:30);eehekysnwramas(seq id no:31);或ildlwvyhtqgyfpd(seq id no:32)。
43.在一些实施例中,所述第二cd8 t细胞识别mhc-e超表位。在一些实施例中,所述mhc-e超表位包括人免疫缺陷病毒表位。在一些实施例中,所述mhc-e超表位与以下的氨基酸序列至少80%、至少85%、至少90%、至少95%或100%相同:ldawekirlrpggkk(seq id no:13);dawekirlr(seq id no:14);kkaqqaaadtgnssq(seq id no:15);kaqqaaadt(seq id no:16);qmvhqaisprtlnaw(seq id no:17);hqaisprtl(seq id no:18);ntmlntvgghqaamq(seq id no:19);vgghqaamq(seq id no:20);stlqeqigwmtnnpp(seq id no:21);stlqeqigw(seq id no:22);ivrmyspvsildirq(seq id no:23);rmyspvsil(seq id no:24);qkqepidkelyplas(seq id no:25);kqepidkel(seq id no:26);sfsfpqitlwqrplv(seq id no:27);vrqydqilieicgkk(seq id no:28);epfrkqnpdiviyql(seq id no:29);yvdgaanretklgka(seq id no:30);eehekysnwramas(seq id no:31);或ildlwvyhtqgyfpd(seq id no:32)。
44.在一些实施例中,所述第一cd8 tcr是通过dna或rna测序鉴定的。
45.在一些实施例中,编码所述第二cd8 tcr的所述核酸序列与编码所述第一cd8 tcr的所述核酸序列相同。
46.在一些实施例中,所述第一受试者是人。在一些实施例中,所述第二受试者是人。
47.本公开还涉及一种产生识别mhc-e肽复合物的cd8 t细胞的方法,所述方法包括:(a)以有效产生识别mhc-e与hiv超表位肽的复合物的一组cd8 t细胞的量向非人灵长类动物施用缺乏ul128、ul130、ul146和ul147的直系同源物并表达hiv抗原的重组恒河猴cmv(rhcmv)或食蟹猴cmv(cycmv)载体;(b)从所述一组cd8 t细胞中鉴定第一cd8 tcr,其中所述第一识别mhc-e/超表位肽复合物;(c)从第二受试者中分离一个或多个cd8 t细胞;以及(d)将所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-e/异源抗原源性肽复合物的一个或多个经转染的cd8 t细胞,其中所述表达载体包括编码第二cd8 tcr的核酸序列和与编码所述第二cd8 tcr的所述核酸序列可操作地连接的启动子,其中所述第二cd8 tcr包括所述第一cd8 tcr的cdr3α和cdr3β。在一些实施例中,所述hiv表位与以下至少80%、至少85%、至少90%、至少95%或100%相同:ldawekirlrpggkk(seq id no:13);dawekirlr(seq id no:14);kkaqqaaadtgnssq(seq id no:15);kaqqaaadt(seq id no:16);qmvhqaisprtlnaw(seq id no:17);hqaisprtl(seq id no:18);ntmlntvgghqaamq(seq id no:19);vgghqaamq(seq id no:20);stlqeqigwmtnnpp(seq id no:21);stlqeqigw(seq id no:22);ivrmyspvsildirq(seq id no:23);rmyspvsil(seq id no:24);qkqepidkelyplas(seq id no:25);kqepidkel(seq id no:26);sfsfpqitlwqrplv(seq id no:27);vrqydqilieicgkk(seq id no:28);epfrkqnpdiviyql(seq id no:29);yvdgaanretklgka(seq id no:30);eehekysnwramas(seq id no:31);或ildlwvyhtqgyfpd(seq id no:32)。本公开还涉及一种产生识别mhc-e肽复合物的cd8 t细胞的方法,所述方法包括:(a)从识别mhc-e与所述hiv超表位肽的复合物的一组cd8 t细胞中鉴定识别mhc-e/超表位肽复合物的第一cd8 tcr,其中所述一组cd8 t细胞由有效产生所述一组cd8 t细胞的量生物缺乏ul128、ul130、ul146和ul147的直系同源物并表达hiv抗原的重组恒河猴(rhcmv)或食蟹猴cmv(cyccmv)载体产生,(b)从第二受试者中分离一个或多个cd8 t细胞;以及(c)将所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-e肽复合物的一个或多个cd8 t细胞,其中所述表达载体包括编码第二cd8 tcr的核酸序列和与编码所述第二cd8 tcr的所述核酸序列可操作地连接的启动子,其中所述第二cd8 tcr包括所述第一cd8 tcr的cdr3α和cdr3β。在一些实施例中,所述hiv表位与以下至少80%、至少85%、至少90%、至少95%或100%相同:ldawekirlrpggkk(seq id no:13);dawekirlr(seq id no:14);kkaqqaaadtgnssq(seq id no:15);kaqqaaadt(seq id no:16);qmvhqaisprtlnaw(seq id no:17);hqaisprtl(seq id no:18);ntmlntvgghqaamq(seq id no:19);vgghqaamq(seq id no:20);stlqeqigwmtnnpp(seq id no:21);stlqeqigw(seq id no:22);ivrmyspvsildirq(seq id no:23):rmyspvsil(seq id no:24);qkqepidkelyplas(seq id no:25);kqepidkel(seq id no:26);sfsfpqitlwqrplv(seq id no:27);vrqydqilieicgkk(seq id no:28);epfrkqnpdiviyql(seq id no:29);yvdgaanretklgka(seq id no:30);eehekysnwramas(seq id no:31);或ildlwvyhtqgyfpd(seq id no:32)。
48.在一些实施例中,所述第一受试者是非人灵长类动物,并且所述第二受试者是人,并且其中所述第二cd8 tcr是包括所述第一cd8 tcr的非人灵长类动物cdr3α和cdr3β的
嵌合非人灵长类动物-人cd8 tcr。在一些实施例中,所述第二cd8 tcr包括所述第一cd8 tcr的非人灵长类动物cdr1α、cdr2α、cdr3α、cdr1β、cdr2β和cdr3β。在一些实施例中,所述第二cd8 tcr包括所述第一cd8 tcr的cdr1α、cdr2α、cdr3α、cdr1β、cdr2β和cdr3β。在一些实施例中,所述第二cd8 tcr是嵌合cd8 tcr。
49.在一些实施例中,向所述第一受试者施用所述重组hcmv载体包括向所述第一受试者静脉内、肌肉内、腹膜内或口服施用所述重组hcmv载体。
50.在一些实施例中,向所述第二受试者施用经转染的cd8 t细胞以治疗或预防癌症。在一些实施例中,所述癌症选自由以下组成的组:急性髓性白血病、急性髓性白血病、慢性髓性白血病、骨髓增生异常综合征、急性淋巴细胞性白血病、慢性淋巴细胞性白血病、非霍奇金淋巴瘤、多发性骨髓瘤、恶性黑色素瘤、乳腺癌、肺癌、卵巢癌、前列腺癌、胰腺癌、结肠癌、肾细胞癌(rcc)和生殖细胞肿瘤。
51.在一些实施例中,向所述第二受试者施用经转染的cd8 t细胞以治疗或预防病原体感染。在一些实施例中,所述病原体感染由选自由以下组成的组的病原体引起:人免疫缺陷病毒、1型单纯疱疹病毒、2型单纯疱疹病毒、乙型肝炎病毒、丙型肝炎病毒、乳头瘤病毒、疟原虫和结核分枝杆菌。
52.在一些实施例中,向所述第二受试者施用经转染的cd8 t细胞以诱导对宿主自身抗原的自身免疫应答。
53.本公开还涉及一种产生识别mhc-ii肽复合物的cd8 t细胞的方法,所述方法包括:(a)以有效产生识别mhc-ii/肽复合物的一组cd8 t细胞的量向第一受试者施用重组hcmv载体;(b)从所述一组cd8 t细胞中鉴定第一cd8 tcr,其中所述第一cd8 tcr识别mhc-ii/异源抗原源性肽复合物;(c)从第二受试者中分离一个或多个cd8 t细胞;以及(d)将所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-ii肽复合物的一个或多个cd8 t细胞,其中所述表达载体包括编码第二cd8 tcr的核酸序列和与编码所述第二cd8 tcr的所述核酸序列可操作地连接的启动子,其中所述第二cd8 tcr包括所述第一cd8 tcr的cdr3α和cdr3β。在一些实施例中,所述重组hcmv载体包括编码异源抗原的核酸序列。在一些实施例中,所述重组hcmv载体不表达ul18。在一些实施例中,所述重组hcmv载体不表达ul128。在一些实施例中,所述重组hcmv载体不表达ul130。在一些实施例中,所述重组hcmv载体不表达ul128和ul130。在一些实施例中,所述重组hcmv载体不表达ul146和ul147。在一些实施例中,所述重组hcmv载体由于编码ul18、ul128、ul130、ul146或ul147的核酸序列中存在一个或多个突变而不表达ul18蛋白、ul128蛋白、ul130蛋白、ul146蛋白和ul147蛋白或其直系同源物。在一些实施例中,编码ul18、ul128、ul130、ul146或ul147的所述核酸序列中的所述突变选自由以下组成的组:点突变、移码突变、截短突变和编码病毒蛋白的整个核酸序列的缺失。在一些实施例中,所述重组hcmv载体进一步包括编码ul40或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体进一步包括编码us28或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体不表达ul82(pp71)或其直系同源物。在一些实施例中,所述重组hcmv载体不表达us11或其直系同源物。在一些实施例中,所述重组hcmv载体进一步包括编码mre的核酸序列,其中所述mre含有在骨髓细胞中表达的mirna的靶位点。在一些实施例中,在骨髓细胞中表达的所述mirna是mir-142-3p、mir-223、mir-27a、mir-652、mir-155、mir-146a、mir-132、mir-21或mir-125。
54.本公开还涉及一种产生识别mhc-ii肽复合物的cd8 t细胞的方法,所述方法包括:(a)从识别mhc-ii/肽复合物的一组cd8 t细胞中鉴定识别mhc-ii/异源抗原源性肽复合物的第一cd8 tcr,其中所述一组cd8 t细胞由所述重组hcmv载体产生;(b)从第二受试者中分离一个或多个cd8 t细胞;以及(c)将所述一个或多个cd8 t细胞用表达载体转染,由此产生ii识别mhc-h肽复合物的一个或多个cd8 t细胞,其中所述表达载体包括编码第二cd8 tcr的核酸序列和与编码所述第二cd8 tcr的所述核酸序列可操作地连接的启动子,其中所述第二cd8 tcr包括所述第一cd8 tcr的cdr3α和cdr3β。在一些实施例中,所述重组hcmv载体包括编码异源抗原的核酸序列。在一些实施例中,所述重组hcmv载体不表达ul18。在一些实施例中,所述重组hcmv载体不表达ul128。在一些实施例中,所述重组hcmv载体不表达ul130。在一些实施例中,所述重组hcmv载体不表达ul128和ul130。在一些实施例中,所述重组hcmv载体不表达ul146和ul147。在一些实施例中,所述重组hcmv载体由于编码ul18、ul128、ul130、ul146或ul147的核酸序列中存在一个或多个突变而不表达ul18蛋白、ul128蛋白、ul130蛋白、ul146蛋白和ul147蛋白或其直系同源物。在一些实施例中,编码ul18、ul128、ul130、ul146或ul147的所述核酸序列中的所述突变选自由以下组成的组:点突变、移码突变、截短突变和编码病毒蛋白的整个核酸序列的缺失。在一些实施例中,所述重组hcmv载体进一步包括编码ul40或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体进一步包括编码us28或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体不表达ul82(pp71)或其直系同源物。在一些实施例中,所述重组hcmv载体不表达us11或其直系同源物。在一些实施例中,所述重组hcmv载体进一步包括编码mre的核酸序列,其中所述mre含有在骨髓细胞中表达的mirna的靶位点。在一些实施例中,在骨髓细胞中表达的所述mirna是mir-142-3p、mir-223、mir-27a、mir-652、mir-155、mir-146a、mir-132、mir-21或mir-125。
55.在一些实施例中,所述第一cd8 t细胞识别mhc-ii超表位。在一些实施例中,所述第二cd8 t细胞识别mhc-ii超表位。
56.在一些实施例中,所述第一cd8 tcr是通过dna或rna测序鉴定的。
57.在一些实施例中,编码所述第二cd8 tcr的所述核酸序列与编码所述第一cd8 tcr的所述核酸序列相同。
58.在一些实施例中,所述第一受试者是人。在一些实施例中,所述第二受试者是人。
59.在一些实施例中,向所述第一受试者施用所述hcmv载体包括向所述第一受试者静脉内、肌肉内、腹膜内或口服施用所述hcmv载体。
60.在一些实施例中,向所述第二受试者施用经转染的cd8 t细胞以治疗或预防癌症。在一些实施例中,所述癌症选自由以下组成的组:急性髓性白血病、急性髓性白血病、慢性髓性白血病、骨髓增生异常综合征、急性淋巴细胞性白血病、慢性淋巴细胞性白血病、非霍奇金淋巴瘤、多发性骨髓瘤、恶性黑色素瘤、乳腺癌、肺癌、卵巢癌、前列腺癌、胰腺癌、结肠癌、肾细胞癌(rcc)和生殖细胞肿瘤。
61.在一些实施例中,向所述第二受试者施用经转染的cd8 t细胞以治疗或预防病原体感染。在一些实施例中,所述病原体感染由选自由以下组成的组的病原体引起:人免疫缺陷病毒、1型单纯疱疹病毒、2型单纯疱疹病毒、乙型肝炎病毒、丙型肝炎病毒、乳头瘤病毒、疟原虫和结核分枝杆菌。
62.在一些实施例中,向所述第二受试者施用经转染的cd8 t细胞以诱导对宿主自身抗原的自身免疫应答。
63.本公开还涉及一种产生识别mhc-i肽复合物的cd8 t细胞的方法,所述方法包括:(a)以有效产生识别mhc-i/肽复合物的一组cd8 t细胞的量向第一受试者施用重组hcmv载体;(b)从所述一组cd8 t细胞中鉴定第一cd8 tcr,其中所述第一cd8 tcr识别mhc-i/异源抗原源性肽复合物;(c)从第二受试者中分离一个或多个cd8 t细胞;以及(d)将所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-i肽复合物的一个或多个cd8 t细胞,其中所述表达载体包括编码第二cd8 tcr的核酸序列和与编码所述第二cd8 tcr的所述核酸序列可操作地连接的启动子,其中所述第二cd8 tcr包括所述第一cd8 tcr的cdr3α和cdr3β。在一些实施例中,所述重组hcmv载体包括编码异源抗原的核酸序列。在一些实施例中,所述重组hcmv载体不表达ul18。在一些实施例中,所述重组hcmv载体不表达ul128。在一些实施例中,所述重组hcmv载体不表达ul130。在一些实施例中,所述重组hcmv载体不表达ul128和ul130。在一些实施例中,所述重组hcmv载体不表达ul146和ul147。在一些实施例中,所述重组hcmv载体由于编码ul1 8、ul128、ul130、ul146或ul147的核酸序列中存在一个或多个突变而不表达ul18蛋白、ul128蛋白、ul130蛋白、ul146蛋白和ul147蛋白或其直系同源物。在一些实施例中,编码ul18、ul128、ul130、ul146或ul147的所述核酸序列中的所述突变选自由以下组成的组:点突变、移码突变、截短突变和编码病毒蛋白的整个核酸序列的缺失。在一些实施例中,所述重组hcmv载体进一步包括编码ul40或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体进一步包括编码us28或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体不表达ul82(pp71)或其直系同源物。在一些实施例中,所述重组hcmv载体不表达us11或其直系同源物。
64.本公开还涉及一种产生识别mhc-i肽复合物的cd8 t细胞的方法,所述方法包括:(a)从识别mhc-i/异源抗原源性肽复合物的一组cd8 t细胞中鉴定识别mhc-i/异源抗原源性肽复合物的第一cd8 tcr,其中所述一组cd8 t细胞由根据权利要求1到11中任一项所述的重组hcmv载体产生;(b)从第二受试者中分离一个或多个cd8 t细胞;以及(c)将所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-i肽复合物的一个或多个cd8 t细胞,其中所述表达载体包括编码第二cd8 tcr的核酸序列和与编码所述第二cd8 tcr的所述核酸序列可操作地连接的启动子,其中所述第二cd8 tcr包括所述第一cd8 tcr的cdr3α和cdr3β。
65.在一些实施例中,所述第一cd8 tcr是通过dna或rna测序鉴定的。
66.在一些实施例中,编码所述第二cd8 tcr的所述核酸序列与编码所述第一cd8 tcr的所述核酸序列相同。
67.在一些实施例中,所述第一受试者是人。在一些实施例中,所述第二受试者是人。
68.在一些实施例中,向所述第二受试者施用经转染的cd8 t细胞以治疗或预防癌症。在一些实施例中,所述癌症选自由以下组成的组:急性髓性白血病、急性髓性白血病、慢性髓性白血病、骨髓增生异常综合征、急性淋巴细胞性白血病、慢性淋巴细胞性白血病、非霍奇金淋巴瘤、多发性骨髓瘤、恶性黑色素瘤、乳腺癌、肺癌、卵巢癌、前列腺癌、胰腺癌、结肠癌、肾细胞癌(rcc)和生殖细胞肿瘤。
69.在一些实施例中,向所述第二受试者施用经转染的cd8 t细胞以治疗或预防病原
体感染。在一些实施例中,所述病原体感染由选自由以下组成的组的病原体引起:人免疫缺陷病毒、1型单纯疱疹病毒、2型单纯疱疹病毒、乙型肝炎病毒、丙型肝炎病毒、乳头瘤病毒、疟原虫和结核分枝杆菌。
70.在一些实施例中,向所述第二受试者施用经转染的cd8 t细胞以诱导对宿主自身抗原的自身免疫应答。
71.在一些实施例中,所述病原体特异性抗原选自由以下组成的组:人免疫缺陷病毒、猿猴免疫缺陷病毒、1型单纯疱疹病毒、2型单纯疱疹病毒、乙型肝炎病毒、丙型肝炎病毒、乳头瘤病毒、疟原虫和结核分枝杆菌。
72.在一些实施例中,所述肿瘤抗原与选自由以下组成的组的癌症有关:急性髓性白血病、急性髓性白血病、慢性髓性白血病、骨髓增生异常综合征、急性淋巴细胞性白血病、慢性淋巴细胞性白血病、非霍奇金淋巴瘤、多发性骨髓瘤、恶性黑色素瘤、乳腺癌、肺癌、卵巢癌、前列腺癌、胰腺癌、结肠癌、肾细胞癌(rcc)和生殖细胞肿瘤。
73.在一些实施例中,所述宿主自身抗原是源自t细胞受体(tcr)的可变区的抗原或是源自b细胞受体的可变区的抗原。
74.本公开还涉及一种治疗或预防受试者的病原体感染的方法,所述方法包括向所述受试者施用cd8 t细胞。
75.本公开还涉及所述cd8 t在制造用于治疗或预防受试者的病原体感染的药物中的用途。
76.本公开还涉及所述cd8 t细胞,其用于治疗或预防受试者的病原体感染。
77.本公开还涉及一种治疗或预防受试者的癌症的方法,所述方法包括向所述受试者施用cd8 t细胞。
78.本公开还涉及所述cd8 t细胞在制造用于治疗或预防受试者的癌症的药物中的用途。
79.本公开还涉及所述cd8 t细胞,其用于治疗或预防受试者的癌症。
80.本公开还涉及一种治疗自身免疫性疾病或病症的方法,所述方法包括向受试者施用cd8 t细胞。
81.本公开还涉及所述cd8 t细胞在制造用于治疗自身免疫性疾病或病症的药物中的用途。
82.本公开还涉及所述cd8 t细胞,其用于治疗自身免疫性疾病或病症。
83.本公开还涉及一种诱导对宿主自身抗原的自身免疫应答的方法,所述方法包括向受试者施用cd8 t细胞。
84.本公开还涉及一种人免疫缺陷病毒mhc-e超表位,其长度介于9个与15个氨基酸之间,与以下的氨基酸序列至少90%、至少95%或100%相同:ldawekirlrpggkk(seq id no:13);dawekirlr(seq id no:14);kkaqqaaadtgnssq(seq id no:15);kaqqaaadt(seq id no:16);qmvhqaisprtlnaw(seq id no:17);hqaisprtl(seq id no:18);ntmlntvgghqaamq(seq id no:19);vgghqaamq(seq id no:20);stlqeqigwmtnnpp(seq id no:21);stlqeqigw(seq id no:22);ivrmyspvsildirq(seq id no:23);rmyspvsil(seq id no:24);qkqepidkelyplas(seq id no:25);kqepidkel(seq id no:26);sfsfpqitlwqrplv(seq id no:27);vrqydqilieicgkk(seq id no:28);epfrkqnpdiviyql(seq id no:29);
yvdgaanretklgka(seq id no:30);eehekysnwramas(seq id no:31);或ildlwvyhtqgyfpd(seq id no:32)。
85.在一些实施例中,所述重组hcmv载体包括编码一个或多个人免疫缺陷病毒抗原的核酸。在一些实施例中,所述重组hcmv载体不表达ul128。在一些实施例中,所述重组hcmv载体不表达ul130。在一些实施例中,所述重组hcmv载体不表达ul128和ul130。在一些实施例中,所述重组hcmv载体不表达ul146和ul147。在一些实施例中,所述重组hcmv载体由于编码ul18、ul128、ul130、ul146或ul147的核酸序列中存在一个或多个突变而不表达ul18蛋白、ul128蛋白、ul130蛋白、ul146蛋白和ul147蛋白或其直系同源物。在一些实施例中,编码ul18、ul128、ul130、ul146或ul147的所述核酸序列中的所述突变选自由以下组成的组:点突变、移码突变、截短突变和编码病毒蛋白的整个核酸序列的缺失。在一些实施例中,所述重组hcmv载体进一步包括编码ul40或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体进一步包括编码us28或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体不表达ul82(pp71)或其直系同源物。在一些实施例中,所述重组hcmv载体不表达us11或其直系同源物。在一些实施例中,所述重组hcmv载体进一步包括编码微rna(mirna)识别元件(mre)的核酸序列,其中所述mre含有在内皮细胞中表达的mirna的靶位点。在一些实施例中,在内皮细胞中表达的所述mirna是mir126、mir-126-3p、mir-130a、mir-210、mir-221/222、mir-378、mir-296或mir-328。在一些实施例中,所述重组hcmv载体进一步包括编码mre的核酸序列,其中所述mre含有在骨髓细胞中表达的mirna的靶位点。在一些实施例中,在骨髓细胞中表达的所述mirna是mir-142-3p、mir-223、mir-27a、mir-652、mir-155、mir-146a、mir-132、mir-21或mir-125。
附图说明
86.图1示出了所指示的队列中的cd4 或cd8 t细胞响应于siv抗原源性肽池的平均频率。在存在表示siv抗原的重叠(以11a重叠)的15聚体肽池的情况下,通过针对ifnγ或tnfα的胞内细胞因子染色(ics),在指定时间点确定外周血单核细胞(pbmc)中的t细胞频率。队列1用三个“仅mhc-e”68-1rhcmv载体免疫,所述载体在必需基因rh108(ul79)和rh156(ie2)的3
′
非翻译区中携带mir126的识别位点并表达siv抗原sivgag、sivretanef(rev、tat和nef的融合物)或sivpol的5
′
区段。队列2用三个“仅mhc-ii”68-1rhcmv载体免疫,所述载体针对rh67(ul40)缺失并表达siv抗原sivgag、sivretanef或sivpol的5
′
区段。队列3用三个“仅mhc-ii”68-1rhcmv载体免疫,所述载体在必需基因rh108(ul79)和rh156(ie2)的3
′
非翻译区中携带mir142的识别位点并表达siv抗原sivgag、sivretanef或sivpol的5
′
区段。队列4(对照队列)用三个68-1rhcmv载体免疫,所述载体表达siv抗原sivgag、sivretanef或sivpol的5
′
区段。
87.图2示出了在存在各个肽的情况下,测量的从每个所指示的队列中的每个队列中的三只恒河猴(rm)获得的pbmc中的sivgag特异性cd8 t细胞应答。产生特异性cd8 t细胞应答的肽用框指示,其中框的颜色指定如通过用抗泛mhc-i mab w6/32、mhc-e阻断肽vl9和mhc-ii阻断肽clip进行阻断来确定的mhc限制。
88.图3示出了队列1、2和3中的rm在重复限制性剂量sivmac239激发后的血浆病毒载量(左图)和队列1、2和3中的rm的sivvif特异性cd8 t细胞应答(右图)。受控的siv感染的
动物(rm受控者)以白框示出,并且非受控者以黑框示出。队列2中的一只动物最初控制了siv感染,但在cd8 t细胞耗尽后失去了控制,这与此rm是自发的精英控制者一致。
89.图4示出了siv超表位融合构建体的免疫印迹。将端粒化恒河猴成纤维细胞(trf)用所指示的rhcmv构建体感染或未感染,并在免疫印迹前对感染的细胞的裂解物进行电泳分离。用抗ha抗体对含有siv超表位的融合蛋白进行可视化,而使用特异性抗体检测病毒蛋白ie1、rh107和rh108。使用ie抗体在模拟感染的或未感染的trf裂解物中观察到的蛋白质条带是非特异性的。
90.图5a示出了队列5动物(n=8)的pbmc中响应于siv抗原源性肽的cd8 t细胞的平均频率。队列5用68-1rhcmv载体免疫,所述载体在必需基因rh108(ul79)和rh156(ie2)的3
′
非翻译区中携带mir126的识别位点并表达mhc-e超表位融合蛋白。在存在表示siv超表位的各个15聚体肽池的情况下,通过针对ifnγ或tnfα的胞内细胞因子染色(ics),在指定时间点确定外周血单核细胞(pbmc)中的t细胞频率。图5b示出了单个rm中响应于特异性mhc-e限制性超表位的cd8 t细胞的频率。示出了mhc-e限制性超表位(gag69和gag120)和其它mhc-e限制性gag表位。
91.图6示出了队列5中的rm在重复限制性剂量sivmac239激发后的siv血浆病毒载量(左图)和sivvif特异性t细胞应答(右图)。rm受控者以白框示出,并且非受控者以黑框示出。sivvif特异性应答表明受控动物“接受”了siv感染。
92.图7a示出了在接种了表达sivgag的68-1rhcmv(n=2)、表达ul18和sivretanef的68-1rhcmv(n=2)或表达ul18和sivpol的68-1rhcmv(n=2)的rm中响应于siv抗原肽池的cd8 t细胞的频率。图7b示出了每个rm中响应于mhc-e限制性超表位的cd8 t细胞的频率。图7c示出了每个rm中响应于mhc-ii限制性超表位的cd8 t细胞的频率。
93.图8示出了从接种了表达ul18和sivpol的68-1rhcmv的三个rm中获得的pbmc中的sivpol特异性cd8 t细胞应答。在存在各个肽的情况下测量了cd8 t细胞应答。产生特异性cd8 t细胞应答的肽用框指示,其中框的颜色指定如通过用抗泛mhc-i-mab w6/32、mhc-e阻断肽vl9和mhc-ii阻断肽clip进行阻断来确定的mhc限制性。所有肽应答均被w6/32阻断,但不被vl9肽或clip肽阻断。因此,cd8 t细胞专门受mhc-i限制。
94.图9a示出了描绘了cd8 t细胞响应于来自接种了表达ul18和sivpol的68-1rhcmv的rm的sivpol肽而产生ifnγ或tnfα的频率的点图。图9b示出了描绘了cd8 t细胞响应于来自接种了表达ul18d196s突变体和sivpol的68-1rhcmv的rm的sivpol肽而产生ifnγ或tnfα的频率的点图。示出了响应于包括sivpol或mhc-e限制性超表位肽sivpol41或mhc-ii限制性超表位肽sivpol90的重叠15聚体肽池的cd8 t细胞的频率。虽然完整的ul18防止了超表位应答的诱导,但对于ul18的d196s突变体没有观察到这一点。
95.图10示出了以下人mrc5成纤维细胞的免疫印迹,所述成纤维细胞未感染或感染hcmv-tr3(caposio p等人,2019.基于hcmv减毒活疫苗平台的表征(characterization of a live-attenuated hcmv-based vaccine platform).《科学报告(sci rep)》9:19236)或感染基于hcmv-tr3的载体,其中ul18被hivgag、hivnef和hivpol融合蛋白置换。另外,ul18缺失的载体缺少ul128、ul130、ul146和ul147,因为先前的研究表明这些基因抑制mhc-e限制性cd8 t细胞应答(美国专利第10,532,099号)。另外,还添加了hivgag的p24片段作为对照。用针对hivgag蛋白的抗体探测上部印迹。用针对hcmv pp65蛋白的抗体探测下部印迹。
96.图11示出了从接种了ul18缺失的载体的rm中获得的pbmc中的hiv gag、nef和pol特异性cd8 t细胞应答(图11,n=2)。在接种后第56天,使用对应于抗原的每个部分的重叠肽池测量cd8 t细胞应答。
具体实施方式
97.i.术语
98.除非另有说明,否则技术术语均根据常规用法使用。
99.出于所有目的,本文所引用或本技术数据表中列出的所有公开、专利、专利申请、互联网站点和登录号/数据库序列(包含多核苷酸和多肽序列两者),包含于2019年8月20日提交的第62/889,310号美国临时专利申请通过全文引用的方式并入本文中,其程度如同每个单独的公开、专利、专利申请、互联网站点或登录号/数据库序列都被具体地和单独地指示通过引用的方式并入。
100.尽管与本文所描述的方法和材料类似或等效的那些方法和材料可以用于实施或测试本公开,但在下文描述适合的方法和材料。另外,所述材料、方法和实例仅是说明性的并且不旨在进行限制。为了便于回顾本公开的各个实施例,提供了对具体术语的以下解释。
101.除非上下文另有要求,否则贯穿本说明书和权利要求书,词语“包括(comprise)”和其变型(如“包括(comprises)”和“包括(comprising)”)将以开放式的、包含性的意义进行解释,即解释为“包含但不限于”。“由
……
组成(consisting of)”应当意味着排除本文中所公开的超过痕量要素的其它成分和大量方法步骤。术语“基本上由
……
组成”将权利要求的范围限制为指定材料或步骤,或限制为实质上不影响所要求保护的本发明的基本特性的材料或步骤。例如,基本上由如本文所定义的要素组成的组合物不会从分离和纯化方法和药学上可接受的载体(如磷酸盐缓冲盐水、防腐剂等)中排除痕量污染物。类似地,当蛋白质包含另外的氨基酸时,蛋白质基本上由特定的氨基酸序列组成,所述氨基酸占蛋白质长度的至多20%并且不会显著影响蛋白质的活性(例如,改变蛋白质的不超过50%活性)。由过渡术语中的每个过渡术语定义的实施例在本发明的范围内。
102.抗原:如本文所使用的,术语“抗原”或“免疫原”可互换使用,指能够在受试者中诱导免疫应答的物质,通常是蛋白质。所述术语还指具有免疫活性的蛋白质,即一旦向受试者施用(直接或通过向受试者施用编码蛋白质的核苷酸序列或载体),蛋白质能够诱发针对所述蛋白质的体液和/或细胞类型的免疫应答。
103.抗原特异性t细胞:识别特定抗原的cd8 或cd4 淋巴细胞。通常,抗原特异性t细胞与由mhc分子呈递的特定抗原特异性结合,但不与同一mhc呈递的其它抗原结合。
104.施用:如本文所使用的,术语“施用”意指通过任何有效途径向受试者提供或给予药剂,如包括有效量的包括外源抗原的cmv载体的组合物。示例性施用途径包含但不限于注射(如皮下、肌肉内、皮内、腹膜内和静脉内)、口服、舌下、直肠、透皮、鼻内、阴道和吸入途径。
105.有效量:如本文所使用的,术语“有效量”是指如减少或消除病状或疾病的体征或症状或诱导对抗原的免疫应答的药剂的量,如足以产生期望的应答的包括异源抗原或识别以下的经转染的cd8 t细胞的cmv载体:mhc-e/异源抗原源性肽复合物、mhc-ii/异源抗原源性肽复合物或mhc-i/异源抗原源性肽复合物。在一些实例中,“有效量”是治疗(包含预
防)病症或疾病中的任何病症或疾病的一种或多种症状和/或潜在原因的量。有效量可以是治疗有效量,包含预防特定疾病或病状的一种或多种体征或症状发展的量,如与传染病或癌症相关的一种或多种体征或症状。
106.异源抗原:如本文所使用的,术语“异源抗原”是指不源自cmv的任何蛋白质或其片段。异源抗原可以是病原体特异性抗原、肿瘤病毒抗原、肿瘤抗原、宿主自身抗原或任何其它抗原。
107.过度增殖性疾病:以细胞不受控制的增殖为特征的疾病或病症。过度增殖性疾病包含但不限于恶性肿瘤和非恶性肿瘤。
108.免疫耐受性:如本文所使用的,“免疫耐受性”是指免疫系统对具有诱导免疫应答潜力的物质无反应的状态。对个体自身抗原,例如肿瘤抗原的自我耐受是通过中枢耐受机制和外周耐受机制两者实现的。
109.免疫原性肽:包括等位基因特异性基序或其它序列,如n端重复序列的肽,使得肽将结合mhc分子并针对免疫原性肽所源自的抗原诱导细胞毒性t淋巴细胞(“ctl”)应答或b细胞应答(例如,抗体产生)。
110.在一些实施例中,免疫原性肽使用序列基序或其它方法来鉴定,如本领域已知的神经网络或多项式测定。通常,算法用于确定肽的“结合阈值”,以选择那些使其以某种亲和力结合的可能性很高并且将具有免疫原性的评分。算法基于对特定位置处的特定氨基酸的mhc结合的影响、特定位置处的特定氨基酸对抗体结合的影响或对含有基序的肽的特定取代的结合的影响。在免疫原性肽的上下文中,“保守残基”出现的频率显著高于所期望的随机分布在肽的特定位置处的频率。在一些实施例中,保守残基是mhc结构可以提供与免疫原性肽的接触点的残基。
111.微rna:如本文所使用的,术语“微rna”是指参与基因表达控制的主要生物分子的类别。例如,在人心脏、肝或大脑中,mirna在组织规范或细胞谱系决定中发挥作用,另外,mirna影响多种过程,包含早期发育、细胞增殖和细胞死亡,以及细胞凋亡和脂肪代谢。大量mirna基因、多样的表达模式和丰富的潜在mirna靶标表明mirna可能是遗传多样性的重要来源。
112.成熟的mirna通常是8-25个核苷酸非编码rna,其调控mrna的表达,包含与mirna互补的序列。已知这些小rna分子通过调控mrna的稳定性和/或翻译来控制基因表达。例如,mirna与靶标mrna的3
′
utr结合并抑制翻译。mirna还可以与靶mrna结合并通过rnai途径介导基因沉默。mirna还可以通过引起染色质凝聚来调控基因表达。
113.mirna通过与mirna识别元件(mre)结合来使一个或多个特定mrna分子的翻译沉默,所述元件被定义为与mrna转录物上某处的mirna直接碱基配对并相互作用的任何序列。通常,mre存在于mrna的3
′
非翻译区(utr),但其也可能存在于编码序列或5
′
utr中。mre不一定是mirna的完美互补体,通常只有少数与mirna互补的碱基,并且通常在这些互补碱基内包括一个或多个错配。mre可以是能够被mirna充分结合的任何序列,使得与mre可操作地连接的基因(如对于体内生长必不可少或增强的cmv基因)的翻译被mirna沉默机制,如risc抑制。
114.突变:如本文所使用的,术语“突变”是指核酸或多肽序列与正常、共有或“野生型”序列的任何差异。突变体是包括突变的任何蛋白质或核酸序列。另外,具有突变的细胞或生
物体也可以被称为突变体。一些类型的编码序列突变包含:点突变(各个核苷酸或氨基酸的差异);沉默突变(不会导致氨基酸变化的核苷酸差异);缺失(缺失一个或多个核苷酸或氨基酸,直至并包含基因的整个编码序列的缺失的差异);移码突变(其中不能被3整除的多个核苷酸的缺失导致氨基酸序列的改变的差异)。导致氨基酸不同的突变也可以被称为氨基酸置换突变。氨基酸取代突变可以通过氨基酸序列中特定位置处相对于野生型的氨基酸变化来描述。
115.核苷酸序列或核酸序列:术语“核苷酸序列”和“核酸序列”是指脱氧核糖核酸(dna)或核糖核酸(rna)序列,包含但不限于信使rna(mrna)、dna/rna杂交体或合成核酸。核酸可以是单链的,或者是部分或完全双链的(双链体)。双链体核酸可以是同源双链体或异源双链体。
116.可操作地连接:如本文所使用的术语“可操作地连接”,当第一核酸序列以对第二核酸序列具有影响的方式放置时,第一核酸序列与第二核酸序列可操作地连接。可操作地连接的dna序列可以是连续的,或者其可以在远处操作。
117.启动子:如本文所使用的,术语“启动子”可以指指导核酸转录的多个核酸控制序列中的任一个。通常,真核启动子包含转录起始位点附近的必需核酸序列,如在聚合酶ii型启动子的情况下,包含tata元件或被一种或多种转录因子识别的任何其它特异性dna序列。启动子的表达可以进一步受到增强子元件或阻遏子元件的调节。启动子的许多实例是可获得的并且为本领域普通技术人员所熟知。包括与编码特定多肽的核酸序列可操作地连接的启动子的核酸可以被称为表达载体。
118.重组:如本文所使用的,关于核酸或多肽的术语“重组”是指具有非天然存在的序列或具有通过人工组合两个或更多个以其它方式分离的序列区段而产生的序列,例如,包括异源抗原的cmv载体。这种人工组合通常通过化学合成来实现,或者更常见的是通过对分离的核酸区段进行人工操纵,例如通过基因工程化技术来实现。重组多肽还可以指使用重组核酸制备的多肽,包含转移到非多肽天然来源的宿主生物体的重组核酸(例如,编码形成包括异源抗原的cmv载体的多肽的核酸)。
119.药学上可接受的载体:如本文所使用的,使用的“药学上可接受的载体”是常规的。e.w.martin,马克出版公司(mack publishing co.),easton,pa,第19版,1995的《雷明顿药物科学(remington
′
s pharmaceutical sciences)》描述了适于本文所公开的药学上递送的组合物和调配物。通常,载体的性质将取决于所采用的特定施用模式。例如,肠胃外调配物通常包括可注射流体,其包含药学和生理学可接受的流体,如水、生理盐水、平衡盐溶液、葡萄糖水溶液、甘油等作为媒剂。对于固体组合物(如粉末、丸剂、片剂或胶囊形式),常规的无毒固体载体可以包含例如药物级的甘露醇、乳糖、淀粉或硬脂酸镁。除了生物学中性载体之外,要施用的药物组合物可以含有少量无毒的辅助物质,如湿润剂或乳化剂、防腐剂和ph缓冲剂等,例如,乙酸钠或脱水山梨糖醇单月桂酸酯。
120.多核苷酸:如本文所使用的,术语“多核苷酸”是指核糖核酸(rna)或脱氧核糖核酸(dna)的聚合物。多核苷酸由四个碱基;腺嘌呤、胞嘧啶、鸟嘌呤和胸腺嘧啶/尿嘧啶(尿嘧啶用于rna)构成。来自核酸的编码序列指示由核酸编码的蛋白质的序列。
121.多肽:术语“蛋白质”、“肽”、“多肽”和“氨基酸序列”在本文中可互换使用以指代任何长度的氨基酸残基的聚合物。聚合物可以是线性的或分支的,其可以包括经修饰的氨基
酸或氨基酸类似物并且可以被除氨基酸以外的化学部分中断。所述术语还涵盖天然地或通过干预修饰的氨基酸聚合物;例如,二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其它操作或修饰,如与标记性或生物活性组分缀合。
122.蛋白质的直系同源物的特征通常在于具有大于75%的序列同一性,其是使用设置为默认参数的align,在与特异性蛋白质的氨基酸序列的全长比对中计数的。当通过这种方法评估时,与参考序列具有甚至更大相似性的蛋白质将显示增加的百分比同一性,如至少80%、至少85%、至少90%、至少92%、至少95%或至少98%序列同一性。另外,可以在所公开的肽的特定结构域的全长上比较序列同一性。
123.序列同一性/相似性:如本文所使用的,两个或更多个核酸序列或两个或更多个氨基酸序列之间的同一性/相似性以序列之间的同一性或相似性表示。序列同一性可以以同一性百分比来测量;百分比越高,序列越相同。序列相似性可以用百分比同一性或相似性(考虑到保守氨基酸取代)来测量;百分比越高,序列越类似。具有大量序列同一性并且彼此功能相同或类似的多肽或其蛋白质结构域(例如,在不同物种中发挥相同功能的蛋白质或不改变蛋白质功能或其大小的蛋白质的突变形式)可以被称为“同源物”。
124.用于比较的序列比对方法在本领域中是众所周知的。各种程序和比对算法在以下中描述:smith和waterman,《高等应用数学(adv applmath)2,482(1981);needleman和wunsch,《分子生物学杂志(j mol biol)》48,443(1970);pearson和lipman,《美国国家科学院院刊(proc natl acad sci usa)》85,2444(1988);higgins和sharp,《基因(gene)》73,237-244(1988);higgins和sharp,cabios 5,151-153(1989);corpet等人,《核酸研究(nuc acids res)》16,10881-10890(1988);huang等人,《计算机应用生物科学(computer app biosci)》8,155-165(1992);以及pearson等人,《分子生物学方法(meth mol bio)》24,307-331(1994))。另外,altschul等人,《分子生物学杂志》215,403-410(1990)呈现了对序列比对方法和同源性计算的详细考虑。
125.ncbi基本局部比对搜索工具(blast)(altschul等人,(1990)同上)可从若干个来源获得,包含国家生物信息中心(national center for biological information)(ncbi,马里兰州贝塞斯达国家医学图书馆38a栋8n805室20894(national library of medicine,building 38a,room 8n805,bethesda,md 20894))和在网上,以用于与序列分析程序blastp、blastn、blastx、tblastn和tblastx结合使用。另外的信息可以在ncbi网站上找到。
126.blastn用于比较核酸序列,而blastp用于比较氨基酸序列。如果所述两个经比较的序列共享同源性,则指定的输出文件将把那些同源区呈现为经比对的序列。如果所述两个经比较的序列不共享同源性,则指定的输出文件将不呈现经比对的序列。
127.一旦经过比对,就通过对在两个序列中呈现相同的核苷酸或氨基酸残基的位置的数量进行计数来确定匹配数。序列同一性百分比是通过将匹配数除以经鉴定序列中示出的序列长度或除以铰接长度(如来自经鉴定序列中示出的序列的100个连续核苷酸或氨基酸残基),然后通过将结果值乘以100来确定。例如,当与具有1154个核苷酸的测试序列比对时,具有1166个匹配的核酸序列与测试序列有75.0%的同一性(1166
÷
1554*100=75.0)。百分比序列同一性值取整为最接近的十分之一。例如,75.11、75.12、75.13和75.14向下取整为75.1,而75.15、75.16、75.17、75.18和75.19向上取整为75.2。长度值将始终是整数。在另一个实例中,含有与来自如下已鉴定的序列的20个连续核苷酸比对的20个核苷酸区的靶
序列含有与已鉴定的序列具有75%序列同一性的区(即,15
÷
20*100=75)。
128.对于大于约30个氨基酸的氨基酸序列的比较,使用设置为默认参数的默认blosum62矩阵,采用blast 2序列函数(空位存在罚分为11,并且每个残基空位罚分为1)。同源物的特征通常在于具有至少70%的序列同一性,其是使用ncbi basic blast 2.0,如具有如nr数据库、swissprot数据库和专利序列数据库等数据库的带空位的blastp,在与氨基酸序列的全长比对中计数的。用blastn程序搜索的查询用dust过滤(hancock和armstrong,《计算机应用生物科学》10,67-70(1994)。其它程序使用seg。另外,可以执行手动比对。当通过这种方法评估时,具有更大相似性的蛋白质将显示出增加的同一性百分比,例如与蛋白质的序列同一性至少为约75%、80%、85%、90%、95%、98%或99%。
129.当比对短肽(少于约30个氨基酸)时,采用设置为默认参数的pam30矩阵,使用blast 2序列函数执行比对(开放空位9罚分,延伸空位1罚分)。当通过这种方法评估时,与参考序列具有更大相似性的蛋白质将显示出增加的同一性百分比,例如与蛋白质的序列同一性至少为约60%、70%、75%、80%、85%、90%、95%、98%或99%。当比较少于整个序列的序列同一性时,同源物通常在10-20个氨基酸的短窗口内具有至少75%的序列同一性,并且可能具有至少85%、90%、95%或98%的序列同一性,这取决于其与参考序列的同一性。在ncbi网站上描述了在这种短窗口内确定序列同一性的方法。
130.两个核酸分子密切相关的一个迹象是两个分子在严格条件下彼此杂交,如上文所描述的。由于遗传密码的简并性,未显示出高度同一性的核酸序列可能仍然编码相同或类似(保守)的氨基酸序列。可以使用这种简并性来改变核酸序列以产生编码基本上相同的蛋白质均的多个核酸分子。此类同源核酸序列可以例如与编码蛋白质的核酸具有至少约50%、60%、70%、80%、90%、95%、98%或99%的序列同一性。
131.受试者:如本文所使用的,术语“受试者”是指活的多细胞脊椎动物生物体,即包含人和非人哺乳动物两者的类别。
132.超表位:如本文所使用的,术语“超表位”或“超表位肽”是指无论mhc单倍型如何,即在存在或不存在给定mhc-i、mhc-ii或mhc-e等位基因的情况下,在超过约90%的人群中被t细胞识别的表位或肽。
133.治疗:如本文所使用的,术语“治疗”是指改善疾病或病理病状的体征或症状的干预。如本文所使用的,关于疾病、病理病状或症状的术语“治疗(treatment)”、“治疗(treat)”和“治疗(treating)”也指治疗的任何可观察到的有益效果。有益效果可以通过例如以下来证明:易感受试者中疾病的临床症状的延迟发作、疾病的一些或所有临床症状的严重程度降低、疾病的进展减慢、疾病复发的次数降低、受试者的整体健康或福祉的改善或者通过本领域众所周知的对特定疾病具有特异性的其它参数来证明。预防性治疗是对未表现出疾病体征或仅表现出早期体征的受试者施用的治疗,目的是降低发生病理的风险。治疗性治疗是在疾病的体征和症状出现后施用于受试者的治疗。
134.疫苗:一种免疫原性组合物,其可以施用于哺乳动物,如人,以赋予对疾病或其它病理病状的免疫力,如主动免疫力。疫苗可以用于预防或治疗。因此,疫苗可以用于降低患上疾病(如肿瘤或病理性感染)的可能性或降低疾病或病状的症状的严重程度,限制疾病或病状的进展(如肿瘤或病理性感染)或限制疾病或病状(如肿瘤)的复发。在特定实施例中,疫苗是表达异源抗原的复制缺陷型cmv,如源自肺、前列腺、卵巢、乳腺、结肠、宫颈、肝、肾、
骨或黑色素瘤的肿瘤的肿瘤相关抗原。
135.载体:可以将特定序列的核酸分子掺入到载体中,然后将其引入到宿主细胞中,由此产生转化的宿主细胞。载体可以包含允许其在宿主细胞如复制起点中进行复制的核酸序列。载体还可以包含一个或多个可选择标志物基因和本领域已知的其它基因元件,包含指导核酸表达的启动子元件。载体可以是病毒载体,如cmv载体。病毒载体可以由野生型或减毒病毒构建,包含复制缺陷型病毒。
136.ii.通过hcmv的ul18调节t细胞应答的方法
137.本文公开了通过hcmv的ul18调节t细胞应答的方法。所述方法涉及向受试者施用有效量的包括至少一种异源抗原的至少一种重组hcmv载体,其中hcmv载体不表达ul18。
138.在一些实施例中,所述方法进一步包括产生对所述至少一种异源抗原的免疫应答,所述方法包括以有效引起对所述至少一种异源抗原的cd8 t细胞应答的量向受试者施用hcmv载体。在一些实施例中,所述方法进一步包括治疗或预防受试者的癌症,所述方法包括以有效引起对至少一种异源抗原的cd8 t细胞应答的量施用hcmv载体。在一些实施例中,所述方法进一步包括治疗或预防受试者的病原体感染,所述方法包括以有效引起对至少一种异源抗原的cd8 t细胞应答的量施用hcmv载体。在一些实施例中,所述方法进一步包括治疗受试者的自身免疫性疾病或病症,所述方法包括以有效引起对所述至少一种异源抗原的cd8 t细胞应答的量向受试者施用hcmv载体。
139.在一些实施例中,ul18缺陷型hcmv载体由于编码ul128、ul130、ul146或ul147的核酸序列中存在突变而也不表达ul128蛋白、ul130蛋白、ul146蛋白和ul147蛋白。另外,ul18缺陷型hcmv载体中的任何载体由于编码us11和/或ul82的核酸序列中存在突变而可能缺乏us11蛋白和/或ul82蛋白。突变可以是导致活性蛋白缺乏表达的任何突变。此类突变可以包含点突变、移码突变、少于编码蛋白质的整个序列的缺失(截短突变)、或编码蛋白质的整个核酸序列的缺失或任何其它突变。
140.在一些实施例中,hcmv载体缺乏ul18、ul128、ul130、ul146和ul147,并且表达ul40和us28。
141.在一些实施例中,hcmv载体包括编码微rna(mirna)识别元件(mre)的核酸序列。在一些实施例中,hcmv载体缺乏ul18、ul128、ul130、ul146和ul147(以及任选地ul82),并且表达ul40和us28,并且mre含有在内皮细胞中表达的mirna的靶位点。在内皮细胞中表达的此类mirna的实例是mir126、mir-126-3p、mir-130a、mir-210、mir-221/222、mir-378、mir-296和mir-328。在一些实施例中,hcmv载体缺乏ul18,并且mre含有在骨髓细胞中表达的mirna的靶位点。在骨髓细胞中表达的此类mirna的实例是mir-142-ep、mir-223、mir-27a、mir-652、mir-155、mir-146a、mir-132、mir-21和mir-125。
142.mre可以是在存在由内皮细胞表达的mirna的情况下,沉默表达的任何mirna识别元件。mre可以是在存在由骨髓细胞表达的mirna的情况下,沉默表达的任何mirna识别元件。此类mre可以是mirna的精确互补体。可替代地,其它序列可以用作给定mirna的mre。例如,mre可以根据序列来预测。在一个实例中,可以在网站microrna.org(www.microrna.org)上搜索mirna。进而,将列出mirna的mrna靶标列表。对于页面上列出的每个靶标,可以访问“比对详细信息”并访问推定的mre。
143.本领域普通技术人员可以从文献中选择经验证的、推定的或突变的mre序列,预测
所述序列在存在在如巨噬细胞等骨髓细胞中表达的mirna的情况下诱导沉默。一个实例涉及上文提及的网站。本领域普通技术人员然后可以获得表达构建体,由此报告基因(如荧光蛋白、酶或其它报告基因)具有由启动子如组成型活性启动子或细胞特异性启动子驱动的表达。然后可以将mre序列引入到表达构建体中。可以将表达构建体转染到合适的细胞中,并且将细胞用所关注的mirna转染。报告基因缺乏表达表明mre在存在mirna的情况下使基因表达沉默。
144.在一些实施例中,所述异源抗原可以是病原体特异性抗原、肿瘤抗原、肿瘤特异性抗原或宿主自身抗原。在一些实施例中,所述宿主自身抗原源自t细胞受体(tcr)的可变区或是源自b细胞受体的可变区的抗原。
145.病原体特异性抗原可以源自例如人免疫缺陷病毒、猿猴免疫缺陷病毒、1型单纯疱疹病毒、2型单纯疱疹病毒、乙型肝炎病毒、丙型肝炎病毒、乳头瘤病毒、疟原虫、破伤风梭菌(clostridium tetani)和结核分枝杆菌。
146.肿瘤抗原相对限于肿瘤细胞,并且可以是任何诱导免疫应答的蛋白质。然而,许多肿瘤抗原是宿主(自身)蛋白,并且因此通常不会被宿主免疫系统视为抗原。肿瘤抗原也可以由癌细胞异常表达。肿瘤抗原也可以是在癌细胞中表达的种系/睾丸抗原、不在成人组织中表达的细胞谱系分化抗原或在癌细胞中过表达的抗原。肿瘤抗原包含但不限于前列腺酸性磷酸酶(pap);威耳姆氏肿瘤抑制蛋白(wilms tumor suppressor protein,wt1);间皮素(msln);her-2(her2);hpv16病毒株的人乳头瘤病毒抗原e6;hpv16病毒株的人乳头瘤病毒抗原e7;hpv18病毒株的人乳头瘤病毒抗原e6;hpv18病毒株的人乳头瘤病毒抗原e7;来自hpv16和hpv18的人乳头瘤病毒e6和e7的融合蛋白;粘蛋白1(muc1);lmp2;表皮生长因子受体(egfr);p53;纽约食道1(ny-eso-1);前列腺特异性膜抗原(psma);gd2;癌胚抗原(cea);黑色素瘤抗原a/t细胞识别的黑色素瘤抗原1(melana/mart1);ras;gp100;蛋白酶3(pr1);bcr-abl;存活素;前列腺特异性抗原(psa);人端粒酶逆转录酶(htert);epha2;ml-iap;甲胎蛋白(afp);epcam;erg;na17;pax3;alk;雄激素受体(ar);细胞周期蛋白b1;mycn;rhoc;酪氨酸相关蛋白2(trp-2);gd3;岩藻糖基gm1;psca;sle(a);cyp1b1;plca1;gm3;boris;tn;globoh;ets变异基因6/急性髓性细胞白血病1基因ets(etv6-aml);ny-br-1;rgs5;鳞状抗原排斥肿瘤或3(sart3);stn;碳酸酐酶ix;pax5;oy-tes1;精子蛋白17;lck;hmwmaa;akap-4;ssx2;b7h3;豆荚蛋白;tie 2;page4;vegfr2;mad-ct-1;fap;pdgfr;mad-ct-2;fos相关抗原1;tag-72;9d7;epha3;端粒酶;sap-1;bage家族;cage家族;gage家族;mage家族;sage家族;xage家族;优先表达黑色素瘤抗原(prame);黑皮质素1受体(mc1r);β-连环蛋白;brca1/2;cdk4;慢性髓性白血病66(cml66);tgf-β。在某些实施例中,宿主自身抗原包含前列腺酸性磷酸酶、威耳姆氏肿瘤抑制蛋白、间皮素或her-2。
147.在一些实施例中,肿瘤抗原源自癌症。癌症包含但不限于以下:急性淋巴细胞性白血病;急性髓性白血病;肾上腺皮质癌;aids相关癌症;aids相关淋巴瘤;肛门癌;阑尾癌;儿童小脑或大脑星形细胞瘤;基底细胞癌;肝外胆管癌;膀胱癌;骨癌,骨肉瘤/恶性纤维组织细胞瘤;脑干胶质瘤;脑瘤;脑瘤,小脑星形细胞瘤;脑瘤,大脑星形细胞瘤/恶性神经胶质瘤;脑瘤,室管膜瘤;脑瘤,成神经管细胞瘤;脑瘤,儿童幕上原始神经外胚层肿瘤;脑瘤,儿童视觉通路和下丘脑神经胶质瘤;乳腺癌;儿童支气管腺瘤/类癌;伯基特淋巴瘤(burkitt lymphoma);儿童类癌瘤;胃肠道类癌;原发性不明肿瘤;原发性中枢神经系统淋巴瘤;儿童
小脑星形细胞瘤;儿童大脑星形细胞瘤/恶性神经胶质瘤;宫颈癌;儿童癌症;慢性淋巴细胞性白血病;慢性粒细胞白血病;慢性骨髓增生性病症;结肠癌;皮肤t细胞淋巴瘤;促结缔组织增生性小圆细胞肿瘤;子宫内膜癌;室管膜瘤;食管癌;尤文氏肿瘤中的尤文氏肉瘤(ewing
′
s sarcoma);儿童颅外生殖细胞肿瘤;性腺外生殖细胞瘤;肝外胆管癌;眼癌,眼内黑色素瘤;视网膜母细胞瘤眼癌;胆囊癌;胃(胃)癌;胃肠道类癌;胃肠道间质瘤(gist);生殖细胞肿瘤:颅外、性腺外或卵巢;妊娠滋养细胞肿瘤;儿童脑干胶质瘤;儿童大脑星形细胞瘤胶质瘤;儿童视觉通路和下丘脑胶质瘤;胃癌;毛细胞白血病;头颈癌;心脏癌症;肝细胞(肝)癌;霍奇金淋巴瘤;下咽癌;儿童下丘脑和视觉通路胶质瘤;眼内黑色素瘤;胰岛细胞癌(内分泌胰腺);卡波西氏肉瘤(kaposi sarcoma);肾癌(肾细胞癌);喉癌;白血病;白血病,急性淋巴细胞性白血病(也称为急性淋巴细胞性细胞白血病);白血病,急性髓性白血病(也称为急性髓性白血病);白血病,慢性淋巴细胞性白血病(也称为慢性淋巴细胞性白血病);白血病,慢性髓性白血病(也称为慢性髓性白血病);毛细胞白血病;唇癌和口腔癌;(原发性)肝癌;非小细胞肺癌;小细胞肺癌;淋巴瘤;aids相关淋巴瘤;伯基特淋巴瘤;皮肤t细胞淋巴瘤;霍奇金淋巴瘤;非霍奇金淋巴瘤(霍奇金以外的所有淋巴瘤的旧分类);原发性中枢神经系统淋巴瘤;马库斯
·
惠特尔致命疾病(marcus whittle,deadly disease);瓦尔登斯特伦巨球蛋白血症(macroglobulinemia,waldenstrim);骨恶性纤维组织细胞瘤/骨肉瘤;儿童成神经管细胞瘤;黑色素瘤;眼内(眼)黑色素瘤;梅克尔细胞癌(merkel cell carcinoma);成人恶性间皮瘤;儿童间皮瘤;原发不明的转移性鳞状颈癌;口腔癌(mouth cancer);儿童多发性内分泌腺瘤综合征;多发性骨髓瘤/浆细胞赘瘤;蕈样肉芽肿;骨髓增生异常综合征;骨髓增生异常/骨髓增生性疾病;慢性粒细胞白血病;成人急性髓性白血病;儿童急性髓性白血病;多发性骨髓瘤(骨髓癌);慢性骨髓增生性疾病;鼻腔和副鼻窦癌;鼻咽癌;成神经细胞瘤;非霍奇金淋巴瘤;非小细胞肺癌;口腔癌;口咽癌;骨肉瘤/骨恶性纤维组织细胞瘤;卵巢癌;卵巢上皮癌(表面上皮-间质瘤);卵巢生殖细胞肿瘤;卵巢低恶性潜在肿瘤;胰腺癌;胰岛细胞肿瘤胰腺癌;副鼻窦和鼻腔癌;甲状旁腺癌;阴茎癌;咽癌;嗜铬细胞瘤;松果体星形细胞瘤;松果体生殖细胞瘤;儿童松果体母细胞瘤和幕上原始神经外胚层肿瘤;垂体腺瘤;浆细胞赘瘤/多发性骨髓瘤;胸膜肺母细胞瘤;原发性中枢神经系统淋巴瘤;前列腺癌;直肠癌;肾细胞癌(肾癌);肾盂和输尿管移行细胞癌;视网膜母细胞瘤;儿童横纹肌肉瘤;唾液腺癌;尤文氏肿瘤家族肉瘤;卡波西肉瘤;软组织肉瘤;子宫肉瘤;塞扎里综合征(sezary syndrome);皮肤癌(非黑色素瘤);皮肤癌(黑色素瘤);梅克尔细胞皮肤癌;小细胞肺癌;小肠癌;软组织肉瘤;鳞状细胞癌——参见皮肤癌(非黑色素瘤);原发不明的转移性鳞状颈癌;胃癌;儿童幕上原始神经外胚层肿瘤;皮肤t细胞淋巴瘤(蕈样真菌病和塞扎里综合征);睾丸癌;咽喉癌;儿童胸腺瘤;胸腺瘤和胸腺癌;甲状腺癌;儿童甲状腺癌;肾盂和输尿管的移行细胞癌;妊娠滋养细胞肿瘤;成人未知原发部位的癌症;儿童未知原发部位的癌症;输尿管肾盂移行细胞癌;尿道癌;子宫内膜子宫癌;子宫肉瘤;阴道癌;儿童视觉通路和下丘脑神经胶质瘤;外阴癌;瓦尔登斯特伦巨球蛋白血症;和威耳姆氏肿瘤(肾癌)。
148.在一些实施例中,所述病原体特异性抗原是mhc-e超表位。在一些实施例中,所述mhc-e超表位是hiv表位。在一些实施例中,所述mhc-e超表位与以下至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%或100%相同:ldawekirlrpggkk(seq id no:13);dawekirlr(seq id no:14);
kkaqqaaadtgnssq(seq id no:15);kaqqaaadt(seq id no:16);qmvhqaisprtlnaw(seq id no:17);hqaisprtl(seq id no:18);ntmlntvgghqaamq(seq id no:19);vgghqaamq(seq id no:20);stlqeqigwmtnnpp(seq id no:21);stlqeqigw(seq id no:22);ivrmyspvsildirq(seq id no:23);rmyspvsil(seq id no:24);qkqepidkelyplas(seq id no:25);kqepidkel(seq id no:26);sfsfpqitlwqrplv(seq id no:27):vrqydqilieicgkk(seq id no:28):epfrkqnpdiviyql(seq id no:29);yvdgaanretklgka(seq id no:30);eehekysnwramas(seq id no:31);或ildlwvyhtqgyfpd(seq id no:32)。在一些实施例中,所述mhc-e超表位中的一个或多个用于产生融合蛋白。融合蛋白可以以任何顺序含有mhc-e超表位中的一个或多个。
149.在一些实施例中,以有效引起对至少一种异源抗原的cd8 t细胞应答的量施用hcmv载体。在一些实施例中,由载体引起的cd8 t细胞应答的特征在于具有针对由mhc-e呈递的表位的cd8 t细胞中至少10%。在另外的实例中,cd8 t细胞中至少15%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%受mhc-e限制。在一些实施例中,受mhc-e限制的cd8 t细胞识别由至少90%的用载体免疫的其它受试者共有的肽。在一些实施例中,cd8 t细胞针对由mhc-e呈递的超表位。
150.在一些实施例中,所述方法进一步包括从由hcmv载体引起的cd8 t细胞中鉴定cd8 t细胞受体(tcr)。
151.tcr可以通过dna或rna测序鉴定。在一些实施例中,cd8 tcr识别mhc-e/异源抗原源性肽复合物。在一些实施例中,cd8 tcr识别mhc-e超表位。在一些实施例中,所述mhc-e超表位是人免疫缺陷病毒表位。在一些实施例中,所述mhc-e超表位与以下至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%或100%相同:ldawekirlrpggkk(seq id no:13);dawekirlr(seq id no:14);kkaqqaaadtgnssq(seq id no:15);kaqqaaadt(seq id no:16);qmvhqaisprtlnaw(seq id no:17);hqaisprtl(seq id no:18);ntmlntvgghqaamq(seq id no:19);vgghqaamq(seq id no:20);stlqeqigwmtnnpp(seq id no:21);stlqeqigw(seq id no:22);ivrmyspvsildirq(seq id no:23);rmyspvsil(seq id no:24);qkqepidkelyplas(seq id no:25);kqepidkel(seq id no:26);sfsfpqitlwqrplv(seq id no:27);vrqydqilieicgkk(seq id no:28);epfrkqnpdiviyql(seq id no:29);yvdgaanretklgka(seq id no:30);eehekysnwramas(seq id no:31);或ildlwvyhtqgyfpd(seq id no:32)。
152.在一些实施例中,所述方法进一步包括使用超表位肽从cd8 t细胞中鉴定mhc-e限制性cd8 t细胞受体(tcr),所述cd8 t细胞是由表达ul128、ul130、ul146和ul147(以及任选地ul82)的直系同源物有缺陷,并表达ul40和us28的直系同源物的非人灵长类动物cmv,如恒河猴或食蟹猴cmv(rhcmv或cycmv)引起的。mhc-e限制性cd t细胞将在具有rhcmv的恒河猴或具有cycmv的食蟹猴中引起。
153.在一些实施例中,由hcmv载体引起的cd8 t细胞应答的特征在于具有针对由mhc-ii呈递的表位的cd8 t细胞中至少10%。在另外的实例中,cd8 t细胞中至少15%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%受mhc-ii的限制。在一些实施例中,受mhc-ii限制的cd8 t细胞识别
由至少90%的用载体免疫的其它受试者共有的肽。在一些实施例中,cd8 t细胞针对由mhc-ii呈递的超表位。
154.在一些实施例中,所述方法进一步包括从由hcmv载体引起的cd8 t细胞中鉴定cd8 t细胞受体(tcr)。tcr可以通过dna或rna测序鉴定。在一些实施例中,cd8 tcr识别mhc-ii/异源抗原源性肽复合物。在一些实施例中,cd8 tcr识别mhc-ii超表位。
155.在一些实施例中,由也缺乏us11的ul18缺陷型hcmv载体引起的cd8 t细胞应答的特征在于具有针对由mhc-ia呈递的表位的cd8 t细胞中至少10%。在另外的实例中,cd8 t细胞中至少15%、至少20%、至少30%、至少40%、至少50%、至少60%、至少75%、至少90%、至少95%或至少95%受mhc-ia的限制。
156.在一些实施例中,所述方法进一步包括从由缺乏ul18和us11的hcmv载体引起的cd8 t细胞中鉴定cd8 t细胞受体(tcr)。tcr可以通过dna或rna测序鉴定。在一些实施例中,cd8 tcr识别mhc-ia/异源抗原源性肽复合物。
157.本文还公开了一种产生识别mhc-e肽复合物的cd8 t细胞的方法。此方法涉及以有效产生识别mhc-i/肽复合物的一组cd8 t细胞的量向第一受试者施用hcmv载体。cmv载体包括编码至少一种异源抗原的第一核酸序列并且不表达以下:ul18蛋白、ul128蛋白、ul130蛋白、ul146蛋白和ul147蛋白。载体也可能缺乏ul82蛋白。在一些实施例中,hcmv载体表达ul40和us28。在一些实施例中,hcmv载体不表达ul18蛋白、ul138蛋白、ul130蛋白、ul146蛋白和ul147蛋白并且包括编码ul40、us28和微rna(mirna)识别元件(mre)的核酸序列。在一些实施例中,mre含有在内皮细胞中表达的mirna的靶位点。在内皮细胞中表达的此类mirna的实例是mir126、mir-126-3p、mir-130a、mir-210、mir-221/222、mir-378、mir-296和mir-328。
158.抗原可以是任何抗原,包含病原体特异性抗原、肿瘤病毒抗原、肿瘤抗原或宿主自身抗原。在一些实施例中,宿主自身抗原是源自t细胞受体或b细胞受体的可变区的抗原。
159.此方法进一步包括:从所述一组cd8 t细胞中鉴定第一cd8 t细胞受体,其中所述第一cd8 t细胞受体识别mhc-e/异源抗原源性肽复合物。在一些实施例中,所述第一cd8 t细胞受体是通过dna或rna测序鉴定的。在一些实施例中,此方法可以进一步包括:将所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-e/异源抗原源性肽复合物的一个或多个cd8 t细胞,其中表达载体包括编码第二cd8 t细胞受体的核酸序列和与编码所述t细胞受体的核酸序列可操作地连接的启动子,其中第二cd8 t细胞受体包括第一cd8 t细胞受体的cdr3α和cdr3β。用于用表达载体转染的所述一个或多个cd8 t细胞可以从第一受试者或第二受试者分离。
160.在一些实施例中,所述方法进一步包括:从由所述hcmv载体引起的所述cd8 t细胞中鉴定cd8 t细胞受体,其中所述cd8 t细胞受体识别mhc-e/异源抗原源性肽复合物。在一些实施例中,所述方法进一步包括从cd8 t细胞中鉴定mhc-e限制性cd8 t细胞受体,所述cd8 t细胞是由表达ul128、ul130、ul146和ul147的直系同源物有缺陷,并表达ul40和us28的直系同源物的非人灵长类动物cmv,如恒河猴或食蟹猴cmv(rhcmv或cycmv)引起的。mhc-e限制性cd8 t细胞将在具有rhcmv的恒河猴或具有cycmv的食蟹猴中引起。在一些实施例中,所述cd8 t细胞受体是通过rna或dna测序鉴定的。在一些实施例中,所述方法进一步包括识别mhc-e超表位的cd8 t细胞受体。在一些实施例中,所述mhc-e超表位是人免疫
no:19);vgghqaamq(seq id no:20);stlqeqigwmtnnpp(seq id no:21);stlqeqigw(seq id no:22);ivrmyspvsildirq(seq id no:23);rmyspvsil(seq id no:24);qkqepidkelyplas(seq id no:25);kqepidkel(seq id no:26);sfsfpqitlwqrplv(seq id no:27);vrqydqilieicgkk(seq id no:28);epfrkqnpdiviyql(seq id no:29);yvdgaanretklgka(seq id no:30);eehekysnwramas(seq id no:31);或ildlwvyhtqgyfpd(seq id no:32)。
165.在一些实施例中,编码所述第二cd8 tcr的所述核酸序列与编码所述第一cd8 tcr的所述核酸序列相同。在一些实施例中,所述第一受试者和/或所述第二受试者是人或非人灵长类动物。在一些实施例中,所述第二cd8 tcr是嵌合cd8 tcr。在一些实施例中,所述第一受试者是非人灵长类动物,并且所述第二受试者是人,并且其中所述第二cd8 tcr是包括所述第一cd8 tcr的非人灵长类动物cdr3α和cdr3β的嵌合非人灵长类动物-人cd8 tcr。在一些实施例中,所述第二cd8 tcr包括所述第一cd8 tcr的非人灵长类动物cdr1α、cdr2α、cdr3α、cdr1β、cdr2β和cdr3β。在一些实施例中,所述第二cd8 tcr包括所述第一cd8 tcr的cdr1α、cdr2α、cdr3α、cdr1β、cdr2β和cdr3β。
166.本文还公开了治疗疾病如癌症、病原体感染或免疫疾病或病症的方法,所述方法包括向第一受试者或第二受试者施用识别mhc-e肽复合物的经转染的t细胞。本文还公开了诱导对宿主自身抗原或组织特异性抗原的免疫应答的方法,所述方法包括向第一受试者或第二受试者施用识别mhc-e肽复合物的经转染的t细胞。
167.癌症包含但不限于急性髓性白血病、慢性髓性白血病、骨髓增生异常综合征、急性淋巴细胞性白血病、慢性淋巴细胞性白血病、急性淋巴细胞性白血病、非霍奇金淋巴瘤、多发性骨髓瘤、恶性黑色素瘤、间皮瘤、恶性间皮瘤、肾癌、宫颈癌、口咽癌、肛门癌、阴茎癌、阴道癌、外阴癌、乳腺癌、肺癌、卵巢癌、前列腺癌、胰腺癌、结肠癌、肾细胞癌和生殖细胞肿瘤。
168.病原体感染包含但不限于人免疫缺陷病毒、i型单纯疱疹病毒、2型单纯疱疹病毒、乙型肝炎病毒、丙型肝炎病毒、乳头瘤病毒、疟原虫和结核分枝杆菌。
169.此处还公开了产生识别mhc-e肽复合物的cd8 t细胞的方法,所述方法包括:(a)从识别mhc-e与所述hiv超表位肽的复合物的一组cd8 t细胞中鉴定识别mhc-e/超表位肽复合物的第一cd8 tcr,其中所述一组cd8 t细胞由有效产生所述一组cd8 t细胞的量生物缺乏ul128、ul130、ul146和ul147的直系同源物并表达hiv抗原的重组恒河猴(rhcmv)或食蟹猴cmv(cyccmv)载体产生,(b)从第二受试者中分离一个或多个cd8 t细胞;以及(c)将所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-e肽复合物的一个或多个cd8 t细胞,其中所述表达载体包括编码第二cd8 tcr的核酸序列和与编码所述第二cd8 tcr的所述核酸序列可操作地连接的启动子,其中所述第二cd8 tcr包括所述第一cd8 tcr的cdr3α和cdr3β。
170.本文还公开了一种产生识别mhc-ii肽复合物的cd8 t细胞的方法。此方法涉及以有效产生识别mhc-ii/肽复合物的一组cd8 t细胞的量向第一受试者(或动物)施用cmv载体。cmv载体包括编码至少一种异源抗原的第一核酸序列并且不表达以下:ul18蛋白、ul128蛋白、ul130蛋白、ul146蛋白或ul147蛋白,以及在一些实施例中,ul82蛋白。
171.在一些实施例中,缺乏ul18的hcmv载体还包括编码微rna(mirna)识别元件(mre)的核酸序列。在一些实施例中,mre含有在骨髓细胞中表达的mirna的靶位点。在骨髓细胞中表达的此类mirna的实例是mir-142-ep、mir-223、mir-27a、mir-652、mir-155、mir-146a、
mir-132、mir-21和mir-125。
172.抗原可以是任何抗原,包含病原体特异性抗原、肿瘤病毒抗原、肿瘤抗原或宿主自身抗原。在一些实施例中,宿主自身抗原是源自t细胞受体或b细胞受体的可变区的抗原。
173.此方法进一步包括:从所述一组cd8 t细胞中鉴定第一cd8 t细胞受体,其中所述第一cd8 t细胞受体识别mhc-ii/异源抗原源性肽复合物。在一些实施例中,所述第一cd8 t细胞受体是通过dna或rna测序鉴定的。在一些实施例中,此方法可以进一步包括:将所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-ii/异源抗原源性肽复合物的一个或多个经转染的cd8 t细胞,其中所述表达载体包括编码第二cd8 t细胞受体的核酸序列和与编码所述t细胞受体的所述核酸序列可操作地连接的启动子,其中所述第二cd8 t细胞受体包括所述第一cd8 t细胞受体的cdr3α和cdr3β。用于用表达载体转染的所述一个或多个cd8 t细胞可以从第一受试者或第二受试者分离。
174.在一些实施例中,所述方法进一步包括:从由所述hcmv载体引起的所述cd8 t细胞中鉴定cd8 t细胞受体,其中所述cd8 t细胞受体识别mhc-ii/异源抗原源性肽复合物。在一些实施例中,所述cd8 t细胞受体是通过rna或dna测序鉴定的。在一些实施例中,所述方法进一步包括识别mhc-h超表位的cd8 t细胞受体。
175.还公开了产生识别mhc-h肽复合物的cd8 t细胞的方法,所述方法包括:(a)从识别mhc-ii/肽复合物的一组cd8 t细胞中鉴定识别mhc-ii/异源抗原源性肽复合物的第一cd8 tcr,其中所述一组cd8 t细胞由所述重组hcmv载体产生;(b)从第二受试者中分离一个或多个cd8 t细胞;以及(c)将所述一个或多个cd8 t细胞用表达载体转染,由此产生ii识别mhc-ii肽复合物的一个或多个cd8 t细胞,其中所述表达载体包括编码第二cd8 tcr的核酸序列和与编码所述第二cd8 tcr的所述核酸序列可操作地连接的启动子,其中所述第二cd8 tcr包括所述第一cd8 tcr的cdr3α和cdr3β。
176.还公开了通过包括以下步骤的方法制备的识别mhc-ii肽复合物的tcr-转染的cd8 t细胞:(1)以有效产生识别mhc-ii/肽复合物的一组cd8 t细胞的量向第一受试者施用缺乏ul18的hcmv载体(ul128、ul130、ul146或ul147(或其组合)也缺失,并且在一些实施例中,ul82缺失;和/或表达编码微rna识别元件的核酸),其中所述重组cmv载体包括至少一种异源抗原;(2)从所述一组cd8 t细胞中鉴定第一cd8 t细胞受体,其中所述第一cd8 t细胞受体识别mhc-ii/异源抗原源性肽复合物;(3)从所述第一受试者或第二受试者中分离一个或多个cd8 t细胞;以及(4)将从所述第一受试者或所述第二受试者中分离的所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-ii肽复合物的经转染的t细胞,其中所述经转染的cd8 t细胞对所述mhc-ii/异源抗原源性肽复合物产生免疫应答。
177.在一些实施例中,此方法可以进一步包括:将所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-ii/异源抗原源性肽复合物的一个或多个经转染的cd8 t细胞,其中所述表达载体包括编码第二cd8 t细胞受体的核酸序列和与编码所述t细胞受体的所述核酸序列可操作地连接的启动子,其中所述第二cd8 t细胞受体包括所述第一cd8 t细胞受体的cdr3α和cdr3β。用于用表达载体转染的所述一个或多个cd8 t细胞可以从第一受试者或第二受试者分离。
178.在一些实施例中,所述第一和/或第二cd8 t细胞受体是通过rna或dna测序鉴定的。在一些实施例中,所述第一和/或第二cd8 t细胞受体识别mhc-ii超表位。
179.在一些实施例中,编码所述第二cd8 tcr的所述核酸序列与编码所述第一cd8 tcr的所述核酸序列相同。在一些实施例中,所述第一受试者和/或所述第二受试者是人或非人灵长类动物。在一些实施例中,所述第二cd8 tcr是嵌合cd8 tcr。在一些实施例中,所述第一受试者是非人灵长类动物,并且所述第二受试者是人,并且其中所述第二cd8 tcr是包括所述第一cd8 tcr的非人灵长类动物cdr3α和cdr3β的嵌合非人灵长类动物-人cd8 tcr。在一些实施例中,所述第二cd8 tcr包括所述第一cd8 tcr的非人灵长类动物cdr1α、cdr2α、cdr3α、cdr1β、cdr2β和cdr3β。在一些实施例中,所述第二cd8 tcr包括所述第一cd8 tcr的cdr1α、cdr2α、cdr3α、cdr1β、cdr2β和cdr3β。
180.本文还公开了治疗疾病如癌症、病原体感染或免疫疾病或病症的方法,所述方法包括向第一受试者或第二受试者施用识别mhc-ii肽复合物的经转染的t细胞。本文还公开了诱导对宿主自身抗原或组织特异性抗原的免疫应答的方法,所述方法包括向第一受试者或第二受试者施用识别mhc-ii肽复合物的经转染的t细胞。
181.癌症包含但不限于急性髓性白血病、慢性髓性白血病、骨髓增生异常综合征、急性淋巴细胞性白血病、慢性淋巴细胞性白血病、急性淋巴细胞性白血病、非霍奇金淋巴瘤、多发性骨髓瘤、恶性黑色素瘤、间皮瘤、恶性间皮瘤、肾癌、宫颈癌、口咽癌、肛门癌、阴茎癌、阴道癌、外阴癌、乳腺癌、肺癌、卵巢癌、前列腺癌、胰腺癌、结肠癌、肾细胞癌和生殖细胞肿瘤。
182.病原体感染包含但不限于人免疫缺陷病毒、i型单纯疱疹病毒、2型单纯疱疹病毒、乙型肝炎病毒、丙型肝炎病毒、乳头瘤病毒、疟原虫和结核分枝杆菌。
183.本文还公开了一种产生识别mhc-ia肽复合物的cd8 t细胞的方法。此方法涉及以有效产生识别mhc-ia/肽复合物的一组cd8 t细胞的量向第一受试者施用缺乏ul18也缺乏us11蛋白的cmv载体。cmv载体包括编码至少一种异源抗原的第一核酸序列并且不表达以下:us11蛋白和ul18蛋白。载体还可能缺乏ul128蛋白、ul130蛋白或ul146蛋白、ul147蛋白和/或ul82蛋白。抗原可以是任何抗原,包含病原体特异性抗原、肿瘤病毒抗原、肿瘤抗原或宿主自身抗原。在一些实施例中,宿主自身抗原是源自t细胞受体或b细胞受体的可变区的抗原。
184.此方法进一步包括:从所述一组cd8 t细胞中鉴定第一cd8 t细胞受体,其中所述第一cd8 t细胞受体识别mhc-ia/异源抗原源性肽复合物。在一些实施例中,所述第一cd8 t细胞受体是通过dna或rna测序鉴定的。在一些实施例中,此方法可以进一步包括:将所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-ia/异源抗原源性肽复合物的一个或多个经转染的cd8 t细胞,其中所述表达载体包括编码第二cd8 t细胞受体的核酸序列和与编码所述t细胞受体的所述核酸序列可操作地连接的启动子,其中所述第二cd8 t细胞受体包括所述第一cd8 t细胞受体的cdr3α和cdr3β。用于用表达载体转染的所述一个或多个cd8 t细胞可以从第一受试者或第二受试者分离。
185.在一些实施例中,所述方法进一步包括:从由所述cmv载体引起的所述cd8 t细胞中鉴定cd8 t细胞受体,其中所述cd8 t细胞受体识别mhc-ia/异源抗原源性肽复合物。在一些实施例中,所述cd8 t细胞受体是通过rna或dna测序鉴定的。
186.还公开了产生识别mhc-i肽复合物的cd8 t细胞的方法,所述方法包括:(a)从识别mhc-i/异源抗原源性肽复合物的一组cd8 t细胞中鉴定识别mhc-i/异源抗原源性肽复合物的第一cd8 tcr,其中所述一组cd8 t细胞由所述重组hcmv载体产生;(b)从第二受试
者中分离一个或多个cd8 t细胞;以及(c)将所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-i肽复合物的一个或多个cd8 t细胞,其中所述表达载体包括编码第二cd8 tcr的核酸序列和与编码所述第二cd8 tcr的所述核酸序列可操作地连接的启动子,其中所述第二cd8 tcr包括所述第一cd8 tcr的cdr3α和cdr3β。
187.还公开了通过包括以下步骤的方法制备的识别mhc-ia肽复合物的经转染的cd8 t细胞:(1)以有效产生识别mhc-ia/肽复合物的一组cd8 t细胞的量向第一受试者施用缺乏us11和ul18的cmv载体(另外,载体可能缺乏ul128、ul130、ul146、ul147和/或ul82;表达ul40和/或us28),其中所述重组cmv载体包括至少一种异源抗原;(2)从所述一组cd8 t细胞中鉴定第一cd8 t细胞受体,其中所述第一cd8 t细胞受体识别mhc-ia/异源抗原源性肽复合物;(3)从所述第一受试者或第二受试者中分离一个或多个cd8 t细胞;以及(4)将从所述第一受试者或所述第二受试者中分离的所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-ia肽复合物的经转染的t细胞,其中所述经转染的cd8 t细胞对所述mhc-ia/异源抗原源性肽复合物产生免疫应答。
188.在一些实施例中,此方法可以进一步包括:将所述一个或多个cd8 t细胞用表达载体转染,由此产生识别mhc-ia/异源抗原源性肽复合物的一个或多个经转染的cd8 t细胞,其中所述表达载体包括编码第二cd8 t细胞受体的核酸序列和与编码所述t细胞受体的所述核酸序列可操作地连接的启动子,其中所述第二cd8 t细胞受体包括所述第一cd8 t细胞受体的cdr3α和cdr3β。用于用表达载体转染的所述一个或多个cd8 t细胞可以从第一受试者或第二受试者分离。
189.在一些实施例中,所述第一和/或第二cd8 t细胞受体是通过rna或dna测序鉴定的。
190.在一些实施例中,编码所述第二cd8 tcr的所述核酸序列与编码所述第一cd8 tcr的所述核酸序列相同。在一些实施例中,所述第二cd8 tcr是嵌合cd8 tcr。在一些实施例中,所述第二cd8 tcr包括所述第一cd8 tcr的cdr1α、cdr2α、cdr3α、cdr1β、cdr2β和cdr3β。
191.本文还公开了治疗疾病如癌症、病原体感染或免疫疾病或病症的方法,所述方法包括向第一受试者或第二受试者施用识别mhc-ia肽复合物的经转染的t细胞。本文还公开了诱导对宿主自身抗原或组织特异性抗原的免疫应答的方法,所述方法包括向第一受试者或第二受试者施用识别mhc-ia肽复合物的经转染的t细胞。
192.癌症包含但不限于急性髓性白血病、慢性髓性白血病、骨髓增生异常综合征、急性淋巴细胞性白血病、慢性淋巴细胞性白血病、急性淋巴细胞性白血病、非霍奇金淋巴瘤、多发性骨髓瘤、恶性黑色素瘤、间皮瘤、恶性间皮瘤、肾癌、宫颈癌、口咽癌、肛门癌、阴茎癌、阴道癌、外阴癌、乳腺癌、肺癌、卵巢癌、前列腺癌、胰腺癌、结肠癌、肾细胞癌和生殖细胞肿瘤。
193.病原体感染包含但不限于人免疫缺陷病毒、i型单纯疱疹病毒、2型单纯疱疹病毒、乙型肝炎病毒、丙型肝炎病毒、乳头瘤病毒、疟原虫和结核分枝杆菌。
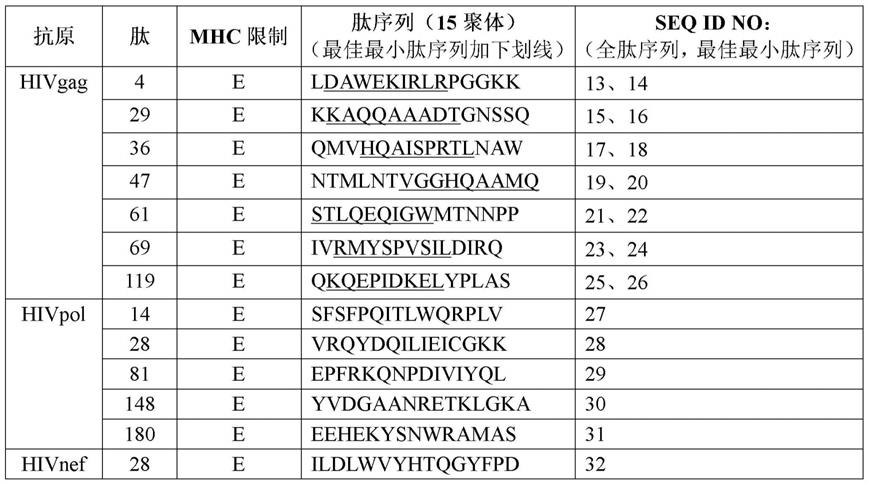
194.iii.hiv超表位构建体
195.本文还公开了人免疫缺陷病毒抗原,其长度介于9个与15个氨基酸之间,并且与以下的氨基酸序列至少90%、至少95%或100%相同:ldawekirlrpggkk(seq id no:13);dawekirlr(seq id no:14);kkaqqaaadtgnssq(seq id no:15);kaqqaaadt(seq id no:
16);qmvhqaisprtlnaw(seq id no:17);hqaisprtl(seq id no:18);ntmlntvgghqaamq(seq id no:19);vgghqaamq(seq id no:20);stlqeqigwmtnnpp(seq id no:21);stlqeqigw(seq id no:22);ivrmyspvsildirq(seq id no:23);rmyspvsil(seq id no:24);qkqepidkelyplas(seq id no:25);kqepidkel(seq id no:26);sfsfpqitlwqrplv(seq id no:27);vrqydqilieicgkk(seq id no:28);epfrkqnpdiviyql(seq id no:29);yvdgaanretklgka(seq id no:30);eehekysnwramas(seq id no:31);或ildlwvyhtqgyfpd(seq id no:32)。
196.在一些实施例中,所述重组hcmv载体包括编码一个或多个人免疫缺陷病毒抗原的核酸。在一些实施例中,所述重组hcmv载体不表达ul128。在一些实施例中,所述重组hcmv载体不表达ul130。在一些实施例中,所述重组hcmv载体不表达ul128和ul130。在一些实施例中,所述重组hcmv载体不表达ul146和ul147。在一些实施例中,所述重组hcmv载体由于编码ul18、ul128、ul130、ul146或ul147的核酸序列中存在一个或多个突变而不表达ul18蛋白、ul128蛋白、ul130蛋白、ul146蛋白和ul147蛋白或其直系同源物。在一些实施例中,编码ul18、ul128、ul130、ul146或ul147的所述核酸序列中的所述突变选自由以下组成的组:点突变、移码突变、截短突变和编码病毒蛋白的整个核酸序列的缺失。在一些实施例中,所述重组hcmv载体进一步包括编码ul40或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体进一步包括编码us28或其直系同源物的核酸序列。在一些实施例中,所述重组hcmv载体不表达ul82(pp71)或其直系同源物。在一些实施例中,所述重组hcmv载体不表达us11或其直系同源物。在一些实施例中,所述重组hcmv载体进一步包括编码微rna(mirna)识别元件(mre)的核酸序列,其中所述mre含有在内皮细胞中表达的mirna的靶位点。在一些实施例中,在内皮细胞中表达的所述mirna是mir126、mir-126-3p、mir-130a、mir-210、mir-221/222、mir-378、mir-296或mir-328。在一些实施例中,所述重组hcmv载体进一步包括编码mre的核酸序列,其中所述mre含有在骨髓细胞中表达的mirna的靶位点。在一些实施例中,在骨髓细胞中表达的所述mirna是mir-142-3p、mir-223、mir-27a、mir-652、mir-155、mir-146a、mir-132、mir-21或mir-125。
197.本文所公开的cmv载体可以用作含有重组cmv病毒或载体以及药学上可接受的载体或稀释剂的免疫原性或疫苗组合物。含有重组cmv病毒或载体(或其表达产物)的免疫组合物引起局部或全身性免疫应答。应答可以但不一定是保护性的。疫苗组合物引起局部或全身性保护或治疗应答。因此,术语“免疫原性组合物”包含“疫苗组合物”(因为前者可以是保护性组合物)。
198.本文所公开的重组cmv载体可以在受试者中诱导免疫应答的方法中使用,所述方法包括向受试者施用包括重组cmv病毒或载体和药学上可接受的载体或稀释剂免疫原性免疫学或疫苗组合物。
199.本文所公开的重组cmv载体可以在含有重组cmv病毒或载体和药学上可接受的载体或稀释剂的治疗组合物中使用。本文所公开的cmv载体可以通过将包括编码肿瘤抗原的序列的dna插入到cmv基因组的必需区或非必需区来制备。所述方法可以进一步包括使一个或多个区从cmv基因组中缺失。所述方法可以包括体内重组。因此,所述方法可以包括在存在供体dna的情况下,在细胞相容性培养基中用cmv dna转染细胞,所述供体dna包括侧接有与cmv基因组的各部分同源的dna序列的异源dna,由此将异源dna引入到cmv的基因组中,并
且任选地通过体内重组回收经修饰的cmv。所述方法还可以包括:切割cmv dna以获得经切割的cmv dna;将异源dna连接到经切割的cmv dna以获得杂交cmv-异源dna;将细胞用杂交cmv-异源dna转染;并且任选地然后回收由于因包括体内重组而存在异源dna而经修饰的cmv,因此,所述方法还提供一种包括非天然存在于cmv中的供体dna的质粒,所述供体dna编码cmv外源性多肽,所述供体dna位于cmv dna的区段内,否则将与cmv基因组的必需区或非必需区共线,使得来自cmv的必需区或非必需区的dna侧接供体dna。异源dna可以插入到cmv中以在期望时以任何取向产生稳定整合的所述dna及其表达的重组cmv。
200.编码重组cmv载体中的异源抗原的dna还可以包含启动子。启动子可以来自任何来源,如疱疹病毒,包含内源性巨细胞病毒(cmv)启动子,如人cmv(hcmv)、恒河猴cmv(rhcmv)、小鼠或其它cmv启动子。启动子也可以是非病毒启动子,如ef1α启动子。启动子可以是截短的转录活性启动子,其包括用由病毒提供的反式激活蛋白反式激活的区和截短的转录活性启动子所源自的全长启动子的最小启动子区。启动子可以由对应于最小启动子和上游调控序列的相关dna序列的构成。最小启动子由cap位点加上ata盒(基本转录水平的最小序列构成;未调控的转录水平);“上游调控序列”由上游元件和增强子序列构成。进一步地,术语“截短”指示全长启动子不完全存在,即全长启动子的一些部分已被去除。并且,截短的启动子可以源自疱疹病毒,如mcmv或hcmv,例如,hcmv-ie或mcmv-ie。基于碱基对,全长启动子的大小可以减少至多40%并且甚至至多90%。启动子也可以是经修饰的非病毒启动子。至于hcmv启动子,参考美国专利第5,168,062号和第5,385,839号。至于将细胞用质粒dna转染以从中表达,参考feigner等人,(1994),《生物化学杂志(j biol.chem.)》269,2550-2561。并且,关于直接注射质粒dna作为一种简单且有效的接种针对多种传染病的疫苗的方法,参见《科学(science)》,259:1745-49,1993。因此,可以通过直接注射载体dna来使用载体处于本公开的范围内。
201.还公开了一种表达盒,所述表达盒可以插入到包括截短的转录活性启动子的重组病毒或质粒中。表达盒还可以进一步包含功能性截短的多聚腺苷酸化信号;例如,sv40多聚腺苷酸化信号,其被截短但有功能。考虑到大自然提供了更大的信号,截短的多腺苷酸化信号具有功能确实令人惊讶。截短的多聚腺苷酸化信号解决了重组病毒(如cmv)的插入物大小限制问题。表达盒还可以包含与其所插入的病毒或系统相关的异源dna;并且所述dna可以是如本文所描述的异源dna。
202.至于供在疫苗或免疫组合物中使用的抗原,还参见stedman的《医学词典(medical dictionary)》(1982年第24版,例如,疫苗的定义(用于疫苗调配物中使用的抗原列表);可以使用此类抗原或来自那些抗原的所关注的表位。至于肿瘤抗原,无需过度实验,本领域技术人员就可以根据肽或多肽的氨基酸和对应dna序列的知识以及特定氨基酸的性质(例如,大小、电荷等)和密码子字典来选择肿瘤抗原及其编码dna。
203.一种确定抗原t表位的方法涉及表位作图。肿瘤抗原的重叠肽由寡肽合成产生。然后测试各个肽诱导t细胞激活的能力。这种方法在对t细胞表位作图时特别有用,因为t细胞识别与mhc分子复合的短线性肽。
204.对肿瘤抗原的免疫应答通常如下产生:只有当蛋白质被切割成更小的肽并以定位在另一个细胞的表面上的被称为“主要组织相容性复合物(mhc)”的复合物中呈现时,t细胞才会识别蛋白质。存在两类mhc复合物——i类和ii类,并且每一类都由许多不同的等位基
因构成。不同物种和个体受试者具有不同类型的mhc复合等位基因;据说其具有不同的mhc类型。一种类型的mhc i类分子被称为mhc-e(人中的hla-e,rm中的mamu-e,小鼠中的qa-lb)。与其它mhc-i分子不同,mhc-e在哺乳动物物种内和其之间是高度保守的。
205.应注意,包括编码肿瘤抗原的序列的dna本身可以包含用于驱动cmv载体中的表达的启动子,或者dna可以限于肿瘤抗原的编码dna。此构建体可以相对于内源性cmv启动子以使得所述构建体与启动子可操作地连接并由此被表达的取向放置。进一步地,可以编码肿瘤抗原的dna的多个拷贝或使用强或早期启动子或早期和晚期启动子,或其任何组合,以扩增或增加表达。因此,编码肿瘤抗原的dna可以相对于cmv内源性启动子适当定位,或者那些启动子可以易位以与编码肿瘤抗原的dna一起插入在另一个位置处。编码多于一种肿瘤抗原的核酸可以包装在cmv载体中。
206.进一步公开了含有所公开的cmv载体的药物组合物和其它组合物。可以调配此类药物组合物和其它组合物以用于本领域已知的任何施用程序。此类药物组合物可以通过肠胃外途径(皮内、腹膜内、肌肉内、皮下、静脉内或其它)。施用也可以通过粘膜途径,例如,口服、鼻腔、生殖器等。
207.所公开的药物组合物可以根据制药学领域技术人员熟知的标准技术制备。考虑到如特定患者的种类或物种、年龄、性别、体重和病状以及施用途径等此类因素,可以以医学领域技术人员熟知的剂量和技术施用此类组合物。组合物可以单独施用,或者可以与其它cmv载体或与其它免疫学、抗原性或疫苗或治疗性组合物共同施用或依次施用。此类其它组合物可以包含纯化的天然抗原或表位或来自重组cmv或另一载体系统的表达的抗原或表位;并考虑到上述因素施用此类其它组合物。
208.组合物的实例包含用于孔口,例如口服、鼻腔、肛门、生殖器,例如阴道等施用的液体制剂,如悬浮液、糖浆剂或酏剂;以及用于肠胃外、皮下、腹膜内、皮内、肌肉内或静脉内施用(例如,注射施用)的制剂,如无菌悬浮液或乳剂。在此类组合物中,重组可以与适合的载体、稀释剂或赋形剂,如无菌水、生理盐水、葡萄糖等混合。
209.抗原性组合物、免疫学组合物或疫苗组合物通常可以含有佐剂和一定量的cmv载体或表达产物以引起期望的应答。在人体应用中,明矾(磷酸铝或氢氧化铝)是典型的佐剂。皂苷及其纯化的组分quil a、弗氏完全佐剂和其它用于研究和兽医应用的佐剂具有毒性,这限制了其在人疫苗中的潜在用途。还可以使用化学限定的制剂,如胞壁酰二肽、单磷脂a、磷脂缀合物,如goodman-snitkoff等人,《免疫学杂志(j immunol.)》147:410-415(1991),如miller等人,《实验医学杂志(j exp.med.)》176:1739-1744(1992)所描述的那些,将蛋白质包封在蛋白脂质体中,并将蛋白质包封在脂质囊泡中,如novasome脂质囊泡(新罕布什尔州纳舒厄的微血管系统公司(micro vescular systems,inc.,nashua,n.h.))。
210.组合物可以包装在单一剂型中以用于通过肠胃外(例如,肌肉内、皮内或皮下)施用或孔口施用,例如,经舌(例如,口服)、胃内、粘膜,包含口内、肛门内、阴道内等施用进行免疫。同样,有效剂量和施用途径由以下确定:组合物的性质;表达产物的性质;如果直接使用重组cmv,则是表达水平;以及已知因素,如宿主的种类或物种、年龄、性别、体重、病状和性质,以及ld50和其它已知且不需要过度实验的筛选程序。表达的产物的剂量可以在从几微克到几百微克,例如5到500μg的范围内。可以以任何合适的量施用cmv载体以实现在这些剂量水平下的表达。在非限制性实例中:cmv载体可以以至少102pfu的量施用;因此,cmv载
体可以至少以此量;或在约102pfu到约107pfu的范围内施用。其它合适的载体或稀释剂可以是水或缓冲盐水,具有或不具有防腐剂。cmv载体可以在施用时被冻干以重新悬浮,或者可以处于溶液中。“约”可能意味着在定义值的1%、5%、10%或20%以内。
211.应当理解,本公开的蛋白质和编码其的核酸可以不同于本文中所展示和描述的确切序列。因此,本公开考虑了所示序列的缺失、添加、截短和替换,只要序列根据本公开的方法起作用。在这点上,取代在本质上通常是保守的,即发生在氨基酸家族内的那些取代。例如,氨基酸通常划分为四个家族:(1)酸性-天冬氨酸和谷氨酸;(2)碱性-赖氨酸、精氨酸和组氨酸;(3)非极性-丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸和色氨酸;以及(4)不带电荷的极性一甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸和酪氨酸。苯丙氨酸、色氨酸以及酪氨酸有时分类为芳香族氨基酸。可合理地预测,用异亮氨酸和缬氨酸对亮氨酸进行单独置换,或者反之亦然;用谷氨酸对天冬氨酸进行置换,或者反之亦然;用丝氨酸对苏氨酸进行置换,或者反之亦然;或者用不会对生物活性产生重大影响的在结构上相关的氨基酸对氨基酸进行类似的保守性置换。因此,具有与所描述的蛋白质基本上相同的氨基酸序列但具有基本上不影响蛋白质的免疫原性的少量氨基酸取代的蛋白质在本公开的范围内。
212.本公开的核苷酸序列可以是密码子优化的,例如密码子可以被优化以用于人细胞。例如,任何病毒或细菌序列都可以如此改变。许多病毒,包含hiv和其它慢病毒使用大量稀有密码子,并且通过改变这些密码子以对应于期望的受试者中常用的密码子,可以实现肿瘤抗原的增强表达,如andre等人,《病毒学杂志(j virol.)》72:1497-1503,1998中所描述的。
213.设想了编码cmv载体和其中包含的糖蛋白的官能上和/或抗原性等效变体和衍生物的核苷酸序列。这些官能上等效的变体、衍生物和片段显示出保留抗原活性的能力。例如,不改变经编码的氨基酸序列的dna序列变化,以及导致氨基酸残基的保守取代、一个或几个氨基酸缺失或添加以及氨基酸残基被氨基酸类似物取代的那些变化是那些不会显著影响经编码的多肽的性质的那些变化。保守的氨基酸取代是甘氨酸/丙氨酸;缬氨酸/异亮氨酸/亮氨酸;天冬酰胺/谷氨酰胺;天冬氨酸/谷氨酸;丝氨酸/苏氨酸/甲硫氨酸;赖氨酸/精氨酸;和苯丙氨酸/酪氨酸/色氨酸。在一些实施例中,变体与所关注的抗原、表位、免疫原、肽或多肽具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的同源性或同一性。
214.序列同一性或同源性是通过在比对时比较序列来确定的,以使重叠和同一性最大化,同时使序列空位最小化。具体地,可以使用多种数学算法中的任一种来确定序列同一性。用于比较两个序列的数学算法的非限制性实例是karlin和altschul,《美国国家科学院院刊》1990;87:2264-2268,所述文献被修改为karlin和altschul,《美国国家科学院院刊》1993;90:5873-5877。
215.用于序列比较的数学算法的另一个实例是myers和miller,cabios 1988;4:11-17。此算法被合并到align程序(版本2.0)中,所述程序是gcg序列比对软件包的一部分。当利用align程序比较氨基酸序列时,可以使用pam120权重残基表、空位长度罚分12以及空位
罚分4。用于识别局部序列相似性和比对区的又另一种有用算法是如pearson和lipman,《美国国家科学院院刊》1988;85:2444-2448中所描述的fasta算法。
216.根据本公开使用的有利的是wu-blast(华盛顿大学blast)2.0版软件。可以下载用于若干个unix平台的wu-blast 2.0版可执行程序。此程序基于wu-blast 1.4版,而后者又基于公共域ncbi-blast1.4版(altschul和gish,1996,“局部比对数据(local alignment statistics)”,doolittle编辑,《酶学方法(methods in enzymology)》266:460-480;altschul等人,《分子生物学杂志》1990;215:403-410;gish和states,1993;《自然遗传学》3:266-272;karlin和altschul,1993;《美国国家科学院院刊》90:5873-5877;所述文献中的每个文献通过引用并入本文)。
217.本公开的各种重组核苷酸序列和抗体和/或抗原是使用标准重组dna和克隆技术制备的。此类技术通常是本领域的技术人员熟知的。参见例如《分子克隆:实验室手册(molecular cloning:a laboratory manual)》,第二版(sambrook等人,1989)。
218.可以根据本公开使用允许表达本公开的病毒的任何载体。在某些实施例中,所公开的病毒可以在体外(如使用无细胞表达系统)和/或在体外生长的培养细胞中使用,以产生经编码的异源抗原(例如,肿瘤病毒抗原、hiv抗原、肿瘤抗原和抗体),然后可以用于各种应用,如生产蛋白质疫苗。对于此类应用,可以使用允许病毒在体外和/或在培养细胞中表达的任何载体。
219.对于要表达的所公开的肿瘤抗原,肿瘤抗原的蛋白质编码序列应与指导蛋白质转录和翻译的调控序列或核酸控制序列“可操作地连接”。如本文所使用的,当编码序列和核酸控制序列或启动子以使编码序列的表达或转录和/或翻译受到核酸控制序列的影响或控制的方式共价连接时,据说其为“可操作地连接”。“核酸控制序列”可以是任何核酸元件,如但不限于启动子、增强子、ires、内含子和本文所描述的指导与其可操作地连接的核酸序列或编码序列的表达的其它元件。术语“启动子”将在本文中用于指一组转录控制模块,其聚集在rna聚合酶ii的起始位点周围,并且当与本公开的蛋白质编码序列可操作地连接时导致经编码蛋白质的表达。本公开的转基因的表达可以处于组成型启动子或诱导型启动子的控制下,其仅在暴露于一些特定外部刺激时才开始转录,如但不限于抗生素,如四环素、激素如蜕皮激素或重金属。启动子也可以对特定细胞类型、组织或器官具有特异性。许多合适的启动子和增强子是本领域已知的,并且任何此类合适的启动子或增强子都可以用于表达本公开的转基因。例如,合适的启动子和/或增强子可以选自真核启动子数据库(epdb)。
220.根据本公开使用的载体可以含有合适的基因调控区,如启动子或增强子,从而可以表达本公开的抗原。
221.本文所描述的cmv载体可能含有可以防止宿主间传播的突变,由此使病毒无法感染免疫功能低下的受试者或可能因cmv感染而面临并发症的其它受试者。本文所描述的cmv载体还可以含有导致免疫显性表位和非免疫显性表位的呈递以及非经典mhc限制性的突变。然而,本文所描述的cmv载体中的突变不影响载体再感染先前已感染cmv的受试者的能力。此类cmv突变在例如美国专利公开2013-013676s;2010-0142s23;2014-014103s;和pct申请公开wo 2014/13s209中有所描述,所有所述文献通过引用并入本文。
222.所公开的cmv载体可以体内施用,例如其中目的是产生免疫原性应答,包含cd8 免疫应答,包含由受mhc-e、mhc-ii或mhc-i(或其同源物或直系同源物)限制的高百分比的cd8
t细胞应答表征的免疫应答。例如,在一些实例中,可能期望在如恒河猴等实验动物中使用所公开的cmv载体,以用于使用rhcmv的免疫原性组合物和疫苗的临床前测试。在其它实例中,将期望在人受试者中使用所公开的cmv载体,如在临床试验中以及用于使用hcmv的免疫原性组合物的实际临床使用。
223.对于此类体内应用,所公开的cmv载体作为免疫原性组合物的组分施用,其进一步包括药学上可接受的载体。在一些实施例中,本公开的免疫原性组合物可用于刺激针对异源抗原,包含肿瘤抗原、肿瘤病毒抗原或宿主自身抗原的免疫应答,并且可以用作针对肿瘤抗原、肿瘤病毒抗原或宿主自身抗原的预防性或治疗性疫苗的一种或多种组分,以用于预防、改善或治疗癌症。本公开的核酸和载体特别可用于提供基因疫苗,即用于将编码本公开的抗原的核酸递送到如人等受试者的疫苗,使得抗原随后在受试者中表达以引起免疫应答。
224.免疫程序(或方案)对于动物(包含人)是众所周知的,并且可以容易地针对特定受试者和免疫原性组合物确定。因此,可以将免疫原一次或多次施用于受试者。优选地,在免疫原性组合物的单独施用之间存在设定的时间间隔。虽然此间隔因每个受试者而异,但通常在10天到几周的范围内,并且通常为2周、4周、6周或8周。对于人,间隔通常为2周到6周。在本公开的特别有利的实施例中,间隔更长,有利地为约10周、12周、14周、16周、18周、20周、22周、24周、26周、28周、30周、32周、34周、36周、38周、40周、42周、44周、46周、48周、50周、52周、54周、56周、58周、60周、62周、64周、66周、68周或70周。免疫方案通常施用免疫原性组合物1到6次,但可以少至一次或两次或四次。诱导免疫应答的方法还可以包含与免疫原一起施用佐剂。在一些情况下,每年、每半年或其它长间隔(5-10年)加强免疫可以补充初始免疫方案。本发明方法还包含多种致敏-加强方案。在这些方法中,一种或多种致敏免疫之后是一种或多种加强免疫。对于每次免疫,实际的免疫原性组合物可以相同或不同,并且免疫原性组合物的类型(例如,含有蛋白质或表达载体)、途径和免疫原的调配物也可以不同。例如,如果表达载体用于致敏和加强步骤,其可以是相同类型或不同类型(例如,dna或细菌或病毒表达载体)。一种有用的致敏-加强方案提供两次致敏免疫,相隔四周,然后在最后一次致敏免疫后的第4周和第8周进行两次加强免疫。对本领域技术人员来说还应该容易理解的是,使用本公开的dna、细菌和病毒表达载体来提供致敏和加强方案涵盖了若干种排列和组合。cmv载体可以重复使用,同时表达来自不同病原体的不同抗原。
225.实例
226.实例1:通过诱导mhc-e限制性cd8 t细胞保护免受siv
227.在几项研究中,表明表达siv抗原的病毒株68-1源性rhcmv载体控制并最终消除高致病性sivmac239的感染(hansen 2019.减毒活rhcmv/siv疫苗显示出针对异源siv激发的长期功效(a live-attenuated rhcmv/siv vaccine shows long-term efficacy against heterologous siv challenge).《科学转化医学(science translational medicine)》11:eaaw2607;hansen 2013.高致病性siv感染的免疫清除.《自然(nature)》502:100-4)。这种保护与病毒株68-1rhcmv引起mhc-ii和mhc-e限制性cd8 t细胞的能力相关,hansen 2016.受主要组织相容性复合物限制的广泛靶向cd8( )t细胞应答(broadly targeted cd8( )t cell responses restricted by major histocompatibility complex)《电子科技(e.science)》351:714-20;hansen.巨细胞病毒载体违反cd8 t细胞表位识别范例
(cytomegalovirus vectors violate cd8 t cell epitope recognition paradigms)《科学(science)》340:1237874-1237874)然而,不知道mhc-ii和/或mhc-e限制性cd8 t细胞是否是这种保护所必需的。
228.因此,对仅受mhc-e或mhc-ii限制的cd8 t细胞进行特异性编程的能力能够检查mhc-e或mhc-ii限制性cd8 t细胞是否负责独特保护免受sivmac239。如下文所描述的,将四个恒河猴(rm)队列接种不同的68-1rhcmv病毒株。
229.队列1:将九个rm接种三个68-1rhcmv“仅mhc-e”载体,所述每个载体在必需基因rh108(ul79)和rh156(ie2)的3
′
非翻译区中携带mir126的三个识别位点并分别表达(每个载体一个插入物)siv抗原sivgag、sivretanef(rev、tat和nef的融合物)和sivpol的5
′
区段。
230.队列2:将15个rm接种三个68-1rhcmv“仅mhc-ii”的载体,所述载体缺失rh67(ul40)并分别表达(每个载体一个插入物)siv抗原sivgag、sivretanef(rev、tat和nef的融合物)和sivpol的5
′
区段。
231.队列3:将12个rm接种三个68-1rhcmv“仅mhc-ii”的载体,所述每个载体在必需基因rh108(ul79)和rh156(ie2)的3
′
非翻译区中携带mir142的三个识别位点并分别表达(每个载体一个插入物)siv抗原sivgag、sivretanef(rev、tat和nef的融合物)和sivpol的5
′
区段。
232.队列4:(对照队列)将15个rm接种三个68-1rhcmv载体,所述载体分别表达(每个载体一个插入物)siv抗原sivgag、sivretanef(rev、tat和nef的融合物)和sivpol的5
′
区段。
233.对cd4 或cd8 t细胞响应于siv抗原源性肽池的平均频率进行了定量。在存在表示siv抗原的重叠(以11a重叠)的15聚体肽池的情况下,通过针对ifnγ或tnfα的胞内细胞因子染色,在指定时间点确定外周血单核细胞(pbmc)中的t细胞频率。rm中的每一个对siv抗原中的每种抗原产生了强大的cd4 和cd8 t细胞应答(图1)。
234.接下来,分析了sivgag特异性cd8 t细胞应答的mhc限制。在存在各个肽的情况下,测量了从每个所指示的队列中的每个队列中的三个rm获得的pbmc中的sivgag特异性cd8 t细胞应答。通过使用抗泛mhc-i mab w6/32、mhc-e阻断肽vl9和mhc-ii阻断肽clip进行阻断来确定mhc限制性。虽然队列1动物中的所有肽应答都被vl9肽阻断,但队列2和3中的肽应答被clip肽阻断(图2)。因此,队列1中的cd8 t细胞完全受mhc-e限制,而队列2和3中的cd8 t细胞完全受mhc-ii限制。如先前报道的,队列4动物(未示出)中的cd8 t细胞应答受mhc-ii和mhc-e两者的限制(hansen 2016.受主要组织相容性复合物限制的广泛靶向cd8( )t细胞应答.《电子科技(e.science)》351:714-20;hansen 2013.巨细胞病毒载体违反cd8 t细胞表位识别范例.《科学》340:1237874-1237874)。
235.为确定mhc-e或mhc-ii限制性cd8 t细胞是否负责保护,队列1、2和3受sivmac239的重复限制剂量直肠内接种的激发。每周对rm进行激发,直到检测到第一血浆病毒载量(pvl)或sivvif应答(其中将感染开始指定为先前的激发)。由于疫苗载体不表达sivvif,因此在不存在可检测到的siv血浆病毒载量的情况下,从头sivvif应答的发展证明了感染。如果在初始阳性pv1 2周内从未观察到或开始无法检测到血浆病毒血症,则rm被认为是受控者(白框),并且然后在随后的5周中至少有4周维持处于阈值以下,与非受控者(黑框)相反,一旦被感染,就会表现出具有典型的峰和稳定期模式的持续的病毒血症。
236.队列2和队列3中的所有动物都患上全身性进行性siv病毒血症,这表明mhc-ii限制性cd8 t细胞无法提供保护免受sivmac239感染(图3)。相比之下,疫苗接种有68-1rhcmv/siv/mir126载体的队列1动物中有6/9(67%)严格控制了患有sivmac239的感染。这些数据表明,mhc-e限制性cd8 t细胞应答提供了保护免受高毒力siv。
237.先前已经证明,病毒株68-1源性rhcmv载体引起cd8 t细胞应答,显示出异常高的表位密度(=给定抗原内t细胞识别的肽的数量)(hansen.2013.巨细胞病毒载体违反cd8 t细胞表位识别范例.《科学》340:1237874-1237874)。进一步表明,这些mhc-e和mhc-ii表位中的一些表位,即所谓的超表位在每一种动物中都被识别(hansen 2016.受主要组织相容性复合物限制的广泛靶向cd8( )t细胞应答.《电子科技(e.science)》351:714-20)。超表位尚未被描述为由mhc-i分子呈递的“经典”表位,并且因此表示了基于cmv的载体的独特特征。为了确定单独的超表位是否可以解释用上述“仅mhc-e”rhcmv载体观察到的保护作用,生成了由来自各个siv抗原的超表位序列组成的人工融合蛋白(表1,15聚体和最小超表位肽序列加下划线)。
238.表1:每个siv抗原中的mhc-e超表位
239.抗原mhc限制肽序列seq id no:sivrevmhc-errwrrrwqqllaladriysfpdp1sivtatmhc-etssasnkpisnrtrhcqpe2sivnefmhc-eismrrsrpsgdlrqrllra3sivnefmhc-eeklayrkqnmddideeddd4sivnefmhc-eaqtsqwddpwgevlawkfd5sivnefmhc-eyvrypeefgsksglseeev6sivpolmhc-eggiggfintkeyknveievlgkr7sivpolmhc-entptfaikkkdknkwrmlidfre8sivpolmhc-ewmgyelwptkwklqkielp9sivgagmhc-elglqkcvrmynptnildvk10sivgagmhc-eymqlgkqqrekqresrekpykev11
240.人工融合蛋白的序列如下(ha-表位标签加下划线):
241.mrrwrrrwqqllaladriysfpdptssasnkpisnrtrhcqpeismrrsrpsgdlrqrllraeklayrkqnmddideedddaqtsqwddpwgevlawkfdyvrypeefgsksglseeevggiggfintkeyknveivlgkrntptfaikkkdknkwrmlidfrewmgyelwptkwklqkielplglqkcvrmynptnildvkymqlgkqqrekqresrekpykevypydvpdyad(seq id no:12)。进行免疫印迹以通过用抗ha抗体探测来证明siv超表位融合构建体的表达(图4)。
242.将siv mhc-e超表位融合蛋白插入到含有mir126靶向位点的68-1rhcmv中,目的是将cd8 t细胞应答集中在一小组的mhc-e限制性表位上。将所得构建体接种到8rm(队列5)中。在存在表示siv超表位的各个15聚体肽池的情况下,通过针对ifnγ或tnfα的胞内细胞因子染色,在指定时间点确定外周血单核细胞(pbmc)中的t细胞频率(图5)。cd8 t细胞对siv抗原源性肽有应答(图5a)。cd8 t细胞对mhc-e限制性超表位gag69和gag120有应答,但对其它mhc-e限制性gag表位无应答,所述表位由来自用表达完整sivgag插入物的68-1rhcmv/gag载体免疫的rm的cd8 t细胞通常识别(图5b)。这些结果表明,所有动物都引起
了专门针对超表位的siv特异性cd8 t细胞应答。
243.为了确定mhc-e超表位限制性cd8 t细胞是否能够复制用“仅mhc-e”载体观察到的保护,如上文所描述的,通过重复低剂量直肠内接种sivmac239激发队列5。每周对rm进行激发,直到检测到第一血浆病毒载量(pv1)或sivvif应答(其中将感染开始指定为先前的激发)。如果在初始阳性pvl 2周内,开始无法检测到pvl,则rm被认为是受控者(白框),并且然后在随后的5周中至少有4周维持处于阈值以下,与非受控者(黑框)相反,一旦被感染,就会表现出具有典型的峰和稳定期模式的持续的病毒血症。
244.重要的是,疫苗接种有表达超表位融合蛋白的单个68-1rhcmv/siv/mir126载体的动物中的5/7(71%)控制了sivmac239的感染(图6)。这些数据表明,对mhc-e超表位具有特异性的cd8 t细胞负责保护免受高致病性siv。
245.为了设计基于hiv的超表位抗原,通过将hiv抗原插入到68-1rhcmv中并接种rm来对hiv超表位作图。表2含有已识别的hiv超表位列表。最佳最小肽序列加下划线。
246.表2:hiv超表位的列表。
[0247][0248]
实例2:ul18的表达防止mhc-e和mhc-ii限制性cd8 t细胞的诱导
[0249]
为了确定ul18对病毒株68-1rhcmv载体引起mhc-ii和mhc-e限制性cd8 t细胞应答能力的影响,生成了两种rhcmv构建体;
[0250]
构建体1:58-1rhcmv,其含有sivpol的5
′
片段的受rhcmv基因rh211中的ef1α启动子控制的表达盒作为载体主链。通过置换基因rh13.1来插入ul18,因此将表达ul18而不是rh13.1。插入的ul18序列对应于hcmv tr分离物的ul18。
[0251]
构建体2:68-1rhcmv,其中基因rh107(hcmv ul78的同源物)被置换为siv rev、tat和nef的融合蛋白(sivrtn)作为载体主链。通过替换基因rh13.1来插入ul18。
[0252]
在第0天,将构建体1的5
×
106个噬菌斑形成单位(pfu)接种到三只rhcmv血清阳性rm中,并将相同数量的构建体2接种到两只rhcmv血清阳性rm中。对于对照,在ef1α启动子的控制下,将rm接种表达sivgag的68-1rhcmv。
[0253]
在第7天、第14天和之后的每两周,从两个rm中分离pbmc,并通过针对ifnγ和tnfα的胞内细胞因子染色(ics),使用分别覆盖sivpol、sivrtn或sivgag的重叠15聚体肽池测量
由构建体1、2或对照引起的对siv抗原的cd8 t细胞应答。为了特异性检测识别mhc-e或mhc-ii背景下的肽的cd8 t细胞,所有动物共享每个siv抗原内的超表位是有利的(hansen《科学》2013,hansen《科学》2016)。因此,通过ics在相应rm的pbmc中对超表位肽中的每一个进行单独测试。
[0254]
分析了响应于siv抗原肽池的cd8 t细胞的频率,因此分析了表示每组两只动物中的总抗原特异性应答(图7a)。还对相同的两只动物分析了响应于mhc-e限制性超表位和mhc-ii限制性超表位的cd8 t细胞的频率(图7b、7c)。
[0255]
所有动物都对用于接种的rhcmv载体表达的siv抗原产生cd8 t细胞应答。然而,仅在68-1rhcmv/sivgag中观察到超表位应答,而表达ul18的两种载体均未引起识别超表位的t细胞。因此,这些结果表明ul18防止了mhc-e和mhc-ii限制性cd8 t细胞的诱导。
[0256]
接下来,进行mhc限制作图以进一步确定哪些mhc分子负责在接受表达68-1rhcmv/sivpol的ul18的三个动物中引起sivpol特异性应答。在存在各个肽的情况下,测量了从接种了构建体1的三个rm中获得的pbmc中的sivpol特异性cd8 t细胞应答。在存在阻断mhc-i、mhc-ii或mhc-e呈递的特异性试剂的情况下,测量了对sivpol内各个肽的cd8 t细胞应答(将mhc-i和mhc-e用抗体w6/32阻断,将mhc-ii用hla-dr特异性抗体和clip肽阻断,将mhc-e用vl9肽阻断)。
[0257]
图8中所示的结果表明,每个单独肽对cd8 t细胞的刺激被泛mhc-i抑制性抗体w6/32抑制,但不受mhc-e特异性肽vl9或mhc-ii特异性抗体和clip肽的抑制。因此,所有cd8 t细胞表位都受mhc-i的限制。相比之下,来自接种表达siv抗原的68-1rhcmv的动物的cd8 t细胞识别mhc-ii或mhc-e背景中的所有肽(hansen《科学》2013,hansen《科学》2016)。
[0258]
这些结果表明,ul18最有可能通过防止mhc-ii和mhc-e限制性cd8 t细胞的诱导来重新编程cd8 t细胞应答。ul18已知与宿主抑制性受体lir-1结合(yang z,bjorkman pj.2008.ul18的结构,作为与宿主抑制性受体结合的肽结合病毒mhc模拟物(structure of ul18,a peptide-binding viral mhc mimic,bound to a host inhibitory receptor).《美国国家科学院学报》105:10095-100;chapman tl,heikeman ap,bjorkman pj.1999.抑制性受体lir-1使用常见的结合相互作用来识别i类mhc分子和病毒同源物ul18(the inhibitory receptor lir-1uses a common binding interaction to recognize class i mhc molecules and the viral homolog ul18).《免疫学(immunity)》11:603-13)。因此,这种重编程的可能机制是,通过与t细胞上的抑制性白细胞抑制受体(lir)结合,ul18防止了68-1rhcmv对cd8 t细胞的直接致敏(直接致敏是指t细胞被感染细胞致敏)。在不存在直接致敏的情况下,cd8 t细胞通过交叉引起来致敏,即通过呈递从感染的细胞获得的抗原的非感染细胞(例如,树突状细胞)来间接致敏。到目前为止,ul18并未参与防止t细胞致敏。因此,这些结果是出乎意料和史无前例的。
[0259]
为了确定与抑制性受体lir1的相互作用是否负责ul18防止诱导mhc-ii和mhc-e限制性cd8 t细胞的能力,上述构建体1中的ul18的编码区被突变,使得α-3结构域中位置196处的氨基酸天冬氨酸将被丝氨酸置换(d196s)。先前的结构研究已表明,此天冬氨酸参与了ul18与lir1的结合(ang z,bjorkman pj.2008.ul18的结构,作为与宿主抑制性受体结合的肽结合病毒mhc模拟物.《美国国家科学院学报》105:10095-100)。此外,此残基在所有结合lir1的hla分子中都是保守的,但在不结合lir 1的hla样分子中不存在。将ul18的d196s突
变体插入到表达sivpol的68-1rhcmv中,并将所得构建体接种到两个rm中。在第91天,将pbmc分离,并通过针对ifnγ和tnfα的ics,使用分别覆盖sivpol或sivpol mhc-e超表位肽po141(gfintkeyknveiev;seq id no:33)或mhc-ii超表位pol90(lpqgwkgspaifqyt;seq id no:34)的重叠15聚体肽池测量对sivpol的cd8 t细胞应答。与接种表达完整ul18的68-1rhcmv的动物相比(图9a),在接种表达ul18的d196s突变体的68-1rhcmv的动物中观察到对两种sivpol超表位的t细胞应答(图9b)。因此,这些结果表明ul18需要与lir1受体结合以防止mhc-e和mhc-ii限制性cd8 t细胞的诱导。
[0260]
ul18被认为在逃逸nk细胞中起作用(prod
′
homme2007.人巨细胞病毒mhc i类同源物ul18抑制lir-1 但激活lir-1-nk细胞(the human cytomegalovirus mhc class i homolog ul18inhibits lir-1 but activates lir-1-nk cells).《免疫学杂志》178:4473-81)。由于nk细胞逃逸可能对载体功能至关重要(sturgill2016.自然杀伤细胞逃逸对于恒河猴巨细胞病毒感染至关重要(natural killer cell evasion is essential for infection by rhesus cytomegalovirus).《公共科学图书馆
·
病原学(plos patog)》12:e1005868),可以想象,使ul18从基于hcmv的载体中缺失会防止其引起对异源抗原的免疫应答的能力。为了确定ul18缺失的hcmv是否能够引起对插入抗原的t细胞应答,将ul18置换为hiv抗原,由此使ul18缺失并使用内源性ul18启动子以驱动hivgag/nef/pol融合蛋白的表达。另外,基因ul128、ul130、ul146和ul147也从ul18缺失的载体中缺失,因为这些基因的产物先前已显示抑制mhc-e和mhc-ii限制性cd8 t细胞应答(美国专利第10,532,099号)。作为载体主链,使用了hcmv tr3(caposio.2019.基于hcmv减毒活疫苗平台的表征.《科学报告》9:19236)。通过人成纤维细胞的免疫印迹证实了hiv融合蛋白在所得病毒载体(hcmv tr3δul18/hivfusionδul128-130δul146-147)中的表达(图10)。
[0261]
ul18缺失的hcmv载体也接种到rm中,并在接种后第56天通过ics在pbmc中测定对hiv抗原的免疫应答。如图11所示,载体在rm中引起对hivgag、hivnef和hivpol的cd8 t细胞应答,如通过使用包括这些抗原中的每一种的重叠肽池所证明的。因此,得出结论,缺乏ul18的hcmv载体保留了其引起对异源抗原的t细胞应答的能力。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。