1.本发明涉及猴头菇多糖技术领域,具体是涉及一种具有调节肠道菌群功能猴头菇多糖的制备方法。
背景技术:
2.猴头菇中含有多种生物活性物质,如多糖、寡糖、氨基酸、甾醇类、萜类和酚类等,其中多糖成分是猴头菇的主要成分。研究显示,猴头菇多糖具有多种生理活性功能,如抗氧化、抗肿瘤、降血糖等方面。
3.肠道微生物群对人体健康的促进作用近年来受到了广泛的关注。一方面,人们逐渐认识到肠道菌群与宿主的健康和疾病之间有着密切的关系,不断发掘肠道菌群与宿主肠道免疫应答之间的关系,发挥两者协同作用,可以共同维护宿主肠道健康。另一方面,肠道菌群对动植物活性成分代谢的影响也逐渐受到关注。研究表明,食用菌多糖成分可以通过口腔、小肠、胃等消化液到达大肠而被大肠内的微生物分解利用,有效调节肠道微生物组。
4.目前关于猴头菇多糖对肠道菌群调节作用的研究还很有限。有研究发现猴头菇β-葡聚糖可以在粪便菌群体外发酵过程促进短链脂肪酸含量,并提供了与利用能力显著相关的4种肠道微生物菌属。在培养基中添加0.3%-0.7%猴头菇多糖可以促进保加利亚乳杆菌和青春双歧杆菌的生长繁殖,并且提高益生菌在胃肠道模拟环境中对消化液的耐受力。体内研究显示猴头菇多糖具有调节结肠炎小鼠 (或大鼠)体内肠道菌群失调症状、促进肠道有益菌群生长、减轻炎症反应的作用。关于猴头菇多糖在肠道菌群方面的文献专利中,猴头菇多糖制备工艺相较单一、多糖含量不高,并且主要集中在小鼠体内研究上,在体外模拟消化和体外发酵条件下,猴头菇多糖能否定向到达大肠被肠道菌群利用,并且对特定肠道菌群发挥影响作用的研究还不够全面。
技术实现要素:
5.本发明所要解决的技术问题是提供一种在热水条件下采用水提醇沉提取的方法来制备猴头菇多糖的制备方法,该制备方法得到的猴头菇多糖,在体外胃肠道模拟消化中表现出不易被口腔、胃液、小肠液降解,而可以直达大肠,在大肠中被肠道菌群降解利用;而且有益于肠道中双歧杆菌属丰度上升。
6.为解决上述技术问题,本发明提供以下技术方案:一种具有调节肠道菌群功能的猴头菇多糖的制备方法,包括如下步骤:
7.(1)猴头菇子实体在烘箱干燥后粉碎、过筛得到猴头菇粉;
8.(2)猴头菇粉经乙醇浸提脱脂,离心去除上清液;
9.(3)脱脂猴头菇粉按照一定料液比加入去离子水,90℃-100℃热水浸提次数1-3次,每次1-4h,然后离心取上清液;
10.(4)上清液加入一定体积的95%乙醇,获得一定浓度的乙醇-水猴头菇溶液;
11.(5)室温静置12-48h,取下层沉淀加入纯水复溶,经过旋蒸、透析和旋蒸后,脱除有
机溶剂,经冷冻干燥,制得猴头菇多糖。
12.在上述方案基础上进一步地,步骤(2)中的猴头菇粉经95%乙醇浸提24h后,离心15min去除上清脂。
13.在上述方案基础上进一步地,步骤(3)中料液比为1:10-1:30。
14.在上述方案基础上进一步地,步骤(4)中乙醇-水猴头菇溶液中乙醇体积分数为30%-70%。
15.在上述方案基础上进一步地,步骤(5)中透析的透析袋分子量大小为3000da,透析时间≥72h。
16.本发明与现有技术相比具有的有益效果是:本发明采用90℃-100℃热水浸提处理可以高效提取猴头菇子实体中的活性成分;并采用室温静置、透析工艺可以尽量分离醇沉多糖组分,除去醇提组分中的蛋白等杂质。该制备方法得到的猴头菇多糖,在体外胃肠道模拟消化中表现出不易被口腔、胃液、小肠液降解,可以直达大肠,在大肠中被肠道菌群降解利用;而且有益于肠道中双歧杆菌属丰度上升;在体外模拟消化和发酵过程中具有抵抗胃肠道消化液分解、调节肠道菌群结构、促进肠道双歧杆菌属生长的作用,有益于肠道健康功能。
附图说明
17.图1代表猴头菇多糖分级组分在反应过程中的还原糖保留率图;
18.图2代表猴头菇多糖分级组分在反应过程中的总糖保留率图;
19.图3代表猴头菇多糖分级组分发酵前后粪便中短链脂肪酸的含量图;
20.图4代表肠道菌群在门水平的相对丰度变化图;
21.图5代表肠道菌群在属水平的相对丰度变化图;
22.图6代表肠道菌群在属水平的相对丰度显著性分析图。
具体实施方式
23.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
24.实施例1
25.一种具有调节肠道菌群功能的猴头菇多糖的制备方法,包括如下步骤:
26.(1)猴头菇子实体在50℃烘箱干燥10h,粉碎、过50目筛,得猴头菇粉;
27.(2)猴头菇粉经95%乙醇浸提24h后,离心15min去除上清脂;
28.(3)取100g脱脂后猴头菇粉末,按照料液比1:10(w/v)加入去离子水, 90℃热水浸提1次,每次1h;离心15min,得上清液;
29.(4)按比例添加一定量的95%乙醇,使得乙醇终浓度为30%;
30.(5)室温静置12h,取下层沉淀复溶,脱蛋白,再用3000da透析袋透析 3天,旋转蒸发浓缩透析液至无有机溶剂味,冷冻干燥获得乙醇浓度为30%的猴头菇粗多糖,命名为hep30。
31.实施例2
32.(1)猴头菇子实体在50℃烘箱干燥10h,粉碎、过50目筛,得猴头菇粉;
33.(2)猴头菇粉经95%乙醇浸提24h后,离心15min去除上清脂;
34.(3)取100g脱脂后猴头菇粉末,按照料液比1:20(w/v)加入去离子水, 95℃热水浸提2次,每次3h;离心15min,得上清液;
35.(4)按比例添加一定量的95%乙醇,使得乙醇终浓度为50%;
36.(5)室温静置24h,取下层沉淀复溶,脱蛋白,再用3000da透析袋透析 3天,旋转蒸发浓缩透析液至无有机溶剂味,冷冻干燥获得乙醇浓度为50%的猴头菇粗多糖,命名为hep50。
37.实施例3
38.(1)猴头菇子实体在50℃烘箱干燥10h,粉碎、过50目筛,得猴头菇粉;
39.(2)猴头菇粉经95%乙醇浸提24h后,离心15min去除上清脂;
40.(3)取100g脱脂后猴头菇粉末,按照料液比1:30(w/v)加入去离子水, 100℃热水浸提3次,每次4h;离心15min,得上清液;
41.(4)按比例添加一定量的95%乙醇,使得乙醇终浓度为70%;
42.(5)室温静置48h,取下层沉淀复溶,脱蛋白,再用3000da透析袋透析 3天,旋转蒸发浓缩透析液至无有机溶剂味,冷冻干燥获得乙醇浓度为70%的猴头菇粗多糖,命名为hep70。
43.本发明对制备的猴头菇多糖在体外模拟消化评价体系中检测其对消化液的耐受力,以及在体外发酵肠道体系中对肠道菌群结构的影响。
44.上述实施例中所用原料及分析方法说明:
45.(1)猴头菇子实体,由常山县豪锋农业开发有限公司提供。
46.(2)分析检测方法:
47.①
还原糖含量:以葡萄糖为标准品,采用二硝基水杨酸法测定还原糖含量。
48.②
总糖含量:以葡萄糖为标准品,采用苯酚-硫酸法测定总糖含量。
49.③
蛋白质含量:以牛血清蛋白为标准品,采用考马斯亮蓝法测定蛋白质含量。
50.④
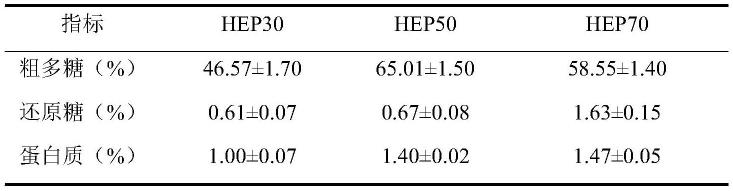
气质联用测定单糖组成:分别配制鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖的单糖标准品溶液以及混合单糖标准溶液。乙酰化处理标准品溶液和样品溶液。采用thermo trace 1300/isq gc-ms配套hp-530m
×
0.25 mm
×
0.25μm石英毛细管柱来进行乙酰化分析。上样量为1μl。升温程序如下:在120℃的初始温度下保持1min,接着以10℃/min升温到165℃后保持1min,再以1℃/min升温至169℃并保持0.5min,然后以10℃/min升温到196℃且保持0.5min,之后再以1℃/min升温至200℃并保持1min,最后以10℃/min升温至240℃且保持5min。检测器、进样口温度都设置为250℃。通过单标和混标在gc-ms中的保留时间进行比对分析,根据面积归一法计算标品峰面积下的百分含量和含量,样品即在标品的峰面积下计算出各单糖的摩尔比。
51.⑤
猴头菇多糖体外模拟消化实验:猴头菇多糖制成8mg/ml的样液,将猴头菇多糖溶液分别与人唾液、人模拟胃液和人模拟肠液按照一定比例混合,猴头菇多糖溶液与去离子水以及去离子水与人消化液分别作为对照组和空白组。将所有试管置于37℃水浴中孵育以进行消化。在消化过程中,在固定时间点取出1ml 混合物,并立即浸入沸水浴中5min以使酶失活,最后测定不同消化液中还原糖和总糖的含量。其中,猴头菇多糖溶液与人唾液的混
合比例为1:1,消化检测时间点为0、10、20min;猴头菇多糖溶液与人胃液混合比例为1:1,混合液ph值调至3.0附近,消化时间为0、2、4h;猴头菇多糖溶液与人肠液混合比例为1:3,混合液ph值调至7.5附近,消化时间为0、2、4h。
52.⑥
猴头菇多糖体外发酵实验:取10名健康志愿者的新鲜粪便0.8g,用移液枪吸取8ml pbs缓冲液(ph 7.0)加入到粪便样液中制成匀浆,并注射进配置含三种hep和空白的培养基中,于37℃恒温培养箱中培养24h,分别在0h和 24h时量取1ml发酵液,采用气相色谱法测定短链脂肪酸含量,并使用16s rdna 高通量对发酵液上清液测序。
53.⑦
总糖保留率和还原糖保留率:测定体外模拟消化过程中以及体外发酵前后的总糖保留率和还原糖保留率。
54.还原糖保留率=(消化液中的还原糖含量/未经消化液的还原糖含量)
×
100%总糖保留率=(消化液中的总糖含量/未经消化液的总糖含量)
×
100%
55.⑧
气相色谱分析短链脂肪酸:使用db-ffap 30m
×
0.53mm
×
0.5μl毛细管柱来进行气相分析,其升温程序如下所示:毛细管柱初始温度设置为100℃并保持5min,以8℃/min升温至180℃并保持1min,接着以20℃/min升温到200℃且保持5min。进样口、检测器设置温度都为240℃,上样量为1μl,分析时间为17.5min。根据保留时间和峰面积计算短链脂肪酸总量和各组分含量。
56.⑨
16s rdna高通量测序:利用dna试剂盒提取对沉淀物进行dna提取,设计并合成引物接头后对v3-v4区域的细菌16s rdna基因进行进行pcr扩增,pcr 引物为338f(5-actcctacgggaggcagcag-3)和806r(5-ggactachvgggtwtctaat-3),用2%琼脂糖凝胶电泳检测纯化产物,荧光定量和文库制备后,在illumina pe 平台将特定的测序接头和扩增产物合并,上机测试,将数据进行对应的生物信息分析。
57.实施例技术效果:
58.(1)采用以上的制备工艺,对3个实施案例中收集的三种hep进行多糖及蛋白含量的测定,结果如表1所示。三个组分的多糖含量较高,其中hep50多糖含量达到65%,并且三组样品都只含有少量蛋白质,说明本工艺制备的多糖含量高,蛋白杂质少。
59.表1猴头菇子多糖分级组分主要成分及含量
[0060][0061]
(2)采用以上的制备工艺,对3个实施案例中收集的三种hep进行体外模拟消化液和发酵中还原糖和总糖保留率的测定。
[0062]
还原糖保留率结果如图1所示,三组多糖在唾液消化20min后的还原糖平均保留率分别为95.98%、97.03%、95.92%;在模拟胃液消化4h后的还原糖平均保留率分别为98.39%、98.03%、98.83%;在模拟小肠液消化6h后的还原糖平均保留率分别为95.46%、98.31%、98.58%。但在进入大肠体外发酵24h后,各组分的平均保留率明显下降。
[0063]
总糖保留率结果如图2所示,三组多糖在唾液消化20min后的总糖平均保留率分别为97.01%、98.03%、97.79%;在模拟胃液消化4h后的总糖平均保留率分别为95.17%、
94.67%、96.40%;在模拟小肠液消化6h后的总糖平均保留率分别为96.59%、97.52%、96.92%,而进入大肠发酵24h后,三种多糖的总糖保留率同样大幅降低。说明猴头菇多糖不易被口腔、胃、小肠液完全分解,能顺利到达大肠,并进行微生物发酵降解,使其成为微生物生长利用所需的碳源。
[0064]
(3)采用体外肠道发酵工艺,对3个实施案例中收集的三种hep进行体外模发酵前后短链脂肪酸的测定。如图3所示,比较发酵24h后的四组培养基,以猴头菇多糖为碳源的三组培养基发酵液中的总短链脂肪酸含量显著高于空白组,说明肠道微生物都能较好的利用三组猴头菇多糖。
[0065]
(4)采用以上的发酵工艺,对3个实施案例中收集的三种hep进行体外模发酵液的沉淀物进行16s rdna高通量测序。肠道菌群在门水平的相对丰度变化如图4(a:男性;b:女性)所示,厚壁菌门(firmicutes)、变形杆菌门 (proteobacteria)、拟杆菌门(bacteroidota)、放线菌门(actinobacteria) 是四种培养基发酵液中主要的微生物门类,厚壁菌门、拟杆菌门、放线菌门相对空白培养基其相对丰度上升,变形杆菌门相对空白培养基其相对丰度显著下降。肠道菌群在属水平的相对丰度变化如图5(a:男性;b:女性)所示以及显著性分析如图6中的a-c,双歧杆菌属(bifidobacterium)、粪杆菌属 (faecalibacterium)都有显著(p<0.05)增加,而大肠杆菌-志贺菌属 (escherichia-shigella)的相对丰度有显著(p<0.05)降低。说明hep可以促进益生菌生长,尤其是双歧杆菌属的生长,同时抑制有害菌生长,可以有效改善肠道微生物菌群结构,从而调节宿主健康。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
