用于研究皮质-纹状体-中脑神经通路的人细胞模型
1.相关专利申请的交叉引用
2.本专利申请案主张于2019年10月31日提交的编号为62/928,905的美国临时专利申请案的优先权,上述专利全文并入本文以用于所有目的。
背景技术:
3.大脑皮质锥体神经元向纹状体的神经投射是控制动机行为的神经回路的重要组成部分。大脑皮质与纹状体之间的这种连接是单向的,其中锥体皮质神经元投射至纹状体中,而纹状体中的中型多棘神经元随后与中脑多巴胺能神经元连接,作为直接和间接基底神经节通路的一部分。这种皮质-纹状体通路的功能障碍被认为会引发严重神经精神病症,例如精神分裂症、强迫症、图雷特综合征、亨廷顿病和孤独症谱系障碍(asd)(shepherd和gordon,2013)。
4.但是,尚未完全了解在这些患者中引发疾病的特定分子和细胞机制,这主要是由于无法直接研究完整、功能性人脑中的这些通路以及在转化动物模型的发现面临挑战。
5.因此,迫切需要开发能够真实捕捉神经回路形成、功能和功能障碍的人细胞模型(pasca,2018年)。
技术实现要素:
6.本发明提供了用于在体外产生人纹状体类器官或球状体(hstrs)以及人中脑类器官或球状体(hmbs)的组合物和方法,所述类器官或球状体可以完全由人多能干细胞(hps)生成。此类球状体(也可称为脑区特异性或区域化类器官)代表所述人纹状体(基底神经节)和人中脑(包括黑质),并且含有与人的所述皮质、纹状体(基底神经节)和中脑相关的特定细胞组(例如,神经元、胶质细胞)。
7.所述hstrs可与包括人皮质神经元(例如谷氨酸能锥体神经元)的人大脑皮质球状体(hcs)进行功能性整合,以提供皮质-纹状体类组装体(hcs-hstrs)。功能性整合的细胞以生理上相关的方式相互作用,例如形成突触、释放神经递质。所述hcs-hstrs中的人皮质神经元从所述hcs投射至所述hstrs,形成功能性皮质-纹状体神经回路。使用病毒追踪和实时成像的组合,本发明提供了有关体外生成的人皮质-纹状体神经回路形成的证据,其提供了皮质-纹状体通路建立和功能障碍的有用建模。
8.所述hstrs还可与hmbs进行功能性整合,以提供中脑-纹状体类组装体(hmbs-hstrs)。人中脑神经元(例如多巴胺能神经元)从所述中脑投射至所述hstrs中,形成纹状体-中脑神经回路。从所述中脑到所述纹状体(基底神经节)的多巴胺能输入被认为在所述纹状体的发育和成熟中起着至关重要的作用,因此这些类组装体为研究所述纹状体的发育和功能障碍提供了独特机会。hstrs中的纹状体神经元也投射至所述hmbs中,以提供对中脑多巴胺能神经元的gaba能调节。此外,hmbs可与所述hcs和hstrs组合,以形成含有皮质-纹状体和纹状体-中脑神经回路的类组装体,从而可以同时研究所述纹状体(基底神经节)的谷氨酸能和多巴胺能输入。
9.所述类组装体(即,hcs-hstrs、hmbs-hstrs以及包含hcs、hstrs和hmbs的类组装体)为分析所述人大脑皮质、纹状体和中脑之间的神经回路的发育和功能提供了独特机会。此外,这些类组装体提供了模型以研究特定神经或精神病症如何损害这些神经回路。特别相关的是与皮质-纹状体功能障碍相关的神经或精神病症,例如精神分裂症、强迫症、图雷特综合征、帕金森病、亨廷顿病和asd。
10.在一些实施例中,提供了类组装体,其中可对所述细胞中的一种或更多种进行基因修饰,以提供额外的筛选功能。例如,可对皮质神经元、纹状体神经元和中脑神经元中的一种或更多种进行基因修饰,以表达荧光钙指示剂,所述指示剂是本领域已知并使用的指示剂。可对皮质神经元、纹状体神经元(中型多棘神经元)和中脑神经元(多巴胺能神经元)中的一种或更多种进行基因修饰,以表达光活化视蛋白。在一些实施例中,类组装体包含表达视蛋白的神经元以及表达荧光钙指示剂的其他神经元,其中所述神经元之间的功能关系通过使用光活化神经元,并观察另一神经元的钙指示剂反应来证明。
11.本发明还提供了如本文进一步定义的球状体(即,hstrs和hmbs)以及制备所述球状体的方法。本发明还提供了如本文进一步定义的类组装体(即,hcs-hstrs、hmbs-hstrs以及包含hcs、hstrs和hmbs的类组装体)以及制备所述类组装体的方法。
12.本发明还提供了用于确定候选药剂在所述类组装体内神经回路中的活性的方法,所述方法包含使所述候选药剂与所述类组装体接触。存在于所述类组装体中的所述细胞任选地包含至少一个等位基因,所述等位基因编码与神经或精神病症相关或可能相关的突变,并确定所述药剂对形态学、遗传或功能参数的影响,所述参数包括但不限于神经元数量、神经元功能、基因表达谱、细胞死亡、单细胞基因表达(rna-seq)、具有药理学筛选功能的钙成像、膜片钳记录、突触发生调节等。
13.在阅读标的方法和组合物的详细信息(详见下文)后,本发明的这些目标、优点和特征以及其他目标、优点和特征对所属领域的技术人员来说是显而易见的。
附图说明
14.结合附图阅读以下详细说明,可获得对本发明最全面的理解。需要强调的是,根据惯例,附图的各个特征未按比例绘制。相反,为了清楚起见,可任意扩大或缩小各个特征的尺寸。附图中包括以下图示:
15.图1a
–
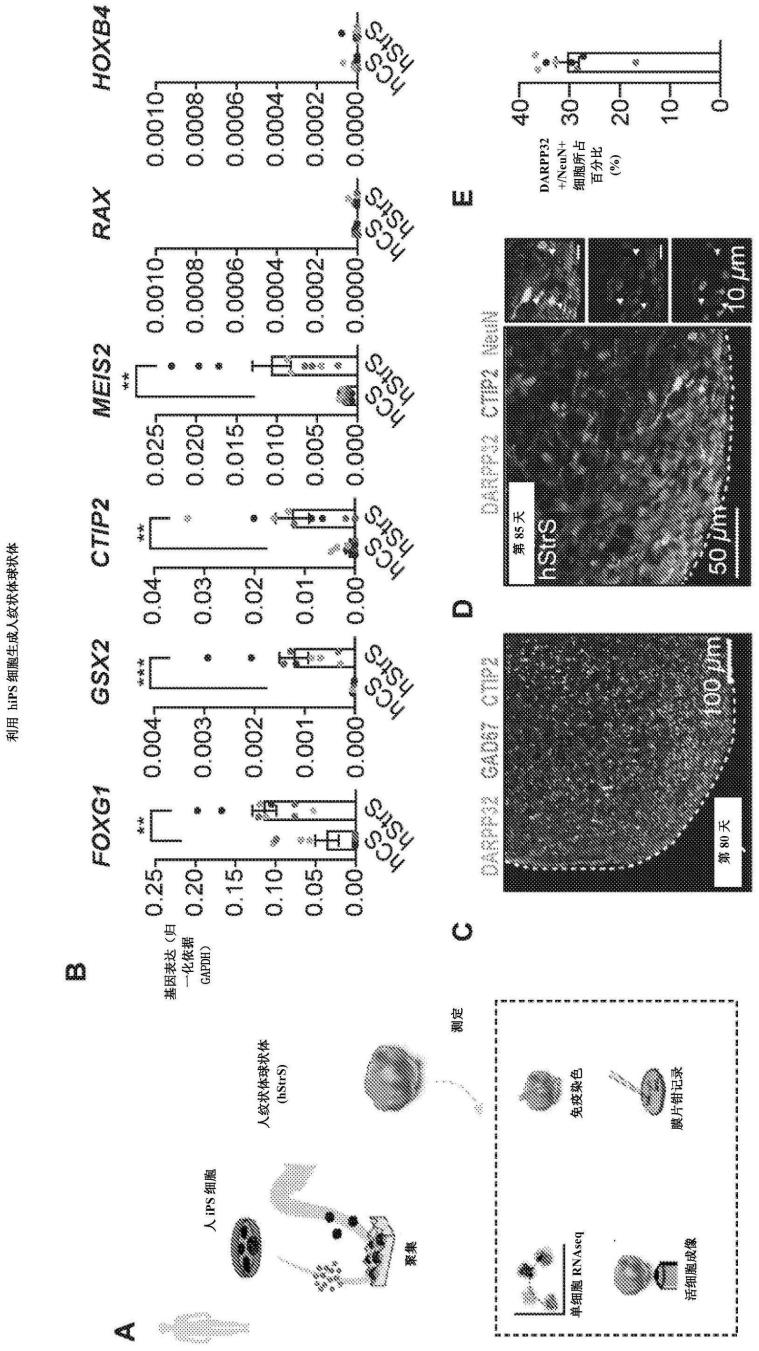
1p.由人多能干细胞生成人纹状体球状体(图1a)图解说明了由人诱导性多能干(hips)细胞生成hstrs(也称为基底神经节类器官)的主要阶段以及随后通过qpcr、切片和免疫组化(ihc)、单细胞rna-seq、活细胞成像和电生理学记录进行的分析的示意图(图1b)第23天hstrs和人皮质球状体(hcs)中前脑标志物foxg1和外侧神经节隆起(lge)标志物gsx2、ctip2和meis2的基因表达水平。依据gadph将基因表达水平归一化。n=由4个hips细胞系产生的9个球状体。(图1c)第80天时对hcs和hstrs的免疫染色,展示了darpp32、gad67、ctip2的蛋白表达。(图1d,e)第85天时对hstrs的免疫染色,展示了darpp32、ctip2和neun的蛋白表达以及量化情况。n=由3个hips细胞系产生的8个球状体。箭头表示表达darpp32和neun的细胞,指示中型多棘神经元。(图1f)对从第80-83天的hstrs中解离出的约25,772个细胞进行的单细胞rna测序分析揭示了不同的gaba能神经元、神经祖细胞、星形胶质细胞、少突胶质细胞和谷氨酸能神经元群体。(图1g)brainspan数据集与人发育中脑(pcw 20-25)
的相关性。(图1h)单细胞rna测序分析揭示了前脑(foxg1)和lge(dlx1、dlx2、dlx5、dlx6、gsx2、ascl1、foxp1和foxp2)中富集的基因的强表达,但未揭示内侧神经节隆起(mge;nkx2-1)或大脑皮质(emx1)中的基因的表达。(图1i)用aav-mdlx::egfp转染的对照hstrs细胞的代表性图像,表明mdlx::egfp
细胞在65天时形成树突棘样结构(在这种情况下,在解离和2d中接种后)。(图1j、k、l)用aav-mdlx::egfp转染的hstrs的代表性图像,展示了第81天和第120天在3d培养物中具有树突棘样结构的mdlx::egfp
细胞以及量化情况。n=第80-90天时来自2个hips细胞系的40个神经元,n=第120-130天时来自3个hips细胞系的38个神经元。(图1m)细胞内电流脉冲注入后hsyn1::eyfp标记的hstrs神经元的全细胞膜片钳记录和代表性膜反应。(图1n)展示了hsyn1::eyfp标记的hstrs神经元中的内向整流的电流-频率(i-v)曲线。n=第110-120天时来自hstrs的17个细胞。(图1o)展示了第160天hsyn1::eyfp标记的hstrs神经元的缓慢斜坡去极化的代表性描记图。黑色箭头:缓慢斜坡去极化,红色箭头:延迟的第一尖峰。(图1p)静息膜电位。n=第160-170天时来自hstrs的13个细胞。
16.图2a
–
2r.由人多能干细胞生成皮质-纹状体类组装体(图2a、b)图解说明了人发育中脑中的皮质-纹状体投射以及皮质-纹状体类组装体内皮质-纹状体投射的体外建模的示意图。(图2c)展示了荧光标记的hcs(aav-dj-hsyn::eyfp)与荧光标记的hstrs(aav-dj-hsyn::mcherry)组装的代表性图像。(图2d)融合后21天时皮质-纹状体类组装体的代表性示例。(图2e)量化hstrs区域中的eyfp覆盖百分比(指示hcs起源的轴突投射)。n=6-8个类组装体。图像表明,球状体形成单向投射,其中hcs中的神经元投射至hstrs中,但反之则不然。(图2f)用于表征hcs投射至hstrs中的病毒逆行示踪。用携带cre-egfp的δg-狂犬病病毒和携带狂犬病糖蛋白(g)的aav转染hstrs。在形成皮质-纹状体类组装体之前,hcs在双侧翼orf(dio-mcherry)下单独用编码mcherry的aav转染。mcherry的表达表明神经元从hcs投射至hstrs。(图2g)融合后28天时检查gfp和mcherry的表达。(图2h、i)量化表达神经元标志物map2、星形胶质细胞标志物gfap、皮质投射神经元标志物satb2或ctip2的hcs中投射细胞的比例。ctip2
和satb2
神经元是皮质-纹状体类组装体中从hcs投射至hstrs的主要细胞群体。(图2j)用于测试皮质-纹状体类组装体的功能的光遗传学和实时成像。aav-hsyn1::chrimsonr在hcs中表达,并在纹状体微型启动子基因gpr88(aav-ple94::icre)下改进了cre(icre),而dio-gcamp6通过aav在hstrs中表达,并组装了类组装体。(图2k-m)表达chrimsonr的hcs神经元的激发能够激发hstrs神经元中的ca
2
活性,表明在类组装体中形成功能性神经回路。(图2o)展示了hstrs或皮质-纹状体类组装体切片中的全细胞膜片钳记录的示意图。(图2p)hstrs和hcs-hstrs神经元中神经元的代表性电生理学描记图。(图2q)展示了尖峰频率与hstrs和hcs-hstrs神经元中注入的电流之间的关系的频率-电流(f-i)曲线。n=hstrs中的17个细胞,n=来自3个hips细胞系的hcs-hstrs中的25个细胞。(图2r)最大尖峰频率。n=hstrs中的17个细胞,n=来自3个hips细胞系的hcs-hstrs中的25个细胞。
17.图3a
–
3g.由人多能干细胞生成中脑-纹状体类组装体(图3a、b)图解说明了从中脑到纹状体的多巴胺能输入以及用中脑-纹状体类组装体对中脑-纹状体通路的体外建模的示意图(图3c)培养第23天时的hmbs展示了低水平的前脑标志物foxg1和高水平的底板中脑多巴胺能神经元标志物foxa2,而下丘脑标志物rax和脊髓标志物hoxb4不表达。(图3d)对从第92天的hmbs中解离出的约2,720个细胞进行的单细胞rna测序分析揭示了不同的中脑多巴胺能神经元(mda)、底板、谷氨酸能神经元、gaba能神经元、放射状胶质细胞和神经祖细胞
群体。(图3e)单细胞rna测序分析揭示了底板(shh、foxa2)和mda(th、nr4a2)以及谷氨酸能(slc17a7)和gaba能(slc32a1)神经元中富集的基因的强表达。(图3f)中脑-纹状体类组装体的代表性图像;单独分化用aav-syn1::eyfp感染的hmbs与用aav-syn1::mcherry感染的hstrs,并将其在锥形管内彼此相邻放置。3天后,这些球状体成功实现组装。(图3g)中脑-纹状体类组装体的代表性图像;单独分化用aav-th::cre和aav-dio-eyfp共感染的hmbs与未发出荧光的hstrs,并将其在锥形管内彼此相邻放置。3天后,这些球状体成功实现组装并开始形成从hmbs到hstrs的投射。
18.结合附图阅读以下详细说明,可获得对本发明最全面的理解。
具体实施方式
19.在描述本发明的组合物和方法之前,应当理解,本发明不限于所描述的特定组合物和方法,因为在实际实施中一定会存在差异。还应当理解,本文中使用的术语仅用于描述特定实施例,而无意限制本发明构思,本发明的范围将仅由所附权利要求书限定。
20.在提供数值范围的情况下,应当理解,该范围的上限和下限之间的每个中间值都明确地公开。除非上下文另有明确规定,否则每个中间值应低至下限单位的十分之一。本发明涵盖了在所述范围内的任何所述值或介入值与在所述范围内的任何其他所述值或介入值之间的每个较小范围。这些较小范围的上限和下限可独立地包括在所述范围内或排除在所述范围外,并且本发明也涵盖一个限值、无限值或两个限值包括在所述较小范围内的各范围,同时需遵守所述范围内任何特别排除的限值的要求。在所述范围包括一个或两个限值的条件下,排除了那些所包括限值中的任一个或两个的范围也包括在本发明内。
21.除非另有定义,否则本文所用的所有技术和科学术语的含义与本发明所属领域的普通技术人员通常理解的含义相同。尽管与本文所描述的方法和材料类似或等同的方法和材料也可用于本发明的实施或测试中,但下文描述了一些潜在和首选的方法和材料。本文提及的所有出版物均以引用方式并入本文,以公开和描述与所引用出版物有关的方法和/或材料。应当理解,当存在矛盾时,本发明内容应取代所引用出版物中的任何公开内容。
22.必须注意的是,如本文和所附权利要求书中所使用的单数形式的“一”、“一个”和“所述/该”包括复数指代对象,除非上下文另有明确说明。因此,举例而言,“重编程因子多肽”的指代对象包括多个此类多肽,而“所述诱导性多能干细胞”的指代对象包括一种或更多种诱导性多能干细胞及所属领域技术人员已知的等效物,等等。
23.本文所讨论的出版物仅供在本专利的申请日之前披露。本文中无任何内容可以解释为承认由于之前的发明使得本发明无权早于此类出版物。此外,所提供的出版日期可能与实际出版日期不同,可能需要单独确认。
24.定义
[0025]“多能性”和多能干细胞意指此类细胞能够分化为生物体内所有类型的细胞。术语“诱导性多能干细胞”涵盖可长时间培养,同时保持分化为生物体内所有类型的细胞的能力的多能细胞(例如胚胎干(es)细胞),也涵盖由分化的体细胞衍生的多能细胞(不同于es细胞),即,潜力更窄、更明确,且在无实验操纵的情况下无法在生物体内产生所有类型的细胞的细胞。hips细胞具有人es样形态,以扁平菌落形式生长,具有较大的核质比、明确的边界和明显的细胞核。此外,hips细胞表达本领域普通技术人员已知的若干种多能性标志物,包
括但不限于碱性磷酸酶、ssea3、ssea4、sox2、oct3/4、nanog、tra160、tra181、tdgf 1、dnmt3b、foxd3、gdf3、cyp26a1、tert和zfp42。此外,所述hips细胞能够形成畸胎瘤。此外,它们能够在活生物体内形成或促成外胚层、中胚层或内胚层组织。
[0026]
本文中使用的“重编程因子”是指作用于细胞以改变转录,从而将细胞重编程为多潜能性或多能性细胞的生物活性因子中的一种或更多种,即混合物。重编程因子可以单独或以重编程因子的单一组合物(即,预混组合物)形式提供给所述细胞,例如,来自具有心脏病家族史或目的基因构成的个体的细胞,例如成纤维细胞、脂肪细胞等。所述因子可以相同的摩尔比或以不同的摩尔比提供。所述因子可以在培养本发明的细胞的过程中提供一次或多次。在一些实施例中,所述重编程因子是转录因子,包括但不限于oct3/4;sox2;klf4;c-myc;nanog;以及lin-28。
[0027]
体细胞与如上定义的重编程因子(其组合和数量足以将所述细胞重编程为多能性细胞)接触。重编程因子可以单独或以重编程因子的单一组合物(即,预混组合物)形式提供给所述体细胞。在一些实施例中,所述重编程因子作为载体上的多个编码序列提供。如本领域所公知,所述体细胞可以是成纤维细胞、脂肪细胞、基质细胞等。体细胞或hips细胞可从细胞库、正常供体、患有目的神经或精神疾病的个体等中获得。
[0028]
进行多能性诱导后,根据任何适宜的方法在诸如辐照过的饲养细胞和市售培养基上培养hips细胞。通过用蛋白酶(例如分散酶)消化,优选地以足以从所述饲养层中分离出完整的多能干细胞集落的浓度和时间消化,可将所述hips细胞从饲养层中解离出来。所述球状体还可通过使用各种方法(包括板中离心等)解离成单细胞悬液和聚集体,由在无饲养层条件下生长的hips细胞生成。
[0029]
可以出于多种目的将基因引入所述体细胞或由其衍生的所述hips细胞,例如,置换具有丧失功能的突变的基因、提供标志基因等。或者,引入表达反义mrna、sirna或核酶等的载体,从而阻断非预期基因的表达。其他基因治疗方法是引入耐药基因,使正常祖细胞具有优势并受到选择压力,例如多重耐药基因(mdr)或抗凋亡基因,例如bcl-2。如上所述,本领域已知的各种技术可用于将核酸引入所述靶细胞,例如,电穿孔、钙沉淀dna、融合、转染、脂质体转染、感染等。引入dna的特定方式对于本发明的实践无关紧要。
[0030]
疾病相关或引起疾病的基因型可通过靶向基因操纵(crispr/cas9等)在健康hips细胞中生成,或者hips细胞可源于携带疾病相关基因型或被诊断患有疾病的个体患者。此外,可在所述模型系统内研究组成不太明确或无遗传组成的神经和神经肌肉疾病。此方法的独特优势是,编辑后的hips细胞系与其相应的未编辑hips细胞系具有相同的遗传背景。这减少了与遗传背景中的系间差异相关的变异性。具有强大的遗传组成或由遗传或基因组改变直接引起的神经发育、神经精神和神经性病症的情况可用本发明的系统建模。
[0031]
本文所述的方法和组合物与脑区特异性球状体相关。脑区特异性球状体或类器官是类似于人脑特定区域的细胞的三维(3d)聚集体,且含有通常与该脑区相关的功能性神经元。这些球状体能够在悬浮培养物中保持较长时间而不粘附于表面(例如培养皿表面),例如2周、4周、1个月、2个月、3个月、4个月、5个月、6个月或更长时间。功能性神经元意指神经元能够与其他神经元一起在同一球状体或另外的球状体中形成功能性突触。可使用钙成像来揭示功能性突触的形成,具体如示例中更为详细的描述所示。例如,本文所述的纹状体球状体包含纹状体神经元,例如中型多棘神经元,并且本文所述的中脑球状体包含多巴胺能
a9/a10神经元。
[0032]
本文所述的方法和组合物还与包含一个以上(例如两个或三个或更多个)的这些脑区特异性球状体的类组装体相关。本文所述的类组装体类似于所述脑的多个区域,且含有一个球状体(代表一个区域)的神经元与另一球状体(代表另一区域)的神经元之间的功能性神经回路。例如,所述皮质-纹状体类组装体类似于所述人脑的所述大脑皮质和纹状体,并且含有从所述皮质球状体投射至所述纹状体球状体中的神经元(例如人皮质神经元),其中这些神经元能够与所述纹状体球状体的人纹状体神经元(例如中型多棘神经元)形成功能性突触。与所述球状体类似,这些类组装体也能够长时间保持而不粘附于表面。
[0033]
纹状体。人纹状体是前脑的一个区域,可以理解为脑中信息处理和协调自主运动控制多个方面的综合枢纽。在神经系统发育过程中,纹状体细胞来自腹侧前脑的外侧神经节隆起(lge)。纹状体是前脑基底神经节(一组以促进运动而闻名的结构)的主要组成部分之一,并接收来自大脑皮质、黑质和丘脑的输入。皮质与纹状体之间的连接是单向的,其中锥体皮质神经元投射至纹状体中,以与中型多棘神经元形成突触,据估计,中型多棘神经元约占人纹状体中神经元总数的95%。纹状体中剩余神经元群体的大部分是gaba能和胆碱能中间神经元。除广泛的皮质连接外,纹状体还与中脑进行广泛的双向连接。
[0034]
纹状体可分为两个主要区域:背侧纹状体和伏隔核。背侧纹状体与涉及运动功能的协调认知有关。黑质中的多巴胺能神经元通过黑质纹状体通路投射至背侧纹状体,并作为基底神经节回路的一部分调节自主运动,其中多巴胺释放调节表达多巴胺受体的中型多棘神经元中的皮质-纹状体传递。伏隔核与其在奖赏和成瘾相关的中脑边缘通路中的作用广泛关联。中脑腹侧被盖区中的多巴胺神经元投射至伏隔核中,活化时会使得多巴胺水平升高。
[0035]
中型多棘神经元是抑制性神经元,也是纹状体的主要神经元。它们是gaba能神经元,因释放神经递质γ-氨基丁酸(gaba)而得名。中型多棘神经元接收来自皮质中的谷氨酸能神经元的兴奋性输入,并且是来自中脑的多巴胺能神经元的目标,其中多巴胺被认为可调节谷氨酸能输入。
[0036]
中型多棘神经元可根据其投射模式以及其神经肽和受体表达细分为两类。表达多巴胺d1受体的中型多棘神经元构成直接通路的一部分。表达多巴胺d2受体的中型多棘神经元构成间接通路的一部分。传统上,这两种纹状体中型多棘神经元群体被认为对基底神经节输出具有相反的影响。直接中型多棘神经元的活化被认为是激发行为的“开始”信号,而间接中型多棘神经元的活化则作为抑制行为的“制动器”(yager等人,2015)。
[0037]
锥体皮质神经元是从大脑皮质投射至纹状体的神经元。这些神经元是兴奋性谷氨酸能神经元。
[0038]
多巴胺能神经元是产生神经递质多巴胺的神经元的集合。神经元主要起源于人中脑中的两个核——黑质和腹侧被盖区。
[0039]
疾病相关性。从皮层到纹状体的神经通路(皮质-纹状体通路)的功能障碍(也可能涉及延伸至/来自中脑的神经通路)被认为会引发严重神经精神病症,例如精神分裂症、强迫症、图雷特综合征、亨廷顿病、帕金森病和孤独症谱系障碍(asd)(shepherd和gordon,2013)。除了解发展外,本文所述的球状体和类组装体还可用于模拟皮质-纹状体通路相关病症,以及用于测试治疗方法,包括基因疗法和小分子药物。
[0040]
精神分裂症。本发明的系统为研究精神分裂症提供了独特机会。精神分裂症是一种影响个体行为的慢性、严重的精神障碍。精神分裂症的根本原因仍不清楚,但该病症与皮质多巴胺信号传导异常有关(shepherd,2014)。
[0041]
强迫症(ocd)是一种个体觉得需要反复执行某些例程的精神障碍。皮质-纹状体功能障碍被认为是ocd发病的主要因素,功能成像显示皮质-纹状体通路中的功能连接增加或出现异常(shepherd,2014)。因此,本文所述的系统为进一步研究ocd以及开发潜在的治疗方法提供了机会。
[0042]
图雷特综合征是一种神经精神运动障碍,其临床特征是出现发声和运动抽搐。虽然仍不清楚其根本原因,但有多项研究均支持皮质-纹状体网络功能障碍是抽搐的神经生物学基础的假设。因此,本文所述的系统允许进一步研究皮质-纹状体网络在图雷特综合征中所起的作用,并支持治疗方案的制定。
[0043]
亨廷顿病是一种神经退行性疾病,其特征在于由选定的神经元群体退化引起的运动和认知功能进行性丧失。亨廷顿病主要由4号染色体上的基因缺陷驱动,导致亨廷顿蛋白编码位点处的cag重复序列扩增。亨廷顿病的神经退行性过程主要影响皮质和纹状体。在纹状体中,此过程主要影响构成间接通路的一部分的中型多棘神经元。可使用本文所述的系统进一步研究这些通路在亨廷顿病和潜在治疗方法中所起的作用。
[0044]
帕金森病是一种影响运动的进行性神经系统病症。当连接中脑黑质与纹状体的神经元退化,导致多巴胺信号传导丢失时,便会出现这种病症。还有证据表明该疾病与皮质-纹状体相关(shepherd,2014)。因此,本文所述的系统为进一步研究帕金森病的潜在回路以及制定新的治疗方案提供了机会。
[0045]
孤独症谱系障碍(asd)是一种发育障碍,其特征在于沟通障碍以及存在重复性/限制性行为,并与纹状体回路缺陷有关。对asd相关基因的多项研究表明皮质-纹状体受累。shank3是一种在中型多棘神经元中表达的突触后支架蛋白,其突变会引起asd相关性22q13.3缺失综合征,也称为费伦-麦克德米德综合征。
[0046]
术语“星形胶质细胞”等涵盖星形胶质细胞谱系的细胞,即胶质祖细胞、星形胶质细胞前体细胞和成熟的星形胶质细胞,出于本发明之目的,其由非星形胶质细胞(即,胶质祖细胞)产生。星形胶质细胞可通过星形胶质细胞谱系细胞特异性标志物来识别,例如gfap、aldh1l1、aqp4、eaat1和eaat2等。反应性星形胶质细胞的标志物包括s100、vim、lcn2、fgfr3等。星形胶质细胞可能具有功能性星形胶质细胞的特征,即,它们可能具有以下能力:促进原代神经元培养物中的突触发生;在相应过程中累积糖原颗粒;吞噬突触;等等。“星形胶质细胞前体”定义为能够产生包括星形胶质细胞的后代的细胞。
[0047]
星形胶质细胞是cns中数量最多、种类最多的神经胶质细胞。星形胶质细胞的原型形态特征是其表达形成细胞骨架的中间丝。星形胶质细胞中间丝蛋白的主要类型是胶质纤维酸性蛋白(gfap)和波形蛋白;gfap、aldh1l1和/或aqp4p的表达通常用作鉴定星形胶质细胞的特异性标志物。
[0048]
术语“少突胶质细胞”、“少突胶质细胞祖细胞”等可涵盖少突胶质细胞谱系的细胞,即最终产生少突胶质细胞、少突胶质细胞祖细胞以及有髓鞘的成熟少突胶质细胞的神经祖细胞,出于本发明之目的,其可通过实验操纵由非少突胶质细胞产生。少突胶质细胞可能具有功能性特性,即可能具有有髓鞘神经元的能力;等等。“少突胶质细胞前体”或“少突
胶质细胞祖细胞”被定义为能够产生包括少突胶质细胞的后代的细胞。少突胶质细胞可以存在于类组装体中。
[0049]
少突胶质细胞是中枢神经系统的髓鞘形成细胞。少突胶质细胞使得许多接触并反复包裹轴突延伸的突起扩展。这些包裹的少突胶质细胞膜层随后凝结形成髓鞘。一个轴突可能含有来自许多不同少突胶质细胞的髓鞘节段。
[0050]
钙传感器。神经活动引起细胞内游离钙的快速变化,所述游离钙可用于追踪神经元群体的活动。用于此目的的本领域认可的传感器包括在钙浓度变化存在的情况下发出荧光的荧光蛋白。可通过在合适的表达载体(例如病毒载体)上包括编码序列来将这些蛋白引入细胞(例如ips细胞),以对通过本文所述的方法产生的神经元进行遗传修饰。尽管也有多种其他传感器可供使用,但gcamp是广泛使用的蛋白钙传感器,由荧光蛋白组成,例如gfp、钙结合蛋白钙调蛋白(cam)以及与cam相互作用的m13肽。有许多不同的蛋白可供使用,包括,例如,以下出版物中所述的蛋白:zhao等人,(2011)科学,333:1888-1891;mank等人,(2008)自然:方法,5(9):805-11;akerboom等人,(2012)神经科学杂志,32(40):13819-40;chen等人,(2013)自然,499(7458):295-300;等等;第8,629,256、9,518,980、9,488,642和9,945,844号美国专利。
[0051]
光遗传学整合了光学和基因工程来测量和操纵神经元。致动器是用于光活化蛋白控制的基因编码工具;例如,视蛋白和光开关。视蛋白是吸收特定波长的光的光门控离子通道或泵。视蛋白可靶向特定神经元子集并在其中表达,从而通过打开和关闭光源对这些神经元进行精确的时空控制。通道视紫红质通常通过直接刺激离子通道,使神经元在暴露于光时快速去极化。莱茵衣藻通道视紫红质-1(chr1)由蓝光激发,并在受刺激时允许非特异性阳离子流入所述细胞。来自其他物种的chr的示例包括:cschr(来自chloromonassubdivisa)、cochr(来自chloromonasoogama)和sdchr(来自scherffeliadubia)。现已创造出合成变体,例如chr2(h134r)、c1v1(t/t)、chief;cheta、vchr1、chrimson、chrimsonr、chronos、pschr2、cochr、cschr、cheriff等。或者,现已创造出并发现了抑制神经元的chr变体,例如gtacr1和gtacr2(来自隐芽植物蓝隐藻)以及变体如ichloc、swichrca、phobos、aurora。嗜盐菌视紫红质(称为nphr,来自法老嗜盐碱单胞菌)用黄光触发时会使得所述细胞超极化,变体包括halo、enphr、enphr2.0、enphr3.0、jaws。来自苏打盐红菌的古细菌视紫红质-3(arch)也用于抑制神经元。
[0052]
本文中使用的术语“治疗”等通常是指获得期望的药理学和/或生理学作用。预防作用是指对疾病或其症状的完全或部分预防,治疗作用是指对疾病和/或疾病导致的不良反应实现部分或完全稳定或治愈。本文中使用的“治疗”涵盖了哺乳动物,特别是人体疾病的任何治疗,包括:(a)防止受试者患上疾病或出现症状,其中所述受试者可能易患上该疾病或出现该症状但尚未确诊;(b)抑制该疾病症状,即阻止其发展;或(c)缓解该疾病症状,即,使疾病或症状消退。
[0053]
术语“个人”、“受试者”、“宿主”和“患者”在本文中可互换使用,指的是需要诊断、治疗或疗法治疗的任何哺乳动物受试者,尤其是人类。
[0054]
产生球状体和类组装体的方法
[0055]
本发明提供了用于获取并使用球状体/类器官和类组装体的体外细胞培养物的方法,其中所述球状体和类组装体由人多能干细胞产生。在一些实施例中,所述人多能干细胞
是诱导性人多能干(hips)细胞。在一些实施例中,所述hips细胞衍生自从神经正常的个体中获得的体细胞。在其他实施例中,所述hips细胞衍生自从个体中获得的体细胞,其包含至少一个编码与疾病相关的突变的等位基因,所述疾病包括但不限于上述神经或精神病症。
[0056]
人诱导性多能干细胞。所述神经祖细胞球状体可由多能干细胞分化而来,包括但不限于人诱导性多能干细胞、hips细胞。最初,hips细胞可从任何适宜的来源获取,或者可使用本领域认可的方法由体细胞生成。从饲养层中解离出所述hips细胞,将其解离成单个细胞并使其在悬浮培养物中生长,优选地在解离为完整集落时进行。在某些实施例中,所述培养物是不含饲养层的培养物,例如在玻连蛋白包被培养皿上生长时。所述培养物可以进一步不含非人源组分,即不含异源动物成分。所述hips细胞可以置于任何适合于hips细胞生长和扩增的培养基中培养。例如,所述培养基可以是essential 8培养基。悬浮生长任选地包括在所述培养基中加入有效剂量的选择性rho相关激酶(rock)抑制剂,用于培养初始阶段,持续至多约6小时、约12小时、约18小时、约24小时、约36小时、约48小时(参见,例如,watanabe等人,(2007)自然:生物技术,25:681 686)。用于此类目的的抑制剂包括但不限于y-27632;thiazovivin(细胞研究,2013,23(10):1187-200;fasudil(ha-1077)hcl(临床研究杂志,2014,124(9):3757-66);gsk429286a(美国国家科学院院刊,2014,111(12):e1140-8);rki-1447;at13148;等等。在特定实施例中,使用rock抑制剂y-27632。任选地,加入了wnt通路抑制剂,例如xav-939。
[0057]
人纹状体球状体(hstrs)
[0058]
为了生成hstrs(也称为纹状体类器官或基底神经节类器官),置于悬浮培养物中约5天、约6天、约7天、约8天、约9天、约10天后,将所述漂浮球状体移至神经培养基中,以分化神经祖细胞。示例性神经培养基是包含神经基础培养基、无维生素a的b-27补充剂和glutamax补充剂的培养基。所述神经培养基补充有所述wnt通路抑制剂和重组活化素a。iwp-2是一种wnt加工和分泌抑制剂(在无细胞测定中,ic50为27nm),选择性阻断porcn介导的wnt棕榈酰化,一般不影响wnt/β-连环蛋白,且对wnt刺激的细胞反应无影响。例如,加入浓度为约0.1μm至约100μm的所述抑制剂,并且所述浓度可以为约1μm至约25μm,具体取决于所选定的抑制剂的活性。其他抑制剂包括但不限于:xav-939,其通过抑制tankyrase1/2来选择性地抑制wnt/β-连环蛋白介导的转录,在无细胞测定中,ic50为11nm/4nm;icg-001,其拮抗wnt/β-连环蛋白/tcf介导的转录,并与元件结合蛋白(cbp)特异性地结合,ic50为3μm;iwr-1-endo,一种wnt通路抑制剂,在表达wnt3a的l细胞中,ic50为180nm,其通过稳定轴蛋白支架破坏复合体诱导axin2蛋白水平并促进β-连环蛋白磷酸化;wnt-c59(c59),一种porcn抑制剂,用于wnt3a介导的多聚化tcf结合位点活化,从而驱动荧光素酶,在hek293细胞中,ic50为74pm;lgk-974,一种有效且具有特异性的porcn抑制剂,能够抑制wnt信号传导,在tm3细胞中,ic50为0.4nm;ky02111,其通过抑制wnt信号传导来促进hips细胞向心肌细胞分化,可以作用于apc和gsk3β的下游;iwp-l6,一种高效porcn抑制剂,ec50为0.5nm;wiki4,一种新型端锚聚合酶抑制剂,对于tnks2,ic50为15nm,可抑制wnt/β-连环蛋白信号传导;fh535,一种wnt/β-连环蛋白信号传导抑制剂,也是一种pparγ和pparδ双重拮抗剂。
[0059]
在某些实施例中,用诸如浓度为约1μm至约10μm、约1μm至约5μm、约2μm至约3μm或约2.5μm的iwp-2补充所述神经培养基。所述重组活化素a可以是重组人/鼠/大鼠活化素a。在某些实施例中,用诸如浓度为约10μg/ml至约100μg/ml、约25μg/ml至约75μg/ml、约40μg/
ml至约60μg/ml或约50μg/ml的人/鼠/大鼠活化素a补充所述神经培养基。
[0060]
为了促进纹状体模式化,在暴露于所述wnt通路抑制剂和所述重组活化素a后约1天至10天、约2天至9天、约3天至8天、约4天至7天、约4天、约5天、约6天或约7天,用有效剂量的类视黄醇x受体(rxr)激动剂进一步补充所述神经培养基。在某些实施例中,在暴露于所述wnt通路抑制剂和所述重组活化素a约6天后,用有效剂量的rxr激动剂补充所述神经培养基。
[0061]
所述神经培养基可以包括有效剂量的rxr激动剂,例如浓度为约10μm至约200μm、约50μm至约150μm或约75μm至约125μm,具体取决于所选定的抑制剂的活性。示例性激动剂是(但不限于)sr11237、贝沙罗汀、agn194204、lg100268、9-顺式-视黄酸、烯虫酯酸。在某些实施例中,所述rxr激动剂是sr11237,例如添加浓度为约10μm至约200μm、约50μm至约150μm、约75μm至约125μm、约100μm。
[0062]
如示例所证实,例如在将悬浮培养的hips细胞向神经命运诱导至少3周后,组合使用所述wnt通路抑制剂、重组活化素a和rxr激动剂可形成具有高水平标志物(指示所述人纹状体)的纹状体球状体。例如,所述纹状体球状体可以具有高水平的前脑标志物(例如foxg1)和/或高水平的外侧神经节隆起(lge)标志物(例如gsx2、meis2、ctip2),但下丘脑标志基因rax和脊髓标志基因hoxb4的水平偏低。用于确定标志基因水平的方法包括如示例中进一步描述的qpcr。在一些实施例中,本文所揭示的方法进一步包含确定所述纹状体球状体是否表达前脑和lge标志物。使用标准统计检验计算时,与非纹状体球状体(例如皮质球状体(hcs))中的基因表达相比,具有高或低水平标志基因的纹状体球状体可以具有明显更高或更低水平的标志基因表达。
[0063]
为了促进神经祖细胞向神经元的分化,在暴露于所述wnt通路抑制剂和所述重组活化素a后约1周、约2周、约3周、约4周,更换所述神经培养基,以用有效剂量的bdnf和nt3替换所述wnt通路抑制剂和所述重组活化素a(以及所述rxr激动剂,如有)。可提供各自浓度为至少约0.5ng/ml、至少约1ng/ml、至少约5ng/ml、至少约10ng/ml、至少约20ng/ml、至多约500ng/ml、至多约250ng/ml、至多约100ng/ml或约20ng/ml的所述生长因子。
[0064]
通常可以用有效剂量的以下各项中的一种或更多种进一步补充此阶段的所述神经培养基:浓度为约1至25μm、约2至10μm且可以为约2.5μm的γ分泌酶抑制剂,例如dapt;浓度为约10至500nm、约50至250nm且可以为约200nm的l-抗坏血酸;浓度为约10至500nm、约50至150nm且可以为约100nm的camp;以及二十二碳六烯酸(dha)。在一些实施例中,所述神经培养基包含有效剂量的bdnf、nt3、γ分泌酶抑制剂、l-抗坏血酸、camp和dha。
[0065]
在暴露于所述wnt通路抑制剂和所述重组活化素a后约4周、约5周、约6周、约7周,可在较长时间内保持所述球状体处于神经培养基中,例如1、2、3、4、5、6、7、8、9、10、11、12个月或更长时间。在一些实施例中,在3个月或更长时间内保持所述球状体。可以保持所述球状体处于无生长因子存在的神经培养基中。
[0066]
所述人纹状体球状体包含功能性gaba能中型多棘神经元,这些神经元在神经培养基中长时间培养后会形成树突棘。如上所述,中型多棘神经元是所述人纹状体中的主要细胞类型,并接收来自若干个区域(包括所述皮质)的谷氨酸能输入以及来自所述中脑的多巴胺能输入。所述树突棘的存在可通过观察来确定,例如通过使用显微镜观察。所述gaba能神经元的存在也可通过监测使用gaba能神经元特异性调节序列(例如启动子和/或增强子)表
达的报告基因(例如dlx)来检测。所述神经元的所述功能可通过监测神经元活动来确定,例如对ca
2
活动进行成像。
[0067]
人皮质球状体。
[0068]
人皮质球状体可以通过前文描述的方法生成,例如以下出版物中所述的方法:pasca等人,(2015)自然:方法,12(7):671-678,标题为“3d培养中来自人多能干细胞的功能性皮质神经元和星形胶质细胞”,该出版物中的内容以引用方式并入本文。
[0069]
例如,如上所述,培养悬浮培养的hips细胞,以提供神经祖细胞球状体。置于悬浮培养物中约5天、约6天、约7天、约8天、约9天、约10天后,将所述漂浮的神经祖细胞球状体移至神经培养基中,以分化所述神经祖细胞。用有效剂量的fgf2和egf补充所述培养基。可提供各自浓度为至少约0.5ng/ml、至少约1ng/ml、至少约5ng/ml、至少约10ng/ml、至少约20ng/ml、至多约500ng/ml、至多约250ng/ml、至多约100ng/ml的所述生长因子。
[0070]
为了促进神经祖细胞向包含谷氨酸能神经元的hcs的分化,在fgf2/egf暴露后约1周、约2周、约3周、约4周,更换所述神经培养基,以用有效剂量的bdnf和nt3替换所述fgf2和egf。可提供各自浓度为至少约0.5ng/ml、至少约1ng/ml、至少约5ng/ml、至少约10ng/ml、至少约20ng/ml、至多约500ng/ml、至多约250ng/ml、至多约100ng/ml的所述生长因子。所述皮质球状体包含功能性谷氨酸能神经元。
[0071]
中脑球状体。
[0072]
人中脑球状体(hmbs)(也称为中脑类器官)生成方式如下:利用与上述hstrs生成类似的多步骤过程,使用药剂来促进中脑而非纹状体的分化。通过在所述培养基中加入有效剂量的bmp和tgfβ通路抑制剂而向神经命运诱导的早期球状体可以在fgf8和音猬因子通路激动剂存在的情况下进行培养,例如,在加入所述bmp和tgfβ通路抑制剂之时即已存在,在用bmp和tgfβ通路抑制剂培养约12小时后、约24小时后、约1天后、约2天后、约3天后、约4天后存在。保持fgf8和音猬因子通路激动剂约6小时、约12小时、约1天、约36小时、约2天。可以保持诸如浓度为约20ng/ml至约200ng/ml的fgf8,所述浓度可以为约50ng/ml至约150ng/ml、约75ng/ml至约125ng/ml或约100ng/ml,具体取决于所选定的抑制剂的活性。可以保持诸如浓度为约0.1μm至约10μm、约0.5μm至约5μm、约0.5μm至约2μm或可以为约1μm的所述音猬因子通路激动剂,具体取决于所选定的抑制剂的活性。
[0073]
合适的音猬因子通路激动剂包括平滑激动剂(sag,cas 364590-63-6),其通过与smo七螺旋结构域相互作用来调节所述smo与其下游效应子的偶联(kd=59nm)。可以在所述培养基中提供浓度为约0.1μm至约10μm、约0.5μm至约5μm、约0.5μm至约2μm或者浓度约为1μm的sag。
[0074]
然后,将所述神经球状体移至神经培养基中,并在fgf8、音猬因子通路激动剂、bmp抑制剂和gsk-3抑制剂存在的情况下进行培养。所述fgf8和音猬因子通路激动剂可以如上述步骤(a)所述。所述bmp抑制剂可以是ldn-193189(临床研究杂志,2015,125(2):796-808);galunisertib(ly2157299)(癌症研究,2014,74(21):5963-77);ly2109761(毒理学,2014,326c:9-17);sb525334(细胞信号,2014,26(12):3027-35);sd-208;ew-7197;kartogenin;dmh1;ldn-212854;ml347;ldn-193189hcl(美国国家研究院院刊,2013,110(52):e5039-48);sb505124;吡非尼酮(组织化学与细胞生物学,2014,10.1007/s00418-014-1223-0);repsox;k02288;橙皮素;gw788388;ly364947;等等。在某些实施例中,所述
bmp抑制剂是在所述培养基中提供的ldn-193189,例如,其浓度为约10nm至约500nm、约50nm至约250nm、约75nm至约125nm或者浓度可以为约100nm。所述gsk-3抑制剂可以是加入的chir99021,例如其浓度为约0.5μm至约50μm、约1μm至约25μm、约1μm至约10μm、约1μm至约5μm或者浓度可以为约3μm。
[0075]
为了提供中脑球状体,所述神经球状体可以在所述神经培养基中培养约1至4周、约1至3周、约2至3周,在此期间,所述fgf8和音猬因子通路激动剂可以存在于所述神经培养基中,或者可以在转移至所述神经培养基中约1、2或3天后添加至所述神经培养基中。可以保持所述fgf8和音猬因子通路激动剂处于所述神经培养基中约7天至约21天、约7天至约18天、约10天至18天,并且保持其处于所述神经培养基中约7天、约10天、约14天、约18天或约21天。所述bmp抑制剂可以与所述fgf8和音猬因子通路激动剂同时添加至所述神经培养基中,并且可以保持其处于所述神经培养基中约7天至约14天、约7天至约10天、约7天、约8天、约9天或约10天。所述gsk-3抑制剂可以与所述fgf8和音猬因子通路激动剂同时添加至所述神经培养基中,或者可以在fgf8和音猬因子通路激动剂添加约1、2或3天后再添加至所述神经培养基中。可以保持所述gsk-3抑制剂处于所述神经培养基中约7天至约21天、约10天至约18天、约12天至16天、约7天、约10天、约15天或约20天。
[0076]
在某些实施例中,所述神经球状体在所述神经培养基中培养约2至3周,其中所述fgf8抑制剂和音猬因子通路激动剂存在于所述神经培养基中(在存在于所述神经培养基之后发生),或者在约1天后添加至所述神经培养基中,并保持其处于所述神经培养基中约10天至18天;所述bmp抑制剂与所述fgf8和音猬因子通路激动剂同时添加至所述神经培养基中,并保持其处于所述神经培养基中约7天至约10天;所述gsk-3抑制剂在fgf8和音猬因子通路激动剂添加约1天后再添加至所述神经培养基中,并保持其处于所述神经培养基中约12天至16天。
[0077]
如示例所证实,例如在将悬浮培养的hips细胞向神经命运诱导至少3周后,组合使用fgf8、音猬因子通路激动剂、bmp抑制剂和gsk-3抑制剂可形成具有高水平标志物(指示所述人中脑)的中脑球状体。例如,所述中脑球状体可以具有高水平的底板中脑多巴胺能神经元标志物(例如en1和foxa2)和低水平的前脑标志物(例如foxg1)。用于确定标志基因水平的方法包括如示例中进一步描述的qpcr。在一些实施例中,本文所揭示的方法进一步包含确定所述中脑球状体是否表达指示所述人中脑的标志物。使用标准统计检验计算时,与非中脑球状体(例如皮质球状体)中的基因表达相比,具有高或低水平标志基因的中脑球状体可以具有明显更高或更低水平的标志基因表达。
[0078]
为了促进神经祖细胞向神经元的分化,在暴露于fgf8、音猬因子通路激动剂、bmp抑制剂和gsk-3抑制剂后约1周、约2周、约3周、约4周,更换所述神经培养基,以用有效剂量的bdnf和nt3替换所述fgf8、音猬因子通路激动剂、bmp抑制剂和gsk-3抑制剂。可提供各自浓度为至少约0.5ng/ml、至少约1ng/ml、至少约5ng/ml、至少约10ng/ml、至少约20ng/ml、至多约500ng/ml、至多约250ng/ml、至多约100ng/ml的所述生长因子。通常可以用以下各项中的一种或更多种进一步补充此阶段的所述神经培养基:浓度为约1至25μm、约2至10μm且可以为约2.5μm的γ分泌酶抑制剂,例如dapt;浓度为约10至500nm、约50至250nm且可以为约200nm的l-抗坏血酸;浓度为约10至500nm、约50至150nm且可以为约100nm的camp;以及dha。
[0079]
可以保持所述中脑球状体处于所述补充的神经培养基中约1周、约2周、约3周。在
此类培养后,可在较长时间内保持所述中脑球状体处于神经培养基中,例如1、2、3、4、5、6、7、8、9、10、11、12、24、36个月或更长时间。在一些实施例中,在3个月或更长时间内保持所述球状体。可以保持所述球状体处于无生长因子存在的神经培养基中。所述人中脑球状体包含在神经培养基中培养了较长时间的多巴胺能神经元。
[0080]
类组装体。所述hstrs可与单独培养的人皮质球状体(hcs)进行功能性整合,以形成包括谷氨酸能神经元的皮质-纹状体类组装体(hcs-hstrs)。由此得到的hcs-hstrs含有皮质-纹状体回路,并对这些回路进行功能整合。功能性整合的细胞以生理上相关的方式相互作用,例如形成突触或肌肉神经接点、传递信号、形成多细胞结构等。
[0081]
在允许细胞融合的条件下,在神经培养基中将所述皮质球状体与所述人纹状体球状体共培养。允许细胞融合的条件可以包括使所述hstrs和hcs紧靠进行培养,例如彼此直接接触。
[0082]
培养约30天、约60天、约90天后(适用于hstrs);培养约30天、约60天、约90天后(适用于hcs),可以用球状体进行组装。可以将所述hstrs和hcs球状体共培养3天、5天、8天、10天、14天、18天、21天或更长时间。据证实,由此得到的皮质-纹状体类组装体含有功能性神经回路,其中所述类组装体包含从所述hcs投射至所述hstrs的谷氨酸能神经元。所述谷氨酸能神经元可以是单向神经元,例如单向ctip2和/或satb2表达神经元。用于确认所述神经元的所述功能的方法是本领域已知的方法,并且包括光遗传学方法和神经元中钙活动成像,例如示例中描述的方法。在一些实施例中,所述方法可以包含确认所述皮质-纹状体类组装体中的神经元的功能。
[0083]
人中脑球状体(hmbs)和中脑-纹状体类组装体(hmbs-hstrs)
[0084]
如上所述,所述人纹状体接收来自所述中脑的多巴胺能输入,所述输入在所述纹状体的发育和成熟中起着重要作用。此外,所述纹状体对所述中脑的gaba能调节是所述基底神经节直接通路的重要组成部分。为了研究这些回路,所述hmbs可与单独培养的hstrs进行功能性整合,以形成包括多巴胺能神经元和gaba能中型多棘神经元的中脑-纹状体类组装体(hmbs-hstrs)。由此得到的hmbs-hstrs类组装体对所述中脑-纹状体回路进行了功能整合。
[0085]
如本文所述分别生成hmbs和hstrs,然后在允许细胞融合的条件下将其置于神经培养基中共培养。允许细胞融合的条件可以包括使所述hmbs和hstrs紧靠进行培养,例如彼此接触。
[0086]
培养约30天、约60天、约90天后(适用于hstrs);培养约30天、约60天、约90天后(适用于hmbs),可以用球状体进行组装。可以将所述hstrs和hmbs球状体共培养1天、2天、3天或更长时间。由此得到的hmbs-hstrs含有功能性神经回路,其中所述hmbs-hstrs类组装体包含从hmbs投射至hstrs的中脑神经元(例如多巴胺能神经元)。
[0087]
可将上述球状体进一步组装至三部分组成的皮质-纹状体-中脑类组装体(hcs-hstrs-hmbs)中,以研究涉及所述纹状体、皮质和中脑神经元的神经回路。例如,上述hcs-hstrs类组装体可与hmbs共培养,以提供这些三部分组成的类组装体。或者,上述hmbs-hstrs可与hcs共培养,以提供所述三部分组成的类组装体。或者另外,所述hmbs、hstrs和hcs球状体可单独生成,并且所有这三种球状体共培养,以提供所述三部分组成的类组装体。由此得到的三部分组成的类组装体包含从hmbs投射至hstrs的多巴胺能神经元以及从
所述hcs投射至hstrs的谷氨酸能神经元,并且可用于研究此系统中的谷氨酸能和多巴胺能调节。
[0088]
筛选测定
[0089]
本文还公开了涉及确定候选药剂对所述球状体(例如hstrs或hmbs)或类组装体(例如hcs-hstrs、hmbs-hstrs或hcs-hstrs-hmbs)或由其衍生的细胞的影响的筛选测定。候选药剂可以是小分子或遗传因子。所述筛选测定可以涉及使所述候选药剂与所述球状体、类组装体或由其衍生的细胞接触,并确定所述候选药剂对所述球状体、组装体或细胞的参数的影响,其中此类参数包括形态、基因或功能变化。
[0090]
例如,筛选测定可以涉及确定候选药剂对球状体或类组装体内神经回路的数量和/或功能的影响。如本文所述,hcs-hstrs类组装体通常包含从所述hcs投射至所述hstrs的神经元,并且这些神经元是功能性神经元。因此,所述筛选测定可以涉及确定候选药剂能否使包含hcs和hstrs的类组装体内的这些皮质-纹状体回路的数量和/或功能增加或减少。另外,如本文所述,hmbs-hstrs类组装体包含从所述hmbs投射至所述hstrs的神经元。因此,所述筛选测定可以涉及确定候选药剂能否使包含hmbs和hstrs的类组装体内的这些纹状体-中脑回路的数量和/或功能增加或减少。
[0091]
另外,如本文所述,各种疾病和病症与皮质-纹状体功能障碍有关。因此,在所述球状体或类组装体包含至少一个与神经或精神病症(例如精神分裂症、强迫症、图雷特综合征、亨廷顿病、帕金森病和孤独症谱系障碍)相关的等位基因的情况下,可能尤其适用本文所述的测定。能够使包含这些病症相关等位基因的球状体或类组装体中皮质-纹状体回路的功能恢复的候选药剂在所述病症的治疗中可能具有治疗效用。
[0092]
神经活动引起细胞内游离钙的快速变化。因此,利用这一点的钙成像测定可用于确定神经元回路的功能。这可能涉及修饰神经元以含有基因编码的钙指示蛋白,使得所述蛋白包括荧光团传感器gcamp并对这些细胞进行成像。gcamp包含循环排列的绿色荧光蛋白、钙结合蛋白钙调蛋白(cam)以及与cam相互作用的m13肽,其中所述gfp的亮度在钙结合后有所增加。有关钙成像测定的进一步详情请见以下出版物:chen等人,(2013)自然,499(7458):295-300。其他钙成像测定包括fura-2钙成像、fluo-4钙成像和cal-590钙成像。
[0093]
例如,可以修饰所述神经元以表达gcamp6f。这可与响应于外部刺激而活化某些神经元的方法相结合,例如响应于光而活化神经元的光遗传学方法。例如,为了测试神经回路中涉及的两种神经元之间的功能,可修饰“第一”神经元以表达光遗传学致动器(例如chrimsonr),并且可修饰“第二”神经元以表达钙指示剂(例如gcamp6f)和用于监测钙释放的成像。如果所述第一神经元与所述第二神经元进行功能性连接(突触连接),则所述第一神经元的光遗传学活化将激发钙释放以及显现所述第二神经元的可见读数。如本文中的示例所述,此类方法用于确认所述皮质-纹状体回路的功能。
[0094]
另外受人关注的是单细胞水平下的分析方法,例如如上所述:实时成像(包括共聚焦或光片显微镜检查)、单细胞基因表达或单细胞rna测序、钙成像、免疫细胞化学、膜片钳、流式细胞术等。可测量各种参数,以确定药物或治疗对所述球状体、类组装体或由其衍生的细胞的影响。例如,构成所述球状体或类组装体的细胞的单细胞rna测序可用于表征这些细胞的特性,并且可用于旨在确定候选药剂是否影响细胞身份的测定中。
[0095]
参数是细胞的可量化组分,尤其是可以在高通量系统中准确测量的组分。参数还
可以是任何细胞组分或细胞产物,包括细胞表面决定因素、受体、蛋白或其构象或翻译后修饰、脂质、碳水化合物、有机或无机分子、核酸(例如,mrna、dna等)或源自此类细胞组分的部分或其组合。虽然大多数参数会提供定量读数,但在一些情况下,半定量或定性结果是可接受的。读数可以包括单个确定的值,也可以包括平均值、中值或方差等。相应值预计会发生变化,并且采用标准统计方法和用于提供单个值的常用统计方法来获取测试参数组中各参数的值范围。
[0096]
目的参数包括细胞质、细胞表面或分泌的生物分子、生物聚合物的检测,例如多肽、多糖、多核苷酸、脂质等。细胞表面和分泌的分子是优选的参数类型,因为它们介导细胞通讯和细胞效应子反应,并且可以更轻易地进行测定。在一实施例中,参数包括特异性表位。经常使用特异性单克隆抗体或受体探针鉴定表位。在一些情况下,包含所述表位的所述分子实体来自两种或更多种物质,并且包含确定的结构;示例包括与异二聚体整联蛋白相关的用组合方法确定的表位。参数可以是特异性修饰的蛋白或寡糖的检测。参数可以由特异性单克隆抗体或配体或受体结合决定簇来定义。
[0097]
目的候选药剂是涵盖许多化学类别的生物活性剂,主要是有机分子,其可以包括有机金属分子、无机分子、基因序列等。本发明的重要方面是评价候选药物、选择具有优选生物反应功能的治疗性抗体和基于蛋白的治疗手段。候选药剂包含与蛋白进行结构相互作用(尤其是氢键结合)所必需的官能团,且通常包括至少一个氨基、羰基、羟基或羧基,经常包括至少两个官能化学基团。所述候选药剂通常包含被一个或更多个上述官能团取代的环状碳或杂环结构和/或芳族或多芳族结构。候选药剂还可以源自于包括肽、多核苷酸、糖类、脂肪酸、类固醇、嘌呤、嘧啶、衍生物、结构类似物或其组合的生物分子。
[0098]
其包括药理活性药物、遗传活性分子等。目的化合物包括化疗剂、抗炎剂、激素或激素拮抗剂、离子通道修饰剂和神经活性剂。适用于本发明的药物制剂的示例是以下出版物中描述的药物制剂:“治疗学的药理学基础”,goodman和gilman,mcgraw-hill,纽约州纽约市,(1996),第九版,以下章节:作用于突触和神经效应器连接部位的药物;心血管药物;维生素,皮肤科;以及毒理学,所有内容均以引用方式并入本文。
[0099]
受试化合物包括上述所有类型的分子,并且可以进一步包含未知含量的样本。受人关注的是源自天然来源(例如植物)的天然存在的化合物的复杂混合物。虽然许多样本包含化合物溶液,但也可以测定可溶于合适溶剂中的固体样本。目的样本包括环境样本,例如地下水、海水、采矿废弃物等;生物学样本,例如用作物、组织样本等制备的裂解物;制造样本,例如药品制备过程中的时间进程;以及为分析制备的化合物文库;等等。目的样本包括正在评估潜在治疗价值的化合物,即候选药物。
[0100]
术语样本还包括已向其中加入额外组分的上述流体,例如影响离子强度、ph、总蛋白浓度等的组分。此外,可对所述样本进行处理,以实现至少部分分级分离或浓缩。如果注意减少所述化合物的降解,则可以将生物学样本储存在氮气下、将其冷冻储存或其组合等。所用样本的体积足以进行可测量的检测,通常约0.1至1ml的生物学样本便已足够。
[0101]
化合物(包括候选药剂)可从各种来源处获得,包括合成或天然化合物文库。例如,许多手段可用于各种有机化合物(包括生物分子)的随机和定向合成,包括随机寡核苷酸和寡肽的表达。或者,可获得或轻易产生呈细菌、真菌、植物和动物提取物形式的天然化合物文库。此外,天然或合成产生的文库和化合物可通过常规化学、物理和生化手段轻易地加以
修饰,且可用于产生组合文库。已知药剂可以进行直接或随机的化学修饰(例如,酰化、烷化、酯化、酰胺化等),以生成结构类似物。
[0102]
本文中使用的术语“遗传因子”是指多核苷酸及其类似物,其中在本发明的筛选测定中通过向细胞中加入所述遗传因子来测试所述遗传因子。所述遗传因子的引入使得所述细胞的总遗传组成发生改变。遗传因子(例如dna)可使得细胞基因组发生实验引入的变化,通常通过将所述序列整合到染色体中进行,例如使用crispr介导的基因组工程(参见,例如,shmakov等人,(2017)自然综述:微生物学,15:169)。基因变化也可以是瞬时变化,其中所述外源序列未整合,而是作为附加体保持。遗传因子(例如反义寡核苷酸)还可通过干扰mrna的转录或翻译,在不改变细胞基因型的情况下影响蛋白的表达。遗传因子的作用是使所述细胞中一种或更多种基因产物的表达增加或减少。
[0103]
编码多肽的表达载体的引入可用于在缺乏所述序列的细胞中表达所述编码产物,或过表达所述产物。可使用各种组成型或受外部调节的启动子,其中在后一种情形中,可开启或关闭基因转录。这些编码序列可以包括全长cdna或基因组克隆、由其衍生的片段或将天然存在的序列与其他编码序列的功能或结构域组合的嵌合体。或者,所述引入的序列可以编码反义序列;为反义寡核苷酸;rnai,编码显性负突变,或天然序列的显性或组成性活性突变;改变的调节序列等。所述表达载体可以是病毒载体,例如腺相关病毒、腺病毒、单纯疱疹病毒、逆转录病毒、慢病毒、甲病毒、黄病毒、弹状病毒、麻疹病毒、新城疫病毒、痘病毒和小核糖核酸病毒载体。
[0104]
可通过本领域已知的方法化学合成反义和rnai寡核苷酸。利用其本身的磷酸二酯结构对优选寡核苷酸进行化学修饰,以便增加其细胞内稳定性和结合亲和力。文献中已记载了许多这样的修饰,其改变骨架、糖或杂环碱基的化学性质。骨架化学法中有用的变化是硫代磷酸酯、二硫代磷酸酯,其中两个非桥连氧都被硫、亚磷酰胺、烷基磷酸三酯和硼酸磷酸酯取代。非手性磷酸酯衍生物包括3'-o'-5'-s-硫代磷酸酯、3'-s-5'-o-硫代磷酸酯、3'-ch2-5'-o-膦酸酯和3'-nh-5'-o-磷酰胺。肽核酸用肽键替代整个核糖磷酸二酯骨架。糖修饰也用于增强稳定性和亲和力,例如吗啉代寡核苷酸类似物。
[0105]
用不同浓度的药剂并行进行多项测定,以获得对各种浓度的不同反应。如本领域所公知,确定药剂的有效浓度通常使用由1:10或其他对数比例的稀释液得到的浓度范围。如有必要,可以使用第二系列稀释液进一步细化浓度。通常,这些浓度中的其中一种用作阴性对照,即零浓度或低于所述药剂的检测水平,或处于或低于不会发生可检测的表型变化的药剂浓度。
[0106]
除上述功能参数外,还可利用各种方法来量化选定参数的存在。为了测量存在的分子的量,适宜的方法是用可检测的部分标记分子,所述部分可以是荧光的、发光的、放射性的、具有酶活性的等,尤其是以高亲和力与所述参数特异性结合的分子,荧光部分可随时用于标记几乎任何生物分子、结构或细胞类型。免疫荧光部分不仅可与特异性蛋白结合,还可与特异性构象、裂解产物或磷酸化等位点修饰结合。可对单独的肽和蛋白进行工程改造以发出荧光,例如通过将其表达为细胞内的绿色荧光蛋白嵌合体实现(有关综述,请参见jones等人,(1999)生物技术动向,17(12):477-81)。因此,可对抗体进行基因修饰,以提供荧光染料作为其结构的一部分
[0107]
根据选择的标记,可以使用荧光标记以外的方法、免疫测定技术(例如放射免疫测
定(ria)或酶联免疫吸附测定(elisa)、均质酶免疫测定)以及相关的非酶技术测量参数。这些技术利用特异性抗体作为报告分子,由于其对附着于单个分子靶标的高度特异性,因此尤为有用。第4,568,649号美国专利描述了配体检测系统,所述系统采用了闪烁计数。这些技术对于蛋白或修饰的蛋白参数或表位或碳水化合物决定簇而言尤为有用。可使用荧光或其他标记的报告分子获得蛋白和其他细胞决定体的细胞读数。基于细胞的elisa或相关的非酶或基于荧光的方法能够测量细胞表面参数和分泌参数。capture elisa和相关的非酶方法通常采用两种特异性抗体或报告分子,可用于测量溶液中的参数。流式细胞术方法可用于测量细胞表面和细胞内参数,以及形状变化和粒度,并且可用于分析用作抗体或探针连接试剂的磁珠。此类测定的读数可以是与单独的荧光抗体检测细胞表面分子或细胞因子相关的荧光平均值,或者是平均荧光强度、中值荧光强度、荧光强度的变化或这些值之间的某种关系。
[0108]
本领域使用单细胞多参数和多细胞多参数多重测定,其中鉴定了输入细胞类型,并通过定量成像以及荧光和共聚焦显微镜检查读取参数,详情请参见共聚焦显微镜检查法和方案(分子生物学方法第122卷)。paddock,编辑,humana press,1998。这些方法请见1999年11月23日发布的第5,989,833号美国专利。
[0109]
可将测定结果输入数据处理器中,以提供数据集。算法用于比较和分析在不同条件下获得的数据。通过确定多个参数的变化来读取因素和药剂的影响。所述数据将包括来自用所述药剂进行的测定组合的结果,并且还可以包括对照状态、模拟状态以及来自使用其他药剂或在其他条件下进行的其他测定组合的结果中的一种或更多种。为了快速轻松地进行比较,所述结果可以在图表中直观地呈现,并且可包括数字、图表、颜色表示等。
[0110]
所述数据集是由通过以下方式获得的值编制而成:在不同细胞(例如基因修饰细胞、在影响神经元功能的特定因素或药剂存在的情况下培养的细胞)存在和不存在的情况下测量参数,将目的药剂的存在情况与至少一种其他状态进行比较,通常是对照状态,其可以包括无药剂或含有不同药剂的状态。所述参数包括功能状态,例如响应于刺激的突触形成和钙离子,其水平在所述因素存在的情况下会有所不同。理想的是,相对于标准(通常是“对照值或状态”)将所述结果归一化,以提供归一化的数据集。从测试条件中获得的值可通过以下方式实现归一化:从所述实测值中减去未受刺激的对照值,将校正的实测值除以校正的刺激对照值。还可使用其他归一化方法;并且可以使用实测值的对数或其他导数或实测值与刺激值或其他对照值的比率。在对照条件下,相对于相同细胞类型的对照数据将数据归一化,但数据集可以包含来自一种、两种或多种细胞类型和测定条件的归一化数据。
[0111]
所述数据集可包含在不同测定组合下获得的参数组的水平值。编制了为足够数量的替代测定组合提供值以允许比较值的汇编。
[0112]
数据库可基于实验组进行汇编,例如,数据库可含有从一组测定组合中获得的数据,具有多种不同的环境变化,其中每项变化可以是一系列相关的化合物,也可以是代表不同类别的分子的化合物。
[0113]
数学系统可用于比较数据集,并定量测量它们之间的相似性和差异性。例如,可通过使用统计分析(相关系数等)以量化相关性的模式识别算法或聚类方法(例如分层或k均值聚类等)来分析所述数据集。可修改这些方法(通过加权、采用分类策略等),以优化数据集区分不同功能效应的能力。例如,在分析数据集时,可向各个参数或多或少地赋予权重,
以增强分析的判别能力。评估改变分配给每个参数的权重的效果,并使用迭代过程来优化通路或细胞功能区分。
[0114]
从受试化合物中获得的数据集与参考数据集的比较通过使用合适的推导方案、ai系统、统计比较等来完成。优选地,将所述数据集与参考数据的数据库进行比较。与涉及已知通路刺激或抑制剂的参考数据的相似性可提供对由受试刺激或药剂靶向或改变的细胞通路的初始指示。
[0115]
可汇编参考数据库。这些数据库可以包括来自套组的参考数据,所述套组包括靶向特定通路的已知药剂或药剂组合,同时包括来自在环境条件下处理的细胞的分析的参考数据,其中删除或专门改变了单个或多个环境条件或参数。参考数据还可以基于含有细胞的套组生成,所述细胞具有选择性靶向或调节特定细胞通路的遗传构建体。通过这种方式,开发可揭示各个通路对复杂反应的贡献的数据库。
[0116]
模式搜索算法在分类中的有效性可涉及参数数量和测定组合的优化。所揭示的用于选择参数的技术提供了得到生理相关输出的计算要求。此外,这些使用细胞活动和疾病相关生物信息预过滤数据集(或潜在数据集)的技术提高了从数据库检索返回的输出与预测药剂机制和体内药剂效果相关的可能性。
[0117]
为了开发用于生物活性药物化合物或其他干预措施选择及分类的专家系统,采用以下程序。对于每种参考和测试模式,通常会生成数据矩阵,其中所述数据矩阵中的每个点对应于参数的读数,其中每个参数的数据可以来自于重复测定,例如相同类型的多个独立细胞。如前所述,数据点可以是定量的、半定量的或定性的,这取决于所述参数的性质。
[0118]
读数可以是与测量相关的平均值、平均数、中值、方差或其他统计学或数学导出的值。通过直接比较相应的参考读出,可以进一步细化参数读数信息。在相同条件下针对各项参数获得的绝对值将显示出活生物体所固有的变异性,还可以反映出个体细胞变异性以及个体之间固有的变异性。
[0119]
分类规则是基于从多次重复实验中获得的训练数据集(即数据矩阵)构建的。选择分类规则,以便正确识别重复参考模式并成功区分不同的参考模式。分类规则学习算法可以包括决策树方法、统计方法、朴素贝叶斯算法等。
[0120]
知识数据库将具有足够的复杂性,以便有效识别新的受试数据并分类。用于生成一组充分涵盖的分类模式的若干种方法以及用于区分它们的足够强大的数学/统计方法可以实现这一点。
[0121]
来自用已知与特定靶标或通路相互作用的特异性药物处理的细胞的数据提供了一组更为详细的分类读数。基于使用过表达技术和反义技术进行基因修饰的细胞生成的数据允许测试单个基因对表型的影响。
[0122]
优选知识数据库含有来自优化细胞、环境和参数组的参考数据。对于复杂的环境,知识数据库还可以包括反映环境微小变化的数据,例如其中一种或更多种目的因子或细胞类型被排除在外或包括在内或定量改变的环境,例如浓度或暴露时间等
[0123]
对于在实践本发明时有用的一般技术的进一步阐述,从业者可参考细胞生物学、组织培养、胚胎学和神经生物学方面的标准教科书和综述。对于组织培养和胚胎干细胞,读者不妨参考畸胎癌和胚胎干细胞:一种实践方法(e.j.robertson,编辑,irl pressltd.,1987);小鼠发育技术指南(p.m.wasserman等人编辑,academic press,1993);胚胎干细胞
体外分化(m.v.wiles,酶学方法,225:900,1993);胚胎干细胞的特性和用途:应用于人类生物学和基因治疗的前景(p.d.rathjen等人,生殖、生育力和发育,10:31,1998)。
[0124]
分子学和细胞生物化学的一般检查方法可参阅以下标准教材:分子克隆:实验室手册,第3版(sambrook等人,harbor laboratory press 2001);精编分子生物学实验指南,第4版(编辑:ausubel等人,john wiley&sons 1999);蛋白质方法(bollag等人,john wiley&sons 1996);用于基因治疗的非病毒载体(编辑:wagner等人,academic press 1999);病毒载体(编辑:kaplift和loewy,academic press 1995);免疫学方法手册(编辑:i.lefkovits,academic press 1997);细胞与组织培养:生物技术实验室程序(doyle和griffiths,john wiley&sons 1998)。本发明中提及的用于基因操纵的试剂、克隆载体和试剂盒可从商业供货商处获得,例如,biorad、stratagene、invitrogen、sigma-aldrich和clontech。
[0125]
本说明书中引用的每份出版物均出于所有目的通过引用方式全文并入本文中。
[0126]
提出以下示例是为了向本领域普通技术人员完整地公开并叙述构建及使用本发明的方法,并且无意限制发明人所认为其发明的范围,也无意表示以下实验是全部或唯一进行的实验。已经努力确保所使用数字(例如数量、温度等)的准确性,但是应该考虑到一些实验误差和偏差。除非另有说明,否则份数为重量份数,分子量为重均分子量,温度为摄氏度,压力指大气压或接近大气压。
[0127]
实验
[0128]
本发明描述了使用人多能干细胞(hpsc)研究功能性神经调节系统,以生成三维(3d)类组装体的新方法,所述类组装体含有中脑和皮质纹状体类组装体。我们生成了hips细胞衍生的人纹状体球状体(hstrs),其包括功能性gaba能中型多棘神经元,这些神经元在培养3-4个月后会形成树突棘。我们还生成了中脑球状体。本项工作涉及鉴定体外生成这些结构所需的小分子和生长因子的新组合。hstrs与人皮质球状体(hcs)(其包括投射至纹状体的锥体谷氨酸能神经元)组装,可在类组装体中形成单向皮质纹状体投射,并实现独特的功能特征。此外,该制品可与中脑球状体进一步组装,以构建三部分组成的类组装体,其中可测试谷氨酸能和多巴胺能调节。结合病毒追踪(包括g缺失狂犬病病毒)、光遗传学与实时钙成像,我们提供了人皮质纹状体回路功能性体外模型形成的证据,该模型可用作疾病建模以及疗法(包括基因疗法和小分子药物)测试平台。
[0129]
示例1
[0130]
方法
[0131]
生成人纹状体球状体(hstrs)。在essential 8培养基(thermo fisher scientific,a1517001)中,于玻连蛋白包被培养板(5μg ml-1
,thermo fisher scientific,a14700)上培养人诱导性多能干(hips)细胞。每4天用ultrapure
tm 0.5mm edta(ph 8.0)(thermo fisher scientific,15575)对细胞进行一次传代。为了生成3d神经球状体,在37℃下将hips细胞与(innovative cell technologies,at104)一同孵育7分钟,并解离成单细胞。任选地,在球状体形成前1天,可使hips细胞暴露于essential8培养基内的1%二甲基亚砜(dmso)(sigma-aldrich,472301)中。为了获得大小均匀的球状体,使用了含有300个微孔的aggrewell-800(stemcell technologies,34815)。在补充有rock抑制剂y27632(10μm,selleckchem,s1049)的essential 8培养基中,向每个aggrewell-800孔中加
入约3x106个单细胞,以100g的离心力离心3分钟以捕获微孔中的细胞,并置于37℃和5%co2条件下孵育。24小时后,通过用p1000移液管吸头的切端上下移取孔中的培养基,并将其转移至补充有两种smad通路抑制剂——多索吗啡(2.5μm,sigma-aldrich,p5499)和sb-431542(10μm,r&d systems,1614)的essential 6培养基(thermo fisher scientific,a1516401)内的超低附着力塑料培养皿(corning,3262)中,从每个微孔中收集由约10,000个细胞组成的球状体。在前5天,每天更换essential 6培养基并补充多索吗啡和sb-431542。任选地,wnt通路抑制剂xav-939(2.5μm,tocris,3748)可与两种smad通路抑制剂一同添加。
[0132]
为了生成hstrs,在悬浮的第6天,将球状体转移至神经培养基中,该神经培养基含有neurobasal
tm-a培养基(thermo fisher scientific,10888022)、无维生素a的b-27
tm
补充剂(thermo fisher scientific,12587010)、glutamax
tm
补充剂(1:100,thermo fisher scientific,35050079)、青霉素-链霉素(1:100,thermo fisher scientific,15070063),且补充有wnt通路抑制剂iwp-2(2.5μm,selleckchem,s7085)和重组人/鼠/大鼠活化素a(50μg ml-1
,peprotech,120-14p)。在分化的第11天,除上述化合物外,还向球状体中补充泛类视黄醇x受体(rxr)激动剂sr11237(100nm,tocris,3411)。
[0133]
从第23天起,为了促进神经祖细胞向神经元的分化,向神经培养基中补充脑源性神经营养因子(bdnf;20ng ml-1
,peprotech,450-02)、nt3(20ng ml-1
,peprotech,450-03)、l-抗坏血酸2-磷酸三钠盐(aa;200nm,wako,323-44822)、n6、2'-o-二丁酰腺苷3',5'-环单磷酸钠盐(camp;100μm,millipore sigma,d0627)、顺式-4,7,10,13,16,19-二十二碳六烯酸(dha;millipore sigma,d2534)。从第43天起,除bdnf、nt3、aa、camp外,还向神经培养基中补充2.5μm dapt(stemcell technologies,72082)。从第47天起,每4天仅使用含有无维生素a的b-27
tm
补充剂(thermo fisher scientific,12587010)或b-27
tm plus补充剂(thermo fisher scientific,a3582801)的神经培养基进行一次培养基更换。
[0134]
实时qpcr。使用rneasy微型试剂盒(qiagen,74106)和dnase i(扩增级,thermo fisher scientific,18068-015)分离mrna,并使用适用于qrt-pcr的superscript
tm iii第一链合成supermix(thermo fisher scientific,11752250)通过逆转录制备模板cdna。使用sybr
tm green pcr master mix(thermo fisher scientific,4312704)在viia7实时pcr系统(thermo fisher scientific,4453545)上进行qpcr。
[0135]
低温保护和免疫荧光染色。在4℃下将hcs、hstrs和皮质-纹状体类组装体固定在4%多聚甲醛(pfa)/磷酸盐缓冲盐水(pbs)中过夜。然后,置于pbs中洗涤,并转移至30%蔗糖/pbs中放置2-3天,直到球状体/类组装体沉入溶液中。随后,置于最佳切割温度(oct)化合物(tissue-tek oct化合物4583,sakura finetek)和30%蔗糖/pbs(1:1)中冲洗并包埋。对于免疫荧光染色,使用leica cryostat(leica,cm1850)切割18μm厚的切片。用pbs洗涤冷冻切片,以去除切片上多余的oct,并在室温下置于10%正常驴血清(nds,abcam,ab7475)、0.3%triton x-100(millipore sigma,t9284-100ml)、1%bsa稀释于pbs而形成的溶液中封闭1小时。然后,在4℃下将切片与一抗稀释于pbs(含有2%nds、0.1%triton x-100)而形成的溶液一同孵育过夜。pbs用于洗涤一抗,冷冻切片与二抗溶于pbs(含有2%nds、0.1%triton x-100)而形成的溶液一同孵育1小时。在37℃下,将玻璃盖玻片上的解离培养物置于4%pfa/4%蔗糖溶于pbs而形成的溶液中固定20分钟,然后用pbs冲洗两次,持续5分钟。
在室温下,将盖玻片置于10%正常驴血清(nds,abcam,ab7475)、0.3%triton x-100(millipore sigma,t9284-100ml)、1%bsa稀释于pbs而形成的溶液中封闭1小时,然后置于4℃下与一抗稀释于pbs(含有2%nds、0.1%triton x-100)而形成的溶液一同孵育过夜。pbs用于洗涤一抗,冷冻切片与二抗溶于pbs(含有2%nds、0.1%triton x-100)而形成的溶液一同孵育。
[0136]
使用以下一抗进行染色:抗ctip2(大鼠,abcam,ab18465)、抗darpp32(兔,cell signaling technology,2306s)、抗darpp32(兔,abcam,ab40801)、抗gad67(小鼠,millipore sigma,mab5406)、抗neun(小鼠,abcam,ab104224)、抗gfp(鸡,genetex,gtx13970)、抗mcherry(兔,genetex,gtx128508)、抗map2(豚鼠,synaptic systems,188 004)、抗gfap(兔,dako,z0334)、抗satb2(小鼠,abcam,ab51502)。使用稀释度为1:1,000的alexa fluor染料(life technologies),并用hoechst 33258(life technologies,h3549)观察细胞核。使用aquamount(polysciences,18606)将冷冻切片安装在载玻片上进行显微镜检查,并在leica tcssp8共聚焦显微镜上成像。在斐济(nih)处理图像。
[0137]
单细胞rna-seq文库制备和数据分析。为了获得单细胞悬液,使用木瓜蛋白酶(worthington biochemical,ls003119)解离hstrs或hmbs。将hstrs或hmbs采集至1.5ml含有木瓜蛋白酶溶液的eppendorf管中,在37℃培养箱中培养15分钟,每5分钟轻轻震摇一次。在神经基础培养基中,用10%fbs进行木瓜蛋白酶灭活,并用移液管吸头轻轻捣碎hstrs,然后以1,000个细胞/μl的浓度使其悬浮于0.04%bsa/pbs(millipore-sigma,b6917-25mg)中。总共装载了10,000个细胞,并根据制造商的说明,用chromium
tm
单细胞3'文库与凝胶微珠试剂盒v3(10x genomics,pn-1000154,pn-1000075)生成cdna文库。每个文库都使用illumina novaseq s4 2x150bp进行测序,映射至人类基因组(hg38)。通过cellranger软件(10x genomics)的计数功能进行质量控制、ensemble基因的umi计数和k均值聚类。使用r包seurat(版本3.1.4)进行了进一步的下游分析。使用voxhunt将hstrs gaba能神经元聚类数据与显微解剖的人脑组织的brainspan转录组学数据进行比较。
[0138]
病毒标记和活细胞成像。如前所述(birey等人,2017),在稍作改动的情况下用病毒感染3d神经球状体。简而言之,将hcs或hstrs转移至含有200μl携带病毒的培养基的1.5ml eppendorf管中,并在37℃、5%co2的条件下孵育过夜。第二天,将800μl新鲜培养基加入试管中并孵育过夜。次日,将球状体转移至超低附着力培养板内的新鲜培养基中。对于活细胞成像,将标记的球状体或类组装体转移至150μl培养基内的corning
tm 96孔半面积高含量成像玻璃底微孔板(corning,4580)的孔中,并在用leica tcs sp8成像之前置于环境控制室中孵育15-30分钟。本研究中使用的病毒如下:aav-mdlx-gfp-fishell-1(addgene,#83900)、aav-ple94(gpr88)-icre(pems1995,addgene,#49125)、aav-dj-ef1a-dio-gcamp6(斯坦福大学神经科学基因载体和病毒核心机构,gvvc-aav-91)、aav-dj-hsyn::eyfp(斯坦福大学神经科学基因载体和病毒核心机构,gvvc-aav-16)、aav-dj-hsyn::mcherry(斯坦福大学神经科学基因载体和病毒核心机构,gvvc-aav-17)、狂犬病-dg-cre-egfp(索尔克研究所病毒载体核心机构)、aav-dj-ef1a-cvs-g-wpre-pghpa(addgene,#67528)、aav-dj-ef1-dio-mcherry(斯坦福大学神经科学基因载体和病毒核心机构,gvvc-aav-14)、aav1-hsyn::chrimsonr-tdt(addgene,#59171-aav1)、aav9-rth::cre(addgene,#107788-aav9)和aav-dj-ef1a-dio-eyfp(斯坦福大学神经科学基因载体和病毒核心机构,gvvc-aav-13)。若干
aav在斯坦福大学医学院神经科学基因载体和病毒核心机构中生成,或购自addgene。狂犬病-dg-病毒购自索尔克研究所病毒载体核心机构。
[0139]
生成皮质-纹状体类组装体。为了生成皮质-纹状体(hcs-hstrs)类组装体,分别生成hcs和hstrs,然后通过将其彼此紧靠放置在培养箱内1.5ml微量离心管中3天进行组装。在第2天,小心更换培养基。在第3天,使用切割的p1000移液器吸头将类组装体置于上述神经培养基内的6孔或60mm超低附着力培养板中。此后,每4天更换一次培养基。用前述方法(yoon等人,2019)在稍作改动的情况下生成hcs。在得到hcs和hstrs的第60-80天(d)进行组装。
[0140]
完整的皮质-纹状体类组装体中的投射成像。使用带有电动载物台的leica tcs sp8共聚焦显微镜,在环境控制条件下,在完整的皮质-纹状体类组装体中对hcs衍生的aav-dj-hsyn1::eyfp
细胞投射至hstrs的情况进行成像。将类组装体转移至150μl培养基内的corning
tm 96孔半面积高含量成像玻璃底微孔板(corning,4580)的孔中,并置于环境控制室中孵育15-30分钟。使用0-500μm深度的10x物镜拍摄图像。
[0141]
带有δg狂犬病病毒的皮质-纹状体类组装体的神经逆行示踪。对于带有δg-狂犬病病毒的皮质-纹状体类组装体的神经逆行示踪实验,用aav-dj-ef1-dio-mcherry标记hcs,用δg-rabies-egfp-cre和aav-dj-ef1a-cvs-g-wpre-pghpa标记hstrs。病毒感染后,组装hcs和hstrs,并置于培养物中28天,每4天更换一次培养基。28天后,类组装体用4%pfa/pbs固定20分钟,并进行免疫染色处理。
[0142]
类组装体的光遗传学刺激和gcamp6成像。使用10x物镜和leica tcs sp8共聚焦显微镜在环境控制条件下对完整的类组装体进行成像。在14.7帧/秒的帧速率下,刺激实验由以下各项组成:刺激前采集的500帧、在625nm led刺激下采集的1帧以及刺激后采集的1,000帧。对于光遗传学刺激,使用针对hcs的光纤耦合led(直径400μm,13.2mw,thorlabs)传送625nm led光脉冲。脉冲由与leica tcs sp8耦合的cyclops led驱动器生成。
[0143]
全细胞记录。将球状体或类组装体切片包埋入4%琼脂糖中,并转移至含有126mm nacl、2.5mm kcl、1.25mm nahpo4、1mm mgso4、2mm cacl2、26mm nahco3和10mm d-( )-葡萄糖的人工脑脊液(acsf)中。在室温下使用leica vt1200振动切片机在200μm处切割切片,并在室温下置于acsf中。在slicescope直立显微镜(scientifica)下对hstrs切片进行全细胞膜片钳记录。用acsf(用95%o2和5%co2鼓泡)灌注切片,并在室温下记录细胞。hsyn1::eyfp标记的神经元用装有内部溶液的硼硅酸盐玻璃移液管修补,该内部溶液含有127mm葡萄糖酸钾、8mm nacl、4mmmgatp、0.3mm na2gtp、10mm hepes、0.6mm egta ph 7.2(用koh(290mosm)调节)。使用multiclamp 700b放大器(molecular devices)和digidata 1550b数字转换器(molecular devices)采集数据,在2khz下低通滤波并在20khz下数字化,使用pclamp软件(10.6版,molecular devices)进行分析。使用jpcalc计算液接电位,并使用估计值——15mm液接电位校正记录。对于f-i曲线,在
–
60mv下对细胞进行电流钳位,电流步长(持续时间为1秒)以10pa的增量给出。
[0144]
生成人中脑球状体(hmbs)和中脑-纹状体类组装体(hmbs-hstrs)。为了生成hmbs,在悬浮的第3天,向球状体中补充100ng/ml fgf8(peprotech,100-25-100μg)和1μm sag(millipore sigma,566660-1mg)以及两种smad通路抑制剂。在前5天,每天更换essential 6培养基并补充多索吗啡和sb-431542。在悬浮的第6天,将球状体转移至神经培养基中,该
神经培养基含有neurobasal
tm-a培养基(thermo fisher scientific,10888022)、无维生素a的b-27
tm
补充剂(thermo fisher scientific,12587010)、glutamax
tm
补充剂(1:100,thermo fisher scientific,35050079)、青霉素-链霉素(1:100,thermo fisher scientific,15070063),且补充有100ng/ml fgf8(第7-21天)、1μm sag(第7-21天)、100nm ldn(第7-16天,selleckchem,s7507)和3μm chir(第8-23天)。从第23天起,为了促进神经祖细胞向神经元的分化,向神经培养基中补充脑源性神经营养因子(bdnf;20ng ml-1
,peprotech,450-02)、nt3(20ng ml-1
,peprotech,450-03)、l-抗坏血酸2-磷酸三钠盐(aa;200nm,wako,323-44822)、n6、2'-o-二丁酰腺苷3',5'-环单磷酸钠盐(camp;100μm,millipore sigma,d0627)、顺式-4,7,10,13,16,19-二十二碳六烯酸(dha;millipore sigma,d2534)。从第43天起,除bdnf、nt3、aa、camp外,还向神经培养基中补充2.5μm dapt(stemcell technologies,72082)。从第47天起,每4天仅使用含有无维生素a的b-27
tm
补充剂(thermo fisher scientific,12587010)或b-27
tm plus补充剂(thermo fisher scientific,a3582801)的神经培养基进行一次培养基更换。为了生成中脑-纹状体(hmbs-hstrs)类组装体,分别生成hmbs和hstrs,然后通过将其彼此紧靠放置在培养箱内1.5ml微量离心管中3天进行组装。在第2天,小心更换培养基。在第3天,使用切割的p1000移液器吸头将类组装体置于上述神经培养基内的24孔或60mm超低附着力培养板中。在得到hmbs和hstrs的第50-62天进行组装,并在第61天和第118天使用leica tcs sp8共聚焦显微镜在环境控制条件下对其进行成像。
[0145]
示例2
[0146]
生成功能性人纹状体球状体(hstrs)
[0147]
为了生成类似于腹侧前脑外侧神经节隆起(lge)的hstrs(最终得到纹状体),我们将hips细胞酶解成单细胞悬液,并使用微孔使其聚集成球状体(图1a)。从微孔中取出球状体后,我们用双重smad抑制剂(多索吗啡和sb-431542)处理球状体,持续处理6天,然后用iwp-2(第7-23天)、活化素a(第7-23天)和类视黄醇x受体激动剂sr11237(第12-23天)处理。在第23天,这种模式化因子的新组合生成了球状体,该球状体具有高水平的前脑标志物foxg1和lge标志物gsx2、meis2和ctip2,但下丘脑标志基因rax和脊髓标志基因hoxb4的水平不高(图1b)。在第80天,hstrs表明存在darpp32
/gad67
、darpp32
/ctip2
和darpp32
/neun
细胞,这些细胞指示中型多棘神经元(图1c、d、e)。为了全面表征hstrs中的纹状体谱系细胞,我们通过酶解从第80-83天的hstrs中解离出单细胞,并使用10x genomics chromium系统进行单细胞rna测序。我们对源自hstrs的约25,772个细胞进行了测序,并使用统一流形逼近和投影(umap)对所有细胞进行聚类,结果揭示了不同的gaba能神经元、神经祖细胞、星形胶质细胞、少突胶质细胞和谷氨酸能神经元群体(图1f)。此外,我们将hstrs映射到brainspan人转录组数据集上,发现与pcw 20-25下的样本相比,hstrs中的gaba能神经元聚类显示出与纹状体的最高比例相关(图1g)。在hstrs中,我们检测了前脑(foxg1)和lge(dlx1、dlx2、dlx5、dlx6、gsx2、ascl1、foxp1和foxp2)中富集的基因的强表达,但未检测内侧神经节隆起(nkx2-1)或大脑皮质(emx1)中的基因的表达(图1g)。我们进一步观察到mdlx::egfp
细胞,这些细胞在65天时在体外解离的2d培养物中形成树突棘样结构(图1h),以及在得到hstrs的第120天时在3d培养物中形成树突棘样结构(图1i、j、k)。为了进一步了解hstrs神经元是否展示纹状体中型多棘神经元的电生理学特征,我们分析了hstrs神经元
的固有膜特性。我们发现在第110-120天,70%的hstrs细胞(17个细胞中有12个)展示内向整流(图1m、n)。在分化的后期(第160-170天),我们发现,15%的hstrs神经元(13个细胞中有2个)显示缓慢斜坡去极化(第一尖峰延迟)(图1o)和静息膜电位超极化(
–
78.2
±
2.3mv;图1p)。
[0148]
示例3
[0149]
生成皮质-纹状体类组装体(hcs-hstrs)
[0150]
为了开发用于在发育中的人脑中形成皮质-纹状体回路的模型(图2a、b),已单独分化的hcs和hstrs在锥形管内彼此相邻放置。3天后,球状体成功实现组装(图2c)并开始形成皮质-纹状体投射(图2d)。投射为单向投射,其中hcs中的神经元投射至hstrs,但反之则不然(图2d、e)。为了进一步表征hcs投射至hstrs的情况,我们使用病毒逆行示踪(图2f)。我们用携带cre-egfp的δg-狂犬病病毒和携带狂犬病糖蛋白(g)的aav分别感染hstrs,并在双侧翼orf(dio-mcherry)下用编码mcherry的aav感染hcs(图2f)。病毒感染后,组装hcs和hstrs,并在融合后28天时检查gfp和mcherry的表达。我们发现,在体内从大脑皮质投射至纹状体的ctip2
和satb2
神经元是皮质-纹状体类组装体中从hcs投射至hstrs的主要细胞群体(图2h、i)。为了测试皮质-纹状体类组装体的功能,我们将光遗传学和神经元中ca
2
活性的实时成像相结合。在组装之前,hsyn1::chrimsonr(激发神经元以响应于红移光)在hcs中表达,并在纹状体微型启动子基因gpr88(aav-ple94::icre)下改进了cre(icre),而用于使纹状体中gaba能神经元的ca
2
活性可视化的dio-gcamp6通过aav在hstrs中表达;随后,组装这些球状体(图2j)。通过625nm光激发表达chrimsonr的hcs神经元能够激发hstrs神经元中的ca
2
活性(图2k、l、m、n)。为了进一步了解hcs和hstrs的组装是否影响hstrs中神经元的电生理学特性,我们在切片的皮质-纹状体类组装体中进行了全细胞膜片钳记录(图2o)。我们发现,与相同体外阶段hstrs中的神经元相比,在hcs-hstrs的hstrs侧,hsyn1::eyfp标记的神经元的固有兴奋性增加(图2p、q、r)。这些结果证明了功能性神经回路的形成以及皮质-纹状体类组装体的成熟。
[0151]
示例4
[0152]
生成人中脑球状体(hmbs)和中脑-纹状体类组装体(hmbs-hstrs)
[0153]
从中脑到纹状体的多巴胺能输入在纹状体的发育和成熟中起着至关重要的作用(kozorovitskiy等人,2015)。此外,纹状体对中脑的gaba能调节是基底神经节直接通路的重要组成部分。为了进一步模拟此复杂回路,我们利用ips细胞衍生出hmbs,并与hstrs组装在一起(图3a、b)。培养第23天的hmbs展示出低水平的前脑标志物foxg1和高水平的底板中脑多巴胺能神经元标志物foxa2,但下丘脑标志基因rax和脊髓标志基因hoxb4的水平不高(图3c)。为了全面表征hmbs中的纹状体谱系细胞,我们从第92天的hmbs中解离出单细胞,并使用10x genomics chromium系统进行单细胞rna测序。我们对约2,720个细胞进行了测序。使用umap对所有细胞进行聚类,结果揭示了不同的中脑多巴胺能神经元、底板、神经祖细胞、谷氨酸能神经元和gaba能神经元群体(图3d、e)。为了生成中脑-纹状体类组装体,用syn1::eyfp标记的hmbs和用syn1::mcherry标记的hstrs在锥形管内彼此相邻放置。3天后,组装这些球状体(图3f)。此外,组装用aav-rth::cre和aav-dio-eyfp共感染的hmbs与hstrs,并开始形成从hmbs中的多巴胺能神经元至hstrs的投射(图3g)。该制品现可与hcs结合使用,以同时研究传送至纹状体的谷氨酸能和多巴胺能输入(其应用广泛)。
[0154]
这是首个通过体外组装利用人多能干细胞生成的3d人皮质-纹状体和纹状体-中脑回路模型。许多应用均可使用该系统,包括开发晚期疾病模型(亨廷顿病、帕金森病、费伦-麦克德米德和其他形式的asd等)、开发轴突退化模型、筛选小分子以挽救疾病特异性表型、测试基因治疗应用。
[0155]
参考文献
[0156]
shepherd,gordon m.g.“皮质纹状体连接及其在疾病中所起的作用.”自然综述:神经科学14,第4期(2013):278
–
91.https://doi.org/10.1038/nrn3469.
[0157]
sergiu p.“三维人脑培养物的兴起.”nature publishinggroup553,第7689期(2018):437
–
45.https://doi.org/10.1038/nature25032.
[0158]
birey,fikri,jimena andersen,christopher d.makinson,saiful islam,wu wei,nina huber,h.christina fan等人.“功能性整合的人前脑球状体的组装.”自然545,第7652期(2017):54
–
59.https://doi.org/10.1038/nature22330.
[0159]
yager lm,garcia af,wunsch am,ferguson sm.“纹状体的详细信息:在药物成瘾中所起的作用.”神经科学.2015.https://doi.org/10.1016/j.neuroscience.2015.06.033
[0160]
yoon,se-jin,lubayna s elahi,anca mrebecca m marton,aaron gordon,omer revah,yuki miura等人.“人皮质类器官生成的可靠性.”自然:方法,2018.https://doi.org/10.1038/s41592-018-0255-0.
[0161]
kozorovitskiy,yevgenia,rui peixoto,wengang wang,arpiar saunders和bernardo l sabatini.“纹状体发育中对兴奋性突触发生的神经调节.”elife 4(2015):1
–
18.https://doi.org/10.7554/elife.10111.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。