1.本发明涉及根据预定的核苷酸序列合成多核苷酸分子的新方法。本发明还涉及合成后组装合成多核苷酸的方法,以及用于执行合成和/或组装方法的系统和试剂盒。
背景技术:
2.存在用于合成和组装多核苷酸分子,特别是dna的两种主要方法。
3.亚磷酰胺化学是通过逐步过程将化学活化的t、c、a或g的单体组装成长度为大约100/150个碱基的寡核苷酸的合成方法。化学反应步骤是高度敏感的,并且条件在完全无水(完全不存在水)、水性氧化和酸性条件之间交替(roy和caruthers,molecules,2013,18,14268-14284)。如果来自先前反应步骤的试剂尚未完全除去,则这将对未来的合成步骤产生不利影响。因此,这个合成方法限于产生长度约为100个核苷酸的多核苷酸。
4.聚合酶合成方法使用聚合酶使用t、c、a和g三磷酸合成dna模板的互补链。反应条件是水性的和温和的,并且此方法可以用于合成长度为数千个碱基的dna多核苷酸。此方法的主要缺点是单链和双链dna不能通过此方法从头合成,其需要从中制备拷贝的dna模板。(kosuri和church,nature methods,2014,11,499-507)。
5.因此,先前的方法不能用于在没有拷贝的预先存在的模板分子的帮助下从头合成双链dna。
6.本发明人开发了新的方法,通过所述方法可以以逐步的方式从头合成单链和双链多核苷酸分子,而无需拷贝预先存在的模板分子。此类方法还避免了与亚磷酰胺化学技术相关的极端条件,相反,在中性ph附近的温和水性条件下进行。这样的方法也能使单链或双链多核苷酸分子的从头合成与当前合成方法具有》100聚体的核苷酸长度至完整基因组相比具有潜在的108改进,提供了广泛的在合成生物学可能的应用。
技术实现要素:
7.本发明提供了一种合成双链多核苷酸的体外方法,其中至少一条链具有预定序列,所述方法包括执行合成循环,其中在每个循环中,双链多核苷酸的一条链通过在第一连接反应中在具有连接酶活性的酶的作用下掺入一个或多个核苷酸而延伸,并且双链多核苷酸的相反链通过在第二连接反应中在具有连接酶活性的酶的作用下掺入一个或多个核苷酸而延伸,其中两条链在双链多核苷酸的同一末端延伸。
8.在本文所述的本发明的任何方法中,所述方法提供双链或单链寡核苷酸的合成。因此,本文中提及使用本发明任何方法合成双链或单链多核苷酸的所有参考经必要修改后适用于双链或单链寡核苷酸的合成。
9.在本发明的方法中:(i)至少一条链可具有预定序列,并且其中掺入所述链中的核苷酸是预定序列的核苷酸;或(ii)两条链均可具有预定序列,并且其中掺入一条链中的核苷酸是所述链的预定序列的核苷酸,并且其中掺入相反链中的核苷酸是所述相反链的预定序列的核苷酸。
10.在这样的方法中,在合成循环中:
11.a)可通过掺入一个或多个核苷酸来延伸一条链的3’末端,并且接着
12.b)可通过掺入一个或多个核苷酸来延伸相反链的5’末端。这些方法可根据如本文所述的本发明的示例性合成方法版本1、2、3和4执行。
13.可替代地,在这样的方法中,在合成循环中:
14.a)可通过掺入一个或多个核苷酸来延伸一条链的5’末端,并且接着
15.b)可通过掺入一个或多个核苷酸来延伸相反链的3’末端。这些方法可根据如本文所述的本发明的示例性合成方法版本5和6执行。
16.在任何这样的方法中,在合成循环中,可通过掺入第一核苷酸来延伸一条链,并且可通过掺入与第一核苷酸配对的第二核苷酸来延伸相反链。这些方法可根据如本文所述的本发明的示例性合成方法版本3、4、5和6执行。
17.可替代地,在任何这样的方法中,在合成循环中,可通过掺入两个核苷酸来延伸一条链,并且可通过掺入两个核苷酸来延伸相反链,从而形成两个核苷酸对。这些方法可根据如本文所述的本发明的示例性合成方法版本1和2执行。
18.在任何上述方法中,每个合成循环可包括包含以下的步骤:
19.(1)提供双链支架多核苷酸;
20.(2)通过将一个或多个核苷酸掺入第一链来延伸所述支架多核苷酸的所述第一链;
21.(3)对所述第一链进行裂解步骤,其中所述一个或多个核苷酸在裂解后保留在所述支架多核苷酸的所述第一链中;
22.(4)通过将一个或多个核苷酸掺入第二链来延伸所述支架多核苷酸的所述第二链;以及
23.(5)对所述第二链进行裂解步骤,其中所述一个或多个核苷酸在裂解后保留在所述支架多核苷酸的所述第二链中。步骤(3)和(5)中的裂解位点可由裂解链中包含通用核苷酸的多核苷酸序列限定。在这样的方法中,双链支架多核苷酸具有连接末端和相对末端;并且其中在步骤(2)和(4)中,预定序列的一个或多个核苷酸由通过酶的作用连接至支架多核苷酸的连接末端的第一和第二多核苷酸连接分子提供,并且其中多核苷酸连接分子包含通用核苷酸,其中在多核苷酸连接分子连接至支架多核苷酸时,支架多核苷酸的链被延伸并且产生由通用核苷酸限定的裂解位点。
24.在上述方法中,多核苷酸连接分子可以是双链多核苷酸分子,其包含合成链和与其杂交的辅助链,并且还包含互补连接末端,连接末端包含:
25.(i)在合成链中:(a)位于所述合成链的末端用于延伸所述支架多核苷酸的所述一个或多个核苷酸,和(b)所述通用核苷酸;以及
26.(ii)在辅助链中,不可连接的末端核苷酸。
27.涉及多核苷酸连接分子的方法可如下执行:
28.(a)在步骤(1)中,所述双链支架多核苷酸具有单碱基突出端,其中所述第二链的末端核苷酸突出于所述第一链的末端核苷酸;
29.(b)在步骤(2)中,在所述第一多核苷酸连接分子中,所述合成链的末端核苷酸占据位置n,其中位置n是将在步骤(2)中添加到所述支架多核苷酸的所述第一链的末端的第
一核苷酸所占据的核苷酸位置;所述合成链的次末端核苷酸占据位置n 1,其中位置n 1是将在步骤(2)中添加到所述支架多核苷酸的所述第一链的末端的第二核苷酸所占据的核苷酸位置;所述通用核苷酸占据所述合成链中的位置n 2并与所述辅助链的次末端核苷酸配对;所述辅助链的末端核苷酸是不可连接的核苷酸;并且所述互补连接末端具有单碱基突出端,其中所述合成链的末端核苷酸突出于所述辅助链的末端核苷酸;
30.(c)在步骤(3)中,所述连接的支架多核苷酸的所述第一链在位置n 1与n 2之间被裂解,由此将所述通用核苷酸从所述支架多核苷酸中去除,并且所述第一多核苷酸连接分子的第一和第二核苷酸保留在所述支架多核苷酸中,并且由此在所述支架多核苷酸中产生单碱基突出端,其中所述第一链的末端核苷酸突出于所述第二链的末端核苷酸;
31.(d)在步骤(4)中,在所述第二多核苷酸连接分子中,所述合成链的末端核苷酸占据位置n 1,其中位置n 1是将在步骤(4)中添加到所述支架多核苷酸的所述第二链的末端并且将与将在步骤(2)中添加到所述第一链的末端的第二核苷酸配对的第一核苷酸所占据的核苷酸位置;所述合成链的次末端核苷酸占据位置n 2,其中位置n 2是将在步骤(4)中添加到所述支架多核苷酸的所述第二链的末端的第二核苷酸所占据的核苷酸位置;所述通用核苷酸占据所述合成链中的位置n 3并与所述辅助链的次末端核苷酸配对;所述辅助链的末端核苷酸是不可连接的核苷酸;并且所述互补连接末端具有单碱基突出端,其中所述合成链的末端核苷酸突出于所述辅助链的末端核苷酸;并且
32.(e)在步骤(5)中,所述连接的支架多核苷酸的所述第二链在位置n 2与n 3之间被裂解,由此将所述通用核苷酸从所述支架多核苷酸中去除,并且所述第二多核苷酸连接分子的第一和第二核苷酸保留在所述支架多核苷酸中,并且由此在所述支架多核苷酸中产生单碱基突出端,其中所述第二链的末端核苷酸突出于所述第一链的末端核苷酸。这样的方法可根据如本文所述的本发明的示例性合成方法版本1执行。
33.涉及多核苷酸连接分子的方法可替代性地如下执行:
34.(a)在步骤(1)中,所述双链支架多核苷酸具有单碱基突出端,其中所述第二链的末端核苷酸突出于所述第一链的末端核苷酸;
35.(b)在步骤(2)中,在所述第一多核苷酸连接分子中,所述合成链的末端核苷酸占据位置n,其中位置n是将在步骤(2)中添加到所述支架多核苷酸的所述第一链的末端的第一核苷酸所占据的核苷酸位置;所述合成链的次末端核苷酸占据位置n 1,其中位置n 1是将在步骤(2)中添加到所述支架多核苷酸的所述第一链的末端的第二核苷酸所占据的核苷酸位置;所述通用核苷酸占据所述合成链中的位置n 2并与所述辅助链的次末端核苷酸配对;所述辅助链的末端核苷酸是不可连接的核苷酸;并且所述互补连接末端具有单碱基突出端,其中所述合成链的末端核苷酸突出于所述辅助链的末端核苷酸;
36.(c)在步骤(3)中,所述连接的支架多核苷酸的所述第一链在位置n 1与n 2之间被裂解,由此将所述通用核苷酸从所述支架多核苷酸中去除,并且所述第一多核苷酸连接分子的第一和第二核苷酸保留在所述支架多核苷酸中,并且由此在所述支架多核苷酸中产生单碱基突出端,其中所述第一链的末端核苷酸突出于所述第二链的末端核苷酸;
37.(d)在步骤(4)中,在所述第二多核苷酸连接分子中,所述合成链的末端核苷酸占据位置n 1,其中位置n 1是将在步骤(4)中添加到所述支架多核苷酸的所述第二链的末端并且将与将在步骤(2)中添加到所述第一链的末端的第二核苷酸配对的第一核苷酸所占据
的核苷酸位置;所述合成链的次末端核苷酸占据位置n 2,其中位置n 2是将在步骤(4)中添加到所述支架多核苷酸的所述第二链的末端的第二核苷酸所占据的核苷酸位置;所述通用核苷酸占据所述合成链中的位置n 4并与所述辅助链中在远离所述互补连接末端的方向上紧邻所述辅助链的次末端核苷酸的核苷酸配对;所述辅助链的末端核苷酸是不可连接的核苷酸;并且所述互补连接末端具有单碱基突出端,其中所述合成链的末端核苷酸突出于所述辅助链的末端核苷酸;并且
38.(e)在步骤(5)中,所述连接的支架多核苷酸的所述第二链在位置n 2与n 3之间被裂解,由此将所述通用核苷酸从所述支架多核苷酸中去除,并且所述第二多核苷酸连接分子的第一和第二核苷酸保留在所述支架多核苷酸中,并且由此在所述支架多核苷酸中产生单碱基突出端,其中所述第二链的末端核苷酸突出于所述第一链的末端核苷酸。这样的方法可根据如本文所述的本发明的示例性合成方法版本2执行。
39.在可根据如本文所述的本发明的示例性合成方法版本2执行的任何上文所述的方法中,所述方法可包括变体方法,其中:
40.(i)在步骤(4)中,在所述第二多核苷酸连接分子中,所述合成链的末端核苷酸占据位置n 1,其中位置n 1是将在步骤(4)中添加到所述支架多核苷酸的所述第二链的末端并且将与将在步骤(2)中添加到所述第一链的末端的第二核苷酸配对的第一核苷酸所占据的核苷酸位置;所述合成链的次末端核苷酸占据位置n 2,其中位置n 2是将在步骤(4)中添加到所述支架多核苷酸的所述第二链的末端的第二核苷酸所占据的核苷酸位置;所述通用核苷酸占据所述合成链中的位置n 4 x并与所述辅助链中的配偶体核苷酸配对;所述辅助链的末端核苷酸是不可连接的核苷酸;并且所述互补连接末端具有单碱基突出端,其中所述合成链的末端核苷酸突出于所述辅助链的末端核苷酸;并且其中x是在远离所述互补连接末端的方向上相对于位置n 4的核苷酸位置的数目并且其中所述数目是从1到10或更大的整数;并且
41.(ii)在步骤(5)中,所述连接的支架多核苷酸的所述第二链在位置n 2与n 3之间被裂解。
42.涉及多核苷酸连接分子的方法可替代性地如下执行:
43.(a)在步骤(1)中,所述双链支架多核苷酸具有平末端,其中所述第二链的末端核苷酸与所述第一链的末端核苷酸配对;
44.(b)在步骤(2)中,在所述第一多核苷酸连接分子中,所述合成链的末端核苷酸占据位置n并与所述辅助链的末端核苷酸配对,其中位置n是将在步骤(2)中添加到所述支架多核苷酸的所述第一链的末端的第一核苷酸所占据的核苷酸位置;所述通用核苷酸是所述合成链的次末端核苷酸,占据位置n 1并与所述辅助链的次末端核苷酸配对;所述辅助链的末端核苷酸是不可连接的核苷酸;并且所述互补连接末端具有平末端;
45.(c)在步骤(3)中,所述连接的支架多核苷酸的所述第一链在位置n与n 1之间被裂解,由此将所述通用核苷酸从所述支架多核苷酸中去除,并且所述第一多核苷酸连接分子的所述第一核苷酸保留在所述支架多核苷酸中,并且由此在所述支架多核苷酸中产生单碱基突出端,其中所述第一链的末端核苷酸突出于所述第二链的末端核苷酸;
46.(d)在步骤(4)中,在所述第二多核苷酸连接分子中,所述合成链的末端核苷酸占据位置n,其中位置n是将在步骤(4)中添加到所述支架多核苷酸的所述第二链的末端并将
与将在步骤(2)中添加到所述第一链的末端的第一核苷酸配对的第一核苷酸所占据的核苷酸位置;所述通用核苷酸是所述合成链的次末端核苷酸,占据位置n 1并与所述辅助链的末端核苷酸配对;所述辅助链的末端核苷酸是不可连接的核苷酸;并且所述互补连接末端具有单碱基突出端,其中所述合成链的末端核苷酸突出于所述辅助链的末端核苷酸;并且
47.(e)在步骤(5)中,所述连接的支架多核苷酸的所述第二链在位置n与n 1之间被裂解,由此将所述通用核苷酸从所述支架多核苷酸中去除,并且所述第二多核苷酸连接分子的第一和第二核苷酸保留在所述支架多核苷酸中,并且由此在所述支架多核苷酸中产生平末端,其中所述第二链的末端核苷酸与所述第一链的末端核苷酸配对。这样的方法可根据如本文所述的本发明的示例性合成方法版本2和5执行。
48.涉及多核苷酸连接分子的方法可替代性地如下执行:
49.(a)在步骤(1)中,所述双链支架多核苷酸具有平末端,其中所述第二链的末端核苷酸与所述第一链的末端核苷酸配对;
50.(b)在步骤(2)中,在所述第一多核苷酸连接分子中,所述合成链的末端核苷酸占据位置n并与所述辅助链的末端核苷酸配对,其中位置n是将在步骤(2)中添加到所述支架多核苷酸的所述第一链的末端的第一核苷酸所占据的核苷酸位置;所述通用核苷酸是所述合成链的次末端核苷酸,占据位置n 1并与所述辅助链的次末端核苷酸配对;所述辅助链的末端核苷酸是不可连接的核苷酸;并且所述互补连接末端具有平末端;
51.(c)在步骤(3)中,所述连接的支架多核苷酸的所述第一链在位置n与n 1之间被裂解,由此将所述通用核苷酸从所述支架多核苷酸中去除,并且所述第一多核苷酸连接分子的所述第一核苷酸保留在所述支架多核苷酸中,并且由此在所述支架多核苷酸中产生单碱基突出端,其中所述第一链的末端核苷酸突出于所述第二链的末端核苷酸;
52.(d)在步骤(4)中,在第二多核苷酸连接分子中,所述合成链的末端核苷酸占据位置n,其中位置n是将在步骤(4)中添加到所述支架多核苷酸的所述第二链的末端并将与将在步骤(2)中添加到所述第一链的末端的第一核苷酸配对的第一核苷酸所占据的核苷酸位置;所述通用核苷酸占据所述合成链中的位置n 2并与所述辅助链的次末端核苷酸配对;所述辅助链的末端核苷酸是不可连接的核苷酸,占据位置n 1并与所述合成链的次末端核苷酸配对;并且所述互补连接末端具有单碱基突出端,其中所述合成链的末端核苷酸突出于所述辅助链的末端核苷酸;并且
53.(e)在步骤(5)中,所述连接的支架多核苷酸的所述第二链在位置n与n 1之间被裂解,由此将所述通用核苷酸从所述支架多核苷酸中去除,并且所述第二多核苷酸连接分子的第一和第二核苷酸保留在所述支架多核苷酸中,并且由此在所述支架多核苷酸中产生平末端,其中所述第二链的末端核苷酸与所述第一链的末端核苷酸配对。这样的方法可根据如本文所述的本发明的示例性合成方法版本4执行。
54.在可根据如本文所述的本发明的示例性合成方法版本4执行的任何上文所述的方法中,所述方法可包括变体方法,其中:
55.(i)在步骤(4)中,在所述第二多核苷酸连接分子中,所述合成链的末端核苷酸占据位置n,其中位置n是将在步骤(4)中添加到所述支架多核苷酸的所述第二链的末端并将与将在步骤(2)中添加到所述第一链的末端的第一核苷酸配对的第一核苷酸所占据的核苷酸位置;所述通用核苷酸占据所述合成链中的位置n 2 x并与所述辅助链中的配偶体核苷
酸配对;所述辅助链的末端核苷酸是不可连接的核苷酸,占据位置n 1并与所述合成链的次末端核苷酸配对;并且所述互补连接末端具有单碱基突出端,其中所述合成链的末端核苷酸突出于所述辅助链的末端核苷酸;并且其中x是在远离所述互补连接末端的方向上相对于位置n 2的核苷酸位置的数目并且其中所述数目是从1到10或更大的整数;并且
56.(ii)在步骤(5)中,所述连接的支架多核苷酸的所述第二链在位置n与n 1之间被裂解。
57.涉及多核苷酸连接分子的方法可替代性地如下执行:
58.(a)在步骤(1)中,所述双链支架多核苷酸具有平末端,其中所述第二链的末端核苷酸与所述第一链的末端核苷酸配对;
59.(b)在步骤(2)中,在所述第一多核苷酸连接分子中,所述合成链的末端核苷酸占据位置n并与所述辅助链的末端核苷酸配对,其中位置n是将在步骤(2)中添加到所述支架多核苷酸的所述第一链的末端的第一核苷酸所占据的核苷酸位置;所述通用核苷酸占据所述合成链中的位置n 2并与所述辅助链中在远离所述互补连接末端的方向上紧邻所述辅助链的次末端核苷酸的核苷酸配对;所述辅助链的末端核苷酸是不可连接的核苷酸;并且所述互补连接末端具有平末端;
60.(c)在步骤(3)中,所述连接的支架多核苷酸的所述第一链在位置n与n 1之间被裂解,由此将所述通用核苷酸从所述支架多核苷酸中去除,并且所述第一多核苷酸连接分子的所述第一核苷酸保留在所述支架多核苷酸中,并且由此在所述支架多核苷酸中产生单碱基突出端,其中所述第一链的末端核苷酸突出于所述第二链的末端核苷酸;
61.(d)在步骤(4)中,在所述第二多核苷酸连接分子中,所述合成链的末端核苷酸占据位置n,其中位置n是将在步骤(4)中添加到所述支架多核苷酸的所述第二链的末端并将与将在步骤(2)中添加到所述第一链的末端的第一核苷酸配对的第一核苷酸所占据的核苷酸位置;所述通用核苷酸是所述合成链的次末端核苷酸,占据位置n 1并与所述辅助链的末端核苷酸配对;所述辅助链的末端核苷酸是不可连接的核苷酸;并且所述互补连接末端具有单碱基突出端,其中所述合成链的末端核苷酸突出于所述辅助链的末端核苷酸;并且
62.(e)在步骤(5)中,所述连接的支架多核苷酸的所述第二链在位置n与n 1之间被裂解,由此将所述通用核苷酸从所述支架多核苷酸中去除,并且所述第二多核苷酸连接分子的第一和第二核苷酸保留在所述支架多核苷酸中,并且由此在所述支架多核苷酸中产生平末端,其中所述第二链的末端核苷酸与所述第一链的末端核苷酸配对。这样的方法可根据如本文所述的本发明的示例性合成方法版本6执行。
63.在可根据如本文所述的本发明的示例性合成方法版本6执行的任何上文所述的方法中,所述方法可包括变体方法,其中:
64.(i)在步骤(2)中,在所述第一多核苷酸连接分子中,所述合成链的末端核苷酸占据位置n并与所述辅助链的末端核苷酸配对,其中位置n是将在步骤(2)中添加到所述支架多核苷酸的所述第一链的末端的第一多核苷酸所占据的核苷酸位置;所述通用核苷酸占据所述合成链中的位置n 2 x并与所述辅助链中在远离所述互补连接末端的方向上紧邻所述辅助链的次末端核苷酸的核苷酸配对;所述辅助链的末端核苷酸是不可连接的核苷酸;并且所述互补连接末端具有平末端;并且其中x是在远离所述互补连接末端的方向上相对于位置n 2的核苷酸位置的数目并且其中所述数目是从1到10或更大的整数;并且
65.(ii)在步骤(3)中,所述连接的支架多核苷酸的所述第一链在位置n与n 1之间被裂解。
66.在可根据如本文所述的本发明示例性合成方法版本1执行的任何上述方法中,所述方法可包括变体方法,其中:在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中的位置n x处,并且其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n 2与n 1之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目,并且其中x是从2到10或更大的整数。
67.在可根据如本文所述的本发明示例性合成方法版本1执行的任何上述方法中,所述方法可包括变体方法,其中:在步骤(5)中,支架多核苷酸的连接的第二链在位置n 3与n 2之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目,并且其中x是从3到10或更大的整数。
68.在可根据如本文所述的本发明示例性合成方法版本1执行的任何上述方法中,所述方法可包括变体方法,其中:在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中的位置n x处,并且其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n 2与n 1之间被裂解,并且其中在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中的位置n x处,并且其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n 3与n 2之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目,并且其中在步骤(2)和(3)中,x是从2到10或更大的整数,并且在步骤(4)和(5)中,x是从3到10或更大的整数。
69.在可根据如本文所述的本发明示例性合成方法版本3和5执行的任何上述方法中,所述方法可包括变体方法,其中:在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n x限定的位置处,并且其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n 1与n之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目,并且其中x是从1到10或更大的整数。
70.在可根据如本文所述的本发明示例性合成方法版本3和5执行的任何上述方法中,所述方法可包括变体方法,其中:在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n x限定的位置处,并且其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n 1与n之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目,并且其中x是从1到10或更大的整数。
71.在可根据如本文所述的本发明示例性合成方法版本3和5执行的任何上述方法中,所述方法可包括变体方法,其中:在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n x限定的位置处,其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n 1与n之间被裂解,其中x是从1到10或更大的整数;并且其中在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n x限定的位置处,并且其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n 1与n之间被裂解,其中x是从1到10或更大的整数;并且其中在步骤(2)和(4)中,x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目。
72.在可根据如本文所述的本发明示例性合成方法版本3和5执行的任何上述方法中,所述方法可包括变体方法,其中:在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的
合成链中由式n 1 x限定的位置处,并且其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n 1 x与n x之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目,并且其中x是从1到10或更大的整数;
73.在可根据如本文所述的本发明示例性合成方法版本3和5执行的任何上述方法中,所述方法可包括变体方法,其中:在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n 1 x限定的位置处,并且其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n 1 x与n x之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目,并且其中x是从1到10或更大的整数。
74.在可根据如本文所述的本发明示例性合成方法版本3和5执行的任何上述方法中,所述方法可包括变体方法,其中:在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n 1 x限定的位置处,并且其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n 1 x与n x之间被裂解,其中x是从1到10或更大的整数;并且其中在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n 1 x限定的位置处,并且其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n 1 x与n x之间被裂解,其中x是从1到10或更大的整数;并且其中在步骤(2)和(4)中,x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目。
75.在可根据如本文所述的本发明示例性合成方法版本3和5执行的任何上述方法中,所述方法可包括变体方法,其中:在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n 1 x限定的位置处,其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n x与n x-1之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目,并且其中x是从1到10或更大的整数。
76.在可根据如本文所述的本发明示例性合成方法版本3和5执行的任何上述方法中,所述方法可包括变体方法,其中:在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n 1 x限定的位置处,其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n x与n x-1之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目,并且其中x是从1到10或更大的整数。
77.在可根据如本文所述的本发明示例性合成方法版本3和5执行的任何上述方法中,所述方法可包括变体方法,其中:在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n 1 x限定的位置处,其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n x与n x-1之间被裂解,其中x是从1到10或更大的整数;并且在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n 1 x限定的位置处,其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n x与n x-1之间被裂解,其中x是从1到10或更大的整数;并且其中在步骤(2)和(4)中,x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目。
78.在任何上述方法中,其中一条链在通用核苷酸所占据的位置与同一条链中由在辅助链的远端方向上紧邻通用核苷酸的核苷酸所占据的位置之间被裂解,在任何一个、多个或所有合成循环中,裂解步骤(3)可包括两步裂解过程,其中每个裂解步骤包括:第一步,其包括去除通用核苷酸,从而形成无碱基位点;和第二步,其包括在无碱基位点处裂解支持链;和/或在任何一个、多个或所有合成循环中,裂解步骤(5)可包括两步裂解过程,其中每
个裂解步骤包括:第一步,其包括去除通用核苷酸,从而形成无碱基位点;和第二步,其包括在无碱基位点处裂解支持链。在任何这些方法中,第一步可使用核苷酸切除酶进行。核苷酸切除酶可为3-甲基腺嘌呤dna糖基化酶。核苷酸切除酶可为人类烷基腺嘌呤dna糖基化酶(haag)或尿嘧啶dna糖基化酶(udg)。
79.在包括两步裂解过程的任何这些方法中,第二步可使用作为碱的化学物质进行。碱可为naoh。
80.在包括两步裂解过程的任何这些方法中,第二步可使用具有无碱基位点裂解活性的有机化学物质进行。有机化学物质可为n,n
’‑
二甲基乙二胺。第二步可使用具有无碱基位点裂解酶活性的酶进行,任选地,其中具有无碱基位点裂解酶活性的酶是:
81.(i)ap核酸内切酶1;
82.(ii)核酸内切酶iii(nth);或
83.(iii)核酸内切酶viii。
84.可替代地,在任何一个、多个或所有合成循环中,裂解步骤(3)可包括一步裂解过程,其包括用裂解酶去除通用核苷酸;和/或在任何一个、多个或所有合成循环中,裂解步骤(5)可包括一步裂解过程,其包括用裂解酶去除通用核苷酸;其中酶是:
85.(i)核酸内切酶iii;
86.(ii)核酸内切酶viii;
87.(iii)甲酰胺基嘧啶dna糖基化酶(fpg);或
88.(iv)8-氧代鸟嘌呤dna糖基化酶(hogg1)。
89.在任何上述方法中,其中一条链在由在辅助链的远端方向上紧邻通用核苷酸的核苷酸所占据的位置与同一条链中在辅助链的远端方向上的下一个核苷酸所占据的位置之间被裂解,在任何一个、多个或所有合成循环中,裂解步骤(3)可包括用酶裂解支持链;和/或在任何一个、多个或所有合成循环中,裂解步骤(5)可包括用酶裂解支持链。所述酶可为核酸内切酶v。
90.在可根据本发明的示例性合成方法版本1、2、3和4中的任一个执行的任何上述方法中,所述方法可如下执行:在步骤(1)中,支架多核苷酸的第二链的末端核苷酸是第二链的5’末端;在步骤(2)中,第一多核苷酸连接分子的合成链的末端核苷酸是合成链的5’末端;在步骤(3)中,支架多核苷酸的第一链的末端核苷酸是第一链的3’末端;并且在步骤(4)中,第二多核苷酸连接分子的合成链的末端核苷酸是合成链的3’末端。
91.在可根据本发明的示例性合成方法版本5和6中的任一个执行的任何上述方法中,所述方法可如下执行:在步骤(1)中,支架多核苷酸的第二链的末端核苷酸是第二链的3’末端;在步骤(2)中,第一多核苷酸连接分子的合成链的末端核苷酸是合成链的3’末端;在步骤(3)中,支架多核苷酸的第一链的末端核苷酸是第一链的5’末端;并且在步骤(4)中,第二多核苷酸连接分子的合成链的末端核苷酸是合成链的5’末端。
92.在任何上述方法中,在任何一个、多个或所有合成循环中,掺入双链多核苷酸的一条链中的一个或多个核苷酸可与相反链中相应位置处的配偶体核苷酸形成一对,并且其中一对核苷酸是互补核苷酸,优选地天然互补的核苷酸。
93.在任何上述方法中,在任何一个、多个或所有合成循环中,在裂解步骤(3)和(5)之前,可从连接的支架多核苷酸中去除辅助链。可通过以下方式从支架多核苷酸中去除辅助
链:(i)将支架多核苷酸加热至约80℃至约95℃的温度,并从支架多核苷酸中分离出辅助链,(ii)用尿素溶液诸如8m尿素处理支架多核苷酸,并且从支架多核苷酸中分离出辅助链,(iii)用甲酰胺或甲酰胺溶液诸如100%甲酰胺处理支架多核苷酸,并且从支架多核苷酸中分离出辅助链,或(iv)使支架多核苷酸与单链多核苷酸分子接触,所述单链多核苷酸分子包括与辅助链的序列互补的核苷酸序列区域,从而竞争性地抑制辅助链与支架多核苷酸的杂交。
94.在任何上述方法中,合成的双链多核苷酸的两条链均可为dna链。在此类方法中,掺入的核苷酸可以是dntp。可替代地,合成的双链多核苷酸的一条链可以是dna链,并且合成的双链多核苷酸的另一条链可以是rna链。在涉及rna链的方法中,掺入rna链的核苷酸可以是ntp。
95.在任何上述方法中,连接酶可为t3 dna连接酶或t4 dna连接酶。
96.任何上述方法可进一步包括在裂解步骤(3)和/或裂解步骤(5)之后通过聚合酶和/或转移酶的作用进一步延伸支架多核苷酸的第一和/或第二链。
97.在包括在裂解步骤之后通过聚合酶的作用进一步延伸支架多核苷酸的第一和/或第二链的方法中,聚合酶可以是dna聚合酶,任选地为修饰的dna聚合酶,其与未修饰聚合酶相比,掺入包含可逆终止子基团的dntp的能力增强。聚合酶可为来自嗜热球菌属(thermococcus)物种9
°
n,优选地物种9
°
n-7的天然dna聚合酶的变体。在任何这些方法中,通过聚合酶掺入的核苷酸中的一个或多个可以是包含可逆终止子基团的dntp。包含可逆终止子基团的掺入核苷酸中的一个或多个可以是3
’‑
o-烯丙基-dntp。包含可逆终止子基团的掺入核苷酸中的一个或多个可以是3
’‑
o-叠氮甲基-dntp。
98.在包括在裂解步骤之后通过聚合酶的作用进一步延伸支架多核苷酸的第一和/或第二链的方法中,聚合酶可以是rna聚合酶,诸如t3或t7 rna聚合酶,任选地为修饰的rna聚合酶,其与未修饰聚合酶相比,掺入包含可逆终止子基团的ntp的能力增强。在任何这些方法中,通过聚合酶掺入的核苷酸中的一个或多个可以是包含可逆终止子基团的dntp。包含可逆终止子基团的掺入核苷酸中的一个或多个可以是3
’‑
o-烯丙基-dntp。包含可逆终止子基团的掺入核苷酸中的一个或多个可以是3
’‑
o-叠氮甲基-dntp。
99.在包括在裂解步骤之后通过转移酶的作用进一步延伸支架多核苷酸的第一和/或第二链的方法中,转移酶可具有末端转移酶活性,任选地其中所述酶是末端核苷酸转移酶、末端脱氧核苷酸转移酶、末端脱氧核苷酸转移酶(tdt)、polλ、polμ或φ29dna聚合酶。
100.在涉及可逆终止子基团的方法中,去除可逆终止子基团的步骤可使用三(羧乙基)膦(tcep)进行。
101.在涉及将多核苷酸连接分子连接至支架多核苷酸的任何上述方法中,在合成循环中,在给定的连接反应中,在多核苷酸连接分子的互补连接末端:(a)如果辅助链在辅助链的3’末端包含不可连接的末端核苷酸,则所述核苷酸可以是2’,3
’‑
双脱氧核苷酸或2
’‑
脱氧核苷酸;或(b)如果辅助链在辅助链的5’末端包含不可连接的末端核苷酸,则所述核苷酸可缺少磷酸基团。
102.在任何上述方法中,在任何一个、多个或所有合成循环中,支架多核苷酸的第一和第二链可在所述分子的与连接末端相对的末端处通过发夹环连接。
103.在涉及将多核苷酸连接分子连接至支架多核苷酸的任何上述方法中,在任何一
个、多个或所有合成循环中,在步骤(2)和/或步骤(4)中,在多核苷酸连接分子中,合成链和与其杂交的辅助链可在与互补连接末端相对的末端处通过发夹环连接。在这样的方法中,在任何一个、多个或所有合成循环中:
104.a)支架多核苷酸的第一和第二链可在所述分子的与连接末端相对的末端处通过发夹环连接;并且
105.b)在步骤(2)和/或步骤(4)中,在多核苷酸连接分子中,合成链和与其杂交的辅助链可在与互补连接末端相对的末端处通过发夹环连接。
106.在任何上述方法中,支架多核苷酸的第一和第二链可拴系至共同表面。在任何这样的方法中,第一链和/或第二链包含可裂解接头,其中在合成之后,接头可被裂解以从表面拆离出双链多核苷酸。在任何这样的方法中,支架多核苷酸中的发夹环可拴系至表面。发夹环可经由可裂解接头拴系至表面,其中在合成之后,接头可被裂解以从表面拆离出双链多核苷酸。可裂解接头可以是uv可裂解接头。
107.在涉及将支架多核苷酸的第一和第二链拴系至共同表面的任何上述方法中,表面可以是微粒。表面可以是平坦表面。表面可包括凝胶。表面可包括聚丙烯酰胺表面,诸如约2%的聚丙烯酰胺,优选地其中聚丙烯酰胺表面联接至固体支撑件,诸如玻璃。
108.在涉及将支架多核苷酸的第一和第二链拴系至共同表面的任何上述方法中,支架多核苷酸的第一和第二链可经由一个或多个共价键拴系至共同表面。一个或多个共价键可在共同表面上的官能团与支架分子上的官能团之间形成,其中支架分子上的官能团可为胺基团、硫醇基团、硫代磷酸酯基团或硫代酰胺基团。共同表面上的官能团可以是溴乙酰基团,任选地其中溴乙酰基团可提供在使用n-(5-溴乙酰胺基戊基)丙烯酰胺(brapa)衍生的聚丙烯酰胺表面上。
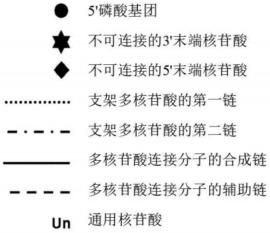
109.在任何上述方法中,合成循环可在微流体系统内的液滴中进行。微流体系统可为电润湿系统。微流体系统可为电介质上电润湿系统(ewod)。
110.在任何上述方法中,在合成之后,可将双链多核苷酸的链分离,以提供具有预定序列的单链多核苷酸。
111.在任何上述方法中,在合成之后,可对双链多核苷酸或其区域进行扩增,优选地通过pcr。
112.本发明还提供了一种组装具有预定序列的多核苷酸的方法,所述方法包括:执行根据前述权利要求中任一项所述的方法,以合成具有预定序列的第一多核苷酸和具有预定序列的一个或多个另外的多核苷酸;以及将第一多核苷酸和一个或多个另外的多核苷酸连结在一起。
113.在任何这样的方法中,第一多核苷酸和一个或多个另外的多核苷酸可以是双链的。在任何这样的方法中,第一多核苷酸和一个或多个另外的多核苷酸可以是单链的。在任何这些方法中,可将第一多核苷酸和一个或多个另外的多核苷酸裂解,以产生相容的末端并将其连结在一起,优选地通过连接。第一多核苷酸和一个或多个另外的多核苷酸可在裂解位点处被限制酶裂解。
114.在组装具有预定序列的多核苷酸的任何这些方法中,合成和/或组装步骤可在微流体系统内的液滴中进行。在任何这样的方法中,组装步骤可包括提供包括具有预定序列的第一合成多核苷酸的第一液滴和各自包括另外的一个或多个具有预定序列的合成多核
苷酸的第二液滴或多个另外的液滴,其中使液滴彼此接触并且其中将合成多核苷酸连结在一起,从而组装包括第一多核苷酸和另外的一个或多个多核苷酸的多核苷酸。在任何这样的方法中,合成步骤可通过提供多个液滴来进行,每个液滴包括与合成循环的步骤相对应的反应试剂,并且根据合成循环的步骤将液滴依次递送至支架多核苷酸。在任何这样的方法中,在递送液滴之后并且在递送下一液滴之前,可实施洗涤步骤以去除过量的反应试剂。在任何这样的方法中,微流体系统可为电润湿系统。在任何这样的方法中,微流体系统可为电介质上电润湿系统(ewod)。在任何这样的方法中,合成和组装步骤可在同一系统内进行。
115.在一个相关方面,本发明还提供了一种延伸双链多核苷酸以合成具有预定序列的双链多核苷酸的体外方法,所述方法包括一个或多个合成循环,其中在每个合成循环中,在第一延伸/连接反应中将通用核苷酸和预定序列的一个或多个核苷酸添加至双链支架多核苷酸的第一链,连接的支架多核苷酸的第一链在第一裂解步骤中在包含通用核苷酸的序列限定的裂解位点处被裂解,其中在裂解后,通用核苷酸从支架多核苷酸中释放并且预定序列的一个或多个核苷酸保留在支架多核苷酸的第一链中,在第二延伸/连接反应中将另一通用核苷酸和预定序列的一个或多个核苷酸添加至双链支架多核苷酸的第二链;并且连接的支架多核苷酸的第二链在第二裂解步骤中在包含另一通用核苷酸的序列限定的裂解位点处被裂解,其中在裂解后,另一通用核苷酸从支架多核苷酸中释放并且预定序列的一个或多个核苷酸保留在支架多核苷酸的第二链中。
116.这种延伸双链多核苷酸以合成具有预定序列的双链多核苷酸的体外方法可使用上文和本文限定和描述的任何特定方法实施。
117.在一个相关方面,本发明还提供了通用核苷酸在延伸双链多核苷酸以合成具有预定序列的双链多核苷酸的体外方法中的用途,其中在合成循环中,在第一延伸/连接反应中将通用核苷酸和预定序列的一个或多个核苷酸添加至双链支架多核苷酸的第一链,连接的支架多核苷酸的第一链在第一裂解步骤中在包含通用核苷酸的序列限定的裂解位点处被裂解,其中在裂解后,通用核苷酸从支架多核苷酸中释放并且预定序列的一个或多个核苷酸保留在支架多核苷酸的第一链中,在第二延伸/连接反应中将另一通用核苷酸和预定序列的一个或多个核苷酸添加至双链支架多核苷酸的第二链;并且连接的支架多核苷酸的第二链在第二裂解步骤中在包含另一通用核苷酸的序列限定的裂解位点处被裂解,其中在裂解后,另一通用核苷酸从支架多核苷酸中释放并且预定序列的一个或多个核苷酸保留在支架多核苷酸的第二链中。
118.通用核苷酸在合成具有预定序列的双链多核苷酸的体外方法中的这种用途可使用上文和本文限定和描述的任何特定方法实施。
119.在一个相关方面,本发明还提供了一种利用一个或多个预定核苷酸在同一末端延伸双链多核苷酸分子的每条链的体外方法,所述方法包括提供包含第一链和与其杂交的第二链的双链支架多核苷酸,在第一延伸/连接反应中将通用核苷酸和预定序列的一个或多个核苷酸添加至双链支架多核苷酸的第一链,在第一裂解步骤中在包含通用核苷酸的序列限定的裂解位点处裂解连接的支架多核苷酸的第一链,其中在裂解后,通用核苷酸从支架多核苷酸中释放并且预定序列的一个或多个核苷酸保留在支架多核苷酸的第一链中,在第二延伸/连接反应中将另一通用核苷酸和预定序列的一个或多个核苷酸添加至双链支架多核苷酸的第二链;以及在第二裂解步骤中在包含另一通用核苷酸的序列限定的裂解位点处
裂解连接的支架多核苷酸的第二链,其中在裂解后,另一通用核苷酸从支架多核苷酸中释放并且预定序列的一个或多个核苷酸保留在支架多核苷酸的第二链中。
120.这种利用一个或多个预定核苷酸在同一末端延伸双链多核苷酸分子的每条链的体外方法可使用上文和本文限定和描述的任何特定方法实施。
121.在一个相关方面,本发明还提供了一种在利用一个或多个预定核苷酸在同一末端延伸双链支架多核苷酸的每条链的循环期间,将各自包含通用核苷酸的两个多核苷酸连接分子连接至双链支架多核苷酸的体外方法,所述方法包括:提供包含第一链和与其杂交的第二链的双链支架多核苷酸,在第一延伸/连接反应中将包含通用核苷酸和预定序列的一个或多个核苷酸的第一多核苷酸连接分子连接至双链支架多核苷酸的第一链,在第一裂解步骤中在包含通用核苷酸的序列限定的裂解位点处裂解连接的支架多核苷酸的第一链,其中在裂解后,第一多核苷酸连接分子和通用核苷酸从支架多核苷酸中释放并且预定序列的一个或多个核苷酸保留在支架多核苷酸的第一链中,在第二延伸/连接反应中将包含另一通用核苷酸和预定序列的一个或多个核苷酸的第二多核苷酸连接分子连接至双链支架多核苷酸的第二链;以及在第二裂解步骤中在包含另一通用核苷酸的序列限定的裂解位点处裂解连接的支架多核苷酸的第二链,其中在裂解后,第二多核苷酸连接分子和另一通用核苷酸从支架多核苷酸中释放并且预定序列的一个或多个核苷酸保留在支架多核苷酸的第二链中。
122.这种在利用一个或多个预定核苷酸在同一末端延伸双链支架多核苷酸的每条链的循环期间将各自包含通用核苷酸的两个多核苷酸连接分子连接至双链支架多核苷酸的体外方法可使用上文和本文限定和描述的任何特定方法实施。
123.在如上文和本文所述的任何用于合成具有预定序列的双链多核苷酸的体外方法中,通用核苷酸可以是肌苷或其类似物、变体或衍生物。辅助链中通用核苷酸的配偶体核苷酸可以是胞嘧啶。通用核苷酸可以是肌苷或其类似物、变体或衍生物,并且辅助链中的配偶体核苷酸可以是胞嘧啶。
124.本发明还提供了一种在多核苷酸分子中存储数据的方法,所述方法包括:(a)通过利用根据如上文和本文所述的用于合成具有预定序列的双链多核苷酸的体外方法中的任一种的方法延伸双链多核苷酸的一条链并且接着延伸相反链来进行第一系列的延伸反应,从而使多核苷酸分子延伸一对或多对核苷酸以产生第一核苷酸序列;以及(b)通过利用根据如上文和本文所述的用于合成具有预定序列的双链多核苷酸的体外方法中的任一种的方法进一步延伸双链多核苷酸的一条链并且接着进一步延伸相反链来进行一个或多个另外系列的延伸反应,从而使多核苷酸分子延伸一对或多对另外的核苷酸,以在多核苷酸中产生第二或另外的核苷酸序列,其中产生的序列指示编码到延伸的多核苷酸分子中的信息。
125.本发明还提供了一种在多核苷酸分子中以位的形式存储数据的方法,所述方法包括:(a)通过利用根据如上文和本文所述的用于合成具有预定序列的双链多核苷酸的体外方法中的任一种的方法延伸双链多核苷酸的一条链并且接着延伸相反链来进行第一系列的延伸反应,从而使多核苷酸分子延伸一对或多对核苷酸,以在多核苷酸分子中产生指示第一信息位的第一核苷酸序列;以及(b)通过利用根据如上文和本文所述的用于合成具有预定序列的双链多核苷酸的体外方法中的任一种的方法进一步延伸双链多核苷酸的一条
链并且接着进一步延伸相反链来进行一个或多个另外系列的延伸反应,从而使多核苷酸分子延伸一对或多对另外的核苷酸,以在多核苷酸分子中产生指示一个或多个另外的信息位的另外的核苷酸序列。
126.本发明还提供了一种在多核苷酸分子中以数字形式存储数据的方法,所述方法包括:(a)通过利用根据如上文和本文所述的用于合成具有预定序列的双链多核苷酸的体外方法中的任一种的方法延伸双链多核苷酸的一条链并且接着延伸相反链来进行第一系列的延伸反应,从而使多核苷酸分子延伸一对或多对核苷酸,以在多核苷酸分子中产生指示数字信息位的“0”或“1”状态的第一核苷酸序列;以及(b)通过利用根据如上文和本文所述的用于合成具有预定序列的双链多核苷酸的体外方法中的任一种的方法进一步延伸双链多核苷酸的一条链并且接着进一步延伸相反链来进行一个或多个另外系列的延伸反应,从而使多核苷酸分子延伸一对或多对另外的核苷酸,以在多核苷酸分子中产生指示在步骤(a)中产生的位的相反状态的第二核苷酸序列。任何这种方法可包括多次重复步骤(a)和(b)以产生指示多个数字信息位的核苷酸序列。
127.本发明还提供了一种制备多核苷酸微阵列的方法,其中所述微阵列包括多个反应区域,每个区域包括一个或多个具有预定序列的多核苷酸,所述方法包括:
128.a)提供包括多个反应区域的表面,每个区域包括一个或多个双链锚或支架多核苷酸,以及
129.b)在每个反应区域处根据如上文和本文所述的用于合成具有预定序列的双链多核苷酸的体外方法中的任一种的方法执行合成循环,从而在每个区域处合成具有预定序列的一个或多个双链多核苷酸。
130.在任何这种方法中,在合成之后,可将双链多核苷酸的链分离,由此微阵列的每个区域包括一个或多个具有预定序列的单链多核苷酸。
131.本发明还提供了一种用于实施根据如上文和本文所述的用于合成具有预定序列的双链多核苷酸的体外方法中的任一种的方法的多核苷酸合成系统,所述系统包括:(a)反应区域的阵列,其中每个反应区域包括至少一个支架多核苷酸;和(b)用于将反应试剂递送至反应区域的装置;以及任选地,(c)用于从支架多核苷酸中裂解合成的双链多核苷酸的装置。任何这种系统可进一步包括用于以液滴形式提供反应试剂的装置和用于根据合成循环将液滴递送至支架多核苷酸的装置。
132.本发明还提供了一种用于与本文所述系统中的任一种一起使用并用于实施根据如上文和本文所述的用于合成具有预定序列的双链多核苷酸的体外方法中的任一种的方法的试剂盒,所述试剂盒包括与合成循环的步骤相对应的体积的反应试剂。
附图说明
133.本文提供的和下文描述的相关附图示出使用包括本发明方法的方法的合成循环的一些或所有步骤,以及用于执行所述方法的方面的方式,诸如寡核苷酸、表面、表面附接化学反应、接头等。这些附图以及其所有描述和所有相关方法、试剂和方案仅用于说明呈现而不应解释为限制。
134.相关附图,诸如图11、12、13、14、15、18a、19a、20a等示出了合成循环的一些或所有步骤,包括:掺入核苷酸(例如,包含可逆终止子基团的核苷酸)、裂解(例如,将支架多核苷
酸裂解成第一部分和第二部分,其中第一部分包含通用核苷酸,并且第二部分包含掺入的核苷酸)、连接(例如,将包含单链部分的多核苷酸构建体连接至包含掺入的核苷酸的裂解的支架多核苷酸的第二部分,其中单链部分包含与掺入的核苷酸互补的配偶体核苷酸)和脱保护(例如,从掺入的核苷酸中去除可逆终止子基团)。提供这些方法仅用于例示性支持,并不在所要求保护的发明的范围内。图1至10以及图57、60、61和64至69所示的方法方案是本发明的方法。
135.图1.本发明的示例性方法版本1的方案。
136.图1a是图1b和图2至10中描绘的各种结构的图例。
137.图1b是示出根据本发明的示例性方法版本1的第一合成循环的方案。
138.所述方法包括提供支架多核苷酸、将第一多核苷酸连接分子连接至支架多核苷酸、导致两个核苷酸掺入支架多核苷酸的第一链中的第一裂解步骤、将第二多核苷酸连接分子连接至支架多核苷酸,以及导致两个核苷酸掺入支架多核苷酸的第二链中的第二裂解步骤的循环。
139.该方案示出支架多核苷酸的提供(101、106)。支架多核苷酸的一个末端将通过将预定序列的核苷酸掺入两条链中来延伸(示出为支架多核苷酸的上末端)。支架多核苷酸的相对末端(示出为下末端,标记为3’和5’)被示出为不延伸。支架多核苷酸包含第一链(点线)和与其杂交的第二链(点划线)。待延伸的支架多核苷酸的末端被示出为具有单碱基突出端。第二链在待延伸的支架多核苷酸的末端处的末端核苷酸被描绘为“a”(腺苷)并且突出于第一链的末端核苷酸。第二链的末端核苷酸是不可连接的核苷酸。也是可连接核苷酸的第一链的末端核苷酸以核苷酸对的形式与第二链的次末端核苷酸配对。该对的两个核苷酸都被描绘为“x”。这两个核苷酸可以是任何两个核苷酸或其类似物或衍生物,并且不限于天然互补的核苷酸对。第二链的突出末端核苷酸可以是任何核苷酸或其类似物或衍生物。
140.该方案示出第一多核苷酸连接分子的提供(102、107;图右上方的结构)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第一链中的预定序列的可连接的第一核苷酸,被描绘为“t”(胸腺嘧啶),并且以单核苷酸突出端的形式突出于互补连接末端的辅助链的末端核苷酸。辅助链的末端核苷酸被描绘为不可连接的“c”(胞嘧啶),并与被描绘为“g”(鸟嘌呤)的合成链的次末端核苷酸配对。互补连接末端在合成链中包含通用核苷酸(描绘为“un”),并且其与辅助链中的配偶体核苷酸(描绘为“x”)配对。t、c、g和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
141.该方案示出将第一多核苷酸连接分子的合成链连接至支架多核苷酸的第一链(102、107)并且在第一多核苷酸连接分子的辅助链与第二链之间产生单链断裂(“缺口(nick)”)。
142.该方案示出第一裂解步骤(103、108),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第一/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第一多核苷酸连接分子并导致来源于第一多核苷酸连接分子的两个核苷酸(t和g)保留在支架多核苷酸中。在第一裂解步骤中,第一/合成链在由通用核苷酸和在辅助链的远端方向上在第一/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解在支架多核苷酸的裂解末端留下单碱基突出端,其中第一链的末端可连接核苷酸突出于第二链的末端可连接核苷
酸。
143.该方案示出第二多核苷酸连接分子的提供(104、109)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第二链中的预定序列的第一核苷酸,被描绘为可连接的“c”(胞嘧啶),并且以单核苷酸突出端的形式突出于互补连接末端的辅助链的末端核苷酸。辅助链的末端核苷酸被描绘为不可连接的“a”(腺嘌呤),并与被描绘为“t”(胸腺嘧啶)的合成链的次末端核苷酸配对。互补连接末端在合成链中包含通用核苷酸(描绘为“un”),并且其与辅助链中处于次末端位置的配偶体核苷酸(描绘为“x”)配对。c、a、t和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
144.该方案示出将第二多核苷酸连接分子的合成链连接至支架多核苷酸的第二链(104、109)并且在第二多核苷酸连接分子的辅助链与第一链之间产生单链断裂(“缺口”)。
145.该方案示出第二裂解步骤(105、110),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第二/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第二多核苷酸连接分子并导致来源于第二多核苷酸连接分子的两个核苷酸(c和t)保留在支架多核苷酸中。在第二裂解步骤中,第二/合成链在由通用核苷酸和在辅助链的远端方向上在第二/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解在支架多核苷酸的裂解末端留下单碱基突出端,其中第二链的末端可连接核苷酸突出于第一链的末端可连接核苷酸。
146.图2.本发明的示例性方法版本2的方案。
147.方案示出根据本发明的示例性方法版本2的第一合成循环。
148.所述方法包括提供支架多核苷酸、将第一多核苷酸连接分子连接至支架多核苷酸、导致两个核苷酸掺入支架多核苷酸的第一链中的第一裂解步骤、将第二多核苷酸连接分子连接至支架多核苷酸,以及导致两个核苷酸掺入支架多核苷酸的第二链中的第二裂解步骤的循环。
149.该方案示出支架多核苷酸的提供(201、206)。支架多核苷酸的一个末端将通过将预定序列的核苷酸掺入两条链中来延伸(示出为支架多核苷酸的上末端)。支架多核苷酸的相对末端(示出为下末端,标记为3’和5’)被示出为不延伸。支架多核苷酸包含第一链(点线)和与其杂交的第二链(点划线)。待延伸的支架多核苷酸的末端被示出为具有单碱基突出端。第二链在待延伸的支架多核苷酸的末端处的末端核苷酸被描绘为“a”(腺苷)并且突出于第一链的末端核苷酸。第二链的末端核苷酸是不可连接的核苷酸。也是可连接核苷酸的第一链的末端核苷酸以核苷酸对的形式与第二链的次末端核苷酸配对。该对的两个核苷酸都被描绘为“x”。这两个核苷酸可以是任何两个核苷酸或其类似物或衍生物,并且不限于天然互补的核苷酸对。第二链的突出末端核苷酸可以是任何核苷酸或其类似物或衍生物。
150.该方案示出第一多核苷酸连接分子的提供(202、207;图右上方的结构)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第一链中的预定序列的可连接的第一核苷酸,被描绘为“t”(胸腺嘧啶),并且以单核苷酸突出端的形式突出于互补连接末端的辅助链的末端核苷酸。辅助链的末端核苷酸被描绘为不可连接的“c”(胞嘧啶),并与被描绘为“g”(鸟嘌呤)的合成链的次末端核苷酸配对。互补连接末端在合成链中包含通用核苷酸(描绘为“un”),并且其
与辅助链中的配偶体核苷酸(描绘为“x”)配对。t、c、g和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
151.该方案示出将第一多核苷酸连接分子的合成链连接至支架多核苷酸的第一链(202、207)并且在第一多核苷酸连接分子的辅助链与第二链之间产生单链断裂(“缺口”)。
152.该方案示出第一裂解步骤(203、208),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第一/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第一多核苷酸连接分子并导致来源于第一多核苷酸连接分子的两个核苷酸(t和g)保留在支架多核苷酸中。在第一裂解步骤中,第一/合成链在由通用核苷酸和在辅助链的远端方向上在第一/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解在支架多核苷酸的裂解末端留下单碱基突出端,其中第一链的末端可连接核苷酸突出于第二链的末端可连接核苷酸。
153.该方案示出第二多核苷酸连接分子的提供(204、209)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第二链中的预定序列的第一核苷酸,被描绘为可连接的“c”(胞嘧啶),并且以单核苷酸突出端的形式突出于互补连接末端的辅助链的末端核苷酸。辅助链的末端核苷酸被描绘为不可连接的“a”(腺嘌呤),并与被描绘为“t”(胸腺嘧啶)的合成链的次末端核苷酸配对。互补连接末端在合成链中包含通用核苷酸(描绘为“un”),并且其与辅助链中的配偶体核苷酸(描绘为“x”)配对,其中x占据在远离互补连接末端的方向上在辅助链中紧邻次末端核苷酸的位置。c、a、t和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
154.该方案示出将第二多核苷酸连接分子的合成链连接至支架多核苷酸的第二链(204、209)并且在第二多核苷酸连接分子的辅助链与第一链之间产生单链断裂(“缺口”)。
155.该方案示出第二裂解步骤(205、210),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第二/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第二多核苷酸连接分子并导致来源于第二多核苷酸连接分子的两个核苷酸(c和t)保留在支架多核苷酸中。在第二裂解步骤中,第二/合成链在作为在辅助链的远端方向上在第二/合成链中紧邻通用核苷酸的第一和第二核苷酸的核苷酸所占据的位置之间被裂解。裂解在支架多核苷酸的裂解末端留下单碱基突出端,其中第二链的末端可连接核苷酸突出于第一链的末端可连接核苷酸。
156.图3.本发明的示例性方法版本3的方案。
157.方案示出根据本发明的示例性方法版本3的第一合成循环。
158.所述方法包括提供支架多核苷酸、将第一多核苷酸连接分子连接至支架多核苷酸、导致一个核苷酸掺入支架多核苷酸的第一链中的第一裂解步骤、将第二多核苷酸连接分子连接至支架多核苷酸,以及导致一个核苷酸掺入支架多核苷酸的第二链中的第二裂解步骤的循环。
159.该方案示出支架多核苷酸的提供(301、306)。支架多核苷酸的一个末端将通过将预定序列的核苷酸掺入两条链中来延伸(示出为支架多核苷酸的上末端)。支架多核苷酸的相对末端(示出为下末端,标记为3’和5’)被示出为不延伸。支架多核苷酸包含第一链(点线)和与其杂交的第二链(点划线)。待延伸的支架多核苷酸的末端被示出为具有平末端。第
一链的末端核苷酸被描绘为“x”并与第二链中也被描绘为“x”的末端核苷酸配对。第一和第二链在待延伸的支架多核苷酸末端处的末端核苷酸是可连接核苷酸。这两个核苷酸可以是任何两个核苷酸或其类似物或衍生物,并且不限于天然互补的核苷酸对。
160.该方案示出第一多核苷酸连接分子的提供(302、307;图右上方的结构)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第一链中的预定序列的可连接的第一核苷酸,被描绘为“t”(胸腺嘧啶),并且以平末端的形式与互补连接末端的辅助链的末端核苷酸配对。辅助链的末端核苷酸被描绘为不可连接的“a”(腺嘌呤)。互补连接末端在合成链中包含通用核苷酸(描绘为“un”),并且其与辅助链中的配偶体核苷酸(描绘为“x”)配对并且所述配偶体核苷酸是辅助链中的次末端核苷酸。t、a和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
161.该方案示出将第一多核苷酸连接分子的合成链连接至支架多核苷酸的第一链(302、307)并且在第一多核苷酸连接分子的辅助链与第二链之间产生单链断裂(“缺口”)。
162.该方案示出第一裂解步骤(303、308),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第一/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第一多核苷酸连接分子并导致来源于第一多核苷酸连接分子的胸腺嘧啶核苷酸保留在支架多核苷酸中。在第一裂解步骤中,第一/合成链在由通用核苷酸和在辅助链的远端方向上在第一/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解在支架多核苷酸的裂解末端留下单碱基突出端,其中第一链的末端可连接核苷酸突出于第二链的末端可连接核苷酸。
163.该方案示出第二多核苷酸连接分子的提供(304、309)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第二链中的预定序列的第一核苷酸,被描绘为可连接的“a”(腺嘌呤),并且以单核苷酸突出端的形式突出于互补连接末端的辅助链的末端核苷酸。辅助链的末端核苷酸被描绘为不可连接的核苷酸“x”,并与通用核苷酸(被描绘为“un”)配对,所述通用核苷酸是合成链在互补连接末端处的次末端核苷酸。a和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
164.该方案示出将第二多核苷酸连接分子的合成链连接至支架多核苷酸的第二链(304、309)并且在第二多核苷酸连接分子的辅助链与第一链之间产生单链断裂(“缺口”)。
165.该方案示出第二裂解步骤(305、310),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第二/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第二多核苷酸连接分子并导致来源于第二多核苷酸连接分子的腺嘌呤核苷酸(a)保留在支架多核苷酸中。在第二裂解步骤中,第二/合成链在由通用核苷酸和在辅助链的远端方向上在第二/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解留下支架多核苷酸的平末端的裂解末端,其中第二链的末端可连接核苷酸与第一链的末端可连接核苷酸配对。
166.图4.本发明的示例性方法版本4的方案。
167.方案示出根据本发明的示例性方法版本4的第一合成循环。
168.所述方法包括提供支架多核苷酸、将第一多核苷酸连接分子连接至支架多核苷酸、导致一个核苷酸掺入支架多核苷酸的第一链中的第一裂解步骤、将第二多核苷酸连接
分子连接至支架多核苷酸,以及导致一个核苷酸掺入支架多核苷酸的第二链中的第二裂解步骤的循环。
169.该方案示出支架多核苷酸的提供(401、406)。支架多核苷酸的一个末端将通过将预定序列的核苷酸掺入两条链中来延伸(示出为支架多核苷酸的上末端)。支架多核苷酸的相对末端(示出为下末端,标记为3’和5’)被示出为不延伸。支架多核苷酸包含第一链(点线)和与其杂交的第二链(点划线)。待延伸的支架多核苷酸的末端被示出为具有平末端。第一链的末端核苷酸被描绘为“x”并与第二链中也被描绘为“x”的末端核苷酸配对。第一和第二链在待延伸的支架多核苷酸末端处的末端核苷酸是可连接核苷酸。这两个核苷酸可以是任何两个核苷酸或其类似物或衍生物,并且不限于天然互补的核苷酸对。
170.该方案示出第一多核苷酸连接分子的提供(402、407;图右上方的结构)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第一链中的预定序列的可连接的第一核苷酸,被描绘为“t”(胸腺嘧啶),并且以平末端的形式与互补连接末端的辅助链的末端核苷酸配对。辅助链的末端核苷酸被描绘为不可连接的“a”(腺嘌呤)。互补连接末端在合成链中包含通用核苷酸(描绘为“un”),并且其与辅助链中的配偶体核苷酸(描绘为“x”)配对并且所述配偶体核苷酸是辅助链中的次末端核苷酸。t、a和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
171.该方案示出将第一多核苷酸连接分子的合成链连接至支架多核苷酸的第一链(402、407)并且在第一多核苷酸连接分子的辅助链与第二链之间产生单链断裂(“缺口”)。
172.该方案示出第一裂解步骤(403、408),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第一/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第一多核苷酸连接分子并导致来源于第一多核苷酸连接分子的胸腺嘧啶核苷酸保留在支架多核苷酸中。在第一裂解步骤中,第一/合成链在由通用核苷酸和在辅助链的远端方向上在第一/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解在支架多核苷酸的裂解末端留下单碱基突出端,其中第一链的末端可连接核苷酸突出于第二链的末端可连接核苷酸。
173.该方案示出第二多核苷酸连接分子的提供(404、409)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第二链中的预定序列的第一核苷酸,被描绘为可连接的“a”(腺嘌呤),并且以单核苷酸突出端的形式突出于互补连接末端的辅助链的末端核苷酸。辅助链的末端核苷酸被描绘为不可连接的核苷酸“x”并与合成链中也被描绘为“x”的次末端核苷酸配对。辅助链中也被描绘为“x”的次末端核苷酸与通用核苷酸(被描绘为“un”)配对。a和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
174.该方案示出将第二多核苷酸连接分子的合成链连接至支架多核苷酸的第二链(404、409)并且在第二多核苷酸连接分子的辅助链与第一链之间产生单链断裂(“缺口”)。
175.该方案示出第二裂解步骤(405、410),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第二/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第二多核苷酸连接分子并导致来源于第二多核苷酸连接分子的腺嘌呤核苷酸(a)保留在支架多核苷酸中。
在第二裂解步骤中,第二/合成链在作为在辅助链的远端方向上在第二/合成链中紧邻通用核苷酸的第一和第二核苷酸的核苷酸所占据的位置之间被裂解。裂解留下支架多核苷酸的平末端的裂解末端,其中第二链的末端可连接核苷酸与第一链的末端可连接核苷酸配对。
176.图5.本发明的示例性方法版本5的方案。
177.方案示出根据本发明的示例性方法版本5的第一合成循环。
178.所述方法包括提供支架多核苷酸、将第一多核苷酸连接分子连接至支架多核苷酸、导致一个核苷酸掺入支架多核苷酸的第一链中的第一裂解步骤、将第二多核苷酸连接分子连接至支架多核苷酸,以及导致一个核苷酸掺入支架多核苷酸的第二链中的第二裂解步骤的循环。
179.该方案示出支架多核苷酸的提供(501、506)。支架多核苷酸的一个末端将通过将预定序列的核苷酸掺入两条链中来延伸(示出为支架多核苷酸的上末端)。支架多核苷酸的相对末端(示出为下末端,标记为3’和5’)被示出为不延伸。支架多核苷酸包含第一链(点线)和与其杂交的第二链(点划线)。待延伸的支架多核苷酸的末端被示出为具有平末端。第一链的末端核苷酸被描绘为“x”并与第二链中也被描绘为“x”的末端核苷酸配对。第一和第二链在待延伸的支架多核苷酸末端处的末端核苷酸是可连接核苷酸。这两个核苷酸可以是任何两个核苷酸或其类似物或衍生物,并且不限于天然互补的核苷酸对。
180.该方案示出第一多核苷酸连接分子的提供(502、507;图右上方的结构)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第一链中的预定序列的可连接的第一核苷酸,被描绘为“t”(胸腺嘧啶),并且以平末端的形式与互补连接末端的辅助链的末端核苷酸配对。辅助链的末端核苷酸被描绘为不可连接的“a”(腺嘌呤)。互补连接末端在合成链中包含通用核苷酸(描绘为“un”),并且其与辅助链中的配偶体核苷酸(描绘为“x”)配对并且所述配偶体核苷酸是辅助链中的次末端核苷酸。t、a和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
181.该方案示出将第一多核苷酸连接分子的合成链连接至支架多核苷酸的第一链(502、507)并且在第一多核苷酸连接分子的辅助链与第二链之间产生单链断裂(“缺口”)。
182.该方案示出第一裂解步骤(503、508),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第一/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第一多核苷酸连接分子并导致来源于第一多核苷酸连接分子的胸腺嘧啶核苷酸保留在支架多核苷酸中。在第一裂解步骤中,第一/合成链在由通用核苷酸和在辅助链的远端方向上在第一/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解在支架多核苷酸的裂解末端留下单碱基突出端,其中第一链的末端可连接核苷酸突出于第二链的末端可连接核苷酸。
183.该方案示出第二多核苷酸连接分子的提供(504、509)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第二链中的预定序列的第一核苷酸,被描绘为可连接的“a”(腺嘌呤),并且以单核苷酸突出端的形式突出于互补连接末端的辅助链的末端核苷酸。辅助链的末端核苷酸被描绘为不可连接的核苷酸“x”,并与通用核苷酸(被描绘为“un”)配对,所述通用核苷酸是合成链在互补连接末端处的次末端核苷酸。a和x仅是为了举例说明而描绘并且可以是任何
核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
184.该方案示出将第二多核苷酸连接分子的合成链连接至支架多核苷酸的第二链(504、509)并且在第二多核苷酸连接分子的辅助链与第一链之间产生单链断裂(“缺口”)。
185.该方案示出第二裂解步骤(505、510),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第二/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第二多核苷酸连接分子并导致来源于第二多核苷酸连接分子的腺嘌呤核苷酸(a)保留在支架多核苷酸中。在第二裂解步骤中,第二/合成链在由通用核苷酸和在辅助链的远端方向上在第二/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解留下支架多核苷酸的平末端的裂解末端,其中第二链的末端可连接核苷酸与第一链的末端可连接核苷酸配对。
186.图6.本发明的示例性方法版本6的方案。
187.方案示出根据本发明的示例性方法版本6的第一合成循环。
188.所述方法包括提供支架多核苷酸、将第一多核苷酸连接分子连接至支架多核苷酸、导致一个核苷酸掺入支架多核苷酸的第一链中的第一裂解步骤、将第二多核苷酸连接分子连接至支架多核苷酸,以及导致一个核苷酸掺入支架多核苷酸的第二链中的第二裂解步骤的循环。
189.该方案示出支架多核苷酸的提供(601、606)。支架多核苷酸的一个末端将通过将预定序列的核苷酸掺入两条链中来延伸(示出为支架多核苷酸的上末端)。支架多核苷酸的相对末端(示出为下末端,标记为3’和5’)被示出为不延伸。支架多核苷酸包含第一链(点线)和与其杂交的第二链(点划线)。待延伸的支架多核苷酸的末端被示出为具有平末端。第一链的末端核苷酸被描绘为“x”并与第二链中也被描绘为“x”的末端核苷酸配对。第一和第二链在待延伸的支架多核苷酸末端处的末端核苷酸是可连接核苷酸。这两个核苷酸可以是任何两个核苷酸或其类似物或衍生物,并且不限于天然互补的核苷酸对。
190.该方案示出第一多核苷酸连接分子的提供(602、607;图右上方的结构)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第一链中的预定序列的可连接的第一核苷酸,被描绘为“t”(胸腺嘧啶),并且以平末端的形式与互补连接末端的辅助链的末端核苷酸配对。辅助链的末端核苷酸被描绘为不可连接的“a”(腺嘌呤)。合成链和辅助链的次末端核苷酸是配对的并且被描绘为“x”。互补连接末端在合成链中包含通用核苷酸(描绘为“un”),并且其与辅助链中的配偶体核苷酸(描绘为“x”)配对,并所述配偶体核苷酸占据在远离互补连接末端的方向上在辅助链中紧邻次末端核苷酸的位置。t、a和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
191.该方案示出将第一多核苷酸连接分子的合成链连接至支架多核苷酸的第一链(602、607)并且在第一多核苷酸连接分子的辅助链与第二链之间产生单链断裂(“缺口”)。
192.该方案示出第一裂解步骤(603、608),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第一/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第一多核苷酸连接分子并导致来源于第一多核苷酸连接分子的胸腺嘧啶核苷酸保留在支架多核苷酸中。在第一裂解步骤中,第一/合成链在作为在辅助链的远端方向上在第一/合成链中紧邻通用核苷酸的第一和第二核苷酸的核苷酸所占据的位置之间被裂解。裂解在支架多核苷酸的裂解末端留下单碱基突出端,其中第一链的末端可连接核苷酸突出于第二链的末端可连接核苷
酸。
193.该方案示出第二多核苷酸连接分子的提供(604、609)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第二链中的预定序列的第一核苷酸,被描绘为可连接的“a”(腺嘌呤),并且以单核苷酸突出端的形式突出于互补连接末端的辅助链的末端核苷酸。辅助链的末端核苷酸被描绘为不可连接的核苷酸“x”,并与通用核苷酸(被描绘为“un”)配对,所述通用核苷酸是合成链在互补连接末端处的次末端核苷酸。a和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
194.该方案示出将第二多核苷酸连接分子的合成链连接至支架多核苷酸的第二链(604、609)并且在第二多核苷酸连接分子的辅助链与第一链之间产生单链断裂(“缺口”)。
195.该方案示出第二裂解步骤(605、610),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第二/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第二多核苷酸连接分子并导致来源于第二多核苷酸连接分子的腺嘌呤核苷酸(a)保留在支架多核苷酸中。在第二裂解步骤中,第二/合成链在由通用核苷酸和在辅助链的远端方向上在第二/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解留下支架多核苷酸的平末端的裂解末端,其中第二链的末端可连接核苷酸与第一链的末端可连接核苷酸配对。
196.图7.本发明的示例性方法版本7的方案。
197.方案示出根据本发明的示例性方法版本7的第一合成循环,所述版本7为本发明的示例性方法版本3的变体。
198.所述方法包括提供支架多核苷酸、将第一多核苷酸连接分子连接至支架多核苷酸、导致一个核苷酸掺入支架多核苷酸的第一链中的第一裂解步骤、将第二多核苷酸连接分子连接至支架多核苷酸,以及导致一个核苷酸掺入支架多核苷酸的第二链中的第二裂解步骤的循环。
199.该方案示出支架多核苷酸的提供(701、706)。支架多核苷酸的一个末端将通过将预定序列的核苷酸掺入两条链中来延伸(示出为支架多核苷酸的上末端)。支架多核苷酸的相对末端(示出为下末端,标记为3’和5’)被示出为不延伸。支架多核苷酸包含第一链(点线)和与其杂交的第二链(点划线)。待延伸的支架多核苷酸的末端被示出为具有平末端。第一链的末端核苷酸被描绘为“x”并与第二链中也被描绘为“x”的末端核苷酸配对。第一和第二链在待延伸的支架多核苷酸末端处的末端核苷酸是可连接核苷酸。这两个核苷酸可以是任何两个核苷酸或其类似物或衍生物,并且不限于天然互补的核苷酸对。
200.该方案示出第一多核苷酸连接分子的提供(702、707;图右上方的结构)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第一链中的预定序列的可连接的第一核苷酸,被描绘为“t”(胸腺嘧啶),并且以平末端的形式与互补连接末端的辅助链的末端核苷酸配对。辅助链的末端核苷酸被描绘为不可连接的“a”(腺嘌呤)。互补连接末端在合成链中包含通用核苷酸(描绘为“un”),并且其与辅助链中的配偶体核苷酸(描绘为“x”)配对。合成链的次末端核苷酸被描绘为“g”(鸟嘌呤)并且辅助链的次末端核苷酸被描绘为“c”(胞嘧啶)。t、a、g、c和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。通用核苷酸占据在远离互补连接末端的方向上在合成链中紧邻次末
端核苷酸的核苷酸位置。
201.该方案示出将第一多核苷酸连接分子的合成链连接至支架多核苷酸的第一链(702、707)并且在第一多核苷酸连接分子的辅助链与第二链之间产生单链断裂(“缺口”)。
202.该方案示出第一裂解步骤(703、708),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第一/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第一多核苷酸连接分子并导致来源于第一多核苷酸连接分子的胸腺嘧啶和鸟嘌呤核苷酸保留在支架多核苷酸中。在第一裂解步骤中,第一/合成链在由通用核苷酸和在辅助链的远端方向上在第一/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解在支架多核苷酸的裂解末端留下双碱基突出端,其中第一链的末端和次末端核苷酸突出于第二链的末端可连接核苷酸。
203.该方案示出第二多核苷酸连接分子的提供(704、709)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第二链中的预定序列的第一核苷酸,被描绘为可连接的“a”(腺嘌呤)。互补连接末端的合成链的次末端核苷酸是待掺入第二链中的预定序列的第二核苷酸,被描绘为“c”(胞嘧啶)。合成链的末端和次末端核苷酸以双核苷酸突出端的形式突出于互补连接末端处的辅助链末端核苷酸。辅助链的末端核苷酸被描绘为不可连接的核苷酸“x”并与通用核苷酸(描绘为“un”)配对,所述通用核苷酸占据在远离互补连接末端的方向上在合成链中紧邻次末端核苷酸的核苷酸位置。a、c和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
204.该方案示出将第二多核苷酸连接分子的合成链连接至支架多核苷酸的第二链(704、709)并且在第二多核苷酸连接分子的辅助链与第一链之间产生单链断裂(“缺口”)。
205.该方案示出第二裂解步骤(705、710),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第二/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第二多核苷酸连接分子并导致来源于第二多核苷酸连接分子的腺嘌呤(a)和胞嘧啶(c)核苷酸保留在支架多核苷酸中。在第二裂解步骤中,第二/合成链在由通用核苷酸和在辅助链的远端方向上在第二/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解留下支架多核苷酸的平末端的裂解末端,其中第二链的末端可连接核苷酸与第一链的末端可连接核苷酸配对并且其中第一和第二核苷酸均掺入第一和第二链中。
206.图8.本发明的示例性方法版本8的方案。
207.方案示出根据本发明的示例性方法版本8的第一合成循环,所述版本8为本发明的示例性方法版本3的变体。
208.所述方法包括提供支架多核苷酸、将第一多核苷酸连接分子连接至支架多核苷酸、导致一个核苷酸掺入支架多核苷酸的第一链中的第一裂解步骤、将第二多核苷酸连接分子连接至支架多核苷酸,以及导致一个核苷酸掺入支架多核苷酸的第二链中的第二裂解步骤的循环。
209.该方案示出支架多核苷酸的提供(801、806)。支架多核苷酸的一个末端将通过将预定序列的核苷酸掺入两条链中来延伸(示出为支架多核苷酸的上末端)。支架多核苷酸的相对末端(示出为下末端,标记为3’和5’)被示出为不延伸。支架多核苷酸包含第一链(点线)和与其杂交的第二链(点划线)。待延伸的支架多核苷酸的末端被示出为具有平末端。第
一链的末端核苷酸被描绘为“x”并与第二链中也被描绘为“x”的末端核苷酸配对。第一和第二链在待延伸的支架多核苷酸末端处的末端核苷酸是可连接核苷酸。这两个核苷酸可以是任何两个核苷酸或其类似物或衍生物,并且不限于天然互补的核苷酸对。
210.该方案示出第一多核苷酸连接分子的提供(802、807;图右上方的结构)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第一链中的预定序列的可连接的第一核苷酸,被描绘为“t”(胸腺嘧啶),并且以平末端的形式与互补连接末端的辅助链的末端核苷酸配对。辅助链的末端核苷酸被描绘为不可连接的“a”(腺嘌呤)。互补连接末端在合成链中包含通用核苷酸(描绘为“un”),并且其与辅助链中的配偶体核苷酸(描绘为“x”)配对。合成链的次末端核苷酸被描绘为“g”(鸟嘌呤)并且辅助链的次末端核苷酸被描绘为“c”(胞嘧啶)。t、a、g、c和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。通用核苷酸占据在远离互补连接末端的方向上在合成链中紧邻次末端核苷酸的核苷酸位置。
211.该方案示出将第一多核苷酸连接分子的合成链连接至支架多核苷酸的第一链(802、807)并且在第一多核苷酸连接分子的辅助链与第二链之间产生单链断裂(“缺口”)。
212.该方案示出第一裂解步骤(803、808),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第一/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第一多核苷酸连接分子并导致来源于第一多核苷酸连接分子的胸腺嘧啶和鸟嘌呤核苷酸保留在支架多核苷酸中。在第一裂解步骤中,第一/合成链在由通用核苷酸和在辅助链的远端方向上在第一/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解在支架多核苷酸的裂解末端留下双碱基突出端,其中第一链的末端和次末端核苷酸突出于第二链的末端可连接核苷酸。
213.该方案示出第二多核苷酸连接分子的提供(804、809)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第二链中的预定序列的第一核苷酸,被描绘为可连接的“a”(腺嘌呤)。互补连接末端的合成链的次末端核苷酸是待掺入第二链中的预定序列的第二核苷酸,被描绘为“c”(胞嘧啶)。合成链的末端和次末端核苷酸以双核苷酸突出端的形式突出于互补连接末端处的辅助链末端核苷酸。辅助链的末端核苷酸被描绘为不可连接的核苷酸“x”并与在远离互补连接末端的方向上在合成链中占据紧邻次末端核苷酸的核苷酸位置的核苷酸配对。通用核苷酸在远离互补连接末端的方向上在合成链中占据第四核苷酸位置。a、c和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
214.该方案示出将第二多核苷酸连接分子的合成链连接至支架多核苷酸的第二链(804、809)并且在第二多核苷酸连接分子的辅助链与第一链之间产生单链断裂(“缺口”)。
215.该方案示出第二裂解步骤(805、810),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第二/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第二多核苷酸连接分子并导致来源于第二多核苷酸连接分子的腺嘌呤(a)和胞嘧啶(c)核苷酸保留在支架多核苷酸中。在第二裂解步骤中,第二/合成链在这样的核苷酸之间被裂解:所述核苷酸在辅助链的远端方向上在第二/合成链中占据紧邻通用核苷酸的第一和第二位置。裂解留下
支架多核苷酸的平末端的裂解末端,其中第二链的末端可连接核苷酸与第一链的末端可连接核苷酸配对并且其中第一和第二核苷酸均掺入第一和第二链中。
216.图9.本发明的示例性方法版本9的方案。
217.方案示出根据本发明的示例性方法版本9的第一合成循环,所述版本9为本发明的示例性方法版本5的变体。
218.所述方法包括提供支架多核苷酸、将第一多核苷酸连接分子连接至支架多核苷酸、导致一个核苷酸掺入支架多核苷酸的第一链中的第一裂解步骤、将第二多核苷酸连接分子连接至支架多核苷酸,以及导致一个核苷酸掺入支架多核苷酸的第二链中的第二裂解步骤的循环。
219.该方案示出支架多核苷酸的提供(901、906)。支架多核苷酸的一个末端将通过将预定序列的核苷酸掺入两条链中来延伸(示出为支架多核苷酸的上末端)。支架多核苷酸的相对末端(示出为下末端,标记为3’和5’)被示出为不延伸。支架多核苷酸包含第一链(点线)和与其杂交的第二链(点划线)。待延伸的支架多核苷酸的末端被示出为具有平末端。第一链的末端核苷酸被描绘为“x”并与第二链中也被描绘为“x”的末端核苷酸配对。第一和第二链在待延伸的支架多核苷酸末端处的末端核苷酸是可连接核苷酸。这两个核苷酸可以是任何两个核苷酸或其类似物或衍生物,并且不限于天然互补的核苷酸对。
220.该方案示出第一多核苷酸连接分子的提供(902、907;图右上方的结构)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第一链中的预定序列的可连接的第一核苷酸,被描绘为“t”(胸腺嘧啶),并且以平末端的形式与互补连接末端的辅助链的末端核苷酸配对。辅助链的末端核苷酸被描绘为不可连接的“a”(腺嘌呤)。互补连接末端在合成链中包含通用核苷酸(描绘为“un”),并且其与辅助链中的配偶体核苷酸(描绘为“x”)配对。合成链的次末端核苷酸被描绘为“c”(胞嘧啶)并且辅助链的次末端核苷酸被描绘为“g”(鸟嘌呤)。t、a、g、c和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。通用核苷酸占据在远离互补连接末端的方向上在合成链中紧邻次末端核苷酸的核苷酸位置。
221.该方案示出将第一多核苷酸连接分子的合成链连接至支架多核苷酸的第一链(902、907)并且在第一多核苷酸连接分子的辅助链与第二链之间产生单链断裂(“缺口”)。
222.该方案示出第一裂解步骤(903、908),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第一/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第一多核苷酸连接分子并导致来源于第一多核苷酸连接分子的胸腺嘧啶和鸟嘌呤核苷酸保留在支架多核苷酸中。在第一裂解步骤中,第一/合成链在由通用核苷酸和在辅助链的远端方向上在第一/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解在支架多核苷酸的裂解末端留下双碱基突出端,其中第一链的末端和次末端核苷酸突出于第二链的末端可连接核苷酸。
223.该方案示出第二多核苷酸连接分子的提供(904、909)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第二链中的预定序列的第一核苷酸,被描绘为可连接的“a”(腺嘌呤)。互补连接末端的合成链的次末端核苷酸是待掺入第二链中的预定序列的第二核苷酸,被描绘为“g”(鸟嘌呤)。合成链的末端和次末端核苷酸以双核苷酸突出端的形式突出于互补连接末端处的辅助链末端核苷酸。辅助链的末端核苷酸被描绘为不可连接的核苷酸“x”并与通用核苷酸(描绘为“un”)配对,所述通用核苷酸占据在远离互补连接末端的方向上在合成链中紧邻次末端核苷酸的核苷酸位置。a、g和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
224.该方案示出将第二多核苷酸连接分子的合成链连接至支架多核苷酸的第二链(904、909)并且在第二多核苷酸连接分子的辅助链与第一链之间产生单链断裂(“缺口”)。
225.该方案示出第二裂解步骤(905、910),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第二/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第二多核苷酸连接分子并导致来源于第二多核苷酸连接分子的腺嘌呤(a)和鸟嘌呤(g)核苷酸保留在支架多核苷酸中。在第二裂解步骤中,第二/合成链在由通用核苷酸和在辅助链的远端方向上在第二/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解留下支架多核苷酸的平末端的裂解末端,其中第二链的末端可连接核苷酸与第一链的末端可连接核苷酸配对并且其中第一和第二核苷酸均掺入第一和第二链中。
226.图10.本发明的示例性方法版本10的方案。
227.方案示出根据本发明的示例性方法版本10的第一合成循环,所述版本10为本发明的示例性方法版本5的变体。
228.所述方法包括提供支架多核苷酸、将第一多核苷酸连接分子连接至支架多核苷酸、导致一个核苷酸掺入支架多核苷酸的第一链中的第一裂解步骤、将第二多核苷酸连接分子连接至支架多核苷酸,以及导致一个核苷酸掺入支架多核苷酸的第二链中的第二裂解步骤的循环。
229.该方案示出支架多核苷酸的提供(1001、1006)。支架多核苷酸的一个末端将通过将预定序列的核苷酸掺入两条链中来延伸(示出为支架多核苷酸的上末端)。支架多核苷酸的相对末端(示出为下末端,标记为3’和5’)被示出为不延伸。支架多核苷酸包含第一链(点线)和与其杂交的第二链(点划线)。待延伸的支架多核苷酸的末端被示出为具有平末端。第一链的末端核苷酸被描绘为“x”并与第二链中也被描绘为“x”的末端核苷酸配对。第一和第二链在待延伸的支架多核苷酸末端处的末端核苷酸是可连接核苷酸。这两个核苷酸可以是任何两个核苷酸或其类似物或衍生物,并且不限于天然互补的核苷酸对。
230.该方案示出第一多核苷酸连接分子的提供(1002、1007;图右上方的结构)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第一链中的预定序列的可连接的第一核苷酸,被描绘为“t”(胸腺嘧啶),并且以平末端的形式与互补连接末端的辅助链的末端核苷酸配对。辅助链的末端核苷酸被描绘为不可连接的“a”(腺嘌呤)。互补连接末端的合成链的次末端核苷酸是待掺入第一链中的预定序列的第二核苷酸,被描绘为“c”(胞嘧啶)。互补连接末端在合成链中包含通用核苷酸(描绘为“un”),并且其与辅助链中的配偶体核苷酸(描绘为“x”)配对。通用核苷酸在远离互补连接末端的方向上在合成链中占据第四核苷酸位置。t、a、g、c和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
231.该方案示出将第一多核苷酸连接分子的合成链连接至支架多核苷酸的第一链
(1002、1007)并且在第一多核苷酸连接分子的辅助链与第二链之间产生单链断裂(“缺口”)。
232.该方案示出第一裂解步骤(1003、1008),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第一/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第一多核苷酸连接分子并导致来源于第一多核苷酸连接分子的胸腺嘧啶和胞嘧啶核苷酸保留在支架多核苷酸中。在第一裂解步骤中,第一/合成链在这样的核苷酸之间被裂解:所述核苷酸在辅助链的远端方向上在第一/合成链中占据紧邻通用核苷酸的第一和第二位置。裂解在支架多核苷酸的裂解末端留下双碱基突出端,其中第一链的末端和次末端核苷酸突出于第二链的末端可连接核苷酸。
233.该方案示出第二多核苷酸连接分子的提供(1004、1009)。多核苷酸连接分子包含辅助链(虚线)、与其杂交的合成链(实线)和互补连接末端。互补连接末端的合成链的末端核苷酸是待掺入第二链中的预定序列的第一核苷酸,被描绘为可连接的“a”(腺嘌呤)。互补连接末端的合成链的次末端核苷酸是待掺入第二链中的预定序列的第二核苷酸,被描绘为“g”(鸟嘌呤)。合成链的末端和次末端核苷酸以双核苷酸突出端的形式突出于互补连接末端处的辅助链末端核苷酸。辅助链的末端核苷酸被描绘为不可连接的核苷酸“x”并与通用核苷酸(描绘为“un”)配对,所述通用核苷酸占据在远离互补连接末端的方向上在合成链中紧邻次末端核苷酸的核苷酸位置。a、g和x仅是为了举例说明而描绘并且可以是任何核苷酸或其类似物或衍生物。配对的核苷酸不必包含天然互补的核苷酸。
234.该方案示出将第二多核苷酸连接分子的合成链连接至支架多核苷酸的第二链(1004、1009)并且在第二多核苷酸连接分子的辅助链与第一链之间产生单链断裂(“缺口”)。
235.该方案示出第二裂解步骤(1005、1010),其包括在由包含通用核苷酸的序列限定的裂解位点处裂解第二/合成链(锯齿状箭头)。裂解释放包含通用核苷酸的第二多核苷酸连接分子并导致来源于第二多核苷酸连接分子的腺嘌呤(a)和鸟嘌呤(g)核苷酸保留在支架多核苷酸中。在第二裂解步骤中,第二/合成链在由通用核苷酸和在辅助链的远端方向上在第二/合成链中占据下一个核苷酸位置的核苷酸所占据的位置之间被裂解。裂解留下支架多核苷酸的平末端的裂解末端,其中第二链的末端可连接核苷酸与第一链的末端可连接核苷酸配对并且其中第一和第二核苷酸均掺入第一和第二链中。
236.图11.示例性方法版本1的方案。
237.该图示出了根据实施例部分的示例性方法版本1的第一合成循环。提供该方法仅用于说明性支持,并且不在所要求保护的发明的范围内。该方法包括提供支架多核苷酸、掺入、裂解、连接和脱保护的循环。该方案显示胸腺嘧啶核苷酸在第一个合成循环(101、102)中的掺入及其与配偶体腺嘌呤核苷酸(104)相对的配对,以及提供用于下一个合成循环的支架多核苷酸(106)。显示此对仅用于说明目的而不具限制性,取决于所需的预定序列,此对可以是任何对。核苷酸z可为任何核苷酸。核苷酸x可为任何合适的核苷酸。所述图还示出了对应于第二合成循环的参考标记。
238.图12.示例性方法版本2的方案。
239.该图显示了根据实施例部分的示例性方法版本2的第一合成循环。提供该方法仅用于说明性支持,并且不在所要求保护的发明的范围内。该方法包括提供支架多核苷酸、掺
烯丙基-dttp。泳道2:使用bst dna聚合酶掺入3
’‑
o-叠氮甲基-dttp。泳道3:使用deep vent(exo-)dna聚合酶掺入3
’‑
o-烯丙基-dttp。泳道4:使用deep vent(exo-)dna聚合酶掺入3
’‑
o-叠氮甲基-dttp。泳道5:使用therminator i dna聚合酶掺入3
’‑
o-烯丙基-dttp。泳道6:使用therminator i dna聚合酶掺入3
’‑
o-叠氮甲基-dttp。泳道7:使用therminator ix dna聚合酶掺入3
’‑
o-烯丙基-dttp。泳道8:使用therminator ix dna聚合酶掺入3
’‑
o-叠氮甲基-dttp。
252.c)对于与肌苷相对掺入3
’‑
o-修饰的dttp评估dna聚合酶。使用各种dna聚合酶掺入的结果。
253.d)使用therminator ix dna聚合酶评估掺入温度。该图描绘了凝胶,其显示了在不同温度下使用therminator ix dna聚合酶在mn
2
离子存在下与肌苷相对掺入3'-修饰的dttp的结果。泳道1:在37℃掺入3
’‑
o-烯丙基dttp。泳道2:在37℃掺入3'-o-叠氮甲基dttp。泳道3:在50℃掺入3
’‑
o-烯丙基dttp。泳道4:在50℃掺入3'-o-叠氮甲基dttp。泳道5:在65℃掺入3
’‑
o-烯丙基dttp。泳道6:在65℃掺入3'-o-叠氮甲基dttp。
254.e)使用therminator ix dna聚合酶评估掺入温度。在不同温度下进行的掺入的结果。
255.f)使用therminator ix dna聚合酶评估掺入时mn
2
的存在。该图描绘了凝胶,其显示在65℃相对肌苷掺入3'-o-修饰的dttp的结果。泳道s:标准。泳道1:没有mn
2
离子的3
’‑
o-烯丙基-dttp的掺入。泳道2:没有mn
2
离子的3
’‑
o-叠氮甲基-dttp的掺入。泳道3:在mn
2
离子存在下掺入3
’‑
o-烯丙基-dttp。泳道4:在mn
2
离子存在下掺入3
’‑
o-叠氮甲基-dttp。
256.g)使用therminator ix dna聚合酶评估掺入时mn
2
的存在。在存在和不存在mn
2
离子的情况下掺入的结果。
257.h)用于研究掺入步骤的寡核苷酸。
258.图18.没有辅助链-裂解。
259.a)显示在不存在辅助链的情况下裂解杂交的多核苷酸链的方案。裂解步骤以虚线框突出显示。
260.b)凝胶显示分别在37℃和室温24℃下用haag和0.2m naoh(强碱)裂解寡核苷酸。泳道1.起始寡核苷酸。作为含有两条全长链的正对照的泳道2显示出裂解与未裂解的dna比率为90%:10%的更高产率。包含没有辅助链的裂解反应的泳道3显示裂解与未裂解的dna的比率为10%:90%的低百分比产率。
261.c)凝胶显示寡核苷酸在37℃下用haag和endo viii裂解。作为含有两条全长链的正对照的泳道2显示出裂解与未裂解的dna比率为约90%:10%的更高产率。包含没有辅助链的裂解反应的泳道3显示裂解与未裂解的dna的比率为约7%:93%的低百分比产率。
262.d)用haag/endo viii和haag/化学碱裂解寡核苷酸的总结。
263.e)用于研究裂解步骤的寡核苷酸。
264.图19.没有辅助链-连接。
265.a)显示在不存在辅助链的情况下连接杂交的多核苷酸链的方案。在虚线框中突出显示连接步骤。
266.b)凝胶显示在没有辅助链的情况下在室温(24℃)下用quick t4 dna连接酶连接寡核苷酸。泳道1含有36聚体tamra单链寡核苷酸和18聚体tamra单链寡核苷酸的混合物。这
些寡核苷酸用作参考条带。
267.c)用于研究连接步骤的寡核苷酸。
268.图20.用辅助链的版本1化学-掺入。
269.a)以虚线框突出显示掺入步骤的方案。
270.b)适用于研究掺入步骤的寡核苷酸。
271.图21.用辅助链的版本1化学-裂解。
272.a)显示在不存在辅助链的情况下裂解杂交的多核苷酸链的方案。裂解步骤以虚线框突出显示。
273.b)凝胶显示分别在37℃和室温24℃下用haag和0.2m naoh(强碱)裂解寡核苷酸。泳道1.起始寡核苷酸。作为含有两条全长链的正对照的泳道2显示出裂解与未裂解的dna比率为90%:10%的更高产率。包含没有辅助链的裂解反应的泳道3显示裂解与未裂解的dna的比率为10%:90%的低百分比产率。包含与辅助链的裂解反应的泳道4显示裂解与未裂解的dna的比率为50%:50%的相同百分比产率。
274.c)评估核酸内切酶viii裂解无碱基位点。凝胶显示寡核苷酸在37℃下用haag和endo viii裂解。作为含有两条全长链的正对照的泳道2显示出裂解与未裂解的dna比率为约90%:10%的更高产率。包含没有辅助链的裂解反应的泳道3显示裂解与未裂解的dna的比率为约7%:93%的低百分比产率。包含有辅助链的裂解反应的泳道4显示裂解与未裂解的dna的比率为10%:90%的低百分比产率。
275.d)评估n,n'-二甲基乙二胺裂解无碱基位点。凝胶显示寡核苷酸用haag和100mm n,n'-二甲基乙二胺在37℃下裂解。泳道1.起始寡核苷酸。作为含有两条全长链的正对照的泳道2显示100%裂解的dna。包含有辅助链的裂解反应的泳道3显示裂解与未裂解的dna的比率为90%:10%的较高百分比产率。
276.e)用haag/endo viii、haag/化学碱和haag/替代化学碱裂解寡核苷酸的总结。
277.f)用于研究裂解步骤的寡核苷酸。
278.图22.利用辅助链的版本1化学-连接。
279.a)显示在存在辅助链的情况下连接杂交的多核苷酸链的方案。在虚线框中突出显示连接步骤。
280.b)凝胶显示在存在辅助链的情况下在室温(24℃)下用quick t4 dna连接酶连接寡核苷酸。泳道1含有36聚体tamra单链寡核苷酸和18聚体tamra单链寡核苷酸的混合物。这些寡核苷酸用作参考条带。在泳道2中,在20分钟后存在预期条带大小为36聚体的可观察的连接产物。
281.c)凝胶显示在辅助链存在下孵育过夜后,在室温(24℃)下用quick t4 dna连接酶连接寡核苷酸。泳道1含有36聚体tamra单链寡核苷酸和18聚体tamra单链寡核苷酸的混合物。这些寡核苷酸作为参考条带。在泳道2中,存在可观察到的完全连接的产物,其预期条带大小为36聚体。
282.d)用于研究连接步骤的寡核苷酸。
283.图23.利用辅助链的版本2化学-掺入。
284.a)显示掺入步骤的方案以橙色虚线框突出显示
285.b)凝胶显示在27℃通过therminator ix dna聚合酶掺入3'-o-改性dttp的结果。
泳道1:起始材料。泳道2:1分钟后掺入,转化率为5%。泳道3:2分钟后掺入,转化率10%。泳道4:5分钟后掺入,转化率20%。泳道5:10分钟后掺入,转化率30%。泳道6:20分钟后掺入,转化率35%。
286.c)该图描绘了凝胶,其显示在37℃通过therminator ix dna聚合酶掺入3'-o-改性dttp的结果。泳道1:起始材料。泳道2:1分钟后掺入,转化率为30%。泳道3:2分钟后掺入,转化率60%。泳道4:5分钟后掺入,转化率90%。泳道5:10分钟后掺入,转化率90%。泳道6:20分钟后掺入,转化率90%。
287.d)凝胶显示在47℃通过therminator ix dna聚合酶掺入3'-o-改性dttp的结果。泳道1:起始材料。泳道2:1分钟后掺入,转化率为30%。泳道3:2分钟后掺入,转化率65%。泳道4:5分钟后掺入,转化率90%。泳道5:10分钟后掺入,转化率90%。泳道6:20分钟后掺入,转化率90%。
288.e)凝胶显示在27℃通过therminator ix dna聚合酶掺入3'-o-改性dttp的结果。泳道1:起始材料。泳道2:1分钟后掺入,转化率为70%。泳道3:2分钟后掺入,转化率85%。泳道4:5分钟后掺入,转化率92%。泳道5:10分钟后掺入,转化率96%。泳道6:20分钟后掺入,转化率96%。
289.f)凝胶显示在37℃通过therminator ix dna聚合酶掺入3'-o-改性dttp的结果。泳道1:起始材料。泳道2:1分钟后掺入,转化率为85%。泳道3:2分钟后掺入,转化率95%。泳道4:5分钟后掺入,转化率96%。泳道5:10分钟后掺入,转化率96%。泳道6:20分钟后掺入,转化率96%。
290.g)凝胶显示在47℃通过therminator ix dna聚合酶掺入3'-o-改性dttp的结果。泳道1:起始材料。泳道2:1分钟后掺入,转化率为85%。泳道3:2分钟后掺入,转化率90%。泳道4:5分钟后掺入,转化率96%。泳道5:10分钟后掺入,转化率96%。泳道6:20分钟后掺入,转化率96%。
291.h)在各种温度和mn
2
离子存在下掺入3
’‑
o-叠氮甲基-dttp的总结。
292.i)凝胶显示在37℃在mn
2
的存在下通过therminator ix dna聚合酶与互补碱基相对3'-o-改性的dntp的掺入结果。泳道1:起始材料。泳道2:3
’‑
o-叠氮甲基-dttp掺入5分钟。泳道3:3
’‑
o-叠氮甲基-datp掺入5分钟。泳道4:3
’‑
o-叠氮甲基-dctp掺入5分钟。泳道5:3
’‑
o-叠氮甲基-dgtp掺入5分钟。
293.j)用于研究掺入步骤的寡核苷酸。
294.图24.利用辅助链的版本2化学-裂解。
295.a)显示在辅助链存在下裂解杂交的多核苷酸链的方案。裂解步骤以橙色虚线框突出显示。
296.b)凝胶显示用endo v在37℃下裂解寡核苷酸。泳道1.起始寡核苷酸。作为含有两条全长链的正对照的泳道2显示出裂解与未裂解的dna比率为80%:20%的产率。包含没有辅助链的裂解反应的泳道3显示出高得多的裂解的dna产率》99%。包含有辅助链的裂解反应的泳道4也显示出》99%的dna裂解产率。
297.c)核酸内切酶v的裂解研究总结。
298.d)用于研究裂解步骤的寡核苷酸。
299.图25.利用辅助链的版本2化学-连接。
300.a)显示在不存在辅助链的情况下连接杂交的多核苷酸链的方案。连接步骤以橙色虚线框突出显示。
301.b)用于研究连接步骤的寡核苷酸。
302.图26.利用辅助链的版本2化学-脱保护。
303.a)显示脱保护步骤的方案在橙色虚线框中突出显示。
304.b)该图描绘了凝胶,其显示在掺入3
’‑
o-叠氮甲基-dttp后通过50mm tcep脱保护3
’‑
o-叠氮甲基的结果。泳道1:起始引物
305.泳道2:在mn
2
存在下掺入3
’‑
o-叠氮甲基-dttp。泳道3:通过添加所有天然dntp在泳道2中延伸产物。泳道4:通过50mm tcep将泳道2中的产物(0.5μm)脱保护。泳道5:通过添加所有天然dntp在泳道4中延伸产物。
306.c)该图描绘了凝胶,其显示在掺入3
’‑
o-叠氮甲基-dttp后通过300mm tcep脱保护3
’‑
o-叠氮甲基的结果。泳道1:起始引物泳道2:在存在mn
2
下掺入3-o-叠氮甲基-dttp。泳道3:通过添加所有天然dntp在泳道2中延伸产物。泳道4:通过300mm tcep将泳道2中的产物(0.5μm)脱保护。泳道5:通过添加所有天然dntp在泳道4中延伸产物。
307.d)该图描绘了凝胶,其显示在掺入3
’‑
o-叠氮甲基-dctp后通过50mm tcep脱保护3
’‑
o-叠氮甲基的结果。泳道1:起始引物泳道2:在存在mn
2
下掺入3-o-叠氮甲基-dctp。泳道3:通过添加所有天然dntp在泳道2中延伸产物。泳道4:通过300mm tcep将泳道2中的产物(0.5μm)脱保护。泳道5:通过添加所有天然dntp在泳道4中延伸产物。
308.e)该图描绘了凝胶,其显示在掺入3
’‑
o-叠氮甲基-dctp后通过300mm tcep脱保护3
’‑
o-叠氮甲基的结果。泳道1:起始引物
309.泳道2:在存在mn
2
下掺入3-o-叠氮甲基-dctp。泳道3:通过添加所有天然dntp在泳道1中延伸产物。泳道4:通过300mm tcep将泳道1中的产物(0.5μm)脱保护。泳道5:通过添加所有天然dntp在泳道3中延伸产物。
310.f).该图描绘了凝胶,其显示在掺入3
’‑
o-叠氮甲基-datp后通过300mm tcep脱保护3
’‑
o-叠氮甲基的结果。
311.泳道1:起始引物
312.泳道2:在存在mn
2
下掺入3-o-叠氮甲基-datp。泳道3:通过添加所有天然dntp在泳道2中延伸产物。泳道4:通过300mm tcep将泳道2中的产物(0.5μm)脱保护。泳道5:通过添加所有天然dntp在泳道4中延伸产物。
313.g)该图描绘了凝胶,其显示在掺入3
’‑
o-叠氮甲基-dgtp后通过300mm tcep脱保护3
’‑
o-叠氮甲基的结果。泳道1:起始引物
314.泳道2:在存在mn
2
下掺入3-o-叠氮甲基-dgtp。泳道3:通过添加所有天然dntp在泳道2中延伸产物。泳道4:通过300mm tcep将泳道2中的产物(0.5μm)脱保护。泳道5:通过添加所有天然dntp在泳道4中延伸产物。
315.h)tcep在0.2μm dna上脱保护的效率。
316.i)用于研究裂解步骤的寡核苷酸。
317.图27.有双发夹模型的版本2化学-掺入。
318.a)以虚线框突出显示掺入步骤的方案。
319.b)对于与它的天然对应物相对掺入3
’‑
o-修饰的dttp评估dna聚合酶。该图描绘了
凝胶,其显示在37℃通过therminator ix dna聚合酶掺入3'-o-改性dttp的结果。泳道1:起始材料。泳道2:掺入天然dntp混合物。泳道3:通过therminator ix dna聚合酶掺入3
’‑
o-叠氮甲基-dttp。泳道4:通过添加所有天然dntp在泳道3中延伸产物。
320.c)对于与它的天然对应物相对掺入3
’‑
o-修饰的dttp评估dna聚合酶。适用于研究掺入步骤的寡核苷酸。
321.图28.有双发夹模型的版本2化学-裂解。
322.a)显示发夹寡核苷酸裂解的方案。裂解步骤以虚线框突出显示。
323.b)凝胶显示用endo v在37℃下裂解发夹寡核苷酸。泳道1.起始发夹寡核苷酸。作为在5分钟后的裂解的发夹寡核苷酸的泳道2显示出高产率的消化dna,比率为约98%。作为在10分钟后的裂解的发夹寡核苷酸的泳道3显示出高产率的消化dna,比率为约99%。作为在30分钟后的裂解的发夹寡核苷酸的泳道4显示出高产率的消化dna,比率为约99%,以及在作为在1小时后的裂解的发夹寡核苷酸的泳道5显示出高产率的消化dna,比率为约99%。
324.c)用于研究裂解步骤的寡核苷酸。
325.图29.利用双发夹模型的版本2化学-连接。
326.a)显示杂交发夹的连接的方案。在虚线框中突出显示连接步骤。
327.b)凝胶显示在存在辅助链的情况下在室温(24℃)下将发夹寡核苷酸用blunt/ta dna连接酶连接。泳道1含有起始发夹寡核苷酸。1分钟后连接的发夹寡核苷酸的泳道2显示出高产率的连接dna产物,比率为约85%。2分钟后连接的发夹寡核苷酸的泳道3显示出高产率的消化dna,比率为约85%。3分钟后连接的发夹寡核苷酸的泳道4显示出高产率的连接dna产物,比率为约85%。4分钟后连接的发夹寡核苷酸的泳道5显示高产率的连接dna产物,比率为约》85%。
328.c)用于研究连接步骤的发夹寡核苷酸。
329.图30.版本2化学-双发夹模型的完整循环。
330.a)显示涉及酶掺入、裂解、连接和脱保护步骤的完整循环的方案。
331.b)对于与它的天然对应物相对掺入3
’‑
o-修饰的dttp评估dna聚合酶。该图描绘了凝胶,其显示在37℃通过therminator ix dna聚合酶掺入3'-o-改性dttp的结果。泳道1:起始材料。泳道2:通过therminator ix dna聚合酶掺入3
’‑
o-叠氮甲基-dttp。泳道3:通过添加所有天然dntp在泳道2中延伸产物。泳道4:通过核酸内切酶v在泳道2中裂解产物。泳道5:通过钝性ta连接酶试剂盒在泳道4中连接产物。
332.c)适用于研究掺入步骤的寡核苷酸。
333.图31.版本2化学-使用辅助链的单发夹模型的完整循环。
334.a)显示涉及酶掺入、裂解、连接和脱保护步骤的完整循环的方案。
335.b)适用于研究掺入步骤的寡核苷酸。
336.图32.版本3化学-双发夹模型的完整循环。
337.a)显示涉及酶掺入、裂解、连接和脱保护步骤的完整循环的方案。
338.b)适用于研究掺入步骤的寡核苷酸。
339.图33.版本2化学-双发夹模型的完整双循环。
340.a)显示涉及酶促掺入、脱保护、裂解和连接步骤的第一个完整循环的方案。
341.b)显示第一个完整循环后的第二个完整循环的方案,涉及酶促掺入、脱保护、裂解
和连接步骤。
342.c)该图描绘了凝胶,其显示完整双循环实验,包括:掺入、脱保护、裂解和连接步骤。
343.泳道1.起始材料。
344.泳道2.用天然dntp延伸起始材料。
345.泳道3.通过therminator ix dna聚合酶掺入3
’‑
o-叠氮甲基-dttp。
346.泳道4.通过添加所有天然dntp在泳道3中延伸产物。
347.泳道5.tcep在泳道3将产物脱保护。
348.泳道6.通过添加所有天然dntp在泳道5中延伸产物。
349.泳道7.核酸内切酶v在泳道5中裂解产物。
350.泳道8.通过钝性ta连接酶试剂盒在泳道7中连接产物。
351.泳道9.通过λ核酸外切酶裂解泳道8中的产物。
352.泳道10.第二循环的起始材料-与泳道9中的材料相同。
353.泳道11.通过therminator ix dna聚合酶掺入3
’‑
o-叠氮甲基-dttp。
354.泳道12.通过添加所有天然dntp在泳道11中延伸产物。
355.泳道13.tcep在泳道11将产物脱保护。
356.泳道14.通过添加所有天然dntp在泳道13中延伸产物。
357.泳道15.核酸内切酶v在泳道13中裂解产物。
358.泳道16.通过钝性ta连接酶试剂盒在泳道15中连接产物。
359.d)用于研究的寡核苷酸。
360.图34.
361.显示从根据本文所述方法合成的预定序列的多核苷酸的支架多核苷酸释放机制的实施例。
362.图35.
363.用于根据本发明合成rna的示例性方法的示意图。示例性方法显示在不存在辅助链的情况下合成。
364.图36.
365.用于根据本发明合成rna的示例性方法的示意图。示例性方法显示在辅助链存在下的合成。
366.图37.
367.用于根据本发明合成rna的示例性方法的示意图。示例性方法显示在辅助链存在下的合成。
368.图38.
369.根据具有单发夹模型的合成方法版本2合成dna的示例性方法的第1个完整循环的示意图,包括在掺入步骤之前使辅助链变性的步骤。
370.图39.
371.根据具有单发夹模型的合成方法版本2合成dna的示例性方法的第2个完整循环的示意图,包括在掺入步骤之前使辅助链变性的步骤。
372.图40.
373.根据具有单发夹模型的合成方法版本2合成dna的示例性方法的第3个完整循环的示意图,包括在掺入步骤之前使辅助链变性的步骤。
374.图41.
375.实施例9中详述的实验中使用的寡核苷酸。
376.图42.
377.显示对应于实施例9中详述的完整三循环实验的反应产物的凝胶。
378.该图描绘了凝胶,其显示了完整的三循环实验的结果,包括:掺入、解封闭、裂解和连接步骤。
379.泳道1:起始材料。
380.泳道2.用天然dntp延伸起始材料
381.泳道3:通过therminator x dna聚合酶掺入3
’‑
o-叠氮甲基-dttp。
382.泳道4:通过添加所有天然dntp延伸泳道3中的产物
383.泳道5:tcep在泳道3中对产物进行解封闭
384.泳道6:通过添加所有天然dntp延伸泳道5中的产物。
385.泳道7:核酸内切酶v对泳道5中的产物的裂解。
386.泳道8:通过t3 dna连接酶在泳道7中连接产物
387.泳道9:第2循环的起始材料-与泳道9中的材料相同。
388.泳道10:通过添加所有天然dntp在泳道9中延伸产物。
389.泳道11:通过therminator x dna聚合酶掺入3
’‑
o-叠氮甲基-dttp。
390.泳道12:通过添加所有天然dntp在泳道11中延伸产物。
391.泳道13:tcep在泳道11中对产物进行解封闭
392.泳道14:通过添加所有天然dntp在泳道13中延伸产物。
393.泳道15:核酸内切酶v在泳道13中裂解产物
394.泳道16:通过t3 dna连接酶在泳道15中连接产物
395.泳道17:第3循环的起始材料-与泳道16中的材料相同。
396.泳道18:通过添加所有天然dntp在泳道17中延伸产物。
397.泳道19:通过therminator x dna聚合酶掺入3
’‑
o-叠氮甲基-dttp。
398.泳道20:通过添加所有天然dntp在泳道19中延伸产物。
399.泳道21:tcep在泳道19中对产物进行解封闭
400.泳道22:通过添加所有天然dntp在泳道21中延伸产物。
401.泳道23:核酸内切酶v在泳道21中裂解产物
402.泳道24:通过t3 dna连接酶在泳道23中连接产物
403.图43.
404.来自聚丙烯酰胺凝胶表面的荧光信号掺杂不同量的brapa,其暴露于fitc-peg-sh和fitc-peg-cooh。
405.图44.
406.测量来自聚丙烯酰胺凝胶表面上的荧光素通道的荧光信号,其掺杂不同量的brapa,其暴露于fitc-peg-sh和fitc-peg-cooh。
407.图45.
408.(a)显示没有接头固定在不同的样品上的发夹dna的序列。
409.(b)显示接头固定在不同样品上的发夹dna的序列。
410.图46.
411.来自具有和不具有固定到溴乙酰基官能化的聚丙烯酰胺表面上的接头的发夹dna寡聚体的荧光信号。
412.图47.
413.来自具有和不具有固定到溴乙酰基官能化的聚丙烯酰胺表面上的接头的发夹dna寡聚体的所测量的荧光。
414.图48.
415.在掺入三磷酸盐后,来自发夹dna寡聚体的荧光信号,有和没有接头固定在溴乙酰基官能化的聚丙烯酰胺表面上。
416.图49.
417.在掺入三磷酸盐之后,测量来自发夹dna寡聚体的荧光,其中有和没有接头固定在溴乙酰基官能化的聚丙烯酰胺表面上。
418.图50.
419.(a)如实施例12中详述的每个反应步骤的实验概述和结果。
420.(b)实施例12中详述的实验中使用的寡核苷酸。
421.图51.
422.显示在裂解反应之前和之后来自发夹dna寡聚体的荧光信号(实施例12)。
423.图52.
424.显示在裂解反应之前和之后测量的来自发夹dna寡聚体的荧光信号(实施例12)。
425.图53.
426.显示含肌苷的链和用于连接反应的互补“辅助”链的序列(实施例12)。
427.图54.
428.与来自对应于连接反应监测的发夹dna寡聚体的荧光信号有关的结果(实施例12)。
429.图55.
430.与来自对应于连接反应监测的发夹dna寡聚体的所测量荧光相关的结果(实施例12)。
431.图56.
432.关于使用根据本发明方法的掺入步骤,例如本发明的合成方法版本1、2、3和4及其变体,通过therminator x dna聚合酶掺入3'-o-修饰的-dntp的结果(图1至10和实施例13)。
433.图56a提供了引物链(合成链的引物链部分;seq id no:68)和模板链(支持链;seq id no:69)的核酸序列。
434.图56b描绘了示出在37℃下在存在mn2 离子的情况下通过therminator x dna聚合酶掺入3
’‑
o-修饰的-dntp的结果的凝胶。
435.泳道1:起始寡核苷酸。
436.泳道2:掺入3'-o-叠氮甲基-dttp(效率》99%)
437.泳道3:3'-o-叠氮甲基-datp的掺入(效率>99%)。
438.泳道4:掺入3'-o-叠氮甲基-dctp(效率>90%)。
439.泳道5:掺入3'-o-叠氮甲基-dgtp(效率>99%)。
440.添加后,新添加的3'-o-修饰的-dntp在引物链部分中占据位置n。引物链部分中的下一核苷酸位置称为n-1。
441.图57.
442.该图示出描绘如实施例14中所述的dna合成反应循环的方案。
443.图58.
444.该图示出在实施例14中描述的实验中使用的寡核苷酸。
445.图59.
446.该图示出展示了包含2-脱氧肌苷(用作通用核苷酸)的多核苷酸连接分子与发夹支架多核苷酸的连接结果的凝胶照片,如实施例14中所述。泳道1示出起始发夹支架多核苷酸并且泳道2示出连接至多核苷酸连接分子的发夹支架多核苷酸。
447.图60和61.
448.该图示出描绘如实施例15所述的dna合成反应循环的方案。
449.图62.
450.该图示出在实施例15中描述的实验中使用的寡核苷酸。
451.图63.
452.该图示出展示了包含2-脱氧肌苷(用作通用核苷酸)的多核苷酸连接分子与发夹支架多核苷酸的连接结果的凝胶照片,如实施例15中所述。凝胶的泳道如下:
453.泳道1:起始发夹支架多核苷酸。
454.泳道2:连接至多核苷酸连接分子的发夹支架多核苷酸(1碱基t突出端)。
455.泳道3:连接至多核苷酸连接分子的发夹支架多核苷酸(1碱基c突出端)。
456.泳道4:起始发夹支架多核苷酸。
457.泳道5:连接至多核苷酸连接分子的发夹支架多核苷酸(2碱基突出端)。
458.泳道6:连接至多核苷酸连接分子的发夹支架多核苷酸(3碱基突出端)。
459.泳道7:连接至多核苷酸连接分子的发夹支架多核苷酸(4碱基突出端)。
460.图64.
461.(a)该图示出在辅助链的存在下通过包含尿苷的多核苷酸连接分子的平末端连接将单个鸟苷核苷酸插入发夹多核苷酸的3’末端,然后在尿苷的位置上进行多核苷酸的位点特异性裂解(实施例16)。
462.(b)该图示出展示了将包含2-脱氧尿苷(用作通用核苷酸)的多核苷酸连接分子连接至平末端发夹的3’末端,然后对含有尿苷的连接的寡核苷酸进行裂解的结果的凝胶照片,如实施例16中所示。
463.泳道1:示出起始平末端发夹多核苷酸。
464.泳道2:示出使用t3 dna连接酶连接至多核苷酸连接分子的发夹支架多核苷酸。
465.泳道3:示出使用尿嘧啶dna糖基化酶和ap核酸内切酶i的混合物的裂解的多核苷酸。
466.(c)该图示出在实施例16中详细描述的实验中使用的寡核苷酸。
467.图65
468.(a)该图示出在辅助链的存在下,通过连接至具有3’单碱基突出端的发夹多核苷酸的5’末端,将单个胞苷核苷酸插入合成链中,然后在肌苷位置3’的第2个磷酸二酯键处进行多核苷酸的位点特异性裂解(实施例17)。
469.(b)该图示出展示了将包含2-脱氧肌苷(用作通用核苷酸)的多核苷酸连接分子连接至突出发夹的5’末端,然后对含有肌苷的连接的寡核苷酸进行裂解的结果的凝胶照片,如实施例17中所示。
470.泳道1:示出起始3’单碱基突出的发夹多核苷酸。
471.泳道2:示出使用t3 dna连接酶连接至多核苷酸连接分子的发夹多核苷酸。
472.泳道3:示出使用核酸内切酶v的裂解的多核苷酸。
473.(c)该图示出在实施例17中详细描述的实验中使用的寡核苷酸。
474.图66
475.(a)该图示出在辅助链的存在下,通过连接至平末端发夹多核苷酸的5’末端,将单个胞苷核苷酸插入合成链中,然后在尿苷位置3’的第1个键处进行多核苷酸的位点特异性裂解(实施例18)。
476.(b)该图示出展示了将包含2-脱氧尿苷(用作通用核苷酸)的多核苷酸连接分子连接至平末端发夹的5’末端,然后对含有尿嘧啶的连接的寡核苷酸进行裂解的结果的凝胶照片,如实施例18中所示。
477.泳道1:示出起始平末端发夹多核苷酸。
478.泳道2:示出使用t3 dna连接酶连接至多核苷酸连接分子的发夹多核苷酸。
479.泳道3:示出使用尿嘧啶dna糖基化酶和核酸内切酶viii的混合物的裂解的多核苷酸。
480.(c)该图示出在实施例18中详细描述的实验中使用的寡核苷酸。
481.图67
482.(a)该图示出在辅助链的存在下,通过连接至具有5’单碱基突出端的发夹多核苷酸的3’末端,将单个胍核苷酸插入合成链中,然后在尿苷位置5’的第1个磷酸二酯键处进行多核苷酸的位点特异性裂解(实施例19)。
483.(b)该图示出展示了将包含2-脱氧尿苷(用作通用核苷酸)的多核苷酸连接分子连接至突出发夹的3’末端,然后对含有尿嘧啶的连接的寡核苷酸进行裂解的结果的凝胶照片,如实施例19中所示。
484.泳道1:示出起始5’单碱基突出的发夹多核苷酸。
485.泳道2:示出使用t3 dna连接酶连接至多核苷酸连接分子的连接的发夹多核苷酸。
486.泳道3:示出使用ap核酸内切酶i的裂解的多核苷酸。
487.(c)该图示出在实施例19中详细描述的实验中使用的寡核苷酸。
488.图68
489.(a)该图示出一个方案,其描绘了在辅助链的存在下,通过连接至具有5’单碱基突出端的发夹多核苷酸的3’末端,将单个胍核苷酸插入合成链中,然后在尿苷位置5’和3’两者的第1个磷酸二酯键处进行多核苷酸的位点特异性裂解,留下与发夹多核苷酸的3’末端附接的磷酸(实施例20)。
490.(b)该图示出展示了将包含2-脱氧尿苷(用作通用核苷酸)的多核苷酸连接分子连接至突出发夹的3’末端,然后对含有尿嘧啶的连接的寡核苷酸进行裂解的结果的凝胶照片,如实施例20中所示。
491.泳道1:示出起始3’单碱基突出的发夹多核苷酸。
492.泳道2:示出使用t3 dna连接酶连接至多核苷酸连接分子的连接的发夹多核苷酸。
493.泳道3:示出使用尿嘧啶dna糖基化酶和核酸内切酶viii的混合物的裂解的多核苷酸。
494.(c)该图示出在实施例20中详细描述的实验中使用的寡核苷酸。
495.图69
496.(a)该图示出通过核酸内切酶iv从平末端发夹多核苷酸中去除3
’‑
磷酸,然后将多核苷酸连接分子连接至平末端发夹多核苷酸的3’末端。进行多核苷酸连接分子与3
’‑
磷酸化的平末端多核苷酸的连接作为负对照(实施例21)。
497.(b)该图示出展示了多核苷酸连接分子与未去磷酸化和去磷酸化的平末端发夹多核苷酸的连接结果的凝胶照片。
498.泳道1:示出起始平末端发夹多核苷酸。
499.泳道2:示出多核苷酸连接分子与未去磷酸化的(即磷酸化的)平末端发夹多核苷酸的连接
500.泳道3:示出使用核酸内切酶iv的去磷酸化的发夹寡核苷酸。
501.泳道4:示出使用t3 dna连接酶将多核苷酸连接分子连接至去磷酸化的平末端发夹多核苷酸。
502.(c)该图示出在实施例21中详细描述的实验中使用的寡核苷酸。
503.附图的解释。
504.图16、17a、18a、19a、20a、21a、22a、23a、24a、25a、26a、27a、28a、29a、30a、31a、32a、33a、33b、34、35、36、37、38、39和40中所描绘的结构将与图11、12、13、14和15中所描绘的结构一致地解释。因此,在这些图中,双链支架多核苷酸分子的每条左手链均与支持链相关(对应于图11至15中的链“a”);双链支架多核苷酸分子的每条右手链均与合成链相关(对应于图11至15中的链“b”);所有支架多核苷酸分子均包含下合成链,其对应于包含引物链部分的链(对应于图6至10的链“b”的实线和点线);在掺入新核苷酸之前,示出某些支架多核苷酸分子(例如,在图20a和28a中),其具有上合成链,所述上合成链对应于包含辅助链部分的链(对应于图11至15中的链“b”的虚线);某些支架多核苷酸分子(例如在图17a、18a和19a中)示出为没有辅助链部分(对应于在图11至15中不存在链“b”的虚线);并且在连接步骤之后,示出某些支架多核苷酸分子(例如在图38、39和40中),其具有上合成链,所述上合成链对应于包含辅助链部分的链(对应于图11至15中的链“b”的虚线),并且其中在下一合成循环中在掺入新核苷酸之前去除辅助链部分。
505.此外,在这些图中,在适当的位置,每个新核苷酸均示出为与可逆终止子基团一起掺入,标记为rtntp,并描绘为小的圆形结构(对应于图11至15中的小三角形结构),并且末端磷酸基团标记为“p”且描绘为小的椭圆形结构。
506.图16c、16d、16g、16h、27a、28a、29a、30a、32a、33a、33b和34示出支架多核苷酸分子,其中包含辅助链部分的链和支持链通过发夹环连接。图16b、27a、28a、29a、30a、31a、
32a、33a、33b、34、38、39和40示出支架多核苷酸分子,其中包含引物链部分的链和支持链通过发夹环连接。
507.诸如图32a和33a的附图示出支架多核苷酸分子,其中包含辅助链部分的链(右上链)和支持链(左上链)通过发夹环连接,并且在同一分子中,包含引物链部分的链(右下链)和支持链(左下链)通过发夹环连接。关于这些附图和相应的方法,对被称为支架多核苷酸分子、支持链、合成链、引物链部分、辅助链部分和多核苷酸连接分子的结构,以及与掺入支架多核苷酸分子中有关的方法或包含可逆终止子基团的核苷酸的完整解释提供于国际专利申请公布wo2018/134616中。
具体实施方式
508.本发明提供了根据预定的核苷酸序列从头合成多核苷酸分子的方法。合成的多核苷酸优选为dna,并且优选为双链多核苷酸分子。与现有的合成方法相比,本发明提供了优点。例如,所有反应步骤可以在温和ph的含水条件下进行,不需要广泛的保护和脱保护程序。此外,合成不依赖于复制包括预定的核苷酸序列的预先存在的模板链。
509.本发明人已经确定,如本文所定义的“通用核苷酸”的使用允许在合成区域内产生多核苷酸裂解位点,这促进合成的裂解和重复循环。本发明提供了用于合成多核苷酸和用于组装包括此类合成多核苷酸的大片段的通用方法。
510.通过参考本发明的示例性合成方法版本及其某些变体(图1至图10及其描述),本文将更一般性地详细描述本发明的合成方法的某些实施方案。应当理解,包括本发明的示例性方法版本及其变体在内的所有示例性方法均不旨在限制本发明。本发明提供了合成具有预定序列的双链多核苷酸分子的体外方法,该方法包括执行合成循环,其中在每个循环中,通过掺入预定序列的第一核苷酸来延伸第一多核苷酸链,并且然后通过掺入预定序列的第二核苷酸来延伸与第一链杂交的第二多核苷酸链。优选地,所述方法用于合成dna。提供本文描述的具体方法作为本发明的实施方案。
511.反应条件
512.在一个方面,本发明提供了合成具有预定序列的双链多核苷酸的方法。
513.合成在适合于双链多核苷酸内的核苷酸杂交的条件下实施。通常在允许核苷酸与互补核苷酸杂交的条件下使多核苷酸与试剂接触。允许杂交的条件是本领域公知的(例如,sambrook等人,2001,molecular cloning:a laboratory manual,第3版,cold spring harbour laboratory press;和current protocols in molecular biology,greene publishing and wiley-lnterscience,new york(1995))。
514.多核苷酸的裂解可以在合适的条件下进行,例如在合适的缓冲溶液存在下,在与酶相容的温度(例如37℃)下使用多核苷酸裂解酶(例如核酸内切酶)。在一个实施方案中,缓冲溶液可包括5mm乙酸钾、2mm tris-乙酸盐、1mm乙酸镁和0.1mm dtt。
515.多核苷酸的连接可以在合适的条件下进行,例如在合适的缓冲溶液存在下,在与酶相容的温度(例如室温)下使用连接酶(例如t4 dna连接酶)。在一个实施方案中,缓冲溶液可以包括4.4mm tris-hcl、7mm mgcl2、0.7mm二硫苏糖醇、0.7mm atp、5%聚乙二醇(peg6000)。
516.锚多核苷酸和支架多核苷酸
517.具有预定序列的双链多核苷酸通过本发明的方法通过将预定核苷酸掺入预先存在的多核苷酸中来合成,所述多核苷酸在本文称为支架多核苷酸,其可附接于或能够附接于表面,如本文所述。如本文更详细描述的,支架多核苷酸形成支持结构以容纳新合成的多核苷酸,并且如从本文的描述中显而易见的,其不包括如常规合成方法中那样复制的预先存在的模板链。如果支架多核苷酸附接于表面,则支架多核苷酸可称为锚多核苷酸。本文更详细地描述了用于将支架多核苷酸附接到表面以形成锚多核苷酸的表面附接化学。
518.支架多核苷酸包含与互补的第二链杂交的第一链(例如参见图1至10)。可提供与互补的第二链杂交的第一链。可替代地,可分开提供第一链和第二链,然后使其杂交。
519.可提供支架多核苷酸,其中第一和第二链中的每一个在相邻末端不连接。支架多核苷酸可具有在支架多核苷酸的两个末端诸如通过发夹环在相邻末端连接的第一和第二链。支架多核苷酸可具有在支架多核苷酸的一个末端诸如通过发夹环或任何其它合适的接头在相邻末端连接的第一和第二链。
520.如本文更详细描述的,可以将具有或不具有发夹的支架多核苷酸固定在固体支撑件或表面上(参见图12)。
521.术语“发夹”或“发夹环”通常用于当前技术领域。术语“发夹环”通常也称为“茎环”。这些术语是指多核苷酸中的二级结构区域,其包括未配对核碱基的环,当多核苷酸分子的一条链由于分子内碱基配对而与相同链的另一部分杂交时形成。因此发夹可以类似于u形结构。这种结构的实施例如图12所示。
522.在本文所述的方法中,第一延伸步骤通过第一延伸/连接反应进行,从而在连接酶的作用下将预定序列的第一核苷酸或第一和第二核苷酸掺入支架多核苷酸的第一链中。因此,如本文进一步描述,预定序列的第一核苷酸或第一和第二核苷酸连接至支架多核苷酸的第一链的末端核苷酸。预定序列的第一核苷酸或预定序列的第一和第二核苷酸由包含合成链、辅助链和互补连接末端的第一多核苷酸连接分子提供。预定序列的第一核苷酸或预定序列的第一和第二核苷酸作为互补连接末端的合成链的末端核苷酸提供。
523.在第一延伸/连接反应之后,进行第一裂解步骤,如本文更详细地描述的,以从支架多核苷酸中释放第一多核苷酸连接分子,并且由此第一多核苷酸连接分子的预定序列的第一核苷酸或第一和第二核苷酸保持附接于支架多核苷酸的第一链。
524.在第一裂解步骤之后,在第二延伸/连接反应中进行第二延伸步骤,从而通过连接酶的作用将预定序列的第一核苷酸或第一和第二核苷酸掺入支架多核苷酸的第二链中。因此,如本文进一步描述的,将待掺入第二链的预定序列的第一核苷酸或第一和第二核苷酸连接至支架多核苷酸的第二链的末端核苷酸。待掺入第二链的预定序列的第一核苷酸或预定序列的第一和第二核苷酸由包含合成链、辅助链和互补连接末端的第二多核苷酸连接分子提供。待掺入第二链的预定序列的第一核苷酸或预定序列的第一和第二核苷酸作为互补连接末端的合成链的末端核苷酸提供。
525.在第二延伸/连接反应之后,进行第二裂解步骤,如本文更详细地描述的,以从支架多核苷酸中释放第二多核苷酸连接分子,并且由此第二多核苷酸连接分子的预定序列的第一核苷酸或第一和第二核苷酸保持附接于支架多核苷酸的第二链。
526.在第一和第二多核苷酸连接分子中,互补连接末端处辅助链的末端核苷酸是不可连接的核苷酸。如果在辅助链的5’末端提供不可连接的核苷酸,则其通常被提供为缺少磷
酸基团。这防止了辅助链的末端核苷酸与支架多核苷酸的第一或第二链的末端核苷酸连接,并且在连接后在辅助链与第一或第二链之间产生单链断裂位点。单链断裂的产生和维持可以通过其它方式实现。例如,辅助链的5’末端核苷酸可具有任何合适的5’封闭基团,其阻止与第一或第二链的连接。如果在辅助链的3’末端提供不可连接的核苷酸,则其通常作为不可连接的核苷酸提供,包括不可连接的2’,3
’‑
双脱氧核苷酸或2
’‑
脱氧核苷酸,或包括任何其它合适的3’不可连接的核苷酸。
527.本文进一步提供了示例性方法的一般方法方案的更多细节。
528.支架多核苷酸的第一和第二链
529.如本文进一步描述的,支架多核苷酸的第一和第二链应适合于允许具有连接酶活性的酶催化多核苷酸连接分子与支架多核苷酸的连接。此外,如果期望任一链的进一步延伸,则支架多核苷酸的第一和第二链应适合于允许酶(诸如聚合酶或具有末端转移酶活性的酶)起始合成,即催化在支架多核苷酸的末端添加新核苷酸。
530.对支架多核苷酸的第一或第二链的长度、序列和结构的参数没有特殊要求,只要支架多核苷酸的第一和第二链适合于促进如本文进一步描述的连接,并在期望时引发如本文进一步描述的新多核苷酸合成即可。
531.第一和第二链可包含核苷酸、核苷酸类似物/衍生物和/或非核苷酸。
532.本领域技术人员能够容易地构建包含第一和第二链的支架多核苷酸,其将适合于促进如本文进一步描述的连接,并且在期望时能够引发如本文进一步描述的新多核苷酸合成。在待延伸的支架多核苷酸末端应避免与支持链错配,应避免富含gc和at的区域,此外,应避免二级结构区域,诸如可能干扰连接和/或其它延伸的发夹或凸起。
533.在开始合成之前,支架多核苷酸的第一和第二链的长度可以由技术人员根据偏好和待使用的连接酶来选择。
534.第一链必须与第二链的相应区域杂交。不必须使整个第一链与第二链的相应区域杂交,只要第一和第二链适合于如本文所述的连接,或在期望时能够引发如本文进一步描述的新多核苷酸合成即可。因此,可以在一定程度上容许第一链与第二链的相应区域之间的错配。优选地,第一和第二链的序列在待延伸的支架多核苷酸末端处的区域应包含与支持链中的相应核碱基互补的核碱基。
535.第一链可在不被延伸的支架多核苷酸末端连接至第二链的相应区域,例如通过发夹。
536.核苷酸和通用核苷酸
537.可以通过本文描述的任何方法掺入合成多核苷酸中的核苷酸可以是核苷酸、核苷酸类似物和修饰的核苷酸。
538.核苷酸可包括天然核碱基或非天然核碱基。核苷酸可含有天然核碱基、糖和磷酸基团。天然核碱基包括腺苷(a)、胸腺嘧啶(t)、尿嘧啶(u)、鸟嘌呤(g)和胞嘧啶(c)。可以进一步修饰核苷酸的一种组分。
539.核苷酸类似物是在碱基、糖或磷酸盐或其组合中在结构上被修饰并且仍然是聚合酶可接受作为掺入寡核苷酸链的底物的核苷酸。
540.非天然核碱基可以是在一定程度上将与靶多核苷酸中的所有核碱基键合例如氢键合的核碱基。非天然核碱基优选地是在某种程度上与包括核苷腺苷(a)、胸腺嘧啶(t)、尿
嘧啶(u)、鸟嘌呤(g)和胞嘧啶(c)的核苷酸键合例如氢键合的核碱基。
541.非天然核苷酸可以是肽核酸(pna)、锁核酸(lna)和解锁核酸(una)、桥接核酸(bna)或吗啉代、硫代磷酸酯或甲基膦酸酯。
542.非天然核苷酸可以包括经修饰的糖和/或经修饰的核碱基。经修饰的糖包含但不限于2'-o-甲基核糖。经修饰的核碱基包含但不限于甲基化的核碱基。核碱基的甲基化是表观遗传修饰的公认形式,其具有改变基因和其它元件(如微rna)的表达的能力。核碱基的甲基化发生在离散的基因座处,所述基因座主要是由cpg基序组成的二核苷酸,但也可以在chh基序(其中h是a、c或t)处发生。通常,在甲基化过程中,将甲基加到胞嘧啶碱基的第五个碳上以产生甲基胞嘧啶。因此,修饰的核碱基包含但不限于5-甲基胞嘧啶。
543.预定序列的核苷酸可以与配偶体核苷酸相对掺入以形成核苷酸对。配偶体核苷酸可以是互补核苷酸。互补核苷酸为在一定程度上能够键结,例如氢键结到预定序列的核苷酸的核苷酸。
544.通常,将预定序列的核苷酸掺入多核苷酸中与天然互补的配偶体核碱基相对。因此,可以掺入腺苷,与胸腺嘧啶相对,反之亦然。可以掺入鸟嘌呤,与胞嘧啶相对,反之亦然。可替代地,可以掺入预定序列的核苷酸,与其在一定程度上将键合例如氢键合的配偶体核碱基相对。
545.或者,配偶体核苷酸可以是非互补核苷酸。非互补核苷酸是这样的核苷酸,其不能够键结,例如氢键结到预定序列的核苷酸。因此,预定序列的核苷酸可以与配偶体核苷酸相对掺入以形成错配,条件是合成的多核苷酸总体上是双链的,并且其中第一链通过杂交与第二链连接。
546.术语“相对”应理解为涉及所述术语在核酸生物化学领域中的正常使用,并且具体地涉及常规的watson-crick碱基配对。因此,序列5'-acga-3'的第一核酸分子可与序列5'-tcgt-3'的第二核酸分子形成双链体,其中第一分子的g将位于与第二分子的c相对并与之形成氢键。序列5'-atga-3'的第一核酸分子可以与序列5'-tcgt-3'的第二核酸分子形成双链体,其中第一分子的t与第二分子的g错配,但仍然位于与其相对,并将作为配偶体核苷酸。所述原理适用于本文公开的任何核苷酸配偶体对关系,包含包括通用核苷酸的配偶体对。
547.在本文所述的所有方法中,第一链中的位置和第二链中的相对位置被指定为位置编号“n”。该位置是指核苷酸在支架多核苷酸的第一链中的位置,所述位置在任何给定的合成循环的第一延伸/连接反应中是支架多核苷酸的第一链中被预定序列的第一核苷酸占据或将被其占据(在该循环中或在后续循环的掺入步骤中将其添加到第一链的末端时)的核苷酸位置。位置“n”还指在连接步骤之前多核苷酸连接分子的合成链中的位置,所述位置是在将第一多核苷酸连接分子连接至支架多核苷酸之前,在任何给定合成循环的第一延伸/连接反应期间将被添加至第一链末端的第一核苷酸所占据的核苷酸位置。
548.第一链中的上述位置和第二链中的相对位置都可以称为位置n。
549.参考图1至图6及其相对于本发明的示例性合成方法版本及其在此更详细描述的变型的描述,提供了关于位置“n”的定义的更多细节。
550.核苷酸和核苷酸类似物可以优选作为核苷三磷酸提供。因此,在本发明的任何方法中,为了合成dna多核苷酸,可以从2
′‑
脱氧核糖核苷-5
′‑
o-三磷酸(dntp)中掺入核苷酸,
例如通过dna聚合酶的作用或通过具有脱氧核苷酸末端转移酶活性的酶的作用。在本发明的任何方法中,为了合成rna多核苷酸,可以将核苷酸掺入核糖核苷5
′‑
o-三磷酸(ntp),例如通过rna聚合酶的作用或例如通过具有核苷酸末端转移酶活性的酶的作用。三磷酸可以被四磷酸或五磷酸(一般低聚磷酸)取代。这些低聚磷酸可以被其它烷基或酰基取代:
[0551][0552]
本发明的示例性方法使用通用核苷酸。如本文进一步描述的,通用核苷酸可用于限定裂解位点。如果期望,通用核苷酸也可作为预定核苷酸序列的组分掺入支架多核苷酸的第一和/或第二链中。
[0553]
通用核苷酸是其中核碱基将在某种程度上与预定序列的任何核苷酸的核苷碱基键结,例如氢键结的核苷酸。通用核苷酸优选地是在某种程度上与包括核苷腺苷(a)、胸腺嘧啶(t)、尿嘧啶(u)、鸟嘌呤(g)和胞嘧啶(c)的核苷酸键合例如氢键合的核碱基。与其它核苷酸相比,通用核苷酸可以更强地与一些核苷酸结合。例如,包括核苷、2'-脱氧肌苷的通用核苷酸(i)将示出i-c》i-a》i-g约=i-t的配对的优先顺序。
[0554]
可能的通用核苷酸的实施例是肌苷或硝基吲哚。通用核苷酸优选地包括以下核碱基中的一个:次黄嘌呤、4-硝基吲哚、5-硝基吲哚、6-硝基吲哚、3-硝基吡咯、硝基咪唑、4-硝基吡唑、4-硝基苯并咪唑、5-硝基吲唑、4-氨基苯并咪唑或苯基(c6-芳环)。通用核苷酸更优选地包括以下核苷之一:2'-脱氧肌苷、肌苷、7-脱氮-2'-脱氧肌苷、7-脱氮-肌苷、2-氮杂-脱氧肌苷、2-氮杂-肌苷、4-硝基吲哚2'-脱氧核糖核苷、4-硝基吲哚核糖核苷、5-硝基吲哚2'脱氧核糖核苷、5-硝基吲哚核糖核苷、6-硝基吲哚2'脱氧核糖核苷、6-硝基吲哚核糖核苷、3-硝基吡咯2'脱氧核糖核苷、3-硝基吡咯核糖核苷、次黄嘌呤的非环糖类似物、硝基咪唑2'脱氧核糖核苷、硝基咪唑核糖核苷、4-硝基吡唑2'脱氧核糖核苷、4-硝基吡唑核糖核苷、4-硝基苯并咪唑2'脱氧核糖核苷、4-硝基苯并咪唑核糖核苷、5-硝基吲唑2'脱氧核糖核苷、5-硝基吲唑核糖核苷、4-氨基苯并咪唑2'脱氧核糖核苷、4-氨基苯并咪唑核糖核苷、苯基c-核糖核苷或苯基c-2'-脱氧核糖基核苷。
[0555]
通用碱基的一些实施例如下所示:
[0556][0557][0558]
还可以使用掺入可裂解碱基的通用核苷酸,包含光可裂解碱基和酶可裂解碱基,所述碱基的一些实施例如下所示。
[0559]
光可裂解碱基:
[0560][0561]
可通过核酸内切酶iii裂解的碱基类似物:
[0562][0563]
可通过甲酰胺基嘧啶dna糖基化酶(fpg)裂解的碱基类似物:
[0564][0565]
可通过8-氧代鸟嘌呤dna糖基化酶(hogg1)裂解的碱基类似物:
[0566]
可通过hneil1裂解的碱基类似物:
[0567][0568]
可通过胸腺嘧啶dna糖基化酶(tdg)裂解的碱基类似物:
[0569]
可通过人类烷基腺嘌呤dna糖基化酶(haag)裂解的碱基类似物:
[0570][0571][0572]
可通过尿嘧啶dna糖基化酶裂解的碱基:
[0573][0574]
可通过人类单链选择性单功能的尿嘧啶-dna糖基化酶(smug1)裂解的碱基:
[0575][0576]
可通过5-甲基胞嘧啶dna糖基化酶(ros1)裂解的碱基:
[0577][0578]
(参见s.s.david,s.d.williams chemical reviews 1998,98,1221-1262和m.i.ponferrada-mar
í
n,t.rold
á
n-arjona,r.r.ariza’nucleic acids res 2009,37,4264-4274)。
[0579]
在涉及支架多核苷酸的任何方法中,通用核苷酸最优选包括2'-脱氧肌苷。
[0580]
可以使用本文描述的任何合成方法掺入的表观遗传碱基的实施例包括以下:
[0581][0582]
可以使用本文描述的任何合成方法掺入的修饰碱基的实施例包括以下:
[0583][0584]
可使用本文所述的任何合成方法掺入的卤代碱基的实施例包括以下:
[0585][0586]
其中r1=f、cl、br、i、烷基、芳基、荧光标记、氨基炔丙基、氨基烯丙基。
[0587]
其可以使用本文描述的任何合成方法掺入的可以用于例如附接/接头化学的氨基修饰的碱基的实施例包括以下:
[0588][0589]
其中碱基=a、t、g或c,具有炔烃或烯烃接头。
[0590]
其可以使用本文描述的任何合成方法掺入的可以用于例如点击化学的修饰的碱基的实施例包括以下:
[0591]
[0592]
可以使用本文描述的任何合成方法掺入的生物素修饰的碱基的实施例包括以下:
[0593][0594]
其中碱基=a、t、g或c,具有炔烃或烯烃接头。
[0595]
可以使用本文所述的任何合成方法掺入的带有荧光团和猝灭剂的碱基的实施例包括以下:
[0596][0597]
核苷酸掺入酶
[0598]
在本文所述的任何方法中,可能期望拷贝一条或两条合成链。例如,可在合成之后将支架多核苷酸的第一和第二链分离,可丢弃一条链而可拷贝另一条链以提供具有与被拷贝的模板链互补的核苷酸序列的拷贝链。可能期望拷贝两条链,诸如在扩增反应,例如pcr,或如本文进一步描述的任何替代方法中。在任何这样的方法中,可提供聚合酶来拷贝模板链。
[0599]
在某些情况下,可能期望掺入如本文所述的具有附接的可逆终止子基团的核苷酸,在这种情况下,可基于聚合酶掺入修饰核苷酸的能力来选择所述聚合酶。
[0600]
因此,聚合酶可以是修饰的聚合酶,其与未修饰聚合酶相比掺入包含可逆终止子基团的核苷酸的能力增强。聚合酶更优选地是来自嗜热球菌属(thermococcus)物种9
°
n,优选地物种9
°
n-7的天然dna聚合酶的基因工程变体。修饰的聚合酶的实施例是可从new england biolabs获得的therminator ix dna聚合酶和therminator x dna聚合酶。该酶具有增强的掺入3'-o-修饰的dntp的能力。可用于在本发明的任何方法中掺入可逆终止子dntp的其它聚合酶的实施例是deep vent(exo-)、vent
[0601]
(exo-)、9
°
n dna聚合酶、therminator dna聚合酶、therminator ix dna聚合酶、therminator x dna聚合酶、klenow片段(exo-)、bst dna聚合酶、bsu dna聚合酶、sulfolobus dna聚合酶i和taq聚合酶。
[0602]
可以用于拷贝模板链的聚合酶的实施例是t3 rna聚合酶、t7 rna聚合酶、sp6 rna聚合酶、polλ、polμ或φ29dna聚合酶。
[0603]
为了拷贝包含dna的模板链,可使用dna聚合酶。可以使用任何合适的dna聚合酶。dna聚合酶可以是例如bst dna聚合酶全长、bst dna聚合酶大片段、bsu dna聚合酶大片段、大肠杆菌dna聚合酶dna pol i大(克列诺(klenow))片段、m-mulv逆转录酶、phi29dna聚合酶、硫化叶菌dna聚合酶iv、taq dna聚合酶、t4 dna聚合酶、t7 dna聚合酶和具有逆转录酶
活性的酶,例如m-mulv逆转录酶。dna聚合酶可能缺乏3'到5'核酸外切酶活性。可以使用任何这种合适的聚合酶。这种dna聚合酶可以是例如bst dna聚合酶全长、bst dna聚合酶大片段、bsu dna聚合酶大片段、dna pol i大(克列诺)片段(3
’→5’
体外-)、m-mulv逆转录酶、硫化叶菌dna聚合酶iv、taq dna聚合酶。dna聚合酶可具有链置换活性。可以使用任何这种合适的聚合酶。这种dna聚合酶可以是例如bst dna聚合酶大片段、bsu dna聚合酶大片段、dna pol i大(克列诺)片段(3
’→5’
体外-)、m-mulv逆转录酶、phi29 dna聚合酶。dna聚合酶可能缺乏3'到5'核酸外切酶活性,并且可以具有链置换活性。可以使用任何这种合适的聚合酶。这种dna聚合酶可以是例如bst dna聚合酶大片段、bsu dna聚合酶大片段、大肠杆菌dna聚合酶dna pol i大(克列诺)片段、m-mulv逆转录酶。dna聚合酶可能缺乏5’到3’核酸外切酶活性。可以使用任何这种合适的聚合酶。这种dna聚合酶可以是例如,
[0604]
bst dna聚合酶大片段、bsu dna聚合酶大片段、dna pol i大(克列诺)片段、dna pol i大(克列诺)片段(3
’→5’
体外-)、m-mulv逆转录酶、phi29 dna聚合酶、硫化叶菌dna聚合酶iv、t4 dna聚合酶、t7 dna聚合酶。dna聚合酶可能缺乏3'到5'和5'到3'核酸外切酶活性两者,并且可以具有链置换活性。可以使用任何这种合适的聚合酶。这种dna聚合酶可以是例如bst dna聚合酶大片段、bsu dna聚合酶大片段、dna pol i大(克列诺)片段(3
’→5’
体外-)、m-mulv逆转录酶。dna聚合酶也可以是经过基因工程化的变体。例如,dna聚合酶可以是来自嗜热球菌属物种9
°
n,例如物种9
°
n-7的天然dna聚合酶的基因工程变体。经过修饰的聚合酶的一个这种实施例是可从新英格兰生物实验室(new england biolabs)获得的therminator ix dna聚合酶或therminator x dna聚合酶。其它经过工程化或变体dna聚合酶包含deep vent(exo-)、vent(exo-)、9
°
n dna聚合酶、therminator dna聚合酶、克列诺片段(exo-)、bst dna聚合酶、bsu dna聚合酶、硫化叶菌dna聚合酶i和taq聚合酶。
[0605]
为了拷贝包含rna的模板链,可使用任何合适的酶。例如,可以使用rna聚合酶。可以使用任何合适的rna聚合酶。rna聚合酶可为t3 rna聚合酶、t7 rna聚合酶、sp6rna聚合酶、大肠杆菌rna聚合酶全酶。
[0606]
在本文所述的任何方法中,可能期望进行一个或多个另外的方法步骤以延伸支架多核苷酸的一条或两条链,作为通过本发明的方法延伸支架多核苷酸的过程的一部分,例如在使用本发明的连接酶介导的方法延伸支架多核苷酸的一条或两条链的过程之前、期间或之后。可能期望作为双链支架多核苷酸的一部分延伸一条或两条链。还可能期望在分离支架多核苷酸的两条链之后,作为单链多核苷酸延伸一条或两条链。在任何这样的另外的方法步骤中,酶可具有末端转移酶活性,例如酶可以是末端核苷酸转移酶或末端脱氧核苷酸转移酶,并且其中支架多核苷酸被延伸以形成包含dna或rna,优选dna的多核苷酸分子。这些酶中的任一种可用于本发明的方法中,其中需要延伸支架多核苷酸。
[0607]
一种此类酶是末端核苷酸转移酶,如末端脱氧核苷酸转移酶(tdt)(参见例如,motea等人,2010;minhaz ud-dean,syst.synth.biol.,2008,2(3-4),67
–
73)。tdt能够催化来自核苷三磷酸底物(ntp或dntp)的核苷酸分子(核苷单磷酸)向支架多核苷酸的添加。tdt能够催化天然和非天然核苷酸的添加。其还能够催化核苷酸类似物的添加(motea等人,2010)。还可以使用polλ和polμ酶(ramadan k,等人,j.mol.biol.,2004,339(2),395-404),如可以使用φ29dna聚合酶。
[0608]
本领域已经广泛讨论了通过末端转移酶(例如,末端脱氧核苷酸转移酶;tdt)的作
用在不存在模板的情况下延伸单链多核苷酸分子dna和rna两者以产生人工合成的单链多核苷酸分子的技术。这些技术在例如专利申请公开wo2016/034807、wo 2016/128731、wo2016/139477和wo2017/009663,以及us2014/0363852、us2016/0046973、us2016/0108382和us2016/0168611中公开。这些文献描述了通过tdt的作用产生人工合成的单链多核苷酸分子的单链多核苷酸合成分子的受控延伸。描述了使用这种酶通过天然和非天然/人工核苷酸的延伸,如通过经过修饰的核苷酸的延伸,例如掺入封闭基团的核苷酸的延伸。这些文献中公开的任何末端转移酶和其任何酶片段、衍生物、类似物或功能等同物均可以应用于本发明的方法中,条件是末端转移酶功能被保存在所述酶中。
[0609]
定向进化技术、常规筛选、合理或半合理工程化/诱变方法或任何其它合适的方法可以用于改变任何此类酶以提供和/或优化所需功能。可以使用能够不使用模板而延伸单链多核苷酸分子部分的任何其它酶,例如包含dna或rna的分子,或具有核苷酸的平末端分子的一条链。
[0610]
因此,在本文定义的任何方法中,包含dna的支架多核苷酸的单链部分或包含dna的平末端双链支架多核苷酸可通过酶延伸,所述酶具有模板独立性酶活性,诸如模板独立性聚合酶或转移酶活性。酶可以具有核苷酸转移酶活性,例如脱氧核苷酸转移酶,例如末端脱氧核苷酸转移酶(tdt)或其酶片段、衍生物、类似物或功能等效物。通过这种酶的作用延伸的支架多核苷酸包含dna。
[0611]
包含rna的支架多核苷酸的单链部分或包含rna的平末端双链支架多核苷酸可通过具有核苷酸转移酶(例如包括tdt)的酶或其酶片段、衍生物、类似物或功能等同物延伸。通过这种酶的作用延伸的支架多核苷酸可包含rna。对于包含rna的单链多核苷酸分子或包含rna的多核苷酸分子的单链部分的合成,可使用任何合适的核苷酸转移酶。核苷酸转移酶,例如聚(u)聚合酶和聚(a)聚合酶(例如来自大肠杆菌)能够将核苷酸单磷酸单元不依赖模板地添加道多核苷酸合成分子。这些酶中的任一种以及其任何酶片段、衍生物、类似物或功能等同物可应用于本文的方法中,只要核苷酸转移酶功能被保存在酶中即可。定向进化技术、常规筛选、合理或半合理工程化/诱变方法或任何其它合适的方法可以用于改变任何此类酶以提供和/或优化所需功能。
[0612]
可逆终止子基团
[0613]
如果在本文所述的任何合成方法中期望作为附加步骤通过聚合酶或转移酶的作用掺入支架多核苷酸的一条或两条链中,则可进一步期望掺入一个或多个诸如包含一个或多个可逆封闭基团,也称为如本文所述的可逆终止子基团的核苷酸。
[0614]
此类基团用于防止由在给定的合成循环中用于催化掺入的酶造成的进一步延伸,使得只有一个核苷酸可以可控制地用于延伸支架多核苷酸,因此防止了非特异性核苷酸掺入。可使用实现此效果的任何官能团。与核苷酸连接的可逆封闭基团/可逆终止子基团和解封闭步骤是实现所述效果的优选方法。然而,这种效果可以通过适当的替代方式来实现。
[0615]
任何合适的可逆封闭基团都可附接到核苷酸上,以防止在给定的循环中将核苷酸掺入到多核苷酸链中之后由用于催化掺入的酶造成的进一步延伸,并限制每一步将一个核苷酸掺入链中。可逆封闭基团可以是可逆终止子基团,其作用是防止由用于催化掺入的酶造成的进一步延伸。以下提供可逆终止子的实施例。
[0616]
炔丙基可逆终止子:
[0617][0618]
烯丙基可逆终止子:
[0619][0620]
环辛烯可逆终止子:
[0621]
氰乙基可逆终止子:
[0622][0623]
硝基苄基可逆终止子:
dntp。
[0633]3’‑
o-烯丙基-dntp如下所示。
[0634][0635][0636]3’‑
o-叠氮甲基-dntp如下所示。
[0637][0638]
在掺入包含可逆封闭基团的核苷酸之后,可进行脱保护或解封闭步骤。这样的步骤涉及通过任何合适的方法去除可逆封闭基团(例如可逆终止子基团),或以其它方式逆转阻断/终止子基团的功能以抑制酶/聚合酶的进一步延伸作用。
[0639]
可使用任何合适的试剂在脱保护步骤期间去除可逆终止子基团。
[0640]
优选的脱保护试剂是三(羧乙基)膦(tcep)。tcep可用于在掺入后从3'-o-烯丙基-核苷酸(与pd0结合)和3'-o-叠氮甲基-核苷酸去除可逆终止子基团。
[0641]
以下提供了脱保护试剂的实施例。
[0642]
炔丙基可逆终止子:
[0643]
用pd催化剂—na2pdcl4、pdcl2处理。
[0644]
可以使用配体,例如:三苯基膦-3,3',3
”‑
三磺酸三钠盐。
[0645]
烯丙基可逆终止子:
[0646]
用pd催化剂—na2pdcl4、pdcl2处理。
[0647]
可以使用配体,例如:三苯基膦-3,3',3
”‑
三磺酸三钠盐。
[0648]
叠氮甲基可逆终止子:
[0649]
通过硫醇(巯基乙醇或二硫苏糖醇)或三(2-羧乙基)膦—tcep处理。
[0650]
氰乙基可逆终止子:
[0651]
通过氟化物—氟化铵、四丁基氯化铵(tbaf)处理。
[0652]
硝基苄基可逆终止子:
[0653]
暴露在uv光下
[0654]
二硫化物可逆终止子:
[0655]
通过硫醇(巯基乙醇或二硫苏糖醇)或三(2-羧乙基)膦—tcep处理。
[0656]
氨基烷氧基可逆终止子:
[0657]
用亚硝酸盐(no
2-、hno2)ph=5.5处理
[0658]
可以通过在掺入步骤之后立即进行的步骤除去可逆的保护基团(例如,可逆的终止剂基团),条件是从掺入步骤中移除不需要的试剂以防止在移除可逆的终止子基团之后进一步掺入。
[0659]
多核苷酸连接分子
[0660]
如本文进一步描述的,本发明的所有示例性方法涉及第一和第二连接/延伸步骤,其中在每种情况下,预定序列的一个或多个核苷酸通过具有连接酶活性的酶的作用附接至支架多核苷酸的链。在此类方法中,多核苷酸连接分子的构型和结构的选择将取决于所采用的具体方法。多核苷酸连接分子包含如本文所述的合成链和如本文所述的辅助链。多核苷酸连接分子在分子的一端包含互补连接末端。多核苷酸连接分子的互补连接末端将被连接至支架多核苷酸的末端。
[0661]
多核苷酸连接分子的互补连接末端在辅助链中具有不可连接的末端核苷酸。这防止辅助链连接至支架多核苷酸的第一或第二链,并因此在连接后在辅助链与支架多核苷酸的第一或第二链之间产生单链断裂。如果辅助链的末端核苷酸处于辅助链的3’末端,则所述核苷酸可作为不可连接的2’,3
’‑
双脱氧核苷酸或2
’‑
脱氧核苷酸,或任何其它合适的不可连接核苷酸提供。如果辅助链的末端核苷酸处于辅助链的5’末端,则可提供不具有磷酸基团的核苷酸,即其可作为核苷提供。可替代地,可使用5
’‑
保护的核苷,在5’位置具有不可连接基团的核苷,诸如5
’‑
脱氧核苷或5
’‑
氨基核苷,或任何其它合适的不可连接的核苷酸或核苷。可以使用用于防止连接的替代方式。例如,封闭部分可以与辅助链中的末端核苷酸连接。
[0662]
多核苷酸连接分子的互补连接末端在合成链中与辅助链中的不可连接的末端核苷酸相邻地具有可连接的末端核苷酸。第一和第二多核苷酸连接分子的合成链的可连接的末端核苷酸是将通过连接酶的作用分别掺入支架分子的第一和第二链中的预定序列的第一核苷酸。多核苷酸连接分子的互补连接末端在合成链中也具有通用核苷酸。相对于合成链的可连接的末端核苷酸,合成链中通用核苷酸的确切定位将取决于所采用的具体反应化学,这将从本发明的具体示例性方法版本及其变体的描述中显而易见。
[0663]
辅助链
[0664]
在多核苷酸连接分子中提供辅助链,以在连接步骤中促进多核苷酸连接分子的合成链与支架多核苷酸的连接。辅助链还可在裂解步骤中促进裂解酶的结合。可以省略辅助链,条件是提供替代方式以确保在裂解步骤中裂解酶的结掺入且如果需要的话确保在连接步骤中的连接。在本发明的优选方法中,合成链具有辅助链。
[0665]
对辅助链的长度、序列和结构的参数没有特殊要求,条件是如有需要时辅助链适合于促进连接酶和裂解酶的结合。
[0666]
辅助链可包含核苷酸、核苷酸类似物/衍生物和/或非核苷酸。
[0667]
优选地,应避免辅助链的序列区域内与合成链的错配,应避免富含gc和at的区域,此外应避免二级结构的区域,诸如发夹或凸起。
[0668]
辅助链的长度可以是10个碱基或更多。任选地,辅助链的长度可以是15个碱基或更多,优选30个碱基或更多。然而,辅助链的长度可以变化,条件是辅助链能够促进裂解和/或连接。
[0669]
辅助链必须与合成链的相应区域杂交。如果辅助链可以促进连接步骤中连接酶的结合和/或裂解步骤中裂解酶的结合,则整个辅助链与支持链的相应区域杂交不是必需的。因此,可以容许辅助链与合成链的相应区域之间的错配。辅助链可比合成链的相应区域长。合成链可在远离互补连接末端的方向上延伸超出与辅助链相对应的区域。辅助链可例如通过发夹连接到合成链的相应区域。
[0670]
辅助链可与多核苷酸连接分子的合成链杂交,使得当多核苷酸连接分子连接至支架多核苷酸时,缺口位点处的辅助链的末端核苷酸占据合成链中相对于缺口位点处的支架多核苷酸的相关链的末端核苷酸的下一顺序核苷酸位置。因此,在此构型中,辅助链与支架多核苷酸的相关链之间没有核苷酸位置切口。然而,由于存在单链断裂或缺口,辅助链和支架多核苷酸的相关链将是物理分离的。
[0671]
与通用核苷酸配对的辅助链中的核苷酸可以是任何合适的核苷酸。优选地,应所述避免可能扭曲分子螺旋结构的配对。优选地,胞嘧啶充当通用核苷酸的配偶体。在特别优选的实施方案中,通用核苷酸是肌苷或其类似物、变体或衍生物,并且辅助链中通用核苷酸的配偶体核苷酸是胞嘧啶。
[0672]
去除辅助链
[0673]
在本文描述的本发明的任何合成方法中,在裂解步骤之前,可将多核苷酸连接分子提供的辅助链从连接的支架多核苷酸中去除。
[0674]
可通过任何合适的方法从支架多核苷酸中去除辅助链,包括但不限于:(i)将支架多核苷酸加热至约80℃至约95℃的温度,并从支架多核苷酸中分离出辅助链部分,(ii)用尿素溶液诸如8m尿素处理支架多核苷酸,并且从支架多核苷酸中分离出辅助链部分,(iii)用甲酰胺或甲酰胺溶液诸如100%甲酰胺处理支架多核苷酸,并且从支架多核苷酸中分离出辅助链部分,或(iv)使支架多核苷酸与单链多核苷酸分子接触,所述单链多核苷酸分子包含与辅助链的序列互补的核苷酸序列区域,从而竞争性地抑制辅助链与支架多核苷酸的杂交。
[0675]
其中在将双链多核苷酸连接分子连接至裂解的支架多核苷酸的步骤之后且在裂解支架多核苷酸的步骤之前,将辅助链从支架多核苷酸中去除的方法中,裂解步骤将包括在不存在由辅助链提供的双链区域的情况下裂解支持链。可以选择任何合适的酶来进行这
样的裂解步骤,例如选自本文公开的任何合适的酶。
[0676]
通过参考本文描述的本发明的示例性方法及其在附图(图1至10)中的描绘,可以容易地确定多核苷酸连接分子的适当结构。
[0677]
连接和连接酶
[0678]
在涉及连接步骤的本发明方法中,可以使用任何合适的方法实现连接。优选地,连接步骤将通过连接酶进行。连接酶可以是对单碱基突出端底物具有增强的活性的经过修饰的连接酶。连接酶可以是t3 dna连接酶或t4 dna连接酶。连接酶可以是平端ta连接酶(blunt ta ligase)。例如,可从新英格兰生物实验室(neb)获得平末端ta连接酶。这是t4 dna连接酶、连接增强子和优化的反应缓冲液的即用型预混合物溶液,其被专门调配以改善平末端和单碱基突出端底物两者的连接和转化。用于连接(连结)单链和双链多核苷酸的分子、酶、化学物质和方法是本领域技术人员公知的。
[0679]
支架多核苷酸的裂解
[0680]
在需要存在支架多核苷酸和裂解步骤的方法中,进行裂解步骤的试剂的选择将取决于所采用的特定方法。在合成链中,裂解位点由通用核苷酸的特定位置限定。因此,所需裂解位点的构型和适当裂解试剂的选择将取决于该方法中采用的特定化学,通过参考本文所述的示例性方法将很容易明白。
[0681]
识别修饰的碱基的dna裂解酶的一些实施例示出在下表中。
[0682][0683]
合成链
[0684]
在本文描述的合成多核苷酸或寡核苷酸的方法中,包括但不限于图1至图6以及在本文中进一步描述的本发明的合成方法版本1和2及其变体,支架多核苷酸具有合成链。合成链包括引物链部分。在合成循环期间,通过延伸引物链部分,将预定序列的每个新的第二核苷酸掺入合成链,将预定序列的第一核苷酸掺入支持链。诸如聚合酶或具有末端转移酶活性的酶的酶可用于催化每个新的第二核苷酸的掺入/添加。预定序列的每个新结合的第二核苷酸将充当引物链部分的末端核苷酸,用于在下一个结合步骤中引发结合。因此,在任何给定的合成循环中,合成链的引物链部分将包含足够的多核苷酸序列以允许通过适当的酶引发。在本文进一步描述的某些实施方案中,在给定的合成循环中,将预定序列的第二核苷酸掺入到合成链中,然后将一个或多个其它核苷酸掺入到合成链中。在这样的实施方案中,预定序列的第二核苷酸和其它核苷酸包含可逆终止子基团,并且该方法另外包括在掺
入下一核苷酸之后和在掺入下一核苷酸之前从核苷酸中除去可逆终止子基团的步骤。
[0685]
核苷酸的术语“掺入”、“延伸”和“添加”在本文中具有相同的含义。
[0686]
支架多核苷酸的第一和第二链
[0687]
如本文进一步描述的,支架多核苷酸的第一和第二链应适合于允许具有连接酶活性的酶催化多核苷酸连接分子与支架多核苷酸的连接。此外,如果期望任一链的进一步延伸,则支架多核苷酸的第一和第二链应适合于允许酶(诸如聚合酶或具有末端转移酶活性的酶)起始合成,即催化在支架多核苷酸的末端添加新核苷酸。
[0688]
对支架多核苷酸的第一或第二链的长度、序列和结构的参数没有特殊要求,只要支架多核苷酸的第一和第二链适合于促进如本文进一步描述的连接,并在期望时引发如本文进一步描述的新多核苷酸合成即可。
[0689]
第一和第二链可包含核苷酸、核苷酸类似物/衍生物和/或非核苷酸。
[0690]
本领域技术人员能够容易地构建包含第一和第二链的支架多核苷酸,其将适合于促进如本文进一步描述的连接,并且在期望时能够引发如本文进一步描述的新多核苷酸合成。在待延伸的支架多核苷酸末端应避免与支持链错配,应避免富含gc和at的区域,此外,应避免二级结构区域,诸如可能干扰连接和/或其它延伸的发夹或凸起。
[0691]
在开始合成之前,支架多核苷酸的第一和第二链的长度可以由技术人员根据偏好和待使用的连接酶来选择。
[0692]
第一链必须与第二链的相应区域杂交。不必须使整个第一链与第二链的相应区域杂交,只要第一和第二链适合于如本文所述的连接,或在期望时能够引发如本文进一步描述的新多核苷酸合成即可。因此,可以在一定程度上容许第一链与第二链的相应区域之间的错配。优选地,第一和第二链的序列在待延伸的支架多核苷酸末端处的区域应包含与支持链中的相应核碱基互补的核碱基。
[0693]
第一链可在不被延伸的支架多核苷酸末端连接至第二链的相应区域,例如通过发夹。
[0694]
合成多核苷酸
[0695]
具有根据本文所述方法合成的预定序列的多核苷酸是双链的。合成的多核苷酸总体上是双链的,并且其中第一链通过杂交与第二链连接。只要整个第一链通过杂交与第二链连接,可以容许错配和非杂交区域。
[0696]
杂交可以通过中等严格或严格杂交条件来定义。中等严格的杂交条件是使用含有5x氯化钠/柠檬酸钠(ssc)、0.5%sds、1.0mm edta(ph 8.0)、约50%甲酰胺的杂交缓冲液、6xssc且杂交温度为55℃的预洗涤溶液(或其它类似的杂交溶液,例如含有约50%甲酰胺的溶液,杂交温度为42℃),并且洗涤条件为60℃,在0.5xssc、0.1%sds中进行。严格的杂交条件在45℃下于6xssc中杂交,然后在68℃下于0.1xssc,0.2%sds中进行一次或多次洗涤。
[0697]
具有根据本文所述方法合成的预定序列的双链多核苷酸可以保留为双链多核苷酸。或者,可以分离双链多核苷酸的两条链以提供具有预定序列的单链多核苷酸。允许双链多核苷酸的两条链分离的条件(熔融)是本领域公知的(例如,sambrook等人,2001,molecular cloning:a laboratory manual,3rd edition,cold spring harbour laboratory press;和current protocols in molecular biology,greene publishing and wiley-lnterscience,new york(1995))。
[0698]
具有根据本文所述方法合成的预定序列的双链多核苷酸可以在合成后扩增。可以扩增双链多核苷酸的任何区域。双链多核苷酸的全部或任何区域可以与支架多核苷酸的全部或任何区域一起扩增。允许双链多核苷酸扩增的条件是本领域公知的(例如,sambrook等人,2001,《分子克隆:实验室手册(molecular cloning:a laboratory manual)》,第3版,冷泉港实验室出版社;以及《当代分子生物学实验手册(current protocols in molecular biology)》,格林出版与威利交叉科学出版社(greene publishing and wiley-lnterscience),纽约,(1995))。因此,本文所述的任何合成方法可以进一步包括扩增步骤,其中如上所述扩增具有预定序列的双链多核苷酸或其任何区域。扩增可以通过任何合适的方法进行,例如聚合酶链反应(pcr)、聚合酶螺旋反应(psr)、环介导的等温扩增(lamp)、基于核酸序列的扩增(nasba)、自持序列复制(3sr)、滚环扩增(rca)、链置换扩增(sda),多重置换扩增(mda)、连接酶链反应(lcr)、解旋酶依赖性扩增(hda)、衍生化扩增方法(ram)等。优选地,通过聚合酶链反应(pcr)进行扩增。
[0699]
具有根据本文所述方法合成的预定序列的双链或单链多核苷酸可以是任何长度。例如,多核苷酸的长度可以是至少10、至少50、至少100、至少150、至少200、至少250、至少300、至少350、至少400、至少450或至少500核苷酸或核苷酸对。例如,长度上,多核苷酸可以是约10至约100核苷酸或核苷酸对,约10至约200核苷酸或核苷酸对,约10至约300核苷酸或核苷酸对,约10至约400核苷酸或核苷酸对和约10至约500核苷酸或核苷酸对。多核苷酸可以是多达约1000个或更多核苷酸或核苷酸对,长度多达约5000个或更多核苷酸或核苷酸对或长度多达约100000个或更多核苷酸或核苷酸对。
[0700]
rna合成
[0701]
描述用于dna合成的方法可以适用于rna的合成。在一种修改中,可修改针对本发明的合成方法版本1至6及其变体描述的合成步骤。
[0702]
核苷酸可作为核糖核苷-5
’‑
o-三磷酸(ntp)掺入。
[0703]
因此,与本发明的合成方法版本1至6及其变体有关的描述可根据需要进行修改,使用可具有连接rna链的能力的相关酶,加上必要的变更应用于rna合成。可替代地,可使用用于将dna序列转录成rna序列的酶和方法将dna链转化为rna链。
[0704]
固相合成
[0705]
根据本发明的合成方法产生的合成多核苷酸可优选使用固相或可逆固相技术合成。各种这样的技术在本领域中是已知的并且可以使用。在开始合成预定序列的新双链多核苷酸之前,可以将支架多核苷酸固定到表面上,例如平面,例如玻璃、基于凝胶的材料、或微粒例如珠子或官能化量子点的表面上。包含表面的材料本身可以与基底结合。例如,支架多核苷酸可以固定在基于凝胶的材料上,例如聚丙烯酰胺,并且其中基于凝胶的材料与支持基底如玻璃结合。
[0706]
多核苷酸可以直接或间接地固定或束缚到表面。例如,它们可以通过化学键合直接附接在表面上。它们可以通过中间表面间接地拴系在表面上,例如微粒或珠子的表面,例如在spri中或在电润湿系统中,如下所述。然后可以启动并完成合成循环,同时固定掺入新合成的多核苷酸的支架多核苷酸。
[0707]
在此类方法中,可以在掺入预定序列的第一核苷酸之前将双链支架多核苷酸固定到表面。因此,这种固定的双链支架多核苷酸可以充当锚,以在合成期间和之后将预定序列
的双链多核苷酸连接到表面。
[0708]
这种双链锚/支架多核苷酸的仅一条链可以在分子同一端固定在表面上。或者,双链锚/支架多核苷酸的两条链可各自在分子同一末端固定在表面上。可以提供双链锚定/支架多核苷酸,其中每条链在相邻末端连接,例如通过与新合成起始位点相反的末端的发夹环连接,并且连接的末端可以固定在表面上(例如,如图12所示)。
[0709]
在涉及支架多核苷酸的方法中,如本文所述,支架多核苷酸可以在以预定序列掺入第一核苷酸之前附接于表面。因此,如图12(a)和(c)所示,包含引物链部分和与之杂交的支持链部分的合成链都可以分别附接在表面上。包括引物链部分和与其杂交的支持链部分的合成链可以在相邻末端连接,例如通过发夹环,例如在新合成起始位点的相对末端,并且连接末端可以束缚至表面,如图12(b)和(d)所示。如图12(e)至(h)所示,包含引物链部分和与之杂交的支持链部分的合成链中的一条或另一条可以单独连接至表面。优选地,包括引物链部分和与其杂交的支持链部分的合成链附接于表面。
[0710]
平坦表面上的固相合成
[0711]
在开始合成预定序列的新双链多核苷酸之前,合成锚/支架多核苷酸可通过本领域已知的方法合成,包含本文所述的那些,并束缚在表面上。
[0712]
可以通过常用于产生附接于平表面的核酸微阵列的方法将预形成的多核苷酸拴在表面上。例如,可以产生锚/支架多核苷酸,然后将其点样或印刷到平表面上。可以使用接触印刷技术将锚/支架多核苷酸沉积在表面上。例如,可将固体或空心尖端或针浸入包括预形成的支架多核苷酸的溶液中并与平表面接触。或者,可以将寡核苷酸吸附到微型印模上,然后通过物理接触转移到平表面。非接触印刷技术包含热印刷或压电印刷,其中包括预形成的支架多核苷酸的亚纳升尺寸微滴可以使用与喷墨和喷泡印刷中使用的方法类似的方法从印刷尖端喷出。
[0713]
单链寡核苷酸可以直接在平表面上合成,例如使用用于产生微阵列的所谓“芯片上”方法。然后,此类单链寡核苷酸可以充当附接位点以固定预先形成的锚/支架多核苷酸。
[0714]
用于产生单链寡核苷酸的芯片上技术包括光刻法,其涉及使用通过光刻掩模引导的uv光来选择性地激活受保护的核苷酸,从而允许随后掺入新的受保护的核苷酸。uv介导的脱保护和预定核苷酸偶联的循环允许原位产生具有所需序列的寡核苷酸。作为使用光刻掩模的替代方案,可以通过使用喷墨印刷技术顺序沉积核碱基并使用偶联、氧化和脱保护的循环来产生具有所需序列的寡核苷酸,从而在平表面上产生寡核苷酸(对于综述,见kosuri和church,nature methods,2014,11,499-507)。
[0715]
在本文所述的任何合成方法中,包含如下所述的涉及可逆固定的方法,表面可由任何合适的材料制成。通常,表面可包括硅、玻璃或聚合物材料。表面可包括凝胶表面,例如聚丙烯酰胺表面,例如约2%聚丙烯酰胺,任选地使用n-(5-溴乙酰基戊基)丙烯酰胺(brapa)衍生的聚丙烯酰胺表面,优选地聚丙烯酰胺表面联接至固体支撑件,诸如玻璃。
[0716]
可逆固定
[0717]
具有预定序列的合成多核苷酸可以根据本发明使用促进可逆固定的结合表面和结构(例如微粒和珠子)来合成。固相可逆固定(spri)方法或改良方法是本领域已知的并且可以使用(例如参见deangelis m.m.等人(1995)solid-phase reversible immobilization for the isolation of pcr products,nucleic acids research,23
(22):4742-4743)。
[0718]
表面可以以微粒的形式提供,例如顺磁珠。顺磁珠可以在磁场的影响下聚集。例如,顺磁表面可以具有化学基团,例如羧基,其在适当的附接条件下将充当核酸的结合部分,如下面更详细描述的。可以在适当的洗脱条件下从这些表面洗脱核酸。微粒和珠子的表面可以提供uv敏感的聚碳酸酯。在合适的固定缓冲液存在下,核酸可以与活化表面结合。
[0719]
可使微粒和珠粒在反应溶液中自由移动,然后可逆地固定,例如通过将珠粒保持在微孔或蚀刻到表面中的凹坑中。珠子可以定位为阵列的一部分,例如通过使用附接于珠子的独特核酸“条形码”或通过使用颜色编码。
[0720]
因此,在开始合成预定序列的新双链多核苷酸之前,可以合成根据本发明的锚/支架多核苷酸,然后可逆地固定到这样的结合表面上。通过本发明方法合成的多核苷酸可以合成,同时可逆地固定在这样的结合表面上。
[0721]
微流体技术和系统
[0722]
表面可以是电介质上电润湿系统(ewod)的一部分。ewod系统提供电介质涂覆的表面,其有助于以微滴形式的非常小的液体体积的微流体操纵(例如参见chou,w-l.等人(2015)recent advances in applications of droplet microfluidics,micromachines,6:1249-1271.)。通过电润湿技术可以可编程地在芯片上创建、移动、分区和组合液滴体积。因此,电润湿系统提供了在合成期间和之后可逆地固定多核苷酸的替代方式。
[0723]
具有预定序列的多核苷酸可以通过本文所述的方法在固相中合成,其中多核苷酸固定在ewod表面上,并且通过电润湿技术促进每个循环中所需的步骤。例如,在涉及支架多核苷酸并需要掺入、裂解、连接和脱保护步骤的方法中,每个步骤所需的试剂以及用于除去用过的和不需要的试剂的任何所需洗涤步骤,可以以通过电润湿技术在电场的影响下传输的微滴的形式提供。
[0724]
可以用于本发明的合成方法中的其它微流体平台是可用的。例如,可以使用通常用于核酸操作的基于乳液的微滴技术。在这样的系统中,微滴在通过混合两种不混溶的流体(通常是水和油)产生的乳液中形成。可以在微流体网络中可编程地创建、移动、分割和组合乳液微滴。水凝胶系统也可提供。在本文所述的任何合成方法中,微滴可以在任何合适的相容系统中操作,例如上述ewod系统和其它微流体系统,例如包括基于包括弹性体材料的组件的结构的微流体系统。
[0725]
微滴可具有任何合适的尺寸,条件是它们与本文的合成方法相容。微滴尺寸将根据所采用的特定系统和系统的相关架构而变化。因此适当地可以调整尺寸。在本文所述的任何合成方法中,液滴直径可以在约150nm到约5mm的范围内。低于1μm的液滴直径可通过本领域已知的方法验证,例如通过涉及毛细管喷射方法的技术,例如等人(nature physics,2007,3,pp737
–
742)
[0726]
中间或最终合成产物的测序。
[0727]
可以对合成或组装的中间产物或最终的多核苷酸合成产物进行测序,以进行质量控制检查,以确定所需的一种或多种多核苷酸是否已正确合成或组装。可以从固相合成平台上除去感兴趣的一种或多种多核苷酸,并通过多种已知的商业上可获得的测序技术中的任一种进行测序,例如使用牛津纳米孔技术有限公司出售的minion tm
装置进行的纳米孔测序。测序可在固相平台本身上进行,从而无需将多核苷酸转移至单独的合成装置。测序可以
方便地在相同的电润湿设备上进行,例如用于合成的ewod设备,由此合成设备包括一个或多个测量电极对。可以将包括目的多核苷酸的液滴与电极对的电极之一接触,该液滴形成液滴界面双层,其中第二液滴与电极对的第二电极接触,其中液滴双层界面在两亲性膜中包括纳米孔。例如,可以在酶的控制下使多核苷酸移位到纳米孔中,并且可以在多核苷酸通过纳米孔的过程中在电极对之间的电势差下测量通过纳米孔的离子电流。可以记录随时间变化的离子电流测量值,并用于确定多核苷酸序列。测序之前,可对多核苷酸进行一个或多个样品制备步骤,以使其最优化以进行测序,例如专利申请no.pct/gb2015/050140。可以适当使用的酶,两亲性膜和纳米孔的实施例公开于专利申请no.pct/gb2013/052767和pct/gb2014/052736。可以通过样品入口将用于制备多核苷酸,纳米孔,两亲性膜等的样品所需的试剂提供给ewod设备。样品入口可以连接到试剂室。
[0728]
表面附接化学
[0729]
尽管寡核苷酸通常是化学连接的,但它们也可以通过间接方式例如通过亲和相互作用附接于表面。例如,寡核苷酸可以用生物素官能化并结合到用抗生物素蛋白或链霉抗生物素蛋白包被的表面上。
[0730]
为了将多核苷酸固定到表面(例如平表面)、微粒和珠子等,可以使用各种表面附接方法和化学品。表面可以被官能化或衍生化以促进附接。这种功能化是本领域中已知的。例如,表面可以用以下各者进行功能化:多组氨酸标签(六组氨酸标签、6xhis-标签、his6标签或)、ni-nta、链霉亲和素、生物素、寡核苷酸、多核苷酸(如dna、rna、pna、gna、tna或lna)、羧基、季胺基、硫醇基、叠氮基、炔基、dibo、脂质、flag-标签(flag八肽)、多核苷酸结合蛋白、肽、蛋白质、抗体或抗体片段。表面可以用与锚/支架多核苷酸特异性地结合的分子或基团进行功能化。
[0731]
图12i和图12j示出了适合于将多核苷酸附接于表面的化学的一些实施例。
[0732]
在本文所述的任何方法中,包括含有引物链部分和与其杂交的支持链部分的合成链的支架多核苷酸可以通过一个或多个共价键连接到共同表面。一个或多个共价键可以在共同表面上的官能团和支架分子上的官能团之间形成。支架分子上的官能团可以是例如胺基团、硫醇基团、硫代磷酸酯基团或硫代酰胺基团。共同表面上的官能团可以是溴乙酰基,可选地其中溴乙酰基在使用n-(5-溴乙酰基戊基)丙烯酰胺(brapa)衍生的聚丙烯酰胺表面上提供。
[0733]
在本发明的任何方法中,支架多核苷酸可以通过接头直接或间接附接于表面。可以使用任何合适的属性是生物相容且亲水的接头。
[0734]
接头可以是直链接头或支链接头。
[0735]
接头可包括烃链。烃链可包括2至约2000或更多个碳原子。烃链可包括亚烷基,例如c2至约2000或更多个亚烷基。烃链可具有通式-(ch2)
n-,其中n为2至约2000或更高。烃链可任选地被一个或多个酯基(即-c(o)-o-)或一个或多个酰胺基(即-c(o)-n(h)-)。
[0736]
可以使用选自包括以下的组的任何接头:peg、聚丙烯酰胺、聚(甲基丙烯酸2-羟乙酯)、聚-2-甲基-2-噁唑啉(pmoxa)、两性离子聚合物,例如聚(羧基甜菜碱甲基丙烯酸酯)(pcbma)、聚[n-(3-磺丙基)-n-甲基丙烯酰氧基乙基-n,n二甲基铵甜菜碱](psbma)、糖聚合物和多肽。
[0737]
接头可包含具有以下通式的聚乙二醇(peg):-(ch
2-ch
2-o)n-,其中n为1至约600或
更大。
[0738]
接头可包括具有通式为-[(ch
2-ch
2-o)
n-po
2-‑
o]
m-的低聚乙二醇磷酸酯单元,其中n是1到约600或更大,并且m可以是1-200或更大。
[0739]
任何上述接头可以在接头的一端连接至如本文所述的支架分子,并且在接头的另一端连接至第一官能团,其中第一官能团可以提供与表面的共价连接。第一官能团可以是例如胺基团、硫醇基团、硫代磷酸酯基团或硫代酰胺基团,如本文进一步描述的。表面可以用另外的官能团官能化以提供与第一官能团的共价键。另外的官能团可以是例如本文进一步描述的2-溴乙酰氨基。任选地,在使用n-(5-溴乙酰胺基戊基)丙烯酰胺(brapa)衍生的聚丙烯酰胺表面上提供溴乙酰基。表面上的进一步官能团可以是溴乙酰基,任选地其中溴乙酰基在使用n-(5-溴乙酰基戊基)丙烯酰胺(brapa)衍生的聚丙烯酰胺表面上提供,并且适当时第一官能团可以是例如胺基团、硫醇基团、硫代磷酸酯基团或硫代酰胺基团。多核苷酸附接的表面可包括凝胶。所述表面包括聚丙烯酰胺表面,例如约2%的聚丙烯酰胺,优选聚丙烯酰胺表面联接至固体支撑件,诸如玻璃。
[0740]
在本发明的任何方法中,支架多核苷酸可任选地通过掺入支架多核苷酸中的支化核苷酸连接至接头。任何合适的支化核苷酸可以与任何合适的相容性接头一起使用。
[0741]
在开始本发明的合成循环之前,可以合成支架多核苷酸,其中一个或多个支化核苷酸被掺入支架多核苷酸中。将一个或多个支化核苷酸掺入支架多核苷酸中并因此可以连接接头的确切位置可以变化,并且可以根据需要选择。所述位置可以例如在支持链和/或合成链的末端或例如在包括发夹环的实施方案中将支持链连接至合成链的环区域中。
[0742]
在支架多核苷酸的合成期间,可以将一个或多个支化核苷酸掺入支架多核苷酸中,其中封闭基团阻断支化部分的反应基团。然后可以在偶联至接头的分支部分之前去除(解封闭)封闭基团,或者如果接头包括多个单元,则将接头的第一单元(分子)去除。
[0743]
在支架多核苷酸的合成期间,可以将一个或多个支化核苷酸掺入支架多核苷酸中,该支架多核苷酸具有适合用于随后的“点击化学”反应的基团,以与连接体的分支部分偶联,或者如果接头包含多个单元,与第一个单元偶联。这种基团的一个实施例是乙炔基。
[0744]
一些非限制性示例性支化核苷酸如下所示。
[0745]
[0746][0747]
接头可任选地包括一个或多个间隔分子(单元),例如sp9间隔基,其中第一间隔基单元被附接到分支核苷酸。
[0748]
接头可包括连接到第一间隔基团的一个或多个其它间隔基团。例如,接头可包括多个例如sp9间隔基团。将第一间隔基团连接到支化部分,然后依次添加一个或多个另外的间隔基团以延伸包括多个间隔单元的间隔基链,所述间隔单元与其间的磷酸酯基团连接。
[0749]
下面显示的是间隔基单元(sp3、sp9和sp13)的一些非限制性实施例,其可以包括与分支核苷酸连接的第一间隔基单元,或者与已经与分支核苷酸连接的现有间隔基单元连接的另外的间隔基单元。
[0750][0751]
接头可包括一个或多个乙二醇单元。
[0752]
接头可包括寡核苷酸,其中多个单元是核苷酸。
[0753]
在上文描述的结构中,术语5”用于区分与支化部分连接的核苷酸的5'末端,其中5'具有本领域的普通含义。5”意指核苷酸上可以延伸接头的位置。5”的位置可能会有所不同。5”位置通常是核苷酸的核碱基中的位置。核碱基中的5”位置可以根据所需支化部分的性质而变化,如上述结构所示。
[0754]
微阵列
[0755]
本文描述的任何多核苷酸合成方法可用于制造多核苷酸微阵列(trevino,v.等
人,mol.med.2007 13,pp527-541)。因此,锚或支架多核苷酸可以连接到表面上的多个可单独寻址的反应位点,并且具有预定序列的多核苷酸可以在微阵列上原位合成。
[0756]
合成后,在每个反应区域,可以为预定序列的多核苷酸提供独特的序列。可以向锚或支架多核苷酸提供条形码序列以便于鉴定。
[0757]
除了合成预定序列的多核苷酸的方法之外,可以使用本技术领域中常用的技术,包含本文所述的技术,进行微阵列制造。例如,可以使用已知的表面附接方法和化学方法将锚或支架多核苷酸拴在表面上,包含本文所述的那些。
[0758]
在合成预定序列的多核苷酸后,可以提供最终裂解步骤以从未束缚端移除任何不需要的多核苷酸序列。
[0759]
可以双链形式在反应位点提供预定序列的多核苷酸。或者,在合成之后,可以分离双链多核苷酸并去除一条链,在反应位点留下单链多核苷酸。可以提供链的选择性束缚以促进所述过程。例如,在涉及支架多核苷酸的方法中,合成链可以束缚在表面上,支持链可以不被束缚,反之亦然。合成链可以具有不可裂解的接头,并且支持链可以具有可裂解的接头,反之亦然。链的分离可以通过常规方法进行,例如热处理。
[0760]
合成多核苷酸的组装
[0761]
具有通过本文所述方法合成的预定序列并且任选地通过本文所述方法扩增的多核苷酸可以与一种或多种其它此类多核苷酸连结以产生更大的合成多核苷酸。
[0762]
可以通过本领域公知的技术实现多个多核苷酸的连结。可以裂解通过本文所描述的方法合成的第一多核苷酸和一种或多种另外的多核苷酸以产生相容的末端,并且然后通过连接将多核苷酸连结在一起。可以通过任何合适的方法实现裂解。通常,可以在多核苷酸中产生限制性酶裂解位点,并且然后使用限制性酶执行裂解步骤,从而从任何锚/支架多核苷酸释放合成的多核苷酸。裂解位点可以被设计为锚/支架多核苷酸的一部分。或者,可以在新合成的多核苷酸内产生裂解位点,作为预定的核苷酸序列的一部分。
[0763]
多核苷酸的组装优选地使用固相方法进行。例如,在合成后,第一多核苷酸可以在远离表面固定位点的合适位置进行单一裂解。因此,第一多核苷酸将保持固定在表面上,并且单个裂解将产生与另一个多核苷酸连结相容的末端。另外的多核苷酸可以在两个合适的位置进行裂解,以在每个末端产生用于连结其它多核苷酸的相容末端,同时从表面固定中释放另外的多核苷酸。另外的多核苷酸可以与第一多核苷酸相容地连结,从而产生更大的固定化多核苷酸,其具有预定序列并且具有与另一个额外多核苷酸连接相容的末端。因此,预选的裂解的合成多核苷酸的连结的迭代循环可以产生更长的合成多核苷酸分子。另外的多核苷酸的连结顺序将由所需的预定序列测定。
[0764]
因此,本发明的组装方法可以允许产生长度为一个或多个mb左右的合成多核苷酸分子。
[0765]
可以使用本领域已知的装置进行本发明的组装和/或合成方法。可获得的技术和装置允许非常小体积的试剂被选择性地移动、分配并与阵列的不同位置中的其它体积组合,通常以液滴的形式,可以使用电润湿技术,例如电介质上电润湿(ewod),如上所述。例如在us8653832、us8828336、us20140197028和us20140202863中公开了可以在本发明中使用的能够操纵液滴的合适的电润湿技术和系统。
[0766]
可以通过在引物链部分和与其杂交的支持链部分中的一个或两个中提供可裂解
接头来实现从固相裂解。可裂解接头可以是例如uv可裂解接头。
[0767]
在图30中示出了涉及酶促裂解的裂解方法的实施例。该示意图示出了附接于表面(通过黑色金刚石结构显示)并包括预定序列的多核苷酸的支架多核苷酸。支架多核苷酸包括顶部和底部发夹。在每种情况下,可以使用通用核苷酸的裂解步骤裂解顶部发夹,以限定裂解位点。底部发夹可以通过限制性核酸内切酶经由设计到支架多核苷酸中的位点去除或者工程化到新合成的预定序列的多核苷酸中。
[0768]
因此,如上所述,可以合成具有预定序列的多核苷酸,同时固定在电润湿表面上。合成的多核苷酸可以从电润湿表面裂解下来并以液滴形式在电场的影响下移动。液滴可以在表面上的特定反应位点处组合,在所述特定反应位点其可以递送裂解的合成多核苷酸用于与其它裂解的合成多核苷酸连接。然后可以(例如通过连接)连结多核苷酸。使用这些技术,可以根据所期望的预定序列合成并且依次连接不同多核苷酸的群体。使用这种系统,可以设计完全自动化的多核苷酸合成和组装系统。系统可以被编程为接收期望的序列、供应试剂、执行合成循环并随后根据期望的预定序列组装期望的多核苷酸。
[0769]
系统和试剂盒
[0770]
本发明还提供了用于实施本文描述和限定的任何合成方法以及本文描述和限定的任何后续扩增和组装步骤的多核苷酸合成系统。
[0771]
通常,合成循环反应将通过将预定序列的核苷酸掺入支架多核苷酸分子来进行,所述支架多核苷酸分子通过本文描述和限定的方式与表面束缚。表面可以是如本文所述和限定的任何合适的表面。
[0772]
在一个实施方案中,将预定序列的核苷酸掺入支架多核苷酸分子的反应涉及在反应区域内在支架多核苷酸上进行任何合成方法。
[0773]
反应区域是支架多核苷酸分子附接的合适基底的任何区域,并且其中可以递送用于进行合成方法的试剂。
[0774]
在一个实施方案中,反应区域可以是包括单个支架多核苷酸分子的表面的单个区域,其中单个支架多核苷酸分子可以用试剂寻址。
[0775]
在另一个实施方案中,反应区域可以是包含多个支架多核苷酸分子的表面的单个区域,其中支架多核苷酸分子不能用彼此隔离的试剂单独寻址。因此,在这样的实施方案中,反应区域中的多个支架多核苷酸分子暴露于相同的试剂和条件,因此可以产生具有相同或基本相同的核苷酸序列的合成多核苷酸分子。
[0776]
在一个实施方案中,用于实施本文所述和限定的任何合成方法的合成系统可以包括多个反应区域,其中每个反应区域包括一个或多个附接的支架多核苷酸分子,并且其中每个反应区域可以与每个其它反应区域隔离地用试剂单独寻址。这种系统可以例如以阵列的形式配置,例如其中反应区域形成在基底上,通常是平面基底。
[0777]
具有包括单个反应区域或包括多个反应区域的基底的系统可包括在例如ewod系统或微流体系统内,并且系统配置成将试剂递送至反应位点。本文更详细地描述了ewod和微流体系统。例如,ewod系统可以配置成在电控制下将试剂递送到反应位点。微流体系统,例如包括微制造结构,例如由弹性体或类似材料形成的微流体系统,可以配置成在流体压力和/或抽吸控制下或通过机械方式将试剂输送到反应位点。试剂可以通过任何合适的方式递送,例如通过用作试剂递送导管的碳纳米管。可以设想任何合适的系统。
[0778]
ewod、微流体和其它系统可以配置成将任何其它所需的试剂递送至反应位点,例如用于在合成后从支架多核苷酸裂解合成的双链多核苷酸的酶,和/或用于裂解接头以从基底释放整个支架多核苷酸的试剂和/或用于在合成后扩增多核苷酸分子的试剂或其任何区域或部分,和/或用于从较小多核苷酸分子组装较大多核苷酸分子的试剂,所述较小多核苷酸分子是根据本发明的合成方法合成的。
[0779]
本发明还提供了用于实施本文所述和限定的任何合成方法的试剂盒。试剂盒可含有任何所需的试剂组合,其用于进行本文所述和限定的本发明的任何合成和/或组装方法。例如,试剂盒可包含任何一个或多个体积的反应试剂,其包含支架多核苷酸、对应于本文所述和限定的合成循环的任何一个或多个步骤的反应试剂的体积、包含含有可逆封闭基团或可逆终止子基团的核苷酸的反应试剂的体积、用于在合成之后扩增一种或多种多核苷酸分子或其任何区域或部分的反应试剂的体积、用于从根据本发明的合成方法合成的较小多核苷酸分子组装较大多核苷酸分子的反应试剂的体积、用于在合成后从支架多核苷酸裂解合成的双链多核苷酸的反应试剂的体积、以及用于裂解一个或多个接头从基底释放完整的支架多核苷酸的反应试剂的体积。
[0780]
数据存储
[0781]
由于形成多核苷酸分子结构的核碱基的同一性和序列的差异,多核苷酸分子能够天然地存储在其内编码的信息。通过根据特异性核碱基序列合成新的多核苷酸分子,可以利用多核苷酸分子的天然数据存储功能来存储新信息,因此所述核碱基序列可以编码多核苷酸分子内的新信息,随后可以访问或“读取”所述信息以检索信息。
[0782]
新信息可以例如以数字形式编码到多核苷酸分子中。因此,本发明另外提供了在多核苷酸分子中以数字形式存储数据,从而在多核苷酸合成分子中产生指示数字信息位的“0”或“1”状态的核苷酸序列的方法。
[0783]
核苷酸序列可以以任何合适的方式掺入到多核苷酸合成分子中以指示数字信息位的“0”或“1”状态。例如,可以使用两种不同物种的核苷酸来产生数字信息位。例如,支架多核苷酸可以被延伸以在第一合成循环中产生腺嘌呤(a)-胸腺嘧啶(t)对,然后延伸以在第二后续循环中产生胞嘧啶(c)-鸟嘌呤(g)对。因此,支架多核苷酸分子中a-t对的存在可以指示数字信息位的“0”或“1”状态。因此,邻近a-t对并置的c-g对的存在可以指示位的相反状态。因此,在序列中掺入多个a-t和c-g核碱基对可以允许数字信息以位的形式编码到支架多核苷酸中。a-t和c-g仅作为实施例提供。可以使用任何核碱基,条件是所述核碱基可以彼此区分。
[0784]
掺入交替物种的单个核碱基是产生数字信息位的一种方式。可替代地,可以通过在相同或连续的合成循环中掺入两个或更多个(即,第一串)相同或不能区分的物种的核碱基来产生位,所述合成循环因此可以指示数字信息位的“0”或“1”状态。这之后可以是在相同或连续的合成循环中掺入两个或更多个(即,第二串)相同或不能区分的物种的核碱基,所述合成循环因此可以指示与先前产生的位相反的位状态。可以使用任何核碱基,条件是第一串的核碱基可以与第二串的核碱基区分开。第一和第二串不需要由相同数量的核碱基组成,因为第一与第二串之间的转变指示数字信息位的“0”或“1”状态与所述位的相反状态之间的转变。
[0785]
本文所描述和定义的任何延伸的支架多核苷酸之后可以是确定延伸的支架多核
苷酸的序列的步骤。可使用纳米孔、使用本领域众所周知的纳米孔测序技术来实施这样的步骤。通过另外的实施例,可在将数据存储在多核苷酸分子中的方法之后进行确定延伸的支架多核苷酸的序列的步骤,如本文所述,例如以提供写入-读取系统。
[0786]
任何这样的数据存储方法都可使用任何如本文所述和定义的合成双链多核苷酸分子的体外方法来进行。可以使用本文所描述和定义的任何装置、设备和系统来执行任何这种数据存储方法。
[0787]
示例性方法
[0788]
本文描述了根据本发明的示例性的非限制性合成多核苷酸或寡核苷酸分子的方法,包括所附权利要求。
[0789]
在以下根据本发明的合成多核苷酸或寡核苷酸分子的六种示例性方法及其变体中,将根据分别在图1至10中列出的反应示意图而不是根据图11至15、57、60和61中的任何图中列出的反应示意图或实施例部分中对其的描述来解释对本发明的合成方法版本1至10的引用。在下面的实施例部分中,在图11至15、57、60和61中的任何一个中列出的反应示意图及其描述基于与本发明的方法相比被修改的连接介导的反应方案为本发明的方法提供了说明性支持。
[0790]
在下面描述的每个示例性方法中,每个步骤中描述的结构可以在适当时借助于附图标记参考具体附图来参考。下文文本中的附图标记与图1至10中的附图标记相对应。此类附图标记并不旨在限于附图中示出的具体结构,并且相关结构的描述对应于如本文中所提供的其全部描述,包括但不限于具体说明的那些。
[0791]
在图1至10中的每一个中都描绘了以下结构。
[0792]
双链支架多核苷酸分子在步骤(1)(提供支架)中被示出为具有左链和与其杂交的右链。在本文所述的方法中,支架多核苷酸被描述为具有“第一”链和“第二”链。第一链被这样指定是因为它是将在给定的合成循环中延伸的第一条链。第二链被这样指定是因为它是将在给定的合成循环中延伸的第二条链。在图1至10中的每一个中,第一链用点线描绘并且第二链用点划线描绘。在图1至4、7和8的步骤(1)(提供支架)中,第一链被描绘为右手链并且第二链被描绘为左手链。在图5、6、9和10的步骤(1)(提供支架)中,第一链被描绘为左手链并且第二链被描绘为右手链。
[0793]
在方法1至10中的每一个中,支架多核苷酸的第一和第二链在同一末端延伸。因此,在图1至10的情况下,待延伸的支架多核苷酸的末端是上末端。支架多核苷酸的下末端(即,其被标记为3’和5’)未示出为待延伸。
[0794]
在图1至10的情况下,实心圆圈,诸如附接至图1的步骤(1)(提供支架)处所示的左链的5’末端的“a”核苷酸,代表5’磷酸基团或作为核苷酸的一部分的任何其它合适的可连接的5’基团。
[0795]
步骤(2)和(4)描绘了第一和第二延伸/连接步骤,其中多核苷酸连接分子连接至支架多核苷酸。多核苷酸连接分子被描绘为双链结构,其具有用实线描绘的合成链和用虚线描绘并与合成链杂交的辅助链。合成链包含被描绘为“un”的通用核苷酸。位于辅助链3’末端的不可连接核苷酸以实心星形结构描绘,诸如在图1至4的步骤(2)中所示的多核苷酸连接分子的辅助链的3’末端处所描绘的。位于辅助链5’末端的不可连接核苷酸以实心菱形结构描绘,诸如在图5和6的步骤(2)中所示的多核苷酸连接分子的辅助链的5’末端处所描
绘的。
[0796]
连接的支架多核苷酸中的单链断裂用两条水平线描绘并标记“缺口”。
[0797]
通过锯齿状箭头描绘裂解,诸如图1至10的步骤(3)和(5)所示。
[0798]
下文描述了本发明的十种非限制性示例性方法,在本文中分别称为本发明的合成方法版本1至10(分别参见图1至10)。每种方法包括五个主要步骤。在步骤(1)中提供支架多核苷酸。步骤(2)包括第一延伸/连接反应,其中将第一多核苷酸连接分子连接至支架多核苷酸,并且用来源于第一多核苷酸连接分子的一个或多个核苷酸延伸支架多核苷酸的第一链。步骤(3)包括第一裂解反应,其中连接的支架多核苷酸在裂解位点处被裂解,从而导致失去第一多核苷酸连接分子并且来源于第一多核苷酸连接分子的一个或多个核苷酸保留在支架多核苷酸的第一链中。步骤(4)包括第二延伸/连接反应,其中将第二多核苷酸连接分子连接至支架多核苷酸,并且用来源于第二多核苷酸连接分子的一个或多个核苷酸延伸支架多核苷酸的第二链。步骤(5)包括第二裂解反应,其中连接的支架多核苷酸在裂解位点处被裂解,从而导致失去第二多核苷酸连接分子并且来源于第二多核苷酸连接分子的一个或多个核苷酸保留在支架多核苷酸的第二链中。
[0799]
提供支架步骤(1)
[0800]
参考描绘了本发明的合成方法的十种特定的非限制性示例性版本的图1至10,初始提供双链支架多核苷酸(步骤1;101、102、103等)。双链支架多核苷酸包含第一链和与其杂交的第二链。
[0801]
支架多核苷酸是双链的并且提供支持结构以修改合成多核苷酸的区域,因为它是从头合成的。在图1至10中的每一个中,支架多核苷酸包含用点线描绘的第一链和用点划线描绘的第二链。
[0802]
双链支架多核苷酸具有一个待延伸的末端,在图中示出为上末端。支架多核苷酸的下末端在图中示出为标记3’和5并且未被示出为待延伸。
[0803]
在方法1至4、7和8(分别为图1至4、7和8)中的每一个的步骤(1)中,第二链在待延伸的支架多核苷酸末端处的末端核苷酸包含磷酸基团或任何其它合适的可连接基团,因此该末端核苷酸是可连接核苷酸。在方法1至4中,第一链在待延伸的支架多核苷酸末端处的末端核苷酸包含羟基或任何其它合适的可连接基团,因此该末端核苷酸也是可连接核苷酸。在方法5、6、9和10中,第一链在待延伸的支架多核苷酸末端处的末端核苷酸包含磷酸基团或任何其它合适的可连接基团,因此该末端核苷酸是可连接核苷酸。在方法5、6、9和10中,第二链在待延伸的支架多核苷酸末端处的末端核苷酸包含羟基或任何其它合适的可连接基团,因此该末端核苷酸也是可连接核苷酸。
[0804]
第一延伸/连接步骤(1)
[0805]
在所述方法的步骤(2)中,进行第一延伸/连接步骤(102、202、302等),其中将第一多核苷酸连接分子连接至双链支架多核苷酸。第一多核苷酸连接分子包含预定核苷酸序列的一个或多个核苷酸。在方法版本1、2和7至10的情况下,第一多核苷酸连接分子包含预定核苷酸序列的两个核苷酸。在方法版本3至6的情况下,第一多核苷酸连接分子包含预定核苷酸序列的一个核苷酸。
[0806]
第一多核苷酸连接分子包含合成链(实线)和与合成链杂交的辅助链(虚线)。
[0807]
第一连接反应的第一多核苷酸连接分子可包含粘性末端的互补连接末端,即具有
单个突出的核苷酸,诸如在方法版本1和2中。在这些版本中,合成链的末端核苷酸突出于辅助链的末端核苷酸。可替代地,第一连接反应的多核苷酸连接分子可包含平末端的互补连接末端,即不具有突出核苷酸,诸如在方法版本3至6中。
[0808]
互补连接末端与待延伸的双链支架多核苷酸末端互补。第一多核苷酸连接分子的合成链在互补连接末端包含预定核苷酸序列的一个或多个核苷酸。预定核苷酸序列的第一核苷酸是互补连接末端处第一多核苷酸连接分子的合成链的末端核苷酸。预定核苷酸序列的第一核苷酸是可连接核苷酸,并连接至支架多核苷酸的第一链的末端核苷酸。在连接时,所述循环的预定核苷酸序列的第一核苷酸与预定核苷酸序列的任何另外的核苷酸一起通过第一多核苷酸连接分子的合成链的末端核苷酸与双链支架多核苷酸的第一链的末端核苷酸的连接而掺入双链支架多核苷酸中。在方法版本3至6中,支架多核苷酸的第一链仅延伸单个核苷酸,因此多核苷酸连接分子仅携带预定序列的一个核苷酸并包含平末端的互补连接末端。在支架多核苷酸中在待延伸的支架多核苷酸末端提供相应的平末端。相比之下,在方法版本1和2中,支架多核苷酸的第一链延伸两个核苷酸,因此多核苷酸连接分子携带预定序列的两个核苷酸并包含具有单碱基突出端的互补连接末端,其中合成链的末端核苷酸突出于辅助链的末端核苷酸。在支架多核苷酸中提供相应的单碱基突出端,其中第二链的末端核苷酸在待延伸的支架多核苷酸末端处突出于第一链的末端核苷酸。
[0809]
在所有六个方法版本及其变体中,第一多核苷酸连接分子的合成链在互补连接末端包含通用核苷酸(在图1至10中的每一个的步骤(2)中描绘的结构中标记为“un”),其将促进第一裂解步骤(3)中的裂解。通用核苷酸的作用将从以下每种方法的详细描述中显而易见。
[0810]
提供第一多核苷酸连接分子的辅助链的末端核苷酸,使得在互补连接末端,辅助链不可连接至支架多核苷酸的相应链(通常是第二链),即它具有不可连接的末端核苷酸。如果辅助链的末端核苷酸处于辅助链的3’末端,则所述核苷酸可作为不可连接的2’,3
’‑
双脱氧核苷酸或2
’‑
脱氧核苷酸,或任何其它合适的不可连接核苷酸提供。如果辅助链的末端核苷酸处于辅助链的5’末端,则可提供不具有磷酸基团的核苷酸,即其可作为核苷提供。可替代地,可使用5
’‑
保护的核苷,在5’位置具有不可连接基团的核苷,诸如5
’‑
脱氧核苷或5
’‑
氨基核苷,或任何其它合适的不可连接的核苷酸或核苷。
[0811]
因此,在第一多核苷酸连接分子的合成链连接至双链支架多核苷酸的第一链后,在第一多核苷酸连接分子的辅助链的末端核苷酸与支架多核苷酸的第二链的末端核苷酸之间提供单链断裂或“缺口”。
[0812]
在第一连接步骤(2)中,如果待连接至双链支架多核苷酸的第一链的末端核苷酸的多核苷酸连接分子的合成链的第一核苷酸处于多核苷酸连接分子的合成链的5’末端,那么它必须在连接步骤之前具有附接的磷酸基团或其它可连接基团,以允许多核苷酸连接分子的合成链的末端核苷酸充当连接酶的底物。类似地,在连接步骤之前,双链支架多核苷酸的第一链的3’末端必须具有羟基或其它可连接基团,以允许双链支架多核苷酸的第一链的末端核苷酸充当连接酶的底物。反之,如果待连接至双链支架多核苷酸的第一链的末端核苷酸的多核苷酸连接分子的合成链的第一核苷酸处于多核苷酸连接分子的合成链的3’末端,那么它必须在连接步骤之前具有羟基或其它可连接基团,以允许多核苷酸连接分子的合成链的末端核苷酸充当连接酶的底物。类似地,在连接步骤之前,双链支架多核苷酸的第
一链的5’末端必须具有附接的磷酸基团或其它可连接基团,以允许双链支架多核苷酸的第一链的末端核苷酸充当连接酶的底物。
[0813]
在将第一多核苷酸连接分子连接至双链支架多核苷酸后,形成这样的双链支架多核苷酸:其包含新掺入的一个或多个核苷酸、用于促进第一裂解步骤(3)中的裂解的通用核苷酸以及支架多核苷酸的第二链中的“缺口”。
[0814]
第一裂解步骤(3)
[0815]
在按照第一连接步骤(2)将一个或多个核苷酸掺入第一链的步骤之后,接着对支架多核苷酸进行第一裂解步骤(步骤3、103、203、303等)。
[0816]
在方法版本1至5、7、8和9中,第一裂解步骤包括在连接的第一多核苷酸连接分子的合成链的远端方向上在紧邻通用核苷酸之后的位置处裂解连接的支架多核苷酸的第一链,即支持链在通用核苷酸所占据的位置与第一链中在连接的第一多核苷酸连接分子的合成链的远端方向上的下一个核苷酸位置之间被裂解。在方法版本6和10中,裂解包括在占据在连接的第一多核苷酸连接分子的合成链的远端方向上处于通用核苷酸之后的第一和第二位置的核苷酸之间裂解连接的支架多核苷酸的第一链。
[0817]
裂解导致多核苷酸连接分子从支架多核苷酸中释放并且保留了附接至裂解的支架多核苷酸的第一链的一个或多个核苷酸。裂解导致刚好在裂解之前与合成链杂交的第一多核苷酸连接分子的辅助链的释放以及包含通用核苷酸的合成链的释放。因此裂解留下裂解的双链支架多核苷酸,所述双链支架多核苷酸在裂解位点包含第一链的裂解末端和包含裂解前缺口位点的第二链的末端。裂解的双链支架多核苷酸包含来源于第一多核苷酸连接分子的预定序列的一个或多个核苷酸作为支架多核苷酸的第一链的裂解末端的末端核苷酸。
[0818]
在本发明的示例性方法1至6中的每一个中,第一裂解步骤(3)在支架多核苷酸的裂解末端,即在支架多核苷酸的在第一延伸/连接步骤(2)中延伸的末端处留下单碱基突出端。在本发明的示例性方法7至10中的每一个中,第一裂解步骤(3)在支架多核苷酸的裂解末端留下双碱基突出端。在每种方法中,裂解的支架多核苷酸的第一链在裂解末端处的末端核苷酸或末端和次末端核苷酸突出于裂解的支架多核苷酸的第二链在裂解末端处的末端核苷酸。在方法1至4、7和8中,第一链3’末端处的末端核苷酸突出于第二链5’的末端核苷酸。在方法5、6、9和10中,第一链5’末端处的末端核苷酸突出于第二链3’末端处的末端核苷酸。在第一裂解步骤中产生的单碱基突出端为同一合成循环的第二连接步骤(4)的第二多核苷酸连接分子的互补连接末端提供互补末端。
[0819]
第二延伸/连接步骤(4)
[0820]
在所述方法的步骤(4)中,进行第二延伸/连接步骤(104、204、304等),其中将第二多核苷酸连接分子连接至裂解的双链支架多核苷酸。第二多核苷酸连接分子包含预定核苷酸序列的一个或多个核苷酸。在方法版本1、2和7至10的情况下,第二多核苷酸连接分子包含预定核苷酸序列的两个核苷酸。在方法版本3至6的情况下,第二多核苷酸连接分子包含预定核苷酸序列的一个核苷酸。
[0821]
第二多核苷酸连接分子包含合成链(实线)和与合成链杂交的辅助链(虚线)。
[0822]
第二连接反应的多核苷酸连接分子包含粘性末端的互补连接末端,即具有单个突出的核苷酸,其中合成链的末端核苷酸突出于第二多核苷酸连接分子的辅助链的末端核苷
酸。
[0823]
互补连接末端与待延伸的裂解的双链支架多核苷酸的末端互补。第二多核苷酸连接分子的合成链在互补连接末端的末端处包含预定核苷酸序列的一个或多个核苷酸。第二多核苷酸连接分子的合成链的末端核苷酸是可连接核苷酸并且连接至裂解的支架多核苷酸的第二链的末端核苷酸。在连接后,多核苷酸连接分子的合成链的末端核苷酸与预定核苷酸序列的任何另外的核苷酸一起通过第二多核苷酸连接分子的合成链的末端核苷酸与裂解的双链支架多核苷酸的第二链的末端核苷酸的连接而掺入裂解的双链支架多核苷酸中。
[0824]
在方法版本3至6中,支架多核苷酸的第二链仅延伸单个核苷酸,因此多核苷酸连接分子仅携带预定序列的一个核苷酸。相比之下,在方法版本1、2和7至10中,支架多核苷酸的第二链延伸两个核苷酸,因此多核苷酸连接分子携带预定序列的两个核苷酸。
[0825]
在所有六个方法版本及其变体中,第二多核苷酸连接分子的合成链在互补连接末端也包含通用核苷酸(在图1至10中的每一个的步骤(4)中描绘的结构中标记为“un”),其将促进第二裂解步骤(5)中的裂解。通用核苷酸的作用将从以下每种方法的详细描述中显而易见。
[0826]
提供第二多核苷酸连接分子的辅助链的末端核苷酸,使得在互补连接末端,辅助链不可连接至支架多核苷酸的相应链(通常是第一链),即它具有不可连接的末端核苷酸。如果辅助链的末端核苷酸处于辅助链的3’末端,则所述核苷酸可作为不可连接的2’,3
’‑
双脱氧核苷酸、2
’‑
脱氧核苷酸,或任何其它合适的不可连接核苷酸提供。如果辅助链的末端核苷酸处于辅助链的5’末端,则可提供不具有磷酸基团的核苷酸,即其可作为核苷提供。可替代地,可使用5
’‑
保护的核苷,在5’位置具有不可连接基团的核苷,诸如5
’‑
脱氧核苷或5
’‑
氨基核苷,或任何其它合适的不可连接的核苷酸或核苷。
[0827]
因此,在第二多核苷酸连接分子的合成链连接至双链支架多核苷酸的第二链后,在第二多核苷酸连接分子的辅助链的末端核苷酸与支架多核苷酸的第一链的末端核苷酸之间提供单链断裂或“缺口”。
[0828]
与第一连接步骤(2)类似,在第二连接步骤(4)中,如果待连接至裂解的双链支架多核苷酸的第二链的末端核苷酸的第二多核苷酸连接分子的合成链的第一核苷酸处于多核苷酸连接分子的合成链的5’末端,那么它必须在连接步骤之前具有附接的磷酸基团或其它可连接基团,以允许第二多核苷酸连接分子的合成链的末端核苷酸充当连接酶的底物。类似地,在连接步骤之前,裂解的双链支架多核苷酸的第二链的3’末端必须具有羟基或其它可连接基团,以允许裂解的双链支架多核苷酸的第二链的末端核苷酸充当连接酶的底物。反之,如果待连接至双链支架多核苷酸的第二链的末端核苷酸的第二多核苷酸连接分子的合成链的第一核苷酸处于第二多核苷酸连接分子的合成链的3’末端,那么它必须在连接步骤之前具有羟基或其它可连接基团,以允许第二多核苷酸连接分子的合成链的末端核苷酸充当连接酶的底物。类似地,在连接步骤之前,裂解的双链支架多核苷酸的第二链的5’末端必须具有附接的磷酸基团或其它可连接基团,以允许裂解的双链支架多核苷酸的第二链的末端核苷酸充当连接酶的底物。
[0829]
在将第二多核苷酸连接分子连接至双链支架多核苷酸后,形成这样的双链支架多核苷酸:其在第二链中包含新掺入的一个或多个核苷酸、用于促进第二裂解步骤(5)中的裂
解的通用核苷酸以及支架多核苷酸的第一链中的“缺口”。
[0830]
第二裂解步骤(5)
[0831]
在按照第二连接步骤(4)将一个或多个核苷酸掺入第二链的步骤之后,接着对支架多核苷酸进行第二裂解步骤(步骤5、105、205、305等)。
[0832]
在方法版本1、3、5、6、7、9和10中,第二裂解步骤包括在连接的第二多核苷酸连接分子的合成链的远端方向上在紧邻通用核苷酸之后的位置处裂解连接的支架多核苷酸的第二链,即第二链在通用核苷酸所占据的位置与第二链中在连接的第二多核苷酸连接分子的合成链的远端方向上的下一个核苷酸位置之间被裂解。在方法版本2、4和8中,裂解包括在占据在连接的第二多核苷酸连接分子的合成链的远端方向上处于通用核苷酸之后的第一和第二位置的核苷酸之间裂解连接的支架多核苷酸的第二链。
[0833]
裂解导致多核苷酸连接分子从支架多核苷酸中释放并且保留了附接至裂解的支架多核苷酸的第二链的一个或多个核苷酸。裂解导致刚好在裂解之前与合成链杂交的第二多核苷酸连接分子的辅助链的释放以及包含通用核苷酸的合成链的释放。裂解因此留下裂解的双链支架多核苷酸,所述双链支架多核苷酸在裂解位点包含第二链的裂解末端和包含裂解前缺口位点的第一链的末端,并且其中裂解的双链支架多核苷酸包含来源于第二多核苷酸连接分子的预定序列的一个或多个核苷酸作为支架多核苷酸的第二链的裂解末端的末端核苷酸。
[0834]
在本发明的示例性方法1和2中的每一个中,第二裂解步骤(5)在支架多核苷酸的裂解末端,即在支架多核苷酸的在第二延伸/连接步骤(4)中延伸的末端处留下单碱基突出端。在方法1和2中的每一个中,裂解的支架多核苷酸的第二链在裂解末端处的末端核苷酸突出于裂解的支架多核苷酸的第一链在裂解末端处的末端核苷酸。在方法1和2中,第二链5’末端的末端核苷酸突出于第一链3’的末端核苷酸。在第二裂解步骤中产生的单碱基突出端为下一合成循环的第一连接步骤(2)的第一多核苷酸连接分子的突出的互补连接末端提供互补末端。
[0835]
在本发明的示例性方法3至10中的每一个中,第二裂解步骤(5)在支架多核苷酸的裂解末端,即在支架多核苷酸的在第二延伸/连接步骤(4)中延伸的末端处留下平末端,没有突出的核苷酸。在第二裂解步骤(5)中产生的裂解的支架多核苷酸的平末端为下一合成循环的第一连接步骤(2)的第一多核苷酸连接分子的平末端的互补连接末端提供互补末端。
[0836]
由第二裂解步骤(5)产生的裂解的双链支架多核苷酸在下一合成循环中充当第一连接反应(2)的双链支架多核苷酸。
[0837]
在合成循环结束时,一个或多个核苷酸被掺入双链支架多核苷酸的第一链中并且一个或多个核苷酸被掺入双链支架多核苷酸的第二链中。在方法版本3至6中,向第一和第二链中的每一个中掺入一个核苷酸,从而形成核苷酸对。在方法版本1和2中,向第一和第二链中的每一个中掺入两个核苷酸,其中每条链中的一个核苷酸形成核苷酸对,掺入第一链的一个核苷酸与最初在步骤(1)中提供的支架多核苷酸的第二链的末端核苷酸形成核苷酸对,并且掺入第二链的一个核苷酸保持未配对并在支架多核苷酸的裂解末端形成末端单碱基突出端。在方法版本7至10中,向第一和第二链中的每一个中掺入两个核苷酸,从而形成两个核苷酸对。
[0838]
在如本文任何方法中描述的第一合成循环的上下文中,与第一和第二链的延伸相关的术语“预定序列的第一核苷酸”和“预定序列的第二核苷酸”或类似术语不必须理解为是指预定序列的恰好第一个或第二个核苷酸。本文所述的方法涉及具有预定序列的双链多核苷酸的合成,并且可以在开始第一合成循环之前在支架多核苷酸中预先合成预定序列的一部分。在本文中,预定序列的术语“一个”第一核苷酸可以意指预定序列的“任何”核苷酸。因此,在此上下文中,术语“预定序列的第一”和“第二”核苷酸”可以仅仅被认为是预定序列的“一个”另外的核苷酸。在本文定义的本发明的特定和非限制性方法版本1至10及其某些变体的情况下,在给定循环中连接至支架多核苷酸的每个“第一核苷酸”将顺序连接至同一核酸链中上一个循环的掺入核苷酸,从而每个循环将第一或第二链顺序延伸一个或多个另外的核苷酸。因此,当合成循环完成时,合成的双链多核苷酸分子将包含由每个循环的连接的第一和第二(如果存在的话)核苷酸限定的一条链的预定序列,以及由每个循环的掺入的第一和第二(如果存在的话)核苷酸限定的相反链的预定序列。
[0839]
可执行本发明的所有示例性方法,从而合成包含由用户选择的特定的期望的预定序列的第一链。在此类方法中,第二链的序列可不必须包含特定的期望的预定序列。反之,可执行本发明的所有示例性方法,从而合成包含由用户选择的特定的期望的预定序列的第二链。在此类方法中,第一链的序列可不必须包含特定的期望的预定序列。由于本发明的方法提供了双链多核苷酸分子的合成,如果期望,用户可在期望数目的合成循环结束时分离两条链,丢弃一条链,保留另一条链并拷贝另一条链以形成双链多核苷酸分子,其中由所述另一条链拷贝的链包含与所述另一条链的序列互补的序列。在这种情况下,由于通过本发明的方法合成的双链多核苷酸分子的一条链被丢弃,因此其多核苷酸序列不是关键的并且例如不需要与被保留以用于拷贝的所述另一条链的序列互补。因此,例如,可以使用与用户选择的待掺入被保留以用于拷贝的所述另一条链中的预定序列的核苷酸不完全互补的核苷酸来构造将丢弃的链。例如,可以将一个或多个通用核苷酸掺入将丢弃的链中,所述通用核苷酸将与用户选择的的待掺入被保留以用于拷贝的所述另一条链中的预定序列的核苷酸配对。在这种方法中,将丢弃的链仅用作被保留以用于拷贝的所述另一链的支持链。在此上下文中,本发明提供了合成双链多核苷酸的体外方法,其中至少一条链(即被保留以用于拷贝的所述另一条链)具有预定序列。将丢弃的链的序列可以是随机的或半随机的。因此,在本文描述或定义的本发明的任何方法中,术语“预定(predefined)”在涉及第一链或第二链的延伸时必须相应地解释。
[0840]
在下文中,将分别参考图1至6详细解释本发明的前六个方法版本。本发明的方法版本7至10可以被认为是其它方法的变体并且将在该上下文中被描述为示例性变体方法。
[0841]
合成方法版本1
[0842]
步骤1-提供支架多核苷酸
[0843]
在本发明的合成方法的示例性版本1中,在步骤(1)(101)中提供了双链支架多核苷酸。提供了包含第一链和与其杂交的第二链的双链支架多核苷酸。第一链的待延伸末端处的末端核苷酸位于第一链的3’末端并且包含羟基或任何其它合适的3’可连接基团,因此该末端核苷酸是可连接核苷酸。在图1中,该核苷酸被描绘为“x”并且可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。第一链的待延伸末端处的末端核苷酸被描绘为与第二链的5’末端的次末端核苷酸配对。该次末端核苷酸被描绘为“x”并且可以是任何核苷酸、核苷酸类
似物或核苷酸衍生物,并且可与或可不与所述对中的其配偶体核苷酸互补。优选是互补的。第二链的5’末端的末端核苷酸未配对并且形成单碱基突出端并突出于第一条的末端3’核苷酸。第二链5’末端的末端核苷酸被描绘为“a”。然而,该核苷酸可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。该核苷酸可以被认为是预定序列的核苷酸。第二链5’末端的末端核苷酸包含磷酸基团或任何其它合适的5’可连接基团,并且因此该末端核苷酸也是可连接核苷酸。
[0844]
未示出为待延伸的支架多核苷酸的末端,即在图1中标记3’和5’的那些,优选地附接至基底,诸如通过本文所述的任何方式。
[0845]
步骤2-将第一多核苷酸连接分子连接至支架多核苷酸并掺入预定序列的一个或多个核苷酸
[0846]
在该方法的步骤(2)中,在粘性(互补)末端连接反应中,通过具有连接酶活性的酶的作用将双链多核苷酸连接分子连接(102)至支架多核苷酸。
[0847]
多核苷酸连接分子包含合成链和与其杂交的辅助链。多核苷酸连接分子还包含互补连接末端,其在合成链中包含通用核苷酸和预定序列的两个核苷酸。
[0848]
第一多核苷酸连接分子的互补连接末端被构造成使得合成链的末端和次末端核苷酸分别是在任何给定的合成循环中被掺入到支架多核苷酸的第一链中的预定序列的第一和第二核苷酸。
[0849]
互补连接末端包含单碱基突出端。合成链的末端核苷酸未配对并突出于辅助链的末端核苷酸。合成链的次末端核苷酸与辅助链的末端核苷酸配对。在图1中,合成链的末端核苷酸被描绘为“t”,合成链的次末端核苷酸被描绘为“g”,并且辅助链的末端核苷酸被描绘为“c”。这些名称中的每一个仅用于说明目的。它们可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。合成链的次末端核苷酸和辅助链的末端核苷酸可以互补或可以不互补。优选地,它们是互补的。
[0850]
在第一多核苷酸连接分子的互补连接末端处的合成链末端,通用核苷酸占据在远离互补连接末端的方向上紧邻次末端核苷酸的位置。通用核苷酸与作为辅助链中远离互补连接末端方向上的次末端核苷酸的核苷酸形成核苷酸对。这在图1中被描绘为“x”。它可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。
[0851]
第一多核苷酸连接分子的互补连接末端处的合成链末端核苷酸在图1中被描绘为处于合成链的5’末端。该核苷酸作为可连接核苷酸提供并且包含磷酸基团或任何其它合适的5’可连接基团。第一多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸在图1中被描绘为处于辅助链的3’末端。该核苷酸作为不可连接核苷酸提供并且包括不可连接的2’,3
’‑
双脱氧核苷酸或2
’‑
脱氧核苷酸,或任何其它合适的不可连接的3’核苷酸。
[0852]
合成链的末端核苷酸,即,将在给定的合成循环中掺入第一链的预定序列的第一核苷酸,占据合成链中的核苷酸位置n。第一多核苷酸连接分子的合成链中的位置n是指在多核苷酸连接分子连接至支架多核苷酸之后将被附接至支架多核苷酸第一链末端的第一核苷酸占据的位置。位置n还指在连接之后由所述第一核苷酸在其附接至第一链的末端之后在连接的支架多核苷酸的第一链中占据的核苷酸位置。位置n还指在第二延伸/连接反应之后在所述第一核苷酸的配偶体核苷酸附接至第二链末端之后将由所述配偶体核苷酸在支架多核苷酸的第二链中占据的核苷酸位置。位置n还指在第二延伸/连接反应之后由所述
配偶体核苷酸在其附接至第二链末端后所占据的核苷酸位置。第一多核苷酸连接分子的合成链中的通用核苷酸占据位置n 2。
[0853]
第一多核苷酸连接分子的互补连接末端被配置成使得当经受合适的连接条件时,它将与支架多核苷酸的突出末端相容地连结。在多核苷酸连接分子的合成链和支架多核苷酸的第一链连接后,合成链的末端和次末端核苷酸变得被掺入支架多核苷酸的第一链中。由于第一多核苷酸连接分子的辅助链的末端核苷酸是不可连接核苷酸,因此将阻止连接酶连接第一多核苷酸连接分子的辅助链和支架多核苷酸的第二链,从而在第一多核苷酸连接分子的辅助链与支架多核苷酸的第二链之间产生单链断裂或“缺口”。
[0854]
多核苷酸连接分子与支架多核苷酸的连接延长了步骤(1)的双链支架多核苷酸的第一链的长度,并且其中第一多核苷酸连接分子的合成链的末端和次末端核苷酸被掺入到支架多核苷酸的第一链中。
[0855]
可通过任何合适的方式进行连接。连接通常可以并且优选地通过具有连接酶活性的酶来进行。例如,可以用t3 dna连接酶或t4 dna连接酶或其功能性变体或等同物或本文所述的其它酶进行连接。此类酶的使用将导致单链断裂的维持,因为辅助链的末端核苷酸被提供使得其无法充当连接酶的底物,如上文所述。
[0856]
步骤3-第一裂解步骤
[0857]
在该方法的步骤(3)中,连接的支架多核苷酸在裂解位点被裂解(103)。裂解位点由连接的第一多核苷酸连接分子的合成链中包含通用核苷酸的序列限定。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤3)导致失去连接的第一多核苷酸连接分子的辅助链并且失去包含通用核苷酸的合成链。支架多核苷酸的裂解从而从支架多核苷酸中释放多核苷酸连接分子,但是导致附接至裂解的支架多核苷酸的第一链的所述循环的第一和第二核苷酸的保留。支架多核苷酸的裂解留下在裂解末端包含单碱基突出端的裂解的双链支架多核苷酸。预定序列的第二核苷酸占据位置(n 1)作为裂解的双链支架多核苷酸的第一链的末端核苷酸,并且预定序列的第一核苷酸占据位置(n)作为裂解的第一链的次末端核苷酸。在第一延伸/连接步骤之前,预定序列的第一核苷酸与作为步骤(1)(101)中的双链支架多核苷酸中的第二链的末端突出核苷酸的核苷酸配对。在图1中,这些核苷酸被描绘(103)为“a”和“t”,仅用于说明目的。这些核苷酸中的每一个可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且所述对可以是互补的或可以不是互补的。优选地,它们是互补的。
[0858]
在该示例性方法中,连接的支架多核苷酸的第二链已经具有单链断裂或“缺口”,因此仅需要裂解第一链即可在支架多核苷酸中提供双链断裂。此外,如先前所述,在该示例性方法版本中,裂解产生具有单碱基突出端的裂解的双链支架多核苷酸,其中第一链的末端核苷酸突出于第二链的末端核苷酸,并且通用核苷酸在裂解步骤之前占据第一链中的位置n 2。为了在通用核苷酸占据第一链中的位置n 2时获得这种具有单碱基突出端的裂解的双链支架多核苷酸,在相对于通用核苷酸的特定位置裂解第一连接链。当支架多核苷酸的第一链在核苷酸位置n 2与n 1之间被裂解时,多核苷酸连接分子从支架多核苷酸中释放(参见在图1中被描绘为在裂解步骤3(103)后立即退出合成循环的结构),除了来源于步骤(2)中的多核苷酸连接分子的所述循环的第一和第二核苷酸保留在支架多核苷酸中,附接至裂解的支架多核苷酸的第一链。
[0859]
磷酸基团或任何其它合适的5’可连接基团应继续在裂解位点附接至裂解的支架多核苷酸的第二链的末端核苷酸。这确保了裂解的支架多核苷酸的第二链可以在第二延伸/连接步骤(4)中连接至第二多核苷酸连接分子的合成链。进行裂解以使裂解的支架多核苷酸的第一链的末端核苷酸在第一链的3’末端保留可连接基团,通常为羟基或任何其它合适的3’可连接基团。
[0860]
因此,在方法版本1中,通用核苷酸在步骤(2)中占据合成/第一链中的位置n 2,并且第一链在步骤(3)中在核苷酸位置n 2与n 1之间被裂解。
[0861]
优选地,通过裂解核苷酸位置n 2与n 1之间的磷酸二酯键(在连接的多核苷酸连接分子的远端方向/第一链的近端方向上,相对于通用核苷酸的位置而言第一链的第一磷酸二酯键)来裂解第二链。
[0862]
可通过裂解核苷酸位置n 2与n 1之间的磷酸二酯键的一个酯键来裂解第一链。
[0863]
优选地,通过相对于核苷酸位置n 2的第一酯键的裂解来裂解第一链。
[0864]
当通用核苷酸占据位置n 2时,可采用任何合适的机制来实现在核苷酸位置n 2与n 1之间裂解第一链。
[0865]
如上所述在核苷酸位置n 2与n 1之间裂解第一链可通过酶的作用进行。
[0866]
如上所述在核苷酸位置n 2与n 1之间裂解第一链可作为两步裂解过程进行。
[0867]
两步裂解过程的第一裂解步骤可包括从第一链上去除通用核苷酸,从而在位置n 2处形成无碱基位点,并且第二裂解步骤可包括在位置n 2与n 1之间在无碱基位点处裂解第一链。
[0868]
实施例2中以类似方式描述了一种以上述方式在由包含通用核苷酸的序列限定的裂解位点处裂解第一链的机制。实施例2中描述的裂解机制是示例性的,并且可采用其它机制,只要实现上述裂解的双链支架多核苷酸即可。
[0869]
在两步裂解过程的第一裂解步骤中,将通用核苷酸从第一链上去除,同时保留糖-磷酸主链的完整性。这可以通过酶的作用来实现,所述酶可以从双链多核苷酸中特异性地切除单个通用核苷酸。在示例性裂解方法中,通用核苷酸是肌苷,并且通过酶的作用从第一链中切除肌苷,从而形成无碱基位点。在示例性裂解方法中,酶是3-甲基腺嘌呤dna糖基化酶,特别是人类烷基腺嘌呤dna糖基化酶(haag)。可以使用其它酶、分子或化学物质,只要形成无碱基位点即可。核苷酸切除酶可以是催化尿嘧啶从多核苷酸释放的酶,例如尿嘧啶-dna糖基化酶(udg)。
[0870]
在两步裂解过程的第二步骤中,通过形成单链断裂而在无碱基位点处裂解第一链。在示例性方法中,第一链通过作为碱诸如naoh的化学物质的作用被裂解。可替代地,可使用有机化学物质,诸如n,n
’‑
二甲基乙二胺。可替代地,可以使用具有无碱基位点裂解酶活性的酶,诸如ap核酸内切酶1、核酸内切酶iii(nth)或核酸内切酶viii。这些酶在相对于无碱基位点位于5’的磷酸基团处裂解dna主链。因此,裂解在第一链的3’末端暴露了oh基团,所述oh基团提供了末端3’核苷酸,所述核苷酸可在下一循环的第一连接步骤中连接。可以使用其它酶、分子或化学物质,只要第一链在如上所述的无碱基位点处被裂解即可。
[0871]
因此,在其中通用核苷酸在步骤(2)中处于第一链的位置n 2并且第一链在位置n 2与n 1之间被裂解的实施方案中,第一裂解步骤可用核苷酸切除酶来执行。这种酶的实施例是3-甲基腺嘌呤dna糖基化酶,诸如人类烷基腺嘌呤dna糖基化酶(haag)。第二裂解步骤
可以用作为碱的化学物质如naoh进行。第二步可以用具有无碱基位点裂解活性的有机化学物质诸如n,n'-二甲基乙二胺进行。第二步骤可以用具有无碱基位点裂解酶活性的酶如核酸内切酶viii或核酸内切酶iii进行。
[0872]
如上所述在核苷酸位置n 2与n 1之间裂解第一链也可作为一步裂解过程进行。可用于任何此类方法的酶的实施例包括核酸内切酶iii、核酸内切酶viii。可用于任何此类过程的其它酶包括裂解8-氧代鸟苷的酶,诸如甲酰胺基嘧啶dna糖基化酶(fpg)和8-氧代鸟嘌呤dna糖基化酶(hogg1),它们裂解dna主链以在裂解的第一链的3’末端留下磷酸基团,然后可以通过核酸内切酶iv或t4多核苷酸激酶将其去除以暴露oh基团,所述oh基团可在下一循环的第一连接步骤中连接。
[0873]
步骤4-将第二多核苷酸连接分子连接至支架多核苷酸并掺入预定序列的一个或多个另外的核苷酸
[0874]
在该方法的步骤(4)中,在粘性(互补)末端连接反应中,通过具有连接酶活性的酶的作用将第二双链多核苷酸连接分子连接(104)至支架多核苷酸。
[0875]
第二多核苷酸连接分子包含合成链和与其杂交的辅助链。第二多核苷酸连接分子还包含互补连接末端,其在合成链中包含通用核苷酸和预定序列的两个另外的核苷酸。
[0876]
第二多核苷酸连接分子的互补连接末端被构造成使得合成链的末端和次末端核苷酸分别是在任何给定的合成循环中被掺入到支架多核苷酸的第二链中的预定序列的第一和第二核苷酸。
[0877]
互补连接末端包含单碱基突出端。合成链的末端核苷酸未配对并突出于辅助链的末端核苷酸。合成链的次末端核苷酸与辅助链的末端核苷酸配对。在图1中,合成链的末端核苷酸被描绘为“c”,合成链的次末端核苷酸被描绘为“t”,并且辅助链的末端核苷酸被描绘为“a”。这些名称中的每一个仅用于说明目的。它们可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。合成链的次末端核苷酸和辅助链的末端核苷酸可以互补或可以不互补。优选地,它们是互补的。
[0878]
在第二多核苷酸连接分子的互补连接末端处的合成链末端,通用核苷酸占据在远离互补连接末端的方向上紧邻次末端核苷酸的位置。通用核苷酸与作为辅助链中远离互补连接末端方向上的次末端核苷酸的核苷酸形成核苷酸对。这在图1中被描绘为“x”。它可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。
[0879]
第二多核苷酸连接分子的互补连接末端处的合成链末端核苷酸在图1中被描绘为处于合成链的3’末端。该核苷酸作为可连接核苷酸提供并且包含羟基或任何其它合适的3’可连接基团。第一多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸在图1中被描绘为处于辅助链的5’末端。该核苷酸作为不可连接的核苷酸提供,例如缺少磷酸基团或具有任何合适的可阻止连接的5’封闭基团。
[0880]
合成链的末端核苷酸,即被添加至裂解的支架多核苷酸的第二链的所述循环的预定序列的第一核苷酸,占据合成链中的核苷酸位置n 1。参考步骤(2)的第一延伸/连接反应中位置n的定义,位置n是指支架多核苷酸的第二链中由在步骤(2)的第一延伸/连接反应之后附接至第一链末端的第一核苷酸的配偶体核苷酸占据的核苷酸位置。第二多核苷酸连接分子的合成链中的通用核苷酸占据位置n 3。
[0881]
第二多核苷酸连接分子的互补连接末端被配置成使得当经受合适的连接条件时,
它将与在步骤(3)中产生的裂解的支架多核苷酸的突出末端相容地连结。在第二多核苷酸连接分子的合成链和支架多核苷酸的第二链连接后,第二多核苷酸连接的合成链的末端和次末端核苷酸变得被掺入裂解的支架多核苷酸的第二链中。由于第二多核苷酸连接分子的辅助链的末端核苷酸是不可连接核苷酸,因此将阻止连接酶连接第二多核苷酸连接分子的辅助链和裂解的支架多核苷酸的第一链,从而在第二多核苷酸连接分子的辅助链与裂解的支架多核苷酸的第一链之间产生单链断裂或“缺口”。
[0882]
第二多核苷酸连接分子与裂解的支架多核苷酸的连接延长了步骤(3)的双链支架多核苷酸的第二链的长度,并且其中第二多核苷酸连接分子的合成链的末端和次末端核苷酸被掺入到支架多核苷酸的第二链中。
[0883]
可通过任何合适的方式进行连接。连接通常可以并且优选地通过具有连接酶活性的酶来进行。例如,可以用t3 dna连接酶或t4 dna连接酶或其功能性变体或等同物或本文所述的其它酶进行连接。此类酶的使用将导致单链断裂的维持,因为辅助链的末端核苷酸被提供使得其无法充当连接酶的底物,如上文所述。
[0884]
连接后,第二多核苷酸连接分子的合成链的末端核苷酸与在步骤(3)中产生的裂解的支架多核苷酸的第一链的末端核苷酸配对,从而形成核苷酸对。
[0885]
步骤5-第二裂解步骤
[0886]
在该方法的步骤(5)中,连接的支架多核苷酸在裂解位点被裂解(105)。裂解位点由连接的第二多核苷酸连接分子的合成链中包含通用核苷酸的序列限定。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤5)导致失去连接的第二多核苷酸连接分子的辅助链并且失去包含通用核苷酸的合成链。支架多核苷酸的裂解从而从支架多核苷酸中释放第二多核苷酸连接分子,但是导致附接至裂解的支架多核苷酸的第二链的所述循环的接下来的两个核苷酸的保留。支架多核苷酸的裂解留下在裂解末端包含单碱基突出端的裂解的双链支架多核苷酸。在步骤(4)中掺入的预定序列的第二核苷酸占据位置(n 2)作为裂解的双链支架多核苷酸的第二链的末端核苷酸,并且在步骤(4)中掺入的预定序列的第一核苷酸占据位置(n 1)作为裂解的第二链的次末端核苷酸。在第一裂解步骤之后,在步骤(4)中掺入的预定序列的第一核苷酸与作为步骤(3)(103)中的双链支架多核苷酸中的第一链的末端突出核苷酸的核苷酸配对。在图1中,这些核苷酸被描绘(105)为“c”和“g”,仅用于说明目的。这些核苷酸中的每一个可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且所述对可以是互补的或可以不是互补的。优选地,它们是互补的。
[0887]
在该示例性方法中,在第二裂解步骤之前,连接的支架多核苷酸的第一链已经具有单链断裂或“缺口”,因此仅需要裂解第二链即可在支架多核苷酸中提供双链断裂。此外,如先前所述,在该示例性方法版本中,裂解产生具有单碱基突出端的裂解的双链支架多核苷酸,其中第二链的末端核苷酸突出于第一链的末端核苷酸,并且通用核苷酸在裂解步骤之前占据第二链中的位置n 3。为了在通用核苷酸占据第二链中的位置n 3时获得这种具有单碱基突出端的裂解的双链支架多核苷酸,在相对于通用核苷酸的特定位置裂解第二链。当支架多核苷酸的第二链在核苷酸位置n 3与n 2之间被裂解时,多核苷酸连接分子从支架多核苷酸释放(参见在图1中被描绘为在裂解步骤5(105)后立即退出合成循环的结构),除了来源于步骤(4)中的第二多核苷酸连接分子的所述循环的第一和第二核苷酸保留在支架多核苷酸中,附接至裂解的支架多核苷酸的第二链。
[0888]
磷酸基团或任何其它合适的5’可连接基团应继续在裂解位点附接至裂解的支架多核苷酸的第二链的末端核苷酸。这确保了裂解的支架多核苷酸的第二链可以在下一合成循环的第二延伸/连接步骤(4)中连接至第二多核苷酸连接分子的合成链。进行裂解以使裂解的支架多核苷酸的第一链的末端核苷酸在第一链的3’末端保留可连接基团,通常为羟基或任何其它合适的3’可连接基团。
[0889]
因此,在方法版本1中,通用核苷酸在步骤(4)中占据合成/第二链中的位置n 3,并且第二链在步骤(5)中在核苷酸位置n 3与n 2之间被裂解。
[0890]
优选地,通过裂解核苷酸位置n 3与n 2之间的磷酸二酯键(在连接的多核苷酸连接分子的远端方向/第二链的近端方向上,相对于通用核苷酸的位置而言第二链的第一磷酸二酯键)来裂解第二链。
[0891]
可通过裂解核苷酸位置n 3与n 2之间的磷酸二酯键的一个酯键来裂解第二链。
[0892]
优选地,通过相对于核苷酸位置n 3的第一酯键的裂解来裂解第二链。
[0893]
当通用核苷酸占据位置n 3时,可采用任何合适的机制来实现在核苷酸位置n 3与n 2之间裂解第二链。
[0894]
如上所述在核苷酸位置n 3与n 2之间裂解第二链可通过酶的作用进行。
[0895]
如上所述在核苷酸位置n 3与n 2之间裂解第二链可作为两步裂解过程进行。
[0896]
两步裂解过程的第一裂解步骤可包括从第二链上去除通用核苷酸,从而在位置n 3处形成无碱基位点,并且第二裂解步骤可包括在位置n 3与n 2之间在无碱基位点处裂解第二链。
[0897]
实施例2中以类似方式描述了一种以上述方式在由包含通用核苷酸的序列限定的裂解位点处裂解第二链的机制。实施例2中描述的裂解机制是示例性的,并且可采用其它机制,只要实现上述裂解的双链支架多核苷酸即可。
[0898]
在两步裂解过程的第一裂解步骤中,将通用核苷酸从第二链上去除,同时保留糖-磷酸主链的完整性。这可以通过酶的作用来实现,所述酶可以从双链多核苷酸中特异性地切除单个通用核苷酸。在示例性裂解方法中,通用核苷酸是肌苷,并且通过酶的作用从链中切除肌苷,从而形成无碱基位点。在示例性裂解方法中,酶是3-甲基腺嘌呤dna糖基化酶,特别是人类烷基腺嘌呤dna糖基化酶(haag)。可以使用其它酶、分子或化学物质,只要形成无碱基位点即可。核苷酸切除酶可以是催化尿嘧啶从多核苷酸释放的酶,例如尿嘧啶-dna糖基化酶(udg)。
[0899]
在两步裂解过程的第二步骤中,通过形成单链断裂而在无碱基位点处裂解第二链。在示例性方法中,所述链通过作为碱诸如naoh的化学物质的作用被裂解。可替代地,可使用有机化学物质,诸如n,n
’‑
二甲基乙二胺。可替代地,可以使用具有无碱基位点裂解酶活性的酶,诸如ap核酸内切酶1、核酸内切酶iii(nth)或核酸内切酶viii。可以使用其它酶、分子或化学物质,只要第二链在如上所述的无碱基位点处被裂解即可。
[0900]
因此,在其中通用核苷酸在步骤(4)中处于第二链的位置n 3并且第二链在位置n 3与n 2之间被裂解的实施方案中,第一裂解步骤可用核苷酸切除酶来进行。这种酶的实施例是3-甲基腺嘌呤dna糖基化酶,诸如人类烷基腺嘌呤dna糖基化酶(haag)。第二裂解步骤可以用作为碱的化学物质如naoh进行。第二步可以用具有无碱基位点裂解活性的有机化学物质诸如n,n'-二甲基乙二胺进行。第二步骤可以用具有无碱基位点裂解酶活性的酶如核
酸内切酶viii或核酸内切酶iii进行。
[0901]
如上所述在核苷酸位置n 3与n 2之间裂解第二链也可作为一步裂解过程进行。可用于任何此类方法的酶的实施例包括核酸内切酶iii、核酸内切酶viii。可以在任何这样的方法中使用的其它酶包括裂解8-氧代鸟苷的酶,例如甲酰胺基嘧啶dna糖基化酶(fpg)和8-氧代鸟嘌呤dna糖基化酶(hogg1)。
[0902]
在合成方法版本1中,应注意到,在任何给定的合成循环中,在第二裂解步骤(步骤5)之后,由裂解末端处第二链的末端核苷酸占据的核苷酸位置被定义为核苷酸位置n 2。该核苷酸位置被定义为下一合成循环中的核苷酸位置n。类似地,由裂解末端处第一链的末端核苷酸占据的核苷酸位置被定义为核苷酸位置n 1。该核苷酸位置被定义为下一合成循环中的核苷酸位置n-1。
[0903]
另外的循环
[0904]
在完成第一合成循环之后,可以使用相同的方法步骤进行第二合成循环和另外的合成循环。
[0905]
提供(在步骤6中)上一循环的步骤(5)的裂解产物作为用于下一合成循环的双链支架多核苷酸。
[0906]
在下一合成循环和每个另外的合成循环的步骤(7)中,将另一个第一双链多核苷酸连接分子连接至上一循环的步骤(5)的裂解产物。所述多核苷酸连接分子可以以与上文针对上一循环的步骤(2)所描述的相同方式构造,不同之处在于,所述另一个第一多核苷酸连接分子包含待掺入第一链中的另外的合成循环的另外的第一和第二核苷酸。在步骤(7)中,所述另一个第一多核苷酸连接分子可以以与上文针对步骤(2)所描述的相同方式连接至上一循环的步骤(5)的裂解产物。
[0907]
在下一合成循环和每个另外的合成循环的步骤(8)中,在裂解位点对连接的支架多核苷酸进行另一个第一裂解步骤。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤8)导致失去另一个第一多核苷酸连接分子中的辅助链并失去包含通用核苷酸的支持链。支架多核苷酸的裂解由此从支架多核苷酸中释放另一个第一多核苷酸连接分子,但导致附接至裂解的支架多核苷酸的合成链的来源于另一个第一多核苷酸连接分子的所述另外的循环的另外的第一和第二核苷酸的保留。支架多核苷酸的裂解留下在支架多核苷酸的合成链的末端包含另外的循环的另外的第一和第二核苷酸的裂解的双链支架多核苷酸。裂解导致单碱基突出端,其中第一链的末端核苷酸突出于第二链的末端核苷酸。步骤(8)的裂解可以以与上文针对步骤(4)所描述的相同方式进行。
[0908]
在下一合成循环和每个另外的合成循环的步骤(9)中,将另一个第二双链多核苷酸连接分子连接至步骤(8)的裂解产物。所述另一个第二多核苷酸连接分子可以以与上文针对上一循环的步骤(8)所描述的相同方式构造,不同之处在于,所述另一个第二多核苷酸连接分子包含待掺入第二链中的另外的合成循环的另外的第一和第二核苷酸。在步骤(9)中,另一个第二多核苷酸连接分子可以以与上文针对步骤(4)所描述的相同方式连接至步骤(8)的裂解产物。
[0909]
在下一合成循环和每个另外的合成循环的步骤(10)中,在裂解位点对连接的支架多核苷酸进行另一个第二裂解步骤。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤10)导致失去另一个第二多核苷酸连接分子中的辅助链并失去包含通用核苷
酸的支持链。支架多核苷酸的裂解由此从支架多核苷酸中释放另一个第二多核苷酸连接分子,但导致附接至裂解的支架多核苷酸的合成链的来源于另一个第二多核苷酸连接分子的所述另外的循环的另外的第一和第二核苷酸的保留。支架多核苷酸的裂解留下在支架多核苷酸的第二链的末端包含来源于另一个第二多核苷酸连接分子的另外的循环的另外的第一和第二核苷酸的裂解的双链支架多核苷酸。另外的第二核苷酸是第二链的末端核苷酸并且以单碱基突出端的形式突出于第一链的末端核苷酸。步骤(10)处的裂解可以以与上文针对步骤(5)所描述的相同的方式进行。
[0910]
合成方法版本2
[0911]
步骤1-提供支架多核苷酸
[0912]
在本发明的合成方法的示例性版本2中,在步骤(1)中提供双链支架多核苷酸(201)。提供了包含第一链和与其杂交的第二链的双链支架多核苷酸。第一链的待延伸末端处的末端核苷酸位于第一链的3’末端并且包含羟基或任何其它合适的3’可连接基团,因此该末端核苷酸是可连接核苷酸。在图2中,该核苷酸被描绘为“x”并且可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。第一链的待延伸末端处的末端核苷酸被描绘为与第二链的5’末端的次末端核苷酸配对。该次末端核苷酸被描绘为“x”并且可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且可与或可不与所述对中的其配偶体核苷酸互补。优选是互补的。第二链的5’末端的末端核苷酸未配对并且形成单碱基突出端并突出于第一条的末端3’核苷酸。第二链5’末端的末端核苷酸被描绘为“a”。然而,该核苷酸可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。该核苷酸可以被认为是预定序列的核苷酸。第二链5’末端的末端核苷酸包含磷酸基团或任何其它合适的5’可连接基团,并且因此该末端核苷酸也是可连接核苷酸。
[0913]
未示出为待延伸的支架多核苷酸的末端,即在图2中标记3’和5’的那些,优选地附接至基底,诸如通过本文所述的任何方式。
[0914]
步骤2-将第一多核苷酸连接分子连接至支架多核苷酸并掺入预定序列的一个或多个核苷酸
[0915]
在该方法的步骤(2)中,在粘性(互补)末端连接反应中,通过具有连接酶活性的酶的作用将双链多核苷酸连接分子连接(202)至支架多核苷酸。
[0916]
多核苷酸连接分子包含合成链和与其杂交的辅助链。多核苷酸连接分子还包含互补连接末端,其在合成链中包含通用核苷酸和预定序列的两个核苷酸。
[0917]
第一多核苷酸连接分子的互补连接末端被构造成使得合成链的末端和次末端核苷酸分别是在任何给定的合成循环中被掺入到支架多核苷酸的第一链中的预定序列的第一和第二核苷酸。
[0918]
互补连接末端包含单碱基突出端。合成链的末端核苷酸未配对并突出于辅助链的末端核苷酸。合成链的次末端核苷酸与辅助链的末端核苷酸配对。在图2中,合成链的末端核苷酸被描绘为“t”,合成链的次末端核苷酸被描绘为“g”,并且辅助链的末端核苷酸被描绘为“c”。这些名称中的每一个仅用于说明目的。它们可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。合成链的次末端核苷酸和辅助链的末端核苷酸可以互补或可以不互补。优选地,它们是互补的。
[0919]
在第一多核苷酸连接分子的互补连接末端处的合成链末端,通用核苷酸占据在远
离互补连接末端的方向上紧邻次末端核苷酸的位置。通用核苷酸与作为辅助链中远离互补连接末端方向上的次末端核苷酸的核苷酸形成核苷酸对。
[0920]
第一多核苷酸连接分子的互补连接末端处的合成链末端核苷酸在图2中被描绘为处于合成链的5’末端。该核苷酸作为可连接核苷酸提供并且包含磷酸基团或任何其它合适的5’可连接基团。第一多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸在图2中被描绘为处于辅助链的3’末端。该核苷酸作为不可连接核苷酸提供并且包括不可连接的2’,3
’‑
双脱氧核苷酸或2
’‑
脱氧核苷酸,或任何其它合适的不可连接的3’核苷酸。
[0921]
合成链的末端核苷酸,即,将在给定的合成循环中掺入第一链的预定序列的第一核苷酸,占据合成链中的核苷酸位置n。第一多核苷酸连接分子的合成链中的位置n是指在多核苷酸连接分子连接至支架多核苷酸之后将被附接至支架多核苷酸第一链末端的第一核苷酸占据的位置。位置n还指在连接之后由所述第一核苷酸在其附接至第一链的末端之后在连接的支架多核苷酸的第一链中占据的核苷酸位置。位置n还指在第二延伸/连接反应之后在所述第一核苷酸的配偶体核苷酸附接至第二链末端之后将由所述配偶体核苷酸在支架多核苷酸的第二链中占据的核苷酸位置。位置n还指在第二延伸/连接反应之后由所述配偶体核苷酸在其附接至第二链末端后所占据的核苷酸位置。第一多核苷酸连接分子的合成链中的通用核苷酸占据位置n 2。
[0922]
第一多核苷酸连接分子的互补连接末端被配置成使得当经受合适的连接条件时,它将与支架多核苷酸的突出末端相容地连结。在多核苷酸连接分子的合成链和支架多核苷酸的第一链连接后,合成链的末端和次末端核苷酸变得被掺入支架多核苷酸中。由于第一多核苷酸连接分子的辅助链的末端核苷酸是不可连接核苷酸,因此将阻止连接酶连接第一多核苷酸连接分子的辅助链和支架多核苷酸的第二链,从而在第一多核苷酸连接分子的辅助链与支架多核苷酸的第二链之间产生单链断裂或“缺口”。
[0923]
多核苷酸连接分子与支架多核苷酸的连接延长了步骤(1)的双链支架多核苷酸的第一链的长度,并且其中多核苷酸连接分子的合成链的末端和次末端核苷酸被掺入到支架多核苷酸的第一链中。
[0924]
可通过任何合适的方式进行连接。连接通常可以并且优选地通过具有连接酶活性的酶来进行。例如,可以用t3 dna连接酶或t4 dna连接酶或其功能性变体或等同物或本文所述的其它酶进行连接。此类酶的使用将导致单链断裂的维持,因为辅助链的末端核苷酸被提供使得其无法充当连接酶的底物,如上文所述。
[0925]
步骤3-第一裂解步骤
[0926]
在该方法的步骤(3)中,连接的支架多核苷酸在裂解位点被裂解(203)。裂解位点由连接的第一多核苷酸连接分子的合成链中包含通用核苷酸的序列限定。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤3)导致失去连接的第一多核苷酸连接分子的辅助链并且失去包含通用核苷酸的合成链。支架多核苷酸的裂解从而从支架多核苷酸中释放多核苷酸连接分子,但是导致附接至裂解的支架多核苷酸的第一链的所述循环的第一和第二核苷酸的保留。支架多核苷酸的裂解留下在裂解末端包含单碱基突出端的裂解的双链支架多核苷酸。预定序列的第二核苷酸占据位置(n 1)作为裂解的双链支架多核苷酸的第一链的末端核苷酸,并且预定序列的第一核苷酸占据位置(n)作为裂解的第一链的次末端核苷酸。在第一延伸/连接步骤之前,预定序列的第一核苷酸与作为步骤(1)(201)中的
双链支架多核苷酸中的第二链的末端突出核苷酸的核苷酸配对。在图2中,这些核苷酸被描绘(203)为“a”和“t”,仅用于说明目的。这些核苷酸中的每一个可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且所述对可以是互补的或可以不是互补的。优选地,它们是互补的。
[0927]
在该示例性方法中,连接的支架多核苷酸的第二链已经具有单链断裂或“缺口”,因此仅需要裂解第一链即可在支架多核苷酸中提供双链断裂。此外,如先前所述,在该示例性方法版本中,裂解产生具有单碱基突出端的裂解的双链支架多核苷酸,其中第一链的末端核苷酸突出于第二链的末端核苷酸,并且通用核苷酸在裂解步骤之前占据第一链中的位置n 2。为了在通用核苷酸占据第一链中的位置n 2时获得这种具有单碱基突出端的裂解的双链支架多核苷酸,在相对于通用核苷酸的特定位置裂解连接的第一链。当支架多核苷酸的第一链在核苷酸位置n 2与n 1之间被裂解时,多核苷酸连接分子从支架多核苷酸中释放(参见在图2中被描绘为在裂解步骤3(203)后立即退出合成循环的结构),除了来源于步骤(2)中的第一多核苷酸连接分子的所述循环的第一和第二核苷酸保留在支架多核苷酸中,附接至裂解的支架多核苷酸的第一链。
[0928]
磷酸基团或任何其它合适的5’可连接基团应继续在裂解位点附接至裂解的支架多核苷酸的第二链的末端核苷酸。这确保了裂解的支架多核苷酸的第二链可以在第二延伸/连接步骤(4)中连接至第二多核苷酸连接分子的合成链。进行裂解以使裂解的支架多核苷酸的第一链的末端核苷酸在第一链的3’末端保留可连接基团,通常为羟基或任何其它合适的3’可连接基团。
[0929]
因此,在方法版本2中,通用核苷酸在步骤(2)中占据合成/第一链中的位置n 2,并且第一链在步骤(3)中在核苷酸位置n 2与n 1之间被裂解。
[0930]
优选地,通过裂解核苷酸位置n 2与n 1之间的磷酸二酯键(第一链的相对于通用核苷酸的位置的第一磷酸二酯键,在连接的多核苷酸连接分子的远端方向/第一链的近端方向上)来裂解第一链。
[0931]
可通过裂解核苷酸位置n 2与n 1之间的磷酸二酯键的一个酯键来裂解第一链。
[0932]
优选地,通过相对于核苷酸位置n 2的第一酯键的裂解来裂解第一链。
[0933]
当通用核苷酸占据位置n 2时,可采用任何合适的机制来实现在核苷酸位置n 2与n 1之间裂解第一链。
[0934]
如上所述在核苷酸位置n 2与n 1之间裂解第一链可通过酶的作用进行。
[0935]
如上所述在核苷酸位置n 2与n 1之间裂解第一链可作为两步裂解过程进行。
[0936]
两步裂解过程的第一裂解步骤可包括从第一链上去除通用核苷酸,从而在位置n 2处形成无碱基位点,并且第二裂解步骤可包括在位置n 2与n 1之间在无碱基位点处裂解第一链。
[0937]
实施例2中以类似方式描述了一种以上述方式在由包含通用核苷酸的序列限定的裂解位点处裂解第一链的机制。实施例2中描述的裂解机制是示例性的,并且可采用其它机制,只要实现上述裂解的双链支架多核苷酸即可。
[0938]
在两步裂解过程的第一裂解步骤中,将通用核苷酸从第一链上去除,同时保留糖-磷酸主链的完整性。这可以通过酶的作用来实现,所述酶可以从双链多核苷酸中特异性地切除单个通用核苷酸。在示例性裂解方法中,通用核苷酸是肌苷,并且通过酶的作用从第一
链中切除肌苷,从而形成无碱基位点。在示例性裂解方法中,酶是3-甲基腺嘌呤dna糖基化酶,特别是人类烷基腺嘌呤dna糖基化酶(haag)。可以使用其它酶、分子或化学物质,只要形成无碱基位点即可。核苷酸切除酶可以是催化尿嘧啶从多核苷酸释放的酶,例如尿嘧啶-dna糖基化酶(udg)。
[0939]
在两步裂解过程的第二步骤中,通过形成单链断裂而在无碱基位点处裂解第一链。在示例性方法中,第一链通过作为碱诸如naoh的化学物质的作用被裂解。可替代地,可使用有机化学物质,诸如n,n
’‑
二甲基乙二胺。可替代地,可以使用具有无碱基位点裂解酶活性的酶,诸如ap核酸内切酶1、核酸内切酶iii(nth)或核酸内切酶viii。这些酶在相对于无碱基位点位于5’的磷酸基团处裂解dna主链。因此,裂解在第一链的3’末端暴露了oh基团,所述oh基团提供了末端3’核苷酸,所述核苷酸可在下一循环的第一连接步骤中连接。可以使用其它酶、分子或化学物质,只要第一链在如上所述的无碱基位点处被裂解即可。
[0940]
因此,在其中通用核苷酸在步骤(2)中处于第一链的位置n 2并且第一链在位置n 2与n 1之间被裂解的实施方案中,第一裂解步骤可用核苷酸切除酶来执行。这种酶的实施例是3-甲基腺嘌呤dna糖基化酶,诸如人类烷基腺嘌呤dna糖基化酶(haag)。第二裂解步骤可以用作为碱的化学物质如naoh进行。第二步可以用具有无碱基位点裂解活性的有机化学物质诸如n,n'-二甲基乙二胺进行。第二步骤可以用具有无碱基位点裂解酶活性的酶如核酸内切酶viii或核酸内切酶iii进行。
[0941]
如上所述在核苷酸位置n 2与n 1之间裂解第一链也可作为一步裂解过程进行。可用于任何此类方法的酶的实施例包括核酸内切酶iii、核酸内切酶viii。可用于任何此类过程的其它酶包括裂解8-氧代鸟苷的酶,诸如甲酰胺基嘧啶dna糖基化酶(fpg)和8-氧代鸟嘌呤dna糖基化酶(hogg1),它们裂解dna主链以在裂解的第一链的3’末端留下磷酸基团,然后可以通过核酸内切酶iv或t4多核苷酸激酶将其去除以暴露oh基团,所述oh基团可在下一循环的第一连接步骤中连接。
[0942]
步骤4-将第二多核苷酸连接分子连接至支架多核苷酸并掺入预定序列的一个或多个另外的核苷酸
[0943]
在该方法的步骤(4)中,在粘性(互补)末端连接反应中,通过具有连接酶活性的酶的作用将第二双链多核苷酸连接分子连接(204)至支架多核苷酸。
[0944]
第二多核苷酸连接分子包含合成链和与其杂交的辅助链。第二多核苷酸连接分子还包含互补连接末端,其在合成链中包含通用核苷酸和预定序列的两个另外的核苷酸。
[0945]
第二多核苷酸连接分子的互补连接末端被构造成使得合成链的末端和次末端核苷酸分别是在任何给定的合成循环中被掺入到支架多核苷酸的第二链中的预定序列的第一和第二核苷酸。
[0946]
互补连接末端包含单碱基突出端。合成链的末端核苷酸未配对并突出于辅助链的末端核苷酸。合成链的次末端核苷酸与辅助链的末端核苷酸配对。在图2中,合成链的末端核苷酸被描绘为“c”,合成链的次末端核苷酸被描绘为“t”,并且辅助链的末端核苷酸被描绘为“a”。这些名称中的每一个仅用于说明目的。它们可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。合成链的次末端核苷酸和辅助链的末端核苷酸可以互补或可以不互补。优选地,它们是互补的。
[0947]
在第二多核苷酸连接分子的互补连接末端处的合成链末端,通用核苷酸占据位置
n 4,所述位置为在远离互补连接末端的方向上距离合成链的末端核苷酸的第三位置,末端核苷酸占据位置n 1并且次末端核苷酸占据位置n 2。参考第一延伸/连接反应中位置n的定义,位置n是指支架多核苷酸的第二链中由在第一延伸/连接反应之后附接至第一链末端的第一核苷酸的配偶体核苷酸占据的核苷酸位置。
[0948]
通用核苷酸与占据在远离互补连接末端的方向上紧邻辅助链的次末端核苷酸的位置的核苷酸形成核苷酸对。这在图2中被描绘为“x”。它可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。在图2中,在合成链和辅助链中占据位置n 3的核苷酸被描绘为“x”,仅用于说明目的。这些核苷酸中的每一个可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且它们可以是互补的或可以不是互补的。
[0949]
第二多核苷酸连接分子的互补连接末端处的合成链末端核苷酸在图2中被描绘为处于合成链的3’末端。该核苷酸作为可连接核苷酸提供并且包含羟基或任何其它合适的3’可连接基团。第二多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸在图2中被描绘为处于辅助链的5’末端。该核苷酸作为不可连接的核苷酸提供,例如缺少磷酸基团或具有任何合适的可阻止连接的5’封闭基团。
[0950]
第二多核苷酸连接分子的互补连接末端被配置成使得当经受合适的连接条件时,它将与在步骤(3)中产生的裂解的支架多核苷酸的突出末端相容地连结。在第二多核苷酸连接分子的合成链和裂解的支架多核苷酸的第二链连接后,第二多核苷酸连接的合成链的末端和次末端核苷酸变得被掺入裂解的支架多核苷酸的第二链中。由于第二多核苷酸连接分子的辅助链的末端核苷酸是不可连接核苷酸,因此将阻止连接酶连接第二多核苷酸连接分子的辅助链和裂解的支架多核苷酸的第一链,从而在第二多核苷酸连接分子的辅助链与裂解的支架多核苷酸的第一链之间产生单链断裂或“缺口”。
[0951]
第二多核苷酸连接分子与裂解的支架多核苷酸的连接延长了步骤(3)的双链支架多核苷酸的第二链的长度,并且其中第二多核苷酸连接分子序列的合成链的末端和次末端核苷酸被掺入到支架多核苷酸的第二链中。
[0952]
可通过任何合适的方式进行连接。连接通常可以并且优选地通过具有连接酶活性的酶来进行。例如,可以用t3 dna连接酶或t4 dna连接酶或其功能性变体或等同物或本文所述的其它酶进行连接。此类酶的使用将导致单链断裂的维持,因为辅助链的末端核苷酸被提供使得其无法充当连接酶的底物,如上文所述。
[0953]
连接后,第二多核苷酸连接分子的合成链的末端核苷酸与在步骤(3)中产生的裂解的支架多核苷酸的第一链的末端核苷酸配对,从而形成核苷酸对。
[0954]
步骤5-第二裂解步骤
[0955]
在该方法的步骤(5)中,连接的支架多核苷酸在裂解位点被裂解(205)。裂解位点由连接的第二多核苷酸连接分子的合成链中包含通用核苷酸的序列限定。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤5)导致失去连接的第二多核苷酸连接分子的辅助链并且失去包含通用核苷酸的合成链。支架多核苷酸的裂解从而从支架多核苷酸中释放第二多核苷酸连接分子,但是导致附接至裂解的支架多核苷酸的第二链的两个核苷酸的保留。支架多核苷酸的裂解留下在裂解末端包含单碱基突出端的裂解的双链支架多核苷酸。在步骤(4)中掺入的预定序列的第二核苷酸占据位置(n 2)作为裂解的双链支架多核苷酸的第二链的末端核苷酸,并且在步骤(4)中掺入的预定序列的第一核苷酸占据位置(n
1)作为裂解的第二链的次末端核苷酸。在第一裂解步骤之后,在步骤(4)中掺入的预定序列的第一核苷酸与作为步骤(3)(203)中的双链支架多核苷酸中的第一链的末端突出核苷酸的核苷酸配对。在图2中,这些核苷酸被描绘(205)为“c”和“g”,仅用于说明目的。这些核苷酸中的每一个可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且所述对可以是互补的或可以不是互补的。优选地,它们是互补的。
[0956]
在该示例性方法中,在第二裂解步骤之前,连接的支架多核苷酸的第一链已经具有单链断裂或“缺口”,因此仅需要裂解第二链即可在支架多核苷酸中提供双链断裂。此外,如先前所述,在该示例性方法版本中,裂解产生具有单碱基突出端的裂解的双链支架多核苷酸,其中第二链的末端核苷酸突出于第一链的末端核苷酸,并且通用核苷酸在裂解步骤之前占据第二链中的位置n 4。为了在通用核苷酸占据第二链中的位置n 4时获得这种具有单碱基突出端的裂解的双链支架多核苷酸,在相对于通用核苷酸的特定位置裂解第二链。当支架多核苷酸的第二链在核苷酸位置n 3与n 2之间被裂解时,多核苷酸连接分子从支架多核苷酸释放(参见在图2中被描绘为在裂解步骤5(205)后立即退出合成循环的结构),除了来源于步骤(4)中的第二多核苷酸连接分子的所述循环的第一和第二核苷酸保留在支架多核苷酸中,附接至裂解的支架多核苷酸的第二链。
[0957]
磷酸基团或任何其它合适的5’可连接基团应继续在裂解位点附接至裂解的支架多核苷酸的第二链的末端核苷酸。这确保了裂解的支架多核苷酸的第二链可以在下一合成循环的第二延伸/连接步骤(4)中连接至第二多核苷酸连接分子的合成链。进行裂解以使裂解的支架多核苷酸的第一链的末端核苷酸在第一链的3’末端保留可连接基团,通常为羟基或任何其它合适的3’可连接基团。
[0958]
因此,在方法版本2中,通用核苷酸在步骤(4)中占据合成/第二链中的位置n 4,并且第二链在步骤(5)中在核苷酸位置n 3与n 2之间被裂解。
[0959]
优选地,通过裂解核苷酸位置n 3与n 2之间的磷酸二酯键(在连接的多核苷酸连接分子的远端方向/第二链的近端方向上,相对于通用核苷酸的位置而言第二链的第一磷酸二酯键)来裂解第二链。
[0960]
可通过裂解核苷酸位置n 3与n 2之间的磷酸二酯键的一个酯键来裂解第二链。
[0961]
优选地,通过相对于核苷酸位置n 4的第一酯键的裂解来裂解第二链。
[0962]
当通用核苷酸占据位置n 4时,可采用任何合适的机制来实现在核苷酸位置n 3与n 2之间裂解第二链。
[0963]
如上所述在核苷酸位置n 3与n 2之间裂解第二链可通过酶的作用进行。
[0964]
如上所述,当通用核苷酸占据第二链中的位置n 4时,在核苷酸位置n 3与n 2之间裂解第二链可通过酶诸如核酸内切酶v的作用来进行。
[0965]
在实施例3中以类似方式描述了一种在由包含在第二链中占据位置n 4的通用核苷酸的序列限定的裂解位点处在核苷酸位置n 3与n 2之间裂解第二链的机制。所描述的机制为示例性的并且可采用其它机制,其条件是实现上文所描述的裂解布置。
[0966]
在此示例性机制中,采用核酸内切酶。在示例性方法中,酶是核酸内切酶v。可以使用其它酶、分子或化学物质,只要当通用核苷酸占据第二链中的位置n 4时,在核苷酸位置n 3与n 2之间裂解第二链即可。
[0967]
在合成方法版本2中,应注意到,在任何给定的合成循环中,在第二裂解步骤(步骤
5)之后,由裂解末端处第二链的末端核苷酸占据的核苷酸位置被定义为核苷酸位置n 2。该核苷酸位置被定义为下一合成循环中的核苷酸位置n。类似地,由裂解末端处第一链的末端核苷酸占据的核苷酸位置被定义为核苷酸位置n 1。该核苷酸位置被定义为下一合成循环中的核苷酸位置n-1。
[0968]
另外的循环
[0969]
在完成第一合成循环之后,可以使用相同的方法步骤进行第二合成循环和另外的合成循环。
[0970]
提供(在步骤6中)上一循环的步骤(5)的裂解产物作为用于下一合成循环的双链支架多核苷酸。
[0971]
在下一合成循环和每个另外的合成循环的步骤(7)中,将另一个第一双链多核苷酸连接分子连接至上一循环的步骤(5)的裂解产物。所述多核苷酸连接分子可以以与上文针对上一循环的步骤(2)所描述的相同方式构造,不同之处在于,所述另一个第一多核苷酸连接分子包含待掺入第一链中的另外的合成循环的另外的第一和第二核苷酸。在步骤(7)中,所述另一个第一多核苷酸连接分子可以以与上文针对步骤(2)所描述的相同方式连接至上一循环的步骤(5)的裂解产物。
[0972]
在下一合成循环和每个另外的合成循环的步骤(8)中,在裂解位点对连接的支架多核苷酸进行另一个第一裂解步骤。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤8)导致失去另一个第一多核苷酸连接分子中的辅助链并失去包含通用核苷酸的支持链。支架多核苷酸的裂解由此从支架多核苷酸中释放另一个第一多核苷酸连接分子,但导致附接至裂解的支架多核苷酸的合成链的来源于另一个第一多核苷酸连接分子的所述另外的循环的另外的第一和第二核苷酸的保留。支架多核苷酸的裂解留下在支架多核苷酸的合成链的末端包含另外的循环的另外的第一和第二核苷酸的裂解的双链支架多核苷酸。裂解导致单碱基突出端,其中第一链的末端核苷酸突出于第二链的末端核苷酸。步骤(8)的裂解可以以与上文针对步骤(4)所描述的相同方式进行。
[0973]
在下一合成循环和每个另外的合成循环的步骤(9)中,将另一个第二双链多核苷酸连接分子连接至步骤(8)的裂解产物。所述另一个第二多核苷酸连接分子可以以与上文针对上一循环的步骤(8)所描述的相同方式构造,不同之处在于,所述另一个第二多核苷酸连接分子包含待掺入第二链中的另外的合成循环的另外的第一和第二核苷酸。在步骤(9)中,另一个第二多核苷酸连接分子可以以与上文针对步骤(4)所描述的相同方式连接至步骤(8)的裂解产物。
[0974]
在下一合成循环和每个另外的合成循环的步骤(10)中,在裂解位点对连接的支架多核苷酸进行另一个第二裂解步骤。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤10)导致失去另一个第二多核苷酸连接分子中的辅助链并失去包含通用核苷酸的支持链。支架多核苷酸的裂解由此从支架多核苷酸中释放另一个第二多核苷酸连接分子,但导致附接至裂解的支架多核苷酸的合成链的来源于另一个第二多核苷酸连接分子的所述另外的循环的另外的第一和第二核苷酸的保留。支架多核苷酸的裂解留下在支架多核苷酸的第二链的末端包含来源于另一个第二多核苷酸连接分子的另外的循环的另外的第一和第二核苷酸的裂解的双链支架多核苷酸。另外的第二核苷酸是第二链的末端核苷酸并且以单碱基突出端的形式突出于第一链的末端核苷酸。步骤(10)处的裂解可以以与上文针
对步骤(5)所描述的相同的方式进行。
[0975]
合成方法版本3
[0976]
步骤1-提供支架多核苷酸
[0977]
在本发明的合成方法的示例性版本3中,在步骤(1)中提供双链支架多核苷酸(301)。提供了包含第一链和与其杂交的第二链的双链支架多核苷酸。第一链的待延伸末端处的末端核苷酸位于第一链的3’末端并且包含羟基或任何其它合适的3’可连接基团,因此该末端核苷酸是可连接核苷酸。在图3中,该核苷酸被描绘为“x”并且可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。第一链的待延伸末端处的末端核苷酸被描绘为与第二链的5’末端的末端核苷酸配对。该末端核苷酸被描绘为“x”并且可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且可与或可不与所述对中的其配偶体核苷酸互补。优选是互补的。由于第二链的5’末端的末端核苷酸与第一链的末端3’核苷酸配对,因此待延伸的支架多核苷酸的末端是平末端的,没有突出的核苷酸。第二链5’末端的末端核苷酸包含磷酸基团或任何其它合适的5’可连接基团,并且因此该末端核苷酸也是可连接核苷酸。
[0978]
未示出为待延伸的支架多核苷酸的末端,即在图3中标记3’和5’的那些,优选地附接至基底,诸如通过本文所述的任何方式。
[0979]
步骤2-将第一多核苷酸连接分子连接至支架多核苷酸并掺入预定序列的一个或多个核苷酸
[0980]
在该方法的步骤(2)中,在平末端连接反应中,通过具有连接酶活性的酶的作用将双链多核苷酸连接分子连接(302)至支架多核苷酸。
[0981]
多核苷酸连接分子包含合成链和与其杂交的辅助链。多核苷酸连接分子还包含互补连接末端,其在合成链中包含通用核苷酸和预定序列的核苷酸。
[0982]
第一多核苷酸连接分子的互补连接末端被构造成使得合成链的末端核苷酸是在任何给定的合成循环中被掺入支架多核苷酸中的预定序列的第一核苷酸。合成链的末端核苷酸与辅助链的末端核苷酸配对。在图3中,合成链的末端核苷酸被描绘为“t”并且辅助链的末端核苷酸被描绘为“a”。这些名称中的每一个仅用于说明目的。它们可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且它们可以是互补的或可以不是互补的。优选地,它们是互补的。
[0983]
通用核苷酸是第一多核苷酸连接分子的互补连接末端处的合成链末端的次末端核苷酸。通用核苷酸与第一多核苷酸连接分子的互补连接末端处的辅助链末端的次末端核苷酸形成核苷酸对。在图3中,互补连接末端处的辅助链末端的次末端核苷酸被描绘为“x”,仅用于说明目的。它可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。
[0984]
第一多核苷酸连接分子的互补连接末端处的合成链末端核苷酸在图3中被描绘为处于合成链的5’末端。该核苷酸是可连接核苷酸并且具有磷酸基团或任何其它合适的5’可连接基团。第一多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸在图3中被描绘为处于辅助链的3’末端。该核苷酸作为不可连接的核苷酸提供并且包括不可连接的2’,3
’‑
双脱氧核苷酸或2
’‑
脱氧核苷酸,或任何其它合适的不可连接的核苷酸。
[0985]
合成链的末端核苷酸,即,将在给定的合成循环中掺入第一链的预定序列的第一核苷酸,占据合成链中的核苷酸位置n。第一多核苷酸连接分子的合成链中的位置n是指在多核苷酸连接分子连接至支架多核苷酸之后将被附接至支架多核苷酸第一链末端的第一
核苷酸占据的位置。位置n还指在连接之后由所述第一核苷酸在其附接至第一链的末端之后在连接的支架多核苷酸的第一链中占据的核苷酸位置。位置n还指在第二延伸/连接反应之后在所述第一核苷酸的配偶体核苷酸附接至第二链末端之后将由所述配偶体核苷酸在支架多核苷酸的第二链中占据的核苷酸位置。位置n还指在第二延伸/连接反应之后由所述配偶体核苷酸在其附接至第二链末端后所占据的核苷酸位置。第一多核苷酸连接分子的合成链中的通用核苷酸占据位置n 1。
[0986]
第一多核苷酸连接分子的互补连接末端被配置成使得当经受合适的连接条件时,它将与支架多核苷酸的平末端相容地连结。在多核苷酸连接分子的合成链和支架多核苷酸的第一链连接后,合成链的末端核苷酸变得被掺入支架多核苷酸的第一链中。由于多核苷酸连接分子的辅助链的末端核苷酸是不可连接核苷酸,因此将阻止连接酶连接第一多核苷酸连接分子的辅助链和支架多核苷酸的第二链,从而在第一多核苷酸连接分子的辅助链与支架多核苷酸的第二链之间产生单链断裂或“缺口”。
[0987]
多核苷酸连接分子与支架多核苷酸的连接延长了步骤(1)的双链支架多核苷酸的第一链的长度,并且其中第一多核苷酸连接分子的合成链的末端核苷酸被掺入到支架多核苷酸的第一链中。
[0988]
可通过任何合适的方式进行连接。连接通常可以并且优选地通过具有连接酶活性的酶来进行。例如,可以用t3 dna连接酶或t4 dna连接酶或其功能性变体或等同物或本文所述的其它酶进行连接。此类酶的使用将导致单链断裂的维持,因为辅助链的末端核苷酸被提供使得其无法充当连接酶的底物,如上文所述。
[0989]
步骤3-第一裂解步骤
[0990]
在该方法的步骤(3)中,连接的支架多核苷酸在裂解位点被裂解(303)。裂解位点由连接的第一多核苷酸连接分子的合成链中包含通用核苷酸的序列限定。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤3)导致失去连接的第一多核苷酸连接分子的辅助链并且失去包含通用核苷酸的合成链。支架多核苷酸的裂解从而从支架多核苷酸中释放多核苷酸连接分子,但是导致附接至裂解的支架多核苷酸的第一链的所述循环的第一核苷酸的保留。支架多核苷酸的裂解留下在裂解末端包含单碱基突出端的裂解的双链支架多核苷酸。预定序列的第一核苷酸占据位置(n)作为裂解的双链支架多核苷酸的第一链的末端核苷酸并且突出于第二链在裂解末端的末端核苷酸。
[0991]
在该示例性方法中,连接的支架多核苷酸的第二链已经具有单链断裂或“缺口”,因此仅需要裂解第一链即可在支架多核苷酸中提供双链断裂。此外,如先前所述,在该示例性方法版本中,裂解产生具有单碱基突出端的裂解的双链支架多核苷酸,其中第一链的末端核苷酸突出于第二链的末端核苷酸,并且通用核苷酸在裂解步骤之前占据第一链中的位置n 1。为了在通用核苷酸占据第一链中的位置n 1时获得这种具有单碱基突出端的裂解的双链支架多核苷酸,在相对于通用核苷酸的特定位置裂解第一链。当支架多核苷酸的第一链在核苷酸位置n 1与n之间被裂解时,多核苷酸连接分子从支架多核苷酸释放(参见在图3中被描绘为在裂解步骤3(303)后立即退出合成循环的结构),除了来源于步骤(2)中的第一多核苷酸连接分子的所述循环的第一核苷酸保留在支架多核苷酸中,附接至裂解的支架多核苷酸的第一链。
[0992]
磷酸基团或任何其它合适的5’可连接基团应继续在裂解位点附接至裂解的支架
多核苷酸的第二链的末端核苷酸。这确保了裂解的支架多核苷酸的第二链可以在第二延伸/连接步骤(4)中连接至第二多核苷酸连接分子的合成链。进行裂解以使裂解的支架多核苷酸的第一链的末端核苷酸在第一链的3’末端保留可连接基团,通常为羟基或任何其它合适的3’可连接基团。
[0993]
因此,在方法版本3中,通用核苷酸在步骤(2)中占据合成/第一链中的位置n 1,并且第一链在步骤(3)中在核苷酸位置n 1与n之间被裂解。
[0994]
优选地,通过裂解核苷酸位置n 1与n之间的磷酸二酯键(在连接的多核苷酸连接分子的远端方向/第一链的近端方向上,相对于通用核苷酸的位置而言第一链的第一磷酸二酯键)来裂解第一链。
[0995]
可通过裂解核苷酸位置n 1与n之间的磷酸二酯键的一个酯键来裂解第一链。
[0996]
优选地,通过相对于核苷酸位置n 1的第一酯键的裂解来裂解第一链。
[0997]
当通用核苷酸占据位置n 1时,可采用任何合适的机制来实现在核苷酸位置n 1与n之间裂解第一链。
[0998]
如上所述在核苷酸位置n 1与n之间裂解第一链可通过酶的作用进行。
[0999]
如上所述在核苷酸位置n 1与n之间裂解第一链可作为两步裂解过程进行。
[1000]
两步裂解过程的第一裂解步骤可包括从第一链上去除通用核苷酸,从而在位置n 1处形成无碱基位点,并且第二裂解步骤可包括在位置n 1与n之间在无碱基位点处裂解第一链。
[1001]
实施例2中以类似方式描述了一种以上述方式在由包含通用核苷酸的序列限定的裂解位点处裂解第一链的机制。实施例2中描述的裂解机制是示例性的,并且可采用其它机制,只要实现上述裂解的双链支架多核苷酸即可。
[1002]
在两步裂解过程的第一裂解步骤中,将通用核苷酸从第一链上去除,同时保留糖-磷酸主链的完整性。这可以通过酶的作用来实现,所述酶可以从双链多核苷酸中特异性地切除单个通用核苷酸。在示例性裂解方法中,通用核苷酸是肌苷,并且通过酶的作用从第一链中切除肌苷,从而形成无碱基位点。在示例性裂解方法中,酶是3-甲基腺嘌呤dna糖基化酶,特别是人类烷基腺嘌呤dna糖基化酶(haag)。可以使用其它酶、分子或化学物质,只要形成无碱基位点即可。核苷酸切除酶可以是催化尿嘧啶从多核苷酸释放的酶,例如尿嘧啶-dna糖基化酶(udg)。
[1003]
在两步裂解过程的第二步骤中,通过形成单链断裂而在无碱基位点处裂解第一链。在示例性方法中,第一链通过作为碱诸如naoh的化学物质的作用被裂解。可替代地,可使用有机化学物质,诸如n,n
’‑
二甲基乙二胺。可替代地,可以使用具有无碱基位点裂解酶活性的酶,诸如ap核酸内切酶1、核酸内切酶iii(nth)或核酸内切酶viii。这些酶在相对于无碱基位点位于5’的磷酸基团处裂解dna主链。因此,裂解在第一链的3’末端暴露了oh基团,所述oh基团提供了末端3’核苷酸,所述核苷酸可在下一循环的第一连接步骤中连接。可以使用其它酶、分子或化学物质,只要第一链在如上所述的无碱基位点处被裂解即可。
[1004]
因此,在其中通用核苷酸在步骤(2)中处于第一链的位置n 1并且第一链在位置n 1与n之间被裂解的实施方案中,第一裂解步骤可用核苷酸切除酶来执行。这种酶的实施例是3-甲基腺嘌呤dna糖基化酶,诸如人类烷基腺嘌呤dna糖基化酶(haag)。第二裂解步骤可以用作为碱的化学物质如naoh进行。第二步可以用具有无碱基位点裂解活性的有机化学物
质诸如n,n'-二甲基乙二胺进行。第二步骤可以用具有无碱基位点裂解酶活性的酶如核酸内切酶viii或核酸内切酶iii进行。
[1005]
如上所述在核苷酸位置n 1与n之间裂解第一链也可作为一步裂解过程进行。可用于任何此类方法的酶的实施例包括核酸内切酶iii、核酸内切酶viii。可用于任何此类过程的其它酶包括裂解8-氧代鸟苷的酶,诸如甲酰胺基嘧啶dna糖基化酶(fpg)和8-氧代鸟嘌呤dna糖基化酶(hogg1),它们裂解dna主链以在裂解的第一链的3’末端留下磷酸基团,然后可以通过核酸内切酶iv或t4多核苷酸激酶将其去除以暴露oh基团,所述oh基团可在下一循环的第一连接步骤中连接。
[1006]
步骤4-将第二多核苷酸连接分子连接至支架多核苷酸并掺入预定序列的一个或多个另外的核苷酸
[1007]
在该方法的步骤(4)中,在粘性(互补)末端连接反应中,通过具有连接酶活性的酶的作用将第二双链多核苷酸连接分子连接(304)至裂解的支架多核苷酸。
[1008]
第二多核苷酸连接分子包含合成链和与其杂交的辅助链。第二多核苷酸连接分子还包含互补连接末端,其在合成链中包含通用核苷酸和预定序列的另外的核苷酸。
[1009]
第二多核苷酸连接分子的互补连接末端被构造成使得合成链的末端核苷酸是在任何给定的合成循环中被掺入裂解的支架多核苷酸的第二链中的预定序列的第一核苷酸。
[1010]
互补连接末端包含单碱基突出端。合成链的末端核苷酸未配对并突出于辅助链的末端核苷酸。在图3中,合成链的末端核苷酸被描绘为“a”,仅用于说明目的。它可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。
[1011]
通用核苷酸是第二多核苷酸连接分子的互补连接末端处的合成链末端的次末端核苷酸。通用核苷酸与第二多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸形成核苷酸对。在图3中,互补连接末端处的辅助链的末端核苷酸被描绘为“x”,仅用于说明目的。它可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。
[1012]
第二多核苷酸连接分子的互补连接末端处的合成链末端核苷酸在图3中被描绘为处于合成链的3’末端。该核苷酸是可连接核苷酸并且具有羟基或任何其它合适的3’可连接基团。第二多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸在图3中被描绘为处于辅助链的5’末端。该核苷酸作为不可连接的核苷酸提供,例如缺少磷酸基团或具有任何合适的可阻止连接的5’封闭基团。
[1013]
合成链的末端核苷酸,即待掺入裂解的支架多核苷酸的第二链的所述循环的预定序列的第一核苷酸,占据合成链中的核苷酸位置n。参考第一延伸/连接反应中位置n的定义,位置n是指第二多核苷酸连接分子的合成链中在第二延伸/连接反应之后在第一链中步骤(2)的第一核苷酸的配偶体核苷酸附接至第二链的末端之后由作为所述配偶体核苷酸的核苷酸所占据的核苷酸位置。位置n还指在第二延伸/连接反应之后由所述配偶体核苷酸在其附接至第二链末端后所占据的核苷酸位置。位置n还指在步骤(2)中的连接之后由第一核苷酸在其附接至第一链的末端之后在支架多核苷酸的第一链中占据的核苷酸位置。
[1014]
第二多核苷酸连接分子的合成链中的通用核苷酸占据位置n 1。
[1015]
第二多核苷酸连接分子的互补连接末端被配置成使得当经受合适的连接条件时,它将与在步骤(3)中产生的裂解的支架多核苷酸的突出末端相容地连结。在第二多核苷酸连接分子的合成链和支架多核苷酸的第二链连接后,第二多核苷酸连接的合成链的末端核
苷酸变得被掺入裂解的支架多核苷酸的第二链中。由于第二多核苷酸连接分子的辅助链的末端核苷酸是不可连接核苷酸,因此将阻止连接酶连接第二多核苷酸连接分子的辅助链和裂解的支架多核苷酸的第一链,从而在第二多核苷酸连接分子的辅助链与裂解的支架多核苷酸的第一链之间产生单链断裂或“缺口”。
[1016]
第二多核苷酸连接分子与裂解的支架多核苷酸的连接延长了步骤(3)的双链支架多核苷酸的第二链的长度,并且其中第二多核苷酸连接分子序列的合成链的末端核苷酸被掺入到支架多核苷酸的第二链中。
[1017]
可通过任何合适的方式进行连接。连接通常可以并且优选地通过具有连接酶活性的酶来进行。例如,可以用t3 dna连接酶或t4 dna连接酶或其功能性变体或等同物或本文所述的其它酶进行连接。此类酶的使用将导致单链断裂的维持,因为辅助链的末端核苷酸被提供使得其无法充当连接酶的底物,如上文所述。
[1018]
连接后,第二多核苷酸连接分子的合成链的末端核苷酸与在步骤(3)中产生的裂解的支架多核苷酸的第一链的末端核苷酸配对,从而形成核苷酸对。
[1019]
步骤5-第二裂解步骤
[1020]
在该方法的步骤(5)中,连接的支架多核苷酸在裂解位点被裂解(305)。裂解位点由连接的第二多核苷酸连接分子的合成链中包含通用核苷酸的序列限定。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤5)导致失去连接的第二多核苷酸连接分子的辅助链并且失去包含通用核苷酸的合成链。支架多核苷酸的裂解从而从支架多核苷酸中释放第二多核苷酸连接分子,但是导致附接至裂解的支架多核苷酸的第二链的所述循环的第一核苷酸的保留。支架多核苷酸的裂解留下包含平末端的裂解的双链支架多核苷酸。在步骤(4)中掺入的预定序列的第二核苷酸占据位置(n)作为裂解的双链支架多核苷酸的第二链的末端核苷酸,并与在步骤(2)中掺入并在第一链中占据位置n的裂解的双链支架多核苷酸的第一链的第一/末端核苷酸配对。在图3中,这些核苷酸被描绘(305)为“a”和“t”,仅用于说明目的。这些核苷酸中的每一个可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且所述对可以是互补的或可以不是互补的。优选地,它们是互补的。
[1021]
在该示例性方法中,在第二裂解步骤之前,连接的支架多核苷酸的第一链已经具有单链断裂或“缺口”,因此仅需要裂解第二链即可在支架多核苷酸中提供双链断裂。此外,如先前所述,在该示例性方法版本中,裂解产生具有平末端的裂解的双链支架多核苷酸,并且通用核苷酸在第二裂解步骤之前占据第二链中的位置n 1。为了在通用核苷酸占据第二链中的位置n 1时获得这种具有平末端的裂解的双链支架多核苷酸,在相对于通用核苷酸的特定位置裂解第二链。当支架多核苷酸的第二链在核苷酸位置n 1与n之间被裂解时,多核苷酸连接分子从支架多核苷酸释放(参见在图3中被描绘为在裂解步骤5(305)后立即退出合成循环的结构),除了来源于步骤(4)中的第二多核苷酸连接分子的所述循环的第一核苷酸保留在支架多核苷酸中,附接至裂解的支架多核苷酸的第二链。
[1022]
磷酸基团或任何其它合适的5’可连接基团应继续在裂解位点附接至裂解的支架多核苷酸的第二链的末端核苷酸。这确保了裂解的支架多核苷酸的第二链可以在下一合成循环的第二延伸/连接步骤(4)中连接至第二多核苷酸连接分子的合成链。进行裂解以使裂解的支架多核苷酸的第一链的末端核苷酸在第一链的3’末端保留可连接基团,通常为羟基或任何其它合适的3’可连接基团。
[1023]
因此,在方法版本3中,通用核苷酸在步骤(4)中占据合成/第二链中的位置n 1,并且第二链在步骤(5)中在核苷酸位置n 1与n之间被裂解。
[1024]
优选地,通过裂解核苷酸位置n 1与n之间的磷酸二酯键(在连接的多核苷酸连接分子的远端方向/第二链的近端方向上,相对于通用核苷酸的位置而言第二链的第一磷酸二酯键)来裂解第二链。
[1025]
可通过裂解核苷酸位置n 1与n之间的磷酸二酯键的一个酯键来裂解第二链。
[1026]
优选地,通过相对于核苷酸位置n 1的第一酯键的裂解来裂解第二链。
[1027]
当通用核苷酸占据位置n 1时,可采用任何合适的机制来实现在核苷酸位置n 1与n之间裂解第二链。
[1028]
如上所述在核苷酸位置n 1与n之间裂解第二链可通过酶的作用进行。
[1029]
如上所述在核苷酸位置n 1与n之间裂解第二链可作为两步裂解过程进行。
[1030]
两步裂解过程的第一裂解步骤可包括从第二链上去除通用核苷酸,从而在位置n 1处形成无碱基位点,并且第二裂解步骤可包括在位置n 1与n之间在无碱基位点处裂解第二链。
[1031]
实施例2中以类似方式描述了一种以上述方式在由包含通用核苷酸的序列限定的裂解位点处裂解第二链的机制。实施例2中描述的裂解机制是示例性的,并且可采用其它机制,只要实现上述裂解的双链支架多核苷酸即可。
[1032]
在两步裂解过程的第一裂解步骤中,将通用核苷酸从第二链上去除,同时保留糖-磷酸主链的完整性。这可以通过酶的作用来实现,所述酶可以从双链多核苷酸中特异性地切除单个通用核苷酸。在示例性裂解方法中,通用核苷酸是肌苷,并且通过酶的作用从链中切除肌苷,从而形成无碱基位点。在示例性裂解方法中,酶是3-甲基腺嘌呤dna糖基化酶,特别是人类烷基腺嘌呤dna糖基化酶(haag)。可以使用其它酶、分子或化学物质,只要形成无碱基位点即可。核苷酸切除酶可以是催化尿嘧啶从多核苷酸释放的酶,例如尿嘧啶-dna糖基化酶(udg)。
[1033]
在两步裂解过程的第二步骤中,通过形成单链断裂而在无碱基位点处裂解第二链。在示例性方法中,所述链通过作为碱诸如naoh的化学物质的作用被裂解。可替代地,可使用有机化学物质,诸如n,n
’‑
二甲基乙二胺。可替代地,可以使用具有无碱基位点裂解酶活性的酶,诸如ap核酸内切酶1、核酸内切酶iii(nth)或核酸内切酶viii。可以使用其它酶、分子或化学物质,只要第二链在如上所述的无碱基位点处被裂解即可。
[1034]
因此,在其中通用核苷酸在步骤(4)中处于第二链的位置n 1并且第二链在位置n 1与n之间被裂解的实施方案中,第一裂解步骤可用核苷酸切除酶来执行。这种酶的实施例是3-甲基腺嘌呤dna糖基化酶,诸如人类烷基腺嘌呤dna糖基化酶(haag)。第二裂解步骤可以用作为碱的化学物质如naoh进行。第二步可以用具有无碱基位点裂解活性的有机化学物质诸如n,n'-二甲基乙二胺进行。第二步骤可以用具有无碱基位点裂解酶活性的酶如核酸内切酶viii或核酸内切酶iii进行。
[1035]
如上所述在核苷酸位置n 1与n之间裂解第二链也可作为一步裂解过程进行。可用于任何此类方法的酶的实施例包括核酸内切酶iii、核酸内切酶viii。可以在任何这样的方法中使用的其它酶包括裂解8-氧代鸟苷的酶,例如甲酰胺基嘧啶dna糖基化酶(fpg)和8-氧代鸟嘌呤dna糖基化酶(hogg1)。
[1036]
在合成方法版本3中,应注意到,在任何给定的合成循环中,在第二裂解步骤(步骤5)之后,由裂解末端处第一和第二链的末端核苷酸占据的核苷酸位置均被定义为核苷酸位置n。这些核苷酸位置被定义为下一合成循环中的核苷酸位置n-1。
[1037]
另外的循环
[1038]
在完成第一合成循环之后,可以使用相同的方法步骤进行第二合成循环和另外的合成循环。
[1039]
提供(在步骤6中)上一循环的步骤(5)的裂解产物作为用于下一合成循环的双链支架多核苷酸。
[1040]
在下一合成循环和每个另外的合成循环的步骤(7)中,将另一个第一双链多核苷酸连接分子连接至上一循环的步骤(5)的裂解产物。所述多核苷酸连接分子可以以与上文针对上一循环的步骤(2)所描述的相同方式构造,不同之处在于,所述另一个第一多核苷酸连接分子包含待掺入第一链中的另外的合成循环的另外的第一核苷酸。在步骤(7)中,所述另一个第一多核苷酸连接分子可以以与上文针对步骤(2)所描述的相同方式连接至上一循环的步骤(5)的裂解产物。
[1041]
在下一合成循环和每个另外的合成循环的步骤(8)中,在裂解位点对连接的支架多核苷酸进行另一个第一裂解步骤。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤8)导致失去另一个第一多核苷酸连接分子中的辅助链并失去包含通用核苷酸的支持链。支架多核苷酸的裂解由此从支架多核苷酸中释放另一个第一多核苷酸连接分子,但导致附接至裂解的支架多核苷酸的合成链的来源于另一个第一多核苷酸连接分子的所述另外的循环的另外的第一核苷酸的保留。支架多核苷酸的裂解留下在支架多核苷酸的合成链的末端包含另外的循环的另外的第一核苷酸的裂解的双链支架多核苷酸。裂解导致单碱基突出端,其中第一链的末端核苷酸突出于第二链的末端核苷酸。步骤(8)的裂解可以以与上文针对步骤(4)所描述的相同方式进行。
[1042]
在下一合成循环和每个另外的合成循环的步骤(9)中,将另一个第二双链多核苷酸连接分子连接至步骤(8)的裂解产物。所述另一个第二多核苷酸连接分子可以以与上文针对上一循环的步骤(8)所描述的相同方式构造,不同之处在于,所述另一个第二多核苷酸连接分子包含待掺入第二链中的另外的合成循环的另外的第一核苷酸。在步骤(9)中,另一个第二多核苷酸连接分子可以以与上文针对步骤(4)所描述的相同方式连接至步骤(8)的裂解产物。
[1043]
在下一合成循环和每个另外的合成循环的步骤(10)中,在裂解位点对连接的支架多核苷酸进行另一个第二裂解步骤。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤10)导致失去另一个第二多核苷酸连接分子中的辅助链并失去包含通用核苷酸的支持链。支架多核苷酸的裂解由此从支架多核苷酸中释放另一个第二多核苷酸连接分子,但导致附接至裂解的支架多核苷酸的合成链的来源于另一个第二多核苷酸连接分子的所述另外的循环的另外的第一核苷酸的保留。支架多核苷酸的裂解留下在支架多核苷酸的第二链的末端包含来源于另一个第二多核苷酸连接分子的另外的循环的另外的第一核苷酸的裂解的平末端的双链支架多核苷酸。步骤(10)处的裂解可以以与上文针对步骤(5)所描述的相同的方式进行。
[1044]
合成方法版本4
[1045]
步骤1-提供支架多核苷酸
[1046]
在本发明的合成方法的示例性版本4中,在步骤(1)中提供双链支架多核苷酸(401)。提供了包含第一链和与其杂交的第二链的双链支架多核苷酸。第一链的待延伸末端处的末端核苷酸位于第一链的3’末端并且包含羟基或任何其它合适的3’可连接基团,因此该末端核苷酸是可连接核苷酸。在图4中,该核苷酸被描绘为“x”并且可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。第一链的待延伸末端处的末端核苷酸被描绘为与第二链的5’末端的末端核苷酸配对。该末端核苷酸被描绘为“x”并且可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且可与或可不与所述对中的其配偶体核苷酸互补。优选是互补的。由于第二链的5’末端的末端核苷酸与第一链的末端3’核苷酸配对,因此待延伸的支架多核苷酸的末端是平末端的,没有突出的核苷酸。第二链5’末端的末端核苷酸包含磷酸基团或任何其它合适的5’可连接基团,并且因此该末端核苷酸也是可连接核苷酸。
[1047]
未示出为待延伸的支架多核苷酸的末端,即在图4中标记3’和5’的那些,优选地附接至基底,诸如通过本文所述的任何方式。
[1048]
步骤2-将第一多核苷酸连接分子连接至支架多核苷酸并掺入预定序列的一个或多个核苷酸
[1049]
在该方法的步骤(2)中,在平末端连接反应中,通过具有连接酶活性的酶的作用将双链多核苷酸连接分子连接(402)至支架多核苷酸。
[1050]
多核苷酸连接分子包含合成链和与其杂交的辅助链。多核苷酸连接分子还包含互补连接末端,其在合成链中包含通用核苷酸和预定序列的核苷酸。
[1051]
第一多核苷酸连接分子的互补连接末端被构造成使得合成链的末端核苷酸是在任何给定的合成循环中被掺入支架多核苷酸中的预定序列的第一核苷酸。合成链的末端核苷酸与辅助链的末端核苷酸配对。在图4中,合成链的末端核苷酸被描绘为“t”并且辅助链的末端核苷酸被描绘为“a”。这些名称中的每一个仅用于说明目的。它们可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且它们可以是互补的或可以不是互补的。优选地,它们是互补的。
[1052]
通用核苷酸是第一多核苷酸连接分子的互补连接末端处的合成链末端的次末端核苷酸。通用核苷酸与第一多核苷酸连接分子的互补连接末端处的辅助链末端的次末端核苷酸形成核苷酸对。在图4中,互补连接末端处的辅助链末端的次末端核苷酸被描绘为“x”,仅用于说明目的。它可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。
[1053]
第一多核苷酸连接分子的互补连接末端处的合成链末端核苷酸在图4中被描绘为处于合成链的5’末端。该核苷酸是可连接核苷酸并且具有磷酸基团或任何其它合适的5’可连接基团。第一多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸在图4中被描绘为处于辅助链的3’末端。该核苷酸作为不可连接的核苷酸提供并且包括不可连接的2’,3
’‑
双脱氧核苷酸或2
’‑
脱氧核苷酸,或任何其它合适的3’不可连接核苷酸。
[1054]
合成链的末端核苷酸,即,将在给定的合成循环中掺入第一链的预定序列的第一核苷酸,占据合成链中的核苷酸位置n。第一多核苷酸连接分子的合成链中的位置n是指在多核苷酸连接分子连接至支架多核苷酸之后将被附接至支架多核苷酸第一链末端的第一核苷酸占据的位置。位置n还指在连接之后由所述第一核苷酸在其附接至第一链的末端之后在连接的支架多核苷酸的第一链中占据的核苷酸位置。位置n还指在第二延伸/连接反应
之后在所述第一核苷酸的配偶体核苷酸附接至第二链末端之后将由所述配偶体核苷酸在支架多核苷酸的第二链中占据的核苷酸位置。位置n还指在第二延伸/连接反应之后由所述配偶体核苷酸在其附接至第二链末端后所占据的核苷酸位置。第一多核苷酸连接分子的合成链中的通用核苷酸占据位置n 1。
[1055]
第一多核苷酸连接分子的互补连接末端被配置成使得当经受合适的连接条件时,它将与支架多核苷酸的平末端相容地连结。在多核苷酸连接分子的合成链和支架多核苷酸的第一链连接后,合成链的末端核苷酸变得被掺入支架多核苷酸的第一链中。由于多核苷酸连接分子的辅助链的末端核苷酸是不可连接核苷酸,因此将阻止连接酶连接第一多核苷酸连接分子的辅助链和支架多核苷酸的第二链,从而在第一多核苷酸连接分子的辅助链与支架多核苷酸的第二链之间产生单链断裂或“缺口”。
[1056]
多核苷酸连接分子与支架多核苷酸的连接延长了步骤(1)的双链支架多核苷酸的第一链的长度,并且其中第一多核苷酸连接分子的合成链的末端核苷酸被掺入到支架多核苷酸的第一链中。
[1057]
可通过任何合适的方式进行连接。连接通常可以并且优选地通过具有连接酶活性的酶来进行。例如,可以用t3 dna连接酶或t4 dna连接酶或其功能性变体或等同物或本文所述的其它酶进行连接。此类酶的使用将导致单链断裂的维持,因为辅助链的末端核苷酸被提供使得其无法充当连接酶的底物,如上文所述。
[1058]
步骤3-第一裂解步骤
[1059]
在该方法的步骤(3)中,连接的支架多核苷酸在裂解位点被裂解(403)。裂解位点由连接的第一多核苷酸连接分子的合成链中包含通用核苷酸的序列限定。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤3)导致失去连接的第一多核苷酸连接分子的辅助链并且失去包含通用核苷酸的合成链。支架多核苷酸的裂解从而从支架多核苷酸中释放多核苷酸连接分子,但是导致附接至裂解的支架多核苷酸的第一链的所述循环的第一核苷酸的保留。支架多核苷酸的裂解留下在裂解末端包含单碱基突出端的裂解的双链支架多核苷酸。预定序列的第一核苷酸占据位置(n)作为裂解的双链支架多核苷酸的第一链的末端核苷酸并且突出于第二链在裂解末端的末端核苷酸。
[1060]
在该示例性方法中,连接的支架多核苷酸的第二链已经具有单链断裂或“缺口”,因此仅需要裂解第一链即可在支架多核苷酸中提供双链断裂。此外,如先前所述,在该示例性方法版本中,裂解产生具有单碱基突出端的裂解的双链支架多核苷酸,其中第一链的末端核苷酸突出于第二链的末端核苷酸,并且通用核苷酸在裂解步骤之前占据第一链中的位置n 1。为了在通用核苷酸占据第一链中的位置n 1时获得这种具有单碱基突出端的裂解的双链支架多核苷酸,在相对于通用核苷酸的特定位置裂解连接的第一链。当支架多核苷酸的第一链在核苷酸位置n 1与n之间被裂解时,多核苷酸连接分子从支架多核苷酸释放(参见在图4中被描绘为在裂解步骤3(403)后立即退出合成循环的结构),除了来源于步骤(2)中的第一多核苷酸连接分子的所述循环的第一核苷酸保留在支架多核苷酸中,附接至裂解的支架多核苷酸的第一链。
[1061]
磷酸基团或任何其它合适的5’可连接基团应继续在裂解位点附接至裂解的支架多核苷酸的第二链的末端核苷酸。这确保了裂解的支架多核苷酸的第二链可以在第二延伸/连接步骤(4)中连接至第二多核苷酸连接分子的合成链。进行裂解以使裂解的支架多核
苷酸的第一链的末端核苷酸在第一链的3’末端保留可连接基团,通常为羟基或任何其它合适的3’可连接基团。
[1062]
因此,在方法版本4中,通用核苷酸在步骤(2)中占据合成/第一链中的位置n 1,并且第一链在步骤(3)中在核苷酸位置n 1与n之间被裂解。
[1063]
优选地,通过裂解核苷酸位置n 1与n之间的磷酸二酯键(在连接的多核苷酸连接分子的远端方向/第一链的近端方向上,相对于通用核苷酸的位置而言第一链的第一磷酸二酯键)来裂解第一链。
[1064]
可通过裂解核苷酸位置n 1与n之间的磷酸二酯键的一个酯键来裂解第一链。
[1065]
优选地,通过相对于核苷酸位置n 1的第一酯键的裂解来裂解第一链。
[1066]
当通用核苷酸占据位置n 1时,可采用任何合适的机制来实现在核苷酸位置n 1与n之间裂解第一链。
[1067]
如上所述在核苷酸位置n 1与n之间裂解第一链可通过酶的作用进行。
[1068]
如上所述在核苷酸位置n 1与n之间裂解第一链可作为两步裂解过程进行。
[1069]
两步裂解过程的第一裂解步骤可包括从第一链上去除通用核苷酸,从而在位置n 1处形成无碱基位点,并且第二裂解步骤可包括在位置n 1与n之间在无碱基位点处裂解第一链。
[1070]
实施例2中以类似方式描述了一种以上述方式在由包含通用核苷酸的序列限定的裂解位点处裂解第一链的机制。实施例2中描述的裂解机制是示例性的,并且可采用其它机制,只要实现上述裂解的双链支架多核苷酸即可。
[1071]
在两步裂解过程的第一裂解步骤中,将通用核苷酸从第一链上去除,同时保留糖-磷酸主链的完整性。这可以通过酶的作用来实现,所述酶可以从双链多核苷酸中特异性地切除单个通用核苷酸。在示例性裂解方法中,通用核苷酸是肌苷,并且通过酶的作用从第一链中切除肌苷,从而形成无碱基位点。在示例性裂解方法中,酶是3-甲基腺嘌呤dna糖基化酶,特别是人类烷基腺嘌呤dna糖基化酶(haag)。可以使用其它酶、分子或化学物质,只要形成无碱基位点即可。核苷酸切除酶可以是催化尿嘧啶从多核苷酸释放的酶,例如尿嘧啶-dna糖基化酶(udg)。
[1072]
在两步裂解过程的第二步骤中,通过形成单链断裂而在无碱基位点处裂解第一链。在示例性方法中,第一链通过作为碱诸如naoh的化学物质的作用被裂解。可替代地,可使用有机化学物质,诸如n,n
’‑
二甲基乙二胺。可替代地,可以使用具有无碱基位点裂解酶活性的酶,诸如ap核酸内切酶1、核酸内切酶iii(nth)或核酸内切酶viii。这些酶在相对于无碱基位点位于5’的磷酸基团处裂解dna主链。因此,裂解在第一链的3’末端暴露了oh基团,所述oh基团提供了末端3’核苷酸,所述核苷酸可在下一循环的第一连接步骤中连接。可以使用其它酶、分子或化学物质,只要第一链在如上所述的无碱基位点处被裂解即可。
[1073]
因此,在其中通用核苷酸在步骤(2)中处于第一链的位置n 1并且第一链在位置n 1与n之间被裂解的实施方案中,第一裂解步骤可用核苷酸切除酶来执行。这种酶的实施例是3-甲基腺嘌呤dna糖基化酶,诸如人类烷基腺嘌呤dna糖基化酶(haag)。第二裂解步骤可以用作为碱的化学物质如naoh进行。第二步可以用具有无碱基位点裂解活性的有机化学物质诸如n,n'-二甲基乙二胺进行。第二步骤可以用具有无碱基位点裂解酶活性的酶如核酸内切酶viii或核酸内切酶iii进行。
[1074]
如上所述在核苷酸位置n 1与n之间裂解第一链也可作为一步裂解过程进行。可用于任何此类方法的酶的实施例包括核酸内切酶iii、核酸内切酶viii。可用于任何此类过程的其它酶包括裂解8-氧代鸟苷的酶,诸如甲酰胺基嘧啶dna糖基化酶(fpg)和8-氧代鸟嘌呤dna糖基化酶(hogg1),它们裂解dna主链以在裂解的第一链的3’末端留下磷酸基团,然后可以通过核酸内切酶iv或t4多核苷酸激酶将其去除以暴露oh基团,所述oh基团可在下一循环的第一连接步骤中连接。
[1075]
步骤4-将第二多核苷酸连接分子连接至支架多核苷酸并掺入预定序列的一个或多个另外的核苷酸
[1076]
在该方法的步骤(4)中,在粘性(互补)末端连接反应中,通过具有连接酶活性的酶的作用将第二双链多核苷酸连接分子连接(404)至支架多核苷酸。
[1077]
第二多核苷酸连接分子包含合成链和与其杂交的辅助链。第二多核苷酸连接分子还包含互补连接末端,其在合成链中包含通用核苷酸和预定序列的一个另外的核苷酸。
[1078]
第二多核苷酸连接分子的互补连接末端被构造成使得合成链的末端核苷酸是在任何给定的合成循环中被掺入支架多核苷酸的第二链中的预定序列的第一核苷酸。
[1079]
互补连接末端包含单碱基突出端。合成链的末端核苷酸未配对并突出于辅助链的末端核苷酸。合成链的次末端核苷酸与辅助链的末端核苷酸配对。在图4中,合成链的末端核苷酸被描绘为“a”,合成链的次末端核苷酸被描绘为“x”,并且辅助链的末端核苷酸被描绘为“x”。这些名称中的每一个仅用于说明目的。它们可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。合成链的次末端核苷酸和辅助链的末端核苷酸可以互补或可以不互补。优选地,它们是互补的。
[1080]
在第二多核苷酸连接分子的互补连接末端处的合成链末端,通用核苷酸占据在远离互补连接末端的方向上紧邻合成链的次末端核苷酸的位置。通用核苷酸占据位置n 2,末端核苷酸占据位置n并且次末端核苷酸占据位置n 1。参考第一延伸/连接反应中位置n的定义,位置n是指支架多核苷酸的第二链中由在第一延伸/连接反应之后附接至第一链末端的第一核苷酸的配偶体核苷酸占据的核苷酸位置。
[1081]
通用核苷酸与作为辅助链中远离互补连接末端方向上的次末端核苷酸的核苷酸形成核苷酸对。这在图4中被描绘为“x”,仅用于说明目的。它可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。
[1082]
第二多核苷酸连接分子的互补连接末端处的合成链末端核苷酸在图4中被描绘为处于合成链的3’末端。该核苷酸作为可连接核苷酸提供并且包含羟基或任何其它合适的3’可连接基团。第二多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸在图4中被描绘为处于辅助链的5’末端。该核苷酸作为不可连接的核苷酸提供,例如缺少磷酸基团或具有任何合适的可阻止连接的5’封闭基团。
[1083]
第二多核苷酸连接分子的互补连接末端被配置成使得当经受合适的连接条件时,它将与在步骤(3)中产生的裂解的支架多核苷酸的突出末端相容地连结。在第二多核苷酸连接分子的合成链和裂解的支架多核苷酸的第二链连接后,第二多核苷酸连接的合成链的末端核苷酸变得被掺入裂解的支架多核苷酸的第二链中。由于第二多核苷酸连接分子的辅助链的末端核苷酸是不可连接核苷酸,因此将阻止连接酶连接第二多核苷酸连接分子的辅助链和裂解的支架多核苷酸的第二链,从而在第二多核苷酸连接分子的辅助链与裂解的支
架多核苷酸的第二链之间产生单链断裂或“缺口”。
[1084]
第二多核苷酸连接分子与裂解的支架多核苷酸的连接延长了步骤(3)的双链支架多核苷酸的第二链的长度,并且其中第二多核苷酸连接分子序列的合成链的末端核苷酸被掺入到支架多核苷酸的第二链中。
[1085]
可通过任何合适的方式进行连接。连接通常可以并且优选地通过具有连接酶活性的酶来进行。例如,可以用t3 dna连接酶或t4 dna连接酶或其功能性变体或等同物或本文所述的其它酶进行连接。此类酶的使用将导致单链断裂的维持,因为辅助链的末端核苷酸被提供使得其无法充当连接酶的底物,如上文所述。
[1086]
连接后,第二多核苷酸连接分子的合成链的末端核苷酸与在步骤(3)中产生的裂解的支架多核苷酸的第一链的末端核苷酸配对,从而形成核苷酸对。
[1087]
步骤5-第二裂解步骤
[1088]
在该方法的步骤(5)中,连接的支架多核苷酸在裂解位点被裂解(405)。裂解位点由连接的第二多核苷酸连接分子的合成链中包含通用核苷酸的序列限定。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤5)导致失去连接的第二多核苷酸连接分子的辅助链并且失去包含通用核苷酸的合成链。支架多核苷酸的裂解从而从支架多核苷酸中释放第二多核苷酸连接分子,但是导致附接至裂解的支架多核苷酸的第二链的所述循环的第一核苷酸的保留。支架多核苷酸的裂解留下在裂解末端包含平末端的裂解的双链支架多核苷酸。在步骤(4)中掺入的预定序列的第一核苷酸占据位置(n)作为裂解的双链支架多核苷酸的第二链的末端核苷酸,并且在步骤(2)中掺入的预定序列的第一核苷酸占据位置(也是n)作为裂解的第一链的末端核苷酸。因此,在步骤(4)中掺入第二链中的预定序列的第一核苷酸和在步骤(4)中掺入第一链中的预定序列的第一核苷酸在第二延伸/连接和第二裂解步骤之后是配对的。在图4中,这些核苷酸被描绘(405)为“a”和“t”,仅用于说明目的。这些核苷酸中的每一个可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且所述对可以是互补的或可以不是互补的。优选地,它们是互补的。
[1089]
在该示例性方法中,在第二裂解步骤之前,连接的支架多核苷酸的第一链已经具有单链断裂或“缺口”,因此仅需要裂解第二链即可在支架多核苷酸中提供双链断裂。此外,如先前所述,在该示例性方法版本中,裂解产生具有平末端的裂解的双链支架多核苷酸,并且通用核苷酸在裂解步骤之前占据第二链中的位置n 2。为了在通用核苷酸占据第二链中的位置n 2时获得这种具有平末端的裂解的双链支架多核苷酸,在相对于通用核苷酸的特定位置裂解第二链。当支架多核苷酸的第二链在核苷酸位置n 1与n之间被裂解时,多核苷酸连接分子从支架多核苷酸释放(参见在图5中被描绘为在裂解步骤5(505)后立即退出合成循环的结构),除了来源于步骤(4)中的第二多核苷酸连接分子的所述循环的第一核苷酸保留在支架多核苷酸中,附接至裂解的支架多核苷酸的第二链。
[1090]
磷酸基团或任何其它合适的5’可连接基团应继续在裂解位点附接至裂解的支架多核苷酸的第二链的末端核苷酸。这确保了裂解的支架多核苷酸的第二链可以在下一合成循环的第二延伸/连接步骤(4)中连接至第二多核苷酸连接分子的合成链。进行裂解以使裂解的支架多核苷酸的第一链的末端核苷酸在第一链的3’末端保留可连接基团,通常为羟基或任何其它合适的3’可连接基团。
[1091]
因此,在方法版本4中,通用核苷酸在步骤(4)中占据合成/第二链中的位置n 2,并
且第二链在步骤(5)中在核苷酸位置n 1与n之间被裂解。
[1092]
优选地,通过裂解核苷酸位置n 1与n之间的磷酸二酯键(在连接的多核苷酸连接分子的远端方向/第二链的近端方向上,相对于通用核苷酸的位置而言第二链的第一磷酸二酯键)来裂解第二链。
[1093]
可通过裂解核苷酸位置n 1与n之间的磷酸二酯键的一个酯键来裂解第二链。
[1094]
优选地,通过相对于核苷酸位置n 1的第一酯键的裂解来裂解第二链。
[1095]
当通用核苷酸占据位置n 2时,可采用任何合适的机制来实现在核苷酸位置n 1与n之间裂解第二链。
[1096]
如上所述在核苷酸位置n 1与n之间裂解第二链可通过酶的作用进行。
[1097]
如上所述,当通用核苷酸占据第二链中的位置n 2时,在核苷酸位置n 1与n之间裂解第二链可通过酶诸如核酸内切酶v的作用来进行。
[1098]
在实施例3中以类似方式描述了一种在由包含在第二链中占据位置n 2的通用核苷酸的序列限定的裂解位点在核苷酸位置n 1与n之间裂解第二链的机制。所描述的机制为示例性的并且可采用其它机制,其条件是实现上文所描述的裂解布置。
[1099]
在此示例性机制中,采用核酸内切酶。在示例性方法中,酶是核酸内切酶v。可以使用其它酶、分子或化学物质,只要当通用核苷酸占据第二链中的位置n 2时,在核苷酸位置n 1与n之间裂解第二链即可。
[1100]
在合成方法版本4中,应注意到,在任何给定的合成循环中,在第二裂解步骤(步骤5)之后,由裂解末端处第一和第二链的末端核苷酸占据的核苷酸位置均被定义为核苷酸位置n。这些核苷酸位置被定义为下一合成循环中的核苷酸位置n-1。
[1101]
另外的循环
[1102]
在完成第一合成循环之后,可以使用相同的方法步骤进行第二合成循环和另外的合成循环。
[1103]
提供(在步骤6中)上一循环的步骤(5)的裂解产物作为用于下一合成循环的双链支架多核苷酸。
[1104]
在下一合成循环和每个另外的合成循环的步骤(7)中,将另一个第一双链多核苷酸连接分子连接至上一循环的步骤(5)的裂解产物。所述多核苷酸连接分子可以以与上文针对上一循环的步骤(2)所描述的相同方式构造,不同之处在于,所述另一个第一多核苷酸连接分子包含待掺入第一链中的另外的合成循环的另外的第一核苷酸。在步骤(7)中,所述另一个第一多核苷酸连接分子可以以与上文针对步骤(2)所描述的相同方式连接至上一循环的步骤(5)的裂解产物。
[1105]
在下一合成循环和每个另外的合成循环的步骤(8)中,在裂解位点对连接的支架多核苷酸进行另一个第一裂解步骤。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤8)导致失去另一个第一多核苷酸连接分子中的辅助链并失去包含通用核苷酸的支持链。支架多核苷酸的裂解由此从支架多核苷酸中释放另一个第一多核苷酸连接分子,但导致附接至裂解的支架多核苷酸的合成链的来源于另一个第一多核苷酸连接分子的所述另外的循环的另外的第一核苷酸的保留。支架多核苷酸的裂解留下在支架多核苷酸的合成链的末端包含另外的循环的另外的第一核苷酸的裂解的双链支架多核苷酸。裂解导致单碱基突出端,其中第一链的末端核苷酸突出于第二链的末端核苷酸。步骤(8)的裂解可以
以与上文针对步骤(4)所描述的相同方式进行。
[1106]
在下一合成循环和每个另外的合成循环的步骤(9)中,将另一个第二双链多核苷酸连接分子连接至步骤(8)的裂解产物。所述另一个第二多核苷酸连接分子可以以与上文针对上一循环的步骤(8)所描述的相同方式构造,不同之处在于,所述另一个第二多核苷酸连接分子包含待掺入第二链中的另外的合成循环的另外的第一核苷酸。在步骤(9)中,另一个第二多核苷酸连接分子可以以与上文针对步骤(4)所描述的相同方式连接至步骤(8)的裂解产物。
[1107]
在下一合成循环和每个另外的合成循环的步骤(10)中,在裂解位点对连接的支架多核苷酸进行另一个第二裂解步骤。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤10)导致失去另一个第二多核苷酸连接分子中的辅助链并失去包含通用核苷酸的支持链。支架多核苷酸的裂解由此从支架多核苷酸中释放另一个第二多核苷酸连接分子,但导致附接至裂解的支架多核苷酸的合成链的来源于另一个第二多核苷酸连接分子的所述另外的循环的另外的第一核苷酸的保留。支架多核苷酸的裂解留下在支架多核苷酸的第二链的末端包含来源于另一个第二多核苷酸连接分子的另外的循环的另外的第一核苷酸的裂解的平末端的双链支架多核苷酸。步骤(10)处的裂解可以以与上文针对步骤(5)所描述的相同的方式进行。
[1108]
合成方法版本5
[1109]
步骤1-提供支架多核苷酸
[1110]
在本发明的合成方法的示例性版本5中,在步骤(1)中提供双链支架多核苷酸(501)。提供了包含第一链和与其杂交的第二链的双链支架多核苷酸。第一链的待延伸末端处的末端核苷酸位于第一链的5’末端并且包含磷酸基团或任何其它合适的5’可连接基团,因此该末端核苷酸是可连接核苷酸。在图5中,该核苷酸被描绘为“x”并且可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。第一链的待延伸末端处的末端核苷酸被描绘为与第二链的3’末端的末端核苷酸配对。该末端核苷酸被描绘为“x”并且可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且可与或可不与所述对中的其配偶体核苷酸互补。优选是互补的。由于第一链的5’末端的末端核苷酸与第二链的末端3’核苷酸配对,因此待延伸的支架多核苷酸的末端是平末端的,没有突出的核苷酸。第二链3’末端的末端核苷酸包含羟基或任何其它合适的3’可连接基团,并且因此该末端核苷酸也是可连接核苷酸。
[1111]
未示出为待延伸的支架多核苷酸的末端,即在图5中标记3’和5’的那些,优选地附接至基底,诸如通过本文所述的任何方式。
[1112]
步骤2-将第一多核苷酸连接分子连接至支架多核苷酸并掺入预定序列的一个或多个核苷酸
[1113]
在该方法的步骤(2)中,在平末端连接反应中,通过具有连接酶活性的酶的作用将双链多核苷酸连接分子连接(502)至支架多核苷酸。
[1114]
多核苷酸连接分子包含合成链和与其杂交的辅助链。多核苷酸连接分子还包含互补连接末端,其在合成链中包含通用核苷酸和预定序列的核苷酸。
[1115]
第一多核苷酸连接分子的互补连接末端被构造成使得合成链的末端核苷酸是在任何给定的合成循环中被掺入支架多核苷酸中的预定序列的第一核苷酸。合成链的末端核苷酸与辅助链的末端核苷酸配对。在图5中,合成链的末端核苷酸被描绘为“t”并且辅助链
的末端核苷酸被描绘为“a”。这些名称中的每一个仅用于说明目的。它们可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且它们可以是互补的或可以不是互补的。优选地,它们是互补的。
[1116]
通用核苷酸是第一多核苷酸连接分子的互补连接末端处的合成链末端的次末端核苷酸。通用核苷酸与第一多核苷酸连接分子的互补连接末端处的辅助链末端的次末端核苷酸形成核苷酸对。在图5中,互补连接末端处的辅助链末端的次末端核苷酸被描绘为“x”,仅用于说明目的。它可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。
[1117]
第一多核苷酸连接分子的互补连接末端处的合成链末端核苷酸在图5中被描绘为处于合成链的3’末端。该核苷酸作为可连接核苷酸提供并且包含羟基或任何其它合适的3’可连接基团。第一多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸在图5中被描绘为处于辅助链的5’末端。该核苷酸作为不可连接核苷酸提供并且被提供为不具有磷酸基团或具有任何其它合适的5’不可连接基团或封闭基团。
[1118]
合成链的末端核苷酸,即,将在给定的合成循环中掺入第一链的预定序列的第一核苷酸,占据合成链中的核苷酸位置n。第一多核苷酸连接分子的合成链中的位置n是指在多核苷酸连接分子连接至支架多核苷酸之后将被附接至支架多核苷酸第一链末端的第一核苷酸占据的位置。位置n还指在连接之后由所述第一核苷酸在其附接至第一链的末端之后在连接的支架多核苷酸的第一链中占据的核苷酸位置。位置n还指在第二延伸/连接反应之后在所述第一核苷酸的配偶体核苷酸附接至第二链末端之后将由所述配偶体核苷酸在支架多核苷酸的第二链中占据的核苷酸位置。位置n还指在第二延伸/连接反应之后由所述配偶体核苷酸在其附接至第二链末端后所占据的核苷酸位置。第一多核苷酸连接分子的合成链中的通用核苷酸占据位置n 1。
[1119]
第一多核苷酸连接分子的互补连接末端被配置成使得当经受合适的连接条件时,它将与支架多核苷酸的平末端相容地连结。在多核苷酸连接分子的合成链和支架多核苷酸的第一链连接后,合成链的末端核苷酸变得被掺入支架多核苷酸的第一链中。由于多核苷酸连接分子的辅助链的末端核苷酸是不可连接核苷酸,因此将阻止连接酶连接第一多核苷酸连接分子的辅助链和支架多核苷酸的第二链,从而在第一多核苷酸连接分子的辅助链与支架多核苷酸的第二链之间产生单链断裂或“缺口”。
[1120]
多核苷酸连接分子与支架多核苷酸的连接延长了步骤(1)的双链支架多核苷酸的第一链的长度,并且其中第一多核苷酸连接分子的合成链的末端核苷酸被掺入到支架多核苷酸的第一链中。
[1121]
可通过任何合适的方式进行连接。连接通常可以并且优选地通过具有连接酶活性的酶来进行。例如,可以用t3 dna连接酶或t4 dna连接酶或其功能性变体或等同物或本文所述的其它酶进行连接。此类酶的使用将导致单链断裂的维持,因为辅助链的末端核苷酸被提供使得其无法充当连接酶的底物,如上文所述。
[1122]
步骤3-第一裂解步骤
[1123]
在该方法的步骤(3)中,连接的支架多核苷酸在裂解位点被裂解(503)。裂解位点由连接的第一多核苷酸连接分子的合成链中包含通用核苷酸的序列限定。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤3)导致失去连接的第一多核苷酸连接分子的辅助链并且失去包含通用核苷酸的合成链。支架多核苷酸的裂解从而从支架多核苷酸
中释放多核苷酸连接分子,但是导致附接至裂解的支架多核苷酸的第一链的所述循环的第一核苷酸的保留。支架多核苷酸的裂解留下在裂解末端包含单碱基突出端的裂解的双链支架多核苷酸。预定序列的第一核苷酸占据位置(n)作为裂解的双链支架多核苷酸的第一链的末端核苷酸并且突出于第二链在裂解末端的末端核苷酸。
[1124]
在该示例性方法中,连接的支架多核苷酸的第二链已经具有单链断裂或“缺口”,因此仅需要裂解第一链即可在支架多核苷酸中提供双链断裂。此外,如先前所述,在该示例性方法版本中,裂解产生具有单碱基突出端的裂解的双链支架多核苷酸,其中第一链的末端核苷酸突出于第二链的末端核苷酸,并且通用核苷酸在裂解步骤之前占据第一链中的位置n 1。为了在通用核苷酸占据第一链中的位置n 1时获得这种具有单碱基突出端的裂解的双链支架多核苷酸,在相对于通用核苷酸的特定位置裂解连接的第一链。当支架多核苷酸的第一链在核苷酸位置n 1与n之间被裂解时,多核苷酸连接分子从支架多核苷酸释放(参见在图5中被描绘为在裂解步骤3(503)后立即退出合成循环的结构),除了来源于步骤(2)中的第一多核苷酸连接分子的所述循环的第一核苷酸保留在支架多核苷酸中,附接至裂解的支架多核苷酸的第一链。
[1125]
羟基或任何其它合适的3’可连接基团应继续在裂解位点附接至裂解的支架多核苷酸的第二链的末端核苷酸。这确保了裂解的支架多核苷酸的第二链可以在第二延伸/连接步骤(4)中连接至第二多核苷酸连接分子的合成链。进行裂解以使裂解的支架多核苷酸的第一链的末端核苷酸在第一链的5’末端保留可连接基团,通常为磷酸基团或任何其它合适的5’可连接基团。
[1126]
因此,在方法版本5中,通用核苷酸在步骤(2)中占据合成/第一链中的位置n 1,并且第一链在步骤(3)中在核苷酸位置n 1与n之间被裂解。
[1127]
优选地,通过裂解核苷酸位置n 1与n之间的磷酸二酯键(在连接的多核苷酸连接分子的远端方向/第一链的近端方向上,相对于通用核苷酸的位置而言第一链的第一磷酸二酯键)来裂解第一链。
[1128]
可通过裂解核苷酸位置n 1与n之间的磷酸二酯键的一个酯键来裂解第一链。
[1129]
优选地,通过相对于核苷酸位置n 1的第一酯键的裂解来裂解第一链。
[1130]
当通用核苷酸占据位置n 1时,可采用任何合适的机制来实现在核苷酸位置n 1与n之间裂解第一链。
[1131]
如上所述在核苷酸位置n 1与n之间裂解第一链可通过酶的作用进行。
[1132]
如上所述在核苷酸位置n 1与n之间裂解第一链可作为两步裂解过程进行。
[1133]
两步裂解过程的第一裂解步骤可包括从第一链上去除通用核苷酸,从而在位置n 1处形成无碱基位点,并且第二裂解步骤可包括在位置n 1与n之间在无碱基位点处裂解第一链。
[1134]
实施例2中以类似方式描述了一种以上述方式在由包含通用核苷酸的序列限定的裂解位点处裂解第一链的机制。实施例2中描述的裂解机制是示例性的,并且可采用其它机制,只要实现上述裂解的双链支架多核苷酸即可。
[1135]
在两步裂解过程的第一裂解步骤中,将通用核苷酸从第一链上去除,同时保留糖-磷酸主链的完整性。这可以通过酶的作用来实现,所述酶可以从双链多核苷酸中特异性地切除单个通用核苷酸。在示例性裂解方法中,通用核苷酸是肌苷,并且通过酶的作用从第一
链中切除肌苷,从而形成无碱基位点。在示例性裂解方法中,酶是3-甲基腺嘌呤dna糖基化酶,特别是人类烷基腺嘌呤dna糖基化酶(haag)。可以使用其它酶、分子或化学物质,只要形成无碱基位点即可。核苷酸切除酶可以是催化尿嘧啶从多核苷酸释放的酶,例如尿嘧啶-dna糖基化酶(udg)。
[1136]
在两步裂解过程的第二步骤中,通过形成单链断裂而在无碱基位点处裂解第一链。在示例性方法中,第一链通过作为碱诸如naoh的化学物质的作用被裂解。可替代地,可使用有机化学物质,诸如n,n
’‑
二甲基乙二胺。可替代地,可以使用具有无碱基位点裂解酶活性的酶,诸如ap核酸内切酶1、核酸内切酶iii(nth)或核酸内切酶viii。可以使用其它酶、分子或化学物质,只要第一链在如上所述的无碱基位点处被裂解即可。
[1137]
因此,在其中通用核苷酸在步骤(2)中处于第一链的位置n 1并且第一链在位置n 1与n之间被裂解的实施方案中,第一裂解步骤可用核苷酸切除酶来执行。这种酶的实施例是3-甲基腺嘌呤dna糖基化酶,诸如人类烷基腺嘌呤dna糖基化酶(haag)。第二裂解步骤可以用作为碱的化学物质如naoh进行。第二步可以用具有无碱基位点裂解活性的有机化学物质诸如n,n'-二甲基乙二胺进行。第二步骤可以用具有无碱基位点裂解酶活性的酶如核酸内切酶viii或核酸内切酶iii进行。
[1138]
如上所述在核苷酸位置n 1与n之间裂解第一链也可作为一步裂解过程进行。可用于任何此类方法的酶的实施例包括核酸内切酶iii、核酸内切酶viii。可以在任何这样的方法中使用的其它酶包括裂解8-氧代鸟苷的酶,例如甲酰胺基嘧啶dna糖基化酶(fpg)和8-氧代鸟嘌呤dna糖基化酶(hogg1)。
[1139]
步骤4-将第二多核苷酸连接分子连接至支架多核苷酸并掺入预定序列的一个或多个另外的核苷酸
[1140]
在该方法的步骤(4)中,在粘性(互补)末端连接反应中,通过具有连接酶活性的酶的作用将第二双链多核苷酸连接分子连接(504)至裂解的支架多核苷酸。
[1141]
第二多核苷酸连接分子包含合成链和与其杂交的辅助链。第二多核苷酸连接分子还包含互补连接末端,其在合成链中包含通用核苷酸和预定序列的另外的核苷酸。
[1142]
第二多核苷酸连接分子的互补连接末端被构造成使得合成链的末端核苷酸是在任何给定的合成循环中被掺入裂解的支架多核苷酸的第二链中的预定序列的第一核苷酸。
[1143]
互补连接末端包含单碱基突出端。合成链的末端核苷酸未配对并突出于辅助链的末端核苷酸。在图5中,合成链的末端核苷酸被描绘为“a”,仅用于说明目的。它可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。
[1144]
通用核苷酸是第二多核苷酸连接分子的互补连接末端处的合成链末端的次末端核苷酸。通用核苷酸与第二多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸形成核苷酸对。在图5中,互补连接末端处的辅助链的末端核苷酸被描绘为“x”,仅用于说明目的。它可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。
[1145]
第二多核苷酸连接分子的互补连接末端处的合成链末端核苷酸在图5中被描绘为处于合成链的5’末端。该核苷酸是可连接核苷酸并且具有磷酸基团或任何其它合适的5’可连接基团。第二多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸在图5中被描绘为处于辅助链的3’末端。该核苷酸作为不可连接的核苷酸提供并且包括不可连接的2’,3
’‑
双脱氧核苷酸或2
’‑
脱氧核苷酸,或任何其它合适的3’不可连接核苷酸。
[1146]
合成链的末端核苷酸,即待掺入裂解的支架多核苷酸的第二链的所述循环的预定序列的第一核苷酸,占据合成链中的核苷酸位置n。参考第一延伸/连接反应中位置n的定义,位置n是指第二多核苷酸连接分子的合成链中在第二延伸/连接反应之后在第一链中步骤(2)的第一核苷酸的配偶体核苷酸附接至第二链的末端之后由作为所述配偶体核苷酸的核苷酸所占据的核苷酸位置。位置n还指在第二延伸/连接反应之后由所述配偶体核苷酸在其附接至第二链末端后所占据的核苷酸位置。位置n还指在步骤(2)中的连接之后由第一核苷酸在其附接至第一链的末端之后在支架多核苷酸的第一链中占据的核苷酸位置。
[1147]
第二多核苷酸连接分子的合成链中的通用核苷酸占据位置n 1。
[1148]
第二多核苷酸连接分子的互补连接末端被配置成使得当经受合适的连接条件时,它将与在步骤(3)中产生的裂解的支架多核苷酸的突出末端相容地连结。在第二多核苷酸连接分子的合成链和支架多核苷酸的第二链连接后,第二多核苷酸连接的合成链的末端核苷酸变得被掺入裂解的支架多核苷酸的第二链中。由于第二多核苷酸连接分子的辅助链的末端核苷酸是不可连接核苷酸,因此将阻止连接酶连接第二多核苷酸连接分子的辅助链和裂解的支架多核苷酸的第一链,从而在第二多核苷酸连接分子的辅助链与裂解的支架多核苷酸的第一链之间产生单链断裂或“缺口”。
[1149]
第二多核苷酸连接分子与裂解的支架多核苷酸的连接延长了步骤(3)的双链支架多核苷酸的第二链的长度,并且其中第二多核苷酸连接分子序列的合成链的末端核苷酸被掺入到支架多核苷酸的第二链中。
[1150]
可通过任何合适的方式进行连接。连接通常可以并且优选地通过具有连接酶活性的酶来进行。例如,可以用t3 dna连接酶或t4 dna连接酶或其功能性变体或等同物或本文所述的其它酶进行连接。此类酶的使用将导致单链断裂的维持,因为辅助链的末端核苷酸被提供使得其无法充当连接酶的底物,如上文所述。
[1151]
连接后,第二多核苷酸连接分子的合成链的末端核苷酸与在步骤(3)中产生的裂解的支架多核苷酸的第一链的末端核苷酸配对,从而形成核苷酸对。
[1152]
步骤5-第二裂解步骤
[1153]
在该方法的步骤(5)中,连接的支架多核苷酸在裂解位点被裂解(505)。裂解位点由连接的第二多核苷酸连接分子的合成链中包含通用核苷酸的序列限定。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤5)导致失去连接的第二多核苷酸连接分子的辅助链并且失去包含通用核苷酸的合成链。支架多核苷酸的裂解从而从支架多核苷酸中释放第二多核苷酸连接分子,但是导致附接至裂解的支架多核苷酸的第二链的所述循环的第二核苷酸的保留。支架多核苷酸的裂解留下包含平末端的裂解的双链支架多核苷酸。在步骤(4)中掺入的预定序列的第二核苷酸占据位置(n)作为裂解的双链支架多核苷酸的第二链的末端核苷酸,并与在步骤(2)中掺入并在第一链中占据位置n的裂解的双链支架多核苷酸的第一链的第一/末端核苷酸配对。在图5中,这些核苷酸被描绘(505)为“a”和“t”,仅用于说明目的。这些核苷酸中的每一个可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且所述对可以是互补的或可以不是互补的。优选地,它们是互补的。
[1154]
在该示例性方法中,在第二裂解步骤之前,连接的支架多核苷酸的第一链已经具有单链断裂或“缺口”,因此仅需要裂解第二链即可在支架多核苷酸中提供双链断裂。此外,如先前所述,在该示例性方法版本中,裂解产生具有平末端的裂解的双链支架多核苷酸,并
且通用核苷酸在第二裂解步骤之前占据第二链中的位置n 1。为了在通用核苷酸占据第二链中的位置n 1时获得这种具有平末端的裂解的双链支架多核苷酸,在相对于通用核苷酸的特定位置裂解第二链。当支架多核苷酸的第二链在核苷酸位置n 1与n之间被裂解时,多核苷酸连接分子从支架多核苷酸释放(参见在图5中被描绘为在裂解步骤5(505)后立即退出合成循环的结构),除了来源于步骤(4)中的第二多核苷酸连接分子的所述循环的第一核苷酸保留在支架多核苷酸中,附接至裂解的支架多核苷酸的第二链。
[1155]
磷酸基团或任何其它合适的5’可连接基团应继续在裂解位点附接至裂解的支架多核苷酸的第一链的末端核苷酸。这确保了裂解的支架多核苷酸的第一链可以在下一合成循环的第一延伸/连接步骤(2)中连接至第一多核苷酸连接分子的合成链。进行裂解以使裂解的支架多核苷酸的第二链的末端核苷酸在第一链的3’末端保留可连接基团,通常为羟基或任何其它合适的3’可连接基团。
[1156]
因此,在方法版本5中,通用核苷酸在步骤(4)中占据合成/第二链中的位置n 1,并且第二链在步骤(5)中在核苷酸位置n 1与n之间被裂解。
[1157]
优选地,通过裂解核苷酸位置n 1与n之间的磷酸二酯键(在连接的多核苷酸连接分子的远端方向/第二链的近端方向上,相对于通用核苷酸的位置而言第二链的第一磷酸二酯键)来裂解第二链。
[1158]
可通过裂解核苷酸位置n 1与n之间的磷酸二酯键的一个酯键来裂解第二链。
[1159]
优选地,通过相对于核苷酸位置n 1的第一酯键的裂解来裂解第二链。
[1160]
当通用核苷酸占据位置n 1时,可采用任何合适的机制来实现在核苷酸位置n 1与n之间裂解第二链。
[1161]
如上所述在核苷酸位置n 1与n之间裂解第二链可通过酶的作用进行。
[1162]
如上所述在核苷酸位置n 1与n之间裂解第二链可作为两步裂解过程进行。
[1163]
两步裂解过程的第一裂解步骤可包括从第二链上去除通用核苷酸,从而在位置n 1处形成无碱基位点,并且第二裂解步骤可包括在位置n 1与n之间在无碱基位点处裂解第二链。
[1164]
实施例2中以类似方式描述了一种以上述方式在由包含通用核苷酸的序列限定的裂解位点处裂解第二链的机制。实施例2中描述的裂解机制是示例性的,并且可采用其它机制,只要实现上述裂解的双链支架多核苷酸即可。
[1165]
在两步裂解过程的第一裂解步骤中,将通用核苷酸从第二链上去除,同时保留糖-磷酸主链的完整性。这可以通过酶的作用来实现,所述酶可以从双链多核苷酸中特异性地切除单个通用核苷酸。在示例性裂解方法中,通用核苷酸是肌苷,并且通过酶的作用从链中切除肌苷,从而形成无碱基位点。在示例性裂解方法中,酶是3-甲基腺嘌呤dna糖基化酶,特别是人类烷基腺嘌呤dna糖基化酶(haag)。可以使用其它酶、分子或化学物质,只要形成无碱基位点即可。核苷酸切除酶可以是催化尿嘧啶从多核苷酸释放的酶,例如尿嘧啶-dna糖基化酶(udg)。
[1166]
在两步裂解过程的第二步骤中,通过形成单链断裂而在无碱基位点处裂解第二链。在示例性方法中,所述链通过作为碱诸如naoh的化学物质的作用被裂解。可替代地,可使用有机化学物质,诸如n,n
’‑
二甲基乙二胺。可替代地,可以使用具有无碱基位点裂解酶活性的酶,诸如ap核酸内切酶1、核酸内切酶iii(nth)或核酸内切酶viii。这些酶在相对于
无碱基位点位于5’的磷酸基团处裂解dna主链。因此,裂解在第二链的3’末端暴露了oh基团,所述oh基团提供了末端3’核苷酸,所述核苷酸可在下一循环的第二连接步骤中连接。可以使用其它酶、分子或化学物质,只要第二链在如上所述的无碱基位点处被裂解即可。
[1167]
因此,在其中通用核苷酸在步骤(4)中处于第二链的位置n 1并且第二链在位置n 1与n之间被裂解的实施方案中,第一裂解步骤可用核苷酸切除酶来执行。这种酶的实施例是3-甲基腺嘌呤dna糖基化酶,诸如人类烷基腺嘌呤dna糖基化酶(haag)。第二裂解步骤可以用作为碱的化学物质如naoh进行。第二步可以用具有无碱基位点裂解活性的有机化学物质诸如n,n'-二甲基乙二胺进行。第二步骤可以用具有无碱基位点裂解酶活性的酶如核酸内切酶viii或核酸内切酶iii进行。
[1168]
如上所述在核苷酸位置n 1与n之间裂解第二链也可作为一步裂解过程进行。可用于任何此类方法的酶的实施例包括核酸内切酶iii、核酸内切酶viii。可用于任何此类过程的其它酶包括裂解8-氧代鸟苷的酶,如甲酰胺基嘧啶dna糖基化酶(fpg)和8-氧代鸟嘌呤dna糖基化酶(hogg1),它们裂解dna主链以在裂解的第二链的3’末端留下磷酸基团,然后可以通过核酸内切酶iv或t4多核苷酸激酶将其去除以暴露oh基团,所述oh基团可在下一循环的第二连接步骤中连接。
[1169]
在合成方法版本5中,应注意到,在任何给定的合成循环中,在第二裂解步骤(步骤5)之后,由裂解末端处第一和第二链的末端核苷酸占据的核苷酸位置均被定义为核苷酸位置n。这些核苷酸位置被定义为下一合成循环中的核苷酸位置n-1。
[1170]
另外的循环
[1171]
在完成第一合成循环之后,可以使用相同的方法步骤进行第二合成循环和另外的合成循环。
[1172]
提供(在步骤6中)上一循环的步骤(5)的裂解产物作为用于下一合成循环的双链支架多核苷酸。
[1173]
在下一合成循环和每个另外的合成循环的步骤(7)中,将另一个第一双链多核苷酸连接分子连接至上一循环的步骤(5)的裂解产物。所述多核苷酸连接分子可以以与上文针对上一循环的步骤(2)所描述的相同方式构造,不同之处在于,所述另一个第一多核苷酸连接分子包含待掺入第一链中的另外的合成循环的另外的第一核苷酸。在步骤(7)中,所述另一个第一多核苷酸连接分子可以以与上文针对步骤(2)所描述的相同方式连接至上一循环的步骤(5)的裂解产物。
[1174]
在下一合成循环和每个另外的合成循环的步骤(8)中,在裂解位点对连接的支架多核苷酸进行另一个第一裂解步骤。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤8)导致失去另一个第一多核苷酸连接分子中的辅助链并失去包含通用核苷酸的支持链。支架多核苷酸的裂解由此从支架多核苷酸中释放另一个第一多核苷酸连接分子,但导致附接至裂解的支架多核苷酸的合成链的来源于另一个第一多核苷酸连接分子的所述另外的循环的另外的第一核苷酸的保留。支架多核苷酸的裂解留下在支架多核苷酸的合成链的末端包含另外的循环的另外的第一核苷酸的裂解的双链支架多核苷酸。裂解导致单碱基突出端,其中第一链的末端核苷酸突出于第二链的末端核苷酸。步骤(8)的裂解可以以与上文针对步骤(4)所描述的相同方式进行。
[1175]
在下一合成循环和每个另外的合成循环的步骤(9)中,将另一个第二双链多核苷
酸连接分子连接至步骤(8)的裂解产物。所述另一个第二多核苷酸连接分子可以以与上文针对上一循环的步骤(8)所描述的相同方式构造,不同之处在于,所述另一个第二多核苷酸连接分子包含待掺入第二链中的另外的合成循环的另外的第一核苷酸。在步骤(9)中,另一个第二多核苷酸连接分子可以以与上文针对步骤(4)所描述的相同方式连接至步骤(8)的裂解产物。
[1176]
在下一合成循环和每个另外的合成循环的步骤(10)中,在裂解位点对连接的支架多核苷酸进行另一个第二裂解步骤。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤10)导致失去另一个第二多核苷酸连接分子中的辅助链并失去包含通用核苷酸的支持链。支架多核苷酸的裂解由此从支架多核苷酸中释放另一个第二多核苷酸连接分子,但导致附接至裂解的支架多核苷酸的合成链的来源于另一个第二多核苷酸连接分子的所述另外的循环的另外的第一核苷酸的保留。支架多核苷酸的裂解留下在支架多核苷酸的第二链的末端包含来源于另一个第二多核苷酸连接分子的另外的循环的另外的第一核苷酸的裂解的平末端的双链支架多核苷酸。步骤(10)处的裂解可以以与上文针对步骤(5)所描述的相同的方式进行。
[1177]
合成方法版本6
[1178]
步骤1-提供支架多核苷酸
[1179]
在本发明的合成方法的示例性版本6中,在步骤(1)中提供双链支架多核苷酸(601)。提供了包含第一链和与其杂交的第二链的双链支架多核苷酸。第一链的待延伸末端处的末端核苷酸位于第一链的5’末端并且包含磷酸基团或任何其它合适的5’可连接基团,因此该末端核苷酸是可连接核苷酸。在图1中,该核苷酸被描绘为“x”并且可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。第一链的待延伸末端处的末端核苷酸被描绘为与第二链的3’末端的末端核苷酸配对。该末端核苷酸被描绘为“x”并且可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且可与或可不与所述对中的其配偶体核苷酸互补。优选是互补的。由于第一链的5’末端的末端核苷酸与第二链的末端3’核苷酸配对,因此待延伸的支架多核苷酸的末端是平末端的,没有突出的核苷酸。第二链3’末端的末端核苷酸包含羟基或任何其它合适的3’可连接基团,并且因此该末端核苷酸也是可连接核苷酸。
[1180]
未示出为待延伸的支架多核苷酸的末端,即在图6中标记3’和5’的那些,优选地附接至基底,诸如通过本文所述的任何方式。
[1181]
步骤2-将第一多核苷酸连接分子连接至支架多核苷酸并掺入预定序列的一个或多个核苷酸
[1182]
在该方法的步骤(2)中,在平末端连接反应中,通过具有连接酶活性的酶的作用将双链多核苷酸连接分子连接(602)至支架多核苷酸。
[1183]
多核苷酸连接分子包含合成链和与其杂交的辅助链。多核苷酸连接分子还包含互补连接末端,其在合成链中包含通用核苷酸和预定序列的核苷酸。
[1184]
第一多核苷酸连接分子的互补连接末端被构造成使得合成链的末端核苷酸是在任何给定的合成循环中被掺入支架多核苷酸中的预定序列的第一核苷酸。合成链的末端核苷酸与辅助链的末端核苷酸配对。在图6中,合成链的末端核苷酸被描绘为“t”并且辅助链的末端核苷酸被描绘为“a”。这些名称中的每一个仅用于说明目的。它们可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且它们可以是互补的或可以不是互补的。优选地,它
们是互补的。
[1185]
在第一多核苷酸连接分子的互补连接末端处的合成链末端,通用核苷酸占据在远离互补连接末端的方向上紧邻次末端核苷酸的位置。通用核苷酸与占据在远离互补连接末端的方向上紧邻辅助链的次末端核苷酸的位置的核苷酸形成核苷酸对。在图6中,互补连接末端处的合成和辅助链末端的次末端核苷酸被描绘为“x”,仅用于说明目的。这些核苷酸中的每一个可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且它们可以是互补的或可以不是互补的。优选地,它们是互补的。
[1186]
第一多核苷酸连接分子的互补连接末端处的合成链末端核苷酸在图6中被描绘为处于合成链的3’末端。该核苷酸作为可连接核苷酸提供并且包含羟基或任何其它合适的3’可连接基团。第一多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸在图6中被描绘为处于辅助链的5’末端。该核苷酸作为不可连接核苷酸提供并且被提供为不具有磷酸基团或具有任何其它合适的5’不可连接基团或封闭基团。
[1187]
合成链的末端核苷酸,即,将在给定的合成循环中掺入第一链的预定序列的第一核苷酸,占据合成链中的核苷酸位置n。第一多核苷酸连接分子的合成链中的位置n是指在多核苷酸连接分子连接至支架多核苷酸之后将被附接至支架多核苷酸第一链末端的第一核苷酸占据的位置。位置n还指在连接之后由所述第一核苷酸在其附接至第一链的末端之后在连接的支架多核苷酸的第一链中占据的核苷酸位置。位置n还指在第二延伸/连接反应之后在所述第一核苷酸的配偶体核苷酸附接至第二链末端之后将由所述配偶体核苷酸在支架多核苷酸的第二链中占据的核苷酸位置。位置n还指在第二延伸/连接反应之后由所述配偶体核苷酸在其附接至第二链末端后所占据的核苷酸位置。第一多核苷酸连接分子的合成链中的通用核苷酸占据位置n 2。
[1188]
第一多核苷酸连接分子的互补连接末端被配置成使得当经受合适的连接条件时,它将与支架多核苷酸的平末端相容地连结。在多核苷酸连接分子的合成链和支架多核苷酸的第一链连接后,合成链的末端核苷酸变得被掺入支架多核苷酸的第一链中。由于多核苷酸连接分子的辅助链的末端核苷酸是不可连接核苷酸,因此将阻止连接酶连接第一多核苷酸连接分子的辅助链和支架多核苷酸的第二链,从而在第一多核苷酸连接分子的辅助链与支架多核苷酸的第二链之间产生单链断裂或“缺口”。
[1189]
多核苷酸连接分子与支架多核苷酸的连接延长了步骤(1)的双链支架多核苷酸的第一链的长度,并且其中第一多核苷酸连接分子的合成链的末端核苷酸被掺入到支架多核苷酸的第一链中。
[1190]
可通过任何合适的方式进行连接。连接通常可以并且优选地通过具有连接酶活性的酶来进行。例如,可以用t3 dna连接酶或t4 dna连接酶或其功能性变体或等同物或本文所述的其它酶进行连接。此类酶的使用将导致单链断裂的维持,因为辅助链的末端核苷酸被提供使得其无法充当连接酶的底物,如上文所述。
[1191]
步骤3-第一裂解步骤
[1192]
在该方法的步骤(3)中,连接的支架多核苷酸在裂解位点被裂解(603)。裂解位点由连接的第一多核苷酸连接分子的合成链中包含通用核苷酸的序列限定。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤3)导致失去连接的第一多核苷酸连接分子的辅助链并且失去包含通用核苷酸的合成链。支架多核苷酸的裂解从而从支架多核苷酸
中释放多核苷酸连接分子,但是导致附接至裂解的支架多核苷酸的第一链的所述循环的第一核苷酸的保留。支架多核苷酸的裂解留下在裂解末端包含单碱基突出端的裂解的双链支架多核苷酸。预定序列的第一核苷酸占据位置(n)作为裂解的双链支架多核苷酸的第一链的末端核苷酸并且突出于第二链的末端核苷酸。
[1193]
在该示例性方法中,连接的支架多核苷酸的第二链已经具有单链断裂或“缺口”,因此仅需要裂解第一链即可在支架多核苷酸中提供双链断裂。此外,如先前所述,在该示例性方法版本中,裂解产生具有单碱基突出端的裂解的双链支架多核苷酸,其中第一链的末端核苷酸突出于第二链的末端核苷酸,并且通用核苷酸在裂解步骤之前占据第一链中的位置n 2。为了在通用核苷酸占据第一链中的位置n 2时获得这种具有单碱基突出端的裂解的双链支架多核苷酸,在相对于通用核苷酸的特定位置裂解连接的第一链。当支架多核苷酸的第一链在核苷酸位置n 1与n之间被裂解时,多核苷酸连接分子从支架多核苷酸释放(参见在图6中被描绘为在裂解步骤3(603)后立即退出合成循环的结构),除了来源于步骤(2)中的第一多核苷酸连接分子的所述循环的第一核苷酸保留在支架多核苷酸中,附接至裂解的支架多核苷酸的第一链。
[1194]
羟基或任何其它合适的3’可连接基团应继续在裂解位点附接至裂解的支架多核苷酸的第二链的末端核苷酸。这确保了裂解的支架多核苷酸的第二链可以在第二延伸/连接步骤(4)中连接至第二多核苷酸连接分子的合成链。进行裂解以使裂解的支架多核苷酸的第一链的末端核苷酸在第一链的5’末端保留可连接基团,通常为磷酸基团或任何其它合适的5’可连接基团。
[1195]
因此,在方法版本6中,通用核苷酸在步骤(2)中占据合成/第一链中的位置n 2,并且第一链在步骤(3)中在核苷酸位置n 1与n之间被裂解。
[1196]
优选地,通过裂解核苷酸位置n 1与n之间的磷酸二酯键(在连接的多核苷酸连接分子的远端方向/第一链的近端方向上,相对于通用核苷酸的位置而言第一链的第一磷酸二酯键)来裂解第一链。
[1197]
可通过裂解核苷酸位置n 1与n之间的磷酸二酯键的一个酯键来裂解第一链。
[1198]
优选地,通过相对于核苷酸位置n 1的第一酯键的裂解来裂解第一链。
[1199]
当通用核苷酸占据位置n 2时,可采用任何合适的机制来实现在核苷酸位置n 1与n之间裂解第一链。
[1200]
如上所述在核苷酸位置n 1与n之间裂解第一链可通过酶的作用进行。
[1201]
如上所述,当通用核苷酸占据第一链中的位置n 2时,在核苷酸位置n 1与n之间裂解第一链可通过酶如核酸内切酶v的作用来进行。
[1202]
在实施例3中以类似方式描述了一种在由包含在第一链中占据位置n 2的通用核苷酸的序列限定的裂解位点在核苷酸位置n 1与n之间裂解第一链的机制。所描述的机制为示例性的并且可采用其它机制,其条件是实现上文所描述的裂解布置。
[1203]
在此示例性机制中,采用核酸内切酶。在示例性方法中,酶是核酸内切酶v。可以使用其它酶、分子或化学物质,只要当通用核苷酸占据第一链中的位置n 2时,在核苷酸位置n 1与n之间裂解第一链即可。
[1204]
步骤4-将第二多核苷酸连接分子连接至支架多核苷酸并掺入预定序列的一个或多个另外的核苷酸
[1205]
在该方法的步骤(4)中,在粘性(互补)末端连接反应中,通过具有连接酶活性的酶的作用将第二双链多核苷酸连接分子连接(604)至裂解的支架多核苷酸。
[1206]
第二多核苷酸连接分子包含合成链和与其杂交的辅助链。第二多核苷酸连接分子还包含互补连接末端,其在合成链中包含通用核苷酸和预定序列的另外的核苷酸。
[1207]
第二多核苷酸连接分子的互补连接末端被构造成使得合成链的末端核苷酸是在任何给定的合成循环中被掺入裂解的支架多核苷酸的第二链中的预定序列的第一核苷酸。
[1208]
互补连接末端包含单碱基突出端。合成链的末端核苷酸未配对并突出于辅助链的末端核苷酸。在图6中,合成链的末端核苷酸被描绘为“a”,仅用于说明目的。它可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。
[1209]
通用核苷酸是第二多核苷酸连接分子的互补连接末端处的合成链末端的次末端核苷酸。通用核苷酸与第二多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸形成核苷酸对。在图6中,互补连接末端处的辅助链末端核苷酸被描绘为“x”,仅用于说明目的。它可以是任何核苷酸、核苷酸类似物或核苷酸衍生物。
[1210]
第二多核苷酸连接分子的互补连接末端处的合成链末端核苷酸在图6中被描绘为处于合成链的5’末端。该核苷酸是可连接核苷酸并且具有磷酸基团或任何其它合适的5’可连接基团。第二多核苷酸连接分子的互补连接末端处的辅助链末端核苷酸在图6中被描绘为处于辅助链的3’末端。该核苷酸作为不可连接的核苷酸提供并且包括不可连接的2’,3
’‑
双脱氧核苷酸或2
’‑
脱氧核苷酸,或任何其它合适的3’不可连接核苷酸。
[1211]
合成链的末端核苷酸,即待掺入裂解的支架多核苷酸的第二链的所述循环的预定序列的第一核苷酸,占据合成链中的核苷酸位置n。参考第一延伸/连接反应中位置n的定义,位置n是指第二多核苷酸连接分子的合成链中在第二延伸/连接反应之后在第一链中步骤(2)的第一核苷酸的配偶体核苷酸附接至第二链的末端之后由作为所述配偶体核苷酸的核苷酸所占据的核苷酸位置。位置n还指在第二延伸/连接反应之后由所述配偶体核苷酸在其附接至第二链末端后所占据的核苷酸位置。位置n还指在步骤(2)中的连接之后由第一核苷酸在其附接至第一链的末端之后在支架多核苷酸的第一链中占据的核苷酸位置。
[1212]
第二多核苷酸连接分子的合成链中的通用核苷酸占据位置n 1。
[1213]
第二多核苷酸连接分子的互补连接末端被配置成使得当经受合适的连接条件时,它将与在步骤(3)中产生的裂解的支架多核苷酸的突出末端相容地连结。在第二多核苷酸连接分子的合成链和支架多核苷酸的第二链连接后,第二多核苷酸连接的合成链的末端核苷酸变得被掺入裂解的支架多核苷酸的第二链中。由于第二多核苷酸连接分子的辅助链的末端核苷酸是不可连接核苷酸,因此将阻止连接酶连接第二多核苷酸连接分子的辅助链和裂解的支架多核苷酸的第一链,从而在第二多核苷酸连接分子的辅助链与裂解的支架多核苷酸的第一链之间产生单链断裂或“缺口”。
[1214]
第二多核苷酸连接分子与裂解的支架多核苷酸的连接延长了步骤(3)的双链支架多核苷酸的第二链的长度,并且其中第二多核苷酸连接分子序列的合成链的末端核苷酸被掺入到支架多核苷酸的第二链中。
[1215]
可通过任何合适的方式进行连接。连接通常可以并且优选地通过具有连接酶活性的酶来进行。例如,可以用t3 dna连接酶或t4 dna连接酶或其功能性变体或等同物或本文所述的其它酶进行连接。此类酶的使用将导致单链断裂的维持,因为辅助链的末端核苷酸
被提供使得其无法充当连接酶的底物,如上文所述。
[1216]
连接后,第二多核苷酸连接分子的合成链的末端核苷酸与在步骤(3)中产生的裂解的支架多核苷酸的第一链的末端核苷酸配对,从而形成核苷酸对。
[1217]
步骤5-第二裂解步骤
[1218]
在该方法的步骤(5)中,连接的支架多核苷酸在裂解位点被裂解(605)。裂解位点由连接的第二多核苷酸连接分子的合成链中包含通用核苷酸的序列限定。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤5)导致失去连接的第二多核苷酸连接分子的辅助链并且失去包含通用核苷酸的合成链。支架多核苷酸的裂解从而从支架多核苷酸中释放第二多核苷酸连接分子,但是导致附接至裂解的支架多核苷酸的第二链的所述循环的第二核苷酸的保留。支架多核苷酸的裂解留下包含平末端的裂解的双链支架多核苷酸。在步骤(4)中掺入的预定序列的第二核苷酸占据位置(n)作为裂解的双链支架多核苷酸的第二链的末端核苷酸,并与在步骤(2)中掺入并在第一链中占据位置n的裂解的双链支架多核苷酸的第一链的第一/末端核苷酸配对。在图6中,这些核苷酸被描绘(605)为“a”和“t”,仅用于说明目的。这些核苷酸中的每一个可以是任何核苷酸、核苷酸类似物或核苷酸衍生物,并且所述对可以是互补的或可以不是互补的。优选地,它们是互补的。
[1219]
在该示例性方法中,在第二裂解步骤之前,连接的支架多核苷酸的第一链已经具有单链断裂或“缺口”,因此仅需要裂解第二链即可在支架多核苷酸中提供双链断裂。此外,如先前所述,在该示例性方法版本中,裂解产生具有平末端的裂解的双链支架多核苷酸,并且通用核苷酸在第二裂解步骤之前占据第二链中的位置n 1。为了在通用核苷酸占据第二链中的位置n 1时获得这种具有平末端的裂解的双链支架多核苷酸,在相对于通用核苷酸的特定位置裂解第二链。当支架多核苷酸的第二链在核苷酸位置n 1与n之间被裂解时,多核苷酸连接分子从支架多核苷酸释放(参见在图6中被描绘为在裂解步骤5(605)后立即退出合成循环的结构),除了来源于步骤(4)中的第二多核苷酸连接分子的所述循环的第一核苷酸保留在支架多核苷酸中,附接至裂解的支架多核苷酸的第二链。
[1220]
磷酸基团或任何其它合适的5’可连接基团应继续在裂解位点附接至裂解的支架多核苷酸的第一链的末端核苷酸。这确保了裂解的支架多核苷酸的第一链可以在下一合成循环的第一延伸/连接步骤(2)中连接至第一多核苷酸连接分子的合成链。进行裂解以使裂解的支架多核苷酸的第二链的末端核苷酸在第一链的3’末端保留可连接基团,通常为羟基或任何其它合适的3’可连接基团。
[1221]
因此,在方法版本6中,通用核苷酸在步骤(4)中占据合成/第二链中的位置n 1,并且第二链在步骤(5)中在核苷酸位置n 1与n之间被裂解。
[1222]
优选地,通过裂解核苷酸位置n 1与n之间的磷酸二酯键(在连接的多核苷酸连接分子的远端方向/第二链的近端方向上,相对于通用核苷酸的位置而言第二链的第一磷酸二酯键)来裂解第二链。
[1223]
可通过裂解核苷酸位置n 1与n之间的磷酸二酯键的一个酯键来裂解第二链。
[1224]
优选地,通过相对于核苷酸位置n 1的第一酯键的裂解来裂解第二链。
[1225]
当通用核苷酸占据位置n 1时,可采用任何合适的机制来实现在核苷酸位置n 1与n之间裂解第二链。
[1226]
如上所述在核苷酸位置n 1与n之间裂解第二链可通过酶的作用进行。
[1227]
如上所述在核苷酸位置n 1与n之间裂解第二链可作为两步裂解过程进行。
[1228]
两步裂解过程的第一裂解步骤可包括从第二链上去除通用核苷酸,从而在位置n 1处形成无碱基位点,并且第二裂解步骤可包括在位置n 1与n之间在无碱基位点处裂解第二链。
[1229]
实施例2中以类似方式描述了一种以上述方式在由包含通用核苷酸的序列限定的裂解位点处裂解第二链的机制。实施例2中描述的裂解机制是示例性的,并且可采用其它机制,只要实现上述裂解的双链支架多核苷酸即可。
[1230]
在两步裂解过程的第一裂解步骤中,将通用核苷酸从第二链上去除,同时保留糖-磷酸主链的完整性。这可以通过酶的作用来实现,所述酶可以从双链多核苷酸中特异性地切除单个通用核苷酸。在示例性裂解方法中,通用核苷酸是肌苷,并且通过酶的作用从链中切除肌苷,从而形成无碱基位点。在示例性裂解方法中,酶是3-甲基腺嘌呤dna糖基化酶,特别是人类烷基腺嘌呤dna糖基化酶(haag)。可以使用其它酶、分子或化学物质,只要形成无碱基位点即可。核苷酸切除酶可以是催化尿嘧啶从多核苷酸释放的酶,例如尿嘧啶-dna糖基化酶(udg)。
[1231]
在两步裂解过程的第二步骤中,通过形成单链断裂而在无碱基位点处裂解第二链。在示例性方法中,所述链通过作为碱诸如naoh的化学物质的作用被裂解。可替代地,可使用有机化学物质,诸如n,n
’‑
二甲基乙二胺。可替代地,可以使用具有无碱基位点裂解酶活性的酶,诸如ap核酸内切酶1、核酸内切酶iii(nth)或核酸内切酶viii。这些酶在相对于无碱基位点位于5’的磷酸基团处裂解dna主链。因此,裂解在第二链的3’末端暴露了oh基团,所述oh基团提供了末端3’核苷酸,所述核苷酸可在下一循环的第二连接步骤中连接。可以使用其它酶、分子或化学物质,只要第二链在如上所述的无碱基位点处被裂解即可。
[1232]
因此,在其中通用核苷酸在步骤(4)中处于第二链的位置n 1并且第二链在位置n 1与n之间被裂解的实施方案中,第一裂解步骤可用核苷酸切除酶来执行。这种酶的实施例是3-甲基腺嘌呤dna糖基化酶,诸如人类烷基腺嘌呤dna糖基化酶(haag)。第二裂解步骤可以用作为碱的化学物质如naoh进行。第二步可以用具有无碱基位点裂解活性的有机化学物质诸如n,n'-二甲基乙二胺进行。第二步骤可以用具有无碱基位点裂解酶活性的酶如核酸内切酶viii或核酸内切酶iii进行。
[1233]
如上所述在核苷酸位置n 1与n之间裂解第二链也可作为一步裂解过程进行。可用于任何此类方法的酶的实施例包括核酸内切酶iii、核酸内切酶viii。可用于任何此类过程的其它酶包括裂解8-氧代鸟苷的酶,如甲酰胺基嘧啶dna糖基化酶(fpg)和8-氧代鸟嘌呤dna糖基化酶(hogg1),它们裂解dna主链以在裂解的第二链的3’末端留下磷酸基团,然后可以通过核酸内切酶iv或t4多核苷酸激酶将其去除以暴露oh基团,所述oh基团可在下一循环的第二连接步骤中连接。
[1234]
在合成方法版本6中,应注意到,在任何给定的合成循环中,在第二裂解步骤(步骤5)之后,由裂解末端处第一和第二链的末端核苷酸占据的核苷酸位置均被定义为核苷酸位置n。这些核苷酸位置被定义为下一合成循环中的核苷酸位置n-1。
[1235]
另外的循环
[1236]
在完成第一合成循环之后,可以使用相同的方法步骤进行第二合成循环和另外的合成循环。
[1237]
提供(在步骤6中)上一循环的步骤(5)的裂解产物作为用于下一合成循环的双链支架多核苷酸。
[1238]
在下一合成循环和每个另外的合成循环的步骤(7)中,将另一个第一双链多核苷酸连接分子连接至上一循环的步骤(5)的裂解产物。所述多核苷酸连接分子可以以与上文针对上一循环的步骤(2)所描述的相同方式构造,不同之处在于,所述另一个第一多核苷酸连接分子包含待掺入第一链中的另外的合成循环的另外的第一核苷酸。在步骤(7)中,所述另一个第一多核苷酸连接分子可以以与上文针对步骤(2)所描述的相同方式连接至上一循环的步骤(5)的裂解产物。
[1239]
在下一合成循环和每个另外的合成循环的步骤(8)中,在裂解位点对连接的支架多核苷酸进行另一个第一裂解步骤。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤8)导致失去另一个第一多核苷酸连接分子中的辅助链并失去包含通用核苷酸的支持链。支架多核苷酸的裂解由此从支架多核苷酸中释放另一个第一多核苷酸连接分子,但导致附接至裂解的支架多核苷酸的合成链的来源于另一个第一多核苷酸连接分子的所述另外的循环的另外的第一核苷酸的保留。支架多核苷酸的裂解留下在支架多核苷酸的合成链的末端包含另外的循环的另外的第一核苷酸的裂解的双链支架多核苷酸。裂解导致单碱基突出端,其中第一链的末端核苷酸突出于第二链的末端核苷酸。步骤(8)的裂解可以以与上文针对步骤(4)所描述的相同方式进行。
[1240]
在下一合成循环和每个另外的合成循环的步骤(9)中,将另一个第二双链多核苷酸连接分子连接至步骤(8)的裂解产物。所述另一个第二多核苷酸连接分子可以以与上文针对上一循环的步骤(8)所描述的相同方式构造,不同之处在于,所述另一个第二多核苷酸连接分子包含待掺入第二链中的另外的合成循环的另外的第一核苷酸。在步骤(9)中,另一个第二多核苷酸连接分子可以以与上文针对步骤(4)所描述的相同方式连接至步骤(8)的裂解产物。
[1241]
在下一合成循环和每个另外的合成循环的步骤(10)中,在裂解位点对连接的支架多核苷酸进行另一个第二裂解步骤。裂解在支架多核苷酸中产生双链断裂。支架多核苷酸的裂解(步骤10)导致失去另一个第二多核苷酸连接分子中的辅助链并失去包含通用核苷酸的支持链。支架多核苷酸的裂解由此从支架多核苷酸中释放另一个第二多核苷酸连接分子,但导致附接至裂解的支架多核苷酸的合成链的来源于另一个第二多核苷酸连接分子的所述另外的循环的另外的第一核苷酸的保留。支架多核苷酸的裂解留下在支架多核苷酸的第二链的末端包含来源于另一个第二多核苷酸连接分子的另外的循环的另外的第一核苷酸的裂解的平末端的双链支架多核苷酸。步骤(10)处的裂解可以以与上文针对步骤(5)所描述的相同的方式进行。
[1242]
合成方法的变体
[1243]
上述合成方法的许多不同变体被设想在本发明的范围内并且在下文更详细地描述。
[1244]
合成方法版本1的变体
[1245]
提供了本发明的合成方法版本1的变体,其中除了以下描述的变化之外,所述方法以与上述合成方法版本1相同的方式执行。
[1246]
本发明的合成方法版本1及其变体可以通过公式进行一般性定义。
[1247]
在第一连接步骤(步骤2)中,第一多核苷酸连接分子的互补连接末端被构造成使得通用核苷酸占据合成链中由式n x限定的核苷酸位置并与辅助链中距离辅助链在互补连接末端的末端核苷酸x-1个位置的配偶体核苷酸配对。例如,如果x=2,则通用核苷酸在合成链中占据核苷酸位置n 2。位置n 2是合成链中在远离互补连接末端的方向上相对于核苷酸位置n的第二核苷酸位置。合成链的位置n处的核苷酸是将在第一连接步骤期间掺入支架多核苷酸的第一链中的预定序列的第一核苷酸,并与第二链的末端核苷酸配对。如果通用核苷酸占据位置n 2,则它与辅助链中距离辅助链在互补连接末端的末端核苷酸2-1个位置,即1个位置的配偶体核苷酸配对。换句话说,占据位置n 2的通用核苷酸将与互补连接末端处的辅助链次末端核苷酸配对。
[1248]
在第一裂解步骤(步骤3)中,支架多核苷酸的合成链总是在位置n 2与n 1之间被裂解,无论为x选择以限定第一多核苷酸连接分子中的通用核苷酸在合成链中的位置的数目是多少。
[1249]
在这些方法中,在步骤(2)和(3)中为x选择的值是从2到10或更大的整数。
[1250]
因此,在合成方法版本1的这些特定变体中,第一裂解位点的位置保持恒定介于位置n 2与n 1之间,并且通用核苷酸相对于裂解位点的位置通过在远离裂解位点的方向上移动通用核苷酸的位置而增加由为x选择的数目确定的核苷酸位置的数目。
[1251]
第二多核苷酸连接分子的构造和第二裂解步骤可以独立地或与对第一多核苷酸连接分子和第一裂解步骤所做的改变结合地变化。
[1252]
因此,在第二连接步骤(步骤4)中,第二多核苷酸连接分子的互补连接末端可被构造成使得通用核苷酸占据合成链中由式n x限定的核苷酸位置并与辅助链中距离辅助链在互补连接末端的末端核苷酸n x-2个位置的配偶体核苷酸配对。例如,如果x=3,则通用核苷酸在合成链中占据核苷酸位置n 3。位置n 3是在合成链中在远离互补连接末端的方向上相对于核苷酸位置n的第三核苷酸位置。如果通用核苷酸占据位置n 3,则它与辅助链中距离辅助链在互补连接末端的末端核苷酸n 3-2个位置,即1个位置的配偶体核苷酸配对。换句话说,占据位置n 3的通用核苷酸将与互补连接末端处的辅助链次末端核苷酸配对。
[1253]
在第二裂解步骤(步骤5)中,支架多核苷酸的合成链总是在位置n 3与n 2之间被裂解,无论为y选择以限定第二多核苷酸连接分子中的通用核苷酸在合成链中的位置的数目是多少。
[1254]
在这些方法中,在步骤(4)和(5)中为x选择的值是从3到10或更大的整数。
[1255]
因此,在合成方法版本1的这些特定变体中,第二裂解位点的位置保持恒定介于位置n 3与n 2之间,并且通用核苷酸相对于裂解位点的位置通过在远离裂解位点的方向上移动通用核苷酸的位置而增加由为x选择的数目确定的核苷酸位置的数目。
[1256]
在第一连接和裂解步骤中为x选择的数目可独立于在第二连接和裂解步骤中为x选择的数目而变化。例如,在本发明的这些特定变体合成方法中,在第二连接和裂解步骤中为x选择的数目可以保持恒定,而在第一连接和裂解步骤中为x选择的数目可以变化。可替代地,在第一连接和裂解步骤中为x选择的数目可以保持恒定,而在第二连接和裂解步骤中为x选择的数目可以变化。此外,设想了组合方法,其中可以针对第一连接和裂解步骤选择任何x值,并且组合地,可以针对第二连接和裂解步骤选择任何x值。
[1257]
因此,本发明提供了根据本发明方法版本1的变体方法,其中在步骤(2)中,通用核
苷酸位于第一多核苷酸连接分子的合成链中由式n x限定的位置处并且其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n 2与n 1之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目并且其中x是从2到10或更大的整数。
[1258]
独立地,本发明提供了根据本发明方法版本1的变体方法,其中在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n x限定的位置处并且其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n 3与n 2之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目并且其中x是从3到10或更大的整数。
[1259]
组合起来,本发明提供了根据本发明合成方法版本1的变体方法,其中在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n x限定的位置处,其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n 2与n 1之间被裂解,其中x是从2到10或更大的整数;并且其中在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n x限定的位置处并且其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n 3与n 2之间被裂解,其中x是从3到10或更大的整数;并且其中在步骤(2)和(4)中,x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目。
[1260]
根据该组合方案,对于第一连接和裂解步骤为x值选择2并且对于第二连接和裂解步骤为x值选择3将得到如针对本发明的合成方法版本1所描述而定义的方法。对于第一连接和裂解步骤为x值选择2并且对于第二连接和裂解步骤为x值选择4将得到如针对本发明的合成方法版本2所描述而定义的方法。因此,当在上述公式的上下文中考虑时,本发明的合成方法2可以定义为本发明的合成方法1的变体。
[1261]
合成方法版本3的变体
[1262]
提供了本发明的合成方法版本3的变体,其中除了以下描述的变化之外,所述方法以与上述合成方法版本3相同的方式执行。
[1263]
本发明的合成方法版本3及其变体可以通过公式进行一般性定义。
[1264]
在第一连接步骤(步骤2)中,第一多核苷酸连接分子的互补连接末端被构造成使得通用核苷酸占据合成链中由式n x限定的核苷酸位置并与辅助链中距离辅助链在互补连接末端的末端核苷酸x个位置的配偶体核苷酸配对。例如,如果x=1,则通用核苷酸在合成链中占据核苷酸位置n 1。位置n 1是在合成链中在远离互补连接末端的方向上相对于核苷酸位置n的第二核苷酸位置。合成链的位置n处的核苷酸是将在第一连接步骤期间掺入支架多核苷酸的第一链中的预定序列的第一核苷酸,并与将在第二连接步骤期间掺入支架多核苷酸的第二链中的预定序列的第一核苷酸配对。如果通用核苷酸占据位置n 1,则它与辅助链中距离辅助链在互补连接末端的末端核苷酸x个位置,即1个位置的配偶体核苷酸配对。换句话说,占据位置n 1的通用核苷酸将与互补连接末端处的辅助链次末端核苷酸配对。
[1265]
在第一裂解步骤(步骤3)中,支架多核苷酸的合成链总是在位置n 1与n之间被裂解,无论为x选择以限定第一多核苷酸连接分子中的通用核苷酸在合成链中的位置的数目是多少。
[1266]
因此,在合成方法版本3的这些特定变体中,第一裂解位点的位置保持恒定介于位置n 1与n之间,并且通用核苷酸相对于裂解位点的位置通过在远离裂解位点的方向上移动通用核苷酸的位置而增加由为x选择的数目确定的核苷酸位置的数目。
[1267]
第二多核苷酸连接分子的构造和第二裂解步骤可以独立地或与对第一多核苷酸
连接分子和第一裂解步骤所做的改变结合地变化。
[1268]
因此,在第二连接步骤(步骤4)中,第二多核苷酸连接分子的互补连接末端可被构造成使得通用核苷酸占据合成链中由式n x限定的核苷酸位置并与辅助链中距离辅助链在互补连接末端的末端核苷酸x-1个位置的配偶体核苷酸配对。例如,如果x=2,则通用核苷酸在合成链中占据核苷酸位置n 2。位置n 2是合成链中在远离互补连接末端的方向上相对于核苷酸位置n的第二核苷酸位置。如果通用核苷酸占据位置n 2,则它与辅助链中距离辅助链在互补连接末端的末端核苷酸2-1个位置,即1个位置的配偶体核苷酸配对。换句话说,占据位置n 2的通用核苷酸将与互补连接末端处的辅助链次末端核苷酸配对。
[1269]
在第二裂解步骤(步骤5)中,支架多核苷酸的合成链总是在位置n 1与n之间被裂解,无论为x选择以限定第二多核苷酸连接分子中的通用核苷酸在合成链中的位置的数目是多少。
[1270]
因此,在合成方法版本3的这些特定变体中,第二裂解位点的位置保持恒定介于位置n 1与n之间,并且通用核苷酸相对于裂解位点的位置通过在远离裂解位点的方向上移动通用核苷酸的位置而增加由为x选择的数目确定的核苷酸位置的数目。
[1271]
在第一连接和裂解步骤中为x选择的数目可独立于在第二连接和裂解步骤中为x选择的数目而变化。例如,在本发明的这些特定变体合成方法中,在第二连接和裂解步骤中为x选择的数目可以保持恒定,而在第一连接和裂解步骤中为x选择的数目可以变化。可替代地,在第一连接和裂解步骤中为x选择的数目可以保持恒定,而在第二连接和裂解步骤中为x选择的数目可以变化。此外,设想了组合方法,其中可以针对第一连接和裂解步骤选择任何x值,并且组合地,可以针对第二连接和裂解步骤选择任何x值。
[1272]
因此,本发明提供了根据本发明方法版本3的变体方法,其中在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n x限定的位置处并且其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n 1与n之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目并且其中x是从1到10或更大的整数。
[1273]
独立地,本发明提供了根据本发明方法版本3的变体方法,其中在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n x限定的位置处并且其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n 1与n之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目并且其中x是从1到10或更大的整数。
[1274]
组合起来,本发明提供了根据本发明合成方法版本3的变体方法,其中在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n x限定的位置处,其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n 1与n之间被裂解,其中x是从1到10或更大的整数;并且其中在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n x限定的位置处并且其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n 1与n之间被裂解,其中x是从1到10或更大的整数;并且其中在步骤(2)和(4)中,x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目。
[1275]
根据该组合方案,对于第一连接和裂解步骤为x值选择1并且对于第二连接和裂解步骤为x值选择1将得到如针对本发明的合成方法版本3所描述而定义的方法。对于第一连接和裂解步骤为x值选择1并且对于第二连接和裂解步骤为x值选择2将得到如针对本发明的合成方法版本4所描述而定义的方法。因此,当在上述公式的上下文中考虑时,本发明的
合成方法版本4可以定义为本发明的合成方法版本3的变体。
[1276]
合成方法版本5的变体
[1277]
提供了本发明的合成方法版本5的变体,其中除了以下描述的变化之外,所述方法以与上述合成方法版本5相同的方式执行。
[1278]
本发明的合成方法版本5及其变体可以通过公式进行一般性定义。
[1279]
在第一连接步骤(步骤2)中,第一多核苷酸连接分子的互补连接末端被构造成使得通用核苷酸占据合成链中由式n x限定的核苷酸位置并与辅助链中距离辅助链在互补连接末端的末端核苷酸x个位置的配偶体核苷酸配对。例如,如果x=1,则通用核苷酸在合成链中占据核苷酸位置n 1。位置n 1是在合成链中在远离互补连接末端的方向上相对于核苷酸位置n的第二核苷酸位置。合成链的位置n处的核苷酸是将在第一连接步骤期间掺入支架多核苷酸的第一链中的预定序列的第一核苷酸,并与将在第二连接步骤期间掺入支架多核苷酸的第二链中的预定序列的第一核苷酸配对。如果通用核苷酸占据位置n 1,则它与辅助链中距离辅助链在互补连接末端的末端核苷酸x个位置,即1个位置的配偶体核苷酸配对。换句话说,占据位置n 1的通用核苷酸将与互补连接末端处的辅助链次末端核苷酸配对。
[1280]
在第一裂解步骤(步骤3)中,支架多核苷酸的合成链总是在位置n 1与n之间被裂解,无论为x选择以限定第一多核苷酸连接分子中的通用核苷酸在合成链中的位置的数目是多少。
[1281]
因此,在合成方法版本5的这些特定变体中,第一裂解位点的位置保持恒定介于位置n 1与n之间,并且通用核苷酸相对于裂解位点的位置通过在远离裂解位点的方向上移动通用核苷酸的位置而增加由为x选择的数目确定的核苷酸位置的数目。
[1282]
第二多核苷酸连接分子的构造和第二裂解步骤可以独立地或与对第一多核苷酸连接分子和第一裂解步骤所做的改变结合地变化。
[1283]
因此,在第二连接步骤(步骤4)中,第二多核苷酸连接分子的互补连接末端可被构造成使得通用核苷酸占据合成链中由式n x限定的核苷酸位置并与辅助链中距离辅助链在互补连接末端的末端核苷酸x-1个位置的配偶体核苷酸配对。例如,如果x=2,则通用核苷酸在合成链中占据核苷酸位置n 2。位置n 2是合成链中在远离互补连接末端的方向上相对于核苷酸位置n的第二核苷酸位置。如果通用核苷酸占据位置n 2,则它与辅助链中距离辅助链在互补连接末端的末端核苷酸2-1个位置,即1个位置的配偶体核苷酸配对。换句话说,占据位置n 2的通用核苷酸将与互补连接末端处的辅助链次末端核苷酸配对。
[1284]
在第二裂解步骤(步骤5)中,支架多核苷酸的合成链总是在位置n 1与n之间被裂解,无论为x选择以限定第二多核苷酸连接分子中的通用核苷酸在合成链中的位置的数目是多少。
[1285]
因此,在合成方法版本5的这些特定变体中,第二裂解位点的位置保持恒定介于位置n 1与n之间,并且通用核苷酸相对于裂解位点的位置通过在远离裂解位点的方向上移动通用核苷酸的位置而增加由为x选择的数目确定的核苷酸位置的数目。
[1286]
在第一连接和裂解步骤中为x选择的数目可独立于在第二连接和裂解步骤中为x选择的数目而变化。例如,在本发明的这些特定变体合成方法中,在第二连接和裂解步骤中为x选择的数目可以保持恒定,而在第一连接和裂解步骤中为x选择的数目可以变化。可替代地,在第一连接和裂解步骤中为x选择的数目可以保持恒定,而在第二连接和裂解步骤中
为x选择的数目可以变化。此外,设想了组合方法,其中可以针对第一连接和裂解步骤选择任何x值,并且组合地,可以针对第二连接和裂解步骤选择任何x值。
[1287]
因此,本发明提供了根据本发明方法版本5的变体方法,其中在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n x限定的位置处并且其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n 1与n之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目并且其中x是从1到10或更大的整数。
[1288]
独立地,本发明提供了根据本发明方法版本5的变体方法,其中在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n x限定的位置处并且其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n 1与n之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目并且其中x是从1到10或更大的整数。
[1289]
组合起来,本发明提供了根据本发明合成方法版本5的变体方法,其中在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n x限定的位置处,其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n 1与n之间被裂解,其中x是从1到10或更大的整数;并且其中在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n x限定的位置处并且其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n 1与n之间被裂解,其中x是从1到10或更大的整数;并且其中在步骤(2)和(4)中,x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目。
[1290]
根据该组合方案,对于第一连接和裂解步骤为x值选择1并且对于第二连接和裂解步骤为x值选择1将得到如针对本发明的合成方法版本5所描述而定义的方法。对于第一连接和裂解步骤为x值选择1并且对于第二连接和裂解步骤为x值选择2将得到如针对本发明的合成方法版本6所描述而定义的方法。因此,当在上述公式的上下文中考虑时,本发明的合成方法版本6可以定义为本发明的合成方法版本5的变体。
[1291]
合成方法版本3的另外的变体
[1292]
提供了本发明的合成方法版本3的另外的变体,其中除了以下描述的变化之外,所述方法以与上述合成方法版本3相同的方式执行。在这些变体方法中,可以在第一连接反应期间将两个或更多个核苷酸掺入第一链中,并且随后可以在第二连接反应期间将两个或更多个相应核苷酸掺入第二链中。这些另外的变体方法也可以通过公式一般性地定义。下文描述了通用变体方法和两种特定的说明性变体方法,即合成方法版本7和8。
[1293]
本发明的合成方法版本7是合成方法版本3的另一变体的说明性具体实施例并且其可以一般性地定义如下。
[1294]
在第一连接步骤(步骤2)中,第一多核苷酸连接分子的互补连接末端被构造成使得通用核苷酸在合成链中占据由式n 1 x限定的核苷酸位置并与互补连接末端处辅助链中相同位置的配偶体核苷酸配对。例如,如果x=1,则通用核苷酸在合成链中占据核苷酸位置n 2。位置n 2是合成链中在远离互补连接末端的方向上相对于核苷酸位置n的第二核苷酸位置。合成链的位置n处的核苷酸是将在第一连接步骤期间掺入支架多核苷酸的第一链中的预定序列的第一核苷酸,并与将在第二连接步骤期间掺入支架多核苷酸的第二链中的预定序列的第一核苷酸配对。合成链的位置n 1处的核苷酸是将在第一连接步骤期间掺入支架多核苷酸的第一链中的预定序列的第二核苷酸,并与将在第二连接步骤期间掺入支架多核苷酸的第二链中的预定序列的第二核苷酸配对。因此,在其中x=1的这种方法中,预定序
列的两个核苷酸将在第一连接反应期间掺入第一链中。
[1295]
在其中x=1并且通用核苷酸占据位置n 2的这种方法中,通用核苷酸与辅助链中的配偶体核苷酸配对,所述配偶体核苷酸在互补连接末端的辅助链中也处于位置n 2。
[1296]
在第一裂解步骤(步骤3)中,支架多核苷酸的合成链在位置n 1 x与n x之间被裂解。因此,在其中x=1的方法中,支架多核苷酸的合成链在位置n 2与n 1之间被裂解。
[1297]
在合成方法版本3的这些特定的另外变体中,在第一裂解和连接步骤中为x选择的值必须至少为1。因此,通用核苷酸将占据为n 2或更大的位置。由于支架多核苷酸在位置n 1 x与n x之间被裂解,这意味着在这种方法中,预定序列的至少两个核苷酸在第一连接步骤期间被掺入第一链中。
[1298]
在第二连接步骤(步骤4)中,第二多核苷酸连接分子的互补连接末端被构造成使得通用核苷酸在合成链中占据由式n 1 x限定的核苷酸位置并与互补连接末端处辅助链中相同位置的配偶体核苷酸配对。例如,如果x=1,则通用核苷酸在合成链中占据核苷酸位置n 2。位置n 2是合成链中在远离互补连接末端的方向上相对于核苷酸位置n的第二核苷酸位置。合成链的位置n处的核苷酸是将在第二连接步骤期间掺入支架多核苷酸的第二链中的预定序列的第一核苷酸,并与将在第一连接步骤期间掺入支架多核苷酸的第一链中的预定序列的第一核苷酸配对。
[1299]
合成链的位置n 1处的核苷酸是将在第二连接步骤期间掺入支架多核苷酸的第二链中的预定序列的第二核苷酸,并与将在第一连接步骤期间掺入支架多核苷酸的第一链中的预定序列的第二核苷酸配对。因此,在其中x=1的这种方法中,在第二连接和裂解步骤中,预定序列的两个核苷酸将在第二连接反应期间掺入第二链中。
[1300]
在第二裂解步骤(步骤5)中,支架多核苷酸的合成链在位置n 1 x与n x之间被裂解。因此,在其中x=1的方法中,在第二连接和裂解步骤中,支架多核苷酸的合成链在位置n 2与n 1之间被裂解。在合成方法版本3的这些特定的另外变体中,在第二连接和裂解步骤中为x选择的值必须至少为1。因此,通用核苷酸将占据为n 2或更大的位置。由于支架多核苷酸在位置n 1 x与n x之间被裂解,这意味着在这种方法中,预定序列的至少两个核苷酸在第二连接步骤期间被掺入第二链中。
[1301]
因此,本发明提供了根据本发明方法版本3的另外的变体方法,其中在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n 1 x限定的位置处,并且其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n 1 x与n x之间被裂解,其中x是从1到10或更大的整数;并且其中在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n 1 x限定的位置处,并且其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n 1 x与n x之间被裂解,其中x是从1到10或更大的整数;并且其中在步骤(2)和(4)中,x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目。
[1302]
在任何这些另外的变体方法中,在步骤(2)和(3)中为x选择的数目以及在步骤(4)和(5)中为x选择的数目经过选择使得在步骤(2)和(3)中掺入支架多核苷酸的第一链中的核苷酸的数目可与在步骤(4)和(5)中掺入支架多核苷酸的第二链中的核苷酸的数目相同。
[1303]
在任何这些另外的变体方法中,在步骤(2)和(3)中为x选择的数目可具有与在步骤(4)和(5)中为x选择的数目相同的值。
[1304]
根据这种组合方案,在步骤(2)和(3)中为x值选择1并且在步骤(4)和(5)中为x值
选择1将得到如针对本发明的合成方法版本7(参见图7)所描述而定义的方法,其中在第一连接反应期间将预定序列的两个核苷酸掺入第一链中并且在第二连接反应期间将预定序列的两个相应核苷酸掺入第二链中,从而将两个新核苷酸对掺入支架多核苷酸中。因此,当在上述公式的上下文中考虑时,本发明的合成方法版本7可以定义为本发明的合成方法版本3的变体。对于第一和第二连接和裂解步骤为x值选择2将得到一种方法,其中在第一连接反应期间将预定序列的三个核苷酸掺入第一链中并且在第二连接反应期间将预定序列的三个相应核苷酸掺入第二链中,从而将三个新核苷酸对掺入支架多核苷酸中。使用者可以以此方式增加为x选择的值,以在每个合成循环期间逐渐将更多的核苷酸对掺入支架多核苷酸中。
[1305]
从本发明的合成方法版本3的上述另外的变体方法的描述中将显而易见,其中本发明的合成方法版本7是一个例子,这些示意图得到了其中第一链和第二链均在通用核苷酸所占据的位置与将在先前的连接反应中掺入链中的预定序列的最后一个核苷酸所占据的位置之间的位置裂解的方法。例如,在描绘本发明合成方法版本7的图7中,在步骤(3)中,第一链在通用核苷酸与被描绘为g的核苷酸之间被裂解,所述g是将在先前的连接反应(步骤2)中掺入第一链的预定序列的最后一个核苷酸。然而,又设想了另外的变体方法,其中可以改变裂解机制。这种另外变体的实施例可以参考本发明合成方法版本8一般性地定义。
[1306]
根据这样的另外的变体方法,在第二连接步骤(步骤4)中,第二多核苷酸连接分子的互补连接末端被构造成使得通用核苷酸在合成链中占据由式n 1 x限定的核苷酸位置并与互补连接末端处辅助链中相同位置的配偶体核苷酸配对。在这些方法中,x是从2到10或更大的整数,并且是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目。例如,如果x=2,则通用核苷酸在合成链中占据核苷酸位置n 3。位置n 3是在合成链中在远离互补连接末端的方向上相对于核苷酸位置n的第三核苷酸位置。在第二裂解步骤(步骤5)中,支架多核苷酸的合成链在位置n x与n x-1之间被裂解。因此,在其中x=2的方法中,支架多核苷酸的合成链在位置n 2与n 1之间被裂解并且通用核苷酸占据位置n 3。
[1307]
这些示意图得到这样的方法:其中第二链在紧接着将在先前的第二连接反应步骤(4)中掺入第二链的预定序列的最后一个核苷酸占据的位置之后(在辅助链的近端方向上)的核苷酸位置处被裂解。因此,在这些示意图中,值x定义了一个变量,所述变量影响相对于裂解位点而言通用核苷酸的位置以及掺入第一和第二链中的预定序列的核苷酸的数目。
[1308]
因此,本发明提供了如上所述的另外的变体方法,其中在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n 1 x限定的位置处,其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n x与n x-1之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目并且其中x是从2到10或更大的整数。
[1309]
根据该组合方案,在第二连接步骤(4)和第二裂解步骤(5)中,为x值选择2将得到如针对本发明的合成方法版本8(参见图8)所描述而定义的方法。因此,当在上述公式的上下文中考虑时,本发明的合成方法版本8可以定义为本发明的合成方法版本7的变体。
[1310]
设想了另外的变体方法,其中通用核苷酸相对于第一裂解步骤中的裂解位点的定位可以独立变化,如下所述。
[1311]
根据这样的另外的变体方法,在第一连接步骤(步骤2)中,第一多核苷酸连接分子的互补连接末端被构造成使得通用核苷酸在合成链中占据由式n 1 x限定的核苷酸位置并
与互补连接末端处辅助链中相同位置的配偶体核苷酸配对。在这些方法中,x是从2到10或更大的整数。例如,如果x=2,则通用核苷酸在合成链中占据核苷酸位置n 3。位置n 3是在合成链中在远离互补连接末端的方向上相对于核苷酸位置n的第三核苷酸位置。在第一裂解步骤(步骤3)中,支架多核苷酸的合成链在位置n x与n x-1之间被裂解。因此,在其中x=2的方法中,支架多核苷酸的合成链在位置n 2与n 1之间被裂解并且通用核苷酸占据位置n 3。
[1312]
这些示意图得到这样的方法:其中第一链在紧接着将在先前的第一连接反应步骤(2)中掺入第一链的预定序列的最后一个核苷酸占据的位置之后(在辅助链的近端方向上)的核苷酸位置处被裂解。因此,在这些示意图中,值x定义了一个变量,所述变量影响相对于裂解位点而言通用核苷酸的位置以及掺入第一和第二链中的预定序列的核苷酸的数目。
[1313]
因此,本发明提供了如上所述的另外的变体方法,其中在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n 1 x限定的位置处,其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n x与n x-1之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目并且其中x是从2到10或更大的整数。
[1314]
如从以上描述中将显而易见的,在两种另外的变体中的第一种中,其中本发明合成方法版本8是说明性实施例,通用核苷酸相对于第二裂解步骤中的裂解位点的定位在不同的方法中可以改变,并且组合地,通用核苷酸相对于第一裂解步骤中的裂解位点的定位可以保持固定。相反地,在两种另外的变体中的第二种中,通用核苷酸相对于第一裂解步骤中的裂解位点的定位在不同的方法中可以改变,并且组合地,通用核苷酸相对于第二裂解步骤中的裂解位点的定位可以保持固定。设想了其它另外的变体方法,其中通用核苷酸相对于第一和第二裂解步骤中的裂解位点的定位可以在不同的方法中以任何组合改变。因此,本发明提供了如上所述的另外的变体方法,其中在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n 1 x限定的位置处,其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n x与n x-1之间被裂解,其中x是从2到10或更大的整数;并且在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n 1 x限定的位置处,其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n x与n x-1之间被裂解,其中x是从2到10或更大的整数;并且其中在步骤(2)和(4)中,x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目。
[1315]
在任何这些方法中,在步骤(2)和(3)中为x选择的数目以及在步骤(4)和(5)中为x选择的数目经过选择使得在步骤(2)和(3)中掺入支架多核苷酸的第一链的核苷酸的数目与在步骤(4)和(5)中掺入支架多核苷酸的第二链的核苷酸的数目相同。
[1316]
在任何这些方法中,在步骤(2)和(3)中为x选择的数目可具有与在步骤(4)和(5)中为x选择的数目相同的值。
[1317]
合成方法版本5的另外的变体
[1318]
提供了本发明的合成方法版本5的另外的变体,其中除了以下描述的变化之外,所述方法以与上述合成方法版本5相同的方式执行。在这些变体方法中,可以在第一连接反应期间将两个或更多个核苷酸掺入第一链中,并且随后可以在第二连接反应期间将两个或更多个相应核苷酸掺入第二链中。这些另外的变体方法也可以通过公式一般性地定义。下文描述了通用变体方法和两种特定的说明性变体方法,即合成方法版本9和10。
[1319]
本发明的合成方法版本9是合成方法版本5的另一变体的说明性具体实施例并且其可以一般性地定义如下。
[1320]
在第一连接步骤(步骤2)中,第一多核苷酸连接分子的互补连接末端被构造成使得通用核苷酸在合成链中占据由式n 1 x限定的核苷酸位置并与互补连接末端处辅助链中相同位置的配偶体核苷酸配对。例如,如果x=1,则通用核苷酸在合成链中占据核苷酸位置n 2。位置n 2是合成链中在远离互补连接末端的方向上相对于核苷酸位置n的第二核苷酸位置。合成链的位置n处的核苷酸是将在第一连接步骤期间掺入支架多核苷酸的第一链中的预定序列的第一核苷酸,并与将在第二连接步骤期间掺入支架多核苷酸的第二链中的预定序列的第一核苷酸配对。合成链的位置n 1处的核苷酸是将在第一连接步骤期间掺入支架多核苷酸的第一链中的预定序列的第二核苷酸,并与将在第二连接步骤期间掺入支架多核苷酸的第二链中的预定序列的第二核苷酸配对。因此,在其中x=1的这种方法中,预定序列的两个核苷酸将在第一连接反应期间掺入第一链中。
[1321]
在其中x=1并且通用核苷酸占据位置n 2的这种方法中,通用核苷酸与辅助链中的配偶体核苷酸配对,所述配偶体核苷酸在互补连接末端的辅助链中也处于位置n 2。
[1322]
在第一裂解步骤(步骤3)中,支架多核苷酸的合成链在位置n 1 x与n x之间被裂解。因此,在其中x=1的方法中,支架多核苷酸的合成链在位置n 2与n 1之间被裂解。
[1323]
在合成方法版本5的这些特定的另外变体中,在第一裂解和连接步骤中为x选择的值必须至少为1。因此,通用核苷酸将占据为n 2或更大的位置。由于支架多核苷酸在位置n 1 x与n x之间被裂解,这意味着在这种方法中,预定序列的至少两个核苷酸在第一连接步骤期间被掺入第一链中。
[1324]
在第二连接步骤(步骤4)中,第二多核苷酸连接分子的互补连接末端被构造成使得通用核苷酸在合成链中占据由式n 1 x限定的核苷酸位置并与互补连接末端处辅助链中相同位置的配偶体核苷酸配对。例如,如果x=1,则通用核苷酸在合成链中占据核苷酸位置n 2。位置n 2是合成链中在远离互补连接末端的方向上相对于核苷酸位置n的第二核苷酸位置。合成链的位置n处的核苷酸是将在第二连接步骤期间掺入支架多核苷酸的第二链中的预定序列的第一核苷酸,并与将在第一连接步骤期间掺入支架多核苷酸的第一链中的预定序列的第一核苷酸配对。
[1325]
合成链的位置n 1处的核苷酸是将在第二连接步骤期间掺入支架多核苷酸的第二链中的预定序列的第二核苷酸,并与将在第一连接步骤期间掺入支架多核苷酸的第一链中的预定序列的第二核苷酸配对。因此,在其中x=1的这种方法中,在第二连接和裂解步骤中,预定序列的两个核苷酸将在第二连接反应期间掺入第二链中。
[1326]
在第二裂解步骤(步骤5)中,支架多核苷酸的合成链在位置n 1 x与n x之间被裂解。因此,在其中x=1的方法中,在第二连接和裂解步骤中,支架多核苷酸的合成链在位置n 2与n 1之间被裂解。在合成方法版本5的这些特定的另外变体中,在第二连接和裂解步骤中为x选择的值必须至少为1。因此,通用核苷酸将占据为n 2或更大的位置。由于支架多核苷酸在位置n 1 x与n x之间被裂解,这意味着在这种方法中,预定序列的至少两个核苷酸在第二连接步骤期间被掺入第二链中。
[1327]
因此,本发明提供了根据本发明方法版本5的另外的变体方法,其中在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n 1 x限定的位置处,并且其中在
步骤(3)中,支架多核苷酸的连接的第一链在位置n 1 x与n x之间被裂解,其中x是从1到10或更大的整数;并且其中在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n 1 x限定的位置处,并且其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n 1 x与n x之间被裂解,其中x是从1到10或更大的整数;并且其中在步骤(2)和(4)中,x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目。
[1328]
在任何这些另外的变体方法中,在步骤(2)和(3)中为x选择的数目以及在步骤(4)和(5)中为x选择的数目经过选择使得在步骤(2)和(3)中掺入支架多核苷酸的第一链中的核苷酸的数目可与在步骤(4)和(5)中掺入支架多核苷酸的第二链中的核苷酸的数目相同。
[1329]
在任何这些另外的变体方法中,在步骤(2)和(3)中为x选择的数目可具有与在步骤(4)和(5)中为x选择的数目相同的值。
[1330]
根据这种组合方案,在步骤(2)和(3)中为x值选择1并且在步骤(4)和(5)中为x值选择1将得到如针对本发明的合成方法版本9(参见图9)所描述而定义的方法,其中在第一连接反应期间将预定序列的两个核苷酸掺入第一链中并且在第二连接反应期间将预定序列的两个相应核苷酸掺入第二链中,从而将两个新核苷酸对掺入支架多核苷酸中。因此,当在上述公式的上下文中考虑时,本发明的合成方法版本9可以定义为本发明的合成方法版本5的变体。对于第一和第二连接和裂解步骤为x值选择2将得到一种方法,其中在第一连接反应期间将预定序列的三个核苷酸掺入第一链中并且在第二连接反应期间将预定序列的三个相应核苷酸掺入第二链中,从而将三个新核苷酸对掺入支架多核苷酸中。使用者可以以此方式增加为x选择的值,以在每个合成循环期间逐渐将更多的核苷酸对掺入支架多核苷酸中。
[1331]
从本发明的合成方法版本5的上述另外的变体方法的描述中将显而易见,其中本发明的合成方法版本9是一个例子,这些示意图得到了其中第一链和第二链均在通用核苷酸所占据的位置与将在先前的连接反应中掺入链中的预定序列的最后一个核苷酸所占据的位置之间的位置裂解的方法。例如,在描绘本发明合成方法版本9的图9中,在步骤(3)中,第一链在通用核苷酸与被描绘为c的核苷酸之间被裂解,所述c是将在先前的连接反应(步骤2)中掺入第一链的预定序列的最后一个核苷酸。然而,又设想了另外的变体方法,其中可以改变裂解机制。这种另外变体的实施例可以参考本发明合成方法版本10一般性地定义。
[1332]
根据这样的另外的变体方法,在第一连接步骤(步骤2)中,第一多核苷酸连接分子的互补连接末端被构造成使得通用核苷酸在合成链中占据由式n 1 x限定的核苷酸位置并与互补连接末端处辅助链中相同位置的配偶体核苷酸配对。在这些方法中,x是从2到10或更大的整数。例如,如果x=2,则通用核苷酸在合成链中占据核苷酸位置n 3。位置n 3是在合成链中在远离互补连接末端的方向上相对于核苷酸位置n的第三核苷酸位置。在第一裂解步骤(步骤3)中,支架多核苷酸的合成链在位置n x与n x-1之间被裂解。因此,在其中x=2的方法中,支架多核苷酸的合成链在位置n 2与n 1之间被裂解并且通用核苷酸占据位置n 3。
[1333]
这些示意图得到这样的方法:其中第一链在紧接着将在先前的第一连接反应步骤(2)中掺入第一链的预定序列的最后一个核苷酸占据的位置之后(在辅助链的近端方向上)的核苷酸位置处被裂解。因此,在这些示意图中,值x定义了一个变量,所述变量影响相对于裂解位点而言通用核苷酸的位置以及掺入第一和第二链中的预定序列的核苷酸的数目。
[1334]
因此,本发明提供了如上所述的另外的变体方法,其中在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n 1 x限定的位置处,其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n x与n x-1之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目并且其中x是从2到10或更大的整数。
[1335]
根据该组合方案,在第一连接步骤(2)和第一裂解步骤(3)中,为x值选择2将得到如针对本发明的合成方法版本10(参见图10)所描述而定义的方法。因此,当在上述公式的上下文中考虑时,本发明的合成方法版本10可以定义为本发明的合成方法版本9的变体。
[1336]
设想了另外的变体方法,其中通用核苷酸相对于第二裂解步骤中的裂解位点的定位可以独立变化,如下所述。
[1337]
根据这样的另外的变体方法,在第二连接步骤(步骤4)中,第二多核苷酸连接分子的互补连接末端被构造成使得通用核苷酸在合成链中占据由式n 1 x限定的核苷酸位置并与互补连接末端处辅助链中相同位置的配偶体核苷酸配对。在这些方法中,x是从2到10或更大的整数。例如,如果x=2,则通用核苷酸在合成链中占据核苷酸位置n 3。位置n 3是在合成链中在远离互补连接末端的方向上相对于核苷酸位置n的第三核苷酸位置。在第二裂解步骤(步骤5)中,支架多核苷酸的合成链在位置n x与n x-1之间被裂解。因此,在其中x=2的方法中,支架多核苷酸的合成链在位置n 2与n 1之间被裂解并且通用核苷酸占据位置n 3。
[1338]
这些示意图得到这样的方法:其中第二链在紧接着将在先前的第二连接反应步骤(4)中掺入第二链的预定序列的最后一个核苷酸占据的位置之后(在辅助链的近端方向上)的核苷酸位置处被裂解。因此,在这些示意图中,值x定义了一个变量,所述变量影响相对于裂解位点而言通用核苷酸的位置以及掺入第二链中的预定序列的核苷酸的数目。
[1339]
因此,本发明提供了如上所述的另外的变体方法,其中在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n 1 x限定的位置处,其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n x与n x-1之间被裂解,其中x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目并且其中x是从2到10或更大的整数。
[1340]
如从以上描述中将显而易见的,在两种另外的变体中的第一种中,其中本发明合成方法版本10是说明性实施例,通用核苷酸相对于第一裂解步骤中的裂解位点的定位在不同的方法中可以改变,并且组合地,通用核苷酸相对于第二裂解步骤中的裂解位点的定位可以保持固定。相反地,在两种另外的变体中的第二种中,通用核苷酸相对于第二裂解步骤中的裂解位点的定位在不同的方法中可以改变,并且组合地,通用核苷酸相对于第一裂解步骤中的裂解位点的定位可以保持固定。设想了其它另外的变体方法,其中通用核苷酸相对于第一和第二裂解步骤中的裂解位点的定位可以在不同的方法中以任何组合改变。因此,本发明提供了如上所述的另外的变体方法,其中在步骤(2)中,通用核苷酸位于第一多核苷酸连接分子的合成链中由式n 1 x限定的位置处,其中在步骤(3)中,支架多核苷酸的连接的第一链在位置n x与n x-1之间被裂解,其中x是从2到10或更大的整数;并且在步骤(4)中,通用核苷酸位于第二多核苷酸连接分子的合成链中由式n 1 x限定的位置处,其中在步骤(5)中,支架多核苷酸的连接的第二链在位置n x与n x-1之间被裂解,其中x是从2到10或更大的整数;并且其中在步骤(2)和(4)中,x是在远离互补连接末端的方向上相对于位置n的核苷酸位置的数目。
[1341]
在任何这些方法中,在步骤(2)和(3)中为x选择的数目以及在步骤(4)和(5)中为x选择的数目经过选择使得在步骤(2)和(3)中掺入支架多核苷酸的第一链的核苷酸的数目与在步骤(4)和(5)中掺入支架多核苷酸的第二链的核苷酸的数目相同。
[1342]
在任何这些方法中,在步骤(2)和(3)中为x选择的数目可具有与在步骤(4)和(5)中为x选择的数目相同的值。
[1343]
实施例
[1344]
以下实施例对用于合成根据本发明的多核苷酸或寡核苷酸的方法以及用于所述方法的示例性构建体提供支持。实施例不限制本发明。
[1345]
以下实施例描述了根据反应方案的合成方法,所述反应方案与根据本发明的合成方法有关但不在其范围内。
[1346]
以下实施例展示了执行合成反应的能力,所述合成反应包括以下步骤:将预定序列的核苷酸添加到支架多核苷酸的合成链中,在由通用核苷酸限定的裂解位点处裂解支架多核苷酸以及连接多核苷酸连接分子,其包含预定序列的添加核苷酸的配偶体核苷酸,以及用于产生裂解位点以用于下一合成循环的新通用核苷酸。本发明的方法以修改的方式结合了这些步骤中的若干步骤。因此,以下实施例提供了对本文定义的本发明方法的说明性支持。
[1347]
在以下实施例中,以及在对应的图17至63中,对合成方法“版本1、2和3”或“版本1、2或3化学”等的引用根据图11至15中分别阐述的反应示意图并非根据图1至10中任何一个所阐述的反应示意图或本文对其的描述来解释。
[1348]
关于这些附图和相应的方法,对被称为支架多核苷酸分子、支持链、合成链、引物链部分、辅助链部分和多核苷酸连接分子的结构,以及与掺入支架多核苷酸分子中有关的方法或包含可逆终止子基团的核苷酸的完整解释提供于国际专利申请公布wo2018/134616中。
[1349]
因此,涉及与以下实施例相关的相关反应条件的细节可以在wo2018/134616的第46页找到。涉及与以下实施例相关的支架多核苷酸的细节可以在wo2018/134616的第47页找到。涉及与以下实施例相关的示例性方法的细节可以在wo2018/134616中从第88页开始的章节中找到。涉及与以下实施例相关的合成链的细节可以在wo2018/134616的第118页找到。涉及与以下实施例相关的辅助链的细节可以在wo2018/134616的第118页找到。涉及与以下实施例相关的引物链的细节可以在wo2018/134616的第121页找到。涉及与以下实施例相关的支持链的细节可以在wo2018/134616的第122页找到。
[1350]
实施例1.不存在辅助链的合成。
[1351]
本实施例描述了使用4个步骤合成多核苷酸:
[1352]
在部分双链dna上掺入3
’‑
o-修饰的dntp,裂解,连接和脱保护,第一步是在通用核苷酸(在这种情况下是肌苷)的对面进行。
[1353]
步骤1:掺入
[1354]
第一步描述了通过利用dna聚合酶的酶促掺入将3
’‑
o-保护的单核苷酸受控地添加到寡核苷酸中(图17a)。
[1355]
材料和方法
[1356]
材料
[1357]
1. 3
’‑
o-修饰的dntp根据博士论文中描述的方案内部合成:jian wu:molecular engineering of novel nucleotide analogues for dna sequencing by synthesis,columbia university,2008。用于合成的方案还描述于专利申请公开:j.william efcavitch,juliesta e.sylvester,modified template-independent enzymes for polydeoxynucleotide synthesis,molecular assemblies us2016/0108382a1。
[1358]
2.寡核苷酸是内部设计的并从sigma-aldrich获得(图17h)。以100μm的浓度制备储备溶液。
[1359]
3.使用therminator ix dna聚合酶,其由new england biolabs工程化,具有增强的掺入3-o-修饰的dntp的能力。然而,可以使用任何可以掺入修饰的dntp的dna聚合酶。
[1360]
测试了两种类型的可逆终止剂:
[1361][1362][1363]
方法
[1364]
1.将2μl的10x缓冲液(20mm tris-hcl、10mm(nh4)2so4、10mm kcl、2mm mgso4、0.1%x-100,ph 8.8,新英格兰生物实验室(new england biolab))与12.25μl无菌去离子水(elga veolia)在1.5ml eppendorf管中混合。
[1365]
2.将0.5μl的10μm引物(合成链)(5pmol,1当量)(seq id no:1,图17h)和0.75μl的10μm模板(支持链)(6pmol,1.5当量)(seq id no:2,图17h)添加到反应混合物中。
[1366]
3.添加3
’‑
o-修饰的-dttp(2μl的100μm)和mncl2(1μl的40mm)。
[1367]
4.然后添加1.5μl的therminator ix dna聚合酶(15u,新英格兰生物实验室)。然而,可以使用任何可以掺入修饰的dntp的dna聚合酶。
[1368]
5.将反应物在65℃孵育20分钟。
[1369]
6.将反应物通过添加tbe-尿素样品缓冲液(novex)停止。
[1370]
7.将反应物在聚丙烯酰胺凝胶(15%)上用tbe缓冲液分离,并通过chemidoc mp成像系统(biorad)进行可视化。
[1371]
凝胶电泳和dna可视化:
[1372]
1.在无菌1.5ml eppendorf管中将5μl反应混合物添加到5μl的tbe-尿素样品缓冲液(novex)中,并使用加热thermomixer(eppendorf)加热至95℃,持续5分钟。
[1373]
2.然后将5μl样品加载到15%tbe-尿素凝胶1.0mm x 10孔(invitrogen)的孔中,所述凝胶含有预热的1x tbe缓冲液thermo scientific(89mm tris、89mm硼酸和2mm edta)。
[1374]
3.将x-cell sure lock模块(novex)固定到位并在以下条件下进行电泳;260v,90amp,室温下40分钟。
[1375]
4.将凝胶通过使用cy3 leds的chemidoc mp(biorad)可视化。可视化和分析在
image lab 2.0平台上进行。
[1376]
结果
[1377]
来自new england biolabs的定制工程化的therminator ix dna聚合酶是一种高效的dna聚合酶,能够掺入与通用核苷酸(例如肌苷)相对的3
’‑
o-修饰的dntp(图17b-c)。
[1378]
与肌苷相对的有效掺入发生在65℃的温度下(图17d-e)。
[1379]
与肌苷相对的3
’‑
o-修饰的dttp的掺入需要存在mn
2
离子(图17f-g)。成功转化在图17c、e、g和h中以粗体标记。
[1380]
结论
[1381]
3-o-改性dttp与肌苷相对地掺入可用new england biolabs的定制工程化therminator ix dna聚合酶在mn
2
离子存在下和在65℃的温度下以特别高的效率实现。
[1382]
步骤2:裂解
[1383]
第二步描述了使用haag/endo viii或haag/化学碱两步裂解多核苷酸(图18a)。
[1384]
材料和方法
[1385]
材料
[1386]
1.实施例1中使用的寡核苷酸是内部设计的并由sigma aldrich合成(序列参见图18(e)的表)。
[1387]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释到100μm的储备浓度。
[1388]
方法
[1389]
使用以下程序对寡核苷酸进行裂解反应:
[1390]
1.用移液管(gilson)将41μl无菌蒸馏水(elga veolia)转移到1.5ml eppendorf管中。
[1391]
2.然后将5μl的10x 反应缓冲液neb(20mm tris-hcl、10mm(nh4)2so4、10mm kcl、2mm mgso4、0.1%x-100,ph 8.8)添加到同一eppendorf管中。
[1392]
3.将1μl每种寡核苷酸(图18e)、模板(seq id no:3)或任何荧光标记的长oligo链、具有t的引物(seq id no:4)和对照(seq id no:5)添加到同一试管中,均为5pmol。
[1393]
4.将1μl人类烷基腺嘌呤dna糖基化酶(haag)neb(10单位/μl)添加到同一试管中。
[1394]
5.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在37℃孵育1小时。
[1395]
6.通常在孵育时间过去之后,将反应物通过酶促热失活(即65℃下20分钟)终止。
[1396]
在环境条件下纯化。使用下面概述的方案纯化样品混合物:
[1397]
1.将500μl缓冲液pni qiagen(5m氯化胍)添加到样品中并通过用移液管重悬浮温和混合。
[1398]
2.将混合物转移到qiaquick旋转柱(qiagen)并以6000rpm离心1分钟。
[1399]
3.离心后,弃去流过液,向旋转柱中添加750μl缓冲液pe qiagen(10mm tris-hcl ph 7.5和80%乙醇),并以6000rpm离心1分钟。
[1400]
4.将流过液丢弃并将旋转柱以13000rpm离心另外的1分钟以去除残余的pe缓冲液。
[1401]
5.然后将旋转柱置于无菌的1.5ml eppendorf管中。
[1402]
6.对于dna洗脱,将50μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)添加到柱膜中
心并在室温下静置1分钟。
[1403]
7.然后将管以13000rpm离心1分钟。测量洗脱的dna浓度并储存在-20℃下以备后用。
[1404]
使用以下方案测定纯化的dna浓度:
[1405]
1.将2μl灭菌蒸馏水(elga veolia)添加到基座平衡nanodrop one(thermo scientific)。
[1406]
2.平衡后,用不起毛的镜片清洁纸(whatman)轻轻擦去水。
[1407]
3.通过添加2μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)掩蔽(blank)nanodrop one。然后在掩蔽后重复步骤2。
[1408]
4.通过将2μl样品加到基座上并在触摸屏上选择测量图标来测量dna浓度。
[1409]
使用以下程序进行产生的无碱基位点的裂解:
[1410]
1.将2μl(10-100ng/μl)dna添加到无菌的1.5ml eppendorf管中。
[1411]
2.在同一试管中添加40μl(0.2m)naoh或1.5μl endo viii neb(10单位/μl)和5μl的10x反应缓冲液neb(10mm tris-hcl、75mm nacl、1mm edta,ph 8@25℃)并通过再悬浮温和混合和在13000rpm离心5秒。
[1412]
3.将得到的混合物在室温下孵育5分钟以使naoh处理样品,同时将endo viii反应混合物在37℃下孵育1小时。
[1413]
4.孵育时间过去之后,将反应混合物用如上面概述的纯化方案的步骤1-7纯化。
[1414]
凝胶电泳和dna可视化:
[1415]
1.将5μl的dna和tbe-尿素样品缓冲液(novex)添加到无菌1.5ml eppendorf管中,并使用加热热块(eppendorf)加热至95℃,持续2分钟。
[1416]
2.然后dna混合物加载到15%tbe-尿素凝胶1.0mm x 10孔(invitrogen)的孔中,所述凝胶含有预热的1x tbe缓冲液thermo scientific(89mm tris、89mm硼酸和2mm edta)。
[1417]
3.将x-cell sure lock模块(novex)固定到位并在以下条件下进行电泳;260v,90amp,室温下40分钟。
[1418]
4.采用使用cy3 leds的chemidoc mp(biorad)进行检测和dna在凝胶中的可视化。可视化和分析在image lab 2.0平台上进行。
[1419]
结果和结论
[1420]
没有辅助链的裂解反应显示裂解的dna与未裂解的dna的低百分比产率为约7%:93%(图18b-d)。
[1421]
裂解结果显示,在该具体实施例中,并且基于所用的特定试剂,与正对照相比,在不存在辅助链的情况下获得了低产率的裂解dna。此外,与endoviii裂解相比,使用化学碱来裂解无碱基位点的时间消耗较少。
[1422]
步骤3:连接
[1423]
第三步描述了在不存在辅助链的情况下用dna连接酶连接多核苷酸。图解说明在图19中示出。
[1424]
材料和方法
[1425]
材料
[1426]
1.实施例1中使用的寡核苷酸是内部设计的并由sigma aldrich合成(序列参见图19c的表)。
[1427]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释至100μm的储备浓度。
[1428]
方法
[1429]
使用以下程序进行寡核苷酸的连接反应:
[1430]
1.用移液管(gilson)将16μl无菌蒸馏水(elga veolia)转移到1.5ml eppendorf管中。
[1431]
2.然后将10μl的2x快速连接反应缓冲液neb(132mm tris-hcl、20mm mgcl2、2mm二硫苏糖醇、2mm atp、15%聚乙二醇(peg6000)和ph 7.6,在25℃)添加到相同的eppendorf管中。
[1432]
3.将1μl每种寡核苷酸(图19c)、tamra或任何荧光标记的磷酸链(seq id no:7)、具有t的引物(seq id no:8)和肌苷链(seq id no:9)添加到同一试管中,均为5pmol。
[1433]
4.将1μl的quick t4 dna连接酶neb(400单位/μl)添加到同一试管中。
[1434]
5.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在室温孵育20分钟。
[1435]
6.通常在孵育时间过去后,添加tbe-尿素样品缓冲液(novex)终止反应。
[1436]
7.使用如上所述的纯化步骤1-7中概述的方案纯化反应混合物。
[1437]
使用以下方案测定纯化的dna浓度:
[1438]
1.将2μl灭菌蒸馏水(elga veolia)添加到基座平衡nanodrop one(thermo scientific)。
[1439]
2.平衡后,用不起毛的镜片清洁纸(whatman)轻轻擦去水。
[1440]
3.通过添加2μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)掩蔽(blank)nanodrop one,然后在掩蔽后重复步骤2。
[1441]
4.通过将2μl样品加到基座上并在触摸屏上选择测量图标来测量dna浓度。
[1442]
5.将纯化的dna在聚丙烯酰胺凝胶上运行,并按照上述步骤5-8中的程序可视化。没有引入条件或试剂的变化。
[1443]
结果和结论
[1444]
在该特定实施例中,并且基于所用的特定试剂,在没有辅助链的情况下,在室温(24℃)下用dna连接酶(在此特定情况下为快速t4 dna连接酶)连接寡核苷酸产生减少量的连接产物(图19b)。
[1445]
实施例2.利用辅助链的版本1化学。
[1446]
本实施例描述了使用4个步骤合成多核苷酸:从缺口位点裂解3
’‑
o-修饰的dntp,连接和脱保护,其中第一步与通用核苷酸相对地进行,在该特定情况下通用核苷酸为肌苷。该方法使用辅助链,其提高了连接和裂解步骤的效率。
[1447]
步骤1:掺入
[1448]
第一步描述了通过使用dna聚合酶的酶促掺入将3
’‑
o-保护的单核苷酸受控地添加到寡核苷酸中(图20a)。
[1449]
材料和方法
[1450]
材料
[1451]
1.根据描述于以下的方案内部合成3'-o-修饰的dntp:博士毕业论文jian wu:molecular engineering of novel nucleotide analogues for dna sequencing by synthesis。columbia university,2008.用于合成的方案还描述于专利申请公开:j.william efcavitch,juliesta e.sylvester,modified template-independent enzymes for polydeoxynucleotide synthesis,molecular assemblies us2016/0108382a1。
[1452]
2.寡核苷酸是内部设计的并从sigma-aldrich获得。以100μm的浓度制备储备溶液。寡核苷酸在图20b中示出。
[1453]
3.使用therminator ix dna聚合酶,其由new england biolabs工程化,具有增强的掺入3-o-修饰的dntp的能力。
[1454]
测试了两种类型的可逆终止剂:
[1455][1456]
方法
[1457]
1. 2μl 10x缓冲液(20mm的tris-hcl、10mm的(nh4)2so4、10mm kcl、2mm mgso4、0.1%x-100,ph 8.8,新英格兰实验室)与10.25μl无菌去离子水(elga veolia)在1.5ml eppendorf管中混合。
[1458]
2.将0.5μl的10μm引物(5pmol,1当量)(seq id no:10,图20(b)中的表)、0.75μl的10μm模板(6pmol,1.5当量)(seq id no:11,图20(b)中的表)、2μl的10μm辅助链(seq id no:12,图20(b)中的表)添加到反应混合物中。
[1459]
3.添加3
’‑
o-修饰的-dttp(2μl的100μm)和mncl2(1μl的40mm)。
[1460]
4.然后添加1.5μl的therminator ix dna聚合酶(15u,新英格兰生物实验室)。
[1461]
5.将反应物在65℃孵育20分钟。
[1462]
6.将反应物通过添加tbe-尿素样品缓冲液(novex)停止。
[1463]
7.将反应物在聚丙烯酰胺凝胶(15%)上用tbe缓冲液分离,并通过chemidoc mp成像系统(biorad)进行可视化。
[1464]
凝胶电泳和dna可视化:
[1465]
1.在无菌1.5ml eppendorf管中将5μl反应混合物添加到5μl的tbe-尿素样品缓冲液(novex)中,并使用加热thermomixer(eppendorf)加热至95℃,持续5分钟。
[1466]
2.然后将5μl样品加载到15%tbe-尿素凝胶1.0mm x 10孔(invitrogen)的孔中,所述凝胶含有预热的1x tbe缓冲液thermo scientific(89mm tris、89mm硼酸和2mm edta)。
[1467]
3.将x-cell sure lock模块(novex)固定到位并在以下条件下进行电泳;260v,90amp,室温下40分钟。
[1468]
4.将凝胶通过使用cy3 leds的chemidoc mp(biorad)可视化。可视化和分析在
image lab 2.0平台上进行。
[1469]
可以根据上述方案研究掺入步骤。
[1470]
步骤2:裂解
[1471]
第二步描述了使用haag/endo viii或haag/化学碱(x2)两步裂解多核苷酸(图21a)。
[1472]
材料和方法
[1473]
材料
[1474]
1.实施例2中使用的寡核苷酸是内部设计的并由sigma aldrich合成(序列参见图21f)。
[1475]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释到100μm的储备浓度。
[1476]
方法
[1477]
使用以下程序进行寡核苷酸的裂解反应:
[1478]
1.用移液管(gilson)将41μl无菌蒸馏水(elga veolia)转移到1.5ml eppendorf管中。
[1479]
2.然后将5μl的10x 反应缓冲液neb(20mm tris-hcl、10mm(nh4)2so4、10mm kcl、2mm mgso4,0.1%x-100,ph 8.8)添加到同一eppendorf管中。
[1480]
3.将1μl每种寡核苷酸(图21f)、模板(seq id no:13)或任何荧光标记的长oligo链、具有t的引物(seq id no:14)、对照(seq id no:15)和辅助链(seq id no:16)添加到同一试管中,均为5pmol。
[1481]
4.将1μl人类烷基腺嘌呤dna糖基化酶(haag)neb(10单位/μl)添加到同一试管中。
[1482]
5.在使用替代碱的反应中,添加1μl的人类烷基腺嘌呤dna糖基化酶(haag)neb(100单位/μl)。
[1483]
6.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在37℃孵育1小时。
[1484]
7.通常在孵育时间过去之后,将反应物通过酶促热失活(即65℃下20分钟)终止。
[1485]
在环境条件下纯化。使用下面概述的方案纯化样品混合物:
[1486]
1.将500μl缓冲液pni qiagen(5m氯化胍)添加到样品中并通过用移液管重悬浮温和混合。
[1487]
2.将混合物转移到qiaquick旋转柱(qiagen)并以6000rpm离心1分钟。
[1488]
3.离心后,弃去流过液,向旋转柱中添加750μl缓冲液pe qiagen(10mm tris-hcl ph 7.5和80%乙醇),并以6000rpm离心1分钟。
[1489]
4.将流过液丢弃并将旋转柱以13000rpm离心另外的1分钟以去除残余的pe缓冲液。
[1490]
5.然后将旋转柱置于无菌的1.5ml eppendorf管中。
[1491]
6.对于dna洗脱,将50μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)添加到柱膜中心并在室温下静置1分钟。
[1492]
7.然后将管以13000rpm离心1分钟。测量洗脱的dna浓度并储存在-20℃下以备后用。
[1493]
使用以下方案测定纯化的dna浓度:
[1494]
1.将2μl灭菌蒸馏水(elga veolia)添加到基座平衡nanodrop one(thermo scientific)。
[1495]
2.平衡后,用不起毛的镜片清洁纸(whatman)轻轻擦去水。
[1496]
3.通过添加2μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)掩蔽(blank)nanodrop one。然后在掩蔽后重复步骤2。
[1497]
4.通过将2μl样品加到基座上并在触摸屏上选择测量图标来测量dna浓度。
[1498]
使用以下程序进行产生的无碱基位点的裂解:
[1499]
1.将2μl(10-100ng/μl)dna添加到无菌的1.5ml eppendorf管中。
[1500]
2.在同一试管中添加40μl(0.2m)naoh或1.5μl endo viii neb(10单位/μl)和5μl的10x反应缓冲液neb(10mm tris-hcl,75mm nacl,1mm edta,ph 8@25℃)并通过再悬浮温和混合和在13000rpm离心5秒。
[1501]
3.将得到的混合物在室温下孵育5分钟以使0.2m naoh处理样品,同时将endo viii反应混合物在37℃下孵育1小时。
[1502]
4.孵育时间过去之后,将反应混合物用如上面所述的纯化方案的步骤1-7纯化。
[1503]
使用以下程序进行使用替代碱性化学物质的产生的无碱基位点的裂解:
[1504]
1.将1μl(10-100ng/μl)dna添加到无菌的1.5ml eppendorf管中。然后将在室温下用乙酸溶液sigma(99.8%)缓冲至ph 7.4的2μl的n,n'-二甲基乙二胺sigma(100mm)添加到同一试管中。
[1505]
2.将20μl无菌蒸馏水(elga veolia)添加到管中,通过重悬浮轻轻混合和在13000rpm离心5秒。
[1506]
3.将所得混合物在37℃下孵育20分钟。
[1507]
4.孵育时间过去之后,将反应混合物用如上面所述的纯化方案的步骤1-7纯化。
[1508]
凝胶电泳和dna可视化:
[1509]
1.将5μl的dna和tbe-尿素样品缓冲液(novex)添加到无菌1.5ml eppendorf管中,并使用加热热块(eppendorf)加热至95℃,持续2分钟。
[1510]
2.然后dna混合物加载到15%tbe-尿素凝胶1.0mm x 10孔(invitrogen)的孔中,所述凝胶含有预热的1x tbe缓冲液thermo scientific(89mm tris、89mm硼酸和2mm edta)。
[1511]
3.将x-cell sure lock模块(novex)固定到位并在以下条件下进行电泳;260v,90amp,室温下40分钟。
[1512]
4.采用使用cy3 leds的chemidoc mp(biorad)进行检测和dna在凝胶中的可视化。可视化和分析在image lab 2.0平台上进行。
[1513]
结果
[1514]
通过haag dna糖基化酶在包含通用核苷酸(在此特定情况下为肌苷)的裂解位点处的裂解效率从不存在辅助链时的10%显著增加至存在辅助链时的50%(图21b)。haag和核酸内切酶viii以比haag和naoh(50%)更低的效率(10%)裂解肌苷。在使用带缺口的dna的所述系统中,使用0.2m naoh的化学裂解显示对于ap位点的裂解优于核酸内切酶viii(图21c)。在中性ph下的温和n,n
’‑
二甲基乙二胺具有与0.2m naoh一样高的裂解无碱基位点效率,并因此与核酸内切酶viii和naoh相比是优选的(图21d-e)。
[1515]
结论
[1516]
对于裂解含有肌苷的dna,评估了三种方法。在实施例2中对于dna裂解研究了一种完全的酶促方法-haag/核酸内切酶viii,以及两种结合化学和酶促裂解的方法-haag/naoh和haag/二甲基乙胺。
[1517]
haag/naoh结果显示,与不存在辅助链(10%)相比,在辅助链存在下裂解dna的产率(50%)高得多。在这些具体的实施例中,并且基于所用的特定试剂,辅助链增加了dna裂解的产率。
[1518]
在辅助链存在下,与naoh(50%)相比,使用核酸内切酶viii作为naoh的替代物的酶促裂解效率较低(10%)。
[1519]
包含替代性的温和化学碱n,n
’‑
二甲基乙二胺引起ap位点的高裂解效率,其与naoh一样有效,并且与10x haag酶的添加一起具有裂解的dna的显著增加(参见图21e)。
[1520]
步骤3:连接
[1521]
第三步描述了在辅助链存在下用dna连接酶连接多核苷酸。图解说明在图22a中示出。
[1522]
材料和方法
[1523]
材料
[1524]
1.寡核苷酸是内部设计的并由sigma aldrich合成(序列参见图22d)。
[1525]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释到100μm的储备浓度。
[1526]
方法
[1527]
使用以下程序进行寡核苷酸的连接反应:
[1528]
1.用移液管(gilson)将16μl无菌蒸馏水(elga veolia)转移到1.5ml eppendorf管中。
[1529]
2.然后将10μl的2x快速连接反应缓冲液neb(132mm tris-hcl、20mm mgcl2、2mm二硫苏糖醇、2mm atp、15%聚乙二醇(peg6000)和ph 7.6,在25℃)添加到相同的eppendorf管中。
[1530]
3.将1μl每种寡核苷酸(图22d)、tamra或任何荧光标记的磷酸链(seq id no:18)、具有t的引物(seq id no:19)以及肌苷链(seq id no:20)和辅助链(seq id no:21)添加到同一试管中,均为5pmol。
[1531]
4.将1μl的quick t4 dna连接酶neb(400单位/μl)添加到同一试管中。
[1532]
5.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在室温孵育20分钟。
[1533]
6.通常在孵育时间过去后,添加tbe-尿素样品缓冲液(novex)终止反应。
[1534]
7.使用如上所述的纯化步骤1-7中概述的方案纯化反应混合物。
[1535]
使用以下方案测定纯化的dna浓度:
[1536]
1.将2μl灭菌蒸馏水(elga veolia)添加到基座平衡nanodrop one(thermo scientific)。
[1537]
2.平衡后,用不起毛的镜片清洁纸(whatman)轻轻擦去水。
[1538]
3.通过添加2μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)掩蔽(blank)nanodrop one。然后在掩蔽后重复步骤2。
[1539]
4.通过将2μl样品加到基座上并在触摸屏上选择测量图标来测量dna浓度。
[1540]
5.将纯化的dna在聚丙烯酰胺凝胶上运行,并按照上述步骤5-8中的程序可视化。没有引入条件或试剂的变化。
[1541]
结果和结论
[1542]
在此特定实施例中,并且基于所使用的特定试剂,在没有辅助链的情况下观察到降低的连接活性(图22b),而在存在辅助链的情况下连接以高效率进行(图22c)并且以高产率形成产物。
[1543]
实施例3.用辅助链的版本2化学。
[1544]
本实施例描述了使用4个步骤合成多核苷酸:在部分双链dna上掺入3
’‑
o-修饰的dntp;在第一步掺入与天然互补核苷酸相对地进行的情况下裂解、连接和脱保护,该天然互补核苷酸位于支持链中与通用核苷酸相邻,在该特定情况下通用核苷酸为肌苷。
[1545]
步骤1:掺入
[1546]
材料和方法
[1547]
材料
[1548]
第一步描述了通过dna聚合酶的酶掺入将3
’‑
o-保护的单核苷酸受控的添加到寡核苷酸中(图23a)。
[1549]
1.根据描述于以下的方案内部合成3'-o-修饰的dntp:博士毕业论文jian wu:molecular engineering of novel nucleotide analogues for dna sequencing by synthesis。columbia university,2008.用于合成的方案还描述于专利申请公开:j.william efcavitch,juliesta e.sylvester,modified template-independent enzymes for polydeoxynucleotide synthesis,molecular assemblies us2016/0108382a1。
[1550]
2.寡核苷酸是内部设计的并从sigma-aldrich获得(图23j)。以100μm的浓度制备储备溶液。
[1551]
3.使用therminator ix dna聚合酶,其由new england biolabs工程化,具有增强的掺入3-o-修饰的dntp的能力。
[1552]
所有dntp的3'-o-叠氮甲基可逆终止子独立测试其掺入:
[1553][1554]
方法
[1555]
1.将2μl的10x缓冲液(20mm tris-hcl、10mm(nh4)2so4、10mm kcl、2mm mgso4、0.1%x-100,ph 8.8,新英格兰实验室)与12.25μl无菌去离子水(elga veolia)在1.5ml eppendorf管中混合。
[1556]
2.将0.5μl的10μm引物(5pmol,1当量)(seq id no:22,图23j)和0.75μl的10μm模板-a/g/t/c(6pmol,1.5当量)(seq id no:23至26,图23j)以及1μl的10μm辅助链-t/c/a/g(10pmol,2当量)(seq id no:27至30,图23j)添加到反应混合物中。
[1557]
3.添加3
’‑
o-修饰的-dttp/dctp/datp/dgtp(2μl的100μm)和mncl2(1μl的40mm)。
[1558]
4.然后添加1.5μl的therminator ix dna聚合酶(15u,新英格兰实验室)。
[1559]
5.将反应物在65℃孵育20分钟。
[1560]
6.将反应物通过添加tbe-尿素样品缓冲液(novex)停止。
[1561]
7.将反应物在聚丙烯酰胺凝胶(15%)上用tbe缓冲液分离,并通过chemidoc mp成像系统(biorad)进行可视化。
[1562]
凝胶电泳和dna可视化:
[1563]
1.在无菌1.5ml eppendorf管中将5μl反应混合物添加到5μl的tbe-尿素样品缓冲液(novex)中,并使用加热thermomixer(eppendorf)加热至95℃,持续5分钟。
[1564]
2.然后将5μl样品加载到15%tbe-尿素凝胶1.0mm x 10孔(invitrogen)的孔中,所述凝胶含有预热的1x tbe缓冲液thermo scientific(89mm tris、89mm硼酸和2mm edta)。
[1565]
3.将x-cell sure lock模块(novex)固定到位并在以下条件下进行电泳;260v,90amp,室温下40分钟。
[1566]
4.将凝胶通过使用cy3 leds的chemidoc mp(biorad)可视化。可视化和分析在image lab 2.0平台上进行。
[1567]
结果和结论
[1568]
关于使用therminator ix dna聚合酶评估3-o-叠氮基甲基-dttp掺入的温度,结果表明在有辅助链连接的情况下3'-o-叠氮基甲基-dttp掺入达到90%5分钟后。在37℃和
47℃下20分钟后,10%的引物保持未延伸。
[1569]
therminator ix dna聚合酶在2mm的mn
2
离子和37℃的温度下提供了在辅助链的存在下与dna中互补碱基相对地高效率(从前一个循环开始的连接步骤)掺入3
’‑
o-修饰的dntp的良好条件。
[1570]
步骤2:裂解
[1571]
第二步描述了使用核酸内切酶v一步裂解多核苷酸(图24a)。
[1572]
材料和方法
[1573]
材料
[1574]
1.实施例3中使用的寡核苷酸是内部设计的并由sigma aldrich合成(序列参见图24d中的表)。
[1575]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释至100μm的储备浓度。
[1576]
方法
[1577]
使用以下程序进行寡核苷酸的裂解反应:
[1578]
1.用移液管(gilson)将41μl无菌蒸馏水(elga veolia)转移到1.5ml eppendorf管中。
[1579]
2.然后将5μ1的10x reactionneb(50mm的醋酸钾、20mm的tris-乙酸盐、10mm的醋酸镁、1mm的dtt,ph值7.9在25℃下)添加到相同的eppendorf管中。
[1580]
3.将1μl每种寡核苷酸(图24d)、模板(seq id no:31)或任何荧光标记的长oligo链、具有t的引物(seq id no:32)和对照(seq id no:33)以及辅助链(seq id no:34)添加到同一试管中,均为5pmol。
[1581]
4.将1μl人类核酸内切酶v(endo v)neb(10单位/μl)添加到同一试管中。
[1582]
5.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在37℃孵育1小时。
[1583]
6.通常在孵育时间过去之后,将反应物通过酶促热失活(即65℃下20分钟)终止。
[1584]
使用下面概述的方案纯化样品混合物:
[1585]
1.将500μl缓冲液pni qiagen(5m氯化胍)添加到样品中并通过用移液管重悬浮温和混合。
[1586]
2.将混合物转移到qiaquick旋转柱(qiagen)并以6000rpm离心1分钟。
[1587]
3.离心后,弃去流过液,向旋转柱中添加750μl缓冲液pe qiagen(10mm tris-hcl ph 7.5和80%乙醇),并以6000rpm离心1分钟。
[1588]
4.将流过液丢弃并将旋转柱以13000rpm再离心1分钟以去除残余的pe缓冲液。
[1589]
5.然后将旋转柱置于无菌的1.5ml eppendorf管中。
[1590]
6.对于dna洗脱,将50μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)添加到柱膜中心并在室温下静置1分钟。
[1591]
7.然后将管以13000rpm离心1分钟。测量洗脱的dna浓度并储存在-20℃下以备后用。
[1592]
使用以下方案测定纯化的dna浓度:
[1593]
1.将2μl灭菌蒸馏水(elga veolia)添加到基座平衡nanodrop one(thermo scientific)。
[1594]
2.平衡后,用不起毛的镜片清洁纸(whatman)轻轻擦去水。
[1595]
3.通过添加2μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)掩蔽(blank)nanodrop one。然后在掩蔽后重复步骤2。
[1596]
4.通过将2μl样品加到基座上并在触摸屏上选择测量图标来测量dna浓度。
[1597]
凝胶电泳和dna可视化:
[1598]
1.将5μl的dna和tbe-尿素样品缓冲液(novex)添加到无菌1.5ml eppendorf管中,并使用加热热块(eppendorf)加热至95℃,持续2分钟。
[1599]
2.然后dna混合物加载到15%tbe-尿素凝胶1.0mm x 10孔(invitrogen)的孔中,所述凝胶含有预热的1x tbe缓冲液thermo scientific(89mm tris、89mm硼酸和2mm edta)。
[1600]
3.将x-cell sure lock模块(novex)固定到位并在以下条件下进行电泳;260v,90amp,室温下40分钟。
[1601]
4.采用使用cy3 leds的chemidoc mp(biorad)进行检测和dna在凝胶中的可视化。可视化和分析在image lab 2.0平台上进行。
[1602]
结果和结论
[1603]
来自实施例3的裂解结果显示,在存在或不存在辅助链的情况下,利用核酸内切酶v可以获得显著高的裂解dna产率(图24c)。
[1604]
步骤3:连接
[1605]
第三步描述了在辅助链存在下用dna连接酶连接多核苷酸。图解说明在图25a中示出。
[1606]
材料和方法
[1607]
材料
[1608]
1.实施例3中使用的寡核苷酸是内部设计的并由sigma aldrich合成(序列参见图25b中的表)。
[1609]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释到100μm的储备浓度。
[1610]
方法
[1611]
使用以下程序进行寡核苷酸的连接反应:
[1612]
1.用移液管(gilson)将16μl无菌蒸馏水(elga veolia)转移到1.5ml eppendorf管中。
[1613]
2.然后将10μl的2x快速连接反应缓冲液neb(132mm tris-hcl、20mm mgcl2、2mm二硫苏糖醇、2mm atp,15%聚乙二醇(peg6000)和ph 7.6,在25℃)添加到相同的eppendorf管中。
[1614]
3.将1μl每种寡核苷酸(图25b)、tamra或任何荧光标记的磷酸链(seq id no:35)、具有t的引物(seq id no:36)以及肌苷链(seq id no:37)和辅助链(seq id no:38)添加到同一试管中,它们均具有5pmol的量。
[1615]
4.将1μl的quick t4 dna连接酶neb(400单位/μl)添加到同一试管中。
[1616]
5.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在室温孵育20分钟。
[1617]
6.通常在孵育时间过去后,添加tbe-尿素样品缓冲液(novex)终止反应。
[1618]
7.使用如上所述的纯化步骤1-7中概述的方案纯化反应混合物。
[1619]
使用以下方案测定纯化的dna浓度:
[1620]
1.将2μl灭菌蒸馏水(elga veolia)添加到基座平衡nanodrop one(thermo scientific)。
[1621]
2.平衡后,用不起毛的镜片清洁纸(whatman)轻轻擦去水。
[1622]
3.通过添加2μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)掩蔽(blank)nanodrop one。然后在掩蔽后重复步骤2。
[1623]
4.通过将2μl样品加到基座上并在触摸屏上选择测量图标来测量dna浓度。
[1624]
5.将纯化的dna在聚丙烯酰胺凝胶上运行,并按照上述步骤5-8中的程序可视化。没有引入条件或试剂的变化。
[1625]
凝胶电泳和dna可视化:
[1626]
1.将5μl的dna和tbe-尿素样品缓冲液(novex)添加到无菌1.5ml eppendorf管中,并使用加热热块(eppendorf)加热到95℃,持续2分钟。
[1627]
2.然后dna混合物加载到15%tbe-尿素凝胶1.0mm x 10孔(invitrogen)的孔中,所述凝胶含有预热的1x tbe缓冲液thermo scientific(89mm tris、89mm硼酸和2mm edta)。
[1628]
3.将x-cell sure lock模块(novex)固定到位并在以下条件下进行电泳;260v,90amp,室温下40分钟。
[1629]
4.采用使用cy3 leds的chemidoc mp(biorad)进行检测和dna在凝胶中的可视化。可视化和分析在image lab 2.0平台上进行。
[1630]
步骤4:脱保护
[1631]
在dna模型上研究了脱保护步骤(图26a),所述模型带有由通过therminator ix dna聚合酶掺入3'-o-叠氮甲基-dntp引入到dna中的3
′‑
o-叠氮甲基。通过三(羧乙基)膦(tcep)进行脱保护,并且当将所有天然dntp的混合物添加到纯化的脱保护dna的溶液中时通过延伸反应进行监测。
[1632]
材料和方法
[1633]
材料
[1634]
1.实施例3中使用的寡核苷酸是内部设计的并由sigma aldrich合成(序列参见图26i)。
[1635]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释到100μm的储备浓度。
[1636]
3.酶购自新英格兰实验室。
[1637]
方法
[1638]
1.将2μl的10x缓冲液(20mm tris-hcl、10mm(nh4)2so4、10mm kcl、2mm mgso4、0.1%x-100,ph 8.8,新英格兰实验室)与12.25μl无菌去离子水(elga veolia)在1.5ml eppendorf管中混合。
[1639]
2.将1μl的10μm引物(10pmol,1当量)(seq id no:39,图26i)和1.5μl的10μm模板-a/g/t/c(15pmol,1.5当量)(seq id no:40至43,图26i)添加到反应混合物中。
[1640]
3.添加3
’‑
o-修饰的-dttp/dctp/datp/dgtp(2μl的100μm)和mncl2(1μl的40mm)。
[1641]
4.然后添加1.5μl的therminator ix dna聚合酶(15u,新英格兰实验室)。
[1642]
5.将反应物在37℃孵育5分钟。
[1643]
6.取出4μl样品并与0.5μl的5mm dntp混合物混掺入使其反应10分钟以进行对照反应。
[1644]
7.将在1m tris缓冲液ph 7.4中的40μl的500mm tcep添加到反应混合物中,并使其在37℃反应10分钟。
[1645]
8.通过用20μl的1x缓冲液洗脱,使用qiagen核苷酸去除试剂盒纯化反应混合物。
[1646]
9.将1μl的5mm dntp混合物和1μl的deepvent(exo-)dna聚合酶添加到纯化的反应混合物中并使其反应10分钟。
[1647]
10.将反应物通过添加tbe-尿素样品缓冲液(novex)停止。
[1648]
11.将反应物在聚丙烯酰胺凝胶(15%)上用tbe缓冲液分离,并通过chemidoc mp成像系统(biorad)进行可视化。
[1649]
结果和结论
[1650]
50mm tcep不足以在0.2μm dna模型上高效裂解3
’‑
o-叠氮甲基(图26h)。相比之下,300mm tcep成功地在0.2μm dna模型上以95%的效率裂解3
’‑
o-叠氮甲基(图26h)。
[1651]
实施例4.有双发夹模型的版本2化学。
[1652]
本实施例描述了使用4个步骤在双发夹模型上合成多核苷酸:从缺口位点掺入3
’‑
o-修饰的dntp;在第一步在与天然互补核苷酸相对地发生的情况下裂解、连接和脱保护,该天然互补核苷酸位于支持链中与通用核苷酸相邻,在该特定情况下通用核苷酸为肌苷。
[1653]
步骤1:掺入
[1654]
第一步描述了通过利用dna聚合酶的酶促掺入将3
’‑
o-保护的单核苷酸受控地添加到寡核苷酸中(图27a)。
[1655]
材料和方法
[1656]
材料
[1657]
1.根据描述于以下的方案内部合成3'-o-修饰的dntp:博士毕业论文jian wu:molecular engineering of novel nucleotide analogues for dna sequencing by synthesis。columbia university,2008.用于合成的方案还描述于专利申请公开:j.william efcavitch,juliesta e.sylvester,modified template-independent enzymes for polydeoxynucleotide synthesis,molecular assemblies us2016/0108382a1。
[1658]
2.寡核苷酸是内部设计的并从sigma-aldrich获得(图27c)。以100μm的浓度制备储备溶液。
[1659]
3.使用therminator ix dna聚合酶,其由new england biolabs工程化,具有增强的掺入3-o-修饰的dntp的能力。
[1660]
测试3'-o-叠氮甲基-dttp的掺入:
[1661]
3'-o-叠氮甲基-dttp:
[1662][1663]
方法
[1664]
1.2μl 10x缓冲液(20mm的tris-hcl、10mm的(nh4)2so4、10mm kcl、2mm mgso4、0.1%x-100,ph 8.8,新英格兰实验室)与10.25μl无菌去离子水(elga veolia)在1.5ml eppendorf管中混合。
[1665]
2.将0.5μl的10μm发夹寡核苷酸(5pmol,1当量)(seq id no:44,图27c)添加到反应混合物中。
[1666]
3.添加3
’‑
o-修饰的-dttp(2μl的100μm)和mncl2(1μl的40mm)。
[1667]
4.然后添加1.5μl的therminator ix dna聚合酶(15u,新英格兰生物实验室)。
[1668]
5.将反应物在65℃孵育20分钟。
[1669]
6.将反应物通过添加tbe-尿素样品缓冲液(novex)停止。
[1670]
7.将反应物在聚丙烯酰胺凝胶(15%)上用tbe缓冲液分离,并通过chemidoc mp成像系统(biorad)进行可视化。
[1671]
凝胶电泳和dna可视化:
[1672]
1.在无菌1.5ml eppendorf管中将5μl反应混合物添加到5μl的tbe-尿素样品缓冲液(novex)中,并使用加热thermomixer(eppendorf)加热至95℃,持续5分钟。
[1673]
2.然后将5μl样品加载到15%tbe-尿素凝胶1.0mm x 10孔(invitrogen)的孔中,所述凝胶含有预热的1x tbe缓冲液thermo scientific(89mm tris、89mm硼酸和2mm edta)。
[1674]
3.将x-cell sure lock模块(novex)固定到位并在以下条件下进行电泳;260v,90amp,室温下40分钟。
[1675]
4.将凝胶通过使用cy3 leds的chemidoc mp(biorad)可视化。可视化和分析在image lab 2.0平台上进行。
[1676]
结果
[1677]
dna聚合酶在发夹构建体中掺入与其天然互补碱基相对的3
’‑
o-修饰的dttp。
[1678]
步骤2:裂解
[1679]
第二步描述了在此特定情况下使用核酸内切酶v一步裂解发夹模型(图28a)。
[1680]
材料和方法
[1681]
材料
[1682]
1.实施例4中使用的寡核苷酸是内部设计的并由sigma aldrich合成(序列参见图28c)。
[1683]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释到100μm的储备浓度。
[1684]
方法
[1685]
发夹寡核苷酸的裂解反应使用以下步骤进行:
[1686]
1.用移液管(gilson)将43μl无菌蒸馏水(elga veolia)转移到1.5ml eppendorf管中。
[1687]
2.然后将5μl的10x reactionneb(50mm的醋酸钾,20mm的tris-乙酸盐,10mm的醋酸镁,1mm的dtt,ph值7.9在25℃下)添加到相同的eppendorf管中。
[1688]
3.将具有5pmol量的1μl发夹寡核苷酸(seq id no:45,图28c)添加到同一试管中。
[1689]
4.将1μl人类核酸内切酶v(endo v)neb(30单位/μl)添加到同一试管中。
[1690]
5.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在37℃孵育1小时。
[1691]
6.通常在孵育时间过去之后,将反应物通过酶促热失活(即65℃下20分钟)终止。
[1692]
使用下面概述的方案纯化样品混合物:
[1693]
1.将500μl缓冲液pni qiagen(5m氯化胍)添加到样品中并通过用移液管重悬浮温和混合。
[1694]
2.将混合物转移到qiaquick旋转柱(qiagen)并以6000rpm离心1分钟。
[1695]
3.离心后,弃去流过液,向旋转柱中添加750μl缓冲液pe qiagen(10mm tris-hcl ph 7.5和80%乙醇),并以6000rpm离心1分钟。
[1696]
4.将流过液丢弃并将旋转柱以13000rpm离心另外的1分钟以去除残余的pe缓冲液。
[1697]
5.然后将旋转柱置于无菌的1.5ml eppendorf管中。
[1698]
6.对于dna洗脱,将50μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)添加到柱膜中心并在室温下静置1分钟。
[1699]
7.然后将管以13000rpm离心1分钟。测量洗脱的dna浓度并储存在-20℃下以备后用。
[1700]
使用以下方案测定纯化的dna浓度:
[1701]
1.将2μl灭菌蒸馏水(elga veolia)添加到基座平衡nanodrop one(thermo scientific)。
[1702]
2.平衡后,用不起毛的镜片清洁纸(whatman)轻轻擦去水。
[1703]
3.通过添加2μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)掩蔽(blank)nanodrop one。然后在掩蔽后重复步骤2。
[1704]
4.通过将2μl样品加到基座上并在触摸屏上选择测量图标来测量dna浓度。
[1705]
凝胶电泳和dna可视化:
[1706]
1.将5μl的dna和tbe-尿素样品缓冲液(novex)添加到无菌1.5ml eppendorf管中,并使用加热thermomixer(eppendorf)加热至95℃,持续2分钟。
[1707]
2.然后dna混合物加载到15%tbe-尿素凝胶1.0mm x 10孔(invitrogen)的孔中,所述凝胶含有预热的1x tbe缓冲液thermo scientific(89mm tris、89mm硼酸和2mm edta)。
[1708]
3.将x-cell sure lock模块(novex)固定到位并在以下条件下进行电泳;260v,90amp,室温下40分钟。
[1709]
4.采用使用cy3 leds的chemidoc mp(biorad)进行检测和dna在凝胶中的可视化。可视化和分析在image lab 2.0平台上进行。
[1710]
结果和结论
[1711]
来自实施例4的裂解结果显示,使用核酸内切酶v在37℃下获得了显著高的消化的发夹dna产率(图28b)。
[1712]
步骤3:连接
[1713]
第三步描述了用dna连接酶连接发夹模型。图解说明在图29a中示出。
[1714]
材料和方法
[1715]
材料
[1716]
1.实施例4中使用的寡核苷酸是内部设计的并由sigma aldrich合成(序列参见图29c)。
[1717]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释到100μm的储备浓度。
[1718]
方法
[1719]
使用以下程序进行寡核苷酸的连接反应:
[1720]
1.使用移液管(gilson)将1μl(5pmol)tamra或任何荧光标记磷酸发夹寡核苷酸(seq id no:46)转移入1.5ml eppendorf管中。
[1721]
2.然后将15μl(100pmol)含肌苷的发夹构建体(seq id no:47)添加到相同的管中,并通过用移液管重悬浮轻轻混合3秒。
[1722]
3.将40μl的blunt/ta dna连接酶neb(180单位/μl)添加到同一试管中。
[1723]
4.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在室温孵育20分钟。
[1724]
5.通常在孵育时间过去后,添加tbe-尿素样品缓冲液(novex)终止反应。
[1725]
6.使用上面的纯化步骤1-7中概述的方案纯化反应混合物。
[1726]
使用以下方案测定纯化的dna浓度:
[1727]
1.将2μl灭菌蒸馏水(elga veolia)添加到基座平衡nanodrop one(thermo scientific)。
[1728]
2.平衡后,用不起毛的镜片清洁纸(whatman)轻轻擦去水。
[1729]
3.通过添加2μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)掩蔽(blank)nanodrop one。然后在掩蔽后重复步骤2。
[1730]
4.通过将2μl样品加到基座上并在触摸屏上选择测量图标来测量dna浓度。
[1731]
5.将纯化的dna在聚丙烯酰胺凝胶上运行,并按照上述步骤5-8中的方法可视化。没有引入条件或试剂的变化。
[1732]
凝胶电泳和dna可视化。
[1733]
1.将5μl的dna和tbe-尿素样品缓冲液(novex)添加到无菌1.5ml eppendorf管中,并使用加热thermomixer(eppendorf)加热至95℃,持续2分钟。
[1734]
2.然后dna混合物加载到15%tbe-尿素凝胶1.0mm x 10孔(invitrogen)的孔中,所述凝胶含有预热的1x tbe缓冲液thermo scientific(89mm tris、89mm硼酸和2mm edta)。
[1735]
3.将x-cell sure lock模块(novex)固定到位并在以下条件下进行电泳;260v,90amp,室温下40分钟。
[1736]
4.采用使用cy3 leds的chemidoc mp(biorad)进行检测和dna在凝胶中的可视化。
可视化和分析在image lab 2.0平台上进行。
[1737]
结果
[1738]
在辅助链的存在下,在室温(24℃)下用发夹/ta dna连接酶连接发夹寡核苷酸,得到高产率的连接产物。1分钟后连接的发夹寡核苷酸显示出高产率的连接dna产物,比率为约85%。2分钟后连接的发夹寡核苷酸显示出高产率的连接dna,比率为约85%。3分钟后连接的发夹寡核苷酸显示出高产率的连接dna产物,比率为约85%。4分钟后连接的发夹寡核苷酸显示出高的连接dna产物产率,比率为约》85%(图29b)。
[1739]
实施例5.版本2化学-双发夹模型的完整循环。
[1740]
本实施例描述了使用4个步骤在双发夹模型上合成多核苷酸:从缺口位点掺入3
’‑
o-修饰的dntp;在第一步在与天然互补核苷酸相对地发生的情况下裂解、连接和脱保护,该天然互补核苷酸位于支持链中与通用核苷酸相邻,在该特定情况下通用核苷酸为肌苷。发夹的一端用作附接锚。
[1741]
该方法首先是通过利用dna聚合酶的酶促掺入将3
’‑
o-保护的单核苷酸受控地添加到寡核苷酸中,然后进行肌苷裂解、连接和脱保护(图30a)。
[1742]
材料和方法
[1743]
材料
[1744]
1.根据描述于以下的方案内部合成3'-o-修饰的dntp:博士毕业论文jian wu:molecular engineering of novel nucleotide analogues for dna sequencing by synthesis。columbia university,2008.用于合成的方案还描述于专利申请公开:j.william efcavitch,juliesta e.sylvester,modified template-independent enzymes for polydeoxynucleotide synthesis,molecular assemblies us2016/0108382a1。
[1745]
2.寡核苷酸是内部设计的并从sigma-aldrich获得(图30c)。以100μm的浓度制备储备溶液。
[1746]
3.使用therminator ix dna聚合酶,其由new england biolabs工程化,具有增强的掺入3-o-修饰的dntp的能力。
[1747]
测试3'-o-叠氮甲基-dttp的掺入:
[1748]
3'-o-叠氮甲基-dttp:
[1749][1750]
方法
[1751]
1.将2μl的10x缓冲液(20mm tris-hcl、10mm(nh4)2so4、10mm kcl、2mm mgso4、0.1%x-100,ph 8.8,新英格兰生物实验室(new england biolab))与12.5μl无菌去离子水(elga veolia)在1.5ml eppendorf管中混合。
[1752]
2.将2μl的10μm双发夹模型寡核苷酸(20pmol,1当量)(seq id no:48,图30c)添加
scientific)。
[1777]
2.平衡后,用不起毛的镜片清洁纸(whatman)轻轻擦去水。
[1778]
3.通过添加2μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)掩蔽(blank)nanodrop one。然后在掩蔽后重复步骤2。
[1779]
4.通过将2μl样品加到基座上并在触摸屏上选择测量图标来测量dna浓度。
[1780]
5.将纯化的dna在聚丙烯酰胺凝胶上运行,并按照章节2步骤5-8中的程序可视化。没有引入条件或试剂的变化。
[1781]
使用下面概述的方案在每个步骤后纯化样品混合物:
[1782]
1.将500μl缓冲液pni qiagen(5m氯化胍)添加到样品中并通过用移液管重悬浮温和混合。
[1783]
2.将混合物转移到qiaquick旋转柱(qiagen)并以6000rpm离心1分钟。
[1784]
3.离心后,弃去流过液,向旋转柱中添加750μl缓冲液pe qiagen(10mm tris-hcl ph 7.5和80%乙醇),并以6000rpm离心1分钟。
[1785]
4.将流过液丢弃并将旋转柱以13000rpm离心另外的1分钟以去除残余的pe缓冲液。
[1786]
5.然后将旋转柱置于无菌的1.5ml eppendorf管中。
[1787]
6.对于dna洗脱,将20μl适当的反应缓冲液添加到柱膜中心,并在室温下静置1分钟。
[1788]
7.然后将管以13000rpm离心1分钟。测量洗脱的dna浓度并储存在-20℃下以备后用。
[1789]
结果
[1790]
dna聚合酶在双发夹构建体中掺入与其天然互补碱基相对的3
’‑
o-修饰的dttp(图30b)。
[1791]
实施例6.版本2化学-使用辅助链的单发夹模型的完整循环。
[1792]
本实施例描述了使用4个步骤在单发夹模型上合成多核苷酸:从缺口位点掺入3
’‑
o-修饰的dntp;在第一步在与天然互补碱基相对地发生的情况下裂解、连接和脱保护。dna合成在所述过程中使用辅助链。
[1793]
该方法首先是通过利用dna聚合酶的酶促掺入将3
’‑
o-保护的单核苷酸受控地添加到寡核苷酸中,然后进行肌苷裂解、连接和脱保护(图31a)。
[1794]
材料和方法
[1795]
材料
[1796]
1.根据描述于以下的方案内部合成3'-o-修饰的dntp:博士毕业论文jian wu:molecular engineering of novel nucleotide analogues for dna sequencing by synthesis。columbia university,2008.用于合成的方案还描述于专利申请公开:j.william efcavitch,juliesta e.sylvester,modified template-independent enzymes for polydeoxynucleotide synthesis,molecular assemblies us2016/0108382a1。
[1797]
2.寡核苷酸是内部设计的并从sigma aldrich获得(图31b)。以100μm的浓度制备储备溶液。
[1798]
3.使用therminator ix dna聚合酶,其由new england biolabs工程化,具有增强的掺入3-o-修饰的dntp的能力。
[1799]
测试3'-o-叠氮甲基-dttp的掺入:
[1800]
3'-o-叠氮甲基-dttp:
[1801][1802]
方法
[1803]
1. 2μl 10x缓冲液(20mm的tris-hcl、10mm的(nh4)2so4、10mm kcl、2mm mgso4、0.1%x-100,ph 8.8,新英格兰实验室)与12.5μl无菌去离子水(elga veolia)在1.5ml eppendorf管中混合。
[1804]
2.将2μl的10μm单发夹模型寡核苷酸(20pmol,1当量)(seq id no:50,图31b)和辅助链(30pmol,1.5当量)(seq id no:51,图31b)添加到反应混合物中。
[1805]
3.添加3
’‑
o-修饰的-dttp(2μl的100μm)和mncl2(1μl的40mm)。
[1806]
4.然后添加1.5μl的therminator ix dna聚合酶(15u,新英格兰生物实验室)。
[1807]
5.将反应物在37℃孵育10分钟。
[1808]
6.从反应混合物取出等分试样(5μl),以及添加0.5μl的天然dntp混合物并使其反应10分钟。通过凝胶电泳分析反应。
[1809]
7.使用上面纯化步骤1-7中概述的方案纯化反应混合物。
[1810]
8.通过20μl的neb反应缓冲液(50mm乙酸钾、20mm tris-乙酸盐、10mm乙酸镁、1mm dtt,ph 7.9,25℃下)将dna样品洗脱到干净的eppendorf管中。
[1811]
9.将1μl人类核酸内切酶v(endo v)neb(30单位/μl)添加到同一试管中。
[1812]
10.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在37℃孵育1小时。
[1813]
11.在孵育时间过去之后,将反应物通过酶促热失活(即65℃下20分钟)终止。
[1814]
12.将等分试样(5μl)从反应混合物取出,并在使用tbe缓冲液的聚丙烯酰胺凝胶(15%)上分析,并用chemidoc mp成像系统(biorad)进行可视化。
[1815]
13.使用上面纯化步骤1-7中概述的方案纯化反应混合物。
[1816]
14.通过20μl的neb反应缓冲液(50mm乙酸钾、20mm tris-乙酸盐、10mm乙酸镁、1mm dtt,ph 7.9,25℃下)将dna样品洗脱到干净的eppendorf管中。
[1817]
15.将10μl用于连接的100μm链(1nmol)(seq id no:52,图31b)和10μl用于连接的100μm辅助链(1nmol)(seq id no:53,图31b)添加到反应混合物中。
[1818]
16.将40μl的blunt/ta dna连接酶neb(180单位/μl)添加到同一试管中。
[1819]
17.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在室温孵育20分钟。
[1820]
18.将在1m tris缓冲液ph 7.4中的40μl的500mm tcep添加到反应混合物中,并使
其在37℃反应10分钟。
[1821]
19.通过用20μl的1x neb缓冲液洗脱,使用qiagen核苷酸去除试剂盒纯化反应混合物。
[1822]
20.通常在孵育时间过去后,添加tbe-尿素样品缓冲液(novex)终止反应。
[1823]
凝胶电泳和dna可视化:
[1824]
1.在无菌1.5ml eppendorf管中将5μl反应混合物添加到5μl的tbe-尿素样品缓冲液(novex)中,并使用加热thermomixer(eppendorf)加热至95℃,持续5分钟。
[1825]
2.然后将5μl样品加载到15%tbe-尿素凝胶1.0mm x 10孔(invitrogen)的孔中,所述凝胶含有预热的1x tbe缓冲液thermo scientific(89mm tris、89mm硼酸和2mm edta)。
[1826]
3.将x-cell sure lock模块(novex)固定到位并在以下条件下进行电泳;260v,90amp,室温下40分钟。
[1827]
4.将凝胶通过使用cy3 leds的chemidoc mp(biorad)可视化。可视化和分析在image lab 2.0平台上进行。
[1828]
使用以下方案测定纯化的dna浓度:
[1829]
1.将2μl灭菌蒸馏水(elga veolia)添加到基座平衡nanodrop one(thermo scientific)。
[1830]
2.平衡后,用不起毛的镜片清洁纸(whatman)轻轻擦去水。
[1831]
3.通过添加2μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)掩蔽(blank)nanodrop one。然后在掩蔽后重复步骤2。
[1832]
4.通过将2μl样品加在基座上并在触摸屏上选择测量图标来测量dna浓度。
[1833]
5.将纯化的dna在聚丙烯酰胺凝胶上运行,并按照上述步骤5-8中的程序可视化。没有引入条件或试剂的变化。
[1834]
使用下面概述的方案在每个步骤后纯化样品混合物:
[1835]
1.将500μl缓冲液pni qiagen(5m氯化胍)添加到样品中并通过用移液管重悬浮温和混合。
[1836]
2.将混合物转移到qiaquick旋转柱(qiagen)并以6000rpm离心1分钟。
[1837]
3.离心后,弃去流过液,向旋转柱中添加750μl缓冲液pe qiagen(10mm tris-hcl ph7.5和80%乙醇),并以6000rpm离心1分钟。
[1838]
4.将流过液丢弃并将旋转柱以13000rpm离心另外的1分钟以去除残余的pe缓冲液。
[1839]
5.然后将旋转柱置于无菌的1.5ml eppendorf管中。
[1840]
6.对于dna洗脱,将20μl适当的反应缓冲液添加到柱膜中心,并在室温下静置1分钟。
[1841]
7.然后将管以13000rpm离心1分钟。测量洗脱的dna浓度并储存在-20℃下以备后用。
[1842]
实施例7.版本3化学-双发夹模型的完整循环。
[1843]
本实施例描述了使用4个步骤在双发夹构建体模型上合成多核苷酸:从缺口位点掺入3
’‑
o-修饰的dntp;在第一步在与通用核苷酸相邻(在该特定情况下是肌苷碱基)相对
地发生的情况下裂解、连接和脱保护。
[1844]
该方法首先是通过利用dna聚合酶的酶促掺入将3
’‑
o-保护的单核苷酸受控地添加到寡核苷酸中,然后进行肌苷裂解、连接和脱保护(图32a)。
[1845]
材料和方法
[1846]
材料
[1847]
1.根据描述于以下的方案内部合成3'-o-修饰的dntp:博士毕业论文jian wu:molecular engineering of novel nucleotide analogues for dna sequencing by synthesis.columbia university,2008.用于合成的方案还描述于专利申请公开:j.william efcavitch,juliesta e.sylvester,modified template-independent enzymes for polydeoxynucleotide synthesis,molecular assemblies us2016/0108382a1。
[1848]
2.寡核苷酸是内部设计的并从sigma-aldrich获得(图32b)。以100μm的浓度制备储备溶液。
[1849]
3.其由new england biolabs工程化的therminator ix dna聚合酶具有增强的掺入3-o-修饰的dntp的能力。
[1850]
测试3'-o-叠氮甲基-dttp的掺入:
[1851]
3'-o-叠氮甲基-dttp:
[1852][1853]
方法
[1854]
1.将2μl的10x缓冲液(20mm tris-hcl、10mm(nh4)2so4、10mm kcl、2mm mgso4、0.1%x-100,ph 8.8,新英格兰生物实验室(new england biolab))与12.5μl无菌去离子水(elga veolia)在1.5ml eppendorf管中混合。
[1855]
2.将2μl的10μm双发夹模型寡核苷酸(20pmol,1当量)(seq id no:54,图32b)添加到反应混合物中。
[1856]
3.添加3
’‑
o-修饰的-dttp(2μl的100μm)和mncl2(1μl的40mm)。
[1857]
4.然后添加1.5μl的therminator ix dna聚合酶(15u,新英格兰生物实验室)。
[1858]
5.将反应物在37℃孵育10分钟。
[1859]
6.从反应混合物取出等分试样(5μl),以及添加0.5μl的天然dntp混合物并使其反应10分钟。通过凝胶电泳分析反应。
[1860]
7.使用纯化步骤1-7中概述的方案纯化反应混合物。
[1861]
8.通过20μl的neb反应缓冲液(50mm乙酸钾、20mm tris-乙酸盐、10mm乙酸镁、1mm dtt,ph 7.9,25℃下)将dna样品洗脱到干净的eppendorf管中。
[1862]
9.将1μl人类核酸内切酶v(endo v)neb(30单位/μl)添加到同一试管中。
[1863]
10.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在
37℃孵育1小时。
[1864]
11.在孵育时间过去之后,将反应物通过酶促热失活(即65℃下20分钟)终止。
[1865]
12.将等分试样(5μl)从反应混合物取出,并在使用tbe缓冲液的聚丙烯酰胺凝胶(15%)上分析,并用chemidoc mp成像系统(biorad)进行可视化。
[1866]
13.使用上面纯化步骤1-7中概述的方案纯化反应混合物。
[1867]
14.通过20μl的neb反应缓冲液(50mm乙酸钾、20mm tris-乙酸盐、10mm乙酸镁、1mm dtt,ph 7.9,25℃下)将dna样品洗脱到干净的eppendorf管中。
[1868]
15.将10μl用于连接的100μm链(1nmol)(seq id no:55,图32b)添加到反应混合物中。
[1869]
16.将40μl的blunt/ta dna连接酶neb(180单位/μl)添加到同一试管中。
[1870]
17.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在室温孵育20分钟。
[1871]
18.将在1m tris缓冲液ph 7.4中的40μl的500mm tcep添加到反应混合物中,并使其在37℃反应10分钟。
[1872]
19.通过用20μl的1xneb缓冲液洗脱,使用qiagen核苷酸去除试剂盒纯化反应混合物。
[1873]
20.通常在孵育时间过去后,添加tbe-尿素样品缓冲液(novex)终止反应。
[1874]
凝胶电泳和dna可视化:
[1875]
1.在无菌1.5ml eppendorf管中将5μl反应混合物添加到5μl的tbe-尿素样品缓冲液(novex)中,并使用加热thermomixer(eppendorf)加热至95℃,持续5分钟。
[1876]
2.然后将5μl样品加载到15%tbe-尿素凝胶1.0mm x 10孔(invitrogen)的孔中,所述凝胶含有预热的1x tbe缓冲液thermo scientific(89mm tris、89mm硼酸和2mm edta)。
[1877]
3.将x-cell sure lock模块(novex)固定到位并在以下条件下进行电泳;260v,90amp,室温下40分钟。
[1878]
4.将凝胶通过使用cy3 leds的chemidoc mp(biorad)可视化。可视化和分析在image lab 2.0平台上进行。
[1879]
使用以下方案测定纯化的dna浓度:
[1880]
1.将2μl灭菌蒸馏水(elga veolia)添加到基座平衡nanodrop one(thermo scientific)。
[1881]
2.平衡后,用不起毛的镜片清洁纸(whatman)轻轻擦去水。
[1882]
3.通过添加2μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)掩蔽(blank)nanodrop one。然后在掩蔽后重复第2步。
[1883]
4.通过将2μl样品加在基座上并在触摸屏上选择测量图标来测量dna浓度。
[1884]
5.将纯化的dna在聚丙烯酰胺凝胶上运行,并按照章节2步骤5-8中的程序可视化。没有引入条件或试剂的变化。
[1885]
使用下面概述的方案在每个步骤后纯化样品混合物:
[1886]
1.将500μl缓冲液pni qiagen(5m氯化胍)添加到样品中并通过用移液管重悬浮温和混合。
mgso4、0.1%x-100,ph 8.8,新英格兰实验室)与12.5μl无菌去离子水(elga veolia)在1.5ml eppendorf管中混合。
[1906]
2.将2μl的10μm双发夹模型寡核苷酸(20pmol,1当量)(seq id no:56,图33d)添加到反应混合物中。
[1907]
3.添加3
’‑
o-修饰的-dttp(2μl的100μm)和mncl2(1μl的40mm)。
[1908]
4.然后添加1.5μl的therminator ix dna聚合酶(15u,新英格兰实验室)。
[1909]
5.将反应物在37℃孵育10分钟。
[1910]
6.从反应混合物取出等分试样(5μl),以及添加0.5μl的天然dntp混合物并使其反应10分钟。通过凝胶电泳分析反应。
[1911]
7.将在1m tris缓冲液ph 7.4中的40μl的500mm tcep添加到反应混合物中,并使其在37℃反应10分钟。
[1912]
8.使用纯化步骤1-7中概述的方案纯化反应混合物。
[1913]
9.通过20μl的neb反应缓冲液(50mm乙酸钾、20mm tris-乙酸盐、10mm乙酸镁、1mm dtt,ph 7.9,25℃下)将dna样品洗脱到干净的eppendorf管中。
[1914]
10.将1μl人类核酸内切酶v(endo v)neb(30单位/μl)添加到同一试管中。
[1915]
11.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在37℃孵育1小时。
[1916]
12.在孵育时间过去之后,将反应物通过酶促热失活(即65℃下20分钟)终止。
[1917]
13.将等分试样(5μl)从反应混合物取出,并在使用tbe缓冲液的聚丙烯酰胺凝胶(15%)上分析,并用chemidoc mp成像系统(biorad)进行可视化。
[1918]
14.使用qiagen核苷酸去除试剂盒,使用纯化步骤1-7中概述的方案纯化反应混合物。
[1919]
15.通过20μl的neb反应缓冲液(50mm乙酸钾、20mm tris-乙酸盐、10mm乙酸镁、1mm dtt,ph 7.9,25℃下)将dna样品洗脱到干净的eppendorf管中。
[1920]
16.将10μl用于连接的100μm链(1nmol)(seq id no:57,图33d)添加到反应混合物中。
[1921]
17.将40μl的blunt/ta dna连接酶neb(180单位/μl)添加到同一试管中。
[1922]
18.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在室温孵育20分钟。
[1923]
19.使用纯化步骤1-5中概述的方案,通过链霉抗生物素蛋白磁珠试剂盒纯化反应混合物。
[1924]
20.未连接的寡核苷酸用λ核酸外切酶消化。
[1925]
21.使用qiagen核苷酸去除试剂盒,使用纯化步骤1-7中概述的方案纯化反应混合物。
[1926]
22.通过20μl的neb反应缓冲液(50mm乙酸钾、20mm tris-乙酸盐、10mm乙酸镁、1mm dtt,ph 7.9,25℃下)将dna样品洗脱到干净的eppendorf管中。
[1927]
第2循环:
[1928]
23.添加3
’‑
o-修饰的-dctp(2μl的100μm)和mncl2(1μl的40mm)。
[1929]
24.然后添加1.5μl的therminator ix dna聚合酶(15u,新英格兰实验室)。
[1930]
25.将反应物在37℃孵育10分钟。
[1931]
26.从反应混合物取出等分试样(5μl),以及添加0.5μl的天然dntp混合物并使其反应10分钟。通过凝胶电泳分析反应。
[1932]
27.将在1m tris缓冲液ph 7.4中的40μl的500mm tcep添加到反应混合物中,并使其在37℃反应10分钟。
[1933]
28.使用纯化步骤1-7中概述的方案纯化反应混合物。
[1934]
29.通过20μl的neb反应缓冲液(50mm乙酸钾、20mm tris-乙酸盐、10mm乙酸镁、1mm dtt,ph 7.9,25℃下)将dna样品洗脱到干净的eppendorf管中。
[1935]
30.将1μl人类核酸内切酶v(endo v)neb(30单位/μl)添加到同一试管中。
[1936]
31.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在37℃孵育1小时。
[1937]
32.在孵育时间过去之后,将反应物通过酶促热失活(即65℃下20分钟)终止。
[1938]
33.将等分试样(5μl)从反应混合物取出,并在使用tbe缓冲液的聚丙烯酰胺凝胶(15%)上分析,并用chemidoc mp成像系统(biorad)进行可视化。
[1939]
34.使用纯化步骤1-7中概述的方案纯化反应混合物。
[1940]
35.通过20μl的neb反应缓冲液(50mm乙酸钾、20mm tris-乙酸盐、10mm乙酸镁、1mm dtt,ph 7.9,25℃下)将dna样品洗脱到干净的eppendorf管中。
[1941]
36.将10μl用于连接的100μm链(1nmol)(seq id no:58,图33d)添加到反应混合物中。
[1942]
37.将40μl的blunt/ta dna连接酶neb(180单位/μl)添加到同一试管中。
[1943]
38.然后将反应混合物通过用移液管重悬温和混合,13,000rpm下离心5秒钟并在室温孵育10分钟。
[1944]
39.在孵育时间过去后,添加tbe-尿素样品缓冲液(novex)终止反应。
[1945]
凝胶电泳和dna可视化:
[1946]
1.在无菌1.5ml eppendorf管中将5μl反应混合物添加到5μl的tbe-尿素样品缓冲液(novex)中,并使用加热thermomixer(eppendorf)加热至95℃,持续5分钟。
[1947]
2.然后将5μl样品加载到15%tbe-尿素凝胶1.0mm x 10孔(invitrogen)的孔中,所述凝胶含有预热的1x tbe缓冲液thermo scientific(89mm tris、89mm硼酸和2mm edta)。
[1948]
3.将x-cell sure lock模块(novex)固定到位并通过应用以下条件下进行电泳;260v,90amp,室温下40分钟。
[1949]
4.将凝胶通过使用cy3 leds的chemidoc mp(biorad)可视化。可视化和分析在image lab 2.0平台上进行。
[1950]
使用以下方案测定纯化的dna浓度:
[1951]
1.将2μl灭菌蒸馏水(elga veolia)添加到基座平衡nanodrop one(thermo scientific)。
[1952]
2.平衡后,用不起毛的镜片清洁纸(whatman)轻轻擦去水。
[1953]
3.通过添加2μl缓冲液eb qiagen(10mm tris.cl,ph 8.5)掩蔽(blank)nanodrop one。然后在掩蔽后重复步骤2。
synthesis,columbia university,2008.用于合成的方案还描述于专利申请公开:j.william efcavitch,juliesta e.sylvester,modified template-independent enzymes for polydeoxynucleotide synthesis,molecular assemblies us2016/0108382a1。
[1977]
2.寡核苷酸是内部设计的并从integrated dna technologies、sigma-aldrich获得(图41)。以100μm的浓度制备储备溶液。
[1978]
3.使用therminator x dna聚合酶,其由new england biolabs工程化,具有增强的掺入3-o-修饰的dntp的能力。可以替代地使用任何可以掺入修饰的dntp的dna聚合酶或其它酶。
[1979]
使用3'-o-叠氮甲基-dttp掺入:
[1980][1981]
方法
[1982]
第1循环:
[1983]
1.将20μl的10x缓冲液(20mm tris-hcl、10mm(nh4)2so4、10mm kcl、2mm mgso4、0.1%x-100,ph 8.8,新英格兰实验室)和mncl2溶液(10μl的40mm)与139μl无菌去离子水(elga veolia)在1.5ml eppendorf管中混合。
[1984]
2.将20μl的100μm单发夹模型寡核苷酸(2nmol,1当量)(seq id no:59,图41)添加到反应混合物中。
[1985]
3.从反应混合物取出等分试样(4μl),以及添加0.5μl的天然dntp混合物(4mm)和0.5μl的bst dna聚合酶以及0.5μl的sulfolobus dna聚合酶iv并使其反应10分钟。通过凝胶电泳分析反应。
[1986]
4.添加3'-o-修饰的-dttp(10μl,2mm)。
[1987]
5.然后添加5μl的therminator x dna聚合酶(50u,new england biolabs)。然而,可以使用任何可以掺入修饰的dntp的dna聚合酶或其它酶。
[1988]
6.将反应物在37℃孵育30分钟。
[1989]
7.使用在纯化步骤66-72中概述的qiagen核苷酸去除试剂盒纯化反应混合物。
[1990]
8.通过200μl的te缓冲液将dna样品洗脱到干净的eppendorf管中。
[1991]
9.从反应混合物取出等分试样(4μl),以及添加0.5μl的天然dntp混合物(4mm)和0.5μl的bst dna聚合酶以及0.5μl的sulfolobus dna聚合酶iv并使其反应10分钟。通过凝胶电泳分析反应。
[1992]
10.将400μl的500mm tcep添加到反应混合物中,并使其在37℃反应10分钟。
[1993]
11.使用在纯化步骤66-72中概述的qiagen核苷酸去除试剂盒纯化反应混合物。
[1994]
12.通过150μl的neb反应缓冲液(50mm乙酸钾、20mm tris-乙酸盐、10mm乙酸镁、1mm dtt,ph 7.9,25℃下)将dna样品洗脱到干净的eppendorf管中。
[1995]
13.从反应混合物取出等分试样(4μl),以及添加0.5μl的天然dntp混合物(4mm)和0.5μl的bst dna聚合酶以及0.5μl的sulfolobus dna聚合酶iv并使其反应10分钟。通过凝胶电泳分析反应。
[1996]
14.将5μl的人类核酸内切酶v(endo v)neb(30单位/μl)添加到洗脱液中并在37℃孵育30分钟。可以使用任何合适的替代性核酸内切酶。
[1997]
15.在孵育时间过去之后,将反应物通过在65℃下酶促热失活20分钟终止。
[1998]
16.将等分试样(5μl)从反应混合物取出,并在聚丙烯酰胺凝胶上分析。
[1999]
17.通过qiagen核苷酸去除试剂盒,使用纯化步骤66-72中概述的方案纯化反应混合物。
[2000]
18.通过100μl的t3 dna连接酶缓冲液(2x浓度)将dna样品洗脱到干净的eppendorf管中。
[2001]
19.将20μl的100μm用于连接的肌苷链(2nmol)和20μl的100μm用于连接的辅助链(2nmol)(seq id no:60、51,图41)以及40μl水添加到反应混合物中。
[2002]
20.将20μl的t3 dna连接酶neb(3000单位/μl)添加到同一试管中(这可包括任何dna连接酶)并在室温下孵育30分钟。
[2003]
使用对于链霉抗生物素蛋白磁珠试剂盒的方案纯化反应混合物,包括纯化步骤73-78中概述的变性步骤。
[2004]
21.使用在纯化步骤66-72中概述的qiagen核苷酸去除试剂盒的方案纯化反应混合物。
[2005]
22.通过100μl的te缓冲液将dna样品洗脱到干净的eppendorf管中。
[2006]
第2循环:
[2007]
23.添加15μl的10x缓冲液(20mm tris-hcl、10mm(nh4)2so4、10mm kcl、2mm mgso4、0.1%x-100,ph 8.8,new england biolabs)、mncl2溶液(7.5μl,40mm)和19μl去离子水。
[2008]
24.从反应混合物取出等分试样(4μl),以及添加0.5μl的天然dntp混合物(4mm)和0.5μl的bst dna聚合酶以及0.5μl的sulfolobus dna聚合酶iv并使其反应10分钟。通过凝胶电泳分析反应。
[2009]
25.添加3'-o-修饰的-dttp(7.5μl,2mm)。
[2010]
26.然后添加5μl的therminator x dna聚合酶(50u,new england biolabs)。可以使用任何可以掺入修饰的dntp的dna聚合酶。
[2011]
27.将反应物在37℃孵育30分钟。
[2012]
28.使用在纯化步骤66-72中概述的qiagen核苷酸去除试剂盒纯化反应混合物。
[2013]
29.通过100μl的te缓冲液将dna样品洗脱到干净的eppendorf管中。
[2014]
30.从反应混合物取出等分试样(4μl),以及添加0.5μl的天然dntp混合物(4mm)和0.5μl的bst dna聚合酶以及0.5μl的sulfolobus dna聚合酶iv并使其反应10分钟。通过凝胶电泳分析反应。
[2015]
31.将200μl的500mm tcep添加到反应混合物中,并使其在37℃反应10分钟。
[2016]
32.使用在纯化步骤66-72中概述的qiagen核苷酸去除试剂盒纯化反应混合物。
[2017]
33.通过100μl的neb反应缓冲液(50mm乙酸钾、20mm tris-乙酸盐、10mm乙酸镁、
1mm dtt,ph 7.9,25℃下)将dna样品洗脱到干净的eppendorf管中。
[2018]
34.从反应混合物取出等分试样(4μl),以及添加0.5μl的天然dntp混合物(4mm)和0.5μl的bst dna聚合酶以及0.5μl的sulfolobus dna聚合酶iv并使其反应10分钟。通过凝胶电泳分析反应。
[2019]
35.将5μl的人类核酸内切酶v(endo v)neb(30单位/μl)添加到洗脱液中并在37℃孵育30分钟。可以使用任何合适的替代性核酸内切酶。
[2020]
36.在孵育时间过去之后,将反应物通过在65℃下酶促热失活20分钟终止。
[2021]
37.将等分试样(5μl)取出反应混合物,并在聚丙烯酰胺凝胶上分析。
[2022]
38.通过qiagen核苷酸去除试剂盒,使用纯化步骤66-72中概述的方案纯化反应混合物。
[2023]
39.通过60μl的t3 dna连接酶缓冲液(2x浓度)将dna样品洗脱到干净的eppendorf管中。
[2024]
40.将20μl的100μm用于连接的肌苷链(2nmol)和20μl的100μm用于连接的辅助链(2nmol)(seq id no:60、51,图41)以及10μl去离子水添加到反应混合物中。
[2025]
41.将10μl的t3 dna连接酶neb(3000单位/μl)添加到同一试管中并在室温下孵育30分钟。可以使用任何合适的dna连接酶。
[2026]
42.使用对于链霉抗生物素蛋白磁珠试剂盒的方案纯化反应混合物,包括纯化步骤73-78中概述的变性步骤。
[2027]
43.使用在纯化步骤66-72中概述的qiagen核苷酸去除试剂盒的方案纯化反应混合物。
[2028]
44.通过46μl的te缓冲液将dna样品洗脱到干净的eppendorf管中。
[2029]
第3循环:
[2030]
45.添加6μl的10x缓冲液(20mm tris-hcl、10mm(nh4)2so4、10mm kcl、2mm mgso4、0.1%x-100,ph 8.8,new england biolabs)、mncl2溶液(3μl,40mm)。
[2031]
46.从反应混合物取出等分试样(4μl),以及添加0.5μl的天然dntp混合物(4mm)和0.5μl的bst dna聚合酶以及0.5μl的sulfolobus dna聚合酶iv并使其反应10分钟。通过凝胶电泳分析反应。
[2032]
47.添加3'-o-修饰的dttp(6μl的200μm)。
[2033]
48.然后添加3μl的therminator x dna聚合酶(30u,new england biolabs)。可以使用任何可以掺入修饰的dntp的dna聚合酶或其它合适的酶。
[2034]
49.将反应物在37℃孵育30分钟。
[2035]
50.使用在纯化步骤66-72中概述的qiagen核苷酸去除试剂盒纯化反应混合物。
[2036]
51.通过50μl的te缓冲液将dna样品洗脱到干净的eppendorf管中。
[2037]
52.从反应混合物取出等分试样(4μl),以及添加0.5μl的天然dntp混合物(4mm)和0.5μl的bst dna聚合酶以及0.5μl的sulfolobus dna聚合酶iv并使其反应10分钟。通过凝胶电泳分析反应。
[2038]
53.将100μl的500mm tcep添加到反应混合物中,并使其在37℃反应10分钟。
[2039]
54.使用在纯化步骤66-72中概述的qiagen核苷酸去除试剂盒纯化反应混合物。
[2040]
55.通过49μl的neb反应缓冲液(50mm乙酸钾、20mm tris-乙酸盐、10mm乙酸镁、
1mm dtt,ph 7.9,25℃下)将dna样品洗脱到干净的eppendorf管中。
[2041]
56.从反应混合物取出等分试样(4μl),以及添加0.5μl的天然dntp混合物(4mm)和0.5μl的bst dna聚合酶以及0.5μl的sulfolobus dna聚合酶iv并使其反应10分钟。通过凝胶电泳分析反应。
[2042]
57.将5μl的人类核酸内切酶v(endo v)neb(30单位/μl)添加到洗脱液中并在37℃孵育30分钟。或者可以使用任何合适的核酸内切酶。
[2043]
58.在孵育时间过去之后,将反应物通过在65℃下酶促热失活20分钟终止。
[2044]
59.将等分试样(5μl)取出反应混合物,并在聚丙烯酰胺凝胶上分析。
[2045]
60.通过qiagen核苷酸去除试剂盒,使用纯化步骤66-72中概述的方案纯化反应混合物。
[2046]
61.通过30μl的t3 dna连接酶缓冲液(2x浓度)将dna样品洗脱到干净的eppendorf管中。
[2047]
62.将10μl的100μm用于连接的肌苷链(2nmol)、10μl的100μm用于连接的辅助链(2nmol)(seq id no:60、51,图41)以及5μl水添加到反应混合物中。
[2048]
63.将5μl的t3 dna连接酶neb(3000单位/μl)添加到同一试管中。(这可包含任何dna连接酶)并在室温下孵育30分钟。
[2049]
64.通过凝胶电泳分析反应混合物。
[2050]
使用下述方案在掺入、解封闭和裂解步骤后通过qiagen核苷酸去除试剂盒纯化反应混合物:
[2051]
65.将10体积的缓冲液pni qiagen(5m氯化胍)添加到样品中并通过用移液管重悬浮温和混合。
[2052]
66.将混合物转移到qiaquick旋转柱(qiagen)并以6000rpm离心1分钟。
[2053]
67.离心后,弃去流过液,向旋转柱中添加750μl缓冲液pe qiagen(10mm tris-hcl ph 7.5和80%乙醇),并以6000rpm离心1分钟。
[2054]
68.将流过液丢弃并将旋转柱以13000rpm再离心1分钟以去除残余的pe缓冲液。
[2055]
69.然后将旋转柱置于无菌的1.5ml eppendorf管中。
[2056]
70.对于dna洗脱,将20-200μl适当的反应缓冲液添加到柱膜中心,并在室温下静置1分钟。
[2057]
71.然后将管以13000rpm离心1分钟。
[2058]
通过下面概述的方案,在使用涉及变性步骤的链霉抗生物素蛋白磁珠的连接步骤后进行反应的纯化:
[2059]
72.用100μl结合缓冲液(20mm tris、500mm nacl,ph=7.4)洗涤200μl链霉抗生物素蛋白磁珠(new england biolabs)3次。
[2060]
73.连接步骤之后反应混合物与10倍体积的结合缓冲液(20mm的tris、500mm的nacl,ph值=7.4)混合,并用链霉抗生物素蛋白磁珠在20℃使其孵育15分钟。
[2061]
74.用200μl结合缓冲液(20mm tris、500mm nacl,ph=7.4)洗涤链霉抗生物素蛋白磁珠3次。
[2062]
75.为了去除辅助链,在放置于磁体上的200μl结合缓冲液(20mm tris、500mm nacl,ph=7.4)中将链霉抗生物素蛋白磁珠加热至80℃,并将上清液迅速丢弃。
[2063]
76.用去离子水洗涤链霉抗生物素蛋白磁珠3次。
[2064]
77.通过加热至95℃持续3分钟将寡核苷酸用50-100μl去离子水洗脱。
[2065]
结果和结论
[2066]
图42描绘了示出与完整三循环实验相对应的反应产物的凝胶,所述实验包括:掺入、解封闭、裂解和连接步骤。所示结果证明了使用本发明的示例性方法的三个完掺入成循环的性能。
[2067]
实施例10.衍生化聚丙烯酰胺表面并随后固定分子。
[2068]
本实施例描述了使用n-(5-溴乙酰胺基戊基)丙烯酰胺(brapa)在聚丙烯酰胺表面上呈现溴乙酰基,并且随后通过它们与溴乙酰基的共价偶联来表面固定硫醇化分子。
[2069]
材料和方法
[2070]
通过在丙酮、乙醇和水中依次超声处理,每次10分钟,并用氩气干燥,清洁玻璃显微镜载玻片和盖玻片。将清洁的盖玻片在聚苯乙烯培养皿中用三氯(1h,1h,2h,2h-全氟辛基)硅烷在气相中硅烷化,在乙醇中超声处理两次并用ar干燥(下文
‘
氟化盖玻片')。在玻璃显微镜载玻片上,将4%丙烯酰胺/n,n'-亚甲基双丙烯酰胺(19:1)溶液与100μl的10%(w/v)过硫酸铵(aps)、10μl的四甲基乙二胺(temed)混合,用0、0.1、0.2和0.3%(w/v)的n-(5-溴乙酰胺基戊基)丙烯酰胺(brapa)掺杂,并快速分配到4mm直径的橡胶垫圈中,随后用氟化盖玻片夹在中间,氟化面朝向丙烯酰胺溶液,并聚合10分钟。10分钟后,将表面浸入去离子水中并浸没总共4小时,在此期间小心地去除氟化盖玻片。聚合的聚丙烯酰胺表面用氩气干燥。
[2071]
随后将聚丙烯酰胺表面暴露于磷酸钠缓冲液(10mm,ph 8)中的硫醇化聚乙二醇(1kda)荧光素(fitc-peg-sh)和作为负对照的羧化聚乙二醇(1kda)荧光素(fitc-peg-cooh)1小时,然后依次用磷酸钠缓冲液(10mm,ph 7)和含有0.05%tween20/0.5m nacl的相同缓冲液洗涤,以除去非特异性吸附的硫醇化和羧化荧光团。随后通过chemidoc(bio-rad)在荧光素通道中对表面成像。
[2072]
结果和结论
[2073]
图43示出荧光信号并且图44示出从聚丙烯酰胺凝胶表面测量的荧光,其中掺杂不同量的brapa,其暴露于fitc-peg-sh和fitc-peg-cooh。荧光素的固定仅在掺杂有brapa并且仅有硫醇化荧光素的聚丙烯酰胺表面成功,对羧化荧光素的非特异性吸附接近于零。
[2074]
与不含brapa(brapa 0%)的那些聚丙烯酰胺表面和含有brapa和羧化分子(fitc-peg-cooh)的那些聚丙烯酰胺表面相比,含有(brapa 0.1、0.2和0.3%)和仅来自巯基化分子(fitc-peg-sh)的聚丙烯酰胺表面获得了显著高的正荧光信号。结果表明,来自表面的溴乙酰基部分和来自荧光素标记分子的硫醇部分之间发生了特异性共价偶联。
[2075]
结果表明,分子,例如包括用于本发明方法的支持链和合成链的分子,可以容易地固定在与本文所述的多核苷酸合成反应相容的表面基底上。
[2076]
实施例11.发夹dna寡聚体的表面固定和随后掺入荧光标记的脱氧核苷三磷酸。
[2077]
本实施例描述:
[2078]
(1)在薄的聚丙烯酰胺表面上呈现溴乙酰基的方法;
[2079]
(2)随后通过硫代磷酸酯官能化的发夹dna在有或没有接头下的共价偶联来固定发夹dna;和
[2080]
(3)将2'-脱氧核苷酸三磷酸(dntp)掺入发夹dna中。
[2081]
所述方法几乎与任何类型的材料表面(例如金属、聚合物等)相容。
[2082]
(1):溴乙酰基官能化的薄聚丙烯酰胺表面的制备
[2083]
材料和方法
[2084]
首先在纯净的decon 90(30分钟)、水(30分钟)、1m naoh(15分钟)、水(30分钟)、0.1m hcl(15分钟)、水(30分钟)中通过超声处理清洁玻璃显微镜载玻片,最后用氩干燥。
[2085]
首先通过将1g丙烯酰胺单体溶解在50ml水中制备2%(w/v)丙烯酰胺单体溶液。将丙烯酰胺单体溶液涡旋并在氩气中脱气15分钟。将n-(5-溴乙酰胺基戊基)丙烯酰胺(brapa,82.5mg)溶解在825μl的dmf中,并添加到丙烯酰胺单体溶液中并进一步涡旋。最后,将1ml5%(w/v)过硫酸钾(kps)和115μl纯四甲基乙二胺(temed)添加到丙烯酰胺溶液中,涡旋并将干净的玻璃显微镜载玻片暴露于所述丙烯酰胺聚合混合物中90分钟。90分钟后,用去离子水洗涤表面并用氩气干燥。在这个实施例的下文中,这些表面将被称为“brapa改性表面”。作为负对照,通过排除向丙烯酰胺单体溶液中添加brapa溶液,也以与上述类似的方式制备不含brapa的聚丙烯酰胺表面。在这个实施例的下文中,这些表面将被称为“brapa对照表面”。
[2086]
(2):硫代磷酸酯官能化的发夹dna在聚丙烯酰胺表面上的共价偶联
[2087]
材料和方法
[2088]
将具有4mm直径圆形开口的橡胶垫圈放置并固定在brapa改性表面和brapa对照表面上。首先用磷酸钠缓冲液(10mm,ph 7)引发表面10分钟。随后去除缓冲液,并将表面暴露于5'-荧光标记的(alexa 647)发夹dna寡聚体,分别具有和不具有以1μm浓度用六种和单一硫代磷酸酯修饰的接头,并在黑暗中孵育1小时。brapa改性表面也与具有和不具有接头但没有硫代磷酸酯作为对照的dna寡聚体一起孵育(在下文中称为“寡聚体对照表面”)。孵育后,将表面用磷酸钠(100mm,ph 7)冲洗,然后用tris-edta缓冲液(10mm tris,10mm edta,ph8)冲洗,最后用水冲洗。为了去除任何非特异性吸附的dna寡聚体,随后用含有1m氯化钠和0.05%(v/v)tween 20的水洗涤表面,用水洗涤并用氩气干燥。在chemidoc成像仪上在alexa 647通道中扫描表面。
[2089]
图45a示出固定在不同样品上的没有接头的发夹dna的序列。图45b示出固定在不同样品上的具有接头的发夹dna的序列。
[2090]
结果
[2091]
结果在图46和47中示出。图46示出源自固定在溴乙酰基官能化的聚丙烯酰胺表面上的具有和没有接头的发夹dna寡聚体的荧光信号,但不是源自brapa或寡聚体对照。
[2092]
图47示出dna固定在聚丙烯酰胺表面上之后的测量荧光强度。所述图显示了从各种聚丙烯酰胺表面获得的表面荧光信号,并显示由于dna在溴乙酰基官能化的聚丙烯酰胺表面上成功的共价固定,与brapa和寡聚体对照表面(如(2)中所述)相比,从固定在brapa改性表面上的发夹dna寡聚体获得显著更高的信号。
[2093]
结论
[2094]
来自dna的荧光信号仅悬垂地存在于掺杂有brapa的brapa改性表面,表明通过硫代磷酸酯官能团将dna成功共价偶联到表面上。与没有接头的dna相比,从有接头的dna获得同源和更高的信号。
[2095]
(3):将三磷酸掺入具有接头的发夹dna寡聚体中
[2096]
材料和方法
[2097]
将具有9mm直径的圆形开口的橡胶密封垫放在固定有具有接头的dna寡聚体的brapa改性表面上,并用掺入缓冲液(50mm tris ph 8、1mm edta、6mm mgso4、0.05%tween20和2mm mncl2)引发10分钟。随后将表面暴露于含有dna聚合酶(0.5u/μltherminator x dna聚合酶)和三磷酸盐(20μm alexa488标记的dutp)的掺入缓冲液中并孵育1小时(此后在该实施例中称为“聚合酶表面”)。另外一组表面也暴露于没有therminator x dna聚合酶的掺入缓冲液1小时作为负对照(在下文中称为“负表面”)。1小时后,将两种类型的样品在水中洗涤,随后暴露于含有1m氯化钠和0.05%(v/v)tween20的水中,并再次用水洗涤。在alexa 647和alexa 488通道中使用chemidoc测量来自表面的荧光信号,以监测发夹dna(alexa 647)的存在和dutp(alexa 488)的掺入。
[2098]
结果
[2099]
图48示出在掺入alexa 488标记的dutp之前和之后从alexa 647和alexa 488通道检测到的荧光信号。在掺入之前和之后来自alexa 647的未改变的正信号表明表面固定的发夹dna在掺入反应期间是稳定的,而来自alexa 488的正信号仅在掺入反应后从聚合酶表面观察到,显示仅在聚合酶存在时成功掺入dutp。
[2100]
图49示出如(3)中所述在掺入alexa 488标记的dutp之前和之后从
‘
聚合酶表面’和
‘
负表面’获得的alexa 647(发夹dna)和alexa 488(dutp)通道中的测量荧光信号。由于成功掺入,在聚合酶表面的掺入反应后获得alexa 488荧光信号的显著增加,而由于不存在聚合酶,来自负表面的信号在掺入反应后保持相同。在掺入反应后,alexa 647通道中的荧光信号基本保持不变,表明表面上存在发夹dna。荧光信号的轻微降低可能归因于第二轮曝光引起的光漂白效应。
[2101]
结论
[2102]
结果表明,包括用于本发明方法的支持链和合成链的分子,可以容易地固定在与本文所述的多核苷酸合成反应相容的表面基底上。结果进一步证明,这种分子可以接受新dntp的掺入以延伸合成链,同时分子保持稳定并附接于基底。
[2103]
实施例12.通过接头和硫代磷酸酯共价键连接固定于衍生化表面的发夹dna寡聚体的裂解和连接。
[2104]
本实施例描述了用接头与硫代磷酸酯官能化的发夹dna的衍生化表面的共价偶联,然后是裂解和连接反应。如实施例11所述进行基底制备和发夹dna的偶联。
[2105]
(1):裂解具有接头的固定的发夹dna寡聚体
[2106]
材料和方法
[2107]
如实施例11中所述,将发夹dna固定在表面brapa改性表面上。制备四组一式三份表面,包括用于裂解和连接反应的所有实验对照。实验条件描述于图50a中。图50b示出固定在不同样品上的发夹dna的序列。
[2108]
在dna固定步骤后,将具有9mm直径圆形开口的橡胶垫圈放置在所有表面上,所述表面用在5'末端用alexa 647标记的dna固定,并用1x nebuffer 4(50mm醋酸钾、20mm tris-乙酸盐、10mm乙酸镁、1mm dtt,ph 7.9)引发10分钟。注意,对于样品d,固定的发夹dna不含肌苷,肌苷被鸟嘌呤取代。随后将所有样品暴露于含有1.5u/μl核酸内切酶v的
nebuffer 4(样品a、b和d)或不含核酸内切酶v的nebuffer 4(样品c)1小时。随后用1xt3 dna连接酶缓冲液(66mm tris-hcl、10mm mgcl2、1mm atp、7.5%peg6000、1mm dtt,ph 7.6)、含有1m氯化钠和0.05%(v/v)tween20的1x t3 dna连接酶缓冲液洗涤所有样品,再用1x t3 dna连接酶缓冲液洗涤,并在alexa 647通道中在chemidoc成像仪上扫描。
[2109]
结果
[2110]
图51示出在裂解反应之前和之后来自发夹dna寡聚体的荧光信号。
[2111]
图52示出如上所述从dna固定表面获得的裂解反应之前和之后的测量荧光信号。仅从样品a和b观察到成功的裂解反应,而由于序列中没有核酸内切酶v(样品c)或肌苷(样品d),样品c和d的荧光信号强度保持几乎相同。
[2112]
从样品a和b中观察到荧光信号的显著降低是由于在核酸内切酶v存在下在dna链内的肌苷位点的成功裂解反应。对于样品c和d,在dna内没有核酸内切酶v和缺乏肌苷分别引起荧光信号保持与dna固定后获得的初始信号几乎相同的水平。
[2113]
(2):连接反应
[2114]
材料和方法
[2115]
在如(1)中所述的裂解反应后,将样品a和b(如图50a中所述)暴露于含有mncl2(2mm)、在5’末端用alexa 647标记的肌苷链(16μm)和互补
‘
辅助’链(16μm)(序列在下面的图53中示出)的1x t3 dna连接酶缓冲液,对于样品a,具有t3 dna连接酶(250u/μl),并且对于样品b,不具有t3 dna连接酶,作为负对照。将样品在相应溶液中孵育1小时。1小时后,将表面在水中洗涤,随后暴露于含有1m氯化钠和0.05%(v/v)tween20的水,并再次用水洗涤。在alexa 647通道中使用chemidoc测量来自表面的荧光信号。图53示出用于连接反应的含肌苷链和互补
‘
辅助’链的序列。
[2116]
结果
[2117]
图54示出与连接反应的监测相关的结果。在连接反应之前和之后从alexa 647通道检测到荧光信号。连接后alexa 647通道中荧光信号的增加仅从具有t3 dna连接酶的样品a获得,而由于不存在t3 dna连接酶,在样品b的连接反应后荧光信号保持在相同水平。
[2118]
图55示出,由于成功连接,在连接反应后从样品a获得的alexa 647荧光信号显著增加,其中信号水平恢复到如图52所示的dna固定后和裂解反应前的初始信号水平。由于不存在t3 dna连接酶,来自样品b的荧光信号在连接反应后保持相同。
[2119]
结论
[2120]
该实施例中的结果表明,包含用于本发明方法的支持链和合成链的分子,可以容易地固定在与本文所述的多核苷酸合成反应相容的表面基底上,并且可以在保持稳定以及附接于基底的同时进行裂解和连接反应。
[2121]
实施例13.将3'-o-叠氮甲基-dntps掺入平端dna的3'末端。
[2122]
本实施例描述了将3'-o-叠氮甲基-dntps掺入平端双链dna的3'末端。
[2123]
下面的步骤证明了通过dna聚合酶的酶促掺入,将3'-o-保护的单核苷酸受控地添加到平端双链寡核苷酸中。所述步骤与图1至10中的每一个中所示的掺入步骤4一致。
[2124]
材料和方法
[2125]
材料
[2126]
1.内部合成的3
’‑
o-叠氮甲基-dntp。
[2127]
2.新英格兰生物实验室设计的therminator x dna聚合酶具有增强的结合3-o-修饰dntp的能力。
[2128]
3.平端双链dna寡核苷酸。
[2129]
测试四种类型的可逆终止子:
[2130][2131]
方法
[2132]
1.将5μl的10x缓冲液(20mm tris-hcl、10mm(nh4)2so4、10mm kcl、2mm mgso4、0.1%x-100,ph 8.8,new england biolabs)与33.5μl无菌去离子水(elga veolia)在1.5ml eppendorf管中混合。
[2133]
2.将2μl的20μm引物(40pmol,1当量)(seq id:no:68,图56a)和3μl的20μm模板(60pmol,1.5当量)(seq id:no:69,图56a)添加到反应混合物中。
[2134]
3.添加3
’‑
o-修饰的-dttp(2μl的100μm)和mncl2(2.5μl的40mm)。
[2135]
4.然后添加2μl的therminator x dna聚合酶(20u,new england biolabs)。
[2136]
5.将反应物在37℃孵育30分钟。
[2137]
6.将反应物通过添加tbe-尿素样品缓冲液(novex)停止。
[2138]
7.将反应物在聚丙烯酰胺凝胶(15%)上用tbe缓冲液分离,并通过chemidoc mp成像系统(biorad)进行可视化。
[2139]
结果
[2140]
图56b描绘了示出在37℃存在mn2 离子的情况下,通过therminator x dna聚合酶掺入3
’‑
o-修饰的-dntp的结果的凝胶。数据显示,therminator x dna聚合酶能够成功地将3'-o-修饰的dntps掺入平端dna寡核苷酸的3'末端,从而产生一个碱基突出的碱基。
[2141]
实施例14.使用平末端连接将多核苷酸连接分子示例性地连接至支架多核苷酸。
[2142]
本实施例描述了使用dna连接酶将多核苷酸连接分子连接至支架多核苷酸。该实施例涉及具有平末端的分子的连接,这与图2所描绘的本发明合成方法版本2一致。
[2143]
图57提供了描绘dna合成反应循环的方案。该方案旨在与图2所示的发明版本2的合成方法一致。因此,图57中的方案示出具有平末端的支架多核苷酸(该方案的最上面的小图中的右手发夹结构)的提供,左链对应于支持链并且右链对应于合成链。支持链的末端核
苷酸在5'端包含磷酸基团。在该循环的下一步骤中,提供了多核苷酸连接分子(方案最上面部分的最右边的结构)。多核苷酸连接分子具有支持链(左链)和辅助链(右链)。多核苷酸连接分子具有互补连接末端,所述互补连接末端为平末端并且包含为2-脱氧肌苷(in)的通用核苷酸。互补连接末端处的辅助链末端包含不可连接的核苷酸。互补连接末端处的支持链末端包含预定序列的核苷酸,描绘为“a”,仅用于说明。将多核苷酸连接分子连接至支架多核苷酸后,将多核苷酸连接分子互补连接末端的支持链末端核苷酸连接至支架多核苷酸支持链末端核苷酸,并且在多核苷酸连接分子的辅助链和支架多核苷酸的合成链之间产生单链断裂(“缺口”)。多核苷酸连接分子的支持链的末端核苷酸包含预定序列的核苷酸,并位于位置n。通用核苷酸因此占据位置n 2。连接后,通过在位置n与n 1之间裂解支持链来裂解多核苷酸连接分子。在图57所示的反应方案中,辅助链被示出为在裂解步骤之前作为任选步骤被去除。裂解后,预定序列的核苷酸保留在支架多核苷酸中。在下一步骤中,在此情况下,仅出于说明目的,通过聚合酶或核苷酸转移酶的作用将另外的核苷酸(仅描述为“t”)并入支架多核苷酸的合成链中。所述另外的核苷酸包含可逆终止子基团或封闭基团。另外的核苷酸与支持链的末端核苷酸配对以形成核苷酸对。然后,该方案描绘了脱保护或解封闭步骤,其中去除了可逆终止子基团或封闭基团,从而完成合成循环。
[2144]
如下文所详述,该实施例14描述了将多核苷酸连接分子连接至支架多核苷酸的步骤,如图57中的虚线框中所示。
[2145]
材料和方法
[2146]
材料:
[2147]
1.在本实施例中使用的寡核苷酸是在室内设计的,并由integrated dna技术合成。这些在图58中进行了描述。
[2148]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释至100um的储备浓度。
[2149]
方法:
[2150]
使用以下步骤进行寡核苷酸的连接反应:
[2151]
1.将12μl无菌蒸馏水(elga veolia)添加到1.5ml eppendorf管中。
[2152]
2.然后将30μl 2x t3 dna连接酶反应缓冲液neb(132mm tris-hcl、20mm mgcl2、2mm二硫苏糖醇、2mm atp、15%聚乙二醇(peg6000),ph 7.6,25℃)和2μl 40mm mncl2添加到同一eppendorf管中。
[2153]
3.将5μl 2-脱氧肌苷(in)链(200μmol/l)(seq id:no 71)和5μl辅助链(200μmol/l)(seq id:no 72)以及1μl tamra或任何荧光标记的平末端多核苷酸(20μmol/l)(seq id:no 70)添加到同一试管中。
[2154]
4.将5μl t3 dna连接酶neb(3000单位/μl)添加到同一试管中。
[2155]
5.然后将反应混合物在室温下孵育30分钟。
[2156]
6.在孵育时间过去之后,通过添加tbe-尿素样品缓冲液(novex)终止反应。
[2157]
结果
[2158]
结果在图59中示出。
[2159]
实施例15.使用突出端连接,示例性地将多核苷酸连接分子连接至支架多核苷酸。
[2160]
本实施例描述了使用dna连接酶将多核苷酸连接分子连接至支架多核苷酸。本实施例涉及具有突出末端的分子的连接,这与如图5中所描绘的本发明合成方法版本4以及如
图8中所描绘的本发明合成方法版本4的另外的变体一致。
[2161]
图60提供了描绘dna合成反应循环的方案。该方案旨在与如图5中所描绘的本发明合成方法版本4一致。因此,图60中的方案示出具有突出末端的支架多核苷酸(该方案的最上面的小图中的右手发夹结构)的提供,左链对应于支持链并且右链对应于合成链。支持链的末端核苷酸占据位置n并突出于合成链的末端核苷酸。支持链的末端核苷酸仅出于说明目的被描绘为“t”并且在5’末端包含磷酸基团。在该循环的下一步骤中,提供了多核苷酸连接分子(方案最上面部分的最右边的结构)。多核苷酸连接分子具有支持链(左链)和辅助链(右链)。多核苷酸连接分子具有互补连接末端,该末端具有突出的末端并且包括2-脱氧肌苷(in)的通用核苷酸。辅助链在互补连接末端的末端包括不可连接的核苷酸,并突出于支持链的末端核苷酸。支持链在互补连接末端的末端仅包括预定序列的核苷酸,其被描述为“g”,仅用于例示。将多核苷酸连接分子连接至支架多核苷酸后,将多核苷酸连接分子互补连接末端的支持链末端核苷酸连接至支架多核苷酸支持链末端核苷酸,并且在多核苷酸连接分子的辅助链和支架多核苷酸的合成链之间产生单链断裂(“缺口”)。多核苷酸连接分子的支持链的末端核苷酸包括预定序列的核苷酸,并且位于位置n 1。通用核苷酸因此占据位置n 3。连接后,通过在位置n 1与n 2之间裂解支持链来裂解多核苷酸连接分子。在图60所示的反应方案中,辅助链被示出为在裂解之前作为任选步骤被去除。裂解后,预定序列的核苷酸保留在支架多核苷酸中,作为支持链在突出末端的末端核苷酸。在下一步骤中,在此情况下,仅出于说明目的,通过聚合酶或核苷酸转移酶的作用将另外的核苷酸(仅描述为“a”)掺入到支架多核苷酸的合成链中。所述另外的核苷酸包含可逆终止子基团或封闭基团。纯粹为了举例说明,另外的核苷酸与支持链中的配偶体核苷酸配对,在这种情况下被描绘为“t”,从而形成核苷酸对。然后,该方案描绘了脱保护或解封闭步骤,其中去除了可逆终止子基团或封闭基团,从而完成合成循环。
[2162]
图61提供了描绘dna合成反应循环的类似方案。该方案旨在与如图8中所描绘的本发明合成方法版本4的另外的变体一致,其中突出端的长度可以从单碱基突出端延长至两个、三个、四个或更多个碱基的突出端。
[2163]
如下文所详述,该实施例15描述了将多核苷酸连接分子连接至支架多核苷酸的步骤,如图60和61中的虚线框中所示。
[2164]
材料和方法
[2165]
材料:
[2166]
1.在本实施例中使用的寡核苷酸是在室内设计的,并由integrated dna技术合成。这些在图62中进行了描述。
[2167]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释到100μm的储备浓度。
[2168]
方法:
[2169]
使用以下步骤进行寡核苷酸的连接反应:
[2170]
1.将12μl无菌蒸馏水(elga veolia)添加到1.5ml eppendorf管中。
[2171]
2.然后将30μl 2x t3 dna连接酶反应缓冲液neb(132mm tris-hcl,20mm mgcl2、2mm二硫苏糖醇,2mm atp,15%聚乙二醇(peg6000)并且ph为7.6,25℃)和2μl 40mm mncl2添加到同一eppendorf管中。
[2172]
3.将5μl 2-脱氧肌苷(in)链(200μmol/l)(seq id:no 78)和5μl辅助链(200μmol/
l)(seq id:no 79、80)以及1μl tamra或任何具有5’突出端的荧光标记的多核苷酸(20μmol/l)(seq id:no 73、74、75、76或77)添加到同一试管中。
[2173]
4.将5μl t3 dna连接酶neb(3000单位/μl)添加到同一试管中。
[2174]
5.然后将反应混合物在室温下孵育30分钟。
[2175]
6.在孵育时间过去之后,通过添加tbe-尿素样品缓冲液(novex)终止反应。
[2176]
结果
[2177]
结果在图63中示出。
[2178]
实施例16.将多核苷酸连接分子示例性地连接至平末端发夹多核苷酸的3’末端,然后进行位点特异性裂解。
[2179]
本实施例描述了通过连接包含用作通用核苷酸的2-脱氧尿苷的多核苷酸连接分子,将单个核苷酸(鸟苷)添加到平末端发夹多核苷酸的3’末端,然后对尿苷位点5’的第1个磷酸二酯键进行位点特异性裂解,如图64a所描绘。
[2180]
连接步骤
[2181]
连接步骤描述了在辅助链的存在下使用dna连接酶将多核苷酸连接分子连接至平末端多核苷酸的3’末端的方案。包含通用核苷酸(尿苷)的多核苷酸连接分子需要在5’末端进行磷酸化。为了防止辅助链的连接,通过在3’末端存在2’,3
’‑
双脱氧核苷酸封闭辅助链的3’末端,所述核苷酸与包含通用核苷酸(尿苷)的多核苷酸连接分子的5’末端的末端核苷酸互补。
[2182]
材料和方法
[2183]
材料
[2184]
1.在本实施例中使用的寡核苷酸是内部设计的并由integrated dna technologies合成。
[2185]
这些在图64c中进行了描述。
[2186]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释至100μm的储备浓度。
[2187]
方法
[2188]
使用以下步骤进行寡核苷酸的连接反应:
[2189]
1.将30μl的2x t3 dna连接酶反应缓冲液neb(132mm tris-hcl、20mm mgcl2、2mm二硫苏糖醇、2mm atp、15%聚乙二醇(peg6000),ph 7.6,25℃)和2μl的40mm mncl2添加到同一eppendorf管中。
[2190]
2.将2.8μl的无菌蒸馏水(elga veolia)添加到1.5ml eppendorf管中。
[2191]
3.将10μl的2-脱氧尿苷(u)链(200μmol/l)(seq id:no 85)和10μl辅助链(200μmol/l)(seq id:no 86)添加到同一试管中。
[2192]
4.将0.2μl tamra 或任何荧光标记的平末端发夹多核苷酸(seq id:no 84)(10μmol/l)添加到同一试管中。
[2193]
5.将5μl的t3 dna连接酶neb(3000单位/μl)添加到同一试管中。
[2194]
6.然后将反应混合物在室温下孵育15分钟。
[2195]
7.在孵育时间过去之后,通过添加tbe-尿素样品缓冲液(novex)终止反应并且获得5μl等分试样用于凝胶分析。
[2196]
8.在孵育时间过去之后,使用qiagen核苷酸去除试剂盒纯化反应混合物。
[2197]
裂解步骤
[2198]
第二步骤描述了使用尿嘧啶dna糖基化酶和ap核酸内切酶1裂解连接的多核苷酸,所述酶裂解通用核苷酸(尿嘧啶)5’的第1个磷酸二酯键。
[2199]
材料和方法
[2200]
材料:
[2201]
1.在本实施例中使用的寡核苷酸是内部设计的并由integrated dna technologies合成。这些在图64c中进行了描述。
[2202]
2.使用无菌去离子水(elga veolia)将寡核苷酸稀释至100μm的储备浓度。
[2203]
方法:
[2204]
使用以下程序进行寡核苷酸的裂解反应:
[2205]
1.将31μl tamra或来自连接反应的任何荧光标记的多核苷酸添加到1.5ml eppendorf管中。
[2206]
2.然后将4μl的10x neb缓冲液4(500mm乙酸钾、200mm tris-乙酸盐、100mm乙酸镁、1000μg/ml牛,ph 7.9)添加到同一eppendorf管中。
[2207]
3.添加1μl的尿嘧啶dna糖基化酶(udg)(10单位/μl)和5μl的ap核酸内切酶i(neb)(10单位/μl)。
[2208]
4.然后通过用移液管重悬轻柔地混合反应混合物,在13,000rpm下离心5秒并在室温下孵育30分钟。
[2209]
5.在孵育时间过去后,通过添加凝胶上样缓冲液ii(invitrogen)终止反应。
[2210]
结果
[2211]
结果在图64中示出。
[2212]
实施例17.将多核苷酸连接分子示例性地连接至具有3’单碱基突出端的发夹多核苷酸的5’末端,然后进行位点特异性裂解。
[2213]
本实施例描述了通过连接包含用作通用核苷酸的肌苷的多核苷酸连接分子,将单个核苷酸(胞苷)添加到具有3’单碱基突出端的发夹多核苷酸的5’末端,然后对肌苷位点3’的第2个磷酸二酯键进行位点特异性裂解,如图65a所描绘。
[2214]
连接步骤
[2215]
连接步骤描述了在辅助链的存在下使用dna连接酶将多核苷酸连接分子连接至3’单碱基突出的多核苷酸的5’末端的方案。辅助链在5’末端缺少磷酸。
[2216]
材料和方法
[2217]
材料:
[2218]
1.在本实施例中使用的寡核苷酸是内部设计的并由integrated dna technologies合成。
[2219]
这些在图65c中进行了描述。
[2220]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释至100μm的储备浓度。
[2221]
方法:
[2222]
使用以下步骤进行寡核苷酸的连接反应:
[2223]
1.将30μl的2x t3 dna连接酶反应缓冲液neb(132mm tris-hcl、20mm mgcl2、2mm二硫苏糖醇、2mm atp、15%聚乙二醇(peg6000),ph 7.6,25℃)和2μl的40mm mncl2添加到
同一eppendorf管中。
[2224]
2.将2.8μl的无菌蒸馏水(elga veolia)添加到1.5ml eppendorf管中。
[2225]
3.将10μl的2-脱氧肌苷(in)链(200μmol/l)(seq id:no 88)和10μl辅助链(200μmol/l)(seq id:no 89)添加到同一试管中。
[2226]
4.将0.2μl tamra或任何荧光标记的具有3’单碱基突出端的用于连接的发夹多核苷酸(seq id:no 87)(10μmol/l)添加到同一试管中。
[2227]
5.将5μl的t3 dna连接酶neb(3000单位/μl)添加到同一试管中。
[2228]
6.然后将反应混合物在室温下孵育15分钟。
[2229]
7.在孵育时间过去之后,通过添加tbe-尿素样品缓冲液(novex)终止反应并且获得5μl等分试样用于凝胶分析。
[2230]
8.在孵育时间过去之后,使用qiagen核苷酸去除试剂盒纯化反应混合物。
[2231]
裂解步骤
[2232]
裂解步骤描述了使用核酸内切酶v裂解连接的多核苷酸,所述酶裂解通用核苷酸(肌苷)3’的第2个磷酸二酯键。
[2233]
材料和方法
[2234]
材料:
[2235]
1.在本实施例中使用的寡核苷酸是内部设计的并由integrated dna technologies合成。这些在图65c中进行了描述。
[2236]
2.使用无菌去离子水(elga veolia)将寡核苷酸稀释至100μm的储备浓度。
[2237]
方法:
[2238]
使用以下程序进行寡核苷酸的裂解反应:
[2239]
1.将31μl tamra或来自连接反应的任何荧光标记的多核苷酸添加到1.5ml eppendorf管中。
[2240]
2.然后将4μl的10x neb缓冲液4(500mm乙酸钾、200mm tris-乙酸盐、100mm乙酸镁、1000μg/ml牛,ph 7.9)添加到同一eppendorf管中。
[2241]
3.添加5μl的核酸内切酶v(3单位/μl)。
[2242]
4.然后通过用移液管重悬轻柔地混合反应混合物,在13,000rpm下离心5秒并在室温下孵育30分钟。
[2243]
5.在孵育时间过去之后,通过添加tbe-尿素样品缓冲液(novex)终止反应。
[2244]
结果
[2245]
结果在图65中示出。
[2246]
实施例18.将多核苷酸连接分子示例性地连接至平末端发夹多核苷酸的5’末端,然后进行位点特异性裂解。
[2247]
本实施例描述了通过连接包含用作通用核苷酸的尿苷的多核苷酸连接分子,将单个核苷酸(胞苷)添加至平末端发夹多核苷酸的5’末端,然后对尿苷3’和5’两者的第1个磷酸二酯键进行位点特异性裂解,如图66a所描绘。
[2248]
连接步骤
[2249]
连接步骤描述了在辅助链的存在下使用dna连接酶将多核苷酸连接分子连接至平末端多核苷酸的5’末端的方案。辅助链在5’末端缺少磷酸。
[2250]
材料和方法
[2251]
材料:
[2252]
1.在本实施例中使用的寡核苷酸是内部设计的并由integrated dna technologies合成。
[2253]
这些在图66c中进行了描述。
[2254]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释至100μm的储备浓度。
[2255]
方法:
[2256]
使用以下步骤进行寡核苷酸的连接反应:
[2257]
1.将30μl的2x t3 dna连接酶反应缓冲液neb(132mm tris-hcl、20mm mgcl2、2mm二硫苏糖醇、2mm atp、15%聚乙二醇(peg6000),ph 7.6,25℃)和2μl的40mm mncl2添加到同一eppendorf管中。
[2258]
2.将2.8μl的无菌蒸馏水(elga veolia)添加到1.5ml eppendorf管中。
[2259]
3.将10μl的2-脱氧尿苷(u)链(200μmol/l)(seq id:no 91)和10μl辅助链(200μmol/l)(seq id:no 92)添加到同一试管中。
[2260]
4.将0.2μl tamra或任何荧光标记的平末端发夹多核苷酸(seq id:no 90)(10μmol/l)添加到同一试管中。
[2261]
5.将5μl的t3 dna连接酶neb(3000单位/μl)添加到同一试管中。
[2262]
6.然后将反应混合物在室温下孵育15分钟。
[2263]
7.在孵育时间过去之后,通过添加tbe-尿素样品缓冲液(novex)终止反应并且获得5μl等分试样用于凝胶分析。
[2264]
8.在孵育时间过去之后,使用qiagen核苷酸去除试剂盒纯化反应混合物。
[2265]
裂解步骤
[2266]
裂解步骤描述了使用含有尿嘧啶dna糖基化酶和核酸内切酶viii的反应混合物裂解连接的多核苷酸,所述反应混合物裂解通用核苷酸(尿苷)3’和5’的第1个磷酸二酯键。
[2267]
材料和方法
[2268]
材料:
[2269]
1.在本实施例中使用的寡核苷酸是内部设计的并由integrated dna technologies合成。这些在图66b中进行了描述。
[2270]
2.使用无菌去离子水(elga veolia)将寡核苷酸稀释至100μm的储备浓度。
[2271]
方法:
[2272]
使用以下程序进行寡核苷酸的裂解反应:
[2273]
1.将31μl tamra或来自连接反应的任何荧光标记的多核苷酸添加到1.5ml eppendorf管中。
[2274]
2.然后将4μl的10x cut smart缓冲液(500mm乙酸钾、200mm tris-乙酸盐、100mm乙酸镁、1000μg/ml牛,ph 7.9)添加到同一eppendorf管中。
[2275]
3.将5μl的user酶(尿嘧啶dna糖基化酶(udg)和核酸内切酶viii的混合物)(1单位/μl)添加到同一试管中。
[2276]
4.然后通过用移液管重悬轻柔地混合反应混合物,在13,000rpm下离心5秒并在室温下孵育30分钟。
[2277]
5.在孵育时间过去之后,通过添加tbe-尿素样品缓冲液(novex)终止反应。
[2278]
结果
[2279]
结果在图66中示出。
[2280]
实施例19.将多核苷酸连接分子示例性地连接至具有5’单碱基突出端的发夹多核苷酸的3’末端,然后进行位点特异性裂解。
[2281]
本实施例描述了通过连接包含用作通用核苷酸的尿苷的多核苷酸连接分子,将单个核苷酸(鸟苷)添加至具有5’单碱基突出端的发夹多核苷酸的3’末端,然后对尿苷位点5’的第1个磷酸二酯键进行位点特异性裂解,如图67a所描绘。
[2282]
连接步骤
[2283]
连接步骤描述了在辅助链的存在下使用dna连接酶将多核苷酸连接至5’单碱基突出的多核苷酸的3’末端的方案。包含通用核苷酸(尿苷)的多核苷酸连接分子需要在5’末端进行磷酸化。为了防止辅助链的连接,通过在3’末端存在2’,3
’‑
双脱氧核苷酸封闭辅助链的3’末端,所述核苷酸与多核苷酸连接分子在5’末端的通用核苷酸互补。
[2284]
材料和方法
[2285]
材料:
[2286]
1.在本实施例中使用的寡核苷酸是内部设计的并由integrated dna technologies合成。
[2287]
这些在图67c中进行了描述。
[2288]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释至100μm的储备浓度。
[2289]
方法:
[2290]
使用以下步骤进行寡核苷酸的连接反应:
[2291]
1.将30μl的2x t3 dna连接酶反应缓冲液neb(132mm tris-hcl、20mm mgcl2、2mm二硫苏糖醇、2mm atp、15%聚乙二醇(peg6000),ph 7.6,25℃)和2μl的40mm mncl2添加到同一eppendorf管中。
[2292]
2.将2.8μl的无菌蒸馏水(elga veolia)添加到1.5ml eppendorf管中。
[2293]
3.将10μl的2-脱氧尿苷(u)链(200μmol/l)(seq id:no 94)和10μl辅助链(200μmol/l)(seq id:no 93)添加到同一试管中。
[2294]
4.将0.2μl tamra或任何荧光标记的具有5’单碱基突出端的发夹多核苷酸(seq id:no93)(10μmol/l)添加到同一试管中。
[2295]
5.将5μl的t3 dna连接酶neb(3000单位/μl)添加到同一试管中。
[2296]
6.然后将反应混合物在室温下孵育15分钟。
[2297]
7.在孵育时间过去之后,通过添加tbe-尿素样品缓冲液(novex)终止反应并且获得5μl等分试样用于凝胶分析。
[2298]
8.在孵育时间过去之后,使用qiagen核苷酸去除试剂盒纯化反应混合物。
[2299]
裂解步骤
[2300]
裂解步骤描述了使用含有尿嘧啶dna糖基化酶和ap核酸内切酶1的裂解反应混合物裂解连接的多核苷酸,所述反应混合物裂解通用核苷酸(尿苷)5’的第1个磷酸二酯键。
[2301]
材料和方法
[2302]
材料:
[2303]
1.在本实施例中使用的寡核苷酸是内部设计的并由integrated dna technologies合成。这些在图67c中进行了描述。
[2304]
2.使用无菌去离子水(elga veolia)将寡核苷酸稀释至100μm的储备浓度。
[2305]
方法:
[2306]
使用以下程序进行寡核苷酸的裂解反应:
[2307]
1.将30μl tamra或来自连接反应的任何荧光标记的多核苷酸添加到1.5ml eppendorf管中。
[2308]
2.然后将4μl的10x neb缓冲液4(500mm乙酸钾、200mm tris-乙酸盐、100mm乙酸镁、10mm dtt,ph 7.9)添加到同一eppendorf管中。
[2309]
3.将1μl的尿嘧啶dna糖基化酶(udg)(5u/μl)和5μl的ap核酸内切酶i(neb)(10单位/μl)添加到同一试管中。
[2310]
4.然后通过用移液管重悬轻柔地混合反应混合物,在13,000rpm下离心5秒并在室温下孵育30分钟。
[2311]
5.在孵育时间过去之后,通过添加tbe-尿素样品缓冲液(novex)终止反应。
[2312]
结果
[2313]
结果在图67中示出。
[2314]
实施例20.将多核苷酸连接分子示例性地连接至具有5’单碱基突出端的发夹多核苷酸的3’末端,然后进行位点特异性裂解,从而在3’末端留下磷酸。
[2315]
本实施例描述了通过连接包含用作通用核苷酸的尿苷的多核苷酸连接分子,将单个核苷酸(鸟苷)添加至具有5’单碱基突出端的发夹多核苷酸的3’末端,然后对尿苷5’和3’两者的第1个磷酸二酯键进行位点特异性裂解,从而留下附接至发夹多核苷酸的3’末端的磷酸,如图68所描绘。
[2316]
连接步骤
[2317]
连接步骤描述了在辅助链的存在下使用dna连接酶将多核苷酸连接分子连接至5’单碱基突出的多核苷酸的3’末端的方案。包含通用核苷酸(尿苷)的多核苷酸连接分子需要在5’末端进行磷酸化。为了防止辅助链的连接,通过在3’末端存在2’,3
’‑
双脱氧核苷酸封闭辅助链的3’末端,所述核苷酸与多核苷酸连接分子在5’末端的通用核苷酸互补。
[2318]
材料和方法
[2319]
材料:
[2320]
1.在本实施例中使用的寡核苷酸是内部设计的并由integrated dna technologies合成。
[2321]
这些在图68c中进行了描述。
[2322]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释至100μm的储备浓度。
[2323]
方法:
[2324]
使用以下步骤进行寡核苷酸的连接反应:
[2325]
1.将30μl的2x t3 dna连接酶反应缓冲液neb(132mm tris-hcl、20mm mgcl2、2mm二硫苏糖醇、2mm atp、15%聚乙二醇(peg6000),ph 7.6,25℃)和2μl的40mm mncl2添加到同一eppendorf管中。
[2326]
2.将2.8μl的无菌蒸馏水(elga veolia)添加到1.5ml eppendorf管中。
[2327]
3.将10μl的2-脱氧尿苷(u)链(200μmol/l)(seq id:no 97)和10μl辅助链(200μmol/l)(seq id:no 98)添加到同一试管中。
[2328]
4.将0.2μl tamra或任何荧光标记的含有2
’‑
脱氧尿苷的发夹多核苷酸(seq id:no 96)(10μmol/l)添加到同一试管中。
[2329]
5.将5μl的t3 dna连接酶neb(3000单位/μl)添加到同一试管中。
[2330]
6.然后将反应混合物在室温下孵育15分钟。
[2331]
7.在孵育时间过去之后,通过添加tbe-尿素样品缓冲液(novex)终止反应并且获得5μl等分试样用于凝胶分析。
[2332]
8.在孵育时间过去之后,使用qiagen核苷酸去除试剂盒纯化反应混合物。
[2333]
裂解步骤
[2334]
裂解步骤描述了使用含有尿嘧啶dna糖基化酶和核酸内切酶viii的裂解反应混合物裂解多核苷酸,所述反应混合物裂解通用核苷酸(尿苷)5’和3’两者的第1个磷酸二酯键,从而在发夹多核苷酸上留下3’磷酸。
[2335]
材料和方法
[2336]
材料:
[2337]
1.在本实施例中使用的寡核苷酸是内部设计的并由integrated dna technologies合成。这些在图68c中进行了描述。
[2338]
2.使用无菌去离子水(elga veolia)将寡核苷酸稀释至100μm的储备浓度。
[2339]
方法:
[2340]
使用以下程序进行寡核苷酸的裂解反应:
[2341]
1.将31μl tamra或来自连接反应的任何荧光标记的多核苷酸添加到1.5ml eppendorf管中。
[2342]
2.然后将4μl的10x cut smart缓冲液(500mm乙酸钾、200mm tris-乙酸盐、100mm乙酸镁、1000μg/ml牛,ph 7.9)添加到同一eppendorf管中。
[2343]
3.将5μl的user酶(尿嘧啶dna糖基化酶(udg)和核酸内切酶viii(neb)的混合物)(1单位/μl)添加到同一试管中。
[2344]
4.然后通过用移液管重悬轻柔地混合反应混合物,在13,000rpm下离心5秒并在室温下孵育30分钟。
[2345]
5.在孵育时间过去之后,通过酶促热灭活(即95℃,10分钟)终止反应。
[2346]
结果
[2347]
结果在图68中示出。
[2348]
实施例21.示例性地去除裂解发夹3’末端的磷酸基团,然后将多核苷酸连接分子连接至平末端发夹的3’末端。
[2349]
本实施例描述了使用核酸内切酶iv去除平末端发夹多核苷酸3’末端的磷酸基团,然后将多核苷酸连接分子连接至平末端发夹多核苷酸的3’末端。进行多核苷酸连接分子与3
’‑
磷酸化的平末端多核苷酸的连接作为负对照。
[2350]
去磷酸化步骤
[2351]
去磷酸化步骤去除3’末端的磷酸基团,使5’末端的磷酸基团保持完整,并使用核酸内切酶iv进行。
[2352]
材料和方法
[2353]
材料:
[2354]
1.在本实施例中使用的寡核苷酸是内部设计的并由integrated dna technologies合成。这些在图69c中进行了描述。
[2355]
2.使用无菌去离子水(elga veolia)将寡核苷酸稀释至100μm的储备浓度。
[2356]
方法:
[2357]
使用以下程序进行寡核苷酸的去磷酸化反应:
[2358]
1.将48μl去离子水添加到1.5ml eppendorf管中。
[2359]
2.然后将1μl tamra或任何荧光标记的多核苷酸(10μm)添加到同一eppendorf管中。
[2360]
3.然后将6μl 10x neb缓冲液3(1000mm nacl、500mm tris-hcl、100mm氯化镁、10mm dtt,ph 7.9)添加到同一eppendorf管中。
[2361]
4.将5μl核酸内切酶iv(1单位/μl)添加到同一试管中。
[2362]
5.然后通过用移液管重悬轻柔地混合反应混合物,在13,000rpm下离心5秒并在室温下孵育30分钟。
[2363]
6.在孵育时间过去之后,通过酶促热灭活(即95℃,10分钟)终止反应。
[2364]
连接步骤
[2365]
连接步骤描述了在辅助链的存在下使用dna连接酶将寡核苷酸连接至去磷酸化的平末端多核苷酸的3’末端。作为负对照进行未去磷酸化的平末端发夹的连接。包含通用核苷酸(尿苷)的多核苷酸连接分子需要在5’末端进行磷酸化。为了防止辅助链的连接,通过在3’末端存在2’,3
’‑
双脱氧核苷酸封闭辅助链的3’末端,所述核苷酸与包含通用核苷酸(尿苷)的多核苷酸连接分子在5’末端的末端核苷酸互补。
[2366]
材料和方法
[2367]
材料:
[2368]
1.在本实施例中使用的寡核苷酸是内部设计的并由integrated dna technologies合成。
[2369]
2.使用无菌蒸馏水(elga veolia)将寡核苷酸稀释至100um的储备浓度。
[2370]
方法:
[2371]
使用以下步骤进行寡核苷酸的连接反应:
[2372]
1.将30μl的2x t3 dna连接酶反应缓冲液neb(132mm tris-hcl、20mm mgcl2、2mm二硫苏糖醇、2mm atp、15%聚乙二醇(peg6000),ph 7.6,25℃)和2μl的40mm mncl2添加到同一eppendorf管中。
[2373]
2.将2.8μl的无菌蒸馏水(elga veolia)添加到1.5ml eppendorf管中。
[2374]
3.将10μl的2-脱氧尿苷(u)链(200μmol/l)(seq id:no 100)和10μl辅助链(200μmol/l)(seq id:no 101)添加到同一试管中。
[2375]
4.将0.2μl tamra或任何荧光标记的发夹多核苷酸(seq id:no 99)(10μmol/l)添加到同一试管中。
[2376]
5.将5μl的t3 dna连接酶neb(3000单位/μl)添加到同一试管中。
[2377]
6.然后将反应混合物在室温下孵育15分钟。
[2378]
7.在孵育时间过去之后,通过添加tbe-尿素样品缓冲液(novex)终止反应并且获得5μl等分试样用于凝胶分析。
[2379]
8.在孵育时间过去之后,使用qiagen核苷酸去除试剂盒纯化反应混合物。
[2380]
结果
[2381]
结果在图68中示出。
[2382]
在上述实施例中,除了seq id no 85、86、89、92、94、95、97、98、99、100、101之外,seq id no 1-101中所示的所有寡核苷酸均在3’末端具有羟基。除了seq id no 7、seq id no 18、seq id no 35、seq id no 70和seq id no 73至77,以及seq id no 84、85、87、90、93、94、96、97、99、100之外,seq id no 1-101中所示的所有寡核苷酸均在5’末端缺少磷酸基团。
[2383]
应当理解,所公开的方法和产品的不同应用可以针对本领域的特定需求。还应理解,本文所使用的术语仅出于对本发明的特定实施方案进行描述的目的而并不旨在是限制性的。
[2384]
如在本说明书和所附权利要求中所使用的,单数形式“一个(a)”、“一种(an)”和“所述(the)”包含复数指示物,除非上下文另外明确指明。因此,例如,提及“多核苷酸连接分子”包括两个或更多个这样的多核苷酸,提及“支架多核苷酸”包括两个或更多个这样的支架多核苷酸,等等。
[2385]
本文所引用的所有公开、专利和专利申请特此通过引用整体并入。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
