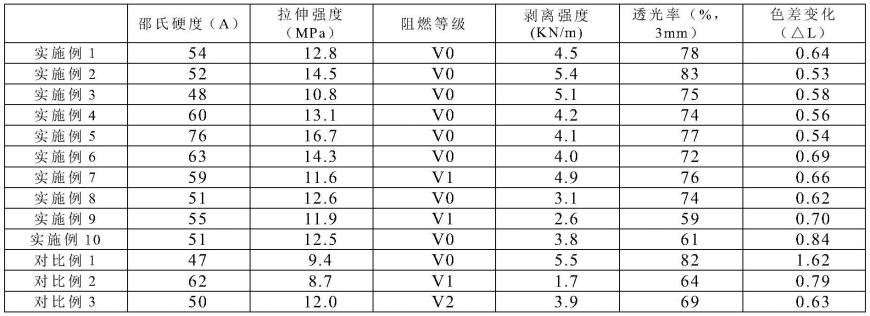
一种由造血干祖细胞向nk细胞分化的方法及培养基
技术领域
1.本发明涉及细胞生物学领域,特别涉及一种由造血干祖细胞向nk细胞分化的方法及培养基。
背景技术:
2.自然杀伤细胞(natural killer cell,nk细胞)在人体内来源于骨髓淋巴样干细胞,其分化、发育依赖于骨髓及胸腺微环境,主要分布于骨髓、外周血、肝、脾、肺和淋巴结。
3.nk细胞介导天然免疫应答,不同于t细胞和b细胞,它不依赖抗体和补体,即能直接杀伤靶细胞,如肿瘤细胞或受病毒感染的细胞等;此外,尚有免疫调节功能,也参与移植排斥反应和某些自身免疫病的发生发展。由于nk细胞的杀伤活性无mhc限制,不依赖抗体,因此称为自然杀伤活性。nk细胞作用于靶细胞后杀伤作用出现早,在体外1小时、体内4小时即可见到杀伤效应。nk细胞的靶细胞主要有某些肿瘤细胞(包括部分细胞系)、病毒感染细胞、某些自身组织细胞(如血细胞)、寄生虫等,因此nk细胞是机体抗肿瘤、抗感染的重要免疫因素,也参与第ⅱ型超敏反应和移植物抗宿主反应。
4.nk细胞在免疫治疗领域具有广泛的应用前景,nk细胞的异体移植已经取得了成功,尤其是2020年在《新英格兰医学杂志》上报道的研究成果,首次实现异体car-nk用于临床免疫治疗。该研究通过改造公共脐带血库来源的nk细胞,建立异体car-nk,靶向复发和难治的cd19
淋巴瘤和慢性淋系白血病,取得了临床1期和2期实验成功。
5.nk细胞可从外周血、脐带血和ipsc或hsc中采集或分化培养而来。目前主流的car-nk研究常采用脐带血(cord blood,cb)或ipsc来源的nk细胞。cb来源的nk细胞可通过从脐血中富集cd34
造血祖细胞(hspc)后再分化培养为nk细胞。然后用慢病毒/逆转录病毒载体转染nk细胞,形成cb-car-nk。一份脐带血制备的car-nk细胞可治疗约10人,由脐带血hspc经改造分化后可获得更多的car-nk细胞,据估计,一份脐带血hspc来源的car-nk可治疗约100人。
6.原代nk细胞基因修饰效率相对较低,而通过干细胞诱导分化为nk细胞,就便于使用病毒和非病毒等多种方法进行基因修饰,因此与分化的成熟nk细胞相比,脐带血造血干祖细胞可以更有效地工程化并分化为nk细胞。所以采用自基因修饰的hspc细胞作为nk细胞来源不失为一种好方法。目前,已有成熟的方案可以分离和扩增造血干祖细胞,并在含有多种细胞因子的成份确定的培养基中就能分化为nk细胞。但是一份脐带血中造血干祖细胞数量有限,分化得到的nk细胞效率低下,nk细胞总产量低就限制了其在临床治疗上的应用,增加了工业化生产成本和批次差异性。因此,为了解决上述问题,建立高效率的nk细胞分化方案迫在眉睫。
技术实现要素:
7.本发明的一个方面,是针对现有技术中nk细胞分化效率低下的缺点,提供了一种由造血干祖细胞向nk细胞分化的方法及培养基。
8.本发明提供的技术方案为:
9.一种由造血干祖细胞向nk细胞分化的方法,在nk细胞分化阶段提高细胞分化培养基的渗透压。
10.在本发明的某些实施方式中,上述方法具体可以包括:
11.步骤1)获得造血干祖细胞;
12.步骤2)对所获得的造血干祖细胞进行扩增;
13.步骤3)对获得的造血干祖细胞进行分化。
14.在本发明中,上述造血干祖细胞为哺乳动物造血干祖细胞,优选为人造血干祖细胞。
15.在本发明中,所述造血干祖细胞(hspc)即造血干细胞(hsc)和/或造血祖细胞(hpc)。其中,造血祖细胞是造血干细胞在一定的微环境和某些因素的调节下,增殖分化为各类血细胞的祖细胞,称造血祖细胞(hematopoietic progenitor cells,hpc),它也是一种相当原始的具有增殖能力的细胞,但已失去多向分化能力,只能向一个或几个血细胞系定向增殖分化,故也称定向干细胞(committed stem cell)。人造血干细胞和造血祖细胞通常表达cd34表面标记。
16.在本发明中,使用常规方法分离、纯化、富集cd34
细胞。例如,wen et al.effective control of large deletions after double-strand breaks by homology-directed repair and dsodn insertion.genome biology,2021中记载的利用microbead kit(miltenyibiotec)进行cd34
细胞的获得。
17.在本发明中,上述造血干祖细胞(cd34
细胞)可以有多种不同来源。例如,在本发明的某些实施方式中,上述造血干祖细胞可以来源于外周血或脐带血,上述造血干细胞还可以来源于骨髓。在本发明的另一些实施方式中,上述造血干祖细胞可以为经诱导分化得到的造血干祖细胞。例如,由诱导多能性干细胞(ipsc)经分化得到造血干祖细胞。在本发明的另一些实施方式中,上述造血祖细胞还可以为由某些特定细胞经重编程后在造血谱系中产生的造血祖细胞。作为优选,在本发明的一个实施方式中,上述造血干祖细胞为脐带血来源的造血干祖细胞。
18.在本发明中,上述造血干祖细胞(cd34
细胞)也可以为经过改造从而使其具有某些特定功能后,再进行向nk细胞分化的过程。例如,在本发明的一个实施方式中,利用crispr-cas9等基因编辑技术对造血干祖细胞进行改造。在本发明的另一个实施方式中,将包含外源基因,例如,嵌合抗原受体(car)基因的病毒载体转入到所述造血干祖细胞中对其进行改造。
19.在本发明中,可以对由步骤1)所获得的造血干祖细胞进行预扩增。
20.可以利用现有技术中的某些方法对富集得到的cd34
细胞进行扩增。在本发明的某些实施方式中,预扩增培养基所使用基础培养基可以为,例如,sfem2(stemcell technologies,09655)。另外,可以在基础培养基中添加细胞因子、细胞分化动员剂等其他物质,例如,包括但不限于,scf、tpo、igf-2、fgf-1、flt-3l、il-6、sr1、um171、il-3、notch配体、其他芳烃受体拮抗剂家族的小分子化合物、g-csf、gm-csf、lif、mip-1α,或其组合。作为优选,在本发明的一个实施方式中,所述预扩增培养基包括sfem2(stemcell technologies,09655) 100ng/ml tpo 100ng/ml scf 100ng/ml flt-3l 50ng/ml il-6
溶液或乳酸钠中的一种或几种;上述无机盐的缓冲液可以为磷酸缓冲盐溶液(pbs溶液)。
33.更优选地,在本发明的一个实施方式中,上述无机盐的溶液为nacl溶液。
34.进一步优选地,在本发明的一个实施方式中,所述nacl溶液为质量分数8%~10%的氯化钠水溶液,所述磷酸盐缓冲液为5
×
~12
×
pbs溶液;
35.进一步优选地,在本发明的一个实施方式中,所述nacl溶液为质量分数9%的氯化钠水溶液,所述磷酸盐缓冲液为10
×
pbs溶液。
36.在本发明中,通过向所述细胞分化培养基中加入能够提高渗透压的物质来提高所述细胞分化培养基的渗透压的方法可以为,例如,在本发明的某些实施方式中,使用能够提高渗透压的物质增加nk分化培养基的渗透压(osmoticpressure),或使用无菌水来降低渗透压,将未调节渗透压的nk分化培养基设定为1xsfemii(正常渗透压),每1毫升nk分化培养基添加111微升无菌水设定为0.9xsfemii(正常渗透压),每1毫升nk分化培养基分别添加11.2,22.4,33.6,44.8,56.0和67.2微升的能够提高渗透压的物质分别设定为1.1x,1.2x,1.3x,1.4x,1.5x和1.6xsfemii(正常渗透压),所有渗透压调节的nk分化培养基均预先配置混合均匀后,再混入细胞或者加入到培养细胞的培养孔中。
37.在本发明的一个实施方式中,上述能够提高渗透压的物质优选为9%氯化钠水溶液或10
×
pbs缓冲液。
38.具体地,在本发明的一个实施方式中,为每毫升培养基中添加11.2微升~44.8微升上述能够提高渗透压的物质,进一步优选地,为每毫升培养基中添加22.4微升~33.6微升上述能够提高渗透压的物质。
39.当通过浓缩所述细胞分化培养基提高所述渗透压时,可以,例如,在本发明的实施方式中,调节培养装置的湿度使培养液蒸发达到增加渗透压的目的。
40.在本发明中,上述向nk细胞分化阶段的起始时间可以为从步骤1)开始的第4天~第14天,分化完成时间可以为分化完全或获得了足够量的nk细胞为止,例如,在本发明的一个实施方式中,nk细胞分化阶段的时间为第4天~第14天,或第14天~第28天,或第28天~第56天。分化培养的条件可以为35~39℃、3~7%co2培养。
41.本发明的另一个方面,是提供了一种由造血干祖细胞向nk细胞分化的培养基,所述培养基中包含提高所述培养基的渗透压的产品。
42.作为优选,在本发明的某些实施方式中,所述提高所述培养基的渗透压的产品可以为选自无机盐的溶液和/或其缓冲液、蔗糖溶液或葡萄糖溶液中的一种或几种;
43.更优选地,在本发明的一个实施方式中,所述无机盐的溶液为选自nacl溶液、kcl溶液、na2hpo4溶液、nah2po4溶液、k2hpo4溶液、kh2po4溶液、nahco3溶液、cacl2溶液、mgcl2溶液或乳酸钠中的一种或几种;所述无机盐的缓冲液为磷酸缓冲盐溶液(pbs溶液);
44.进一步优选地,在本发明的一个实施方式中,所述无机盐的溶液为nacl溶液;
45.进一步优选地,在本发明的一个实施方式中,所述nacl溶液为质量分数8%~10%的氯化钠水溶液,所述磷酸盐缓冲液为5
×
~12
×
pbs溶液;
46.进一步优选地,在本发明的一个实施方式中,所述nacl溶液为质量分数9%的氯化钠水溶液,所述磷酸盐缓冲液为10
×
pbs溶液。
47.具体地,在本发明的一个实施方式中,上述培养基包括:分化培养基和增强剂;所述增强剂包括氯化钠或磷酸盐缓冲液。
48.本发明的另一个方面,是提供了由造血干祖细胞向nk细胞分化的系统,所述系统在nk细胞分化阶段提高细胞分化培养基的渗透压。
49.上述系统可以为常规的细胞培养系统,即人工环境下的细胞培养系统,也可以为适用于工业化的机械系统,例如,全自动细胞培养系统、使用由柔性包装材料制成的培养袋在封闭系统中自动培养细胞的细胞培养系统,等。可以为二维细胞培养系统,也可以为三维细胞培养系统。可以为实验室环境下的细胞培养系统,也可以为发酵罐、生物反应器等大规模细胞培养系统。
50.本发明的另一个方面,是提供了一种nk细胞,所述nk细胞由上述方法分化得到。
51.本发明的另一个方面,是提供了一种car-nk细胞的制备方法,所述car-nk细胞是由导入了car的造血干祖细胞分化为nk细胞制得,所述造血干祖细胞分化为nk细胞利用上述由造血干祖细胞向nk细胞分化的方法进行。
52.本发明的另一个方面,是提供了一种基因编辑的nk细胞的制备方法,所述基因编辑的nk细胞是采用基因编辑技术,比如talen,crispr-cas9,病毒载体转导技术方式对造血干祖细胞进行基因水平的改造后分化为nk细胞制得,所述造血干祖细胞分化为nk细胞利用上述由造血干祖细胞向nk细胞分化的方法进行。
53.本发明的有益效果为:
54.本发明方法通过对nk细胞分化过程中渗透压的调节,大幅度提高了nk细胞的生产比例和细胞总数,为后续的nk细胞分化和扩增提供了前期技术基础。同时,本发明方法的改造是在目前科研领域较为成熟的nk细胞分化方案的技术上进行的,技术改造操作简便,几乎不额外增加成本,在目前工业化nk细胞生产过程中具有较强的应用前景和显著的行业竞争力。
附图说明
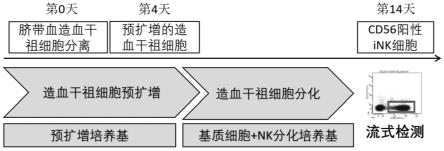
55.图1为本发明实施例中实验流程图;
56.图2为本发明实施例中不同渗透压对分化细胞总数的影响结果图;
57.图3为本发明实施例中不同渗透压对nk分化比例的影响结果图;
58.图4为本发明实施例中不同渗透压对nk细胞总数的影响结果图。
具体实施方式
59.本发明公开了一种由造血干祖细胞向nk细胞分化的方法及培养基,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。需要特别指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明,并且相关人员明显能在不脱离本发明内容、精神和范围的基础上对本文所述内容进行改动或适当变更与组合,来实现和应用本发明技术。
60.在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。术语“如”、“例如”等旨在指示例性实施方案,而不意图限制本公开的范围。
61.下面就本发明中出现的部分术语作以解释。
62.术语“造血干祖细胞”(hspc)即造血干细胞(hsc)和/或造血祖细胞(hpc)。其中,造血祖细胞是造血干细胞在一定的微环境和某些因素的调节下,增殖分化为各类血细胞的祖细胞,称造血祖细胞(hematopoietic progenitor cells,hpc),它也是一种相当原始的具有增殖能力的细胞,但已失去多向分化能力,只能向一个或几个血细胞系定向增殖分化,故也称定向干细胞(committed stem cell)。人造血干细胞和造血祖细胞通常表达cd34表面标记。
63.术语“细胞分化”(cell differentiation)是指同一来源的细胞逐渐产生出形态结构、功能特征各不相同的细胞类群的过程,其结果是在空间上细胞产生差异,在时间上同一细胞与其从前的状态有所不同。细胞分化的本质是基因组在时间和空间上的选择性表达,通过不同基因表达的开启或关闭,最终产生标志性蛋白质。
64.术语“渗透压”是对于两侧水溶液浓度不同的半透膜,为了阻止水从低浓度一侧渗透到高浓度一侧而在高浓度一侧施加的最小额外压强称为渗透压。
65.术语“磷酸缓冲盐溶液”简称为pbs缓冲液,是生物化学研究中使用最为广泛的一种缓冲液,主要成分为na2hpo4、kh2po4、nacl和kcl,一般作为溶剂,起溶解保护试剂的作用。
66.术语“ipsc”,即诱导多能性干细胞,是指通过导入特定的转录因子将终末分化的体细胞重编程为多能性的干细胞。
67.为了使本领域的技术人员更好地理解本发明的技术方案,下面结合具体实施例对本发明作进一步的详细说明。
68.本发明具体实施方式所使用的材料包括:
69.1)脐带血来源的造血干祖细胞,即使用常规方法从脐带血分离cd34阳性的细胞,直接使用或冻存后复苏使用,具体细节可以参考文献wen et al.genome biology,2021
70.2)预扩增培养基,即sfem2(stemcell technologies,09655,下同) 100ng/ml tpo 100ng/ml scf 100ng/ml flt3l 50ng/ml il6 750nmsr1 50nmum171,具体细节可以参考文献wen et al.genome biology,2021
71.3)工程化op9-feeder基质细胞,过表达dll1和dll4
72.4)op9-feeder基质细胞培养基:mem(gibco,12561-056) 20%fbs
73.5)0.1%明胶水溶液
74.6)细胞洗液:mem
75.7)nk分化培养基,即sfem2 20ng/ml tpo 20ng/ml scf 20ng/ml flt3l 20ng/ml il7 50μg/ml l-抗坏血酸(维生素c)
76.8)不同规格的tc培养板和non-tc培养板
77.9)9%质量分数氯化钠溶液
78.10)无菌水
79.11)10
×
pbs(gibco,70011-044)
80.12)accutase(innovative cell technologies,#at104-500)
81.13)pbe,即pbs 2mm edta 2%fbs
82.14)cd56(ncam)monoclonal antibody(cmssb),apc,ebioscience
tm
(ebioscience,17-0567-42)
83.15)cd3 monoclonal antibody(okt3),pe-cyanine7,ebioscience
tm
(ebioscience,25-0037-42)
84.16)pe anti-human cd45(biolegend,304039)
85.17)apc mouse igg1,κisotype ctrl antibody(biolegend,400120)
86.实施例1:
87.本实施例中的nk分化实验以24孔板的一个孔为例,24孔板仅使用中间8个孔,周围16个孔添加无菌水。实验流程如图1所示。
88.1)第0天,hspc预培养:新鲜分离的或复苏的cb cd34
细胞用预扩增培养基于non-tc培养板中培养3天,密度为5x10^5/ml。
89.2)第3天,hspc预扩增:离心上述细胞,用适量培养基重悬细胞并细胞计数,按1x10^5/0.3ml密度在24孔non-tc培养板中用预扩增培养基继续培养1天。
90.3)第3天,准备op9-feeder基质细胞:使用0.1%明胶水溶液覆盖tc培养板皿底,放置于培养箱中孵育20分钟,弃掉明胶后备用;复苏op9-feeder基质细胞,均匀接种于孵育过明胶的tc培养板,用op9-feeder基质细胞培养基培养1天后可以使用;在使用前应弃掉op9-feeder基质细胞培养基,使用细胞洗液清洗残留血清,立即接种下一步所述细胞。
91.4)第4天,nk分化:将培养了4天的cb cd34
细胞离心,弃掉上清,细胞沉淀用1ml nk细胞分化培养基重悬后,接种于op9-feeder基质细胞上,密度7.5x10^3/孔/0.5ml。
92.5)第7天,nk分化:加50%体积的新配置的nk细胞分化培养基,即24孔板每个孔加入0.25ml。
93.6)第11天,nk分化:加50%体积的nk细胞分化培养基,即24孔板每个孔加入0.375ml。
94.7)第14天,nk细胞(或称为ink细胞,induced nk细胞)的检测:收集上清,并用accutase消化贴壁细胞为单细胞悬液,合并到一起,进行细胞计数,离心收集细胞沉淀后用100μl pbe重悬细胞,每个流式染色取20μl细胞悬液,每种抗体添加1微升,4度孵育1小时,pbe洗一次后进行流式检测。
95.实施例2:
96.在实施例1的过程中渗透压调节方法:
97.使用8%~10%,优选为9%(m/v)的氯化钠水溶液,或5
×
~12
×
,优选为10
×
pbs缓冲液增加实施例1中nk分化培养基的渗透压(osmoticpressure),或使用无菌水来降低渗透压,将未调节渗透压的正常渗透压(300mmol/l)培养基设定为1xsfemii,每1毫升nk分化培养基添加111微升无菌水设定为0.9xsfemii,每1毫升nk分化培养基分别添加11.2,22.4,33.6,44.8,56.0和67.2微升的9%氯化钠水溶液或10xpbs缓冲液分别设定为1.1x,1.2x,1.3x,1.4x,1.5x和1.6xsfemii,所有渗透压调节的nk分化培养基均预先配置混合均匀后,再混入细胞或者加入到培养细胞的培养孔中。
98.实验结果:
99.1)不同渗透压对分化细胞总数的影响:如图2所示,在hspc向nk分化的模型中,分化4-14天,渗透压从正常渗透压(300mmol/l)的0.9倍逐渐升高到1.6倍,14天细胞分化总数先上升后下降,在正常渗透压(300mmol/l)的1.1-1.3倍时细胞总数达到最大;
100.2)不同渗透压对nk分化比例的影响:如图3所示,在hspc向nk分化的模型中,分化
4-14天,渗透压从正常渗透压(300mmol/l)的0.9倍逐渐升高到1.6倍,14天nk细胞比例先升高后下降,在正常渗透压(300mmol/l)的1.3-1.4倍时nk细胞比例达到最大;
101.3)不同渗透压对nk细胞总数的影响:如图4所示,通过分化细胞总数和nk分化比例计算得到nk细胞总数,在hspc向nk分化的模型中,分化4-14天,渗透压从正常渗透压(300mmol/l)的0.9倍逐渐升高到1.6倍,14天nk细胞总数先升高后下降,在正常渗透压(300mmol/l)的1.2-1.3倍时nk细胞总数达到最大。
102.实验结论:
103.hsc向nk分化模型中,可以通过调节渗透压提高nk细胞分化效率和nk细胞获得数量,推荐渗透压调节范围是1.1x-1.4x sfemii;
104.为了实现hsc向nk分化模型中nk细胞比例和获得总数最大化,优选为调节渗透压到1.2x-1.3x sfemii;
105.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。