1.本发明涉及酶活提高的精氨酸脱亚胺酶突变体,属于基因工程和酶工程技术领域。
背景技术:
2.精氨酸脱亚胺酶(arginine deiminase,ec 3.5.3.6)简称adi,它能将精氨酸水解,生成瓜氨酸和氨,因此可用于瓜氨酸的生产。精氨酸脱亚胺酶的微生物来源十分广泛,从1933年被首次发现以来,已在乳链球菌、粪链球菌、酵母、假单胞菌、支原体、盐杆菌及部分真核细胞等中发现有该酶存在。不同微生物来源的adi分子量范围,最适ph、最适温度等酶学性质具有明显的差异。
3.目前,adi主要被研究用于瓜氨酸的生产,具有反应条件温和、转化效率高、提取工艺简单等优点,具有较高的研究和生产价值。然而,目前已被报道发现的大部分adi都表现出低比酶活力,这成为adi产业应用的技术瓶颈。因此,寻找催化效率更高、安全稳定的精氨酸脱亚胺酶成为该酶用于功能性食品配料生物制造的关键问题。
技术实现要素:
4.本发明提供了经定点突变改造的精氨酸脱亚胺酶突变体,以奥氏嗜热盐丝菌(halothermothrix orenii)的精氨酸脱亚胺酶基因登录号:nc_011899.1:720621-721853,核苷酸序列如seq id no.1所示,运用定点突变技术获得。
5.在一种实施方式中,所述突变体是将出发酶的第116位天冬氨酸,第203位苏氨酸,第103位丙氨酸,第32位苏氨酸或第345位甘氨酸进行了突变。
6.在一种实施方式中,所述突变体是将出发酶的第116位天冬氨酸突变为甘氨酸,获得突变体n116g,氨基酸序列如seq id no.2所示。
7.在一种实施方式中,所述突变体是将出发酶的第203位苏氨酸突变为甘氨酸,获得突变体t203g,氨基酸序列如seq id no.3所示。
8.在一种实施方式中,所述突变体是将出发酶的第103位丙氨酸突变为酪氨酸,获得突变体a103y,氨基酸序列如seq id no.4所示。
9.在一种实施方式中,所述突变体是将出发酶的第32位苏氨酸突变为酪氨酸,获得突变体t32y,氨基酸序列如seq id no.5所示。
10.在一种实施方式中,所述突变体是将出发酶的第345位甘氨酸突变为丙氨酸,获得突变体g345a,氨基酸序列如seq id no.6所示。
11.本发明还提供了编码所述突变体的基因。
12.在一种实施方式中,所述基因的核苷酸序列如seq id no.7~11所示。
13.本发明还提供了携带所述基因的重组质粒。
14.在一种实施方式中,所述重组质粒包括但不限于pet系列质粒。
15.本发明还提供了表达所述突变体的重组微生物细胞。
16.在一种实施方式中,所述重组微生物细胞包括但不限于细菌或真菌。
17.在一种实施方式中,所述微生物为大肠杆菌。
18.在一种实施方式中,所述大肠杆菌以大肠杆菌bl21(de3)为宿主,以pet-28a为载体,表达所述精氨酸脱亚胺酶突变体。
19.本发明还提供一种提高精氨酸脱亚胺酶酶活的方法,所述方法是将奥氏嗜热盐丝菌(halothermothrix orenii)来源的精氨酸脱亚胺酶的第116位天冬氨酸,第203位苏氨酸,第103位丙氨酸,第32位苏氨酸或第345位甘氨酸进行突变。
20.在一种实施方式中,所述方法是将奥氏嗜热盐丝菌来源的精氨酸脱亚胺酶的第116位天冬氨酸突变为甘氨酸,或将第203位苏氨酸突变为甘氨酸,或将第103位丙氨酸突变为酪氨酸,或将第32位苏氨酸突变为酪氨酸,或将第345位甘氨酸突变为丙氨酸。
21.本发明还提供一种生产精氨酸脱亚胺酶突变体的方法,是将表达所述突变体的重组大肠杆菌在lb培养基中,于30~37℃培养至少12h。
22.在一种实施方式中,所述方法还对重组大肠杆菌进行诱导;所述诱导是将所述重组大肠杆菌培养至od
600
在0.5~0.7范围内,加入0.5mmol/l的iptg在28℃、200r/min条件下诱导6h。
23.本发明还提供所述精氨酸脱亚胺酶突变体在氨基酸生产或抗肿瘤药物的制备方面的应用。
24.有益效果:本发明提供的一系列精氨酸脱亚胺酶突变体酶活相比于野生酶均有了明显的提高,突变后的酶仍保持着适中的ph,且酶活可达135.8u/mg,154.9u/mg,158.7u/mg,163.0u/mg,194.1u/mg,相比于野生型酶活提高了1.47-2.11倍。本发明优化改良了野生型的精氨酸脱亚胺酶酶活较低的问题,为该酶在实际应用中创造更好的使用条件。
附图说明
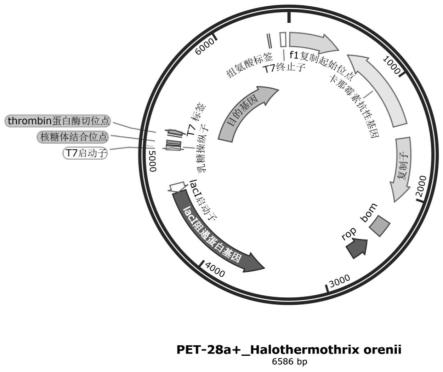
25.图1为重组质粒的构建图谱。
26.图2为野生酶wt和突变酶的相对酶活。
具体实施方式
27.材料与试剂:所用的限制性内切酶、solutionⅰ连接酶、pcr试剂等均购于takara宝生物公司;质粒提取试剂盒、基因组提取试剂盒、琼脂糖纯化试剂盒、e.coil dh5α、e.coil bl21(de3)菌株、引物均购于生工生物工程(上海)有限公司;其他试剂均为国内或国外购买的分析纯试剂。
28.实施例1:精氨酸脱亚胺酶突变位点的设计
29.多序列比对结合在线服务器hotspot vizard(https://loschmidt.chemi.mu ni.cz/hotspotwizard/)选择突变位点;利用swiss-model软件对精氨酸脱亚胺酶蛋白结构进行模拟,获得精氨酸脱亚胺酶的三级结构模型。确定要突变的氨基酸位点为第116位天冬氨酸,第203位苏氨酸,第103位丙氨酸,第32位苏氨酸,第345位甘氨酸,第340位天冬氨酸,第398位脯氨酸。
30.实施例2:精氨酸脱亚胺酶的定点突变及重组质粒、重组大肠杆菌的构建
31.根据seq id no.1所示的halothermothrix orenii来源的编码arca的基因进行引
物设计:
32.n116g-f:atatggacggcgagacacttattcgtaagatgatggc;
33.n116g-r:tgtctcgccgtccatatctgcgaagtactccttt;
34.t203g-f:caaggatggcgaaatccccttctggtttgatcg;
35.t203g-r:ggatttcgccatccttgaagtccggatggtacg;
36.a103y-f:taaggggtatcgtcaagtcttaaaggagtacttcgc;
37.a103y-r:cttgacgataccccttaccaatcacaccagct;
38.t32y-f:gtatccggacttacttgagcgtctgttgttcg;
39.t32y-r:caagtaagtccggatacaaattctcaatttcgtgtccagg;
40.g345a-f:attacatcgatgccgcgcgtgaacagtggaacgacgg;
41.g345a-r:cgcggcatcgatgtaatcaccgcctgcacagc;
42.其中下划线部分代表突变体基因编码的第116位天冬氨酸,第203位苏氨酸,第103位丙氨酸,第32位苏氨酸,第345位甘氨酸,所对应的密码子。
43.pcr扩增体系为:
[0044][0045][0046]
pcr扩增后,向反应液中加入1μl dpnⅰ限制性内切酶(10u/μl),在37℃下保温2h消除模板。将pcr产物转化至e.coil dh5α细胞中,涂布平板,挑取单菌落到液体培养基,提取质粒,经测序得到正确突变质粒pet-28a-adi
n116g
、pet-28a-adi
t203g
、pet-28a-adi
a103y
、pet-28a-adi
t32y
、pet-28a-adi
g345a
,分别将构建成功的突变质粒转化入e.coil bl21(de3)中,得到突变株bl21(de3)/pet-28a-adi
n116g
、bl21(de3)/pet-28a-adi
t203g
、bl21(de3)/pet-28a-adi
a103y
、bl21(de3)/pet-28a-adi
t32y
、bl21(de3)/pet-28a-adi
g345a
。
[0047]
实施例3:野生酶和突变酶的表达纯化
[0048]
挑取bl21(de3)/pet-28a-adi和各突变株单菌落于含0.5mmol/l卡那霉素的lb培养基中,37℃、200r/min培养12h后,转接至含0.5mmol/l卡那霉素的lb培养基中,在37℃、200r/min培养至od
600
在0.5~0.7范围内,加入0.5mmol/l的iptg在28℃、200r/min条件下诱导6h。
[0049]
发酵液在10000r/min、4℃下离心10min后,弃上清,用磷酸盐缓冲液洗涤两次,加入15~20ml磷酸盐缓冲液使菌体悬浮,超声破碎15min(功率22w,破碎1s,间歇2s)。在4℃、10000r/min条件下离心10min,收集上清液,即为粗酶液,用孔径0.22μm水系膜过滤。结果显示,野生酶的粗酶活为3.88u/ml,n116g粗酶活为5.74u/ml,t203g粗酶活为6.52u/ml,a103y粗酶活为6.71u/ml,t32y粗酶活为6.89u/ml,g345a粗酶活为8.2u/ml。
[0050]
用binding buffer对ni
2
螯合琼脂糖树脂柱进行预平衡;加入粗酶液,分别用
binding buffer和washing buffer平衡;用elution buffer将酶洗脱下来,回收;将回收的酶液在透析缓冲液中透析后于4℃冰箱中保存。
[0051]
所涉及缓冲液配制:
[0052]
磷酸盐缓冲液(pb):50mmol/l,ph 5.5
[0053]
binding buffer:50mmol/l pb,500mmol/l nacl,ph 7.0
[0054]
washing buffer:50mmol/l pb,500mmol/l nacl,ph 7.0,50mmol/l咪唑
[0055]
elution buffer:50mmol/l pb,500mmol/l nacl,ph 7.0,500mmol/l咪唑
[0056]
透析缓冲液:50mmol/l pb,ph 7.0,10mmol/l edta
[0057]
酶活测定条件:反应体系包括0.05mg纯化的酶,500ul浓度为100mg/ml的精氨酸溶液(ph=6.5),50mmpbs buffer(ph=6.5)补足1ml,于60℃条件下反应10min,煮沸5min灭酶。离心后稀释一定倍数用高效液相色谱测定产物浓度。
[0058]
酶活定义:在反应条件下,以精氨酸作为底物,每分钟催化生成1μmol瓜氨酸所需要的酶量为一个酶活单位。在此条件下,将原始酶酶活定义为100%,并以相对酶活的百分比对突变体种类作图,评价酶活性得到的结果如图2,相比野生酶wt的比酶活91.8u/mg,突变体的比酶活分别为n116g为135.7u/mg、t203g为154.9u/mg、a103y为158.7u/mg、t32y为163.0u/mg、g345a为194.1u/mg,而d340p和p398g基本丧失酶活。
[0059]
对比例1:
[0060]
按照实施例1~3相同的策略,分别构建突变体d340p、p398g,质粒pet-28a-adi
d340p
、pet-28a-adi
p398g
,并构建重组菌bl21(de3)/pet-28a-adi
d340p
、bl21(de3)/pet-28a-adi
p398g
;按照实施例3相同的方法培养重组菌,并分别检测粗酶液和纯化后的比酶活,结果显示,几乎检测不到d340p和p398g的粗酶活和比酶活,表明突变体d340p和p398g丧失了酶活,这两个位点为保守位点,是该酶具有催化能力的重要残基。
[0061]
p398g-f:ggccgttgcatgagtatgccccttgtgcgcga;
[0062]
p398g-r:atactcatgcaacggccgcctccgcgtccacgaga;
[0063]
d340p:gcggtccgtacatcgatgccgggcgtgaacag;
[0064]
d340p:atcgatgtacggaccgcctgcacagcgaataa。
[0065]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。