作为klk5/7双重抑制剂的苯并噁嗪酮化合物
1.相关申请的交叉引用
2.本技术要求于2019年10月1日提交的美国临时申请号62/909,006的优先权,其内容出于所有目的在此通过引用整体并入本文。
3.联邦资助的研究与开发下的有关发明权利的声明
4.不适用
5.通过光盘提交的“序列表”、表格或计算机程序列表附录的引用
6.不适用
背景技术:
7.遗传性皮肤病是表现为皮肤症状的遗传性疾病。这些疾病通常在出生时或出生后短时间内可以被检测到。疾病的类型取决于基因是如何受到影响的,但由此产生的症状可能是严重的、罕见的,并可能导致残疾、寿命缩短以及其他慢性疾病和癌症的发展,而严重影响患者的生活。大约有400种不同种类的遗传性皮肤病,其发病率从6000人中1例到500,000人中1例不等。对于可能只能获得非常有限范围的昂贵药物来帮助控制疾病的患者和家庭来说,这种疾病的负担可能很重。遗传性皮肤病可以分为单基因疾病,其中皮肤疾病是由单基因异常引起的;多基因疾病,其中几个基因突变(缺陷)影响患者所患的疾病类型。单基因疾病包括急性间歇性卟啉病、大疱性表皮松解症、鱼鳞病、法布里病、无汗性外胚层发育不良和色素失禁。有鱼鳞病症状的遗传疾病包括内瑟顿综合征(netherton syndrome)。
8.内瑟顿综合征(ns)是一种罕见的常染色体隐性遗传皮肤病,其特征是先天性鱼鳞状红皮病、特应性素质和称为内陷性脱毛的特征性毛干异常。内瑟顿综合征是最严重的角质化疾病之一。婴儿通常在出生时就出现全身鳞屑性红皮病,并且有较高风险出现危及生命的并发症,例如高钠性脱水、发育迟缓和败血症。在年龄较大的儿童中,可能会出现多种过敏表现,包括严重的特应性皮炎、哮喘、花粉热和血清免疫球蛋白e水平显著升高。在年龄较大的儿童和成人中,鳞屑可能具有独特的圆形图案(旋曲线状鱼鳞病)。但在婴幼儿中,皮肤通常为红色并有全身鳞屑,没有独特的圆形图案。毛干很脆弱,并且由于内陷性毛囊或“竹节状发”而容易折断,从而导致头发短而稀疏。内瑟顿综合征的另一个特征是易患过敏、哮喘和湿疹。除了细菌性皮肤和全身感染外,患有内瑟顿综合征的成人和儿童也易患疱疹和人乳头瘤病毒的病毒性皮肤感染。内瑟顿综合征的患病率估计为1/200,000新生儿,发病率估计为1-9/1,000,000。然而,区域研究表明,由于婴儿期和幼儿的诊断难度,包括与特应性皮炎和其他隐性鱼鳞病的重叠特征,发病率可能更高。目前,对于ns没有特定的治疗方法,只有姑息治疗来治疗皮肤感染、减少瘙痒和疼痛。
9.ns是由丝氨酸蛋白酶抑制剂kazal型5(spink5)的功能缺失突变截断引起的,该基因编码lekti(淋巴上皮kazal型抑制剂)。lekti功能丧失导致蛋白酶活性不受抑制以及表皮结构蛋白和屏障蛋白的过度消化。
10.letki是激肽释放酶(klk)丝氨酸蛋白酶家族成员(klk5、klk7和klk14)的特异性抑制剂(chavanas等,nat genet 2000,25:141-142)。klk5被表征为klk7上游的启动子。根
据目前的假说,pro-klk在颗粒层合成和激活,活性klk酶与lekti快速复合,从而防止角质层/颗粒层界面的桥粒过早降解(borgono等,j biol chem 2007,282:3640-3652;deraison等,mol biol cell 2007,18:3607-3619;ovaere等,trends biochem sci 2009,34:453-463)。klk-lekti复合物扩散到外层角质层,角质层的酸性微环境导致lekti释放活性klk。随后,活跃的klk在角质层的最表层切割角桥粒蛋白。这确保了对脱屑过程的精细平衡调节(ovaere等,trends biochem sci 2009,34:4s3-463)。
11.spink5-/-小鼠重现ns疾病(descargues等,nat genet 200s,37:s6-6s;hewett等,hum mol genet 200s,14:33s-346;yang等,genes dev 2004,18:23s4-23s8)。一个关键的发现是,与在患有ns的受试者中观察到的相似,spink5-/-小鼠表皮显示出无对抗的klk5和klk7蛋白酶活性(descargues等,nat genet 200s,37:s6-6s)。
12.相反,klk5的缺失挽救了spink5-/-新生小鼠的新生死亡率,并逆转了ns的皮肤特征,包括皮肤屏障缺陷、表皮结构紊乱和皮肤炎症(furio等,plos genet 201s,sep;11(9):el00s389)。值得注意的是,klk5损失导致表皮蛋白水解活性降低,特别是klk7和klk14。随后,恢复桥粒和角桥粒的结构完整性、正常的表皮分化以及il-1β、il-17a和tslp(胸腺基质造血素)的正常化表达。
13.除了动物模型,用转染spink5靶向小干扰rna(sirna)的正常人角质形成细胞和成纤维细胞填充的胶原凝胶产生了器官型3d培养物,并且在这些培养模型中观察到表皮缺陷(wang等,exp dermatol2014,jul;23(7):s24-6)。klk5或klk7的基因沉默显着改善了因spink5表达减少而受损的表皮结构。总之,这些研究证实了klk5及其上游和下游调节剂在ns中的主要作用。
14.klk7由颗粒层中的角质形成细胞表达,并作为随后被klk5激活的酶原分泌到角质层(即皮肤的最外层)细胞外空间。一旦被激活,klk7在皮肤的脱屑过程中起着核心作用。klk7的蛋白水解事件对于脱屑过程和皮肤的受控再生是必不可少的。新角质细胞的产生和脱屑之间的紧密平衡对于维持皮肤稳态至关重要,反过来说,这两个过程之间的不平衡会导致皮肤功能受损,并最终导致皮肤病,例如内瑟顿综合征。在正常情况下,这种平衡是通过klk7的内源蛋白抑制剂(lekti)的表达抵消其蛋白水解活性来维持的。在皮肤病中,klk7过度表达和/或活性增加会导致过度脱屑。动物模型和人类中的遗传关联进一步支持了klk7参与皮肤病发展的理论。已经表明,过度表达人klk7的转基因小鼠的皮肤特征与慢性特应性皮炎患者中所见的皮肤特征相似,这些患者与内瑟顿综合征患者具有某些共同特征。
15.鉴于klk5和klk7在调节脱屑过程中的作用,并结合已报道的从组合spink5-/-/klk5-/-/klk7-/-敲除小鼠模型中完整表型挽救的结果(kasparek等,plos genet 2017,jan;13(1):e1006566),因此,需要有效和选择性的双重klk5/klk7抑制剂来治疗遗传性皮肤病,例如通过调节这些蛋白酶的蛋白水解活性来治疗内瑟顿综合征。
技术实现要素:
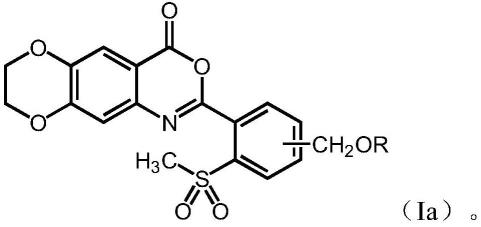
16.在本发明的第一方面,提供一种式(i)所示化合物,或其药学上可接受的配合物(complex):
[0017][0018]
其中,r为h或选自下组:-r1和-c(o)r
1a
,其中r1为c
1-12
烷基,r
1a
为h或c
1-12
烷基。
[0019]
在本发明的第二方面,提供一种药物组合物,其包含式(i)所示的化合物或其药学上可接受的复合物,以及药学上可接受的载体。
[0020]
在本发明的第三方面,提供了一种在有需要的受试者中治疗与一种或多种klk蛋白酶的蛋白水解活性相关的皮肤病的方法。所述方法包括向受试者施用有效量的式(i)化合物或其药学上可接受的配合物(complex),或包含式(i)化合物或其药学上可接受的配合物(complex)的药物组合物。
[0021]
在本发明的第四方面,提供了一种用于确定皮肤中一种或多种klk蛋白酶的蛋白水解活性的体外测定方法。所述方法包括1)制备皮肤提取物;2)将底物和式(i)化合物或其药学上可接受的复合物暴露于皮肤提取物;3)确定底物的蛋白水解切割速率。
附图说明
[0022]
图1显示了制备化合物1.001的方案。
[0023]
图2显示了制备化合物1.002的方案。
[0024]
图3显示了用于制备中间体100的方案,其用于制备化合物1.001和1.002。
[0025]
图4a-4d显示了化合物1.001、1.002或已知化合物14在皮肤提取物测定中对klk5选择性底物的蛋白水解切割速率。图4a:对照组;图4b:化合物14;图4c:化合物1.001;图4d:化合物1.002。其中,nsk指新鲜制备的皮肤提取物;osk指冻融后的皮肤提取物。
具体实施方式
[0026]
i.总述
[0027]
本发明提供用于治疗与一种或多种klk蛋白酶的蛋白水解活性相关的皮肤病的式(i)化合物和包含式(i)化合物的药物组合物。特别地,药物组合物可以是包括式(i)化合物的局部制剂,用于局部用于治疗遗传性皮肤病。本发明还提供通过施用式(i)化合物或其药物组合物治疗与一种或多种klk蛋白酶的蛋白水解活性相关的皮肤病的方法。特别地,式(i)化合物或其药物组合物可以局部给药。具体而言,皮肤病是遗传性皮肤病,例如内瑟顿综合征。
[0028]
ii.定义
[0029]
本文使用的缩写具有其在化学和生物学领域内的常规含义。
[0030]“烷基”是指具有所示碳原子数的直链或支链饱和脂肪族基团(即,c
1-12
表示1至12个碳)。烷基可以包括任意数量的碳,例如c
1-2
、c
1-3
、c
1-4
、c
1-5
、c
1-6
、c
1-7
、c
1-8
、c
1-9
、c
1-10
、c
1-11
、c
1-12
、c
2-3
、c
2-4
、c
2-5
、c
2-6
、c
2-7
、c
2-8
、c
2-9
、c
2-10
、c
2-11
、c
2-12
、c
3-4
、c
3-5
、c
3-6
、c
3-7
、c
3-8
、c
3-9
、c
3-10
、c3-11
、c
3-12
、c
4-5
、c
4-6
、c
4-7
、c
4-8
、c
4-9
、c
4-10
、c
4-11
、c
4-12
、c
5-6
、c
5-7
、c
5-8
、c
5-9
、c
5-10
、c
5-11
、c
5-12
、c
6-7
、c
6-8
、c
6-9
、c
6-10
、c
6-11
、c
6-12
、c
7-8
、c
7-9
、c
7-10
、c
7-11
、c
7-12
、c
8-9
、c
8-10
、c
8-11
、c
8-12
、c
9-10
、c
9-11
、c
9-12
、c
10-11
、c
10-12
和c
11-12
。例如,c
1-12
烷基包括但不限于甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、正己基、正庚基、正辛基、正壬基、正癸基、正十一烷基、正十二烷基等。烷基还可以指具有最多20个碳原子的烷基,例如但不限于十三烷基、十四烷基、十五烷基、十六烷基、十七烷基和十八烷基等。
[0031]
如本文所用,“药学上可接受的配合物”是指包括式(i)化合物和至少一种络合剂的配合物。术语“药学上可接受的”是指经联邦或州政府的监管机构批准或在美国药典或其他公认的药典中列出的用于动物的,尤其是用于人类的。络合剂具有通过非共价次级相互作用与式(i)化合物形成配合物结构的功能。次级相互作用可以通过静电相互作用形成,例如离子相互作用、氢键、偶极-偶极相互作用、偶极诱导的偶极相互作用、伦敦色散力、n-n相互作用和疏水相互作用。式(i)化合物的药学上可接受的配合物包括其药学上可接受的盐和/或溶剂化物。
[0032]“溶剂化物”是指本文提供的化合物或其盐,其还包括由非共价分子间力结合的化学计量或非化学计量量的溶剂。在溶剂是水的情况下,溶剂化物是水合物。
[0033]“水合物”是指与水分子络合的化合物。本发明的化合物可以与1/2个水分子或1至10个水分子络合。
[0034]
如本文所用,“肽-对硝基苯胺”或“肽-pna”是指一种肽底物,有4到6个氨基酸,通过肽键连接,c端有一个对硝基苯胺基团。本发明中的肽-pna底物的例子包括tyr-arg-ser-arg-pna和lys-his-leu-tyr-pna。
[0035]
如本文所用,“组合物”旨在涵盖包含指定量的指定成分的产品,以及直接或间接由指定量的指定成分的组合产生的任何产品。“药学上可接受的”是指载体、稀释剂或赋形剂必须与制剂的其他成分相容并且对其接受者无害。
[0036]“药学上可接受的载体或赋形剂”是指有助于将活性剂施用于受试者并帮助受试者吸收的物质。可用于本发明的药用赋形剂包括但不限于粘合剂、填充剂、崩解剂、润滑剂、包衣剂、甜味剂、调味剂和色素。在本发明中用于透皮/局部递送的药用赋形剂包括但不限于增强剂、增溶剂、抗氧化剂、增塑剂、增稠剂、聚合物和压敏粘合剂。本领域技术人员可以认识到其他药物赋形剂可用于本发明。
[0037]“ic
50”是指特定测试化合物的量、浓度或剂量,该量的化合物在测量特定反应的测试中能实现最大反应的50%抑制。
[0038]“抑制”、“抑制物”和“抑制剂”是指禁止特定作用或功能的化合物或禁止方法。
[0039]“给药”是指局部给药,例如作为洗剂、喷雾剂、软膏、霜剂、凝胶、糊剂或贴剂。
[0040]“局部”是指将合适的化合物(例如活性成分)或包含化合物(例如活性成分)的组合物施用于皮肤以治疗疾病或病症,例如遗传皮肤病。在一些实施方式中,“局部”是指将合适的化合物(例如活性成分)或包含化合物(例如活性成分)的组合物施用至皮肤,并充分渗透表皮或真皮以治疗遗传性皮肤病。在一些局部应用的实施方式中,化合物或组合物透过表皮或真皮而没有明显的全身暴露,也没有意图治疗或预防另一器官系统的疾病。在一些局部应用的实施方式中,化合物或组合物通过皮肤经皮递送以进行全身分布。例子包括用于药物递送的透皮贴剂。
[0041]“治疗”是指在治疗或改善损伤、病理或状况中的任何成功标志,包括任何客观或主观参数,例如减轻;缓解;减轻症状或使损伤、病理或状况对患者更易耐受;减慢退化或衰退的速度;使退化的终点不那么令人衰弱;改善患者的身心健康。症状的治疗或改善可以基于客观或主观参数;包括体检、神经精神病学检查和/或精神病学评估的结果。
[0042]“患者”或“受试者”是指患有或倾向于患有可通过施用本文提供的药物组合物来治疗的疾病或病症的活生物体。非限制性实例包括人、其他哺乳动物、牛、大鼠、小鼠、狗、猴、山羊、绵羊、牛、鹿和其他非哺乳动物。在一些实施方式中,患者是人。
[0043]“治疗有效量”是指化合物或药物组合物的量,该量可用于治疗或改善已确定的疾病或病症,或用于表现出可检测的治疗或抑制作用。确切的量将取决于治疗的目的,并且可以由本领域技术人员使用已知技术确定(详见,例如,lieberman,药物剂型(pharmaceutical dosage forms)(卷1-3,1992);lloyd,药物复配的艺术、科学与技术(the art,science and technology of pharmaceutical compounding)(1999);pickar,剂量计算(dosage calculations)(1999);和雷明顿:药学的科学与实践(remington:the science and practice of pharmacy),第20版,2003,gennaro,ed.,lippincott,williams&wilkins)
[0044]“一”、“一个”或“一种”,当在本文中用于提及一组取代基或“取代基”时,是指至少一个。例如,当化合物被“一个”烷基或芳基取代时,该化合物任选被至少一个烷基和/或至少一个芳基取代,其中每个烷基和/或芳基任选地不同。在另一个实例中,当化合物被“一个”取代基取代时,化合物被至少一个取代基取代,其中每个取代基任选不同。
[0045]
iii.化合物
[0046]
在本发明的第一方面中,提供了一种式(i)所示的化合物,或其药学上可接受的复合物:
[0047][0048]
其中,r为h或选自下组:-r1和-c(o)r
1a
,其中r1为c
1-12
烷基,r
1a
为h或c
1-12
烷基。
[0049]
式(i)中的甲磺酰基(-so2ch3)可以在7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯并[1,2-d][1,3]噁嗪-4-酮的邻位、间位或对位。在一些实施方式中,-so2ch3基团在7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯并[1,2-d][1,3]噁嗪-4-酮的邻位。
[0050]
式(i)中的-ch2or基团可以在7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯并[1,2-d][1,3]噁嗪-4-酮的邻位、间位或对位。在一些实施方式中,-ch2or基团在7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯并[1,2-d][1,3]噁嗪-4-酮的间位。在一些实施方式中,-ch2or基团在7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯并[1,2-d][1,3]噁嗪-4-酮的对位。
[0051]
在一些实施方式中,所述的化合物如式(ia)所示:
[0052][0053]
其中,r的定义如对式(i)的描述中所述。
[0054]
在式(ia)的一些实施方式中,-ch2or基团可以在-so2ch3基团的邻位、间位或对位。在一些实施方式中,-ch2or基团在-so2ch3基团的间位。在一些实施方式中,-ch2or基团在-so2ch3基团的对位。
[0055]
在一些实施方式中,所述的化合物如式(ib)所示:
[0056][0057]
其中,r的定义如对式(i)的描述中所述。
[0058]
在一些实施方式中,所述的化合物如式(ic)所示:
[0059][0060]
其中,r的定义如对式(i)的描述中所述。
[0061]
参考式(i)、(ia)、(ib)和(ic)中的任一个,在一些实施方式中,r是h。
[0062]
在一些实施方式中,所述的化合物如下式所示:
[0063][0064]
在一些实施方式中,所述的化合物如下式所示:
[0065][0066]
参考式(i)、(ia)、(ib)和(ic)中的任一个,在一些实施方式中,r选自下组:-r1和-c(o)r
1a
,其中r1为c
1-12
烷基,r
1a
为h或c
1-12
烷基。
[0067]
在式(i)、(ia)、(ib)和(ic)中的任一个的实施方式中,r为c
1-12
烷基。在一些实施方式中,r为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、正己基、正庚基、正辛基、正壬基、正癸基、正十一烷基或正十二烷基。在一些实施方式中,r为c
1-6
烷基。在一些实施方式中,r为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基或正己基。在一些实施方式中,r为甲基或乙基。在一些选定的实施方式中,r为甲基。
[0068]
在式(i)、(ia)、(ib)和(ic)中的任一个的实施方式中,r为-c(o)r
1a
,其中r
1a
为h或c
1-12
烷基。在一些实施方式中,r
1a
为h。在一些实施方式中,r
1a
为c
1-12
烷基。在一些实施方式中,r
1a
为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、正己基、正庚基、正辛基、正壬基、正癸基、正十一烷基或正十二烷基。在一些实施方式中,r
1a
为c
1-6
烷基。在一些实施方式中,r
1a
为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基或正己基。在一些实施方式中,r
1a
为甲基或乙基。在一些实施方式中,r
1a
为乙酰基。
[0069]
在一些实施方式中,所述的化合物如下式所示:
[0070][0071]
在一些实施方式中,所述的化合物如下式所示:
[0072][0073]
示例性的式(i)化合物如表1所述。
[0074]
表1:式(i)化合物
[0075][0076][0077]
其他形式的化合物
[0078]
本发明的化合物可以与至少一种络合剂共同作为复合物存在。络合剂具有通过非共价次级相互作用与式(i)化合物形成络合物结构的功能。次级相互作用可以通过静电相互作用形成,例如离子相互作用、氢键、偶极-偶极相互作用、偶极诱导的偶极相互作用、伦敦色散力、n-n相互作用和疏水相互作用。式(i)化合物的药学上可接受的复合物包括其药学上可接受的盐和/或溶剂化物。在一些实施方式中,式(i)化合物的药学上可接受的复合物是其药学上可接受的盐和/或溶剂化物。在一些实施方式中,式(i)化合物的药学上可接受的复合物是其药学上可接受的盐。在一些实施方式中,式(i)化合物的药学上可接受的复合物是其药学上可接受的溶剂化物。
[0079]
本发明的某些化合物可以以非溶剂化形式以及溶剂化形式存在,包括水合形式。一般而言,溶剂化形式与非溶剂化形式等价,并包含在本发明的范围内。本发明的某些化合物可以多种结晶或无定形形式存在。一般而言,所有物理形式对于本发明所设想的用途都是等效的,并且旨在落入本发明的范围内。
[0080]
除非另有说明,本发明的化合物还可以在构成此类化合物的一个或多个原子处包含非自然比例的原子同位素。例如,本发明的化合物可以用放射性或稳定同位素标记,例如氘(2h)、氚( h)、碘-125(
125
i)、氟-18(
18
f)、氮-15(
15
n)、氧-17(
17
o)、氧-18(
18
o)、碳-13(
13
c)或碳-14(
14
c)。本发明化合物的所有同位素变体,无论是否具有放射性,都包括在本发明的范围内。
[0081]
本发明提供了前药形式的化合物。本文所述化合物的前药是那些在生理条件下容易发生化学变化以提供本发明化合物的化合物。此外,前药可以在离体环境中通过化学或生化方法转化为本发明的化合物。例如,当将前药置于具有合适酶或化学试剂的透皮贴剂储库中时,前药可以缓慢地转化为本发明的化合物。
[0082]
iv.组合物
[0083]
在本发明的第二方面,提供一种药物组合物,其包含式(i)所示的化合物或其药学上可接受的复合物,以及药学上可接受的载体。在一些实施方式中,药物组合物包含式(ia)化合物或其药学上可接受的复合物和药学上可接受的载体。在一些实施方式中,药物组合物包含式(ib)化合物或其药学上可接受的复合物和药学上可接受的载体。在一些实施方式中,药物组合物包含式(ic)化合物或其药学上可接受的复合物和药学上可接受的载体。
[0084]
式(i)、(ia)、(ib)和(ic)中任一项的化合物的药学上可接受的复合物的定义和描述如本文所述。式(i)、(ia)、(ib)和(ic)中任一项的化合物的药学上可接受的复合物可以包括其药学上可接受的盐和/或溶剂合物。
[0085]
在一些实施方式中,式(i)、(ia)、(ib)和(ic)中任一项的化合物具有下式所示的
结构,或其药学上可接受的盐:
[0086][0087]
在一些实施方式中,式(i)、(ia)、(ib)和(ic)中任一项的化合物具有下式所示的结构,或其药学上可接受的盐:
[0088][0089]
可以使用本领域可用的方法和本文公开的方法将本文提供的化合物配制成药物组合物。本文公开的任何化合物可以在适当的药物组合物中提供并通过适当的给药途径给药。
[0090]
将本文所述的化合物施用于受试者的给药方法可以是局部的或非全身的,例如,局部的、皮内的或病灶内的。在一些实施方式中,化合物可以通过局部给药来给药。在一些实施方式中,化合物可以通过皮内给药来给药。在一些实施方式中,化合物可以通过病灶内给药来给药,例如,通过病灶内注射。
[0091]
本文提供的方法包括施用含有至少一种如本文所述的化合物的药物组合物,包括盐形式或络合物形式的式(i)化合物(如果合适的话),其可以单独使用或以与一种或多种相容且药学上可接受的载体的组合形式使用,例如稀释剂或佐剂,或在受试者有需要的情况下与另一种用于治疗遗传性皮肤病的药剂一起施用。
[0092]
在某些实施方式中,第二种药剂可以与本文提供的化合物一起配制或包装。当然,只有当根据本领域技术人员的判断,这种复合制剂不会干扰任一药剂的活性或给药方法时,第二药剂才可与本文提供的化合物一起配制。在某些实施方式中,本文提供的化合物和第二药剂分开配制。为了本领域技术人员的方便,它们可以包装在一起,或分开包装。
[0093]
在临床实践中,本文提供的活性成分可以通过任何常规途径给药,特别是局部、皮内、病灶内、口服、肠胃外、直肠或通过吸入(例如以气雾剂的形式)。在某些实施方式中,本文提供的化合物被局部、皮内或病灶内给药。在某些实施方式中,本文提供的化合物是局部给药的。在某些实施方式中,本文提供的化合物是皮内给药的。在某些实施方式中,本文提供的化合物是病灶内给药的。
[0094]
作为用于口服给药的固体组合物,可以以片剂、丸剂、硬明胶胶囊、散剂或颗粒剂形式使用。在这些组合物中,活性产品与一种或多种惰性稀释剂或佐剂混合,例如蔗糖、乳糖或淀粉。
[0095]
这些组合物可以包含除稀释剂以外的物质,例如润滑剂,例如硬脂酸镁,或用于控
释的涂层。
[0096]
作为用于口服给药的液体组合物,可以以药学上可接受的溶液、悬浮液、乳剂、糖浆剂和含有惰性稀释剂如水或液体石蜡的酏剂形式使用。这些组合物还可包含除稀释剂之外的物质,在某些实施方式中,包含润湿、甜味或调味产品。
[0097]
用于局部给药的组合物,可以以洗剂、酊剂、霜剂、乳剂、凝胶或软膏形式使用。在这些组合物中,活性产品与一种或多种惰性赋形剂混合,包括水、丙酮、乙醇、乙二醇、丙二醇、聚乙二醇、1,3-丁二醇、肉豆蔻酸异丙酯、棕榈酸异丙酯、矿物油及其混合物。
[0098]
用于肠胃外、病灶内或皮内给药的组合物可以是乳液或无菌溶液。作为溶剂或载体,可以使用丙二醇、聚乙二醇、植物油,特别是橄榄油,或可注射的有机酯,在某些实施方式中,使用油酸乙酯。这些组合物还可以包含助剂,特别是润湿剂、等渗剂、乳化剂、分散剂和稳定剂。可以通过多种方式进行灭菌,在某些实施方式中,通过使用细菌过滤器、辐射或加热进行灭菌。它们也可以制成无菌固体组合物的形式,在使用时可以溶解在无菌水或任何其他可注射的无菌介质中。
[0099]
用于直肠给药的组合物是栓剂或直肠胶囊,除活性成分外,还含有赋形剂如可可脂、半合成甘油酯或聚乙二醇。
[0100]
该组合物也可以是气雾剂。对于以液体气雾剂的形式使用,组合物可以是稳定的无菌溶液,或在使用时溶解在无热原无菌水、盐水或任何其他药学上可接受的载体中的固体组合物。对于旨在直接吸入的干气雾剂形式的使用,活性成分被细化并与水溶性固体稀释剂或载体组合,在某些实施方式中,葡聚糖、甘露醇或乳糖。
[0101]
在某些实施方式中,本文提供的组合物是药物组合物或单一单位剂型。本文提供的药物组合物和单一单位剂型包含预防或治疗有效量的一种或多种预防或治疗剂(例如本文提供的化合物或其他预防或治疗剂),以及通常一种或多种药学上可接受的载体或辅料。在一个具体的实施方式中并且在本文中,术语“药学上可接受的”是指由联邦或州政府的监管机构批准或在美国药典或其他公认的药典中列出的用于动物,更具体地用于人类。术语“载体”包括用于施用治疗剂的稀释剂、佐剂(例如弗氏佐剂(完全和不完全))、赋形剂或载体。这样的药物载体可以是无菌液体,例如水和油,包括来自石油、动物、植物或合成的,例如花生油、大豆油、矿物油、芝麻油等。当药物组合物通过静脉内给药时,水可以用作载体。盐水溶液和右旋糖和甘油水溶液也可以用作液体载体,特别是用于可注射溶液。雷明顿:药学的科学与实践(remington:the science and practice of pharmacy),医药出版社(pharmaceutical press),第22版(2012年9月15日)中描述了合适的药物载体的例子。
[0102]
典型的药物组合物和剂型包含一种或多种赋形剂。合适的赋形剂是药学领域技术人员熟知的,并且在某些实施方式中,合适的赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石粉、氯化钠、脱脂奶粉、甘油、丙烯、乙二醇、水、乙醇等。特定赋形剂是否适合掺入药物组合物或剂型取决于本领域熟知的多种因素,包括但不限于将剂型施用于受试者的方式以及剂型中的特定活性成分。如果需要,组合物或单一单位剂型还可以包含少量的润湿剂或乳化剂,或ph缓冲剂。
[0103]
本发明提供的不含乳糖的组合物可包含本领域熟知的赋形剂,在某些实施方式中,列于美国药典(usp 36-nf 31s2)中。通常,不含乳糖的组合物包含药学相容和药学可接受量的活性成分、粘合剂/填充剂和润滑剂。示例性无乳糖剂型包含活性成分、微晶纤维素、
预糊化淀粉和硬脂酸镁。
[0104]
本发明进一步涵盖的是包含活性成分的无水药物组合物和剂型,因为水可以促进一些化合物的降解。例如,添加水(例如,5%)在制药领域被广泛接受,作为模拟长期储存的手段,以确定诸如保质期或制剂随时间的稳定性等特性。参见,例如jens t.carstensen,药物稳定性:原则与实践(drug stability:principles&practice),2d,marcel dekker编,纽约,1995年,pp.379 80。水和热会有效加速某些化合物的分解。因此,水对制剂的影响可能具有重要意义,因为在制剂的制造、处理、包装、储存、运输和使用过程中通常会遇到水分和/或湿气。
[0105]
本文提供的无水药物组合物和剂型可以使用无水或含低水分的成分和低水分或低湿度条件来制备。如果预期在制造、包装和/或储存期间与水分和/或湿气大量接触,则包含乳糖和至少一种包含伯胺或仲胺的活性成分的药物组合物和剂型可以是无水的。
[0106]
应制备和储存无水药物组合物以保持其无水性质。因此,可以使用防止暴露于水的已知材料包装无水组合物,从而可以将它们包括在合适的处方药盒中。在某些实施方式中,合适的包装包括但不限于密封箔、塑料、单位剂量容器(例如小瓶)、泡罩包装和条形包装。
[0107]
本发明还提供了包含一种或多种降低活性成分分解速率的化合物的药物组合物和剂型。此类化合物在本文中称为“稳定剂”,包括但不限于抗氧化剂如抗坏血酸、ph缓冲剂或盐缓冲剂。
[0108]
药物组合物和单一单位剂型可以采取溶液剂、混悬剂、乳剂、片剂、丸剂、胶囊剂、散剂、缓释剂等形式。口服制剂可以包括标准载体,例如药物级甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等。这些组合物和剂型将含有预防或治疗有效量的预防或治疗剂,在某些实施方式中,预防或治疗剂呈纯化形式,连同合适量的载体,以提供适合向受试者给药的形式。所述的制剂应适合给药方式。在某些实施方式中,药物组合物或单一单位剂型是无菌的并且为适合向受试者给药的形式,在某些实施方式中,受试者为动物受试者,例如哺乳动物受试者,在某些实施方式中,受试者为人类受试者。
[0109]
将药物组合物配制成与其预期的给药途径相容。在某些实施方式中,给药途径包括但不限于肠胃外,例如静脉内、皮内、皮下、肌内、皮下、口服、口腔、舌下、吸入、鼻内、透皮、局部、经粘膜、肿瘤内、滑膜内和直肠给药。在某些实施方式中,给药途径是皮内、局部或病灶内给药。在某些实施方式中,给药途径是非全身给药。在一个具体的实施方式中,根据常规程序将组合物配制成适合向人类进行静脉内、皮下、肌内、口服、鼻内或局部给药的药物组合物。在一个实施方式中,药物组合物根据用于对人皮下给药的常规程序进行配制。通常,用于静脉内给药的组合物是无菌等渗水性缓冲体系中的溶液。必要时,该组合物还可以包括增溶剂和局部麻醉剂,例如利多卡因,以减轻注射部位的疼痛。
[0110]
在某些实施方式中,剂型包括但不限于:片剂;囊片;胶囊,例如软弹性明胶胶囊;扁囊剂;含片;锭剂;分散体;栓剂;药膏;巴布剂(凝胶膏剂);糊状物;粉末;敷料;乳剂;膏药;解决方案;补丁;气雾剂(例如,鼻喷雾剂或吸入器);凝胶;适合于向受试者口服或粘膜给药的液体剂型,包括混悬剂(例如,水性或非水性液体混悬剂、水包油乳剂或油包水液体乳剂)、溶液和酏剂;适用于对受试者进行肠胃外给药的液体剂型;和无菌固体(例如,结晶或无定形固体),它们可以被重构以提供适合于对受试者进行肠胃外给药的液体剂型。
[0111]
本文提供的剂型的组成、形状和类型通常会根据它们的用途而变化。在某些实施方式中,用于遗传皮肤病初始治疗的剂型可以包含比用于维持治疗相同病症或疾病的剂型更大量的一种或多种其包含的活性成分。类似地,与用于治疗相同疾病或病症的口服剂型相比,肠胃外剂型可以包含较少量的一种或多种其所包含的活性成分。对于本领域技术人员来说,本文所涵盖的具体剂型彼此不同的这些和其他方式将是显而易见的。参见,例如,雷明顿:药学的科学与实践(remington:the science and practice of pharmacy),医药出版社(pharmaceutical press),第22版(2012年9月15日)。
[0112]
通常,组合物的成分单独提供或以单位剂型混合在一起,在某些实施方式中,其以干燥的冻干粉末或无水浓缩物形式装在密封容器,例如安瓿或小袋中,以指示活性成分的量。当组合物通过输注给药时,它可以用装有无菌药用级水或盐水的输液瓶分配。在通过注射施用组合物的情况下,可以提供无菌注射用水或盐水的安瓿,从而可以在施用前混合成分。
[0113]
典型的剂型包含本文提供的化合物或其药学上可接受的复合物、溶剂化物或水合物,其在每天约0.1mg至约1000mg的范围内,作为每天一次的单一剂量在早上或全天分次随餐服用。具体的剂型可以具有约0.1、0.2、0.3、0.4、0.5、1.0、2.0、2.5、5.0、10.0、15.0、20.0、25.0、50.0、100、200、250、500或1000mg的活性化合物。
[0114]
口服剂型
[0115]
适合口服给药的药物组合物可以呈离散剂型,例如但不限于片剂(例如咀嚼片)、囊片、胶囊和液体(例如调味糖浆)。这种剂型含有预定量的活性成分,并且可以通过本领域技术人员熟知的药学方法制备。一般参见,雷明顿:药学的科学与实践(remington:the science and practice of pharmacy),医药出版社(pharmaceutical press),第22版(2012年9月15日)。
[0116]
在某些实施方式中,口服剂型是固体并且在无水条件下用无水成分制备,具体如本文所述。然而,本文提供的组合物的范围超出了无水固体口服剂型。因此,本文进一步描述了其他的形式。
[0117]
通过根据常规药物混合技术,典型的口服剂型是将活性成分与至少一种赋形剂紧密混合来制备的。取决于给药所需的制剂形式,赋形剂可以采用多种形式。在某些实施方式中,适用于口服液体或气雾剂剂型的赋形剂包括但不限于水、乙二醇、油、醇、调味剂、防腐剂和着色剂。在某些实施方式中,适用于固体口服剂型(例如,粉剂、片剂、胶囊和囊片)的赋形剂包括但不限于淀粉、糖、微晶纤维素、稀释剂、成粒剂、润滑剂、粘合剂、和崩解剂。
[0118]
由于易于给药,片剂和胶囊剂代表了最有利的口服剂量单位形式,在这种情况下使用固体赋形剂。如果需要,可以通过标准的水性或非水性技术对片剂进行包衣。这种剂型可以通过任何药学方法制备。通常,药物组合物和剂型的制备方法为,将活性成分与液体载体、精细分散的固体载体或两者均匀且紧密地混合,然后如果需要,将产品成型为所需的外观。
[0119]
在某些实施方式中,片剂可以通过压制或模制来制备。压制片剂可以通过在合适的机器中压制自由流动形式如粉末或颗粒的活性成分来制备,任选地与赋形剂混合。模制片剂可以通过将用惰性液体稀释剂润湿的粉末状化合物的混合物在合适的机器中模压来制备。
[0120]
在某些实施方式中,可用于口服剂型的赋形剂包括但不限于粘合剂、填充剂、崩解剂和润滑剂。适用于药物组合物和剂型的粘合剂包括但不限于玉米淀粉、马铃薯淀粉或其他淀粉、明胶、天然和合成胶如阿拉伯胶、海藻酸钠、海藻酸、其他海藻酸盐、瓜尔豆胶、纤维素及其衍生物(例如乙基纤维素、醋酸纤维素、羧甲基纤维素钙、羧甲基纤维素钠)、聚乙烯吡咯烷酮、甲基纤维素、预糊化淀粉、羟丙基甲基纤维素(例如,nos.2208、2906、2910),微晶纤维素及其混合物。
[0121]
在某些实施方式中,适用于本文公开的药物组合物和剂型的填充剂包括但不限于滑石粉、碳酸钙(例如,颗粒或粉末)、微晶纤维素、粉状纤维素、葡聚糖、高岭土、甘露醇、硅酸盐酸、山梨糖醇、淀粉、预糊化淀粉及其混合物。药物组合物中的粘合剂或填充剂通常以药物组合物或剂型的约50至约99重量%存在。
[0122]
在某些实施方式中,微晶纤维素的合适形式包括但不限于以avicel ph 101、avicel ph 103avicel rc 581、avicel ph 105为商品名出售的材料(可从fmc公司,美国粘胶事业部(american viscose division),avicel销售,marcus hook获得,宾夕法尼亚州)及其混合物。一种特定的粘合剂是微晶纤维素和羧甲基纤维素钠的混合物,以avicel rc 581的商品名出售。合适的无水或低水分赋形剂或添加剂包括avicel ph 103
tm
和starch 1500lm。
[0123]
崩解剂用于组合物中以提供在暴露于水性环境时崩解的片剂。崩解剂含量过多的片剂可能会在储存时崩解,而崩解剂含量过少的片剂可能无法以所需的速率或在所需的条件下崩解。因此,应该使用足够量的崩解剂来形成固体口服剂型,该崩解剂既不过多也不过少而不会有害地改变活性成分的释放。崩解剂的使用量根据制剂的类型而变化,并且对于本领域普通技术人员来说是容易判断的。典型的药物组合物包含约0.5至约15重量%的崩解剂,特别是约1至约5重量%的崩解剂。
[0124]
可用于药物组合物和剂型的崩解剂包括但不限于琼脂、藻酸、碳酸钙、微晶纤维素、交联羧甲基纤维素钠、交联聚维酮、波拉克林钾、羟基乙酸淀粉钠、马铃薯或木薯淀粉、预糊化淀粉、其他淀粉、粘土、其他藻类、其他纤维素、树胶及其混合物。
[0125]
可用于药物组合物和剂型的润滑剂包括但不限于硬脂酸钙、硬脂酸镁、矿物油、轻质矿物油、甘油、山梨糖醇、甘露醇、聚乙二醇、其他二醇、硬脂酸、十二烷基硫酸钠、滑石粉、氢化植物油(例如,花生油、棉籽油、葵花油、芝麻油、橄榄油、玉米油和大豆油)、硬脂酸锌、油酸乙酯、月桂酸乙酯、琼脂及其混合物。在某些实施方式中,另外的润滑剂包括syloid硅胶(aerosil 200,由马里兰州巴尔的摩的wr grace公司制造)、合成二氧化硅的凝结气溶胶(由德克萨斯州普莱诺的degussa公司销售)、cab o sil(马萨诸塞州波士顿的cabot公司销售的热解二氧化硅产品)及其混合物。如果使用润滑剂,润滑剂的用量通常少于掺入它们的药物组合物或剂型的约1重量%。
[0126]
延迟释放剂型
[0127]
活性成分如本文提供的化合物可以通过控释方式或通过本领域普通技术人员熟知的递送装置给药。在某些实施方式中,包括但不限于,美国专利号:3,845,770;3,916,899;3,536,809;3,598,123;4,008,719;5,674,533;5,059,595;5,591,767;5,120,548;5,073,543;5,639,476;5,354,556;5,639,480;5,733,566;5,739,108;5,891,474;5,922,356;5,972,891;5,980,945;5,993,855;6,045,830;6,087,324;6,113,943;6,197,350;6,
248,363;6,264,970;6,267,981;6,376,461;6,419,961;6,589,548;6,613,358;和6,699,500中描述的那些,其中的每一项都以全文引用的方式并入本文。此类剂型可用于提供一种或多种活性成分的缓慢或受控释放,在某些实施方式中,使用羟丙基甲基纤维素、其他聚合物基质、凝胶、渗透膜、渗透系统、多层包衣、微粒、脂质体、微球或其组合以提供不同比例的所需释放曲线。可以容易地选择本领域普通技术人员已知的合适的控释制剂,包括本文所述的那些,以与本文提供的活性成分一起使用。因此本文涵盖适合口服给药的单一单位剂型,例如但不限于片剂、胶囊、明胶胶囊和适于控释的囊片。
[0128]
所有控释药物产品都有一个共同的目标,即相较于非控释药物改善药物治疗效果。理想地,在医学治疗中使用优化设计的控释制剂的特征在于在最短时间内使用最少的药物来治愈或控制疾病或病症。控释制剂的优点包括药物活性延长、给药频率降低和受试者依从性增加。此外,控释制剂可用于影响起效时间或其他特性,例如药物的血液水平,从而影响副作用(例如,不良反应)的发生。
[0129]
大多数控释制剂的设计初衷是释放一定量的药物(活性成分),从而迅速产生所需的治疗效果,然后逐渐和持续释放其余量的药物,以在较长时间内保持这种水平的治疗或预防效果。为了在体内维持这种恒定的药物水平,药物必须以一定速率从剂型中释放,该速率将替代从体内代谢和排泄的药物量。活性成分的受控释放可以受到各种疾病或病症的刺激,包括但不限于ph、温度、酶、水或其他生理疾病或病症或化合物。
[0130]
在某些实施方式中,可以使用静脉输注、植入式渗透泵、透皮贴剂、脂质体或其他给药方式来给药药物。在某些实施方式中,可以使用泵(参见,sefton,生物医学工程评论(crc crit.ref biomed eng.)14:201(1987);buchwald等,外科手术(surgery)88:507(1980);saudek等,新英格兰医学杂志(n.engl.j med)321:574(1989))。在另一个实施方式中,可以使用聚合材料。在另一个实施方式中,可以将控释系统置于受试者体内由本领域技术人员确定的适当部位,即,因此仅需要全身剂量的一部分(参见例如goodson,控释的医学应用(medical applications of controlled release),第2卷,第115-138页(1984年))。在langer的综述(科学(science)249:1527-1533(1990))中讨论了其他控释系统。活性成分可以分散在不溶于体液的固体内基质中,例如聚甲基丙烯酸甲酯、聚甲基丙烯酸丁酯、增塑或未增塑的聚氯乙烯、增塑尼龙、增塑聚对苯二甲酸乙二醇酯、天然橡胶、聚异戊二烯、聚异丁烯、聚丁二烯、聚乙烯、乙烯-乙酸乙烯酯共聚物、硅橡胶、聚二甲基硅氧烷、有机硅碳酸酯共聚物、亲水性聚合物,例如丙烯酸和甲基丙烯酸酯的水凝胶、胶原、交联聚乙烯醇和交联部分水解聚醋酸乙烯酯,固体基质被不溶于体液的外层聚合物膜包围,例如,聚乙烯、聚丙烯、乙烯/丙烯共聚物、乙烯/丙烯酸乙酯共聚物、乙烯/醋酸乙烯酯共聚物、硅橡胶、聚二甲基硅氧烷、氯丁橡胶、氯化聚乙烯、聚氯乙烯、氯乙烯与醋酸乙烯酯共聚物、偏二氯乙烯、乙烯和丙烯的共聚物、离聚物聚对苯二甲酸乙二醇酯、丁基橡胶环氧氯丙烷橡胶、乙烯/乙烯醇共聚物、乙烯/醋酸乙烯酯/乙烯醇三元共聚物、和乙烯/乙烯氧基乙醇共聚物。然后活性成分在释放速率控制步骤中通过外聚合物膜扩散。这种肠胃外组合物中活性成分的百分比高度取决于其具体性质以及受试者的需要。
[0131]
肠胃外剂型
[0132]
在某些实施方式中,本文提供的是肠胃外剂型。在某些实施方式中,肠胃外剂型可以通过各种途径施用于受试者,包括但不限于皮下、静脉内(包括推注)、肌内和动脉内。在
某些实施方式中,肠胃外剂型可以通过各种途径施用于受试者,包括但不限于局部、皮内或病灶内。因为其施用通常绕过受试者对污染物的天然防御,所以肠胃外剂型通常是无菌的或能够在施用至受试者之前被灭菌。在某些实施方式中,肠胃外剂型包括但不限于准备注射的溶液、准备溶解或悬浮在药学上可接受的注射用载体中的干燥产品、准备注射的混悬剂和乳剂。
[0133]
可用于提供肠胃外剂型的合适载体是本领域技术人员熟知的。在某些实施例中,合适的载体包括但不限于:注射用水usp;水性载体,例如但不限于氯化钠注射液、林格氏注射液、葡萄糖注射液、葡萄糖和氯化钠注射液和乳酸林格注射液;与水混溶的载体,例如但不限于乙醇、聚乙二醇和聚丙二醇;和非水载体,例如但不限于玉米油、棉籽油、花生油、芝麻油、油酸乙酯、肉豆蔻酸异丙酯和苯甲酸苄酯。
[0134]
能增加本文公开的一种或多种活性成分的溶解度的化合物也可以掺入肠胃外剂型中。
[0135]
透皮、局部和粘膜剂型
[0136]
本发明还提供了透皮、局部和粘膜剂型。透皮、局部和粘膜剂型包括但不限于眼用溶液、喷雾剂、气雾剂、乳膏、洗剂、软膏、凝胶、溶液、乳液、悬浮液或本领域技术人员已知的其他形式。参见,例如,雷明顿:药学的科学与实践(remington:the science and practice of pharmacy),医药出版社(pharmaceutical press),第22版(2012年9月15日);和药物剂型介绍(introduction to pharmaceutical dosage forms),第4版,lea和febiger,费城(1985)。适用于治疗口腔内粘膜组织的剂型可以配制成漱口水或口服凝胶。此外,透皮剂型包括“储库型”或“基质型”贴剂,可将其施用于皮肤并佩戴特定时长以允许所需量的活性成分渗透。
[0137]
术语“药学上可接受的载体”是指药学上可接受的材料、组合物或载体,例如液体或固体填充剂、稀释剂、赋形剂、溶剂或包封材料,用于携带或运输任何主题组合物或其组分。在与主题组合物及其组分相容且对患者无害的意义上,每种载体必须是“可接受的”。合适的载体(例如赋形剂和稀释剂)和其他可用于提供本文涵盖的透皮、局部和粘膜剂型的材料是制药领域技术人员熟知的,并且取决于将对其应用给定药物组合物或剂型的特定组织。考虑到这一事实,典型的载体包括但不限于水、丙酮、乙醇、乙二醇、丙二醇、聚乙二醇、1,3-丁二醇、肉豆蔻酸异丙酯、棕榈酸异丙酯、矿物油、及其混合物以形成洗剂、酊剂、霜剂、乳剂、凝胶或软膏,它们是无毒且药学上可接受的。在一些实施方式中,可用作药学上可接受的载体的材料包括:(1)糖,例如乳糖、葡萄糖和蔗糖;(2)淀粉,例如玉米淀粉和马铃薯淀粉;(3)纤维素及其衍生物,如羧甲基纤维素钠、乙基纤维素、醋酸纤维素;(4)黄蓍胶粉;(5)麦芽;(6)明胶;(7)滑石;(8)可可脂、栓剂蜡等赋形剂;(9)油类,如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油、大豆油;(10)二醇类,例如丙二醇;(11)多元醇,如甘油、山梨醇、甘露醇、聚乙二醇等;(12)酯类,如油酸乙酯、月桂酸乙酯;(13)琼脂;(14)缓冲剂,如氢氧化镁、氢氧化铝;(15)海藻酸;(16)无热原水;(17)等渗盐水;(18)林格氏溶液;(19)乙醇;(20)磷酸盐缓冲溶液;(21)药物制剂中使用的其他无毒相容物质。如果需要,也可以将保湿剂或保湿剂添加到药物组合物和剂型中。这种附加成分的例子在本领域中是众所周知的。参见,例如,雷明顿:药学的科学与实践(remington:the science and practice of pharmacy),医药出版社(pharmaceutical press),第22版(2012年9月15日)
[0138]
根据待治疗的具体组织,可以在用所提供的活性成分治疗之前、同时或之后使用额外的组分。在某些实施方式中,渗透促进剂可用于帮助将活性成分递送至组织。合适的渗透促进剂包括但不限于:丙酮;乙醇、油醇、四氢呋喃等各种醇;烷基亚砜,例如二甲亚砜;二甲基乙酰胺;二甲基甲酰胺;聚乙二醇;吡咯烷酮,例如聚乙烯吡咯烷酮;聚乙稀吡咯烷酮(聚维酮);尿素;以及各种水溶性或不溶性糖酯,例如吐温80(聚山梨醇酯80)和斯潘60(山梨糖醇单硬脂酸酯)。
[0139]
还可以调节药物组合物或剂型的ph值,或施用药物组合物或剂型的组织的ph值,以改善一种或多种活性成分的递送。类似地,可以调节溶剂载体的极性、离子强度或张力以改善递送。诸如硬脂酸盐的化合物也可以添加到药物组合物或剂型中,以有利地改变一种或多种活性成分的亲水性或亲油性,从而改善递送。在这方面,硬脂酸盐可用作制剂的脂质载体、乳化剂或表面活性剂、以及递送增强剂或渗透增强剂。活性成分的不同配合物、盐、水合物或溶剂化物可用于进一步调节所得组合物的性质。
[0140]
剂量和单位剂型
[0141]
在人类治疗中,医生将根据预防性或治愈性治疗并根据年龄、体重、疾病或疾病的阶段和其他特定于待治疗对象的因素来确定他认为最合适的剂量。在某些实施方式中,剂量为成人每天约1至约1000mg,或成人每天约5至约250mg或每天约10至50mg。在某些实施方式中,剂量为每名成人每天约5至约400mg或每天25至200mg。在某些实施方式中,还考虑每天约50至约500mg的剂量率。
[0142]
在另一方面,提供了通过向有需要的受试者施用治疗或预防有效量的本发明提供的化合物,或其药学上可接受的复合物,来治疗受试者需要治疗的疾病或病症和/或受试者的遗传性皮肤病的方法。在治疗障碍或其一种或多种症状中,在治疗或预防上有效的化合物或组合物的量,将随疾病或病症的性质和严重程度以及施用活性成分的途径而变化。频率和剂量也将根据每个受试者的具体因素而变化,具体取决于所施用的具体疗法(例如,治疗剂或预防剂)、病症、疾病或病症的严重程度、施用途径以及受试者的年龄、身体、体重、反应和既往病史。有效剂量可以从来自体外或动物模型试验系统的剂量反应曲线外推。
[0143]
在某些实施方式中,组合物的示例性剂量包括每千克受试者体重或样品重量的毫克或微克量的活性化合物(例如,约10微克/千克至约50毫克/千克、约100微克/千克至约25毫克/千克,或约100微克/千克至约10毫克/千克)。对于本文提供的组合物,在某些实施方式中,给予受试者的剂量为,基于活性化合物的重量,0.140mg/kg至3mg/kg受试者体重。在某些实施方式中,给予受试者的剂量为0.20mg/kg至2.00mg/kg、0.30mg/kg至1.50mg/kg、1mg/kg至100mg/kg、5mg/kg至50mg/kg、10mg/kg至50mg/kg、20mg/kg至50mg/kg、15mg/kg至40mg/kg、15mg/kg至35mg/kg、15mg/kg至30mg/kg、25mg/kg至35mg/kg、10mg/kg至30mg/kg、10mg/kg至20mg/kg、约5mg/kg、约10mg/kg、约15mg/kg、约20mg/kg、约25mg/kg、约30mg/kg、约35mg/kg、约40mg/kg、约45mg/kg或约50mg/kg受试者体重。
[0144]
在某些实施方式中,本文提供的用于本文所述的疾病或病症的组合物的推荐日剂量范围在约0.1mg至约1000mg/天的范围内,作为一天一次的单一剂量或一天内分次给予。在某些实施方式中,每日剂量以等分的剂量每天给药两次。在某些实施方式中,日剂量范围应为每天约10mg至约200mg,在其他实施方式中,每天约10mg至约150mg,在进一步的实施方式中,每天约25至约100mg。在某些情况下,可能需要使用本文公开范围之外的活性成分的
剂量,这对本领域普通技术人员来说是显而易见的。此外,注意到临床医师或治疗医师将知道如何以及何时根据受试者反应中断、调整或终止治疗。
[0145]
如本领域普通技术人员所易知,不同的治疗有效量可适用于不同的疾病和病症。类似地,足以预防、控制、治疗或改善此类病症但不足以引起或足以减少与本文提供的组合物相关的副作用的量也包括在本文所述的剂量和给药频率方案中。此外,当向受试者施用多剂量的本文提供的组合物时,并非所有剂量都需要相同。在某些实施方式中,可以增加给予受试者的剂量以提高组合物的预防或治疗效果,或者可以降低剂量以减少特定受试者正在经历的一种或多种副作用。
[0146]
在某些实施方式中,施用以预防、治疗、控制或改善受试者的病症或其一种或多种症状的本文提供的组合物的剂量,基于活性化合物的重量,为0.1mg/kg、1mg/kg、2mg/kg、3mg/kg、4mg/kg、5mg/kg、6mg/kg、10mg/kg或15mg/kg受试者体重或更多。在另一实施方式中,施用以预防、治疗、控制或改善受试者的病症或其一种或多种症状的本文提供的组合物的剂量,基于活性化合物的重量,为0.1mg至200mg、0.1mg至100mg、0.1mg至50mg、0.1mg至25mg、0.1mg至20mg、0.1mg至15mg、0.1mg至10mg、0.1mg至7.5毫克、0.1毫克至5毫克、0.1至2.5毫克、0.25毫克至20毫克、0.25至15毫克、0.25至12毫克、0.25至10毫克、0.25毫克至7.5毫克、0.25毫克至5毫克、0.5毫克至2.5毫克、1毫克至20毫克、1毫克至15毫克、1毫克至12毫克、1毫克至10毫克、1毫克至7.5毫克、1毫克至5毫克或1毫克至2.5毫克的单位剂量。
[0147]
在某些实施方式中,治疗或预防可以用一种或多种本文提供的化合物或组合物的负荷剂量开始,然后是一次或多次维持剂量。在这样的实施方式中,负荷剂量可以是例如每天约60至约400mg,或每天约100至约200mg,持续1天至5周。负荷剂量之后可以是一次或多次维持剂量。在某些实施方式中,每次维持剂量独立地为每天约10mg至约200mg、每天约25mg至约150mg、或每天约25mg至约80mg。维持剂量可以每天给药,也可以单次给药,也可以分次给药。
[0148]
在某些实施方式中,可以施用一定剂量的本文提供的化合物或组合物以达到活性成分在受试者的血液或血清中的稳态浓度。稳态浓度可以根据本领域技术人员可用的技术通过测量来确定,或者可以基于受试者的身体特征,例如身高、体重和年龄。在某些实施方式中,施用足量的本文提供的化合物或组合物以在受试者的血液或血清中达到约300至约4000ng/ml、约400至约1600ng/ml、约600到约1200ng/ml的稳态浓度。在某些实施方式中,局部施用足量的本文提供的化合物或组合物以在受试者的血液或血清中达到约0.01至约300ng/ml、约0.01至约100ng/ml、约0.01至约10ng/ml、约0.01至约1ng/ml、约0.01至约0.1ng/ml或约0.01至约0.05ng/ml的稳态浓度。在一些实施方式中,可以施用负荷剂量以达到约1200至约8000ng/ml或约2000至约4000ng/ml的稳态血液或血清浓度持续1至5天。在一些实施方式中,可以局部施用负荷剂量以实现约0.05至约1200ng/ml、约0.05至约100ng/ml、约0.05至约10ng/ml、约0.05至约1ng/ml、约0.05至约0.5ng/ml,或约0.05至约0.1ng/ml的稳态血液或血清浓度,持续1至5天。在某些实施方式中,可以施用维持剂量以在受试者的血液或血清中达到约300至约4000ng/ml、约400至约1600ng/ml或约600至约1200ng/ml的浓度。在某些实施方式中,可以局部施用维持剂量以达到约0.01至约300ng/ml、约0.01至约100ng/ml、约0.01至约10ng/ml、约0.01至约1ng/ml、约0.01至约0.1ng/ml、或约0.01至约0.05ng/ml的受试者血液或血清中的稳态浓度。
[0149]
在某些实施方式中,可以重复施用相同的组合物并且施用可以相隔至少1天、2天、3天、5天、10天、15天、30天、45天、2个月、75天、3个月或6个月。在其他实施方式中,可以重复施用相同的预防剂或治疗剂并且施用可以相隔至少1天、2天、3天、5天、10天、15天、30天、45天、2个月、75天、3个月或6个月。
[0150]
在本发明的某些方面,本文提供了单位剂量,其包含适合施用的形式的化合物或其药学上可接受的复合物。对于任何化合物,治疗有效剂量最初可以从细胞培养测定中估计。可以在动物模型中配制剂量以在具有损伤(例如,内瑟顿综合征或由klk蛋白酶介导的皮肤病)的皮肤中达到包括在细胞培养中测定的ic
50
(即达到最大抑制症状一半的测试化合物的浓度)的水平。此类信息可用于更准确地确定人体的有用剂量。此外,可以测量血浆中的化合物水平,例如,通过高效液相色谱,以确定全身暴露。
[0151]
还应该理解,任何特定患者的特定剂量和治疗方案将取决于多种因素,包括所用特定化合物的活性、年龄、病变大小、病变数量、一般健康状况、性别、饮食、给药时间、药物组合,以及治疗医师的判断和正在治疗的特定疾病的严重程度。本文所述的式(i)化合物在组合物中的量还将取决于组合物中的具体式(i)化合物。
[0152]
在一些实施方式中,局部剂量为约0.01μg/cm2、约0.05μg/cm2、约0.1μg/cm2、约0.15μg/cm2、约0.2μg/cm2、约0.3f.lg/cm2、约0.4f.lg/cm2、约0.5μg/cm2、约0.6μg/cm2、约0.7μg/cm2、约0.8μg/cm2、or约0.9μg/cm2;或者在约0.01-0.03μg/cm2、约0.03-0.05μg/cm2、约0.05-0.1μg/cm2、约0.1-0.3μg/cm2、约0.3-0.5μg/cm2、约0.5-0.8μg/cm2、约0.8-1.0μg/cm2、约1-10μg/cm2、约10-20μg/cm2、约20-30μg/cm2、约30-40μg/cm2、约40-50μg/cm2、约50-60μg/cm2、约60-70μg/cm2、约70-80μg/cm2、约80-90μg/cm2、约90-100μg/cm2、约100-125μg/cm2、约125-150μg/cm2、约150-175μg/cm2、约175-200μg/cm2、约200-20250μg/cm2、约250-300μg/cm2、约300-350μg/cm2、约350-400μg/cm2、约400-450μg/cm2、约450-500μg/cm2、约500-550μg/cm2、约550-600μg/cm2、约600-650μg/cm2、约650-700μg/cm2、约700-750μg/cm2、约750-800μg/cm2、约800-850μg/cm2、约850-900μg/cm2、约900-950μg/cm2或约950-1000μg/cm2范围内。
[0153]
在一些实施方式中,局部剂量在约0.5-1.0mg/cm2、1.0-1.5mg/cm2、1.5-2.0mg/cm2、2.5-2.5mg/cm2、3.0-3.5mg/cm2、3.5-5.0mg/cm2、5.0-7.5mg/cm2、7.5-10mg/cm2、1-10mg/cm2、约10-20mg/cm2、约20-30mg/cm2、约30-40mg/cm2、约40-50mg/cm2、约50-60mg/cm2、约60-70mg/cm2、约70-80mg/cm2、约80-90mg/cm2、约90-100mg/cm2、约100-125mg/cm2、约125-150mg/cm2、约150-175mg/cm2、约175-200mg/cm2、约200-250mg/cm2、约250-300mg/cm2、约300-350mg/cm2、约350-400mg/cm2、约400-450mg/cm2、约450-500mg/cm2、约500-550mg/cm2、约550-600mg/cm2、约600-650mg/cm2、约650-700mg/cm2、约700-750mg/cm2、约750-800mg/cm2、约800-850mg/cm2、约850-900mg/cm2、约900-950mg/cm2或约950-1000mg/cm2。
[0154]
v.方法
[0155]
在本发明的第三方面,提供了一种用于治疗与一种或多种klk蛋白酶的蛋白水解活性相关的有需要的受试者的皮肤病的方法。该方法包括向受试者施用治疗有效量的式(i)化合物或其药学上可接受的复合物,或包含式(i)化合物或其药学上可接受的复合物的药物组合物。
[0156]
在一些实施方式中,所述式(i)化合物为下式所示化合物或其药学上可接受的复
合物:
[0157][0158]
在一些实施方式中,所述式(i)化合物为下式所示化合物或其药学上可接受的复合物:
[0159][0160]
式(i)化合物的药学上可接受的复合物如本文所定义和描述。式(i)化合物的药学上可接受的复合物可以包括其药学上可接受的盐和/或溶剂化物。
[0161]
在一些实施方式中,皮肤病是遗传皮肤病。在一些实施方式中,所述的遗传性皮肤病是内瑟顿综合征。
[0162]
在一些实施方式中,受试者具有截短的丝氨酸蛋白酶抑制剂kazal型5(spink5)的功能缺失突变。在一些实施方式中,受试者具有lekti(淋巴上皮kazal型抑制剂)功能丧失。在一些实施方式中,受试者具有一种或多种激肽释放酶(klk)丝氨酸蛋白酶的过表达。在一些实施方式中,受试者具有一种或多种klk5、klk7和klk14蛋白酶的过表达。在一些实施方式中,受试者具有klk5蛋白酶的过表达。在一些实施方式中,受试者具有klk7蛋白酶的过表达。在一些实施方式中,受试者具有klk14蛋白酶的过表达。在一些实施方式中,受试者具有klk5和klk7蛋白酶的过表达。在一些实施方式中,受试者具有klk5、klk7和klk14蛋白酶的过表达。在一些实施方式中,受试者具有升高的一种或多种激肽释放酶(klk)丝氨酸蛋白酶的蛋白水解活性。在一些实施方式中,受试者具有升高的一种或多种klk5、klk7和klk14蛋白酶的蛋白水解活性。在一些实施方式中,受试者具有升高的klk5蛋白酶的蛋白水解活性。在一些实施方式中,受试者具有升高的klk7蛋白酶的蛋白水解活性。在一些实施方式中,受试者具有升高的klk14蛋白酶的蛋白水解活性。在一些实施方式中,受试者具有升高的klk5和klk7蛋白酶的蛋白水解活性。在一些实施方式中,受试者具有升高的klk5、klk7和klk14蛋白酶的蛋白水解活性。
[0163]
在一些实施方式中,本文提供了一种用于治疗有需要的受试者的内瑟顿综合征的方法。该方法包括向受试者施用治疗有效量的式(i)化合物或其药学上可接受的复合物,或包含式(i)化合物或其药学上可接受的复合物的药物组合物
[0164]
在一些实施方式中,本文提供了一种用于治疗遗传性皮肤病的方法,其中受试者有需要并且遗传性皮肤病由一种或多种klk蛋白酶介导。该方法包括向受试者施用治疗有效量的式(i)化合物或其药学上可接受的复合物,或包含式(i)化合物或其药学上可接受的
复合物的药物组合物。在一些实施方式中,遗传性皮肤病由klk5蛋白酶、klk7蛋白酶、klk14蛋白酶或其组合介导。在一些实施方式中,遗传皮肤病由klk5蛋白酶介导。在一些实施方式中,遗传皮肤病由klk7蛋白酶介导。在一些实施方式中,遗传皮肤病由klk14蛋白酶介导。在一些实施方式中,遗传皮肤病由klk5和klk7蛋白酶两者介导。在一些实施方式中,遗传皮肤病由klk5、klk7和klk14蛋白酶介导。在一些实施方式中,遗传性皮肤病是内瑟顿综合征。
[0165]
在一些实施方式中,提供了一种通过抑制一种或多种klk蛋白酶的蛋白水解活性来治疗受试者遗传性皮肤病的方法。该方法包括向受试者施用治疗有效量的式(i)化合物或其药学上可接受的复合物,或包含式(i)化合物或其药学上可接受的复合物的药物组合物。在一些实施方式中,式(i)化合物抑制一种或多种klk蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk5蛋白酶、klk7蛋白酶、klk14蛋白酶或其组合的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk5蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk7蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk14蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk5和klk7蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk5、klk7和klk14蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物是klk5抑制剂。在一些实施方式中,式(i)化合物是klk7抑制剂。在一些实施方式中,式(i)化合物是klk14抑制剂。在一些实施方式中,式(i)化合物是双重klk5/klk7抑制剂。在一些实施方式中,遗传性皮肤病是内瑟顿综合征。
[0166]
在一些实施方式中,本文提供了一种通过抑制一种或多种klk蛋白酶的蛋白水解活性来治疗受试者的内瑟顿综合征的方法。该方法包括向受试者施用治疗有效量的式(i)化合物或其药学上可接受的复合物,或包含式(i)化合物或其药学上可接受的复合物的药物组合物。在一些实施方式中,式(i)化合物抑制一种或多种klk蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk5蛋白酶、klk7蛋白酶、klk14蛋白酶或其组合的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk5蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk7蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk14蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk5和klk7蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk5、klk7和klk14蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物是klk5抑制剂。在一些实施方式中,式(i)化合物是klk7抑制剂。在一些实施方式中,式(i)化合物是klk14抑制剂。在一些实施方式中,式(i)化合物是双重klk5/klk7抑制剂。
[0167]
本发明的化合物可用于通过抑制一种或多种klk蛋白酶的蛋白水解活性和促进健康皮肤发育来保护皮肤。因此,在另一方面,本文提供了一种治疗皮肤病的方法,其中受试者需要治疗并且该皮肤病由一种或多种klk蛋白酶介导。该方法包括向受试者施用治疗有效量的式(i)化合物或其药学上可接受的复合物,或包含式(i)化合物或其药学上可接受的复合物的药物组合物。在一些实施方式中,皮肤病由klk5蛋白酶、klk7蛋白酶、klk14蛋白酶或其组合介导。在一些实施方式中,皮肤病由klk5蛋白酶介导。在一些实施方式中,皮肤病由klk7蛋白酶介导。在一些实施方式中,皮肤病由klk14蛋白酶介导。在一些实施方式中,皮肤病由klk5和klk7蛋白酶两者介导。在一些实施方式中,皮肤病由klk5、klk7和klk14蛋白酶介导。在一些实施方式中,皮肤病是klk介导的疾病,选自内瑟顿综合征、脱皮综合征、红斑痤疮、牛皮癣、湿疹和特应性皮炎。在一些实施方式中,klk介导的疾病是内瑟顿综合征。
[0168]
在一些实施方式中,本文提供了一种通过抑制一种或多种klk蛋白酶的蛋白水解活性来治疗受试者皮肤病的方法。该方法包括向受试者施用治疗有效量的式(i)化合物或其药学上可接受的复合物,或包含式(i)化合物或其药学上可接受的复合物的药物组合物。在一些实施方式中,式(i)化合物抑制一种或多种klk蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk5蛋白酶、klk7蛋白酶、klk14蛋白酶或其组合的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk5蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk7蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk14蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk5和klk7蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物抑制klk5、klk7和klk14蛋白酶的蛋白水解活性。在一些实施方式中,式(i)化合物是klk5抑制剂。在一些实施方式中,式(i)化合物是klk7抑制剂。在一些实施方式中,式(i)化合物是klk14抑制剂。在一些实施方式中,式(i)化合物是双重klk5/klk7抑制剂。在一些实施方式中,皮肤病选自内瑟顿综合征、脱皮综合征、红斑痤疮、牛皮癣、湿疹和特应性皮炎。在一些实施方式中,皮肤病是内瑟顿综合征。
[0169]
本发明的式(i)化合物或包含式(i)化合物的药物组合物,可用于受试者中皮肤疾病或病理或其他不良皮肤状况的预防性和治疗性治疗。例如,本发明的组合物可用于预防皮肤刺激、防止皮疹、在皮疹或刺激发生后促进皮肤组织的愈合(即,构建皮肤的表皮和/或真皮层)、预防和/或延缓皮肤萎缩,防止和/或延缓蜘蛛状血管和/或皮肤上的红色斑点的出现,防止和/或延缓皮肤脱皮,防止和/或缓解皮肤瘙痒,调节皮肤质地(例如,改善脱皮、粗糙、肿胀和酸痛)和改善肤色(例如,减少发红)。
[0170]
可以通过润肤液、乳膏、凝胶、泡沫、软膏、糊剂、乳剂、喷雾剂、调理剂、滋补剂、贴剂等形式施用式(i)的化合物或其药物组合物,以此来实施对受试者的遗传性皮肤病或皮肤病的预防性或治愈性治疗,它们最好留在皮肤上。在将组合物施用于皮肤后,它可以留在皮肤上至少约15分钟,或至少约30分钟,或至少约1小时,或至少几个小时,例如,至少约2小时、3小时、6小时、12小时或24小时。
[0171]
本发明的化合物还可用于通过在细胞/组织培养过程中抑制一种或多种klk蛋白酶的蛋白酶活性来调节体外脱屑。因此,在另一个方面,本发明提供了一种体外分解细胞或组织的方法,该方法包括将细胞或组织暴露于klk蛋白酶(例如klk5、klk7和/或klk14)然后暴露于本发明的式(i)化合物或其药学上可接受的复合物。
[0172]
应当理解,该方法通常可应用于细胞培养程序,其中该方法可用于解离和分离细胞以供传代。此外,该方法可用于人工皮肤的培养,其中通过klk蛋白酶(例如,klk5、klk7和/或klk14)选择性切割细胞-细胞粘附蛋白,同时通过式(i)化合物或其其药学上可接受的复合物调节这种切割,使细胞/组织更适合随后的治疗用途。
[0173]
在另一方面,本发明提供了用于确定皮肤中一种或多种klk蛋白酶的蛋白水解活性的体外测定方法。该方法包括1)制备皮肤提取物;2)将底物和式(i)化合物或其药学上可接受的复合物暴露于皮肤提取物;3)确定底物的蛋白水解切割速率。在一些实施方式中,底物是肽-对硝基苯胺(也称为肽-pna)。在一些实施方式中,底物是二肽-pna、三肽-pna、四肽-pna、五肽-pna或六肽-pna。在一些实施方式中,底物是四肽-pna。在一些实施方式中,底物是tyr-arg-ser-arg-pna或lys-hisleu-tyr-pna。在一些实施方式中,底物是tyr-arg-ser-arg-pna。在一些实施方式中,底物是lys-his-leu-tyr-pna。皮肤提取物可以是人皮肤
提取物或动物皮肤提取物(例如小鼠)。在一些实施方式中,皮肤提取物是人皮肤提取物。
[0174]
vi.实施例
[0175]
一般合成方法
[0176]
如本文所用,这些过程、路线和实施例中使用的符号和约定,无论是否具体定义了特定缩写,都与当代科学文献中使用的符号和约定一致,例如,美国化学学会杂志(journal of the american chemical society)或生物化学杂志(journal of biological chemistry)。具体地,以下缩写,但不限于此,可用于示例中和整个说明书中:eq.(当量);g(克);mg(毫克);ml(毫升);μl(微升);mm(毫摩尔每升);μm(微摩尔每升);hz(赫兹);mhz(兆赫兹);mmol(毫摩尔);hr或hrs(小时);min(分钟);rt(室温);ms(质谱);esi(电喷雾电离);tlc(薄层色谱);hplc(高压液相色谱);thf(四氢呋喃);cdcl3(氘代氯仿);acoh(乙酸);dcm(二氯甲烷);dmw(软化水);dme(二甲氧基乙烷);dmf(n,n二甲基甲酰胺);dmso(二甲基亚砜);dmso-d6(氘代二甲亚砜);etoac(乙酸乙酯);和meoh(甲醇)。
[0177]
对于所有以下实施例,可以使用本领域技术人员已知的标准后处理和纯化方法。除非另有说明,否则所有温度均以℃(摄氏度)表示。除非另有说明,所有反应均在室温下进行。本文说明的合成方法旨在通过使用具体实施例来举例说明适用的化学,并不表示本公开的范围。
[0178]
实施例1:2-(4-(羟甲基)-2-(甲基磺酰基)苯基)-7,8-二氢-4h[1,4]二噁英[2',3':4,5]苯并[1,2-d)[1,3]噁嗪-4-酮(化合物1.001)的合成
[0179][0180]
化合物1.001的合成如图1所示。中间体100的合成如图3所示。
[0181]
步骤1:4-溴-2-巯基苯甲酸(中间体102)
[0182][0183]
向2-氨基-4-溴苯甲酸(101)(200.0g,926.0mmol,1.0当量)、naoh(37.0g,926.0mmol,1.0当量)和亚硝酸钠(63.90g,926.0mmol,1.0当量)的dmw(4.0l)溶液中,缓慢加入浓hcl(280.0ml)和冰水(280.0ml)的混合物,以一定的速率加入,使得反应温度维持在3-6℃。添加后,将反应混合物在0℃搅拌30分钟,然后用乙酸钾(454.0g,4.63mol,5.0当量)中和。将该溶液加入到预热至90℃的dmw(4.0l)中的o-乙基黄原酸钾(445.0g,2.78mol,3.0当量)溶液中。将反应混合物在90℃搅拌30分钟,冷却至0℃,并用浓hcl(600.0ml)酸化。用20%naoh(1750ml)碱化反应混合物,加热至85℃保持2小时。向该混合物中分小份加入
nahso3(96.30g,926.0mmol,1.0当量),并将反应混合物加热至85℃保持10分钟。过滤反应混合物,冷却至0℃,并用浓hcl(650.0ml)酸化。过滤收集析出的固体,用dmw(500ml)洗涤,然后用正己烷洗涤,风干,得到淡灰色固体状的中间体102(216.0g,100.0%)。1hnmr(300mhz,dmso-d6):δ7.88ppm(d,j=1.9hz,1h),7.81ppm(t,j=7.4hz,1h),7.38ppm(dd,j=8.4,2.0hz,1h).ms(esi):m/z 232.8(m-1).
[0184]
步骤2:4-溴-2-(甲硫基)苯甲酸甲酯(中间体103)
[0185][0186]
在室温下,向4-溴-2-巯基苯甲酸(102)(216.0g,927.0mmol,1.0当量)的dmf(3.24l)溶液中加入碳酸钾(896.0g,6.49mol,7.0当量)和碘甲烷(231.0ml,3.71mol,4.0当量)。将反应混合物加热到80℃并在80℃下搅拌20h。反应进程通过tlc(10%etoac的正己烷溶液)监控,以确定反应完全。加入dmw(2.5l),产物用乙酸乙酯(2x2.5l)萃取。合并的etoac萃取液用dmw(2x2.5l)、盐水(2.5l)洗涤,用硫酸钠干燥,过滤,滤液真空浓缩得到棕色油状的中间体103(180g,74.40%)。1hnmr(300mhz,dmso-d6):δ7.83ppm(d,j=8.3hz,1h),7.51-7.39ppm(m,2h),3.83ppm(s,3h),2.46ppm(s,3h).
[0187]
步骤3:4-溴-2-(甲基磺酰基)苯甲酸甲酯(中间体104)
[0188][0189]
在0℃下,向4-溴-2-(甲硫基)苯甲酸甲酯(103)(180.0g,589mmol,1.0当量)的甲醇(3.60l)溶液中,加入过氧化氢(1.17kg,3.79mol,5.50当量)的dmw(4.50l)溶液。反应混合物在60℃搅拌16h。反应进程通过tlc(30%etoac的正己烷溶液)监控。通过蒸馏除去约40%的溶剂,然后将冷却的dmw(4.50l)加入到反应混合物中并搅拌15分钟。通过过滤收集沉淀的固体以提供湿产物104。在低于50℃的真空烘箱中干燥湿产物,得到干燥的中间体104(200g,99.0%),为灰白色固体。1hnmr(300mhz,dmso-d6):δ8.19-8.02ppm(m,2h),7.73ppm(d,j=8.1hz,1h),3.87ppm(s,3h),3.42ppm(s,3h).ms(esi):m/z 311.5(m 18)
[0190]
步骤4:4-溴-2-(甲基磺酰基)苯甲酸(中间体105)
[0191][0192]
向4-溴-2-(甲基磺酰基)苯甲酸甲酯(104)(201.0g,0.68mol,1.0当量)的甲醇(2.01l)溶液中加入naoh(192.0g,4.80mol,7.0当量)的水(2.01l)溶液。反应混合物在室温搅拌3.0h。反应进程通过tlc(20%meoh的dcm溶液)监控。减压除去溶剂。将冰冷的dmw(1.5l)添加到残余物中并添加5n hcl以将ph调节至~5。通过过滤收集沉淀的固体,用冷水(1000ml)洗涤,干燥,得到中间体105(155.0g,81.0%),为灰白色固体。1h nmr(300mhz,dmso-d6):8.09ppm(d,j=2.0hz,1h),8.04ppm(dd,j=8.2,2.0hz,1h),7.70ppm(d,j=8.2hz,1h),3.44ppm(s,3h).ms(esi):m/z 278.8(m-1)
[0193]
步骤5:4-溴-2-(甲基磺酰基)苯甲酰氯(中间体106)
[0194][0195]
在室温下,向4-溴-2-(甲基磺酰基)苯甲酸(105)(105.0g,376.0mmol,1.0当量)的thf(1.05l)溶液中加入亚硫酰氯(68.4ml,940.0mmol,2.50当量),然后加入dmf(1.37ml,18.80mmol,0.05当量)。将反应混合物加热至80℃并搅拌2小时。通过tlc(50%etoac的正己烷溶液)监测反应进程以确保反应完成。在真空下除去溶剂以获得中间体106(112.0g)。中间体106的粗品直接用于步骤6。
[0196]
步骤6:7-(4-溴-2-(甲基磺酰基)苯甲酰胺)-2,3-二氢苯并[b][1,4]二噁英-6-羧酸(中间体107)
[0197][0198]
在0℃下,向7-氨基-2,3-二氢苯并[b][1,4]二噁英-6-羧酸(100)(60.20g,309.0mmol,0.82当量)的thf(1.68l)溶液中加入三乙胺(103.3ml,753.0mmol,2.0当量),然后在0℃下加入4-溴-2-(甲基磺酰基)苯甲酰氯(106)(60.20g,309.0mmol,1.0当量)的thf(1.68l)溶液。将反应混合物在0℃搅拌10分钟,然后在室温搅拌2.5h。通过tlc(10%meoh的dcm溶液)监测反应进程。加入1n hcl将ph值调节至7。通过蒸馏除去约70%的thf,剩余的残余物与乙醚(250ml)一起研磨以沉淀固体产物。过滤收集固体,用乙醚(50ml)洗涤并干燥,
得到中间体107(120.0g,69.90%),为浅棕色固体。
[0199]
通过如本文所述的步骤a-e合成中间体100:7-氨基-2,3-二氢苯并[b][1,4]二噁英-6-羧酸。
[0200]
步骤a:3,4-二羟基苯甲酸甲酯(中间体100b)
[0201][0202]
向3,4-二羟基苯甲酸(100a)(200.0g,1.30mol,1.0当量)的甲醇(2.0l)溶液中加入硫酸(138.0ml,2.60mol,2.0当量)。将反应混合物在80℃搅拌15h。通过tlc(50%etoac的正己烷溶液)监测反应进程。通过真空蒸馏除去溶剂,然后加入dmw(1500ml)并用乙酸乙酯(3
×
1.5l)萃取产物。合并的有机萃取液用饱和碳酸氢钠溶液(2000ml)、盐水(1500ml)洗涤,经硫酸钠干燥并真空浓缩,得到中间体100b(198.0g,90.70%),为灰白色固体。1h nmr(300mhz,dmso):δ9.78ppm(s,1h),9.37ppm(s,1h),7.36-7.23ppm(m,2h),6.81ppm(d,j=8.2hz,1h),3.76ppm(s,3h).
[0203]
步骤b:2,3-二氢苯并[b][1,4]二噁英-6-羧酸甲酯(中间体100c)
[0204][0205]
向3,4-二羟基苯甲酸甲酯(100b)(197.0g,1.17mol,1.0当量)的dmf(2.96l)溶液中加入碳酸钾(405g,2.93mol,2.50当量)和1,2-二溴乙烷(152.0ml,1.76mol,1.50当量)。将反应混合物加热到90℃并搅拌25h。通过tlc(tlc分析60%乙酸乙酯的正庚烷溶液)监测反应进程。将反应冷却至室温,然后加入dmw(7.50l),然后用etoac(2x3.50l)萃取。合并的有机萃取液用dmw(2x3.5l)、盐水(3.5l)洗涤,经硫酸钠干燥并真空浓缩,得到中间体100c(214.0g,94.10%),为淡棕色油。1h nmr(300mhz,cdcl3):δ7.63-7.51ppm(m,2h),6.89ppm(d,j=9.0hz,1h),4.35-4.24ppm(m,4h),3.88ppm(s,3h).
[0206]
步骤c:7-硝基-2,3-二氢苯并[b][1,4]二噁英-6-羧酸甲酯(中间体100d)
[0207][0208]
在20℃以下,向2,3-二氢苯并[b][1,4]二噁英-6-羧酸甲酯(100c)(214.0g,1.10mol,1.0当量)的乙酸(832.0ml,14.50mol,13.2当量)溶液中加入浓硝酸(832.0ml,14.50mol,17.0当量)。将反应混合物在室温下搅拌2h,期间通过tlc(洗脱剂:60%乙酸乙酯的正庚烷溶液)监测反应进程。在剧烈搅拌下将反应混合物倒入冰水(5.0l)中。过滤收集析出的固体,用dmw(1100ml)洗涤,干燥,得到淡黄色固体状的中间体100d(261g,99.0%)。1h nmr(300mhz,dmso-d6):δ7.65ppm(s,1h),7.30ppm(s,1h),4.47-4.34ppm(m,1h),4.39ppm(s,4h),3.80ppm(s,3h).
[0209]
步骤d:7-氨基-2,3-二氢苯并[b][1,4]二噁英-6-羧酸甲酯(中间体100e)
[0210][0211]
将7-硝基-2,3-二氢苯并[b][1,4]二噁英-6-羧酸甲酯(100d)(260g,1.09mol,1.0当量)、铁粉(217.0g,2.72mol,2.5当量;目数300-400)和乙醇(1.69l,6.50体积当量)、水(585ml)、乙酸(1.69l)的混合物加热至80℃并在此温度下搅拌45分钟。通过tlc(洗脱剂:60%乙酸乙酯的正庚烷溶液)监测反应进程。将反应混合物冷却至室温,并通过硅藻土床过滤,用乙酸乙酯(500ml)洗涤硅藻土床。向滤液中加入水(5.0l)并混合。分离水层并用乙酸乙酯(3
×
2.0l)反萃取。将合并的有机萃取物用饱和碳酸氢钠(3x3.0l)和盐水(5.0l)洗涤,然后用硫酸钠干燥并过滤。滤液在真空下浓缩以获得中间体100e(226g,99.40%),为浅棕色固体。1h nmr(300mhz,dmso-d6):δ7.14ppm(s,1h),6.27ppm(s,2h),6.24ppm(s,1h),4.28-4.19ppm(m,2h),4.16-4.06ppm(m,2h),3.73ppm(s,3h).
[0212]
步骤e:7-氨基-2,3-二氢苯并[b][1,4]二噁英-6-羧酸(中间体100)
[0213][0214]
向7-氨基-2,3-二氢苯并[b][1,4]二噁英-6-羧酸盐(100e)(225.0g,1.08mol,1.0
当量)的thf(1.58ml)溶液中加入naoh(237.0g,5.92mol,5.5当量)的水(1.58ml)溶液,反应混合物被加热到80℃并搅拌15h。通过tlc(10%meoh的dcm溶液)监测反应进程以确保反应完全。将反应混合物冷却至室温并减压蒸发thf。随后,将冷却的dmw(1500ml)加入到残余物中并使用5n hcl将ph调节至~6.0。通过过滤收集沉淀的固体,用dmw(300ml)洗涤并干燥,得到中间体100(152.50g,72.5%),为淡黄色固体。1h nmr(300mhz,dmso):δ8.17ppm(s,2h),7.13ppm(s,1h),6.20ppm(s,1h),4.27-4.17ppm(m,2h),4.17-4.02ppm(m,2h).
[0215]
步骤7:2-(4-溴-2-(甲基磺酰基)苯基)-7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯并[1,2-d][l,3]噁嗪-4-酮(中间体108)的合成
[0216][0217]
将7-(4-溴-2-(甲基磺酰基)苯甲酰胺)-2,3-二氢苯并[b][1,4]二噁英-6-羧酸(107)(120.0g,263.0mmol,1.0当量)的乙酸酐(960ml)溶液加热至140℃并搅拌1.5h。通过tlc(50%etoac的正己烷溶液)监测反应进程以确保反应完成。通过真空蒸馏除去约70%的溶剂。将剩余的残余物冷却至室温,然后加入dmw(1000ml)并将混合物搅拌40分钟。通过过滤收集沉淀的固体,用dmw(1000ml)洗涤并干燥至中间体108(85.4g,74.1%),为灰白色固体。1hnmr(300mhz,dmso-d6):δ8.29-8.12ppm(m,2h),7.91ppm(d,j=8.2hz,ih),7.59ppm(s,ih),7.26ppm(s,ih),4.55-4.32ppm(m,4h),3.57ppm(s,3h).ms(esi):m/z 439.6(m 1).
[0218]
步骤8:2-(2-(甲基磺酰基)-4-乙烯基苯基)-7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯并[1,2-d][l,3]噁嗪-4-酮(中间体109)的合成
[0219][0220]
将2-(4-溴-2-(甲基磺酰基)苯基)-7,8-二氢-4h[1,4]二噁英[2',3':4,5]苯并[1,2-d][l,3]噁嗪-4-酮(108)(84.0g,192.0mmol,1.0当量)的1,4-二氧六环(1.68l)溶液,通过交替施加真空和氮气填充,进行了三次脱气以去除氧气。在氮气下加入碳酸氢钠(56.40g,671.0mmol,3.5当量)、乙烯基三氟硼酸钾(64.20g,479.0mmol,2.5当量)、三(邻甲苯基)-膦(14.60g,47.90mmol,0.25当量)和pd(oac)2(1.51g,6.71mmol,0.035当量),并且通过用交替真空和氮气填充,将反应烧瓶再脱气两次。将反应混合物在70℃加热并搅拌3.5h。通过tlc(40%etoac的正己烷溶液)监测反应进程以确保反应完成。将反应混合物冷却至室温,用1n hcl(1000ml)淬灭并通过硅藻土垫过滤。减压蒸发溶剂并将dmw(2.5l)加入到残余物中。产物用乙酸乙酯(3x2l)萃取,合并的etoac萃取液用盐水(2.5l)洗涤,用硫酸钠干燥,过滤并浓缩,得到粗产物。将粗产物在乙醚(150ml)中搅拌并过滤,得到中间体109
(72.0g,97.50%),为淡黄色固体。1h nmr(300mhz,dmso-d6):δ7.14ppm(s,1h),6.27ppm(s,2h),6.24ppm(s,1h),4.28-4.19ppm(m,2h),4.16-4.06ppm(m,2h),3.73ppm(s,3h).
[0221]
步骤9:3-(甲基磺酰基)-4-(4-氧代-7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯并[1,2-d][1,3]噁嗪-2-基)苯甲醛(中间体110)的合成
[0222][0223]
在室温下,向2-(2-(甲基磺酰基)-4-乙烯基苯基)-7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯并[1,2-d][1,3]噁嗪-4-酮(109)(72.0g,187.0mmol,1.0当量)的乙腈(1.44l)、etoac(1.44l)和dmw(1.08l)的溶液中,加入钌碳(5.66g,5.60mmol,0.03当量)。在0℃加入高碘酸钠(130.0g,607.0mmol,3.25当量)。将反应混合物在0℃搅拌3.0h。通过tlc(50%etoac的正己烷溶液)监测反应进程。通过硅藻土床过滤反应混合物。用乙酸乙酯(4x1.5l)洗涤固体。滤液用水(3.0l)洗涤,水层用乙酸乙酯(800ml)反萃取。合并的有机萃取物用盐水(2.0l)洗涤,经硫酸钠干燥并过滤。滤液真空浓缩,得到粗品110(65.0,95.30%),为棕色固体。中间体110的粗品直接用于后续步骤10。
[0224]
步骤10:2-(4-(羟甲基)-2-(甲基磺酰基)苯基)-7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯丙[l,2-d][l,3]噁嗪-4-酮(化合物1.001)的合成
[0225][0226]
在0℃下,向3-(甲基磺酰基)-4-(4-氧代-7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯并[1,2-d][1,3]噁嗪-2-基)苯甲醛(110)(82.0g,212.0mmol,1.0当量)的thf(1.23ml)和乙醇(1.23l)的溶液中,在1.0h内缓慢加入硼氢化钠(8.0g,1.0当量)。将反应混合物在0℃搅拌2h。通过tlc(70%etoac的正己烷溶液)监测反应进程以确保反应完成。反应混合物用饱和氯化铵溶液(100ml)淬灭,产物用乙酸乙酯(3x1500ml)萃取。合并的有机萃取物用盐水(500ml)洗涤,经硫酸钠干燥并真空浓缩,得到粗产物。粗产物通过硅胶柱色谱法(230-400目),使用梯度溶剂(20-40%[(10%meoh的etoac溶液)]的正己烷溶液)纯化,得到化合物1.001(15.50g,18.80%)),为灰白色固体。1h nmr(300 mhz,dmso-d6):δ8.08ppm(d,j=1.5 hz,1h),7.91 ppm(d,j=7.9 hz,1h),7.83 ppm(dd,j=7.9,1.6 hz,1h),7.58 ppm(s,1h),7.24 ppm(s,1h),5.64 ppm(t,j=5.7 hz,1h),4.70 ppm(d,j=5.7 hz,2h),4.47-4.35 ppm(m,4h),3.50 ppm(s,3h).
[0227]
实施例2:2-(5-(羟甲基)-2-(甲基磺酰基)苯基)-7,8-二氢-4h[1,4]二噁英[2',
3':4,5]苯并[1,2-d][1,3]噁嗪-4-酮(化合物1.002)
[0228][0229]
化合物1.002的合成如图2所示。中间体100的合成如图3所示。
[0230]
步骤1:5-溴-2-巯基苯甲酸(中间体202)
[0231][0232]
向2-氨基-5-溴苯甲酸(201)(20.0g,92.6mmol,1.0当量)、naoh(3.70g,92.6mmol,1.0当量)和亚硝酸钠(6.39g,92.6mmol,1.0当量)的dmw(400ml)溶液重,缓慢加入浓hcl(28.0ml)和冷水(34ml)的混合物,逐滴加入,使得反应温度维持在3-6℃。添加后,将反应混合物在0℃搅拌30分钟,然后用乙酸钾(30g,306.0mmol,3.3当量)中和。将该溶液加入到预热至90℃的o-乙基黄原酸钾(44.6g,278mmol,3.0当量)的dmw(223ml)溶液中。将反应混合物在90℃搅拌30分钟,冷却至0℃,并用浓hcl(100ml)酸化。用10%naoh(200ml)碱化反应混合物,加热至85℃保持2小时。向该混合物中分小份加入nahso3(9.81g,92.6mmol),并将反应混合物加热至85℃保持10分钟。过滤反应混合物,冷却至0℃,并用浓hcl(100ml)酸化。过滤收集析出的固体,用h2o洗涤,然后用正己烷洗涤,得到淡灰色固体状的中间体202(20.2g,93.6%)。ms(esi):m/z 230.8(m-1).
[0233]
步骤2:5-溴-2-(甲硫基)苯甲酸甲酯(中间体203)
[0234][0235]
在0℃下,向4-溴-2-巯基苯甲酸(202)(20g,85.8mmol,1当量)的dmf(600ml)溶液中加入碳酸钾(83.0g,601mmol,7.0当量)和碘乙烷(21.4ml,343mmol,4.0当量)。将反应混
合物在80℃下搅拌20h。反应进程通过tlc(10%etoac的正己烷溶液)监控,以确定反应完全。加入dmw(500ml),产物用乙酸乙酯(3x500ml)萃取。合并的etoac萃取液用盐水(300ml)洗涤,用硫酸钠干燥,过滤,滤液真空浓缩得到粗产物。粗产物用硅胶(230-400目)柱色谱纯化(溶剂梯度0-5%etoac的正己烷溶液),得到中间体203(20g,89.30%),为灰白色固体。
[0236]
步骤3:5-溴-2-(甲基磺酰基)苯甲酸甲酯(中间体104)
[0237][0238]
在0℃下,向5-溴-2-(甲硫基)苯甲酸甲酯(203)(14.0g,53.6mmol,1.0当量)的甲醇(350ml)溶液中,加入过氧化氢(40.8g,268mmol,5.0当量)的dmw(280ml)溶液。反应混合物在50℃搅拌16h。反应进程通过tlc(30%etoac的正己烷溶液)监控以保证反应完全。产物用etoac(4x500ml)萃取。合并的有机相用盐水(2x300ml)洗涤,硫酸钠干燥,经真空浓缩得到粗产物。粗产物经硅胶(230-400目)柱色谱纯化(溶剂梯度5-20%etoac)的正己烷溶液,得到中间体204(13.2g,84.0%),为灰白色固体。1h nmr(300mhz,dmso):δ8.08-7.98ppm(m,2h),7.93ppm(dd,j=7.9,0.9hz,ih),3.87ppm(s,3h),3.44-3.35ppm(m,3h).ms(esi):m/z 292.8(m-1).
[0239]
步骤4:2-(甲基磺酰基)-5-乙烯基苯甲酸甲酯(中间体205)
[0240][0241]
将5-溴-2-(甲基磺酰基)苯甲酸甲酯(204)(5.0g,17.1mmol,1.0当量)在dme(100.0ml,20体积当量)中的溶液,以真空和氮气交替填充的方式脱气三次。在氮气中加入碳酸钾(4.71g,34.1mmol,2.0当量)、乙烯基三氟硼酸钾(4.57g,34.1mmol,2.0当量)和pd(pph3)4(591mg,512μmol,0.03当量),并再以交替真空和氮气填充的方式脱气两次。反应混合物加热到80℃并搅拌4h(当温度升到40-45℃时除去氮气)。通过tlc(30%etoac的正己烷溶液)监测反应进程以确保反应完成。将反应混合物冷却至室温并通过硅藻土过滤。向滤液中加入dmw(300ml)并用乙酸乙酯(2x100ml)萃取产物。将合并的有机萃取物用盐水
(2x100ml)洗涤,经硫酸钠干燥,过滤并浓缩以提供粗产物。粗产物通过硅胶柱色谱法(230-400目)使用梯度溶剂(5-20%etoac的正己烷溶液)作为洗脱剂纯化,得到中间体205(3.36g,82.0%),为浅黄色胶状物。
[0242]
步骤5:2-(甲基磺酰基)-5-乙烯基苯甲酸(中间体206)
[0243][0244]
向2-(甲基磺酰基)-5-乙烯基苯甲酸甲酯(205)(3.36g,14.0mmol,1.0equiv)的甲醇(67.2ml)溶液中加入naoh(3.92g,97.9mmol,7.0当量)的水(67.2ml)溶液。
[0245]
将反应混合物在60℃搅拌2小时。通过tlc(70%etoh的正己烷溶液)监测反应进程以确保反应完成。将反应混合物冷却至室温,使用3n hcl将ph调节至~6,并用乙酸乙酯(4x500ml)萃取水层。将合并的有机萃取物用盐水洗涤,用硫酸钠干燥,过滤并真空浓缩滤液,得到所需的中间体206(1.48g,46.8%),为灰白色固体。1h nmr(300mhz,dmso):δ7.93ppm(t,j=7.6hz,1h),7.88-7.78ppm(m,2h),6.87ppm(dd,j=17.7,11.0hz,1h),6.13ppm(d,j=17.6hz,1h),5.53ppm(d,j=10.9hz,1h),3.37ppm(s,3h).ms(esi):m/z 224.95(m-1).
[0246]
步骤6:2-(甲基磺酰基)-5-乙烯基苯甲酰氯(中间体207)
[0247][0248]
在室温下,向2-(甲基磺酰基)-5-乙烯基苯甲酸(206)(1.4g,6.19mmol,1.0当量)的dcm(70ml)溶液中加入草酰氯(2.66ml,30.9mmol,5.0当量),然后加入2滴dmf。将反应混合物回流2小时。通过tlc(50%etoac的正己烷溶液)监测反应进程以确保反应完成。真空除去溶剂,得到所需产物,为中间体207(540mg,83.2%)。中间体207的粗品直接用于后续步骤7。
[0249]
步骤7:7-(2-(甲基磺酰基)-5-乙烯基苯甲酰胺基)-2,3-二氢苯并[b][1,4]二噁英-6-羧酸(中间体208)
[0250][0251]
在0℃下,向7-氨基-2,3-二氢苯并[b][1,4]二噁英-6-羧酸(100)(900mg,4.61mmol,1.0当量)的thf(36.0ml)溶液中加入三乙胺(1.93ml,13.8mmol,3.0当量)和2-(甲磺酰基)-5-乙烯基苯甲酰氯(207)(1.35mg,5.53mmol,1.2eq)的thf(36ml)溶液。将反应混合物在相同温度搅拌10分钟,然后在室温搅拌1.5小时。通过tlc(20%etoac的正己烷溶液)监测反应进程以确保反应完成。真空除去溶剂。将dmw加入到残余物中并用etoac(9x200ml)萃取产物。合并的etoac萃取液用盐水(200ml)洗涤,经硫酸钠干燥并真空浓缩,得到中间体208(1.6g,86.0%),为棕色固体。ms(esi):m/z 404.10(m 1),m/z 401.90(m-1).
[0252]
通过如本文所述的步骤a-e合成中间体100:7-氨基-2,3-二氢苯并[b][1,4]二噁英-6-羧酸。
[0253]
步骤a:3,4-二羟基苯甲酸甲酯(中间体100b)
[0254][0255]
在室温下向3,4-二羟基苯甲酸(100a)(97%,10.0g,62.9mmol,1.0当量)的甲醇(500ml)溶液中加入硫酸(96%,7.0ml,126.0mmol,2.0当量)。反应混合物搅拌过夜。通过tlc确保反应完成。真空除去溶剂,然后加入水(500ml)。水层用etoac(3
×
100ml)萃取。合并的有机层用饱和nahco3溶液(250ml)、盐水(250ml)洗涤,用硫酸钠干燥并真空浓缩,得到所需的中间体100b(8.72g,82.4%),为灰白色固体。1h nmr(300mhz,dmso-d6):δ9.81ppm(d,j=131.1hz,2h),7.41-7.19ppm(m,2h),6.81ppm(d,j=8.2hz,1h),3.77ppm(s,3h).
[0256]
步骤b:2,3-二氢苯并[b][1,4]二噁英-6-羧酸甲酯(中间体100c)
[0257][0258]
向3,4-二羟基苯甲酸甲酯(100b)(10.0g,59.5mmol,1.0当量)的丙酮(200ml)溶液中加入碳酸钾(20.5g,149mmol,2.50当量),然后加入1,2-二溴乙烷(7.72ml,89.2mmol,
1.50当量),反应混合物回流过夜。通过tlc确保反应完成。真空除去溶剂,然后加入水。水层用1n hcl中和,然后用etoac(2x250ml)萃取。合并的有机萃取物用盐水(500ml)洗涤,经硫酸钠干燥并真空浓缩。粗品通过闪式色谱(combiflash)使用乙酸乙酯/正己烷(0至10%)纯化,得到所需中间体100c(9.0g,77.9%),为无色油状物。1h nmr(300mhz,cdcl3):δ7.54-7.42ppm(m,2h),6.85-6.75ppm(m,ih),4.27-4.14ppm(m,4h),3.79ppm(s,3h).
[0259]
步骤c:7-硝基-2,3-二氢苯并[b][1,4]二噁英-6-羧酸甲酯(中间体100d)
[0260][0261]
在20℃以下,向2,3-二氢苯并[b][1,4]二噁英-6-羧酸甲酯(100c)(9.0g,46.3mmol,1.0当量)的乙酸(35.0ml,612mmol,13.2当量)溶液中逐滴加入浓硝酸(47.0ml,788mmol,17.0当量),然后可以将反应混合物在室温下搅拌2h。通过tlc确定反应完全。在剧烈搅拌下将反应混合物倒入冰水中,水相用etoac(3x500ml)。合并的有机萃取液用nahco3、盐水洗涤,无水硫酸钠干燥,真空浓缩得到产物中间体100d(9.7g,87.5%),为淡黄色固体。1hnmr(300mhz,dmso-d6):δ7.65ppm(s,ih),7.30ppm(s,ih),4.47-4.34ppm(m,ih),4.39ppm(s,4h),3.80ppm(s,3h).
[0262]
步骤d:7-氨基-2,3-二氢苯并[b][1,4]二噁英-6-羧酸甲酯(中间体100e)
[0263][0264]
将7-硝基-2,3-二氢苯并[b][1,4]二噁英-6-羧酸甲酯(100d)(25.0g,105.0mmol,1.0当量)、铁粉(20.4g,366.0mmol,3.5当量)和乙醇(625ml)、水(163ml)和乙酸(500ml)的混合物加热至70℃并在此温度下搅拌45分钟。通过tlc确保反应完成。将反应混合物冷却至室温并通过硅藻土过滤。滤液用水(1000ml)稀释,水层用乙酸乙酯(3x700ml)萃取。合并的有机萃取物用饱和溶液洗涤。碳酸氢钠(2x1000ml)、盐水(1000ml),经硫酸钠干燥并过滤。将滤液真空浓缩,得到标题化合物中间体100e(21.8g,99.7%),为棕色固体。1h nmr(300mhz,dmso):δ7.14ppm(s,1h),6.25ppm(d,j=7.6hz,3h),4.26-10 4.19ppm(m,2h),4.17-4.08ppm(m,2h),3.73ppm(s,3h).ms(esi):m/z 210.10(m 1).
[0265]
步骤e:7-氨基-2,3-二氢苯并[b][1,4]二噁英-6-羧酸(中间体100)
[0266][0267]
向7-氨基-2,3-二氢苯并[b][1,4]二噁英-6-羧酸盐(100e)(22.0g,105mmol,1.0当量)的thf(440.0ml)溶液中加入naoh(23.1g,578mmol,5.5当量)的水(440.0ml)溶液,反应混合物在80℃搅拌20h。通过tlc(10%meoh的dcm溶液)监测反应进程以确保反应完全。将反应混合物冷却至室温,使用3n hcl将ph调节至6,并用乙酸乙酯(5x500ml)萃取水层。合并的有机层用盐水洗涤,经硫酸钠干燥,过滤并真空浓缩滤液,得到固体棕色粗产物。粗品用正己烷纯化,得到所需的中间体100(18.6g,90.6%),为棕色固体。1h nmr(300mhz,dmso):δ8.27ppm(s,2h),7.13ppm(s,1h),6.20ppm(s,1h),4.27-4.19ppm(m,2h),4.18-4.08ppm(m,2h).
[0268]
步骤8:2-(2-(甲基磺酰基)-5-乙烯基苯基)-7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯并[1,2-d][l,3]噁嗪-4-酮(中间体209)的合成
[0269][0270]
将7-(2-(甲基磺酰基)-5-乙烯基苯甲酰氨基)-2,3-二氢苯并[b][1,4]二噁英-6-羧酸(208)(1.60g,3.97mmol,1.0当量)的乙酸酐(40ml)溶液加热至140℃并搅拌1.5h。通过tlc(50%etoh的正己烷溶液)监测反应进程以确保反应完成。将反应混合物冷却至室温,然后加入dmw(100ml)。产物用etoac(4x200ml)萃取。合并的etoac萃取液用盐水(2x200ml)洗涤,经硫酸钠干燥并真空浓缩得到粗品。粗产物通过硅胶(230-400目)和梯度溶剂(20-50%etoac/己烷)柱色谱纯化,得到中间体209(700mg,45.8%),为黄色固体。1hnmr(300mhz,cdcl3):δ8.15ppm(d,j=8.2hz,1h),7.90ppm(d,j=1.7hz,1h),7.77-7.68ppm(m,2h),7.16ppm(s,1h),6.82ppm(dd,j=17.5,10.9hz,1h),6.01ppm(d,j=17.5hz,1h),5.57ppm(d,j=10.9hz,1h),4.40ppm(dd,j=11.8,5.3hz,5h),3.52ppm(d,j=3.0hz,3h).ms(esi):m/z 385.80(m 1).
[0271]
步骤9:3-(甲基磺酰基)-4-(4-氧代-7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯并[1,2-d][1,3]噁嗪-2-基)苯甲醛(中间体210)的合成
[0272][0273]
在室温下,向2-(2-(甲基磺酰基)-5-乙烯基苯基)-7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯并[1,2-d][1,3]噁嗪-4-酮(209)(0.630g,1.63mmol,1.0当量)的乙腈(12.6ml)、etoac(12.6ml)和dmw(12.6l)的溶液中,加入钌碳(10%,50mg,0.049mmol,0.03当量)。在0℃加入高碘酸钠(1.05g,4.9mmol,3.0当量)。将反应混合物在室温搅拌1小时。通过tlc(30%etoac的正己烷溶液)监测反应进程以确保反应完成。通过硅藻土床过滤反应混合物。滤液用水(100ml)稀释,水层用乙酸乙酯(3x200ml)萃取。合并的有机萃取物用饱和碳酸氢钠溶液、盐水,用硫酸钠干燥并过滤。滤液真空浓缩得到粗中间体210。中间体210的粗产物直接用于后续步骤10。
[0274]
步骤10:2-(4-(羟甲基)-2-(甲基磺酰基)苯基)-7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯丙[l,2-d][l,3]噁嗪-4-酮(化合物1.002)的合成
[0275][0276]
在-10℃下,向3-(甲基磺酰基)-4-(4-氧代-7,8-二氢-4h-[1,4]二噁英[2',3':4,5]苯并[1,2-d][1,3]噁嗪-2-基)苯甲醛(210)(0.20g,0.52mmol,1.0当量)的thf(10.0ml)溶液中,在1h内缓慢加入硼氢化钠(9.77mg,0.258mmol,0.5当量)。将反应混合物在0℃相同温度下搅拌30分钟。通过tlc(70%etoac的正己烷溶液)监测反应进程以确保反应完成。反应混合物用饱和氯化铵溶液(50ml)淬灭,产物用乙酸乙酯(3
×
100ml)萃取。合并的有机萃取物用盐水(500ml)洗涤,经硫酸钠干燥并真空浓缩以获得粗产物。粗产物通过硅胶柱色谱法(230-400)使用梯度溶剂(20-40%[(10%meoh的etoac溶液)]的正己烷溶液)纯化,得到化合物1.002(70mg,34.80%),为灰白色固体。1h nmr(300mhz,dmso):δ8.07ppm(d,j=8.2hz,1h),7.88ppm(s,1h),7.79ppm(d,j=8.5hz,1h),7.58ppm(s,1h),7.24ppm(s,1h),5.63ppm(t,j=5.7hz,1h),4.69ppm(d,j=5.6hz,2h),4.52-4.31ppm(m,4h),3.48ppm(s,3h).ms(esi):m/z 390.0(m 1).
[0277]
实施例3:体外活性测定
[0278]
人激肽释放酶蛋白:在hek293中表达的重组人klk5购自speedbio(盖瑟斯堡,马里兰州)获取。在小鼠骨髓瘤细胞中表达的重组酶原klk-7和重组酶原klk-14均购自r&d生物系统公司(r&d biosystems,明尼阿波利斯,明尼苏达州)。纤溶酶和凝血酶购自血液学科技公司(haematologic technologies埃塞克斯章克申,佛蒙特州)。胰蛋白酶和胰凝乳蛋白酶
购自worthington生物化学公司(莱克伍德,新泽西州),血浆激肽释放酶购自prospec公司(东布伦瑞克,新泽西州)。中性粒细胞弹性蛋白酶购自innovative研究公司(peary court,密歇根州)。在大肠杆菌中表达的牛重组肠激酶购自sigma公司(圣路易斯,密歇根州)。在大肠杆菌中表达的基质酶购自enzo生命科学(法明代尔,纽约州)。对照抑制剂甲磺酸萘莫司他购自sigma公司(圣路易斯,密歇根州),(2-(2-氟苯基)-5,6,7,8-四氢-4h-苯并[4,5]噻吩并[2,3-d][1,3]噁嗪-4-酮购自interbioscreen公司(莫斯科,俄罗斯)。
[0279]
底物:s-2288(d-ile-pro-arg-pna)、cs-psa(meo-suc-arg-pro-tyr-pna)、s-2266(h-d-val-leu-arg-pna)和s-2288(h-d-lle-pro-arg-pna)购自diapharma公司(威彻斯特,俄亥俄州)。meosuccala-ala-pro-val-pna购自sigma公司(圣路易斯,密歇根州)。将底物以10mm溶解在水中,并在-20℃下冷冻成等分试样。
[0280]
klk-7和klk-14的激动:在37摄氏度下,将150μl的8μm的klk-7或klk-14的酶原的50mm tris,10mm cacl2,150mm nacl,0.05%(w/v)brij-35,ph 7.5溶液,与150μl的10μg/ml牛肠激酶在相同缓冲体系中的溶液混合,klk-7温育2小时,klk温育1小时。在温育期之后,通过添加6μl 0.5m、ph 8.0的edta溶液停止激动。
[0281]
测定:所有测定均在384孔聚苯乙烯板中进行,该板在4℃下涂有0.1%吐温20过夜。然后将板用100μl水洗涤两次并干燥。为了确定ic
50
值,将抑制剂以1:3的间隔连续稀释到纯dmso中,浓度为试验中预期最终浓度的50倍。通常制备八种抑制剂稀释液和一种dmso对照。将底物稀释到水中,达到试验混合物中最终浓度的2.2倍。将50μl的酶填充到板的孔中,该酶以预期浓度的两倍稀释在2x测定缓冲液(100mm tris、200mm nacl、0.2%peg、0.01%tween、2mm edta、ph 8.0)中。然后加入5ul dmso、2.2ul抑制剂和45ul底物开始反应。在37℃下,在多孔板读数器中以405nm的波长(molecular devices,san jose,ca)监测测定1小时。工具抑制剂萘莫司他用作胰蛋白酶、凝血酶、klk-5和klk-14的对照,最大浓度为10μm,(2-(2-氟苯基)-5,6,7,8-四氢-4h-苯并[4,5]噻吩并[2,3-d][1,3]噁嗪-4-酮用作klk-7的对照,最大浓度为5μm。
[0282]
下表总结了各个酶的测定条件:
[0283]
酶酶浓度(nm)底物底物浓度(μm)klk-720cs-psa500klk-510s-2288500klk-145s-2288500血浆激肽释放酶5s-2266200胰蛋白酶0.1s-2288500糜蛋白酶0.2cs-psa500纤溶酶1s-2288500凝血酶0.5s-2288200基质蛋白酶0.015u/μls-2288200
[0284]
数据分析:通过反应最后20分钟的线性回归分析底物水解的进展曲线。将所得速率的剂量响应拟合到下式得出ic
50
:
[0285]
[0286]
其中1)c:最高抑制剂浓度下的背景率;2)d:对照反应的速率;3)ic
50
:抑制剂的ic
50
;4)x:抑制剂浓度;5)b:斜率。
[0287]
实施例4:人体皮肤中的蛋白酶活性
[0288]
材料:肽底物ps-01(yrsr-pna tyr-arg-ser-arg-pna)和ps-02(lys-his-leu-tyr-pna)由zamboni化学解决方案公司(zamboni chemical solutions,蒙特利尔,加拿大)合成。
[0289]
皮肤提取物的制备:将表皮冷冻并冻干。将15mg冻干表皮样品浸入1ml高盐缓冲液(100mm tris、5mm edta、2m kcl、ph 8)中,在干冰中冷冻两次并解冻。在4℃下孵育过夜并添加六个2.4mm金属珠后,将样品在bertin precellys均质器(阿特金森,新罕布什尔州)中以5000hz均化3次,每次20秒,中间冷却30秒。在台式微型离心机中以最大速度离心后,通过bca测定法测定上清液的蛋白质浓度(~0.5mg/ml)。
[0290]
抑制皮肤提取物中的蛋白酶活性:制备200、66、22和0μm的受试化合物在dmso中的储备溶液。通过溶解在水中制备1100μmps-01和ps-02的底物储液。将50μl 2x测定缓冲液(见上文)加入384孔板的孔内,然后加入45μl底物原液和5μl测试化合物。通过向底物ps-02中添加10μl皮肤提取物,向底物ps-01中添加5μl皮肤提取物以开始反应。在多孔板读数器中在405nm监测底物水解。
[0291]
实施例5:受试化合物的测定结果
[0292]
根据实施例3和4的测定方案测试化合物1.001和1.002以及已知化合物14。测试结果列于表2中。化合物14公开于wo 2015/112081并具有下式:
[0293][0294]
表2:测试化合物的测定结果
[0295][0296]
*吸光度
405
/min
[0297]
根据实施例4的人角质层提取物测定,使用klk5和klk7优选的显色肽底物(ps-01和ps-02)测试化合物1.001、1.002和14的显色底物切割进程。在图4a-4d中比较并显示了化合物1.001、1.002和14对皮肤提取物中klk5选择性底物的蛋白水解切割。nsk是指新鲜制备的皮肤提取物;osk是指冻融后的皮肤提取物。
[0298]
从图4a-4d(nsk)可以看出,对于化合物1.001,曲线的初始线性部分的速率(斜率)似乎低于其他两种化合物,表明对底物切割的抑制更高。观察到的化合物1.001较低的蛋白水解活性初始速率也与观察到的曲线的较低截距一致。从图4a-4d(nsk)可以看出,底物裂解的速率随着底物耗尽呈指数减慢。化合物1.001的较低指数速率常数表明化合物1.001似乎对蛋白水解活性具有更强的抑制作用。
[0299]
与纯化重组klk5的结果相比,基于三个参数(速率、底物消耗和蛋白水解活性的初始速率),与已知化合物14相比,化合物1.001似乎是更有效的皮肤提取物蛋白水解活性抑制剂。
[0300]
实施例6:显色法
[0301]
新生儿人表皮角质形成细胞裂解物的制备:合并的人表皮角质形成细胞(hek)购自invitrogen(目录号al3401)。在没有血清的情况下,细胞在补充有商业补充剂s7(赛默飞,目录号s00175)的商业培养基epilife(赛默飞,目录号mepi500ca)中生长。组织培养在37℃、5%二氧化碳的加湿室中进行。hek裂解缓冲液成分:100mm tris-hcl、150mm nacl、1%triton、5mm edta,最终ph 7.6。两次传代后,使用不添加蛋白酶和磷酸酶抑制剂的hek裂解缓冲液裂解细胞,并使用二辛可宁酸测定法(bca)(thermofisher,目录号23225)测定蛋白质浓度。
[0302]
健康人志愿者角质层提取物的制备:角质层片购自biopredic(目录号str0020)。提取物制备:根据制造商的说明在均质化后,使用minute脂肪组织总蛋白提取试剂盒(inventbiotech,目录号at-022)制备角质层裂解物。使用bca测定法(thermofisher,目录
号23225)确定总蛋白质浓度。将提取物快速冷冻并储存在-80℃直至使用。
[0303]
角质层提取物中klk5的浓度:角质层提取物中klk5的浓度通过1)购自abcam的elisa(目录号ab131555)测定;2)选择性显色底物ps-01(yrsr-pnatyr-arg-ser-arg-pna)与已知浓度的纯化klk5(speedbio)的水解速率的比较。此外,未知样品中klk5的浓度是通过从已知样品的速率的线性图插值,通过选择性底物的水解速率确定的。
[0304]
内源性和外源性激肽释放酶5对大分子底物的裂解:将10ughek裂解物与等体积的角质层提取物或蛋白酶在缓冲液中于37℃孵育1.5小时。通过在还原条件下(50mm dtt)用加载缓冲液在100℃下煮沸5分钟来淬灭反应。通过以4-12%丙烯酰胺梯度,在bis-tris凝胶上电泳分离蛋白质,该凝胶在200v下进行电泳22分钟。将蛋白质转移至pvdf膜后,使用intercept封闭缓冲液(licor)在室温下封闭非特异性结合1小时。印迹上的信号通过gapdh归一化。
[0305]
检测特定蛋白质的条件总结如下:
[0306]
桥粒芯蛋白1:将桥粒芯蛋白抗体sc-137164(圣克鲁斯生化(santa cruz biochemicals))稀释1/750并在40℃下孵育18小时。洗涤后,将原液稀释1/20000后加入抗小鼠二抗(licor)。用蛋白酶/磷酸酶抑制剂混合物(cellsignalling,#5872)处理不包含klk5的对照组。
[0307]
桥粒芯胶粘蛋白1:抗桥粒芯胶粘蛋白1抗体(abcam,150382)以1:1000稀释。二抗以1:15000稀释。洗涤后加入1:15000稀释后的二抗兔抗体。
[0308]
丝聚蛋白:抗丝聚蛋白(ls-bio,1561)以1:400稀释。二抗以1:10000稀释。
[0309]
显色测定结果:
[0310]
蛋白酶:klk5(speedbiosystems);klk7(r&dsystems)在测定前用肠激酶(2小时,37℃)激活;胰蛋白酶(sigmaaldrich);胰凝乳蛋白酶(sigmaaldrich);xa因子(haematologic技术公司);纤溶酶(haematologic技术公司);klk14(r&dsystems)在测定前用肠激酶(1小时,37所述的)激活;凝血酶(haematologic技术公司);中性粒细胞弹性蛋白酶(athens研究技术公司);和klk1(prospec)。
[0311]
化合物408:化合物1.001的4-喹唑啉酮部分水解开环的产物,由下式表示:
[0312][0313]
测定结果见表3。
[0314]
表3:化合物1.001和化合物408的显色测定结果。
[0315][0316][0317]
s-2288、s-2266和cs-psa来自diapharma并以10mm溶液溶解与水水中;弹性蛋白酶底物1来自sigma,并以0.8mm溶液溶解在水中。a:klk14的ic50浓度为5nm的;b:klk14的ic50浓度为1nm。
[0318]
结论:可以得出结论,化合物1.001是klk5、klk7和糜蛋白酶的抑制剂。相反,缺少4-喹唑啉酮部分(即化合物1.001的药效基团)的化合物408不能抑制蛋白酶。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。