通过溶瘤腺病毒、cdk4/6抑制剂和其他治疗活性剂的组合治疗肿瘤
1.本发明涉及溶瘤病毒和cdk4/抑制剂的组合;这种组合在治疗诸如肿瘤的疾病中的用途;与cdk4/6抑制剂一起用于治疗诸如肿瘤的疾病的溶瘤病毒,优选溶瘤腺病毒;以及与溶瘤病毒,优选溶瘤腺病毒一起用于治疗诸如肿瘤的疾病的cdk4/6抑制剂。
2.当前在肿瘤的治疗中使用许多治疗概念。除了使用手术以外,主要是化学疗法和放射疗法。然而,所有这些技术都具有相当大的副作用。复制选择性溶瘤病毒的使用提供了治疗肿瘤的新平台。与此相关的是,启动了病毒剂的选择性肿瘤内复制,这导致病毒复制,感染肿瘤细胞的裂解以及病毒向相邻肿瘤细胞的扩散。由于病毒的复制能力仅限于肿瘤细胞,因此可以避免正常组织复制,从而避免被病毒裂解。
3.本发明的问题是提供手段,以提高基于溶瘤病毒和特别是腺病毒的肿瘤治疗的功效。
4.这些和其他问题通过所附独立权利要求的主题解决。优选的实施方案可取自所附的从属权利要求。
5.在第一方面,还通过包含腺病毒和cdk4/6抑制剂以及至少一种其他药剂的组合解决了本发明所基于的问题,所述其他药剂选自选自包含parp抑制剂、布罗莫结构域(bromodomain)抑制剂和nutlin或nutlin衍生物的组,这也是该第一方面的第一实施方案。
6.在下文中,公开了该第一方面的其他实施方案。
7.实施方案2:实施方案1的组合,其中所述腺病毒是溶瘤腺病毒。
8.实施方案3:实施方案1和2中任一项的组合,其中
9.所述腺病毒以yb-1依赖性方式复制。
10.实施方案4:实施方案3的组合,其中所述腺病毒在细胞核中缺乏yb-1的细胞中是复制缺陷的,但是在细胞核中具有yb-1的细胞中复制。
11.实施方案5:实施方案2至4中任一项的组合,其中所述腺病毒编码癌基因蛋白,其中所述癌基因蛋白使至少一个腺病毒基因反式激活,其中所述腺病毒基因选自由e1b55kda、e4orf6、e4orf3和e3adp组成的组。
12.实施方案6:实施方案5的组合,其中所述癌基因蛋白是e1a蛋白。
13.实施方案7:实施方案6的组合,其中所述e1a蛋白能够结合功能性rb肿瘤抑制基因产物。
14.实施方案8:实施方案6的组合,其中所述e1a蛋白不能结合功能性rb肿瘤抑制基因产物。
15.实施方案9:实施方案6至8中任一项的组合,其中e1a蛋白不诱导yb-1定位到细胞核中。
16.实施方案10:实施方案5至9中任一项的组合,其中与野生型癌基因蛋白e1a相比,所述癌基因蛋白表现出一个或若干个突变或缺失。
17.实施方案11:实施方案10的组合,其中所述缺失选自包含cr3片段(stretches)的缺失、n末端的缺失和c末端的缺失的组中的一种。
18.实施方案12:实施方案6至11中任一项的组合,其中所述e1a蛋白能够结合rb。
19.实施方案13:实施方案6至12中任一项的组合,其中与野生型癌基因蛋白相比,所述e1a蛋白包含一个或若干个突变或缺失,其中所述缺失优选为cr1区域和/或cr2区域中的缺失。
20.实施方案14:实施方案13的组合,其中所述e1a蛋白不能结合rb。
21.实施方案15:实施方案1至14中任一项的组合,其中所述病毒是表达e1a12 s蛋白的腺病毒。
22.实施方案16:实施方案1至15中任一项的组合,其中所述病毒是缺乏e1a13s蛋白表达的腺病毒。
23.实施方案17:实施方案1至16中任一项的组合,其中所述病毒是缺乏功能活性腺病毒e3区域的腺病毒。
24.实施方案18:实施方案1至17中任一项的组合,其中所述病毒是缺乏e1b 19kda蛋白表达的腺病毒。
25.实施方案19:实施方案1至18中任一项的组合,其中所述病毒是在尾丝处表达rgd基序的腺病毒。
26.实施方案20:实施方案1至19中任一项的组合,其中所述病毒是腺病毒血清型5。
27.实施方案21:实施方案1至20中任一项的组合,其中所述腺病毒选自包含以下各项的组:xvir-n-31、dl520、adδ24、adδ24-rgd、dl922-947、e1ad/01/07、dl1119/1131、cb 016、vcn-01、e1adl1107、e1adl1101、orca-010、enadenotucirev和缺乏表达的病毒癌基因的病毒,其能够结合功能性rb肿瘤抑制基因产物。
28.实施方案22:实施方案21的组合,其中所述腺病毒是xvir-n-31。
29.实施方案23:实施方案21的组合,其中所述腺病毒是dl520,其中所述腺病毒e3区域是功能失活的。
30.实施方案24:实施方案21至23中任一项的组合,其中所述腺病毒是dl520,其中dl520缺乏e1b 19kda蛋白的表达。
31.实施方案25:实施方案21至24中任一项的组合,其中所述腺病毒是在尾丝上表达rgd基序的dl520。
32.实施方案26:实施方案1至25中任一项的组合,其中所述病毒编码yb-1。
33.实施方案27:实施方案26的组合,其中编码yb-1的基因在组织特异性启动子、肿瘤特异性启动子和/或yb-1依赖性启动子的控制下。
34.实施方案28:实施方案27的组合,其中所述yb-1依赖性启动子是腺病毒e2晚期启动子。
35.实施方案29:实施方案1至28中任一项的组合,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb磷酸化的化合物。
36.实施方案30:实施方案1至29中任一项的组合,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb表达的化合物。
37.实施方案31:实施方案1至30中任一项的组合,其中所述cdk4/6抑制剂选自包含以下各项的组;帕博西尼(palbociclib),其也被称为pd0332991;阿贝西利,其也被称为ly-2835219;瑞博西尼(ribociclib),其也被称为lee011;trilaciclib,其也被称为g1t28;和
dinaciclib。
38.实施方案32:实施方案1至31中任一项的组合,其中所述cdk4/6抑制剂引起细胞中的g1阻滞并抑制e2f1。
39.实施方案33:实施方案1至32中任一项的组合,其中所述组合物还包含parp抑制剂。
40.实施方案34:实施方案33的组合,其中所述parp抑制剂选自包含奥拉帕尼(olaparib)、维利帕尼(veliparib)、鲁卡帕尼(rucaparib)和bmn673的组。
41.实施方案35:实施方案1至32中任一项的组合,其中所述组合物还包含布罗莫结构域抑制剂。
42.实施方案36:实施方案35的组合,其中所述布罗莫结构域抑制剂选自包含jq-1、otx-015、i-bet151、cpi-0610、i-bet762、cpi203、pfi-1和ms 436的组。
43.实施方案37:实施方案1至36中任一项的组合,其中所述组合物还包含nutlin或其衍生物。
44.实施方案38:实施方案37的组合物,其中所述nutlin是nutlin-3。
45.实施方案39:实施方案37和38中任一项的组合物,其中所述nutlin的衍生物选自包含nvp-hdm201、idasanutlin、am-8553、sar405838、nutlin-3a、amg232的组。
46.实施方案40:实施方案1至39中任一项的组合,其中所述组合的成分用于单独施用。
47.实施方案41:实施方案1至39中任一项的组合,其中所述组合的成分用于组合施用。
48.通过根据第一方面,包括其任何实施方案的包含腺病毒和cdk4/6抑制剂的组合用于治疗疾病,更优选地用于治疗肿瘤或癌症,在第二方面中也解决了本发明的问题,其也是该第二方面的第一实施方案。
49.在下文中,公开了该第二方面的其他实施方案。
50.实施方案1:包含腺病毒和cdk4/6抑制剂的组合,其用于治疗和/或预防疾病,优选肿瘤或癌症的方法。
51.实施方案2:实施方案1的用途的组合,其中所述腺病毒是溶瘤腺病毒。
52.实施方案3:实施方案1和2中任一项的用途的组合,其中所述腺病毒以yb-1依赖性方式复制。
53.实施方案4:实施方案3的用途的组合,其中所述腺病毒在细胞核中缺乏yb-1的细胞中是复制缺陷的,但是在细胞核中具有yb-1的细胞中复制。
54.实施方案5:实施方案2至4中任一项的用途的组合,其中所述腺病毒编码癌基因蛋白,其中所述癌基因蛋白使至少一个腺病毒基因反式激活,其中所述腺病毒基因选自包含e1b55kda、e4orf6、e4orf3和e3adp的组。
55.实施方案6:实施方案5的用途的组合,其中所述癌基因蛋白是e1a蛋白。
56.实施方案7:实施方案6的用途的组合,其中所述e1a蛋白能够结合功能性rb肿瘤抑制基因产物。
57.实施方案8:实施方案6的用途的组合,其中e1a蛋白不能结合功能性rb肿瘤抑制基因产物。
58.实施方案9:实施方案6至8中任一项的用途的组合,其中e1a蛋白不诱导yb-1定位到细胞核中。
59.实施方案10:实施方案5至9中任一项的用途的组合,其中与野生型癌基因蛋白e1a相比,所述癌基因蛋白表现出一个或若干个突变或缺失。
60.实施方案11:实施方案10的用途的组合,其中所述缺失选自包含cr3片段的缺失、n末端的缺失和c末端的缺失的组中的一种。
61.实施方案12:实施方案6至11中任一项的用途的组合,其中所述e1a蛋白能够结合rb。
62.实施方案13:实施方案6至12中任一项的用途的组合,其中与野生型癌基因蛋白相比,所述e1a蛋白包含一个或若干个突变或缺失,其中所述缺失优选为cr1区域和/或cr2区域中的缺失。
63.实施方案14:实施方案13的用途的组合,其中所述e1a蛋白不能结合rb。
64.实施方案15:实施方案1至14中任一项的用途的组合,其中所述病毒是表达e1a12s蛋白的腺病毒。
65.实施方案16:实施方案1至15中任一项的用途的组合,其中所述病毒是缺乏e1a13s蛋白表达的腺病毒。
66.实施方案17:实施方案1至16中任一项的用途的组合,其中所述病毒是缺乏功能活性腺病毒e3区域的腺病毒。
67.实施方案18:实施方案1至17中任一项的用途的组合,其中所述病毒是缺乏e1b 19kda蛋白表达的腺病毒。
68.实施方案19:实施方案1至18中任一项的用途的组合,其中所述病毒是在尾丝上表达rgd基序的腺病毒。
69.实施方案20:实施方案1至19中任一项的用途的组合,其中所述病毒是腺病毒血清型5。
70.实施方案21:实施方案1至20中任一项的用途的组合,其中所述腺病毒选自包含以下各项的组:xvir-n-31、dl520、adδ24、adδ24-rgd、dl922-947、e1ad/01/07、dl1119/1131、cb 016、vcn-01、e1adl1107、e1adl1101、orca-010、enadenotucirev和缺乏表达的病毒癌基因的病毒,其能够结合功能性rb肿瘤抑制基因产物。
71.实施方案22:实施方案21的用途的组合,其中所述腺病毒是xvir-n-31。
72.实施方案23:实施方案21的用途的组合,其中所述腺病毒是dl520,其中所述腺病毒e3区域是功能失活的。
73.实施方案24:实施方案21至23中任一项的用途的组合,其中所述腺病毒是dl520,其中dl520缺乏e1b 19kda蛋白的表达。
74.实施方案25:实施方案21至24中任一项的用途的组合,其中所述腺病毒是在尾丝上表达rgd基序的dl520。
75.实施方案26:实施方案1至25中任一项的用途的组合,其中所述病毒编码yb-1。
76.实施方案27:实施方案26的用途的组合,其中编码yb-1的基因在组织特异性启动子、肿瘤特异性启动子和/或yb-1依赖性启动子的控制下。
77.实施方案28:实施方案27的用途的组合,其中所述yb-1依赖性启动子是腺病毒e2
晚期启动子。
78.实施方案29:实施方案1至28中任一项的用途的组合,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb磷酸化的化合物。
79.实施方案30:实施方案1至29中任一项的用途的组合,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb表达的化合物。
80.实施方案31:实施方案1至30中任一项的用途的组合,其中所述cdk4/6抑制剂选自包含以下各项的组;帕博西尼(palbociclib),其也被称为pd 0332991;阿贝西利,其也被称为ly-2835219;瑞博西尼(ribociclib),其也被称为lee011;trilaciclib,其也被称为g1t28;和dinaciclib。
81.实施方案32:实施方案1至31中任一项的用途的组合,其中所述cdk4/6抑制剂引起细胞中的g1阻滞并抑制e2f1。
82.实施方案33:实施方案1至32中任一项的用途的组合,其中所述组合物还包含parp抑制剂。
83.实施方案34:实施方案33的用途的组合,其中所述parp抑制剂选自包含奥拉帕尼(olaparib)、维利帕尼(veliparib)、鲁卡帕尼(rucaparib)和bmn673的组。
84.实施方案35:实施方案1至32中任一项的用途的组合,其中所述组合物还包含布罗莫结构域抑制剂。
85.实施方案36:实施方案35的用途的组合,其中所述布罗莫结构域抑制剂选自包含jq-1、otx-015、i-bet151、cpi-0610、i-bet762、cpi203、pfi-1和ms 436的组。
86.实施方案37:实施方案1至36中任一项的用途的组合,其中所述组合的成分用于单独施用。
87.实施方案38:实施方案1至37中任一项的用途的组合,其中肿瘤的细胞具有cdk4/6信号传导途径的破坏。
88.实施方案39:实施方案1至38中任一项的用途的组合,其中所述肿瘤的细胞具有细胞周期的不受控制的g1-s转变。
89.实施方案40:实施方案1至38中任一项的用途的组合,其中所述肿瘤的细胞在选自包含rb1基因、cdkn2a基因和cdkn2b基因的组中的基因中具有功能丧失的突变或缺失。
90.实施方案41:实施方案1至38中任一项的用途的组合,其中所述肿瘤的细胞具有基因的扩增和/或基因中的活化突变。
91.实施方案42:实施方案41的用途的组合,其中所述基因选自包含ccnd1、e2f1、e2f2、e2f3、cdk4和cdk6的组。
92.实施方案43:实施方案41的用途的组合,其中所述基因是编码有丝分裂信号传导途径的组分的一个基因。
93.实施方案44:实施方案43的用途的组合,其中所述有丝分裂信号传导途径选自包含pi3k途径和mapk途径的组。
94.实施方案45:实施方案1至44中任一项的用途的组合,其中所述肿瘤细胞的细胞对一种或几种药物活性剂和/或辐射具有抗性或对其不敏感。
95.实施方案46:实施方案45的用途的组合,其中所述药物活性剂是细胞抑制剂。
96.实施方案47:权利要求46的用途的组合,其中所述抗性由abc转运蛋白介导。
97.实施方案48:权利要求47的用途的组合,其中所述abc转运蛋白选自包含mrp和mdr,特别是mdr-1的组。
98.实施方案49:实施方案45至48中任一项的用途的组合,其中所述抗性是多重抗性或多抗性,特别是针对细胞抑制剂和/或辐射的多重或多抗性。
99.实施方案50:实施方案1至49中任一项的用途的组合,其中所述肿瘤的细胞是rb阳性的。
100.实施方案51:实施方案1至50中任一项的用途的组合,其中所述肿瘤的细胞在细胞核中具有yb-1。
101.实施方案52:实施方案1至51中任一项的用途的组合,其中所述肿瘤的细胞在诱导后在细胞核中具有yb-1。
102.实施方案53:实施方案52的用途的组合,其中yb-1向细胞核内的运输通过选自包含辐射、施用细胞抑制剂和过热的组中的至少一种措施触发。
103.实施方案54:实施方案53的用途的组合,其中所述措施应用于细胞、器官或生物体,优选需要其的生物体,更优选患有肿瘤的生物体。
104.实施方案55:权利要求1至54中任一项的用途的组合,其中所述肿瘤选自包含以下各项的组:膀胱癌、乳腺癌、转移性乳腺癌(mbc)、黑色素瘤、神经胶质瘤、胰腺癌、肝细胞癌、肺腺癌、肉瘤、卵巢癌、肾癌、前列腺癌和白血病。
105.通过腺病毒用于治疗和/或预防受试者的疾病,更优选肿瘤或癌症,其中该方法包括向受试者施用腺病毒和cdk4/6抑制剂,在第三方面中也解决了本发明的问题,其也是该第三方面的第一实施方案。
106.在下文中,公开了该第三方面的其他实施方案。
107.实施方案2:实施方案1的用途的腺病毒,其中所述腺病毒是溶瘤腺病毒。
108.实施方案3:实施方案1和2中任一项的用途的腺病毒,其中所述腺病毒以yb-1依赖性方式复制。
109.实施方案4:实施方案3的用途的腺病毒,其中所述腺病毒在细胞核中缺乏yb-1的细胞中是复制缺陷的,但是在细胞核中具有yb-1的细胞中复制。
110.实施方案5:实施方案2至4中任一项的用途的腺病毒,其中所述腺病毒编码癌基因蛋白,其中所述癌基因蛋白使至少一个腺病毒基因反式激活,其中所述腺病毒基因选自包含e1b55kda、e4orf6、e4orf3和e3adp的组。
111.实施方案6:实施方案5的用途的腺病毒,其中所述癌基因蛋白是e1a蛋白。
112.实施方案7:实施方案6的用途的腺病毒,其中所述e1a蛋白能够结合功能性rb肿瘤抑制基因产物。
113.实施方案8:实施方案6的用途的腺病毒,其中所述e1a蛋白不能结合功能性rb肿瘤抑制基因产物。
114.实施方案9:实施方案6至8中任一项的用途的腺病毒,其中e1a蛋白不诱导yb-1定位到细胞核中。
115.实施方案10:实施方案5至9中任一项的用途的腺病毒,其中与野生型癌基因蛋白e1a相比,所述癌基因蛋白表现出一个或若干个突变或缺失。
116.实施方案11:实施方案10的用途的腺病毒,其中所述缺失选自包含cr3片段的缺
失、n末端的缺失和c末端的缺失的组中的一种。
117.实施方案12:实施方案6至11中任一项的用途的腺病毒,其中所述e1a蛋白能够结合rb。
118.实施方案13:实施方案6至12中任一项的用途的腺病毒,其中与野生型癌基因蛋白相比,所述e1a蛋白包含一个或若干个突变或缺失,其中所述缺失优选为cr1区域和/或cr2区域中的缺失。
119.实施方案14:实施方案13的用途的腺病毒,其中所述e1a蛋白不能结合rb。
120.实施方案15:实施方案1至14中任一项的用途的腺病毒,其中所述病毒是表达e1a12s蛋白的腺病毒。
121.实施方案16:实施方案1至15中任一项的用途的腺病毒,其中所述病毒是缺乏e1a13s蛋白表达的腺病毒。
122.实施方案17:实施方案1至16中任一项的用途的腺病毒,其中所述病毒是缺乏功能活性腺病毒e3区域的腺病毒。
123.实施方案18:实施方案1至17中任一项的用途的腺病毒,其中所述病毒是缺乏e1b 19kda蛋白表达的腺病毒。
124.实施方案19:实施方案1至18中任一项的用途的腺病毒,其中所述病毒是在尾丝上表达rgd基序的腺病毒。
125.实施方案20:实施方案1至19中任一项的用途的腺病毒,其中所述病毒是腺病毒血清型5。
126.实施方案21:实施方案1至20中任一项的用途的腺病毒,其中所述腺病毒选自包含以下各项的组:xvir-n-31、dl520、adδ24、adδ24-rgd、dl922-947、e1ad/0i/07、dl1119/1131、cb 016、vcn-01、e1adl1107、e1adl1101、orca-010、enadenotucirev和缺乏表达的病毒癌基因的病毒,所述表达的病毒癌基因能够结合功能性rb肿瘤抑制基因产物。
127.实施方案22:实施方案21的用途的腺病毒,其中所述腺病毒是xvir-n-31。
128.实施方案23:实施方案21的用途的腺病毒,其中所述腺病毒是dl520,其中所述腺病毒e3区域是功能失活的。
129.实施方案24:实施方案21至23中任一项的用途的腺病毒,其中所述腺病毒是dl520,其中dl520缺乏e1b 19kda蛋白的表达。
130.实施方案25:实施方案21至24中任一项的用途的腺病毒,其中所述腺病毒是在尾丝上表达rgd基序的dl520。
131.实施方案26:实施方案1至25中任一项的用途的腺病毒,其中所述病毒编码yb-1。
132.实施方案27:实施方案26的用途的腺病毒,其中编码yb-1的基因在组织特异性启动子、肿瘤特异性启动子和/或yb-1依赖性启动子的控制下。
133.实施方案28:实施方案27的用途的腺病毒,其中所述yb-1依赖性启动子是腺病毒e2晚期启动子。
134.实施方案29:实施方案1至28中任一项的用途的腺病毒,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb磷酸化的化合物。
135.实施方案30:实施方案1至29中任一项的用途的腺病毒,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb表达的化合物。
136.实施方案31:实施方案1至301中任一项的用途的腺病毒,其中所述cdk4/6抑制剂选自包含以下各项的组;帕博西尼(palbociclib),其也被称为pd 0332991;阿贝西利,其也被称为ly-2835219;瑞博西尼(ribociclib),其也被称为lee011;trilaciclib,其也被称为g1t28;和dinaciclib。
137.实施方案32:实施方案1至31中任一项的用途的腺病毒,其中所述cdk4/6抑制剂引起细胞中的g1阻滞并抑制e2f1。
138.实施方案33:实施方案1至32中任一项的用途的腺病毒,其中所述方法还包括向受试者施用parp抑制剂。
139.实施方案34:实施方案33的用途的腺病毒,其中所述parp抑制剂选自包含奥拉帕尼(olaparib)、维利帕尼(veliparib)、鲁卡帕尼(rucaparib)和bmn673的组。
140.实施方案35:实施方案1至32中任一项的用途的腺病毒,其中所述组合物还包括向受试者施用布罗莫结构域抑制剂。
141.实施方案36:实施方案35的用途的腺病毒,其中所述布罗莫结构域抑制剂选自包含jq-1、otx-015、i-bet151、cpi-0610、i-bet762、cpi203、pfi-1和ms 436的组。
142.实施方案37:实施方案1至36中任一项的用途的腺病毒,其中所述腺病毒、所述cdk4/6抑制剂、所述parp抑制剂和/或所述布罗莫结构域抑制剂单独或以任何组合形式施用于受试者。
143.实施方案38:实施方案1至37中任一项的用途的腺病毒,其中肿瘤的细胞具有cdk4/6信号传导途径的破坏。
144.实施方案39:实施方案1至38中任一项的用途的腺病毒,其中所述肿瘤的细胞具有细胞周期的不受控制的g1-s转变。
145.实施方案40:实施方案1至38中任一项的用途的腺病毒,其中所述肿瘤的细胞在选自包含rb1基因、cdkn2a基因和cdkn2b基因的组中的基因中具有功能丧失的突变或缺失。
146.实施方案41:实施方案1至38中任一项的用途的腺病毒,其中所述肿瘤的细胞具有基因的扩增和/或基因中的活化突变。
147.实施方案42:实施方案41的用途的腺病毒,其中所述基因选自包含ccnd1、e2f1、e2f2、e2f3、cdk4和cdk6的组。
148.实施方案43:实施方案41的用途的腺病毒,其中所述基因是编码有丝分裂信号传导途径的组分的一个基因。
149.实施方案44:实施方案43的用途的腺病毒,其中所述有丝分裂信号传导途径选自包含pi3k途径和mapk途径的组。
150.实施方案45:实施方案1至44中任一项的用途的腺病毒,其中所述肿瘤细胞的细胞对一种或几种药物活性剂和/或辐射具有抗性或对其不敏感。
151.实施方案46:实施方案45的用途的腺病毒,其中所述药物活性剂是细胞抑制剂。
152.实施方案47:权利要求46的用途的腺病毒,其中所述抗性由abc转运蛋白介导。
153.实施方案48:权利要求47的用途的腺病毒,其中所述abc转运蛋白选自包含mrp和mdr,特别是mdr-1的组。
154.实施方案49:实施方案45至48中任一项的用途的腺病毒,其中所述抗性是多重抗性或多抗性,特别是针对细胞抑制剂和/或辐射的多重或多抗性。
155.实施方案50:实施方案1至49中任一项的用途的腺病毒,其中所述肿瘤的细胞是rb阳性的。
156.实施方案51:实施方案1至50中任一项的用途的腺病毒,其中所述肿瘤的细胞在细胞核中具有yb-1。
157.实施方案52:实施方案1至51中任一项的用途的腺病毒,其中所述肿瘤的细胞在诱导后在细胞核中具有yb-1。
158.实施方案53:实施方案52的用途的腺病毒,其中yb-1向细胞核内的运输通过选自包含辐射、施用细胞抑制剂和过热的组中的至少一种措施触发。
159.实施方案54:实施方案53的用途的腺病毒,其中所述措施应用于细胞、器官或生物体,优选需要其的生物体,更优选患有肿瘤的生物体。
160.实施方案55:权利要求1至54中任一项的用途的腺病毒,其中所述肿瘤选自包含以下各项的组:膀胱癌、乳腺癌、转移性乳腺癌(mbc)、黑色素瘤、神经胶质瘤、胰腺癌、肝细胞癌、肺腺癌、肉瘤、卵巢癌、肾癌、前列腺癌和白血病。
161.通过cdk4/6抑制剂用于治疗和/或预防受试者的疾病,更优选肿瘤或癌症,其中该方法包括向受试者施用腺病毒和cdk4/6抑制剂,在第四方面中也解决了本发明的问题,其也是该第四方面的第一实施方案。
162.在下文中,公开了该第四方面的其他实施方案。
163.实施方案2:实施方案1的用途的cdk4/6抑制剂,其中所述腺病毒是溶瘤腺病毒。
164.实施方案3:实施方案1和2中任一项的用途的cdk4/6抑制剂,其中所述腺病毒以yb-1依赖性方式复制。
165.实施方案4:实施方案3的用途的cdk4/6抑制剂,其中所述腺病毒在细胞核中缺乏yb-1的细胞中是复制缺陷的,但是在细胞核中具有yb-1的细胞中复制。
166.实施方案5:实施方案2至4中任一项的用途的cdk4/6抑制剂,其中所述腺病毒编码癌基因蛋白,其中所述癌基因蛋白使至少一个腺病毒基因反式激活,其中所述腺病毒基因选自包含e1b55kda、e4orf6、e4orf3和e3adp的组。
167.实施方案6:实施方案5的用途的cdk4/6抑制剂,其中所述癌基因蛋白是e1a蛋白。
168.实施方案7:实施方案6的用途的cdk4/6抑制剂,其中所述e1a蛋白能够结合功能性rb肿瘤抑制基因产物。
169.实施方案8:实施方案6的用途的cdk4/6抑制剂,其中e1a蛋白不能结合功能性rb肿瘤抑制基因产物。
170.实施方案9:实施方案6至8中任一项的用途的cdk4/6抑制剂,其中e1a蛋白不诱导yb-1定位到细胞核中。
171.实施方案10:实施方案5至9中任一项的用途的cdk4/6抑制剂,其中与野生型癌基因蛋白e1a相比,所述癌基因蛋白表现出一个或若干个突变或缺失。
172.实施方案11:实施方案10的用途的cdk4/6抑制剂,其中所述缺失是选自包含cr3片段的缺失、n末端的缺失和c末端的缺失的组中的一种。
173.实施方案12:实施方案6至11中任一项的用途的cdk4/6抑制剂,其中所述e1a蛋白能够结合rb。
174.实施方案13:实施方案6至12中任一项的用途的cdk4/6抑制剂,其中与野生型癌基
因蛋白相比,所述e1a蛋白包含一个或若干个突变或缺失,其中所述缺失优选为cr1区域和/或cr2区域中的缺失。
175.实施方案14:实施方案13的用途的cdk4/6抑制剂,其中所述e1a蛋白不能结合rb。
176.实施方案15:实施方案1至14中任一项的用途的cdk4/6抑制剂,其中所述病毒是表达e1a12s蛋白的腺病毒。
177.实施方案16:实施方案1至15中任一项的用途的cdk4/6抑制剂,其中所述病毒是缺乏e1a13s蛋白表达的腺病毒。
178.实施方案17:实施方案1至16中任一项的用途的cdk4/6抑制剂,其中所述病毒是缺乏功能活性腺病毒e3区域的腺病毒。
179.实施方案18:实施方案1至17中任一项的用途的cdk4/6抑制剂,其中所述病毒是缺乏e1b 19kda蛋白表达的腺病毒。
180.实施方案19:实施方案1至18中任一项的用途的cdk4/6抑制剂,其中所述病毒是在尾丝上表达rgd基序的腺病毒。
181.实施方案20:实施方案1至19中任一项的用途的cdk4/6抑制剂,其中所述病毒是腺病毒血清型5。
182.实施方案21:实施方案1至20中任一项的用途的cdk4/6抑制剂,其中所述腺病毒选自包含以下各项的组:xvir-n-31、dl520、adδ24、adδ24-rgd、dl922-947、e1ad/0i/07、dl1119/1131、cb 016、vcn-01、e1adl1107、e1adl1101、orca-010、enadenotucirev和缺乏表达的病毒癌基因的病毒,所述表达的病毒癌基因能够结合功能性rb肿瘤抑制基因产物。
183.实施方案22:实施方案21的用途的cdk4/6抑制剂,其中所述腺病毒是xvir-n-31。
184.实施方案23:实施方案21的用途的cdk4/6抑制剂,其中所述腺病毒是dl520,其中所述腺病毒e3区域是功能失活的。
185.实施方案24:实施方案21至23中任一项的用途的cdk4/6抑制剂,其中所述腺病毒是dl520,其中dl520缺乏e1b 19kda蛋白的表达。
186.实施方案25:实施方案21至24中任一项的用途的cdk4/6抑制剂,其中所述腺病毒是在尾丝上表达rgd基序的dl520。
187.实施方案26:实施方案1至25中任一项的用途的cdk4/6抑制剂,其中所述病毒编码yb-1。
188.实施方案27:实施方案26的用途的cdk4/6抑制剂,其中编码yb-1的基因在组织特异性启动子、肿瘤特异性启动子和/或yb-1依赖性启动子的控制下。
189.实施方案28:实施方案27的用途的cdk4/6抑制剂,其中所述yb-1依赖性启动子是腺病毒e2晚期启动子。
190.实施方案29:实施方案1至28中任一项的用途的cdk4/6抑制剂,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb磷酸化的化合物。
191.实施方案30:实施方案1至29中任一项的用途的cdk4/6抑制剂,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb表达的化合物。
192.实施方案31:实施方案1至30中任一项的用途的cdk4/6抑制剂,其中所述cdk4/6抑制剂选自包含以下各项的组;帕博西尼(palbociclib),其也被称为pd 0332991;阿贝西利,其也被称为ly-2835219;瑞博西尼(ribociclib),其也被称为lee011;trilaciclib,其也被
称为g1t28;和dinaciclib。
193.实施方案32:实施方案1至31中任一项的用途的cdk4/6抑制剂,其中所述cdk4/6抑制剂引起细胞中的g1阻滞并抑制e2f1。
194.实施方案33:实施方案1至32中任一项的用途的cdk4/6抑制剂,其中所述方法还包括向受试者施用parp抑制剂。
195.实施方案34:实施方案33的用途的cdk4/6抑制剂,其中所述parp抑制剂选自包含奥拉帕尼(olaparib)、维利帕尼(veliparib)、鲁卡帕尼(rucaparib)和bmn673的组。
196.实施方案35:实施方案1至32中任一项的用途的cdk4/6抑制剂,其中所述方法还包括向受试者施用布罗莫结构域抑制剂。
197.实施方案36:实施方案35的用途的cdk4/6抑制剂,其中所述布罗莫结构域抑制剂选自包含jq-1、otx-015、i-bet151、cpi-0610、i-bet762、cpi203、pfi-1和ms 436的组。
198.实施方案37:实施方案1至36中任一项的用途的cdk4/6抑制剂,其中所述腺病毒、所述cdk4/6抑制剂、所述parp抑制剂和/或所述布罗莫结构域抑制剂单独或以任何组合形式施用于受试者。
199.实施方案38:实施方案1至37中任一项的用途的cdk4/6抑制剂,其中肿瘤的细胞具有cdk4/6信号传导途径的破坏。
200.实施方案39:实施方案1至38中任一项的用途的cdk4/6抑制剂,其中所述肿瘤的细胞具有细胞周期的不受控制的g1-s转变。
201.实施方案40:实施方案1至38中任一项的用途的cdk4/6抑制剂,其中所述肿瘤的细胞在选自包含rb1基因、cdkn2a基因和cdkn2b基因的组中的基因中具有功能丧失的突变或缺失。
202.实施方案41:实施方案1至38中任一项的用途的cdk4/6抑制剂,其中所述肿瘤的细胞具有基因的扩增和/或基因中的活化突变。
203.实施方案42:实施方案41的用途的cdk4/6抑制剂,其中所述基因选自包含ccnd1、e2f1、e2f2、e2f3、cdk4和cdk6的组。
204.实施方案43:实施方案41的用途的cdk4/6抑制剂,其中所述基因是编码有丝分裂信号传导途径的组分的一个基因。
205.实施方案44:实施方案43的用途的cdk4/6抑制剂,其中所述有丝分裂信号传导途径选自包含pi3k途径和mapk途径的组。
206.实施方案45:实施方案1至44中任一项的用途的cdk4/6抑制剂,其中所述肿瘤细胞的细胞对一种或若干种药物活性剂和/或辐射具有抗性或对其不敏感。
207.实施方案46:实施方案45的用途的cdk4/6抑制剂,其中所述药物活性剂是细胞抑制剂。
208.实施方案47:权利要求46的用途的cdk4/6抑制剂,其中所述抗性由abc转运蛋白介导。
209.实施方案48:权利要求47的用途的cdk4/6抑制剂,其中所述abc转运蛋白选自包含mrp和mdr,特别是mdr-1的组。
210.实施方案49:实施方案45至48中任一项的用途的cdk4/6抑制剂,其中所述抗性是多重抗性或多抗性,特别是针对细胞抑制剂和/或辐射的多重或多抗性。
211.实施方案50:实施方案1至49中任一项的用途的cdk4/6抑制剂,其中所述肿瘤的细胞是rb阳性的。
212.实施方案51:实施方案1至50中任一项的用途的cdk4/6抑制剂,其中所述肿瘤的细胞在细胞核中具有yb-1。
213.实施方案52:实施方案1至51中任一项的用途的cdk4/6抑制剂,其中所述肿瘤的细胞在诱导后在细胞核中具有yb-1。
214.实施方案53:实施方案52的用途的cdk4/6抑制剂,其中yb-1向细胞核内的运输通过选自包含辐射、施用细胞抑制剂和过热的组中的至少一种措施触发。
215.实施方案54:实施方案53的用途的cdk4/6抑制剂,其中所述措施应用于细胞、器官或生物体,优选需要其的生物体,更优选患有肿瘤的生物体。
216.实施方案55:权利要求1至54中任一项的用途的cdk4/6抑制剂,其中所述肿瘤选自包含以下各项的组:膀胱癌、乳腺癌、转移性乳腺癌(mbc)、黑色素瘤、神经胶质瘤、胰腺癌、肝细胞癌、肺腺癌、肉瘤、卵巢癌、肾癌、前列腺癌和白血病。
217.通过parp抑制剂用于治疗和/或预防受试者的疾病,更优选肿瘤或癌症,其中所述方法包括向所述受试者施用腺病毒、cdk4/6抑制剂和parp抑制剂,在第五方面中也解决了本发明的问题,其也是该第五方面的第一实施方案。
218.在下文中,公开了该第五方面的其他实施方案。
219.实施方案2:实施方案1的用途的parp抑制剂,其中所述腺病毒是溶瘤腺病毒。
220.实施方案3:实施方案1和2中任一项的用途的parp抑制剂,其中所述腺病毒以yb-1依赖性方式复制。
221.实施方案4:实施方案3的用途的parp抑制剂,其中所述腺病毒在细胞核中缺乏yb-1的细胞中是复制缺陷的,但是在细胞核中具有yb-1的细胞中复制。
222.实施方案5:实施方案2至4中任一项的用途的parp抑制剂,其中所述腺病毒编码癌基因蛋白,其中所述癌基因蛋白使至少一个腺病毒基因反式激活,其中所述腺病毒基因选自包含e1b55kda、e4orf6、e4orf3和e3adp的组。
223.实施方案6:实施方案5的用途的parp抑制剂,其中所述癌基因蛋白是e1a蛋白。
224.实施方案7:实施方案6的用途的parp抑制剂,其中所述e1a蛋白能够结合功能性rb肿瘤抑制基因产物。
225.实施方案8:实施方案6的用途的parp抑制剂,其中e1a蛋白不能结合功能性rb肿瘤抑制基因产物。
226.实施方案9:实施方案6至8中任一项的用途的parp抑制剂,其中e1a蛋白不诱导yb-1定位到细胞核中。
227.实施方案10:实施方案5至9中任一项的用途的parp抑制剂,其中与野生型癌基因蛋白e1a相比,所述癌基因蛋白表现出一个或若干个突变或缺失。
228.实施方案11:实施方案10的用途的parp抑制剂,其中所述缺失选自包含cr3片段的缺失、n末端的缺失和c末端的缺失的组中的一种。
229.实施方案12:实施方案6至11中任一项的用途的parp抑制剂,其中所述e1a蛋白能够结合rb。
230.实施方案13:实施方案6至12中任一项的用途的parp抑制剂,其中与野生型癌基因
蛋白相比,所述e1a蛋白包含一个或多个突变或缺失,其中所述缺失优选为cr1区域和/或cr2区域中的缺失。
231.实施方案14:实施方案13的用途的parp抑制剂,其中所述e1a蛋白不能结合rb。
232.实施方案15:实施方案1至14中任一项的用途的parp抑制剂,其中所述病毒是表达e1a12s蛋白的腺病毒。
233.实施方案16:实施方案1至15中任一项的用途的parp抑制剂,其中所述病毒是缺乏e1a13s蛋白表达的腺病毒。
234.实施方案17:实施方案1至16中任一项的用途的parp抑制剂,其中所述病毒是缺乏功能活性腺病毒e3区域的腺病毒。
235.实施方案18:实施方案1至17中任一项的用途的parp抑制剂,其中所述病毒是缺乏e1b 19kda蛋白表达的腺病毒。
236.实施方案19:实施方案1至18中任一项的用途的parp抑制剂,其中所述病毒是在尾丝上表达rgd基序的腺病毒。
237.实施方案20:实施方案1至19中任一项的用途的parp抑制剂,其中所述病毒是腺病毒血清型5。
238.实施方案21:实施方案1至20中任一项的用途的parp抑制剂,其中所述腺病毒选自包含以下各项的组:xvir-n-31、dl520、adδ24、adδ24-rgd、dl922-947、e1ad/01/07、dl1119/1131、cb 016、vcn-01、e1adl1107、e1adl1101、orca-010、enadenotucirev和缺乏表达的病毒癌基因的病毒,所述表达的病毒癌基因能够结合功能性rb肿瘤抑制基因产物。
239.实施方案22:实施方案21的用途的parp抑制剂,其中所述腺病毒是xvir-n-31。
240.实施方案23:实施方案21的用途的parp抑制剂,其中所述腺病毒是dl520,其中所述腺病毒e3区域是功能失活的。
241.实施方案24:实施方案21至23中任一项的用途的parp抑制剂,其中所述腺病毒是dl520,其中dl520缺乏e1b 19kda蛋白的表达。
242.实施方案25:实施方案21至24中任一项的用途的parp抑制剂,其中所述腺病毒是在尾丝上表达rgd基序的dl520。
243.实施方案26:实施方案1至25中任一项的用途的parp抑制剂,其中所述病毒编码yb-1。
244.实施方案27:实施方案26的用途的parp抑制剂,其中编码yb-1的基因在组织特异性启动子、肿瘤特异性启动子和/或yb-1依赖性启动子的控制下。
245.实施方案28:实施方案27的用途的parp抑制剂,其中所述yb-1依赖性启动子是腺病毒e2晚期启动子。
246.实施方案29:实施方案1至28中任一项的用途的parp抑制剂,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb磷酸化的化合物。
247.实施方案30:实施方案1至29中任一项的用途的parp抑制剂,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb表达的化合物。
248.实施方案31:实施方案1至30中任一项的用途的parp抑制剂,其中所述cdk4/6抑制剂选自包含以下各项的组;帕博西尼(palbociclib),其也被称为pd 0332991;阿贝西利,其也被称为ly-2835219;瑞博西尼(ribociclib),其也被称为lee011;trilaciclib,其也被称
为g1t28;和dinaciclib。
249.实施方案32:实施方案1至31中任一项的用途的parp抑制剂,其中所述cdk4/6抑制剂引起细胞中的g1阻滞并抑制e2f1。
250.实施方案33:实施方案1至32中任一项的用途的parp抑制剂,其中所述方法还包括向受试者施用parp抑制剂。
251.实施方案34:实施方案33的用途的parp抑制剂,其中所述parp抑制剂选自包含奥拉帕尼(olaparib)、维利帕尼(veliparib)、鲁卡帕尼(rucaparib)和bmn673的组。
252.实施方案35:实施方案1至32中任一项的用途的parp抑制剂,其中所述组合物还包括向受试者施用布罗莫结构域抑制剂。
253.实施方案36:实施方案35的用途的parp抑制剂,其中所述布罗莫结构域抑制剂选自包含jq-1、otx-015、i-bet151、cpi-0610、i-bet762、cpi203、pfi-1和ms 436的组。
254.实施方案37:实施方案1至36中任一项的用途的parp抑制剂,其中所述腺病毒、所述cdk4/6抑制剂、所述parp抑制剂和/或所述布罗莫结构域抑制剂单独或以任何组合形式施用于受试者。
255.实施方案38:实施方案1至37中任一项的用途的parp抑制剂,其中肿瘤的细胞具有cdk4/6信号传导途径的破坏。
256.实施方案39:实施方案1至38中任一项的用途的parp抑制剂,其中所述肿瘤的细胞具有细胞周期的不受控制的g1-s转变。
257.实施方案40:实施方案1至38中任一项的用途的parp抑制剂,其中所述肿瘤的细胞在选自包含rb1基因、cdkn2a基因和cdkn2b基因的组中的基因中具有功能丧失的突变或缺失。
258.实施方案41:实施方案1至38中任一项的用途的parp抑制剂,其中所述肿瘤的细胞具有基因的扩增和/或基因中的活化突变。
259.实施方案42:实施方案41的用途的parp抑制剂,其中所述基因选自包含ccnd1、e2f1、e2f2、e2f3、cdk4和cdk6的组。
260.实施方案43:实施方案41的用途的parp抑制剂,其中所述基因是编码有丝分裂信号传导途径的组分的一个基因。
261.实施方案44:实施方案43的用途的parp抑制剂,其中所述有丝分裂信号传导途径选自包含pi3k途径和mapk途径的组。
262.实施方案45:实施方案1至44中任一项的用途的parp抑制剂,其中所述肿瘤细胞的细胞对一种或若干种药物活性剂和/或辐射具有抗性或对其不敏感。
263.实施方案46:实施方案45的用途的parp抑制剂,其中所述药物活性剂是细胞抑制剂。
264.实施方案47:权利要求46的用途的parp抑制剂,其中所述抗性由abc转运蛋白介导。
265.实施方案48:权利要求47的用途的parp抑制剂,其中所述abc转运蛋白选自包含mrp和mdr,特别是mdr-1的组。
266.实施方案49:实施方案45至48中任一项的用途的parp抑制剂,其中所述抗性是多重抗性或多抗性,特别是针对细胞抑制剂和/或辐射的多重或多抗性。
267.实施方案50:实施方案1至49中任一项的用途的parp抑制剂,其中所述肿瘤的细胞是rb阳性的。
268.实施方案51:实施方案1至50中任一项的用途的parp抑制剂,其中所述肿瘤的细胞在细胞核中具有yb-1。
269.实施方案52:实施方案1至51中任一项的用途的parp抑制剂,其中所述肿瘤的细胞在诱导后在细胞核中具有yb-1。
270.实施方案53:实施方案52的用途的parp抑制剂,其中yb-1向细胞核内的运输通过选自辐射、施用细胞抑制剂和过热的组中的至少一种措施触发。
271.实施方案54:实施方案53的用途的parp抑制剂,其中所述措施应用于细胞、器官或生物体,优选需要其的生物体,更优选患有肿瘤的生物体。
272.实施方案55:权利要求1至54中任一项的用途的parp抑制剂,其中所述肿瘤选自包含以下各项的组:膀胱癌、乳腺癌、转移性乳腺癌(mbc)、黑色素瘤、神经胶质瘤、胰腺癌、肝细胞癌、肺腺癌、肉瘤、卵巢癌、肾癌、前列腺癌和白血病。
273.通过布罗莫结构域抑制剂用于治疗和/或预防受试者的疾病,更优选肿瘤或癌症,其中该方法包括向受试者施用腺病毒、cdk4/6抑制剂和布罗莫结构域抑制剂,在第六方面中解决了本发明的问题,其也是该第六方面的第一实施方案。
274.在下文中,公开了该第六方面的其他实施方案。
275.实施方案2:实施方案1的用途的布罗莫结构域抑制剂,其中所述腺病毒是溶瘤腺病毒。
276.实施方案3:实施方案1和2中任一项的用途的布罗莫结构域抑制剂,其中所述腺病毒以yb-1依赖性方式复制。
277.实施方案4:实施方案3的用途的布罗莫结构域抑制剂,其中所述腺病毒在细胞核中缺乏yb-1的细胞中是复制缺陷的,但是在细胞核中具有yb-1的细胞中复制。
278.实施方案5:实施方案2至4中任一项的用途的布罗莫结构域抑制剂,其中所述腺病毒编码癌基因蛋白,其中所述癌基因蛋白使至少一个腺病毒基因反式激活,其中所述腺病毒基因选自包含e1b55kda、e4orf6、e4orf3和e3adp的组。
279.实施方案6:实施方案5的用途的布罗莫结构域抑制剂,其中所述癌基因蛋白是e1a蛋白。
280.实施方案7:实施方案6的用途的布罗莫结构域抑制剂,其中所述e1a蛋白能够结合功能性rb肿瘤抑制基因产物。
281.实施方案8:实施方案6的用途的布罗莫结构域抑制剂,其中e1a蛋白不能结合功能性rb肿瘤抑制基因产物。
282.实施方案9:实施方案6至8中任一项的用途的布罗莫结构域抑制剂,其中e1a蛋白不诱导yb-1定位到细胞核中。
283.实施方案10:实施方案5至9中任一项的用途的布罗莫结构域抑制剂,其中与野生型癌基因蛋白e1a相比,所述癌基因蛋白表现出一个或若干个突变或缺失。
284.实施方案11:实施方案10的用途的布罗莫结构域抑制剂,其中所述缺失选自包含cr3片段的缺失、n末端的缺失和c末端的缺失的组中的一种。
285.实施方案12:实施方案6至11中任一项的用途的布罗莫结构域抑制剂,其中所述
e1a蛋白能够结合rb。
286.实施方案13:实施方案6至12中任一项的用途的布罗莫结构域抑制剂,其中与野生型癌基因蛋白相比,所述e1a蛋白包含一个或若干个突变或缺失,其中所述缺失优选为cr1区域和/或cr2区域中的缺失。
287.实施方案14:实施方案13的用途的布罗莫结构域抑制剂,其中所述e1a蛋白不能结合rb。
288.实施方案15:实施方案1至14中任一项的用途的布罗莫结构域抑制剂,其中所述病毒是表达e1a12s蛋白的腺病毒。
289.实施方案16:实施方案1至15中任一项的用途的布罗莫结构域抑制剂,其中所述病毒是缺乏e1a13s蛋白表达的腺病毒。
290.实施方案17:实施方案1至16中任一项的用途的布罗莫结构域抑制剂,其中所述病毒是缺乏功能活性腺病毒e3区域的腺病毒。
291.实施方案18:实施方案1至17中任一项的用途的布罗莫结构域抑制剂,其中所述病毒是缺乏e1b 19kda蛋白表达的腺病毒。
292.实施方案19:实施方案1至18中任一项的用途的布罗莫结构域抑制剂,其中所述病毒是在尾丝上表达rgd基序的腺病毒。
293.实施方案20:实施方案1至19中任一项的用途的布罗莫结构域抑制剂,其中所述病毒是腺病毒血清型5。
294.实施方案21:实施方案1至20中任一项的用途的布罗莫结构域抑制剂,其中所述腺病毒选自包含以下各项的组:xvir-n-31、dl520、adδ24、adδ24-rgd、dl922-947、e1ad/01/07、dl1119/1131、cb016、vcn-01、e1adl1107、e1adl1101、orca-010、enadenotucirev和缺乏表达的病毒癌基因的病毒,所述表达的病毒癌基因能够结合功能性rb肿瘤抑制基因产物。
295.实施方案22:实施方案21的用途的布罗莫结构域抑制剂,其中所述腺病毒是xvir-n-31。
296.实施方案23:实施方案21的用途的布罗莫结构域抑制剂,其中所述腺病毒是dl520,其中所述腺病毒e3区域是功能失活的。
297.实施方案24:实施方案21至23中任一项的用途的布罗莫结构域抑制剂,其中所述腺病毒是dl520,其中dl520缺乏e1b 19kda蛋白的表达。
298.实施方案25:实施方案21至24中任一项的用途的布罗莫结构域抑制剂,其中所述腺病毒是在尾丝上表达rgd基序的dl520。
299.实施方案26:实施方案1至25中任一项的用途的布罗莫结构域抑制剂,其中所述病毒编码yb-1。
300.实施方案27:实施方案26的用途的布罗莫结构域抑制剂,其中编码yb-1的基因在组织特异性启动子、肿瘤特异性启动子和/或yb-1依赖性启动子的控制下。
301.实施方案28:实施方案27的用途的布罗莫结构域抑制剂,其中所述yb-1依赖性启动子是腺病毒e2晚期启动子。
302.实施方案29:实施方案1至28中任一项的用途的布罗莫结构域抑制剂,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb磷酸化的化合物。
303.实施方案30:实施方案1至29中任一项的用途的布罗莫结构域抑制剂,其中所述
cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb表达的化合物。
304.实施方案31:实施方案1至30中任一项的用途的布罗莫结构域抑制剂,其中所述cdk4/6抑制剂选自包含以下各项的组;帕博西尼(palbociclib),其也被称为pd 0332991;阿贝西利,其也被称为ly-2835219;瑞博西尼(ribociclib),其也被称为lee011;trilaciclib,其也被称为g1t28;和dinaciclib。
305.实施方案32:实施方案1至31中任一项的用途的布罗莫结构域抑制剂,其中所述cdk4/6抑制剂引起细胞中的g1阻滞并抑制e2f1。
306.实施方案33:实施方案1至32中任一项的用途的布罗莫结构域抑制剂,其中所述方法还包括向受试者施用parp抑制剂。
307.实施方案34:实施方案33的用途的布罗莫结构域抑制剂,其中所述parp抑制剂选自包含奥拉帕尼(olaparib)、维利帕尼(veliparib)、鲁卡帕尼(rucaparib)和bmn673的组。
308.实施方案35:实施方案1至32中任一项的用途的布罗莫结构域抑制剂,其中所述组合物还包括向受试者施用布罗莫结构域抑制剂。
309.实施方案36:实施方案35的用途的布罗莫结构域抑制剂,其中所述布罗莫结构域抑制剂选自包含jq-1、otx-015、i-bet151、cpi-0610、i-bet762、cpi203、pfi-1和ms 436的组。
310.实施方案37:实施方案1至36中任一项的用途的布罗莫结构域抑制剂,其中所述腺病毒、所述cdk4/6抑制剂、所述parp抑制剂和/或所述布罗莫结构域抑制剂单独或以任何组合形式施用于受试者。
311.实施方案38:实施方案1至37中任一项的用途的布罗莫结构域抑制剂,其中肿瘤的细胞具有cdk4/6信号传导途径的破坏。
312.实施方案39:实施方案1至38中任一项的用途的布罗莫结构域抑制剂,其中所述肿瘤的细胞具有细胞周期的不受控制的g1-s转变。
313.实施方案40:实施方案1至38中任一项的用途的布罗莫结构域抑制剂,其中所述肿瘤的细胞在选自包含rb1基因、cdkn2a基因和cdkn2b基因的组中的基因中具有功能丧失的突变或缺失。
314.实施方案41:实施方案1至38中任一项的用途的布罗莫结构域抑制剂,其中所述肿瘤的细胞具有基因的扩增和/或基因中的活化突变。
315.实施方案42:实施方案41的用途的布罗莫结构域抑制剂,其中所述基因选自包含ccnd1、e2f1、e2f2、e2f3、cdk4和cdk6的组。
316.实施方案43:实施方案41的用途的布罗莫结构域抑制剂,其中所述基因是编码有丝分裂信号传导途径的组分的一个基因。
317.实施方案44:实施方案43的用途的布罗莫结构域抑制剂,其中所述有丝分裂信号传导途径选自包含pi3k途径和mapk途径的组。
318.实施方案45:实施方案1至44中任一项的用途的布罗莫结构域抑制剂,其中所述肿瘤细胞的细胞对一种或若干种药物活性剂和/或辐射具有抗性或对其不敏感。
319.实施方案46:实施方案45的用途的布罗莫结构域抑制剂,其中所述药物活性剂是细胞抑制剂。
320.实施方案47:权利要求46的用途的布罗莫结构域抑制剂,其中所述抗性由abc转运
蛋白介导。
321.实施方案48:权利要求47的用途的布罗莫结构域抑制剂,其中所述abc转运蛋白选自包含mrp和mdr,特别是mdr-1的组。
322.实施方案49:实施方案45至48中任一项的用途的布罗莫结构域抑制剂,其中所述抗性是多重抗性或多抗性,特别是针对细胞抑制剂和/或辐射的多重或多抗性。
323.实施方案50:实施方案1至49中任一项的用途的布罗莫结构域抑制剂,其中所述肿瘤的细胞是rb阳性的。
324.实施方案51:实施方案1至50中任一项的用途的布罗莫结构域抑制剂,其中所述肿瘤的细胞在细胞核中具有yb-1。
325.实施方案52:实施方案1至51中任一项的用途的布罗莫结构域抑制剂,其中所述肿瘤的细胞在诱导后在细胞核中具有yb-1。
326.实施方案53:实施方案52的用途的布罗莫结构域抑制剂,其中yb-1向细胞核内的运输通过选自包含辐射、施用细胞抑制剂和过热的组中的至少一种措施触发。
327.实施方案54:实施方案53的用途的布罗莫结构域抑制剂,其中所述措施应用于细胞、器官或生物体,优选需要其的生物体,更优选患有肿瘤的生物体。
328.实施方案55:权利要求1至54中任一项的用途的布罗莫结构域抑制剂,其中所述肿瘤选白包含以下各项的组:膀胱癌、乳腺癌、转移性乳腺癌(mbc)、黑色素瘤、神经胶质瘤、胰腺癌、肝细胞癌、肺腺癌、肉瘤、卵巢癌、肾癌、前列腺癌和白血病。
329.通过nutlin或nutlin衍生物用于治疗和/或预防受试者的疾病,更优选肿瘤或癌症,其中该方法包括向受试者施用腺病毒、cdk4/6抑制剂和布罗莫结构域抑制剂,在第七方面中解决了本发明的问题,其也是该第六方面的第一实施方案。
330.在下文中,公开了该第六方面的其他实施方案。
331.实施方案2:实施方案1的用途的nutlin或nutlin衍生物,其中所述腺病毒是溶瘤腺病毒。
332.实施方案3:实施方案1和2中任一项的用途的nutlin或nutlin衍生物,其中所述腺病毒以yb-1依赖性方式复制。
333.实施方案4:实施方案3的用途的nutlin或nutlin衍生物,其中所述腺病毒在细胞核中缺乏yb-1的细胞中是复制缺陷的,但是在细胞核中具有yb-1的细胞中复制。
334.实施方案5:实施方案2至4中任一项的用途的nutlin或nutlin衍生物,其中所述腺病毒编码癌基因蛋白,其中所述癌基因蛋白使至少一个腺病毒基因反式激活,其中所述腺病毒基因选自包含e1b55kda、e4orf6、e4orf3和e3adp的组。
335.实施方案6:实施方案5的用途的nutlin或nutlin衍生物,其中所述癌基因蛋白是e1a蛋白。
336.实施方案7:实施方案6的用途的nutlin或nutlin衍生物,其中所述e1a蛋白能够结合功能性rb肿瘤抑制基因产物。
337.实施方案8:实施方案6的用途的nutlin或nutlin衍生物,其中所述e1a蛋白不能结合功能性rb肿瘤抑制基因产物。
338.实施方案9:实施方案6至8中任一项的用途的nutlin或nutlin衍生物,其中所述e1a蛋白不诱导yb-1定位到细胞核中。
339.实施方案10:实施方案5至9中任一项的用途的nutlin或nutlin衍生物,其中与野生型癌基因蛋白e1a相比,所述癌基因蛋白表现出一个或几个突变或缺失。
340.实施方案11:实施方案10的用途的nutlin或nutlin衍生物,其中所述缺失是选自包含cr3片段的缺失、n末端的缺失和c末端的缺失的组中的一种。
341.实施方案12:实施方案6至11中任一项的用途的nutlin或nutlin衍生物,其中所述e1a蛋白能够结合rb。
342.实施方案13:实施方案6至12中任一项的用途的nutlin或nutlin衍生物,其中与野生型癌基因蛋白相比,所述e1a蛋白包含一个或若干个突变或缺失,其中所述缺失优选为cr1区域和/或cr2区域中的缺失。
343.实施方案14:实施方案13的用途的nutlin或nutlin衍生物,其中所述e1a蛋白不能结合rb。
344.实施方案15:实施方案1至14中任一项的用途的nutlin或nutlin衍生物,其中所述病毒是表达e1a12s蛋白的腺病毒。
345.实施方案16:实施方案1至15中任一项的用途的nutlin或nutlin衍生物,其中所述病毒是缺乏e1a13s蛋白表达的腺病毒。
346.实施方案17:实施方案1至16中任一项的用途的nutlin或nutlin衍生物,其中所述病毒是缺乏功能活性腺病毒e3区域的腺病毒。
347.实施方案18:实施方案1至17中任一项的用途的nutlin或nutlin衍生物,其中所述病毒是缺乏e1b 19kda蛋白表达的腺病毒。
348.实施方案19:实施方案1至18中任一项的用途的nutlin或nutlin衍生物,其中所述病毒是在尾丝上表达rgd基序的腺病毒。
349.实施方案20:实施方案1至19中任一项的用途的nutlin或nutlin衍生物,其中所述病毒是腺病毒血清型5。
350.实施方案21:实施方案1至20中任一项的用途的nutlin或nutlin衍生物,其中所述腺病毒选自包含以下各项的组:xvir-n-31、dl520、adδ24、ad δ24-rgd、dl922-947、e1ad/01/07、dl1119/1131、cb 016、vcn-01、e1adl1107、e1adl1101、orca-010、enadenotucirev和缺乏表达的病毒癌基因的病毒,所述表达的病毒癌基因能够结合功能性rb肿瘤抑制基因产物。
351.实施方案22:实施方案21的用途的nutlin或nutlin衍生物,其中所述腺病毒是xvir-n-31。
352.实施方案23:实施方案21的用途的nutlin或nutlin衍生物,其中所述腺病毒是dl520,其中所述腺病毒e3区域是功能失活的。
353.实施方案24:实施方案21至23中任一项的用途的nutlin或nutlin衍生物,其中所述腺病毒是dl520,其中dl520缺乏e1b 19kda蛋白的表达。
354.实施方案25:实施方案21至24中任一项的用途的nutlin或nutlin衍生物,其中所述腺病毒是在尾丝上表达rgd基序的dl520。
355.实施方案26:实施方案1至25中任一项的用途的nutlin或nutlin衍生物,其中所述病毒编码yb-1。
356.实施方案27:实施方案26的用途的nutlin或nutlin衍生物,其中编码yb-1的基因
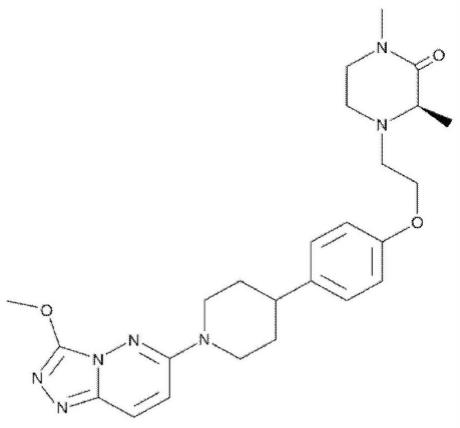
在组织特异性启动子、肿瘤特异性启动子和/或yb-1依赖性启动子的控制下。
357.实施方案28:实施方案27的用途的nutlin或nutlin衍生物,其中所述yb-1依赖性启动子是腺病毒e2晚期启动子。
358.实施方案29:实施方案1至28中任一项的用途的nutlin或nutlin衍生物,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb磷酸化的化合物。
359.实施方案30:实施方案1至29中任一项的用途的nutlin或nutlin衍生物,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb表达的化合物。
360.实施方案31:实施方案1至30中任一项的用途的nutlin或nutlin衍生物,其中所述cdk4/6抑制剂选自包含以下各项的组;帕博西尼(palbociclib),其也被称为pd 0332991;阿贝西利,其也被称为ly-2835219;瑞博西尼(ribociclib),其也被称为lee011;trilaciclib,其也被称为g1t28;和dinaciclib。
361.实施方案32:实施方案1至31中任一项的用途的nutlin或nutlin衍生物,其中所述cdk4/6抑制剂引起细胞中的g1阻滞并抑制e2f1。
362.实施方案33:实施方案1至32中任一项的用途的nutlin或nutlin衍生物,其中所述方法还包括向受试者施用parp抑制剂。
363.实施方案34:实施方案33的用途的nutlin或nutlin衍生物,其中所述parp抑制剂选自包含奥拉帕尼(olaparib)、维利帕尼(veliparib)、鲁卡帕尼(rucaparib)、他拉唑帕尼(talazoparib)和bmn673的组。
364.实施方案35:实施方案1至32中任一项的用途的nutlin或nutlin衍生物,其中所述方法还包括向受试者施用布罗莫结构域抑制剂。
365.实施方案36:实施方案35的用途的nutlin或nutlin衍生物,其中所述布罗莫结构域抑制剂选自包含jq-1、otx-015、i-bet151、cpi-0610、i-bet762、cpi203、pfi-1和ms 436的组。
366.实施方案37:实施方案1至36中任一项的用途的nutlin或nutlin衍生物,其中所述腺病毒、所述cdk4/6抑制剂、所述parp抑制剂、所述布罗莫结构域抑制剂和或nutlin或nutlin衍生物单独或以任何组合形式施用于受试者。
367.实施方案38:权利要求1和37中任一项的用途的nutlin或nutlin衍生物,其中所述nutlin衍生物选自包含nvp-hdm201、idasanutlin、am-8553、sar405838、nutlin-3a和amg232的组。
368.实施方案39:权利要求1至37中任一项的用途的nutlin或nutlin衍生物,其中所述nutlin衍生物不同于nutlin-3a。
369.实施方案40:实施方案1至39中任一项的用途的nutlin或nutlin衍生物,其中肿瘤的细胞具有cdk4/6信号传导途径的破坏。
370.实施方案41:实施方案1至40中任一项的用途的nutlin或nutlin衍生物,其中所述肿瘤的细胞具有细胞周期的不受控制的g1-s转变。
371.实施方案42:实施方案1至40中任一项的用途的nutlin或nutlin衍生物,其中所述肿瘤的细胞在选自包含rb1基因、cdkn2a基因和cdkn2b基因的组中的基因中具有功能丧失的突变或缺失。
372.实施方案43:实施方案1至40中任一项的用途的nutlin或nutlin衍生物,其中所述
肿瘤的细胞具有基因的扩增和/或基因中的活化突变。
373.实施方案44:实施方案43的用途的nutlin或nutlin衍生物,其中所述基因选自包含ccnd1、e2f1、e2f2、e2f3、cdk4和cdk6的组。
374.实施方案45:实施方案43的用途的nutlin或nutlin衍生物,其中所述基因是编码有丝分裂信号传导途径的组分的一个基因。
375.实施方案46:实施方案45的用途的nutlin或nutlin衍生物,其中所述有丝分裂信号传导途径选自包含pi3k途径和mapk途径的组。
376.实施方案47:实施方案1至46中任一项的用途的nutlin或nutlin衍生物,其中所述肿瘤细胞的细胞对一种或若干种药物活性剂和/或辐射具有抗性或对其不敏感。
377.实施方案48:实施方案47的用途的nutlin或nutlin衍生物,其中所述药物活性剂是细胞抑制剂。
378.实施方案49:权利要求48的用途的nutlin或nutlin衍生物,其中所述抗性由abc转运蛋白介导。
379.实施方案50:权利要求49的用途的nutlin或nutlin衍生物,其中所述abc转运蛋白选自包含mrp和mdr,特别是mdr-1的组。
380.实施方案51:实施方案47至50中任一项的用途的nutlin或nutlin衍生物,其中所述抗性是多重抗性或多抗性,特别是针对细胞抑制剂和/或辐射的多重或多抗性。
381.实施方案52:实施方案1至51中任一项的用途的nutlin或nutlin衍生物,其中所述肿瘤的细胞是rb阴性的。
382.实施方案53:实施方案1至52中任一项的用途的nutlin或nutlin衍生物,其中所述肿瘤的细胞是rb阳性的。
383.实施方案54:实施方案1至53中任一项的用途的nutlin或nutlin衍生物,其中所述肿瘤的细胞在细胞核中具有yb-1。
384.实施方案55:实施方案1至54中任一项的用途的nutlin或nutlin衍生物,其中所述肿瘤的细胞在诱导后在细胞核中具有yb-1。
385.实施方案56:实施方案55的用途的nutlin或nutlin衍生物,其中yb-1向细胞核内的运输通过选自包含辐射、施用细胞抑制剂和过热的组中的至少一种措施触发。
386.实施方案57:实施方案56的用途的布罗莫结构域抑制剂,其中所述措施应用于细胞、器官或生物体,优选需要其的生物体,更优选患有肿瘤的生物体。
387.在第八方面,通过联合疗法解决了本发明的问题,这也是第七方面的第一实施方案,其中该联合疗法包括向有需要的受试者施用以下各项(除其他外),
388.a)腺病毒,特别是根据第三方面如本文定义的一种,包括其任何实施方案;cdk4/6抑制剂,特别是根据第四方面如本文定义的一种,包括其任何实施方案,和parp抑制剂,特别是根据第四方面如本文定义的一种;
389.b)腺病毒,特别是根据第三方面如本文定义的一种,包括其任何实施方案;cdk4/6抑制剂,特别是根据第四方面如本文定义的一种,包括其任何实施方案,和布罗莫结构域抑制剂,特别是根据第五方面如本文定义的一种;
390.c)腺病毒,特别是根据第三方面如本文定义的一种,包括其任何实施方案;cdk4/6抑制剂,特别是根据第四方面如本文定义的一种,包括其任何实施方案,和nutlin或nutlin
衍生物,特别是根据第六方面如本文定义的一种;
391.d)腺病毒,特别是根据第三方面如本文定义的一种,包括其任何实施方案;cdk4/6抑制剂,特别是根据第四方面如本文定义的一种,包括其任何实施方案,布罗莫结构域抑制剂,布罗莫结构域抑制剂,特别是根据第五方面如本文定义的一种;和nutlin或nutlin衍生物,特别是根据第六方面如本文定义的一种;
392.e)腺病毒,特别是根据第三方面如本文定义的一种,包括其任何实施方案;cdk4/6抑制剂,特别是根据第四方面如本文定义的一种,包括其任何实施方案,布罗莫结构域抑制剂,布罗莫结构域抑制剂,特别是根据第五方面如本文定义的一种;和parp抑制剂,特别是根据第五方面如本文定义的一种;和
393.f)腺病毒,特别是根据第三方面如本文定义的一种,包括其任何实施方案;cdk4/6抑制剂,特别是根据第四方面如本文定义的一种,包括其任何实施方案,布罗莫结构域抑制剂,布罗莫结构域抑制剂,特别是根据第五方面如本文定义的一种;parp抑制剂,特别是根据第五方面如本文定义的一种;和nutlin或nutlin衍生物,特别是根据第六方面如本文定义的一种。
394.在本发明中,结合第三方面(包括其任何实施方案)、第四方面(包括其任何实施方案)、第五方面(包括其任何实施方案)和第六方面(包括其任何实施方案)描述的各种实施方案可以是根据第八方面各种形式的的组合疗法的实施方案,特别是如上定义的a)、b)、c)、d)、e)和f)。
395.通过用于治疗和/或预防受试者的疾病,更优选肿瘤或癌症的方法,其中该方法包括向受试者施用腺病毒和cdk4/6抑制剂,在第九方面中也解决了本发明的问题,其也是该第七方面的第一实施方案。
396.在下文中,公开了该第九方面的其他实施方案。
397.实施方案2:实施方案1的方法,其中所述腺病毒是溶瘤腺病毒。
398.实施方案3:实施方案1和2中任一项的方法,其中所述腺病毒以yb-1依赖性方式复制。
399.实施方案4:实施方案3的方法,其中所述腺病毒在细胞核中缺乏yb-1的细胞中是复制缺陷的,但是在细胞核中具有yb-1的细胞中复制。
400.实施方案5:实施方案2至4中任一项的方法,其中所述腺病毒编码癌基因蛋白,其中所述癌基因蛋白使至少一个腺病毒基因反式激活,其中所述腺病毒基因选自由e1b55kda、e4orf6、e4orf3和e3adp组成的组。
401.实施方案6:实施方案5的方法,其中所述癌基因蛋白是e1a蛋白。
402.实施方案7:实施方案6的方法,其中所述e1a蛋白能够结合功能性rb肿瘤抑制基因产物。
403.实施方案8:实施方案6的方法,其中所述e1a蛋白不能结合功能性rb肿瘤抑制基因产物。
404.实施方案9:实施方案6至8中任一项的方法,其中e1a蛋白不诱导yb-1定位到细胞核中。
405.实施方案10:实施方案5至9中任一项的方法,其中与野生型癌基因蛋白e1a相比,所述癌基因蛋白表现出一个或几个突变或缺失。
406.实施方案11:实施方案10的方法,其中所述缺失是选自包含cr3片段(stretches)的缺失、n末端的缺失和c末端的缺失的组中的一种。
407.实施方案12:实施方案6至11中任一项的方法,其中所述e1a蛋白能够结合rb。
408.实施方案13:实施方案6至12中任一项的方法,其中与野生型癌基因蛋白相比,所述e1a蛋白包含一个或若干个突变或缺失,其中所述缺失优选为cr1区域和/或cr2区域中的缺失。
409.实施方案14:实施方案13的方法,其中所述e1a蛋白不能结合rb。
410.实施方案15:实施方案1至14中任一项的方法,其中所述病毒是表达e1a1.2s蛋白的腺病毒。
411.实施方案16:实施方案1至15中任一项的方法,其中所述病毒是缺乏e1a13s蛋白表达的腺病毒。
412.实施方案17:实施方案1至16中任一项的方法,其中所述病毒是缺乏功能活性腺病毒e3区域的腺病毒。
413.实施方案18:实施方案1至17中任一项的方法,其中所述病毒是缺乏e1b 19kda蛋白表达的腺病毒。
414.实施方案19:实施方案1至18中任一项的方法,其中所述病毒是在尾丝上表达rgd基序的腺病毒。
415.实施方案20:实施方案1至19中任一项的方法,其中所述病毒是腺病毒血清型5。
416.实施方案21:实施方案1至20中任一项的方法,其中所述腺病毒选自包含以下各项的组:xvir-n-31、dl520、adδ24、adδ24-rgd、dl922-947、e1ad/01/07、dl1119/1131、cb 016、vcn-01、e1adl1107、e1adl1101、orca-010、enadenotucirev和缺乏表达的病毒癌基因的病毒,所述表达的病毒癌基因能够结合功能性rb肿瘤抑制基因产物。
417.实施方案22:实施方案21的方法,其中所述腺病毒是xvir-n-31。
418.实施方案23:实施方案21的方法,其中所述腺病毒是dl520,其中所述腺病毒e3区域是功能失活的。
419.实施方案24:实施方案21至23中任一项的方法,其中所述腺病毒是dl520,其中dl520缺乏e1b 19kda蛋白的表达。
420.实施方案25:实施方案21至24中任一项的方法,其中所述腺病毒是在尾丝上表达rgd基序的dl520。
421.实施方案26:实施方案1至25中任一项的方法,其中所述病毒编码yb-1。
422.实施方案27:实施方案26的方法,其中编码yb-1的基因在组织特异性启动子、肿瘤特异性启动子和/或yb-1依赖性启动子的控制下。
423.实施方案28:实施方案27的方法,其中所述yb-1依赖性启动子是腺病毒e2晚期启动子。
424.实施方案29:实施方案1至28中任一项的方法,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb磷酸化的化合物。
425.实施方案30:实施方案1至29中任一项的方法,其中所述cdk4/6抑制剂是降低细胞,优选肿瘤细胞中rb表达的化合物。
426.实施方案31:实施方案1至30中任一项的方法,其中所述cdk4/6抑制剂选自包含以
下各项的组;帕博西尼(palbociclib),其也被称为pd0332991;阿贝西利,其也被称为ly-2835219;瑞博西尼(ribociclib),其也被称为lee011;trilaciclib,其也被称为g1t28;和dinaciclib。
427.实施方案32:实施方案1至31中任一项的方法,其中所述cdk4/6抑制剂引起细胞中的g1阻滞并抑制e2f1。
428.实施方案33:实施方案1至32中任一项的方法,其中所述方法还包括向受试者施用parp抑制剂。
429.实施方案34:实施方案33的方法,其中所述parp抑制剂选自包含奥拉帕尼(olaparib)、维利帕尼(veliparib)、鲁卡帕尼(rucaparib)和bmn673的组。
430.实施方案35:实施方案1至32中任一项的方法,其中所述组合物还包括向受试者施用布罗莫结构域抑制剂。
431.实施方案36:实施方案35的方法,其中所述布罗莫结构域抑制剂选自包含jq-1、otx-015、i-bet1 51、cpi-0610、i-bet762、cpi203、pfi-1和ms 436的组。
432.实施方案37:实施方案1至36中任一项的方法,其中所述腺病毒、所述cdk4/6抑制剂、所述parp抑制剂和/或所述布罗莫结构域抑制剂单独或以任何组合形式施用于受试者。
433.实施方案38:实施方案1至37中任一项的方法,其中肿瘤的细胞具有cdk4/6信号传导途径的破坏。
434.实施方案39:实施方案1至38中任一项的方法,其中所述肿瘤的细胞具有细胞周期的不受控制的g1-s转变。
435.实施方案40:实施方案1至38中任一项的方法,其中所述肿瘤的细胞在选自包含rb1基因、cdkn2a基因和cdkn2b基因的组中的基因中具有功能丧失的突变或缺失。
436.实施方案41:实施方案1至38中任一项的方法,其中所述肿瘤的细胞具有基因的扩增和/或基因中的活化突变。
437.实施方案42:实施方案41的方法,其中所述基因选自包含ccnd1、e2f1、e2f2、e2f3、cdk4和cdk6的组。
438.实施方案43:实施方案41的方法,其中所述基因是编码有丝分裂信号传导途径的组分的一个基因。
439.实施方案44:实施方案43的方法,其中所述有丝分裂信号传导途径选自包含p13k途径和mapk途径的组。
440.实施方案45:实施方案1至44中任一项的方法,其中所述肿瘤细胞的细胞对一种或若干种药物活性剂和/或辐射具有抗性或对其不敏感。
441.实施方案46:实施方案45的方法,其中所述药物活性剂是细胞抑制剂。
442.实施方案47:权利要求46的方法,其中所述抗性由abc转运蛋白介导。
443.实施方案48:权利要求47的方法,其中所述abc转运蛋白选自包含mrp和mdr,特别是mdr-1的组。
444.实施方案49:实施方案45至48中任一项的方法,其中所述抗性是多重抗性或多抗性,特别是针对细胞抑制剂和/或辐射的多重或多抗性。
445.实施方案50:实施方案1至49中任一项的方法,其中所述肿瘤的细胞是rb阳性的。
446.实施方案51:实施方案1至50中任一项的方法,其中所述肿瘤的细胞在细胞核中具
有yb-1。
447.实施方案52:实施方案1至51中任一项的方法,其中所述肿瘤的细胞在诱导后在细胞核中具有yb-1。
448.实施方案53:实施方案52的方法,其中yb-1向细胞核内的运输通过选自包含辐射、施用细胞抑制剂和过热的组中的至少一种措施触发。
449.实施方案54:实施方案53的方法,其中所述措施应用于细胞、器官或生物体,优选需要其的生物体,更优选患有肿瘤的生物体。
450.实施方案55:权利要求1至54中任一项的方法,其中所述肿瘤选自包含以下各项的组:膀胱癌、乳腺癌、转移性乳腺癌(mbc)、黑色素瘤、神经胶质瘤、胰腺癌、肝细胞癌、肺腺癌、肉瘤、卵巢癌、肾癌、前列腺癌和白血病。
451.在第十方面,本发明还涉及组合物在制备药物中的用途,其中所述组合物是结合本发明的第一方面包括其任何实施方案公开的组合物,并且该药物用于治疗和/或预防结合本发明的第二方面包括其任何实施方案指定的疾病。
452.在第十一方面,本发明还涉及腺病毒在制备药物中的用途,其中所述腺病毒是结合本发明第三方面包括其任何实施方案公开的腺病毒,并且该药物用于治疗和/或预防结合本发明的第三方面包括其任何实施方案指定的疾病。
453.在第十二方面,本发明还涉及cdk4/6抑制剂在制备药物中的用途,其中所述cdk4/6抑制剂是结合本发明第四方面包括其任何实施方案所公开的cdk4/6抑制剂,并且该药物用于治疗和/或预防结合本发明的第四方面包括其任何实施方案指定的疾病。
454.在第十三方面,本发明还涉及parp抑制剂在制备药物中的用途,其中所述parp抑制剂是结合本发明第五方面包括其任何实施方案公开的parp抑制剂,并且该药物用于治疗和/或预防结合本发明的第五方面包括其任何实施方案指定的疾病。
455.在第十四方面,本发明还涉及布罗莫结构域抑制剂在制备药物中的用途,其中所述布罗莫结构域抑制剂是结合本发明第六方面包括其任何实施方案公开的布罗莫结构域抑制剂,并且该药物用于治疗和/或预防结合本发明的第六方面包括其任何实施方案指定的疾病。
456.在第十五方面,本发明还涉及nutlin或其衍生物在制备药物中的用途,其中所述nutlin或nutlin衍生物是结合本发明的第七方面包括其任何实施方案公开的nutlin或nutlin衍生物,并且该药物用于治疗和/或预防结合本发明的第七方面包括其任何实施方案指定的疾病。
457.在本文公开的每个和任何方面包括其任何实施方案的实施方案中,cdk4/6抑制剂是抑制或能够抑制cdk4/6从而导致相应处理的细胞阻滞在g1期的药剂。
458.在本发明的每个和任何方面包括其任何实施方案的实施方案中,布罗莫结构域抑制剂是二价布罗莫结构域抑制剂,更优选布罗莫结构域抑制剂是下式的azd5153:
[0459][0460]
在本发明的每个和任何方面包括其任何实施方案的实施方案中,布罗莫结构域抑制剂是bet降解剂,优选布罗莫结构域抑制剂选自包含下式的dbet6和下式的arv771的组:
[0461]
bet降解剂的一般结构
[0462][0463]
(参见,例如scheepstra m等人(computational and structural biotechnology journal 17(2019)160-179)。
[0464]
本领域技术人员将认识到,本发明一个方面的每个和任意实施方案也是本发明每个和任意其它方面的实施方案,包括其任何实施方案。
[0465]
不希望被任何理论所束缚,本发明人惊奇地发现,将溶瘤病毒,优选溶瘤腺病毒与cdk4/6抑制剂组合,提高了基于这种溶瘤腺病毒的肿瘤治疗的功效。更具体地,假定cdk4/6抑制剂抑制e2f1(本文也称为e2f-1),从而降低其有效浓度,优选降低其在肿瘤细胞中的浓度,并使细胞的g1阻滞同步。因此,更多受感染的细胞可以完成整个病毒生命周期。
[0466]
基于本文提供的证据和见解,本领域技术人员将理解,任何突变腺病毒均适用于本发明的实践,其允许通过这种腺病毒可实现至少低至10%、20%或30%的野生型表达以及和e1b55k和e4orf6的活性。本领域技术人员将理解,可以通过修饰e1a来产生这种突变腺病毒。示例性的突变腺病毒是腺病毒xvir-n-31、dl520、adδ24、adδ24-rgd、dl922-947、e1ad/01/07、dl1119/1131、cb 016、vcn-01、e1adl1107、e1adl1101、orca-010、
enadenotucirev和缺乏表达的病毒癌基因的病毒,其能够结合功能性rb肿瘤抑制基因产物。
[0467]
腺病毒的得名由于wallace p.rowe和robert j.huebner于1953年在人的扁桃体和腺样体组织中首次分离出该病毒(rowe等人,1953年)。腺病毒科包括五个属,即哺乳动物腺病毒属(mastadenoviruses)、禽腺病毒(aviadenoviruses)、唾液酸酶同源性腺病毒属(siadenoviruses)、腺嘌呤-胸腺嘧啶富集性腺病毒属(atadenoviruses)和鱼腺病毒属(ichtadenoviruses)(modrow,2013)。由于它们在新生啮齿动物中的致癌性,可以将它们分为7个亚型hadv-a至hadv-g(boulanger和blair,1991),共有62种血清型。因此,溶瘤病毒疗法的研究主要集中在哺乳动物腺病毒c型血清型5。
[0468]
大小为80至110nm的未包被二十面体衣壳包括252个壳粒,这些壳粒由衣壳顶点上的12个五邻体(penton)(其由五邻体为基础和刺突状(spike-like)蛋白结构(称为尾丝)组装)和249个称为六邻体(hexon)的面组成(modrow,2013)。腺病毒的整个生命周期可以细分为具有细胞进入的早期、病毒基因组的核转运、早期基因的转录和翻译以及具有晚期基因的转录和翻译的晚期。因此,晚期蛋白质主要负责结构蛋白质的组装和病毒体的成熟(russell,2000)。在受纳细胞中,早期阶段大约需要6-8小时,随后的晚期大约需要4-6小时。至少对于腺病毒hadv-a、-c、-e和-f,通过存在于尾丝结构的每个末端上的球形结构(knob structure)与靶细胞上的受体的相互作用而发生附着。由于检测到该受体与引起柯萨奇b病毒吸附的受体相同,因此将该受体称为柯萨奇病毒和腺病毒受体(car)(bergelson,1997)。此外,靶细胞表面上的结合由“桥分子”支撑,“桥分子”是体液中的可溶性蛋白,例如凝血因子vii和x,其介导某些腺病毒类型的尾丝蛋白的结合(modrow,2013)。
[0469]
在该吸附步骤之后,五邻体基础(penton base)中的rgd-基序(精氨酸-甘氨酸-天冬氨酸)与异二聚体整联蛋白dvβ3或αvβ5相互作用,后者在此过程中起共受体的作用。这种相互作用导致病毒的内化(wickham等人,1993)。随后,通过网格蛋白介导的内化作用在细胞质膜中发生内吞作用,然后病毒出现于内体中。内吞囊泡酸化后,病毒尾丝蛋白会改变其构象,从而破坏内体膜(greber等人,1996)。病毒颗粒现在在细胞质中游离。通过将残留颗粒结合在微管的动力蛋白上,病毒基因组被转移到细胞核中(modrow,2013)。
[0470]
腺病毒的基因组由长度为36-38kb的双链线性dna组成。通过两个与5
′
端共价连接的末端蛋白质(tp)分子的相互作用,形成了准圆形状态(modrow,2013)。通常,腺病毒基因组的五个编码区可细分为早期基因e1-e4(主要在感染的早期阶段有活性)和晚期基因(l1-l5),后者编码主要是病毒颗粒形成所必需的蛋白质(modrow,2013)。
[0471]
腺病毒复制尤其取决于早期病毒基因e2的表达,该基因被大e1a蛋白(e1a13s)强烈诱导。感染后被转录的第一个病毒基因是早期1a区(e1a)。通过差异剪接处理主要的e1a转录物,以产生5个不同的信息,其沉降系数分别为13s、12s、11s、10s和9s。13s和12s mrna在感染期间的早期最为丰富,而9s mrna则在晚期最丰富。11s和10s mrna是少数种类,在感染后的后期变得更加丰富。13s、12s、11s、10s和9s e1amrna分别编码289个残基(r)、243r、217r、171r和55r蛋白,所有这些蛋白都可以在体内检测到,只有9s产物才在体外检测到。通常,腺病毒基因表达在感染过程中受到高度调节,具有高度的复杂性。因此,e2基因的转录在两个启动子e2-早期和e2-晚期启动子的控制下,其产物编码病毒dna聚合酶和有效病毒复制所必需的其他蛋白质。
[0472]
由于其两个重叠的转录控制区,e2-早期启动子可以细分为从 1位开始的主要启动子和从-26位开始的次要启动子,两者都含有tata基序(swaminathan和thimmapaya,1996)。这些基序充当tata盒结合蛋白(tbp)的结合位点。此外,-68位和-77位之间的一个活化转录因子(atf)的结合位点和彼此反向排列的两个e2f1/dp-1结合位点(tttcgcgc)位于主要e2早期启动子的-35位和-63位(swaminathan和thimmapaya,1996)。e2早期启动子通过e1a的激活主要取决于位于主要启动子部分的两个e2f-1结合位点。
[0473]
在感染的中间阶段,大约6hpi(感染后小时数)后,e2基因的表达受e2-晚期启动子控制。在其157bp序列的nt-33至-22位,有一个tata盒,可以被细胞tbp结合并激活(swaminathan和thimmapaya,1996)。此外,两个sp1识别位点和三个ccaat盒是e2-晚期启动子的特征。
[0474]
由于显示出细胞因子yb-1能够结合倒置的ccaat盒,因此研究了y盒结合蛋白1(yb-1)和e2-晚期启动子之间的相互作用。holm等人在2002年表明yb-1与e2-晚期启动子中存在的y-盒(倒置的ccaat-盒)存在特定的相互作用,并具有控制该启动子活性的能力(holm等人,2002)。为了发挥其反式激活活性,yb-1必须通过腺病毒复合体e1b-55k/e4-orf6转移到细胞核中。这些早期病毒基因在e1a-13s反式激活后表达(frisch和mymryk,2002)。
[0475]
由ybx1基因编码的细胞因子yb-1是一种带有dna结合蛋白的冷休克结构域,在转录、剪接、翻译控制和dna损伤修复中具有多种功能(kohno等人,2003)。此外,由于它激活了参与癌细胞多药耐药表型的发展的mdr1和mrp1基因,因此它在耐药性中起着重要的作用(mantwill等人,2006)。通过暴露于外部应激因素(如腺病毒感染、化学疗法或紫外线辐射),随后的核转运可诱导yb-1表达(mantwill等人,2006)。
[0476]
腺病毒早期基因和晚期基因的转录激活对于病毒生命周期至关重要。简而言之,病毒生命周期是由e1a转录的激活开始的,随后是e2、e3和e4基因的激活的级联。最后,激活主要晚期启动子(mlp)以协调衣壳和主要参与基因组壳体化的辅助蛋白的表达(turner等人,2015)。为了克服对非增殖细胞中存在的病毒dna复制的阻碍,该病毒表达了早期1a蛋白(e1a)。这些立即早期蛋白将细胞驱动到s期,并诱导所有其他病毒早期基因的表达。在感染过程中,表达了几种e1a同种型,其中存在5型人类腺病毒的289、243、217、171和55个残基的蛋白。在感染的情况下,病毒基因表达的主要驱动因子是大的e1a 289r蛋白(radko等人,2015年)。
[0477]
感染后,即使在最终分化的上皮细胞(人类腺病毒的主要靶标)中,腺病毒e1a蛋白的表达也能促进细胞周期从g0/g1期进入s期,并促进病毒复制。该过程被认为是腺病毒生命周期必不可少的。
[0478]
腺病毒已被设计为在保留正常细胞的同时感染、复制和杀死癌细胞。在肿瘤细胞中感染和复制后,溶瘤病毒杀死细胞,释放病毒体以用于随后的扩增循环。为了实现仅向肿瘤细胞中的复制,已经进行了两种遗传修饰,导致设计了溶瘤腺病毒的三个亚类(在本文中也称为crad),所有这些亚类都可以用于实施本发明。此外,wo2003/099859中特别描述了适用于实施本发明的溶瘤腺病毒。
[0479]
i型crad的特征在于基因组的e1区域中的突变或缺失,干扰了细胞周期调节剂如p53和视网膜母细胞瘤蛋白(rb)的失活。结果,i型crad在活跃分裂的肿瘤细胞中复制。例
如,onyx-015(也称为dl1520)无法表达e1b-55kda蛋白,无法使p53失活并避免p53诱导的细胞周期阻滞。几项研究将onyx-015选择性的分子基础归因于p53或p53通路相关基因之一的表达缺失。但是,o
′
shea等人表明,晚期病毒rna输出而不是p53失活决定了onyx-015病毒的选择性。在e1a区域中具有缺失的其他i型crad无法结合rb并触发s期进入。例如,dl922-947和δ24在e1a区域的cr2结构域中含有24个核苷酸缺失,从而废除了e1a-rb相互作用。结果,这些病毒主要在肿瘤细胞中复制,其中游离的、未结合的e2f1是可得的。
[0480]
将腺病毒复制限制到肿瘤细胞的另一种方法是调节病毒复制所需的病毒基因的转录。在ii型crad中,基因组处于肿瘤特异性启动子的控制之下。这些启动子来自己知在某些肿瘤中与正常组织相比优先表达的基因(例如端粒酶或环加氧酶ii);或与正常组织相比在肿瘤中过度表达(例如,前列腺特异性抗原,psa或甲胎蛋白,afp)的基因。在iii型crad中,例如xvir-n-31(ad-delo3-rgd)的特征是e1a13s蛋白中反式激活结构域cr3的缺失。xvir-n-31是正常细胞中的复制缺陷型腺病毒。xvir-n-31通过细胞核中存在的细胞多功能蛋白yb-1来恢复其复制能力。因此,crad仅能在肿瘤细胞中复制并最终使其裂解。p53突变、ras或rb突变均不能有效弥补xvir-n-31的复制缺陷。xvir-n-31缺乏e1a13s,因此未表达e1855k蛋白和e4orf6蛋白。在肿瘤细胞核中存在yb-1可以弥补这种缺陷,这可以独立于e1a13s而触发e1b55k和e4orf6的表达。一旦由细胞核中存在的yb-1诱导,e1b55k和e4orf6会进一步将细胞yb-1转移到细胞核中,从而促进病毒复制。
[0481]
细胞周期依次经历间隙1期(g1)、合成期(s)、间隙2期(g2)和有丝分裂(m)期。该进程通过复杂的信号传导网络进行调节。当与特定的细胞周期蛋白复合时,cdk(细胞周期蛋白依赖性激酶)蛋白cdk1、cdk2、cdk4和cdk6是细胞周期进程的主要调节剂。cdk的组成型表达和各种细胞周期蛋白的时序控制,可以通过不同的细胞周期蛋白-cdk复合物调节特定的细胞周期阶段。cdk活性受到几种抑制蛋白的负调控。cdk生物学和功能的各个方面以前已经进行了全面的评论。
[0482]
具有结构和功能同源性的cdk4和cdk6与细胞周期蛋白d蛋白复合时,可调节g1期的静止细胞向s期的转变。细胞周期蛋白d蛋白具有三种亚型,即细胞周期蛋白d1-3,并在有丝分裂刺激下积累。cdk4/6的负调节剂包括cdk4(ink4)蛋白抑制剂p16ink4a、p15ink4b、p18ink4c和p19ink4d,它们可通过减少它们与细胞周期蛋白d1的结合或直接占据其催化结构域来抑制cdk4/6的活性。
[0483]
cdk4/6的激酶活性导致成视网膜细胞瘤(rb)蛋白家族成员(包括rb、p107和p130)的磷酸化,导致其功能失活。在静止的细胞中,活性低磷酸化的rb与e2f1转录因子家族的成员结合并抑制e2f1功能(rubin等,2005),所述成员与dp-1/2以及其他共抑制因子一起形成复合物。磷酸化后,rb从该复合物中解离,并允许e2f1靶基因,包括细胞周期蛋白a、细胞周期蛋白e和dhfr等的转录,其是细胞周期过渡到s期所必需的。因此,cdk4/6活性的抑制导致rb脱磷酸化和e2f1活性的抑制,从而促进g0/g1阻滞。这推动了cdk4/6抑制剂作为癌细胞靶向治疗的发展。
[0484]
cdk4/6-rb信号传导途径的破坏和细胞周期的不受控制的g1-s过渡是癌细胞的共同特征。发生这种情况的原因可能是各种分子变化,包括功能突变的缺失或rb1基因(编码rb)、cdkn2a(编码p16ink4a和p14arf)或cdkn2b(编码p15ink4b)的缺失。这种失调也可能是由于ccnd1(编码细胞周期蛋白d1)、e2f1-3、cdk4、cdk6或各种促有丝分裂信号传导途径(例
如pi3k或mapk途径)成分中的扩增或激活突变引起的。
[0485]
已经开发了几种atp竞争性小分子cdk抑制剂。但是,第一代抑制剂如flavopiridol是非选择性的,可以抑制多种cdk,这可能会导致有限的功效和高毒性。下一代cdk4/6抑制剂显示出高选择性,包括帕博西尼(palbociclib)(来自pfizer的pd-0332991)、阿贝西利(来自eli lilly的ly-2835219)和瑞博西尼(ribociclib)(来自novartis的lee011)和trilaciclib(g1t28)。这些cdk4/6抑制剂已在多种癌症实体的体外和体内模型中进行过临床前测试,包括白血病、乳腺癌、黑色素瘤、神经胶质瘤、胰腺癌、肝细胞癌、肺腺癌、肉瘤、卵巢癌、肾癌、前列腺癌和转移性乳腺癌(mbc)。在大多数研究中,它们已经表现出一致的分子和功能表型,具有rb磷酸化、蛋白质表达和e2f1靶基因的转录的剂量依赖性降低,这与g0/g1阻滞和细胞增殖抑制相关。此外,所有这些报告表明rb表达是对这些抑制剂敏感的先决条件。
[0486]
cdk4/6抑制剂(例如pd-0332991)导致总rb蛋白的剂量依赖性降低,这与磷酸化rb的降低有关。总rb的降低与rb1转录水平的降低以及e2f1靶基因ccna2和ccne2转录的降低部分相关。同样,e2f1表达水平明显下调。
[0487]
在图25中公开了适用于实施本发明的cdk4/6抑制剂。
[0488]
从实施例部分显而易见,任何cdk4/6抑制剂均适合与病毒(优选腺病毒,更优选溶瘤性腺病毒)联合使用,从而cdk4/6抑制剂可引起g1细胞阻滞并抑制e2f1,更具体地抑制e2f1活性。
[0489]
本领域技术人员将认识到,任何cdk4/6抑制剂以治疗有效浓度使用。
[0490]
parp1是一种对修复单链断裂(dna中的“缺口”)重要的蛋白质。在哺乳动物中,已发现17个parp家族成员,其中只有6个合成聚adp-核糖(padpr)。parp1、parp2和parp3在dna修复中起作用。parp1结合遭受单链断裂(ssb)和双链断裂(dsb)的dna。然后,parp1经历构象变化,该构象变化使活性位点中的关键氨基酸残基对齐,从而增加了其活性。一旦parp1被激活,它就会合成padpr,padpr与蛋白质结合并改变它们的功能。padpr糖原水解酶迅速降解padpr,以确保存在的padpr的水平反映dna损伤,并确保在dna修复后终止对padpr的反应。
[0491]
通过抑制dna修复途径,parp1抑制剂导致dna内单链断裂的增加。这种dna损伤未被修复,并且在复制后被带入子细胞,因为ber不再发生。这导致具有brca1和brca2突变的肿瘤中dsb的增加(scott等人,2015,j clin oncol.,33(12):1397-140)。包括parp候选药物鲁卡帕尼(rucaparib)、维利帕尼(veliparib)和奥拉帕尼(olaparib)的parp抑制剂的化学结构如图26所示,并在antolin和mestres 2014,oncotarget,30;5(10):3023-8中进行了描述,包括表征所有parp抑制剂结构的苯甲酰胺部分。
[0492]
此外,已经确定yb-1增强parp活性并降低parp1抑制剂的功效(alemasova等人,2018,oncotarget,34,23349-65),这表明yb-1依赖性溶瘤性腺病毒与cdk4/6抑制剂和parp抑制剂联合使用可协同作用杀死癌细胞。奥拉帕尼(olaparib)和bmn673(pfizer开发的talazolarib,usa,clin cancer res.2013,15;19(18):5003-15)是parp抑制剂的实例。
[0493]
本领域技术人员将理解,任何parp抑制剂以治疗有效浓度使用。
[0494]
在图25中公开了适用于实施本发明的cdk4/6抑制剂。
[0495]
表观遗传学景观(epigenetic landscape)中的异常是癌症的标志,赖氨酸残基的
乙酰化是与细胞信号传导和疾病生物学广泛相关的翻译后修饰。“写入”(组蛋白乙酰转移酶,hat)和“擦除”(组蛋白脱乙酰基酶,hdac)乙酰化位点的酶是当前药物开发中广泛研究的领域。通过乙酰化赖氨酸残基向大分子复合物的蛋白质募集由布罗莫结构域(brd)介导,该结构域是进化上高度保守的蛋白质相互作用模块,可识别ε-n-赖氨酸乙酰化基序。保守的brd折叠包含一个深的、主要是疏水性的乙酰赖氨酸结合位点,其代表了一个开发小的药理活性分子的吸引人的口袋。含有brd的蛋白质与多种疾病的发展有关。
[0496]
最近,靶向bet(布罗莫结构域和超末端(extra-terminal))家族brd的两种高效的选择性抑制剂提供了令人信服的数据,支持将这些brd靶向癌症。由brd2、brd3、brd4和brdt组成的布罗莫结构域蛋白的bet(布罗莫结构域和超末端结构域)亚家族,在rna聚合酶ii(polii)的调控转录中发挥多种作用,是令人兴奋的新型表观遗传药物靶标。这些蛋白质通过与乙酰化赖氨酸残基处的活化染色质结合而促进转录的起始和延伸阶段。这些所谓的表观遗传“阅读器”对活化染色质的识别促进了rna聚合酶ii复合物向活性转录位点的募集。brd4/p-tefb相互作用对于有丝分裂后的快速转录重新启动很重要(muller等人,2011,expert rev.mol.medicine,13,e19)。使用源自果蝇细胞的体外转录系统,将p-tefb鉴定并纯化为生成长失控转录物(run-off transcript)所需的因子。它是果蝇中的一种细胞周期蛋白依赖性激酶,含有催化亚基cdk9和调节性亚基细胞周期蛋白t。在人类中,有多种形式的p-tefb,其包含cdk9和几种细胞周期蛋白亚基(细胞周期蛋白t1、t2和k)之一。p-tefb与包括布罗莫结构域蛋白brd4在内的其他因子缔合,并发现与称作超延伸复合物的大型蛋白质复合物缔合(yang z等人,2005.mol cell;19:535-45;fu等人,1999,j biol chem.,274:34527-30)。
[0497]
jq-1((噻吩并-三唑并-1,4-二氮杂)thieno-triazolo-1-4-diazepine)是布罗莫结构域蛋白bet家族的有效抑制剂,该bet家族包括brd2、brd3、brd4(filippakopoulos等人,2010nature 468,1067-1073)。jq-1阻止了布罗莫结构域和乙酰基之间的相互作用,从而导致某些基因的下调。已经描述了其他bet布罗莫结构域抑制剂,包括otox15、bay1238097、gsk2820151、i-bet762和plx51107(perez-salvia和esteller 2017,epigenetics,12,323-339;brandt等人,2015acs chem.biol.,10,22-39)。jq-1在结构上与苯并二氮杂类有关。分子式为c23h25cln4o2s。
[0498]
最近,已经表明bet抑制剂jq-1促进腺病毒感染和腺病毒载体介导的基因递送。用jq-1处理细胞会诱导brd4与cdk9(转录延伸的p-tefb的一个亚基)的结合增加。但是,正如本文所述,需要进一步研究以阐明bed4用于调节腺病毒感染和转基因表达的机制(baojie lv等人,2018,scientific report,8,11554)。重要的是,还未研究病毒复制和病毒转录。然而,已知的是,cdk9通过增加转录聚合酶的数量并因此增加单位时间内的mrna合成量来刺激暂停的聚合酶释放并激活转录(gressel等人,2017,elife,6,e29736)。此外,已经表明cdk4/6抑制剂可以克服bet抑制剂抗性(jin等人,2018,mol cell;71(4):592-605)。最近证明了从细胞周期的晚期有丝分裂到早期的g1阶段,p-tefb-brd4相互作用显著增加以及p-tefb向染色体的主动募集,随后启动关键基因转录以促进g1进程。重要的是,brd4的耗尽通过减少必需的g1基因的转录而取消了整个过程,从而导致g1细胞周期阻滞和凋亡(yang等人,2008,mol cell biol.,28:967-976,kohoutek,2009,cell division,4.19)。
[0499]
但是,关于将yb-1依赖性溶瘤腺病毒与cdk 4/6抑制剂和bet抑制剂联用尚一无所知。
[0500]
应当理解并且在本发明内,其他布罗莫结构域抑制剂将同样适用于使用病毒(优选腺病毒,更优选溶瘤性腺病毒例如xvir-n-31)和cdk4/6抑制剂的三联疗法中。
[0501]
本领域技术人员将认识到,任何布罗莫结构域(bet)抑制剂以治疗有效浓度使用。
[0502]
在图27中公开了适用于实施本发明的布罗莫结构域抑制剂。
[0503]
mdm2对p53和e2f1的作用
[0504]
p53和成视网膜细胞瘤(rb)蛋白是两个关键的肿瘤抑制因子。在所有人类癌症肿瘤中都发现了一者或两者中的突变,并且两者都已作为药物开发计划中的潜在治疗靶点进行了广泛研究。由于p53和e2f1是细胞增殖和成活力(细胞死亡)的关键调节剂,因此它们的丰度和活性受到严格调节。小鼠双微体2蛋白(mouse double minute 2protein)(mdm2)也称为e3泛素蛋白连接酶,似乎调节mdm2-p53和rb-e2f1途径两者。由于rb和p53不能直接相互作用,因此建议mdm2是rb和p53之间的桥(polager和ginsberg,nat rev cancer 2009,9,738-48)。进一步支持mdm2作为癌基因的作用,几种人类肿瘤类型已显示具有增加的mdm2水平,包括软组织肉瘤和骨肉瘤以及乳腺肿瘤。mdm2癌蛋白泛素化和拮抗p53,但也可能执行p53非依赖性功能。mdm2直接与p53结合并抑制其转录活性。此外,作为p53选择性e3泛素连接酶,mdm2促进p53泛素化并将其靶向用于蛋白酶体降解(eischem等人,hum.mutant.20014,35,728-737)。然而,有证据表明mdm2也是p53缺陷型癌细胞存活所需要的(feeley等人,cancer res 2017,77,3823-3833)。
[0505]
与mdm2对e2f1途径的正向作用一致,mdm2可以与rb、e2f1和e2f1的异二聚体伴侣dpi发生物理相互作用,以促进g1/s细胞周期转变。因此,mdm2与e2f1或dp1的相互作用可以刺激参与细胞周期进程的e2f1靶基因的转录。此外,mdm2的结合可以拮抗e2f1对被f-box蛋白skp2降解的靶向性。因此,存在mdm2结合增加e2f1稳定性的证据(zhang等人oncogene 2005,24,7238-7247),而mdm2抑制与e2f1蛋白水平的降低有关。mdm2与许多其他癌蛋白一样,选择性地与低磷酸化的rb结合。mdm2和rb之间的相互作用抑制rb-e2f1复合物的形成,从而抑制rb功能。此外,rb和mdm2之间的相互作用导致mdm2介导的rb降解。目前的事实似乎证实mdm2也是(除了p53)是rb的关键负调节剂(shi和gu,genes cancer.2012,3240-248;yap等人,oncogene1999,18,7681-7689,wu等人,jbc 2009,284,26315-26321)。
[0506]
nutlin-3
[0507]
nutlins是顺式咪唑啉类似物,可抑制mdm2和肿瘤抑制因子p53之间的相互作用。nutlin-3是抗癌研究中最常用的化合物。nutlin小分子占据mdm2的p53结合口袋并有效破坏p53-mdm2相互作用,其导致p53野生型细胞中p53途径的激活。响应nutlin-3治疗,p53癌细胞经历细胞周期停滞(g0/g1或g2/s)或凋亡。此外,nutlin-3可以诱导分化和细胞衰老。结果表明,一系列因素影响nutlin-3治疗的结果,包括mdm2、mdm4、p73、atm和e2f1的单核苷酸多态性。p53的激活上调p21和mdm2,这两者都是rb的重要调节剂。最近显示,nultin-3对rb和e2f1蛋白水平和rb磷酸化都产生负面影响,这显著影响细胞对nutlin-3的反应(du等人,jbc 2009,284,26315-26321)。
[0508]
尽管先前的研究表明mdm2的致瘤性是由于其对p53的负调控,但p53非依赖性相互作用可能同样重要。在最近使用mdm2抑制剂的研究中,注意到e2f转录因子1(e2f1)在抑制
mdm2后被下调,而与癌症的p53状态无关。一份出版物描述了使用反义rna来抑制mdm2功能。他们得出结论,mdm2通过p53依赖性和p53非依赖性机制在前列腺癌生长中发挥作用。此外,他们显示bcl2、rb、prb和e2f1蛋白水平降低,而p21升高(zhang等人2003,pnas 2003,100,11636-11641)。然而,研究表明mdm2通过抑制其泛素化来延长e2f1蛋白的半衰期。mdm2取代e2f1 e3连接酶scf(skp2)。mdm2和e2f1之间的直接结合对于mdm2对e2f1泛素化的负向影响是必要的,并且mdm2核定位信号的缺失不会导致失去增加e2f1蛋白水平的能力。mdm2抑制后e2f1的下调不是由于prb或p14(arf)。此外,e2f1至少部分抑制了mdm2敲低诱导的细胞增殖。总之,本研究提供了以下证据,e2f1蛋白的稳定化可能是mdm2介导的肿瘤发生的另一个p53非依赖性成分(zhang等人,oncogene 2005,24,7238-7247)。
[0509]
显然,rb-e2f1和mdm2-p53途径,以及它们之间的多方面对话(crosstalk),是细胞周期进程和成活力的关键调节剂。然而,使用mdm2靶向药物的临床研究目前还没有达到最初的预期,至少在作为单一药物使用时是这样。这促使人们寻找mdm2抑制剂与其他癌症药物的优化组合。
[0510]
nutlin的几种衍生物已被开发并进入人体研究(图1)。这些化合物被认为对含有正常或“野生型”p53的肿瘤最有效。然而,最近的结果表明,e2f1转录活性是mdm2拮抗剂诱导的细胞凋亡的关键决定因素,并且p73对由nutlin-3诱导的e2f1介导的细胞凋亡很重要(burgess等人,frontiers in oncology 2016,6,article 7;skalniak等人,2019,29,151-170;kitagawa等人,oncogene 2008,27,5303-5314)。
[0511]
nutlin及其衍生物(nvp-hdm201、idasanutlin、am-8553、sar405838、nutlin-3a、amg232)如图43所示。
[0512]
可以特别地通过病毒以及因此在此描述的本发明的组合治疗的肿瘤优选地是选自包含以下各项的组的那些肿瘤:神经系统肿瘤、眼肿瘤、皮肤肿瘤、软组织肿瘤、胃肠道肿瘤,呼吸系统肿瘤、骨骼肿瘤、内分泌系统肿瘤、女性生殖系统肿瘤、乳腺肿瘤、男性生殖系统肿瘤、泌尿外流系统肿瘤、包括混合和胚胎瘤的造血系统肿瘤、以及白血病。在本发明的范围内,这些肿瘤特别是如本文特别定义的抗性肿瘤。
[0513]
神经系统肿瘤组优选包括:
[0514]
1.颅骨和大脑(颅内)肿瘤,优选星形细胞瘤、少突神经胶质瘤、脑膜瘤、神经母细胞瘤、神经节神经瘤、室管膜瘤、神经鞘瘤、神经纤维瘤、血管母细胞瘤、脂肪瘤、颅咽管瘤、畸胎瘤和脊索瘤;
[0515]
2.脊髓和椎管肿瘤,优选胶质母细胞瘤、脑膜瘤、神经母细胞瘤、神经纤维瘤、骨肉瘤、软骨肉瘤、血管肉瘤、纤维肉瘤和多发性骨髓瘤;和
[0516]
3.周围神经肿瘤,优选神经鞘瘤、神经纤维瘤、神经纤维肉瘤和神经周围纤维母细胞瘤。
[0517]
眼肿瘤组优选包括:
[0518]
1.眼睑和睑腺肿瘤,优选腺瘤、腺癌、乳头状瘤、组织细胞瘤、肥大细胞瘤、基底细胞瘤、黑色素瘤、鳞状细胞癌、纤维瘤和纤维肉瘤;
[0519]
2.结膜和瞬膜肿瘤,优选鳞状细胞癌、血管瘤、血管肉瘤、腺瘤、腺癌、纤维肉瘤、黑色素瘤和乳头状瘤;和
[0520]
3.眼眶、视神经和眼球肿瘤,优选成视网膜细胞瘤、骨肉瘤、肥大细胞瘤、脑膜瘤、
网状细胞瘤、神经胶质瘤、神经鞘瘤、软骨瘤、腺癌、鳞状细胞癌、浆细胞瘤、淋巴瘤、横纹肌肉瘤和黑色素瘤。
[0521]
皮肤肿瘤组优选包括:
[0522]
组织细胞瘤、脂肪瘤、纤维肉瘤、纤维瘤、肥大细胞瘤、恶性黑色素瘤、乳头状瘤、基底细胞瘤、角化棘皮瘤、血管外皮细胞瘤、毛囊肿瘤、汗腺肿瘤、皮脂腺肿瘤、血管瘤、血管肉瘤、脂肪瘤、脂肪肉瘤、恶性纤维组织细胞瘤、浆细胞瘤和淋巴管瘤。
[0523]
软组织肿瘤组优选包括:
[0524]
肺泡软组织肉瘤、上皮样细胞肉瘤、软组织软骨肉瘤、软组织骨肉瘤、软组织的尤因氏肉瘤、原始神经外胚层肿瘤(pnet)、纤维肉瘤、纤维瘤、平滑肌肉瘤、平滑肌瘤、脂肪肉瘤、恶性纤维组织细胞瘤、恶性血管外皮细胞瘤、恶性血管瘤、血管瘤、血管肉瘤、恶性间质瘤、恶性周围神经鞘瘤(mpnst)、恶性神经鞘瘤、恶性黑素细胞性神经鞘瘤、横纹肌肉瘤、滑膜肉瘤、淋巴管瘤和淋巴管肉瘤。
[0525]
胃肠道肿瘤组优选包括:
[0526]
1.口腔和舌头的肿瘤,优选鳞状细胞癌、纤维肉瘤、梅克尔细胞瘤、诱导型纤维成釉细胞瘤、纤维瘤、纤维肉瘤、病毒性乳头状瘤病、特发性乳头状瘤病、鼻咽息肉、平滑肌肉瘤、成肌细胞瘤和肥大细胞瘤;
[0527]
2.唾液腺肿瘤,优选腺癌;
[0528]
3.食道肿瘤,优选鳞状细胞癌、平滑肌肉瘤、纤维肉瘤、骨肉瘤、巴雷特癌和食道旁肿瘤;
[0529]
4.外分泌胰腺肿瘤,优选腺癌;和
[0530]
5.胃肿瘤,优选腺癌、平滑肌瘤、平滑肌肉瘤和纤维肉瘤。
[0531]
呼吸系统肿瘤组优选包括:
[0532]
1.鼻和鼻腔,喉和气管的肿瘤、优选鳞状细胞癌、纤维肉瘤、纤维瘤、淋巴肉瘤、淋巴瘤、血管瘤、血管肉瘤、黑色素瘤、肥大细胞瘤、骨肉瘤、软骨肉瘤、嗜酸粒细胞腺瘤(横纹肌瘤)、腺癌和成肌细胞瘤;和
[0533]
2.肺部肿瘤,优选鳞状细胞癌、纤维肉瘤、纤维瘤、淋巴肉瘤、淋巴瘤、血管瘤、血管肉瘤、黑色素瘤、肥大细胞瘤、骨肉瘤、软骨肉瘤、嗜酸粒细胞腺瘤(横纹肌瘤)、腺癌、成肌细胞瘤、小细胞癌、非小细胞癌、支气管腺癌、支气管肺泡腺癌和肺泡腺癌。
[0534]
骨骼肿瘤组优选包括:
[0535]
骨肉瘤、软骨肉瘤、骨旁骨肉瘤、血管肉瘤、滑膜细胞肉瘤、血管瘤肉瘤、纤维肉瘤、恶性间叶瘤、巨细胞瘤、骨瘤和多叶骨瘤。
[0536]
内分泌系统肿瘤组优选包括:
[0537]
1.甲状腺/甲状旁腺肿瘤,优选腺瘤和腺癌;
[0538]
2.肾上腺肿瘤,优选腺瘤、腺癌和嗜铬细胞瘤(肾上腺髓质瘤);
[0539]
3.下丘脑/垂体肿瘤,优选腺瘤和腺癌;
[0540]
4.内分泌胰腺肿瘤,优选胰岛素瘤(β细胞瘤,apudom)和zollinger-ellison综合征(胰腺δ细胞的胃泌素分泌性肿瘤);和
[0541]
5.多发性内分泌肿瘤(men)和化学感受器瘤。
[0542]
女性性系统肿瘤的肿瘤组优选包括:
[0543]
1.卵巢肿瘤,优选腺瘤、腺癌、囊腺瘤和未分化癌;
[0544]
2.子宫肿瘤,优选平滑肌瘤、平滑肌肉瘤、腺瘤、腺癌、纤维瘤、纤维肉瘤和脂肪瘤;
[0545]
3.子宫颈肿瘤,优选腺癌、腺瘤、平滑肌肉瘤和平滑肌瘤;
[0546]
4.阴道和外阴肿瘤,优选平滑肌瘤、平滑肌肉瘤、纤维平滑肌瘤、纤维瘤、纤维肉瘤、息肉和鳞状细胞癌。
[0547]
乳腺肿瘤组优选包括:
[0548]
纤维腺瘤、腺瘤、腺癌、间质瘤、癌、癌肉瘤。
[0549]
男性性系统的肿瘤组优选包括:
[0550]
1.睾丸肿瘤,优选精原细胞瘤、间质细胞瘤和睾丸支持细胞瘤;
[0551]
2.前列腺肿瘤,优选腺癌、未分化癌、鳞状细胞癌、平滑肌肉瘤和移行细胞癌;和
[0552]
3.阴茎和外生殖器肿瘤,优选肥大细胞瘤和鳞状细胞癌。
[0553]
泌尿外流系统的肿瘤组优选包括:
[0554]
1.肾脏肿瘤,优选腺癌、移行细胞癌(上皮细胞肿瘤)、纤维肉瘤、软骨肉瘤(间质瘤)、威尔姆氏肿瘤(wilm’s tumor)、肾母细胞瘤和胚胎性肾瘤(胚胎多能母细胞瘤);
[0555]
2.输尿管肿瘤,优选平滑肌瘤、平滑肌肉瘤、纤维乳头瘤、移行细胞癌;
[0556]
3.膀胱肿瘤,优选为移行细胞癌、鳞状细胞癌、腺癌、botryoid(胚胎性横纹肌肉瘤)、纤维瘤、纤维肉瘤、平滑肌瘤、平滑肌肉肉瘤、乳头状瘤和血管肉瘤;和
[0557]
4.尿道肿瘤,优选移行细胞癌、鳞状细胞癌和平滑肌肉瘤。
[0558]
造血系统的肿瘤组优选包括:
[0559]
1.淋巴瘤,淋巴白血病、非淋巴白血病、骨髓增生性白血病、霍奇金淋巴瘤、非霍奇金淋巴瘤。
[0560]
混合和胚胎瘤组优选包括:
[0561]
血管肉瘤、胸腺瘤和间皮瘤。
[0562]
优选地,这些肿瘤选自乳腺癌、卵巢癌、前列腺癌、骨肉瘤、成胶质细胞瘤、黑色素瘤、小细胞肺癌和结肠直肠癌。另外的肿瘤是如本文所述的那些抗性肿瘤,优选是那些多重抗性肿瘤,特别是上述组的那些肿瘤。
[0563]
在本发明内,分别鉴定和筛选了要施用本发明的组合的受试者。可以在本发明的各个方面中受益于本发明的患者的这种鉴定是基于对受试者样品的细胞核中yb-1的检测。
[0564]
在一个实施方案中,通过使用选自包含以下各项的组的试剂进行肿瘤组织的检查:抗yb-1的抗体,针对yb-1的适体和针对yb-1的spiegelmer以及针对yb-1的anticaline。基本上,可以为相应的标志物产生相同的手段并相应地使用。抗体、特别是单克隆抗体的制备是本领域技术人员已知的。用于特异性检测yb-1或所述标志物的另一手段是与靶结构(在当前情况下为yb-1或所述标志物)高亲和力结合的肽。在现有技术中,已知例如噬菌体展示的方法以产生此类肽。通常,以肽文库为起点,其中各个肽的长度为8至20个氨基酸,并且文库的大小为约102至1018,优选108至1015个不同的肽。靶分子结合多肽的一种特殊形式是所谓的anticalines,其例如在德国专利申请de 19742706中描述。
[0565]
用于特异性结合yb-1或本文公开的相应标记物并因此用于检测yb-1在细胞核中的细胞周期独立定位的另一种手段是所谓的适体,即d-核酸,其以rna或dna、单链或双链形式存在,并且可以与目标分子特异性结合。适体的产生例如在欧洲专利ep 0533838中描述。
适体的一种特殊形式是所谓的适酶(aptazyme),其例如由piganeau,n.等人(2000),angew.chem.int.ed.,39,no.29,第4369-4373页描述。这些是适体的特殊实施方案,因为它们除了适体部分外还包含核酶部分,并在结合或释放与适体部分结合的靶分子时具有催化活性并裂解核酸底物,这伴随着信号的产生。
[0566]
适体的另一种形式是所谓的spiegelmers,即由l-核酸制成的靶分子结合核酸。例如,在wo 98/08856中描述了用于制备这种spiegelmers的方法。
[0567]
肿瘤组织的样品可以通过穿刺或手术获得。经常通过使用显微镜技术和/或免疫组织分析,优选地使用抗体或任何其他前述手段,来评估yb-1是否与细胞周期无关地位于细胞核中。用于检测细胞核中的yb-1,特别是用于检测yb-1与细胞周期无关地位于细胞核中的其他手段是本领域技术人员已知的。例如,在筛选染色组织切片时,可以很容易地检测到yb-1在其中的定位。yb-1在细胞核中的出现频率已经表明该定位独立于细胞周期。细胞核中yb-1的细胞周期独立检测的另一选择在于对yb-1染色,并检测yb-1是否位于细胞核中以及确定细胞的阶段。也可以通过使用针对yb-1的上述手段来执行yb-1的检测。手段的检测通过本领域技术人员已知的方法完成。通过所述试剂与yb-1特异性结合而不与待分析的样品(特别是细胞)中的任何其他结构结合,可以检测它们的定位,并且由于它们与yb-1的特异性结合,通过适当的手段标记还可以检测和确定yb-1的定位。标记所述手段的方法是本领域技术人员已知的。
[0568]
在下文中,将参考附图和实施例进一步阐述本发明,从这些附图和实施例中可以得到新的特征、实施方案和优点。
[0569]
图1a是柱状图,显示了与cdk4/6抑制剂ly(ly-2835219)、pd(pd-032991)或lee(lee011)组合使用时,xvir-n-31(xvir)、野生型腺病毒(wt)和对照(ctrl)的作为细胞成活力指标的相对吸光度。
[0570]
图1b是柱状图,显示了与cdk4/6抑制剂ly(ly-2835219)、pd(pd-032991)或lee(lee011)组合使用时,xvir-n-31(xvir)和野生型腺病毒(wt)的病毒滴度。
[0571]
图1c是柱状图,显示了与cdk4/6抑制剂ly(ly-2835219)、pd(pd-032991)或lee(lee011)组合使用时,xvir-n-31(xvir)和野生型腺病毒(wt)的相对尾丝dna。
[0572]
图2描绘了蛋白质印迹分析的结果。
[0573]
图3a-d是柱状图。
[0574]
图4a-d是柱状图。
[0575]
图5是柱状图。
[0576]
图6是一系列显微照片。
[0577]
图7是用和不用帕博西尼(palbociclib)处理的、用表达gfp的e1缺失的腺病毒感染的t24细胞的荧光显微图像。
[0578]
图8是柱状图,显示了使用化合物nutlin 3a、lee、c11040和roscovertine 48小时后腺病毒dl703的病毒dna复制。
[0579]
图9a-c显示了用指定浓度的nutlin-3a和lee011(瑞博西尼)(图9a),roscovitine(图9b)和ci-1040(图9c)处理的umuc细胞的蛋白质印迹分析结果;rb表示成视网膜细胞瘤蛋白;phrb是指磷酸化的成视网膜细胞瘤蛋白;e2f1是指转录因子e2f1;gapdh作为上样对照。
[0580]
图10是柱状图,显示在处理后48小时测量的umuc3细胞中细胞周期分布,其中cdk4/6抑制剂的浓度如下:roscovetine:10μm,ci-1040:1μm,nutlin-3a:10μm和lee011:10μm。
[0581]
图11是显示用和不用帕博西尼处理的腺病毒六邻体基因表达的一组显微图像。
[0582]
图12是柱状图,显示了暴露于单独的xvir-n-31、含有15nm parp抑制剂parpi、500nm pd(帕博西尼)或15nm parpi和500nm pd的组合的t24细胞的效能测定结果,以细胞存活百分比表示,其中细胞未感染(左栏),或以10moi(中间栏)或50moi(右栏)感染。
[0583]
图13是一组图片,其显示了用xvir-n-31(20moi),xvir-n-31和15nm parpi,xvir-n-31和500nm pd,xvir-n-31、15nm parpi和500nm pd处理1dpi,2dpi,3dpi,4dpi,5dpi和6dpi后srb染色的t24细胞培养物。
[0584]
图14是一组图片,其显示了用xvir-n-31(10moi),xvir-n-31和160nm parpi,xvir-n-31和400nm pd,xvir-n-31、160nm parpi和400nm pd处理1dpi,2dpi,3dpi,4dpi,5dpi和6dpi后srb染色的umuc细胞培养物。
[0585]
图15是柱状图,显示了用xvir-n-31、cdk 4/6抑制剂帕博西尼和布罗莫结构域抑制剂jq-1感染后5天的t24细胞的效能测定结果。y轴:以%表示的细胞存活率。
[0586]
图16是柱状图,显示了在暴露于单独的xvir-n-31、含有200nm阿贝西利、500nm jq-1或200nm阿贝西利和500nm jq-1的组合后,sk-n-mc细胞的效能测定结果,以细胞存活百分比表示,其中细胞未感染,或以5、10或20moi感染。
[0587]
图17显示了用指定浓度的cdk 4/6抑制剂ly-2835219(阿贝西利)和wee抑制剂mk-1775(adavosertib)处理24和48小时后的sk-n-mc细胞的蛋白质印迹分析结果;rb是指成视网膜细胞瘤蛋白;phrb是指磷酸化的成视网膜细胞瘤蛋白;e2f1是指转录因子e2f1;gapdh作为上样对照。
[0588]
图18显示了用xvir-n-31、cdk 4/6抑制剂阿贝西利和adavosertib(wee抑制剂mk-1775)感染后5天对sk-n-mc细胞的效能测定结果,以存活细胞的百分比表示。
[0589]
图19显示了用指定的抑制剂处理sk-n-mc细胞后的细胞周期分布。
[0590]
图20是显示针对e2f1的sirna对各种细胞系中e2f1表达的影响的柱状图。y轴:对肌动蛋白归一化的e2f1表达,以sictrl转染细胞的%表示。
[0591]
图21是显示在用sirna-e2f1处理的t24细胞中,e2f1抑制导致e2早期表达增加的柱状图。y轴:对肌动蛋白归一化的腺病毒基因表达(以sictrl的%表示)。
[0592]
图22是显示用于确定腺病毒e2-早期表达的引物的位置的示意图。
[0593]
图23是野生型e2早期启动子腺病毒(上)和在e2f1结合位点具有突变的突变型e2早期启动子(下)的核苷酸序列表示。
[0594]
图24是柱状图,显示了在感染后24小时通过rt-qpcr获得的adwt-rgd和ade2fm(在尾丝中还包含rgd基序)感染的t24细胞中的rna表达;将ad-wt基因表达设置为100%。
[0595]
图25显示了适用于本发明的各种cdk4/6抑制剂。
[0596]
图26显示了适用于本发明的各种parp抑制剂。
[0597]
图27显示了适用于本发明的各种bet抑制剂。
[0598]
图28显示了wt-ad5和腺病毒dl520的结构,该腺病毒dl520是通过缺失e1a基因的cr3结构域而仅表达e1a12蛋白的溶瘤腺病毒。
[0599]
图29显示了xvir-n-31的结构,其特征在于缺失e1b19k蛋白,缺失e3区中的2kb,缺失e1a13s蛋白,并向尾丝蛋白引入rgd基序。
[0600]
图30显示了ad-δ24和ad-δ24-rgd的结构,它们也由kleijn等人描述(kleijn等人,plos one.2014;9(5):e97495),其特征在于缺失了e1a基因的cr2结构域;它仅在具有失调成视网膜细胞瘤途径(rb)的肿瘤细胞中复制。如xvir-n-31所示,ad-δ24-rgd在尾丝球中还包含一个rgd基序(motive)。请注意,溶瘤腺病毒dl922-947与δ24类似,因为该病毒的缺失也位于e1a-cr2结构域中,并影响rb结合(成视网膜细胞瘤蛋白)。
[0601]
图31显示了vcn-01的结构,其是一种具有复制能力的腺病毒,被特别工程化以在rb途径缺陷的肿瘤中复制,通过修饰的尾丝表现出增强的感染性,并通过表达可溶性透明质酸酶表现出改善的分布(pascual-pasto等人,sci transl med.2019,11476)。vcn-01中e1a中的缺失类似于δ24中的缺失(e1a中cr2结构域的缺失)。此外,通过在e1a启动子中引入e2f1结合位点来调节该e1a蛋白的表达。此外,它在尾丝球中含有rgd基序并表达可溶性透明质酸酶(mart
í
nez-v
é
lez等人,2016,clin cancer res.1;22(9):2217-25.the oncolytic adenovirus vcn-01as therapeutic approach against pediatric osteosarcoma)。
[0602]
图32显示了e1adl1107和e1adl1101的结构,其中这两种溶瘤腺病毒的缺失影响了与p300(组蛋白乙酰转移酶p300,也称为p300 hat或e1a相关蛋白p300)或prb(成视网膜细胞瘤蛋白)的结合(howe等人,molecular therapy 2000,2,485-495)
[0603]
图33显示了溶瘤腺病毒cb016(和野生型腺病毒5(wt-ad5)之一)的结构,其中e1a-cr2结构域中的缺失与ad-δ24中的相似。此外,cb016在cr1结构域中含有缺失。此外,其在尾丝中或在来自血清型3的尾丝中包含rgd基序(larocca等人,oral oncol.2016,56,25-31)。
[0604]
图34显示了腺病毒orca-010的结构,其含有e1a cr2结构域中的e1aδ24缺失,e3/19k蛋白中的效能增强的t1突变,以及传染性增强的尾丝rgd修饰(dong等人,hum gene ther.2014年10月1日;25(10):897-904)。
[0605]
图35是柱状图,显示表示为以%表示的细胞存活率的效能测定结果,以确定在感染后5天(5dpi)的umuc-3细胞中xvir-n-31单独或与帕博西尼单独组合、与talazoparib单独组合或与帕博西尼和talazoparib组合(“组合”)的细胞杀伤作用,其中xvir-n-31的moi为10、20或50。
[0606]
图36是柱状图,显示表示为以%表示的细胞存活率的效能测定结果,以确定在感染后4天(4dpi)的t24细胞中xvir-n-31单独或与帕博西尼单独组合、与talazoparib单独组合或与帕博西尼和talazoparib组合(“组合”)的细胞杀伤作用,其中xvir-n-31的moi为10、50或100。
[0607]
图37是柱状图,显示表示为以%表示的细胞存活率的效能测定结果,以确定在感染后5天(5dpi)的253j细胞中xvir-n-31单独或与帕博西尼单独组合、与talazoparib单独组合或与帕博西尼和talazoparib组合(“组合”)的细胞杀伤作用,其中xvir-n-31的moi为10、20或50。
[0608]
图38是柱状图,显示在单独用talazoparib、单独用帕博西尼或用talazoparib和帕博西尼两者(“组合”)感染后48小时,t24细胞(左)和umuc-3细胞(右)的细胞周期阶段g0/
g1、s和g2中的细胞百分比。
[0609]
图39是柱状图,显示了在用xvir-n-31(5、10和20moi)、cdk 4/6抑制剂阿贝西利(200nm)和布罗莫结构域抑制剂jq-1(200nm)感染后4天对a673细胞进行效能测定时存活细胞的百分比。
[0610]
图40是一组图片,显示感染后4天用xvir-n-31(1、5和10moi)、100nm帕博西尼单独、100nm jq-1单独或组合(帕博西尼和jq-1两者)处理后srb染色的cal-33细胞的培养物。
[0611]
图41是柱状图,显示了如图40所示的效能测试结果,表示为使用100nm帕博西尼、100nm jq-1或帕博西尼和jq-1的组合在以5的xvir-n-31moi感染cal-33细胞后4天的以%表示的细胞存活率。
[0612]
图42(a,b)是柱状图,显示感染后24小时(图42a)和48小时(图42b)在cal-33细胞中表示为“相对尾丝”的xvir-n-31复制。moi为10,帕博西尼浓度为100nm,jq-1浓度同样为100nm。
[0613]
图43显示了nutlin及其衍生物,即nvp-hdm201、idasanutlin、am-8553、sar405838、nutlin-3a、amg232。
[0614]
图44是一组图片,显示了在用单独的xvir-n-31、xvir-n-1和30μm nutlin-3a、xvir-n-31和500nm帕博西尼以及xvir-n-31与nutlin-3a和帕博西尼两者处理后srb染色的t24细胞的培养物,其中xvir-n-31的moi为0、1、5、10、20或30。
[0615]
图45是柱状图,显示了如图44中所示的效能测试的结果,表示为以%表示的相对于对照的存活细胞。
[0616]
图46是一组图片,显示了在用单独的xvir-n-31、xvir-n-1和30μm nutlin-3a、xvir-n-31和500nm帕博西尼以及xvir-n-31与nutlin-3a和帕博西尼两者处理后srb染色的t24shrb细胞的培养物,其中xvir-n-31的moi为0、1、5、10、20或30。
[0617]
图47是柱状图,显示了如图46中所示的效能测试的结果,表示为以%表示的相对于对照的存活细胞。
[0618]
图48是一组图片,显示了在用单独的xvir-n-31、xvir-n-1和10μm isadanutlin、xvir-n-31和500nm帕博西尼以及xvir-n-31与isadanutlin和帕博西尼两者处理后srb染色的t24细胞的培养物,其中xvir-n-31的moi为0、5、10、20、40或60。
[0619]
图49是柱状图,显示了如图48中所示的效能测试的结果,表示为相对于对照的存活细胞,以%表示。
[0620]
图50是一组图片,显示了在用单独的xvir-n-31、xvir-n-1和10μm idasanutlin、xvir-n-31和500nm帕博西尼以及xvir-n-31与idasanutlin和帕博西尼两者处理后srb染色的t24shrb细胞的培养物,其中xvir-n-31的moi为0、5、10、20、40和60。
[0621]
图51是柱状图,显示了如图50中所示的效能测试的结果,表示为相对于对照的存活细胞,以%表示。
[0622]
图52是分别在24小时和48小时后显示在t24shrb细胞(左)和t24细胞(右)中表示为“相对尾丝”的xvir-n-31复制的柱状图。moi为20,帕博西尼浓度为500nm,nutlin-3a浓度为30μm。
[0623]
图53显示了蛋白质印迹分析的结果。
[0624]
图54是柱状图,显示在t24shrb细胞暴露于帕博西尼、nutlin-3a或两者的组合后
e2f1蛋白的相对量。
[0625]
图55(a)-(d)是柱状图,显示在细胞暴露于指定浓度的帕博西尼、nutlin-3a或两者的组合后,t24细胞(a)、t24shrb细胞(b)、umuc-3细胞(c)和rt112细胞(d)的细胞周期阶段g0/g1、s和g2中的细胞百分比。
[0626]
图56(a)-(d)是柱状图,显示在细胞暴露于指定浓度的帕博西尼、nutlin-3a或两者的组合后,t24细胞(a)、t24shrb细胞(b)、umuc-3细胞(c)和rt112细胞(d)的细胞周期阶段g1中的细胞百分比。
[0627]
图57是柱形图,指示在具有100nm瑞博西尼(lee,也称为lee011)、具有100nm jq1和具有100nm瑞博西尼(lee)和100nm jq1两者的xvir-n-31感染后,u87细胞的相对存活率,其中xvir-n-31的moi为5。
[0628]
图58是柱形图,指示在具有100nm瑞博西尼(lee,也称为lee011)、200nm jq1和100nm瑞博西尼(lee)和200nm jq1两者的xvir-n-31感染后,ln229细胞的相对存活率,其中xvir-n-31的moi为20。
[0629]
图59是柱形图,指示在具有1μm瑞博西尼(lee,也称为lee011)、200nm jq1和100nm瑞博西尼(lee)和200nm jq1两者的xvir-n-31感染后,t98g细胞的相对存活率,其中xvir-n-31的moi为50。
[0630]
图60是柱状图,指示用xvir-n-31感染后24小时(hpi)当暴露于瑞博西尼(lee)(500nm)、jq1(50nm)或瑞博西尼(500nm)和jq1 24(50nm)的组合时,u87细胞中腺病毒xvir-n-31尾丝dna的相对量。
[0631]
图61是柱状图,指示用xvir-n-31感染后48小时(hpi)当暴露于瑞博西尼(lee)(500nm)、jq1(100nm)或瑞博西尼(500nm)和jq1(100nm)的组合时,ln229细胞中腺病毒xvir-n-31尾丝dna的相对量。
[0632]
图62是柱状图,指示用xvir-n-31感染后48小时(hpi)当暴露于瑞博西尼(lee)(1μm)、jq1(100nm)或瑞博西尼(1μm)和jq1(100nm)的组合时,t98g细胞中腺病毒xvir-n-31尾丝dna的相对量。
[0633]
图63显示了ln229细胞在用xvir-n-31(moi 20)感染24小时后的暴露于500nm lee、200nm jq-1或500nm lee和200nm jq-1的组合的蛋白质印迹分析结果。
[0634]
图64显示了ln229细胞在用xvir-n-31(moi 20)感染48小时后的暴露于500nm lee、200nm jq-1或500nm lee和200nm jq-1的组合的蛋白质印迹分析结果。
[0635]
图65显示了ln229细胞在用xvir-n-31(moi20)感染72小时后的暴露于500nm lee、200nm jq-1或500nm lee和200nm jq-1的组合的蛋白质印迹分析结果。
[0636]
图66显示了ln229细胞在用xvir-n-31(moi 20)感染72小时后的暴露于500nm lee、200nm jq-1或500nm lee和200nm jq-1的组合的蛋白质印迹分析结果。
[0637]
图67说明了e1a的相互作用伴侣和保守区cr1-cr4的位置。
[0638]
图68是柱状图,显示了在jq-1处理(200nm)后,腺病毒adwt、dl1119、adδ24、xvir-n-31和adwt/e2fm(moi20)感染后24小时(pi)ln229细胞中腺病毒dna的相对增加。
[0639]
图69是柱状图,显示了在jq-1处理(200nm)后,腺病毒adwt、dl1119、adδ24、xvir-n-31和adwt/e2fm(moi 20)感染后48小时(pi)ln229细胞中腺病毒dna的相对增加。
[0640]
图70是显示在用100nm jq-1(左)或500nm jq-1(右)引发(priming)或并发
(concurrent)处理后的用xvir-n-31感染后24小时的umuc-3细胞中量化的尾丝dna(表示为尾丝/肌动蛋白)在4小时归一化为尾丝)的图。
[0641]
图71是显示在感染后39、49、62或72小时(hpi)具有和不具有500nm jq-1的umuc-3细胞中xvir-n-31的颗粒形成(表示为pfu/ml)的图。
[0642]
图72是在不具有(上排)和具有500nm jq-1(下排)的感染后39、49、62或72小时(hpi)的六邻体滴度测试后的xvir-n-31感染细胞(moi为10)一组明场显微照片。
[0643]
图73是在感染后12小时、感染后24小时、感染后36小时和感染后48小时用具有或不具有500nm jq-1的xvir-n-31处理后umuc-3细胞的蛋白质印迹分析,说明了量化的病毒表达动力学。
[0644]
图74是柱状图,显示了在100nm jq-1、300nm jq-1、500nm帕博西尼、100nm jq-1和500nm帕博西尼的组合,以及300nm jq-1和500nm帕博西尼的组合的影响下,在g0/g1期、s期和g2期的umuc-3细胞(左)和rt112细胞(右)的百分比。
[0645]
图75显示了umuc-3细胞(左)和rt-112细胞(右)在处理后24小时的暴露于0、0.2μm和0.5μm的jq-1和/或帕博西尼的蛋白质印迹分析结果。
[0646]
图76是柱状图,显示各自在感染后五天的用200nm jq-1、100nm帕博西尼以及200nm jq-1和100nm帕博西尼的组合处理后,xvir-n31(moi为5)对umuc-3细胞的杀伤作用。
[0647]
图77是柱状图,显示各自在感染后五天的用200nm jq-1、300nm帕博西尼以及200nm jq-1和300nm帕博西尼的组合处理后,xvir-n31(moi为40)对rt112细胞的杀伤作用。
[0648]
图78是柱状图,显示各自在感染后五天的用100nm jq-1、200nm帕博西尼以及100nm jq-1和200nm帕博西尼的组合处理后,xvir-n31(moi为40)对t24细胞的杀伤作用。
[0649]
图79是柱状图,显示在用jq-1(300nm)、帕博西尼(100nm)、或jq-1(300nm)和帕博西尼(100nm)的组合引发和并发处理后,在感染xvir-n-31(moi为10)24小时后xvir-n-31在umuc-3细胞中的复制,其中将xvir-n-31的复制量化为相对尾丝dna水平。
[0650]
图80是柱状图,显示在用jq-1(100nm)、帕博西尼(200nm)、或jq-1(100nm)和帕博西尼(200nm)的组合引发和并发处理后,在感染xvir-n-31(moi为50)24小时后xvir-n-31在t24细胞中的复制,其中将xvir-n-31的复制量化为相对尾丝dna水平。
[0651]
图81是柱状图,显示在用jq-1(200nm)、帕博西尼(300nm)、或jq-1(200nm)和帕博西尼(300nm)的组合引发和并发处理后,在感染xvir-n-31(moi为20)24小时后xvir-n-31在rt112细胞中的复制,其中将xvir-n-31的复制量化为相对尾丝dna水平。
[0652]
图82是柱状图,说明用200nm jq-1、500nm帕博西尼或200nm jq-1和500nm帕博西尼的组合,用xvir-n-31(moi为9)感染的病毒产生umuc-3细胞的定量平均产量,其中平均产量的量化表示为每个视野(f.o.v)的染色细胞。
[0653]
图83是在六邻体滴度测试后xvir-n-31感染的umuc-3细胞(moi为9)的一组明场显微照片,其中细胞用仅xvir-n-31,xvir-n-31和200nm jq-1的组合,xvir-n-31和500nm帕博西尼的组合,或xvir-n-31、200nm jq-1和500nm帕博西尼的组合感染。
[0654]
图84是柱状图,表明在用xvir-n-31(moi为0、5和10)与指定的bet抑制剂otx(300nm)、azd(5nm)、dbet6(50nm)和arv(50nm)组合感染后umuc-3细胞的相对存活率。
[0655]
图85是柱状图,表明在用xvir-n-31(moi为0、20和50)与指定的bet抑制剂otx(130nm)、azd(10nm)、dbet6(150nm)和arv(10nm)组合感染后rt112细胞的相对存活率。
[0656]
图86是柱状图,表明在用xvir-n-31(moi为10)与指定的bet抑制剂(otx:50nm;azd:50nm,dbet:50nm,和arv:50nm)组合感染后24小时umuc-3细胞中的病毒复制。
[0657]
图87是柱状图,表明在用xvir-n-31(moi为50)与指定的bet抑制剂(otx:40nm;azd:15nm,dbet:25nm,和arv:15nm)组合感染后24小时rt112细胞中的病毒复制。
[0658]
图88是动物研究的图解,表明xvir-n-31和瑞博西尼的给药和预定应用。瑞博西尼琥珀酸盐(lee011)每天通过口服管饲法以200mg/kg/体重施用共5天(第x天直到x 4)。不含lee011的溶剂应用于pbs和仅xvir-n-31的动物。在第x 1和x 3天两次将xvir-n-31注射到肿瘤中。所有未接受xvir-n-31的对照动物都接受了i.t.分别注射pbs。
[0659]
图89是显示不同处理组(pbs、lee、仅xvir和组合)的体积增长曲线的图;每个数据点显示处理开始后指定天数的平均值
±
肿瘤大小。
[0660]
图90是一个箱形图,显示了各种处理组(pbs动物数量=5)、lee(pbs动物数量=6)、仅xvir(pbs动物数量=7)和组合(pbs动物数量=7)开始处理后第12-21天时的肿瘤体积[mm3]。
[0661]
图91是柱状图,显示与仅xvir-n-31处理相比,接受组合处理的代表性动物的肿瘤中的病毒基因组(表示为尾丝/1000肌动蛋白);在第二次i.t.注射xvir-n31后2天进行评估。
[0662]
实施例1:材料和方法
[0663]
细胞培养
[0664]
将人膀胱癌细胞系在亚汇合(subconfluent)条件下分别在补充有10%fbs(biochrom ag)和1%nea(biochrom ag)的rpmi或dmem培养基(biochrom ag)中在5%或10%co2下培养。根据细胞系和实验条件,分别以10cm,6孔,12孔和96孔形式接种0.2-1x106、0.5-1x105、0.25-0.5x105和500-700个细胞。
[0665]
细胞系
[0666]
helap
[0667]
hela p细胞(atcc ccl-2)是来自宫颈腺癌的上皮细胞,以患者henrietta lacks的名字命名。该细胞系是分布最广、最古老的细胞系(rahbari等人,2009),因为它是1951年建立的第一个永久细胞系(gey等人,1952)。在37℃于10%co2条件下在dmem(10%fbs,1%ps)中进行培养。
[0668]
helardb
[0669]
helardb是helap细胞系的一个亚细胞系,基于糖蛋白p的过度表达,对柔红霉素具有抗性。该抗性是通过用含有该蒽环类抗生素的培养基培养而获得的。这种细胞抑制剂插入双链dna序列中,并抑制细胞的转录和复制(mizuno等人,1975)。由于由柔红霉素处理引起的应激反应的结果,与亲本细胞系相比,细胞因子yb-1显示出更高的细胞核定位(holm等人,2004)。为了维持对柔红霉素的抗性,每14天将细胞在含有0.25μg/ml柔红霉素的dmem(10%fbs,1%ps)中在10%co2条件下于37℃培养。
[0670]
a549
[0671]
a549细胞(atcc ccl-185)在1972年从人肺泡基底的腺癌中分离出来(giard等人,1973)。在37℃和10%co2下于dulbecco mem(10%fbs和1%ps)中进行培养。
[0672]
t24
[0673]
t24细胞(atcc htb-4)源自1970年的原发性人膀胱癌(bubenik,baresov
à
等人,1973)。由于hras基因中的点突变(reddy等人,1982),mapk和pi3k途径被激活。此外,该细胞系中还存在肿瘤抑制基因p53的基因座中的另一个突变(pinto-leite等人,2014)。将细胞用含有10%fcs,1%ps和1%非必需氨基酸的rpmi于37℃在5%co2条件下培养。
[0674]
hek293
[0675]
hek293细胞(atcc crl-1573)是1973年分离的人类胚胎肾细胞。由于腺病毒血清型5(其中包括整个e1区域(graham和smiley,1977年))基因组的4.5kb大小部分的稳定转染,该细胞系用于产生e1缺陷型腺病毒和测量病毒滴度。
[0676]
表1:引物
[0677]
[0678][0679]
病毒特征
[0680]
ad-wt adwt-rgd野生型哺乳动物腺病毒,c型,血清型5和带有额外的rgd-尾丝基序的adwt
[0681]
adwt-e2f1mut.哺乳动物腺病毒,c型,血清型5,在e2-早期启动子的两个e2f1结合位点突变,带有额外的rgd-尾丝基序,在e3区域(δe3)有2,7kb大小的缺失
[0682]
xvir-n-31哺乳动物腺病毒,c型,血清型5,在e1b区域(1.716-1915,200bp),e3区域(28.132-30.813)具有缺失,在e1a区缺失12个碱基。在癌细胞中复制品仅显示细胞核yb-1表达。
[0683]
xvir-n-31/e2f1m哺乳动物腺病毒,c型,血清型5,在e1b区域(1.716-1915,200bp),e3区域(28.132-30.813)具有缺失,在e1a区缺失12个碱基。在癌细胞中复制品仅显示细胞核yb-1表达。在癌细胞中复制品仅显示细胞核yb-1表达。e2早期启动子的两个e2f1结合位点存在突变,带有额外的rgd尾丝基序,并且在e3区域有2,7kb大小的缺失(δe3)
[0684][0685]
方法
[0686]
sirna转染
[0687]
使用sirna转染进行某些基因的下调。由此,在一个试管中将5μl的lipofectamin rnaimax(thermo fischer)试剂添加到150μl的opti-mem中,在另一支试管中将36pmol的sirna与150μl的opti-mem合并。合并两个试管的内容物并短暂涡旋后,将溶液在室温下温育5分钟。然后将250μl sirna-脂质复合物添加到250,000-1,000,000个细胞中,这些细胞在前一天接种到6孔板中,无需更换培养基,sirna的终浓度达到30pmol/孔。在37℃在10%co2条件下温育48小时后,发生了感染或裂解。
[0688]
组合sirna的rna定量
[0689]
还定量了细胞中的rna,其中病毒与sirna转染组合。因此,第二天接种125,000个细胞,并用30pmol ctrl-,yb-1-和e2f1-sirna的sirna构建体转染。温育48小时后,发生感染,并在感染后24小时发生裂解。将裂解物储存在-20℃。
[0690]
rna分离
[0691]
用pbs冲洗细胞,并用裂解缓冲液(mirvana mirna分离试剂盒,life technologies)裂解,并转移至1.5ml反应管中。将50μl匀浆添加剂(mirvana mirna分离试剂盒,life technologies)添加至裂解液中,重悬并在冰上温育10分钟。加入500μl的酸-苯酚-氯仿,涡旋约30秒,并在冰上温育2分钟。在室温下以14,000g离心5分钟后,分离出水相和有机相。将上层水相转移至新的卡口盖管(snap cap)中,并与等量的异丙醇合并并倒置。在室温下温育10分钟后,将样品在4℃和14,000g下离心30分钟。随后除去上清液,并用1ml 75%乙醇洗涤rna沉淀。将样品在4℃下以7500g短暂离心5分钟。除去上清液后,将风干的沉淀物溶于20μl无核酸酶的水中,并在55℃和500rpm下在热混合器中温育10分钟。随后,通过分光光度法测量rna浓度。为了避免dna辙迹(ruts)的扩增,进行了dnase消化。因此,使用了脱氧核糖核酸酶i,life technologies的invitrogen扩增级试剂盒。向1μg rna中加入1μl 10x dnase i反应缓冲液和1μl dnase i,并用depc处理的水填充至最终体积10μl,并在室温下精确温育15分钟。通过加入1μl 25mm edta溶液,使dnase i失活,从而终止dnase消化过程。将样品在65℃下温育10分钟,然后用于逆转录。
[0692]
逆转录
[0693]
为了将rna重写为cdna,使用了高容量cdna逆转录试剂盒(high capacity cdna reverse transcription kit)(thermo scientific)。将经dna消化的样品的2μg rna加入pcr软管中的mastermix中,其中含有转录缓冲液,100mm dntp和rnase抑制剂。因此,必须考虑到,通过e2-早期和e2-晚期启动子转录的rna不能被通常用于逆转录的随机引物重写,因为这些随机引物会与双链腺病毒基因组的两条链结合。因此,使用特定的e2早期反向引物(表1)对用于e2早期和e2晚期定量的样品进行了从rna到cdna的重写。对于用于使结果归一化的管家基因肌动蛋白,使用随机引物。
[0694]
dna复制分析
[0695]
为了研究感染细胞内的病毒复制,进行了dna复制分析。将125,000个细胞接种在6孔板中,并用10-20moi感染。分别在感染后2、8、12、24、36和48小时后,发生裂解。由此,除去培养基,并用1ml pbs洗涤贴壁细胞。加入200μl dna裂解缓冲液后,使用细胞刮刀将贴壁细胞从平板分离。然后将裂解物转移到卡口盖管中。加入3μl的蛋白酶k,并在热混合器上于56℃和550rpm下温育过夜。在第二天,进行dna分离。
[0696]
dna分离
[0697]
为了纯化dna,将200μl苯酚-氯仿-异戊醇加入到裂解物中。涡旋并随后在冰上温育5分钟后,通过在4℃下以16430g离心3分钟来实现相分离。将上层水相转移到新的卡口盖管中,该卡口盖管中含有溶于10mm triscl中的200μl氯仿和20μl甲酚红,以更好地显示各相。涡旋并在冰上温育5分钟后,在4℃下以16430g离心3分钟。再次将上层水相与800μl乙醇和50μl 3m乙酸钠溶液合并。加入2μl糖原,以实现更好的沉淀。将管短暂倒置后,将溶液在4℃下以16430g离心30分钟。随后,将dna沉淀用400μl 70%乙醇覆盖,并在室温下温育10分钟。在室温下以4760g离心7分钟后,dna沉淀在37℃下干燥约5-10分钟。随后,将沉淀溶解在100μl的0.1xte缓冲液中,并在40℃以400rpm振荡大约3小时。当dna完全溶解时,通过分光光度计测量dna浓度,使用2μ1dna溶液进行测量,并用0.1xte-缓冲液作为空白溶液。然后将dna在4℃储存。
[0698]
qpcr
[0699]
为了进一步定量,使用实时定量pcr。以10ng/μl的终浓度分别使用5μl模板dna和cdna。使用在96孔板中以一式两份移取的10μl mastermix gotaq qpcr(promega corporation)(7.5μl mastermix,1.5μl引物,1μl h2o)和5μl dna模板进行qpcr。使用具有两个标准化基因的比较ct方法进行相对定量。通过箔封闭平板,并在室温下以220g离心2分钟。然后在热循环仪中按照一定的温度-时间程序温育平板。表1列出了所用的引物。反应在cfx96实时pcr检测系统(bio-rad laboratories)上进行。
[0700]
qpcr循环条件
[0701]
尾丝:94℃持续2分钟,94℃持续15秒,60℃持续15秒和72℃持续15秒,共45个循环
[0702]
其他病毒基因:94℃持续1.5分钟,94℃持续15秒,58℃持续15秒和72℃持续15秒,共45个循环
[0703]
rb:94℃持续2分钟,94℃持续15秒,60℃持续30秒和72℃持续1分钟,共44个循环
[0704]
e2f1:95℃持续2分钟,95℃持续15秒,60℃持续30秒和72℃持续30秒,共40个循环
[0705]
蛋白质分离
[0706]
使用1%sds缓冲液裂解细胞,以破坏核膜。为了避免蛋白质变性,整个过程在冰上进行。抽吸培养基后,将细胞用冷pbs洗涤两次。用200μl的1%sds缓冲液裂解一式两份方法(duplicate approach)的一孔的贴壁细胞,并用细胞刮刀刮除。然后将裂解物转移至该一式两份方法的另一孔中,并再次刮除。然后将合并的两个孔的裂解物转移到卡口盖管中。随后将裂解物用注射器处理,以破坏粘性dna,并在4℃以31000rpm离心30分钟。由于上清液中存在蛋白质,因此将上清液转移到新的卡口盖管中,并用于进一步的步骤。
[0707]
蛋白质定量
[0708]
为了定量蛋白质的量,通过pierce tm bca蛋白质试剂盒进行了二辛可宁酸(bca)
分析。由此,将112.5μl的bca溶液a b(50∶1)和12.5μl的样品加入96孔板的一个孔中,并在37℃下温育30分钟。取决于蛋白质浓度,导致溶液染色。通过具有已知蛋白质浓度的标准系列,通过酶标仪在562nm处通过光度测量确定样品的蛋白质浓度。
[0709]
sds凝胶电泳
[0710]
为了在随后的十二烷基硫酸钠聚丙烯酰胺凝胶电泳中分离蛋白质,将计算量的裂解物和裂解缓冲液与15μl上样缓冲液-ddt-mixture(6∶1)混合。然后将蛋白质上样物质在100℃下煮5分钟。然后将5μl的有色蛋白质标准品和40μl的样品上样到凝胶上。为了蛋白分离进行病毒蛋白检测,使用了10%的凝胶。为了研究通过sirna下调的基因,使用了12%的凝胶。分离胶和浓缩胶的组成列在“缓冲液和溶液”部分。凝胶在tgs-缓冲液中在90v运行约20分钟,以将所有蛋白质浓缩在一条带中。随后,凝胶在tgs-buffer中于150v下运行约60分钟,以按大小分离蛋白质。
[0711]
蛋白质印迹
[0712]
为了将蛋白质从凝胶转移到膜上,使用蛋白质印迹技术将其印迹。为了活化疏水性pvdf膜,将其在甲醇中温育约2分钟。随后,将膜与海绵、滤纸和凝胶一起沉积在印迹缓冲液中。通过在4℃在100v下电泳大约两个小时,将蛋白质在印迹缓冲液中转移到膜上。为避免非特异性抗体结合,将膜在溶于tbst中的10ml 5%乳粉中于室温下封闭旋转一小时,以分别在5ml5%bsa-tbst中分析细胞蛋白,随后用于检测病毒蛋白的抗体。将膜在tbst中洗涤五次,每次五分钟后,将膜与一级抗体溶液在4℃下旋转温育过夜。对于抗体gapdh、e1a、e1b55k、e2a和e4orf6,此步骤在室温下进行1小时。抗体因此在含有0.02%叠氮化钠的溶于tbst的5%bsa中稀释不同倍数。再经过五个洗涤步骤后,将膜在1∶10,000稀释的二级抗体中于室温旋转温育30分钟。病毒抗体的二级抗体(抗小鼠)用5%的bsa-tbst稀释,所有其他抗体用溶于tbst的5%奶粉稀释。这些二级抗体与辣根过氧化物酶缀合。经过5个最后的洗涤步骤后,将该膜在增强化学发光(ecl)溶液中温育5分钟,以显示过氧化物酶的信号。对于与一级抗体dp-1和e2f-1温育的膜,使用ge-healthcare的amersham ecl prime蛋白质印迹检测试剂来获得更明亮的信号,对于所有其他膜,均使用实验室生产的ecl溶液。“缓冲液和溶液”部分列出了在1:1使用之前不久混合在一起的ecl a和ecl b的组成。最后,可以通过在膜上显影信号来检测蛋白质。
[0713]
抗体:
[0714]
检查点激酶1(sc-377231,santa cruz biotechnology)
[0715]
总rb(554136,bd biosciences)
[0716]
phospho rb ser 780(8180,cell signaling technology)
[0717]
e2f1(sc-251,santa cruz biotechnology)
[0718]
e2f2(ab138515,abcam)
[0719]
e2f3(pg37,thermo fisherscientific)
[0720]
e2f4(wuf 10,thermo fisher scientific)
[0721]
e2f5(sc-999,santa cruz biotechnology)
[0722]
细胞周期蛋白d1(92g2,cell signaling technology)
[0723]
细胞周期蛋白e2(4132,cell signaling technology)
[0724]
cdk2(78b2,cell signaling technology)
[0725]
gapdh(14c10,cell signaling technology)
[0726]
肌动蛋白(a2066,sigma-aldrich chemie gmbh)
[0727]
e1a(sc-25,santa cruz biotechnology)
[0728]
e1b55k(由m.dobbelstein提供)
[0729]
e4orf6(由m.dobbelstein提供
[0730]
e2a(dbp,由m.dobbelstein提供)
[0731]
六邻体(abin2686029,antibodies online)
[0732]
小分子抑制剂处理
[0733]
将pd-0332991羟乙磺酸盐(帕博西尼,sigma-aldrich chemie gmbh)和ly-2835219(abemaciclib,selleck chemicals)溶解在无菌水中,作为10mm储备溶液。将lee011(瑞博西尼,medchem express)和nutlin-3a(sigma)分别溶解在dmso中,作为10mm和5μm的储备溶液。新鲜配制的工作浓度可立即使用。
[0734]
病毒感染和组合处理
[0735]
为了确定病毒诱导的细胞杀伤,将细胞接种在12孔板中。对于与pd-033299、ly-2835219和lee011的组合处理,将细胞用抑制剂预处理24小时。在没有fbs的200-400μl培养基中,用指定的病毒以指定的moi感染细胞。在1hpi,将具有或不具有小分子抑制剂的完全培养基添加到细胞中。
[0736]
细胞成活力(srb测定)
[0737]
在4℃用10%tca固定细胞1小时,并在室温下用1%乙酸中的0.5%磺基罗丹明b(srb,sigma-aldrich chemie gmbh)染色30分钟,然后用1%乙酸洗涤以去除多余的srb。将干燥的srb溶解在10mm tris缓冲液中,并通过在590nm处的光度测量进行定量。
[0738]
滴度测试
[0739]
为了确定感染性病毒颗粒的产生,使用细胞刮刀在3dpi收获感染的细胞和上清液。通过多次冻融循环,然后以1600rcf离心,从完整细胞中释放出病毒。如adeasy病毒滴度试剂盒说明手册(972500)中所述,使用hek293细胞测试了细胞裂解物上清液的病毒颗粒产生。使用了以下试剂:山羊抗六邻体抗体(1056,chemicon),兔抗山羊抗体(p0449,dako),dab溶液(dako)。
[0740]
实施例2:cdk4/6抑制剂pd0332991对e1-负型腺病毒复制的作用
[0741]
已经表明,e1缺失的腺病毒在癌细胞中复制,尽管功效非常低。用100moi的表达绿色荧光蛋白(ad-gfp)的e1-负型腺病毒感染t24细胞,并在感染前一天和温育期间用500nm pd0332991处理。在这种条件下,观察到gfp表达的增加,因此表明由腺病毒e2-早期启动子的激活介导的e1a非依赖性病毒复制和基因表达。
[0742]
实施例3:野生型腺病毒或xvir-n-31与不同的cdk4/6抑制剂的组合使用
[0743]
基于使用e2早期突变的腺病毒ad-wt/e2m和ad-gfp与pd0332991结合的结果,使用不同的cdk4/6抑制剂与野生型腺病毒ad-wt或xvir-n-31结合进行了实验。由于这些试剂可将细胞阻滞在g1期,因此令人惊讶地发现所有抑制剂均能够支持病毒复制。
[0744]
进一步检查了用三种临床上先进的cdk4/6抑制剂pd-033299、ly-2835219和lee011处理细胞是否可以影响感染对细胞成活力、病毒复制和病毒滴度产生的作用。
[0745]
经处理后,所有三种抑制剂均对rb的表达和磷酸化水平表现出相似的作用,这在
之前的许多出版物中已有描述。经过24小时几乎完全的去磷酸化以及总蛋白的下调后,磷酸化水平随时间而部分恢复。处理后cdk2水平上调,而细胞周期蛋白d2和细胞周期蛋白e2水平下调。
[0746]
实施例4:cdk4/6抑制剂和溶瘤腺病毒的组合产生的协同作用
[0747]
cdk4/6抑制剂pd-033299、ly-2835219和lee011与腺病毒感染细胞结合使用。处理后24小时完成了细胞感染,因为只能在处理后8到24小时之间检测到对靶分子的下游影响。
[0748]
结果如图1所示。
[0749]
cdk4/6抑制剂对细胞成活力、病毒复制和病毒滴度具有协同作用。(a)用三种cdk4/6抑制剂pd-033299、ly-2835219和lee011预处理细胞24小时,并用xvir-n-31(moi 60)或野生型腺病毒(moi 80)感染。感染后四天,通过srb测定法测量细胞成活力。图显示了最少三个独立实验的平均值。(b)感染后三天,从细胞制备裂解物,并对hek293细胞进行滴度测试。病毒滴度显示为相对于对照的倍数变化。(c)在4、24、36和48hpi从感染细胞中提取dna,并使用qpcr对尾丝cdna进行病毒复制分析。将数值对4hpi时的gapdh归一化。图显示了至少两个独立实验的代表。误差线代表标准误。
[0750]
从图1可以明显看出,所有三种cdk4/6抑制剂均显著支持细胞裂解(图1a),细胞内复制(图18)和病毒颗粒形成(图1b)。
[0751]
实施例5:cdk4/6抑制剂帕博西尼(pd-033299)对所选病毒蛋白表达水平的作用
[0752]
为了更详细地分析这些作用,确定了处理或未处理细胞中所选病毒蛋白的表达水平。对于该实验,抑制剂帕博西尼(pd-033299)用作代表性的cdk4/6抑制剂。用15的moi感染细胞。感染后24小时进行500nm的pd处理,直到进行蛋白质分离。12、24和36小时后,使用1%sds缓冲液进行蛋白质分离。包括作为阳性对照的肌动蛋白。由于上样对照在所有细胞系中均显示相同水平的细胞肌动蛋白,因此可以确保在细胞系之间进行适当的比较。hpi:感染后小时数
[0753]
结果显示在图2中,其显示了结合cdk4/6抑制剂pd0332991(pd)的ad-wt和xvir-n-31感染的t24细胞的病毒蛋白表达结果。与腺病毒野生型病毒相比,在用cdk4/6抑制剂pd-0332991处理的细胞中,该实验中研究的病毒蛋白(e1a、e1b-55k、dbp(e2a)和六邻体)均以更高的水平表达。对于e1a,这种作用最早可在12hpi时观察到,对于其他蛋白质,则可在24hpi时观察到。
[0754]
实施例6:cdk4/6抑制剂介导的作用的特异性
[0755]
实施例5中的cdk4/6抑制剂类别要求表达rb。因此,使用了三个rb阳性和两个rb阴性膀胱癌衍生的细胞系,并用联合疗法处理了这些细胞。将细胞系用ic50浓度的pd-0332991(t24:500nm,rt112:2000nm,253j:100nm)预处理24小时,并用xvir-n-31(t24 moi50、253jmoi 25,rt112moi450)感染。数值是至少两次独立实验的平均值。误差线显示标准误。使用srb分析(a,c)测量4dpi时的细胞成活力。3dpi时制备细胞的(b,d)裂解物,并对hek293细胞进行滴度测试。病毒滴度显示为相对于对照的倍数变化。
[0756]
结果如图3所示。
[0757]
从图3可以明显看出,只有rb阳性的细胞系分别显示出细胞生长和细胞成活力的显著下降(图3a,c)。另外,pd-0332991处理后,病毒颗粒形成仅在rb阳性细胞系中增加(图3b,d)。
[0758]
实施例7:cdk4/6抑制剂pd-0332991与xvir-n-31组合处理的作用
[0759]
为了研究pd-0332991对rb阳性细胞系中病毒复制的作用,使用qpcr对尾丝dna拷贝进行了相对定量。将膀胱癌细胞系预处理24小时,并用xvir-n-31(t24 moi 40,umuc3和253j moi 20,rt112moi 400)感染。24-48hpi时提取dna,并使用qpcr分析病毒尾丝。将数值对gapdh归一化。数据代表至少两次独立实验;误差线s.d.
[0760]
结果如图4所示。
[0761]
从图4中可以看出,cdk4/6抑制剂pd-0332991与xvir-n-31的组合处理显著增加了病毒复制。
[0762]
实施例8:cdk4/6抑制剂的时间动力学
[0763]
cdk4/6抑制剂对rb的去磷酸化和降解的时间动力学在细胞处理后约10小时。同样,以上提供的结果显示了rb下游目标随时间的部分恢复(图1)。该观察结果暗示cdk4/6抑制剂的时间动力学以及对病毒诱导的细胞死亡的作用是该联合疗法的重要参数,如实施例7所示。对于联合疗法的应用,测试了用于细胞预处理的不同时间点。据此,在感染之前(感染前天/小时,dai/hai)或感染后1小时,处理细胞,并使用srb测定法测量细胞生长。误差线代表s.e.,数值是三个独立实验的平均值。
[0764]
结果如图5所示。
[0765]
从图5可以明显看出,平行治疗已经足以增加细胞死亡。
[0766]
实施例9:不同腺病毒与cdk4/6抑制剂pd0332991的组合处理
[0767]
进行该实施例是为了提供实验证据,表明可以将不同的溶瘤腺病毒与cdk4/6抑制剂(例如pd0332991)一起用于细胞杀伤,并且观察到的病毒复制和细胞杀伤的增加并不限于xvir-n-31。据此,具有ad-δ24和onyx-015的t24癌细胞如下:用20moi的指定溶瘤腺病毒感染t24膀胱癌细胞。利用500nm cdk4/6抑制剂pd0332991的处理在感染前一天和感染后4天进行。感染后4天拍摄照片。细胞病变效应(cpe)的出现表明病毒复制和细胞杀伤。
[0768]
结果如图6所示。
[0769]
从图6中可以看出,cdk4/6抑制剂pd0332991作为cdk4/6抑制剂的代表性实例,当与其他溶瘤性腺病毒如ad-δ24和onyx-015组合时,减少了rb磷酸化,增加了细胞杀伤。
[0770]
实施例10:用表达gfp的重组e1缺失腺病毒(ad-负型/gfp)与帕博西尼组合感染t24细胞导致gfp表达增加
[0771]
将100,000个t24细胞/孔接种在6孔板中,并在37℃和5%co2下在含有10%fcs的rpmi培养基中生长。感染前24小时用500nm帕博西尼处理t24细胞并在感染后1小时再次处理。在没有血清的400μl培养基中感染表达gfp的e1缺失腺病毒(ad-负型/gfp)。感染后48小时使用10倍放大率的荧光显微镜拍摄照片。
[0772]
使用和不使用帕博西尼处理的gfp表达的荧光显微镜分析结果如图7所示。
[0773]
结果表明,用帕博西尼处理t24细胞引起gfp表达的强烈增加,gfp表达是由帕博西尼诱导的病毒dna复制介导。
[0774]
实施例11:在用各种细胞周期抑制剂处理的umuc细胞中e1a独立的病毒复制
[0775]
为了研究在不同处理条件下dl703的复制差异(mantwill等人,2013,journal of translational medicine,11,216),进行了dna复制分析。将100,000个umuc细胞接种在6孔板中,并在37℃在5%co2条件下在含有10%fcs的dmem培养基中生长。接种后24小时,将细
胞用10μm lee(瑞博西尼),1μm ci-1040、10μm nutlin-3a和10μm roscovertine处理24小时,并在感染后再次向培养基中添加适量的抑制剂。在处理后24小时,用50moi的dl703(哺乳动物腺病毒,c型,在e1区域中缺失3.2kb的血清型5)感染。感染后4小时和48小时后,分离dna,并使用病毒尾丝基因的特异性引物进行qpcr。尾丝正向引物5`-aagctagccctgcaaacatca-3`(seq id no:17);尾丝反向引物5`-cccaagctaccagtggcagta-3`(seq id no:18)。
[0776]
结果如图8所示。
[0777]
从图8可以明显看出,用cdk 4/6抑制剂lee011(瑞博西尼)处理umuc细胞导致e1-负型腺病毒dl703的病毒dna复制急剧增加(近100倍)。这种增加强烈表明,瑞博西尼特异性诱导的g1阻滞与e2f1表达的抑制一起促进了e1独立的腺病毒复制。结果,不仅在e1a基因中具有特定缺失的病毒在cdk 4/6处理下显示出增强的腺病毒dna复制,而且即使e1a基因完全缺失的腺病毒也显示出病毒dna复制的增加。
[0778]
尽管mek抑制剂gi-1040在抑制e2f1表达和g1阻滞方面表现出相似的特性,但与瑞博西尼处理的细胞相比,复制要低得多。这可能是由于以下事实:同时抑制了其他重要的细胞周期相关途径,例如病毒复制所必需的mek/erk。此外,已表明抑制mek/erk途径可将颗粒形成减少100倍以上,使得其在临床环境中不适用于与溶瘤腺病毒复制的联合治疗(sch
ü
mannand doppelstein 2016,cancer research,66,1282-1288)。
[0779]
实施例12:用指定细胞周期抑制剂处理的umuc细胞的蛋白质印迹分析
[0780]
用指定浓度的ci-1040、roscovitine,nutlin-3a和lee011(瑞博西尼)处理的umuc细胞的蛋白质印迹分析。将1
×
106个细胞接种在10cm培养皿中。处理后24小时使用1%sds缓冲液以破坏核膜,分离蛋白质。将所有样品吸取到注射器中数次以破坏dna,随后在4℃下以30000rpm离心30分钟。将上清液转移到新的反应管中,直接用于进一步的步骤或保存在-80℃。为了分离蛋白质,进行了十二烷基硫酸钠聚丙烯酰胺凝胶电泳。通过在4℃100v下电泳约2个小时,装载40μg总蛋白并针对指定的特异性抗体进行探测。
[0781]
结果示于图9a、9b和9c中。
[0782]
从图9可以明显看出,roscovitine和nutlin-3a对rb、phrb和e2f1的表达没有明显影响,而10μm的lee-011(瑞博西尼)和1μm的mi-1040则可以诱导e2f1的抑制以及rb和phrb表达。
[0783]
实施例13:cdk 4/6抑制剂对e1缺失的复制缺陷型腺病毒dl703的病毒dna复制的分析
[0784]
为了进行细胞周期分析,将细胞接种在6孔板中(2.5
×
10e4个细胞/孔)。在用dl703感染前8小时,用指定浓度的细胞周期抑制剂处理细胞。用10moi的dl703感染后,再次处理细胞48小时。未处理的细胞和dl703感染的细胞仅用作对照。感染后48小时,通过胰蛋白酶消化收集细胞,并在涡旋的同时用80%乙醇固定。为了研究细胞周期状态,将固定的细胞在室温和300g下离心5分钟,然后抽吸乙醇。将细胞重悬并用1%bsa-pbs(牛血清白蛋白)洗涤,并再次离心。将细胞用edu染色,并使用来自thermo fischer的click-it
tm plus edu流式细胞术检测试剂盒(目录号c10632)进行细胞周期分析。此外,用1%bsa/pbs洗涤3次后,将细胞用pi(碘化丙锭,50μg/ml)染色。用facscalibur流式细胞术系统在染色后直接进行测量。使用flowjo软件分析数据。
[0785]
cdk4/6抑制剂的特征
[0786]
ci1040:双特异性苏氨酸/酪氨酸激酶,map激酶激酶(mek),是人肿瘤中经常被激活的ras/raf/mek/erk信号途径的关键组分。ci-1040是一种benzhydroxamate化合物,其有效抑制mek(allen等人,2003,semin oncol.(5suppl.16):105-16)并引起g1阻滞。
[0787]
nutlin-3a:nutlin-3是mdm2的小分子拮抗剂,可有效地恢复具有野生型p53的mdm2正常表达和mdm2过表达细胞系中的p53功能,从而导致细胞周期阻滞和凋亡(wang等人,2012,acta biochimica et biophysica sinica,第44卷,第8期,2012年8月1日,第685-691页)。
[0788]
roscovitine(seliciclib或cyc202)是药理细胞周期蛋白依赖性激酶(cdk)抑制剂家族中的实验性候选药物,其优先抑制多种酶靶标,包括cdk2、cdk7和cdk9,这些靶标改变了所治疗细胞的细胞周期的生长阶段或状态(whitaker等人,2004,cancer research 64,262-272)。
[0789]
lee011(瑞博西尼;商品名kisqali)是细胞周期蛋白d1/cdk4和cdk6的抑制剂,用于治疗某些类型的乳腺癌。cdk 4/6的抑制导致g1细胞周期阻滞和e2f1表达的抑制(kim s.等人,oncotarget.2018,oct 16;9(81):35226-35240;yang c等人,oncogene(2017)(36,2255-2264)。
[0790]
结果如图10所示。
[0791]
cdk 4/6抑制剂lee011(瑞博西尼)和ci-1040诱导明显的g1阻滞。roscovitine处理显示g2/m阻滞细胞略有增加。在所使用的浓度下,nutlin-3a对细胞周期的影响很小或没有影响。用e1缺失的(没有e1a蛋白)重组腺病毒dl703感染umuc细胞并没有显著改变细胞周期分布。
[0792]
实施例14:帕博西尼增加处理后体外腺病毒六邻体染色
[0793]
将膀胱细胞系rt112、t24和umuc接种在6孔板中(2
×
105个细胞/孔)。接种后一天,在感染前24小时用500nm帕博西尼处理细胞并在感染后1小时再次处理。在无血清的400μl dmem培养基中,用指定moi的ad-wt进行感染。感染后两天,使用来自agilent的adeasy病毒滴定试剂盒(目录号:972500)按照制造商的说明进行六邻体染色。
[0794]
结果如图11所示。
[0795]
从图11可以明显看出,感染后48小时,以帕博西尼处理的细胞中帕博西尼(500nm)作为示例性cdk4/6抑制剂的处理显著增加了六邻体阳性细胞,如棕色/红色所示。必须得出的结论是,由于腺病毒六邻体的表达只发生于病毒复制的开始,因此接受帕博西尼处理的更多细胞能够产生病毒颗粒并显示出增加的病毒dna复制。
[0796]
从实施例10至14的结果可以看出,只有cdk4/6抑制剂但没有其他细胞周期抑制剂能够增加复制缺陷型腺病毒(缺乏e1基因的dl703)和ad-gfp的复制和基因表达。此外,为了提供这种增加的病毒复制和基因表达的cdk4/6抑制剂必须引起(感染)细胞的g1阻滞和f2f1表达的抑制。
[0797]
实施例15:使用包含xvir-n-31、帕博西尼和parp抑制剂的三联疗法处理t24细胞
[0798]
为了表明使用包含xvir-n-31、帕博西尼和parp抑制剂(bmn673(talazolarib))的三联疗法对t24细胞进行三联疗法的功效,进行了效能测定。
[0799]
将12,500个t24细胞接种到12孔板的每个孔中,并在37℃在含10%fcs的rpmi培养
基中过夜生长。通过向培养基中添加指定浓度,在细胞接种后24小时对细胞进行抑制剂处理并在感染后1小时再次处理。抑制剂处理后24小时,在无血清的250μl培养基中发生细胞感染。感染后4天进行固定和srb染色。pd,帕博西尼;parpi:bmn673。
[0800]
为了srb染色,通过抽吸除去培养基。将细胞用1ml(每孔)10%的冷tca在4℃固定1小时。通过抽吸去除tca,并用自来水洗涤细胞层4次。用溶于1%乙酸中的1ml(每孔)0.5%srb(磺基罗丹明b)染色细胞30分钟。在五个洗涤步骤中,用1ml 1%乙酸/孔除去未结合的srb;在每个洗涤步骤之后,通过抽吸除去乙酸。将板风干2小时。为了溶解srb染色的细胞,向每个孔中加入200μl 10mm tris碱。然后,将20μl分别分配到96孔板的孔中。将96孔板装载到elisa板读数器中,并在560nm处测量样品的吸收。模拟物处理的细胞设定为100%细胞存活。
[0801]
结果如图12所示。
[0802]
图12中显示的结果清楚地表明,由帕博西尼、bmn673和xvir-n-31组成的三联疗法在细胞杀伤方面表现出优于单一疗法或联合疗法的优异性能。使用10moi的xvir-n-31与parp抑制剂parpi(bmn673)和cdk4/6抑制剂帕博西尼(pd)结合可以达到近90%的细胞杀伤。没有xvir-n-31的parpi和帕博西尼的组合仅杀死了65%的细胞。t24细胞和umuc细胞对cdk 4/6-抑制剂敏感(通过e2f1下调来提供g1阻滞)。
[0803]
实施例16:包含xvir-n-31、帕博西尼和parp抑制剂的三联疗法的动力学
[0804]
为了表明使用包含xvir-n-31、帕博西尼和parp抑制剂(bmn673(talazolarib))的三联疗法对t24细胞进行三联疗法的动力学,进行了效能测定,并在不同时间点评估了效能。
[0805]
将3000个t24细胞接种到12孔板的每孔中,并在37℃在含10%fcs的rpmi培养基中过夜生长。通过向培养基中添加指定浓度,在细胞接种后24小时对细胞进行抑制剂处理并在感染后1小时再次处理。抑制剂处理后24小时,在无血清的250ul培养基中感染细胞。固定和srb染色在感染后1-5天(dpi:感染后天数)进行。15nm parpi对应于t24细胞中的ic-80值。
[0806]
结果如图13所示。
[0807]
从图13可以明显看出,从动力学的观点来看,使用除xvir-n-31以外还包含cdk4/6抑制剂(帕博西尼(pd)和parp抑制剂parpi(bmn673))的三联疗法比仅使用xvir-n-31的单一疗法或使用xvir-n-31与parp抑制剂或cdk4/6抑制剂的联合疗法更有效。重要的是,cdk4/6敏感细胞系umuc和t24中,在第4天和第5天肿瘤细胞的重新生长显著减少(dpi:感染后天数)。
[0808]
实施例17:包含xvir-n-31、帕博西尼和parp抑制剂的三联疗法的动力学
[0809]
为了表明使用包含xvir-n-31、帕博西尼和parp抑制剂(bmn673(talazolarib))的三联疗法对umuc细胞进行三联疗法的动力学,进行了效能分析,并在不同的时间点评估了效能。
[0810]
接种umuc-3:将3000个细胞接种到12孔板的每孔中,并在37℃在含10%fcs的dmem培养基中过夜生长。通过向培养基中添加指定浓度,在接种后24小时对细胞进行抑制剂处理并在感染后1小时再次处理。在抑制剂处理后24小时进行细胞感染。固定和srb染色在感染后1-6天(dpi:感染后天数)进行。160nm parpi对应于umuc3细胞中的ic-80值。
[0811]
结果如图14所示。
[0812]
图14所示的结果清楚地表明,由帕博西尼、bmn673和xvir-n-31组成的三联疗法显示出优于单疗法或联合疗法的性能。重要的是,cdk4/6敏感细胞系umuc和t24中,在第4天和第5天肿瘤细胞的重新生长显著减少(dpi:感染后天数)。
[0813]
实施例18:包含xvir-n-31、cdk4/6抑制剂和布罗莫结构域抑制剂的三联疗法
[0814]
将5000个t24细胞接种在12孔板中,并在含有10%fcs的1ml rpmi培养基中生长。第二天,用500nm帕博西尼和300nm jq-1处理细胞。处理后24小时,在200μl不含fcs的rpmi-培养基中,用指定moi的xvir-n-31感染细胞。1小时后,将800μl含10%fcs的rpmi-培养基添加到每个孔中。此外,将500nm帕博西尼和300nm jq-1添加到培养基中。感染后5天进行srb染色。模拟物处理的细胞设定为100%细胞存活。
[0815]
结果如图15所示。
[0816]
从图15可以明显看出,布罗莫结构域抑制剂jq-1在低moi时与cdk4/6抑制剂帕博西尼结合可提高xvir-n-31的细胞杀伤能力。感染后48小时的光学显微镜分析表明,经jq-1/帕博西尼/xvir-n-31处理的细胞已发生大量细胞死亡。必须得出的结论是,jq-1增加了帕博西尼处理的细胞中的病毒转录,从而促进了病毒复制,因为仅使用300nm jq-1的单一疗法在10和20moi时不会增加xvir-n-31的细胞杀伤力。
[0817]
在腺病毒感染的癌细胞中观察到的jq-1增强的前提条件是帕博西尼诱导g1阻滞的能力。在对帕博西尼有抗性的细胞中(参见实施例18,相同的处理步骤),未观察到细胞杀伤的增加。该观察结果与baojie lv等人,2018,scientific reports,8,11554形成鲜明对比,后者用不同浓度的jq-1处理的细胞未引起g1阻滞,也没有联合使用帕博西尼。
[0818]
实施例19:包含xvir-n-31、cdk4/6抑制剂和布罗莫结构域抑制剂的三联疗法
[0819]
将100,000个sk-n-mc细胞/孔接种到12孔板中,并在37℃在5%co2下在含10%fcs的rpmi培养基中生长。通过在培养基中添加适量的培养基,在感染前24小时用200nm阿贝西利 500nm jq-1处理细胞并在感染后1小时再次处理。在500μl无血清的rpmi培养基中进行xvir-n-31的感染。感染后5天进行srb染色。模拟物处理的细胞设定为100%细胞存活。
[0820]
结果如图16所示。
[0821]
已经确定,sk-n-mc细胞对cdk 4/6抑制剂具有抗性,因此不会引起g1阻滞。添加jq-1不会增加对cdk4/6(阿贝西利)抗性的sk-n-mc细胞的杀伤力,这表明cdk 4/6介导的g1阻滞是jq-1介导的细胞杀伤作用的前提。
[0822]
因此,图16(以及图15)表明,在cdk 4/6抑制剂诱导处理的细胞中g1阻滞的前提下,靶向brd2、brd3,brd4的布罗莫结构域抑制剂进一步提高了xvir-n-3的细胞杀伤作用。
[0823]
实施例20:用cdk 4/6抑制剂ly-2835219(阿贝西利)和wee抑制剂mk-1775(adavosertib)处理的sk-n-mc细胞的蛋白质印迹分析
[0824]
将1
×
106个细胞接种在10cm培养皿中。处理后24小时使用1%sds缓冲液以破坏核膜,分离蛋白质。将所有样品吸取到注射器中数次以破坏dna,随后在4℃下以30000rpm离心30分钟。将上清液转移到新的反应管中,直接用于进一步的步骤或保存在-80℃。为了分离蛋白质,进行了十二烷基硫酸钠聚丙烯酰胺凝胶电泳。通过在4℃100v下电泳约2个小时,装载40μg总蛋白并针对指定的特异性抗体进行探测。
[0825]
结果如图17所示。
sirna-阴性对照sirna(qiagen#1022076)或sie2f1(sigma#nm_005225,sirna id sasi_hs01_00162220),并在150μl opti-mem中制备9μl lipofectaminernaimax。将sirna溶液和lipofectamine rnaimax溶液混合并温育5分钟。将该混合物逐滴添加至t24细胞。在将细胞与10moi的adwtrgd在400μl无血清培养基中温育并每10-15分钟摇动平板48小时后,发生感染。1小时后,加入1.6ml完全培养基。感染后24小时进行rna分离。
[0841]
结果如图21所示。
[0842]
iii.
[0843]
用冷pbs冲洗细胞,然后加入500μl mirvana试剂盒(thermo fisher目录号am1560)中的裂解缓冲液破坏细胞,用刮刀收集裂解物,然后吸取到1.5ml试管中。为了有机萃取,添加50μl匀浆添加剂,并将样品在冰上温育10分钟。加入500μl的酸-苯酚:氯仿,将样品涡旋60秒并在冰上温育2分钟。样品在室温下以14000x g离心5分钟以分离水相和有机相。将上层相小心地转移到新管中,并加入等量的异丙醇。在室温下温育10分钟后,沉淀出rna(14000x g,4℃,30分钟),并用1ml的75%乙醇洗涤两次(离心7500
×
g,4℃,5分钟)。将rna风干5-10分钟,然后重悬于20-50μl无rnase的水,通过在55℃下以500rpm摇动10分钟溶解,并通过nanodrop进行测量。使用具有1μl 10x dnase i反应缓冲液的1μg rna样品,无核酸酶水至9μl体积,1μl dnasei(1u/μl)在室温下温育15分钟进行dna消化后(脱氧核糖核酸酶i,invitrogen目录号18068-015),通过添加1μl25mm edta溶液,在65℃下加热10分钟使dnasei失活。使用高容量cdna逆转录试剂盒(thermo fisher/applied biosystems
tm
目录号:4368814)进行逆转录。使用随机六聚体进行尾丝和肌动蛋白pcr的转录,并使用e2早期引物用于e2早期转录-pcr。
[0844]
使用的引物和sirna
[0845]
e2早期正向引物:ccgtcatctctacagcccat(seq id no:19)
[0846]
e2早期反向引物:gggctttgtcagagtcttgc(seq id no:20)
[0847]
尾丝正向引物:aagctagccctgcaaacatca(seq id no:21)
[0848]
尾丝反向引物:cccaagctaccagtggcagta(seq id no:22)
[0849]
肌动蛋白正向引物:tcacccacactgtgcccatctacg(seq id no:23)
[0850]
肌动蛋白反向引物:cagcggaaccgctcattgccaatgg (seq id no:24)
[0851]
e2f1正向引物:catcccaggaggtcacttctg (seq id no:25)
[0852]
e2f1反向引物:gacaacagcggttcttgctc(seq id no:26)
[0853]
对照sirna
[0854]
正义uucuccgaacgugucacgudtdt(seq id no:27)
[0855]
反义:acgugacacguucggagaadtdt(seq id no:28)
[0856]
e2f1 sirna
[0857]
cugaggaguucaucagccu[dt][dt](seq id no:29)
[0858]
aggcugaugaacuccucag[dt][dt](seq id no:30)
[0859]
为了通过rt-qpcr证明e2早期表达的作用,绝对必要选择正确的引物。引物的位置应在e2-早期和e2-晚期启动子之间。否则,e2-晚期启动子将强烈影响结果。引物的位置如图22所示。
[0860]
如图20和21所示,sirna对e2f1的下调导致e2早期表达增加。这只能由e2f1在e2早
期表达中的抑制作用来解释。如果e2f1是激活剂,则可能会导致e2早期表达减少。此外,针对e2f1的sirna模拟cdk 4/6抑制剂的作用,其也抑制e2f1表达(yang c等人,oncogene 2017,36,2255-2264)。
[0861]
实施例24:在腺病毒e2-早期启动子中具有两个e2f1结合位点突变的重组腺病毒显示出e2-早期表达增加。
[0862]
产生了在腺病毒e2早期启动子的两个e2f1结合位点具有突变的突变腺病毒。野生型e2早期启动子和突变的e2早期启动子的启动子示于图23(seq id no 44,45,46和47)。
[0863]
在感染后24小时,通过rt-qpcr在获得的adwt-rgd和ade2fm(也包含rgd基序)感染的t24细胞中进行rna表达分析。将ad-wt基因表达设置为100%。该方法与实施例23的iii部分所述的方法相同。
[0864]
结果如图24所示。
[0865]
从图24可以明显看出,与ad-wt感染的细胞相比,ade2fm感染的细胞中e2-早期基因表达更高。因此,必须得出结论,e2f-1在e2早期启动子激活中起抑制作用。这与当前的理解形成了鲜明的对比,在当前的理解中,e2f1被假定为激活剂(decaprio ja,virology.2009feb 20;384(2):274-84)。
[0866]
众所周知,如图22所示,在所有当前已知的溶瘤腺病毒中e2区域的结构均已建立。因此,e2f1的作用方式与此处所述相同。结果,所有它们,即所有溶瘤腺病毒都可以与cdk 4/6抑制剂(包括coload1和delta-24-rgd)组合使用。
[0867]
coload1的特征如下:
[0868]
enadenotucirev(以前称为coload1)是一种具有所阐明的临床前活性的肿瘤选择性嵌合腺病毒。coload1的衣壳来自ad11p,这是一种在人类中具有有限血清流行病学的血清型。enad通过结合在许多癌细胞上广泛表达的cd46和/或桥粒芯糖蛋白2,6而感染细胞。大多数enad基因组均源自ad11p,在e3中具有大的缺失并且在e4中具有较小缺失。另外,e2b区域由来自ad11p和ad3的序列的嵌合体组成。enad中的e4缺失是在e4orf4中,它在ad5中编码一种使蛋白磷酸酶2a失活的蛋白,从而激活蛋白翻译机制并在反馈抑制环中调节e1a蛋白的活性。这些缺失,可能与嵌合的e2b区组合,可能有助于enad的惊人的癌症选择性复制(deyer等人,mol ther oncolytics.2017,16;562-74)
[0869]
δ-24-rgd(dnx-2401)的特征如下:
[0870]
δ-24-rgd(dnx-2401)是一种有条件复制能力的溶瘤病毒,其被设计用于优先在具有p16/rb/e2f1途径异常的肿瘤细胞中复制并裂解肿瘤细胞(fueyo等人,oncogene.2000年1月6日;19(1):2-12)。靶向rb途径的突变溶瘤腺病毒在体内产生抗神经胶质瘤作用(dai b.等人,mol cancer therapy.2017年4月;16(4):662-670)。
[0871]
实施例25:包含xvir-n-31、cdk4/6抑制剂帕博西尼和parp抑制剂talazoparib的三联疗法和t24和umuc-3细胞的facs分析
[0872]
效能测定/srb染色
[0873]
在12孔板中分析了病毒单独以及与小分子抑制剂帕博西尼和talazoparib组合诱导的细胞杀伤效果的效果。因此,接种12.5x103t24或6.3x103umuc-3/253j细胞并在24小时后用增加浓度(感染复数,moi)的xvir-n-31感染。对于与所示小分子抑制剂的组合处理,在感染前24小时和感染后1小时(hpi)用各自浓度的talazoparib、帕博西尼或两种药物的组
合处理细胞。在没有胎牛血清(fbs)的200μl培养基中,用指定的病毒一式三份感染细胞。在1hpi,将具有或不具有小分子抑制剂的完全培养基添加到细胞中。感染后四(t24)或五(umuc-3/253j)天(dpi),细胞在4℃下用10%三氯乙酸(tca)固定1小时,并在室温下用磺基罗丹明b(srb)染色30分钟,然后用1%乙酸洗涤以去除过量的srb。将干燥的srb溶解在10mm tris碱中,并使用多标签读板器(perkinelmer victor x3)在562nm处通过光度测量进行定量。
[0874]
结果如图35,36和37所示。
[0875]
facs分析
[0876]
在dna染色后,通过流式细胞术分析以指定浓度应用的小分子抑制剂对膀胱癌细胞系t24和umuc-3的细胞周期的影响。将5x104个细胞接种在6孔板中,24小时后用适当的抑制剂处理。两天后,在大约80%汇合(confluency)时,用pbs洗涤细胞,胰蛋白酶化,再次洗涤并用冰冷的80%乙醇固定。对于细胞周期分析,样品与dna嵌入染料7-氨基放线菌素d(7-aad)一起温育并通过facs分析进行测量。通过软件flowjo对测量数据进行评估。
[0877]
结果如图38所示。
[0878]
图35、36和37中显示的结果清楚地表明,由帕博西尼、talazoparib和xvir-n-31组成的三联疗法与单一疗法或联合疗法相比在细胞杀伤方面表现出优异性能。
[0879]
图38中描绘的经处理的膀胱细胞t24和umuc-3的facs分析表明,增加病毒复制所需的g1阻滞不受添加parp抑制剂talazoparib的影响。
[0880]
实施例26:包含xvir-n-31、cdk4/6抑制剂帕博西尼和布罗莫结构域抑制剂jq-1的三联疗法
[0881]
效能测定
[0882]
在12孔板中分析了使用病毒单独以及与小分子抑制剂组合的病毒诱导的细胞杀伤效果。因此,接种2x104个细胞(cal-33)并在24小时后用xvir-n-31的每细胞5个感染性病毒颗粒(感染复数,moi)感染。对于与所示小分子抑制剂的组合处理,在感染前24小时和感染后1小时(hpi)用100nm帕博西尼、100nm jq-1或两种药物的组合处理细胞。在没有fbs的200μl培养基中,用指定的病毒一式三份感染细胞。在1hpi,将具有或不具有小分子抑制剂的完全培养基添加到细胞中。感染后四天(dpi),细胞在4℃下用10%三氯乙酸(tca)固定1小时,并在室温下用磺基罗丹明b(srb)染色30分钟,然后用1%乙酸洗涤以去除过量的srb。将干燥的srb溶解在10mm tris碱中,并使用多标签读板器(perkinelmer victor x3)在562nm处通过光度测量进行定量。
[0883]
检测腺病毒复制
[0884]
尾丝qpcr
[0885]
dna分离
[0886]
为了纯化dna,吸出培养基,向孔中加入200μl裂解液。向溶液中加入蛋白酶k后,在56℃下温育10分钟。将200μl苯酚-氯仿-异戊醇添加到病毒细胞裂解液中。涡旋并随后在冰上温育5分钟后,通过在4℃下以16430g离心3分钟来实现相分离。将上层水相转移到新的卡口盖管中,该卡口盖管中含有溶于10mm triscl中的200μl氯仿和20μl甲酚红,以更好地显示各相。涡旋并在冰上温育5分钟后,在4℃下以16430g离心3分钟。再次将上层水相与800μl乙醇和50μl 3m乙酸钠溶液合并。加入2μl糖原溶液,以实现更好的沉淀。将管短暂倒置后,
将溶液在4℃下以16430g离心30分钟。随后,将dna沉淀用400μl70%乙醇覆盖,并在室温下温育10分钟。在室温下以4760g离心7分钟后,dna沉淀在37℃下干燥约5-10分钟。随后,将沉淀溶解在100μl的0.1xte缓冲液中,并在40℃以400rpm振荡大约3小时。当dna完全溶解时,通过分光光度计测量dna浓度,使用2μl dna溶液进行测量,并用0.1xte-缓冲液作为空白溶液。然后将dna在4℃储存。
[0887]
实时pcr
[0888]
通过腺病毒特异性尾丝定量pcr(qpcr)分析病毒复制。使用δδct方法,根据病毒进入细胞的水平(4hpi值)从每个细胞的病毒dna拷贝(归一化为细胞β-肌动蛋白)计算xvir-n-31的复制。将cal-33细胞接种在6孔板中(每孔1.5x105)并用指定的抑制剂预处理24小时。第二天,在400μl不含fbs的培养基中,用10moi的xvir-n-31感染细胞。在1hpi,将具有或不具有小分子抑制剂的完全培养基添加到细胞中。对于dna提取,在4、24和48hpi收获细胞。然后使用苯酚氯仿提取方法分离dna。将通过qpcr确定的对照样品(没有额外小分子抑制剂的10moi xvir-n-31)的倍数变化值设置为1.0,并相对于它们绘制其他样品的倍数变化。在96孔板上使用sybr green mastermix(eurogentec)在以下循环条件下进行定量pcr:95℃2分钟和45个循环94℃15秒,60℃15秒,72℃15s。使用δδct方法计算基因表达。
[0889]
为了检测病毒dna,使用了以下特异性引物:
[0890]
肌动蛋白正向引物5`-taagtaggtgcacagtaggtctg-3`(seq id no:31)
[0891]
肌动蛋白反向引物5`-aaagtgcaaagaacacggctaag-3`(seq id no:32)
[0892]
尾丝正向引物5`-aagctagccctgcaaacatca-3`(seq id no:33)
[0893]
尾丝反向引物5`-cccaagctaccagtggcagta-3`(seq id no:34)
[0894]
a673细胞(atcc crl 1598):尤因肉瘤细胞系于1973年建立。mart
í
nez-ram
í
rez等人2003.characterization of the a673 cell line(ewing tumor)by molecular cytogenetic techniques.cancer genet cytogenet.mar;141(2):138-42。
[0895]
cal-33细胞:是舌鳞状细胞癌。cal 33是一种广泛使用的头颈部鳞状细胞癌(hnscc)细胞系,用于测试治疗剂。
[0896]
结果
[0897]
图39显示了使用moi为5、10和20的xvir-n-31单独、联合cdk4/6抑制剂阿贝西利、联合布罗莫结构域抑制剂jq-1或联合cdk4/6抑制剂阿贝西利和布罗莫结构域jq-1对尤文肉瘤细胞系a673的效能测定结果。
[0898]
头颈部鳞状细胞癌(hnscc)细胞cal-33的效能测定结果如图40和41所示。
[0899]
在以下处理条件下进行qpcr分析病毒复制:xvir-n-31moi:10;100nm帕博西尼,100nm jq-1;细胞系:cal-33;感染后24小时和感染后48小时进行分析)。在用jq-1、帕博西尼或两者(组合)治疗后24小时,用10moi的xvir-n-31发生感染。4、24和48小时后分离dna并进行实时pcr以确定病毒复制。将获得的结果归一化为β-肌动蛋白和4小时值。
[0900]
结果示于图42a和42b中。在所有细胞系中,三联疗法优于单一疗法或任何双重疗法,即xvir-n-31 cdk4/6抑制剂;xvir-n-31 布罗莫结构域抑制剂;和cdk4/6抑制剂 布罗莫结构域抑制剂。
[0901]
实施例27:包含xvir-n-31、cdk4/6抑制剂帕博西尼以及nutlin和nutlin衍生物的三联疗法
[0902]
实施例27.1方法和材料
[0903]
效能测定/srb染色
[0904]
在12孔板中分析了使用xvir-n-31单独以及与小分子抑制剂组合的细胞杀伤。因此,接种20,000个t24或25,000个umuc-3细胞并在24小时后用增加浓度(感染复数,moi)的xvir-n-31感染。对于与所示小分子抑制剂的组合处理,在感染前24小时用各自浓度的nutlin-3a或idasanutlin,帕博西尼和两种药物的组合处理细胞。在没有fbs的250μl培养基中,用指定的病毒一式三份感染细胞。在1hpi,将具有帕博西尼的完全培养基添加到用帕博西尼预处理的细胞中。向对照以及向nutlin处理的细胞中加入不含抑制剂的完全培养基。感染后四天(dpi),细胞在4℃下用10%三氯乙酸(tca)固定1小时,并在室温下用1%乙酸中的0.05%磺基罗丹明b(srb)染色至少30分钟,然后用1%乙酸洗涤以去除过量的srb。对板进行拍照后,将干燥的srb溶解在10mm tris碱中,并使用多标签读板器(perkinelmer victor x3)在562nm处通过光度测量进行定量。
[0905]
facs分析
[0906]
在dna染色后,通过流式细胞术分析以指定浓度应用的小分子抑制剂对膀胱癌细胞系t24,t24shrb,umuc-3和rt112的细胞周期的影响。因此,将5x104个细胞接种在6孔板中,24小时后用适当的抑制剂处理。两天后,在大约80%汇合(confluency)时,用pbs洗涤细胞,胰蛋白酶化,再次洗涤并用冰冷的80%乙醇固定。对于细胞周期分析,样品与碘丙啶(propodium iodine)(pi)一起温育并通过facs分析进行测量。通过软件flowjo对测量数据进行评估。
[0907]
腺病毒复制
[0908]
尾丝qpcr
[0909]
dna分离
[0910]
为了纯化dna,吸出培养基,向孔中加入200μl裂解液。向溶液中加入蛋白酶k后,在56℃下温育10分钟。将200μl苯酚-氯仿-异戊醇添加到病毒细胞裂解液中。涡旋并随后在冰上温育5分钟后,通过在4℃下以16.430g离心3分钟来实现相分离。将上层水相转移到新的卡口盖管中,该卡口盖管中含有溶于10mm triscl中的200μl氯仿和20μl甲酚红,以更好地显示各相。涡旋并在冰上温育5分钟后,在4℃下以16430g离心3分钟。再次将上层水相与800μl乙醇和50μl 3m乙酸钠溶液合并。加入2μl糖原溶液,以实现更好的沉淀。将管短暂倒置后,将溶液在4℃下以16430g离心30分钟。随后,将dna沉淀用400μl70%乙醇覆盖,并在室温下温育10分钟。在室温下以4760g离心7分钟后,dna沉淀在37℃下干燥约5-10分钟。随后,将沉淀溶解在100μl的0.1xte缓冲液中,并在40℃以400rpm振荡大约3小时。当dna完全溶解时,通过分光光度计测量dna浓度,使用2μl dna溶液进行测量,并用0.1xte-缓冲液作为空白溶液。然后将dna在4℃储存。
[0911]
实时pcr
[0912]
通过腺病毒特异性尾丝定量pcr(qpcr)分析病毒复制。使用δδct方法,根据病毒进入细胞的水平(4hpi值)从每个细胞的病毒dna拷贝(归一化为细胞β-肌动蛋白)计算xvir-n-31的复制。将t24和t24shrb细胞接种在6孔板中(每孔5x105)并用指定的抑制剂预处理24小时。第二天,在400μl不含fbs的培养基中,用20moi的xvir-n-31感染细胞。在1hpi,将含有帕博西尼的完全培养基添加到已经用帕博西尼预处理的细胞中。向对照以及向用
nutlin处理的细胞中加入不含抑制剂的完全培养基。对于dna提取,在24和48hpi收获细胞。然后使用苯酚氯仿提取方法分离dna。将通过qpcr确定的对照样品(没有额外小分子抑制剂的20moi xvir-n-31)的倍数变化值设置为1.0,并相对于它们绘制其他样品的倍数变化。在96孔板上使用sybr green mastermix(eurogentec)在以下循环条件下进行定量pcr:95℃2分钟和45个循环94℃15秒,60℃15秒,72℃15s。使用δδct方法计算基因表达。
[0913]
为了检测病毒拷贝,使用了以下特异性引物:
[0914]
肌动蛋白正向引物5`-taagtaggtgcacagtaggtctg-3`(seq id no:35)
[0915]
肌动蛋白反向引物5`-aaagtgcaaagaacacggctaag-3`(seq id no:36)
[0916]
尾丝正向引物5`-aagctagccctgcaaacatca-3`(seq id no:37)
[0917]
尾丝反向引物5`-cccaagctaccagtggcagta-3`(seq id no:38)
[0918]
实施例27.2对t24细胞的包含xvir-n-31、nutlin-3a和帕博西尼的三联疗法
[0919]
使用t24细胞进行效能测定以确定单独的xvir-n-31、xvir-n-31与nutlin-3a、xvir-n-31与帕博西尼以及xvir-n-31与nutlin-3a和帕博西尼的细胞杀伤作用。
[0920]
结果如图44和45所示。
[0921]
从图44和45明显看出,用帕博西尼预处理t24细胞增加了xvir-n-31对细胞的杀伤。帕博西尼和nutlin-3a的组合处理增强了这种效果。此外,nutlin-3a处理增强了对于xvir-n-31和帕博西尼的组合观察到的细胞杀伤。
[0922]
实施例27.3对t24shrb细胞的包含xvir-n-31、nutlin-3a和帕博西尼的三联疗法
[0923]
使用t24shrb细胞进行与实施例27.2相同的效能测定。t24shrb细胞是没有rb表达的t24细胞。这种缺乏rb表达是通过慢病毒转染产生的,其中所述慢病毒编码针对rb的shrna。使用的慢病毒载体是plko-rb1-shrna19(从addgene,watertown,ma 02472,usa获得),shrna的序列如下:cagagatcgtgtattgagattctcgagaatctcaatacacgatctctg(seq id no 39)。michaud k等人(cancer res.2010年4月15日70(8):3228-38)也描述了该程序。
[0924]
结果如图46和47所示。
[0925]
从图46和47可以明显看出,单独用nutlin-3a或帕博西尼处理在xvir-n-31杀死rb阴性细胞(t24shrb)方面无效。只有帕博西尼和nutlin-3a的组合显示xvir-n-31介导的细胞杀伤增加。因此,nutlin-3a增强了使用xvir-n-31和帕博西尼处理rb阴性细胞的双重联合疗法的溶瘤作用。
[0926]
实施例27.4对t24细胞和t24shrb细胞的包含xvir-n-31、idasanutlin和帕博西尼的三联疗法
[0927]
使用t24细胞进行效能测定以确定xvir-n-31、xvir-n-31与idasanutlin、xvir-n-31与帕博西尼以及xvir-n-31、idasanutlin和帕博西尼的细胞杀伤作用。
[0928]
结果如图48和49所示。
[0929]
使用t24shrb细胞进行类似的效能测定以确定xvir-n-31、xvir-n-31与idasanutlin、xvir-n-31与帕博西尼以及xvir-n-31、idasanutlin和帕博西尼的细胞杀伤作用。
[0930]
结果如图50和51所示。
[0931]
从图48到51可以明显看出,在使用xvir-n-31和cdk4/6抑制剂的三联疗法中,idasanutlin具有与nutlin-3a相似的效果。
[0932]
实施例27.5在实施例27.2至27.4的条件下评估xvir-n-31的复制
[0933]
通过使用δδct方法测定病毒dna来评估xvir-n-31在t24shrb细胞和t24细胞中的复制。
[0934]
实验设置如下:
[0935]
在24和48小时后确定病毒复制。在用nutlin-3a、帕博西尼或两者(组合)处理后24小时,用20moi的xvir-n-31发生感染。4和48小时后分离dna并进行实时pcr以确定病毒复制。根据δδct方法将获得的结果归一化为β-肌动蛋白和4小时值。
[0936]
结果如图52所示。
[0937]
从图52可以明显看出,nutlin-3a与帕博西尼组合显示病毒dna增加。虽然在帕博西尼处理的t24细胞中相对尾丝dna已经很高,但与nutlin-3a的组合显示出比未经处理的对照高近10倍的值。在rb阴性t24shrb细胞中,仅当组合nutlin-3a、帕博西尼和xvir-n-31时才会出现这种效果。在这里,与对照相比,单独的帕博西尼对病毒dna的影响不太明显。
[0938]
对用nutlin-3a(5μm、10μm或30μm)、帕博西尼(500μm)或两者(组合)处理的t24shrb细胞进行蛋白质印迹分析。结果如图53所示。
[0939]
用帕博西尼和/或nutlin-3a(nutlin-3a(5μm 10μm或30μm)、帕博西尼(500μm)或两者(组合))处理后的图53所示的e2f1蛋白水平如图54所示。未处理细胞的e2f1蛋白水平设置为“1”。
[0940]
从图53和54可以明显看出,与单一疗法相比,使用30μm nutlin-3a和500nm帕博西尼的组合处理降低了e2f1的相对量。
[0941]
实施例27.6从实施例27.5的处理获得的细胞的facs分析
[0942]
对如实施例27.5中所述处理的细胞进行facs分析。此外,对umuc细胞和rt112细胞进行与实施例27.5中所述相同的处理方案。
[0943]
结果示于图55(a),t24细胞;图55(b),t24shrb细胞;图55(c),umuc-3细胞;和图55(d),rt112细胞。
[0944]
关注在g1中细胞百分比的图55(a)-(d)中所示结果的进一步分析结果示于图56(a)(t24细胞),图56(b)(t24shrb细胞),图56(c)(unuc-3细胞),t和图56(d)(rt112细胞)中。
[0945]
从所述图55(a)-(d)和图56(a)-(d)可以明显看出,当用nutlin-3a和帕博西尼组合处理时,对所有细胞系中g0/g1阻滞的影响最为明显。
[0946]
实施例28:包含布罗莫结构域抑制剂jq1和xvir-n-31的联合疗法治疗成胶质细胞瘤
[0947]
将2x104细胞(u87细胞、ln229细胞或t98g细胞)接种在dmem培养基中的12孔板中,并在第二天进行抑制剂处理。接种后48小时,用xvir-n-31感染细胞。4天后,使用10%tca固定细胞。使用0.1%srb溶液对板进行染色。除去多余的并用1%乙酸洗涤板。除去乙酸后,将板风干过夜。将srb溶解在1ml的10mm tris碱溶液中,并使用光度计在560nm处测量1∶10的稀释度。
[0948]
结果如图57,58和59所示。
[0949]
从图57、58和59可以明显看出,jq1和xvir-n-31的组合导致强烈增强的细胞杀伤。使用cdk4/6抑制剂lee011可以在所有三种成胶质细胞瘤细胞系中进一步增加细胞杀伤。
[0950]
实施例29:xvir-n-31在暴露于jq1和瑞博西尼的组合后的复制
[0951]
将1x105个细胞接种在dmem培养基中的6孔板中。第二天,细胞用500nm lee011和50nm jq1处理。第二天早上,细胞分别用20moi感染u87和ln229,50moi感染t98g。感染一小时后,将含有抑制剂的dmem培养基添加到细胞上。在每个时间点(4、24、48小时)后,用pbs洗涤细胞一次,并加入200μl sds dna裂解缓冲液。在进行苯酚-氯仿-异戊醇纯化之前,将细胞与蛋白酶k一起温育1小时。dna在1xte缓冲液中稀释,并使用nanodrop测定dna的浓度。对于每个样品,制备10ng/μl的溶液,并使用50ng dna和gotaq master mix进行rt-qpcr。使用了特异性尾丝正向和反向引物,并且还使用了特异性肌动蛋白引物来计算δct值。对于每个样品,测量了3个尾丝和2个肌动蛋白值。计算在excel中完成,每24和48小时根据其4小时值(初始病毒进入,复制前)计算。
[0952]
结果如图60,61和62所示。
[0953]
从图60、61和62可以明显看出,当暴露于jq1时,xvir-n-31显示出高度的复制增加。在两个细胞系中,与使用cdk4/6抑制剂lee011(lee)相比,这种效果要高得多。在所有三种细胞系中,当同时使用jq1和lee011(lee)两者的组合时,病毒复制的增加最高。
[0954]
实施例30xvir-n-31感染癌细胞的蛋白质印迹分析
[0955]
将2.5x105ln229细胞接种在dmem培养基中的10cm平板中。第二天,细胞用500nm lee011和200nm jq1或两者的组合处理。第二天早上,细胞用20moi的xvir-n-31感染。感染一小时后,将含有抑制剂的dmem培养基添加到细胞上。在每个时间点(24、48、72小时)后,将细胞置于冰上,用冰冷的pbs洗涤两次,并加入300μl sds蛋白裂解缓冲液。将细胞转移到反应管中,用注射器和针头剪切dna,离心后转移上清液以供进一步使用。使用bca测定法测量蛋白质浓度,并产生具有4x∶dtt6∶1和20μg浓度(concertation)的样品并转移到10%sds凝胶中。凝胶电泳从90v开始,在梯度开始分离后增加到150v。凝胶上的蛋白质在100v下被印迹到膜上2小时,并在室温下在tbs-t中的5%牛奶中封闭1小时。在tbs-t中洗涤后,根据制造商的信息在4℃下加入一抗过夜。使用的抗体针对所有时间点的gapdh、e1a、dbp、e2f1、rb、prb,以及另外地针对72小时样品的胱天蛋白酶3和parp的全长和切割形式。第二天,重复洗涤并在室温下添加二抗1小时。洗涤后,使用ecl通过chemidoctm mp成像系统对化学发光进行成像。
[0956]
结果如图63,64,65和66所示。
[0957]
如图63所示,病毒蛋白e1a和dbp通过xvir-n-31与500nm lee011或/和200nm jq-1的组合处理而增加。这些样品中的细胞蛋白rb和prb仍然受到抑制(泳道5、6和7)。
[0958]
如图64所示,病毒蛋白e1a和dbp通过xvir-n-31与lee011或/和jq-1的组合处理而增加。细胞蛋白rb和prb在这些样品中仍然受到抑制,而e2f-1在这些样品中稳定(泳道5、6和7)。
[0959]
如图65所示,通过xvir-n-31与lee011或/和jq-1的组合处理,病毒蛋白e1a和dbp增加,而这些样品中的细胞蛋白rb减少并且e2f1增加。此外,在48kda处可见rb的切割产物,这表明细胞凋亡(fattman,cheryl l.;delach,scott m.;dou,qing ping;johnson,daniel e.(2001):sequential two-step cleavage of the retinoblastoma protein by caspase-3/-7during etoposide-induced apoptosis.in:oncogene 20(23),s.2918-2926.)。
[0960]
如图66所示,胱天蛋白酶3和parp存在于所有细胞裂解物中,即使在对照中也是如此。不仅通过切割的parp抗体检测切割的parp,而且还通过全长parp抗体检测切割的parp。切割的parp仅在受感染的细胞中可见,并且其存在通过用lee011和jq1处理而增加。这种切割是细胞凋亡的标志(chaitanya等人:parp-1cleavage fragments:signatures of cell-death proteases in neurodegeneration.cell communication and signaling2010 8:31)。
[0961]
实施例31:成胶质细胞瘤中jq1对不同腺病毒的影响
[0962]
腺病毒e1a由不同的保守区(cr)组成,该保守区结合各种细胞蛋白并干扰它们的功能。cr1与p300/cbp结合,后者也可与cr3结合。cr3的其他区域可以结合不同的介质复合物亚基,例如med23,因此在e1a对其他病毒早期基因的反式激活中发挥作用。腺病毒区域cr1以及cr2能够结合rb。这种相互作用导致e2f的释放和随后的细胞周期进程。此外,e2f结合腺病毒e2的早期启动子并激活其转录。
[0963]
e1a的相互作用配偶体和保守区cr1-cr4的位置如图67所示。
[0964]
为了找出e1a的哪些保守区域对于jq1增强病毒复制的作用是必不可少的,使用了具有不同缺失和突变的腺病毒。野生型腺病毒用作对照,其含有rgd基序以获得更好的感染性和含有e3缺失以获得未受损的抗病毒反应。其他病毒是dl119,其中n-末端和cr1和cr2被缺失,adδ24在cmv启动子的控制下并且缺乏cr2。作为cr3缺失病毒xvir-n-31被使用,它还包含rgd基序和e3缺失以及e1b-19k缺失以增强细胞凋亡。另一种使用的病毒是adwt/e2fm。该病毒在e2早期启动子的e2f结合位点中包含突变,其阻断了e2f的结合。这些特征再次总结如下:
[0965]
adwt:野生型e1a
[0966]
xvir-n-31:δcr3 e1a
[0967]
dl119:δcr1和δcr2 e1a
[0968]
addelta24:δcr2 e1a
[0969]
adwt/e2fm:野生型e1a
[0970]
将1x105个细胞接种在dmem培养基中的6孔板中。第二天,细胞用20moi的不同病毒(adwt、dl1l9、addelta24、xvir-n-31、adwt/e2fm)感染。感染1小时后,将dmem培养基或含有200nm jq1的dmem培养基添加到细胞上,使细胞在有或没有jq1处理的情况下被感染。在每个时间点(4、24、48小时)后,用pbs洗涤细胞一次,并加入200μl sds dna裂解缓冲液。在进行苯酚-氯仿-异戊醇纯化之前,将细胞与蛋白酶k在56℃下温育15分钟。dna在ae缓冲液中稀释,并使用nanodrop测定dna的浓度。对于每个样品,制备10ng/μl的溶液,并使用50ng dna和gotaq master mix进行qpcr。使用了特异性尾丝正向和反向引物,并且还使用了特异性肌动蛋白引物来计算δct值。对于每个样品,测量了3个尾丝和3个肌动蛋白值。计算在excel中完成,并且基于其4小时值(初始病毒进入,复制前)和关于未处理的感染样本的通过jq1的复制增加,计算每24和48小时。
[0971]
各种引物的核苷酸序列如下:
[0972]
b-肌动蛋白正向引物taagtaggtgcacagtaggtctga (seq id no:40)
[0973]
b-肌动蛋白反向引物aaagtgcaaagaacacggctaag(seq id no:41)
[0974]
尾丝正向引物aagctagccctgcaaacatca (seq id no:42)
[0975]
尾丝反向引物cccaagctaccagtggcagta (seq id no:43)
[0976]
结果如图68和69所示。
[0977]
在各种病毒中,xvir-n-31在48小时后在jq1的影响下表现出最高的病毒复制增加,表明cr3缺失的病毒从jq1的处理中获益最大。
[0978]
实施例32:xvir-n-31和jq-1在膀胱癌中的双重治疗
[0979]
作为第一个方面,评估了xvir-n-31的复制。
[0980]
将2.5x104个umuc-3细胞接种在dmem培养基中的12孔板中。第二天,细胞用jq-1(引发)或dmem培养基处理。第二天早上,用10moi的xvir-n-31感染细胞。感染一小时后,将含有jq-1的dmem培养基添加到细胞上(并发处理)。在每个4和24小时后,用pbs洗涤细胞一次,并加入200μl sds dna裂解缓冲液。在进行苯酚-氯仿-异戊醇纯化之前,将细胞与蛋白酶k温育至少1小时。dna在1xte缓冲液中稀释,并使用nanodrop测定dna的浓度。对于每个样品,制备15ng/μl的溶液,并使用75ng dna和gotaq master mix进行rt-qpcr。使用了特异性尾丝正向和反向引物,并且还使用了特异性肌动蛋白引物来计算δct值。对于每个样品,测量了3个尾丝和3个肌动蛋白值。计算在excel中完成,每24小时值根据其4小时值(初始病毒进入,复制前)计算。
[0981]
结果如图70所示。
[0982]
从图70可以明显看出,引发本身对xvir-n-31复制没有有益影响。图中所示的引发的轻微积极影响是由于实验装置中的冲洗不足造成的。与jq-1的并发处理对于双重疗法的成功至关重要,而与并发处理相比,先前添加jq-1(引发)导致效率降低。
[0983]
作为第二个方面,评估了xvir-n-31的颗粒形成。
[0984]
通过六邻体蛋白的免疫组织化学染色(六邻体滴度测试)分析病毒颗粒的产生。因此,将每孔2x105个贴壁hek293细胞接种在24孔板中。将在感染后指定时间点和指定与jq-1并发处理后收集的细胞培养物样品用三个循环解冻-冷冻预处理,以从细胞中释放病毒颗粒,然后连续稀释。hek293细胞以每个样品50μl或10μl的体积被感染。然后将板在37℃和10%co2下温育40小时,然后检查可检测的细胞病变效应。吸出培养基,将板干燥5-10分钟,然后在-20℃下通过加入冰冷的甲醇10分钟固定细胞。将孔用pbs 1%bsa洗涤两次。加入一抗(山羊抗六邻体,1∶500),将板在37℃下温育1小时,然后用pbs 1%bsa洗涤两次。接下来,加入二抗(兔抗山羊hrp缀合物,1∶1000)并在37℃下温育1小时。再次,在添加dab溶液之前,用含有1%bsa的pbs洗涤孔两次。温育30分钟后,在20倍显微镜物镜下对每孔10个不同的随机视野(f.o.v.)进行计数。对计数迭代进行平均,并根据此公式计算每毫升感染性颗粒:
[0985][0986]
结果如图71和72所示
[0987]
从图71可以明显看出,在添加500nm jq-1后,umuc-3细胞中xvir-n-31的颗粒形成显著增加。此外,xvir-n-31的颗粒形成的动力学通过与500nm jq-1的并发处理得到高度加速。
[0988]
作为第三方面,进行了蛋白质印迹分析。
[0989]
将1x106个umuc-3细胞接种在dmem培养基中的10cm板中,并在接种后24小时用10moi xvir-n-31感染。感染后1小时,用dmem或掺有500nm jq-1的dmem重新填充培养基。在
12、24、36和48h.p.i,使用sds缓冲液获取总蛋白质的裂解物。应用bca测定来调整等效蛋白质浓度。然后,用缓冲液补充蛋白质样品,并通过sds-pa凝胶电泳在10%pa-gels上进行分离。使用biorad wet tank system将样品印迹到pvdf膜上。这些膜在室温下用含有5%脱脂奶粉的tbs-吐温缓冲液封闭1小时。在4℃下用一抗温育过夜,在室温下用hrp缀合的二抗温育1小时。使用ecl prime(pierce)和chemidoc成像系统(biorad)检测化学发光。图表在illustrator中设计,并使用imagelab进行评估。
[0990]
结果如图73所示。
[0991]
从图73可以明显看出,通过jq-1并发处理高度加速了xvir-n-31病毒蛋白(e1a、e1b55k、dbp和e40rf6)的绝对病毒蛋白表达和最重要的动力学。由于jq-1处理,特别是后来的病毒蛋白(如六邻体)在感染xvir-n-31后的早期时间点以高水平表达。
[0992]
实施例33:使用xvir-n-31、帕博西尼和jq-1的膀胱癌三联疗法
[0993]
作为第一个方面,在dna染色后,通过流式细胞术分析以其指定浓度应用的小分子抑制剂对膀胱癌细胞系umuc-3和rt112的细胞周期的影响。
[0994]
为此,将5x104个细胞umuc-3和rt112分别接种在6孔板中,24小时后用适当的抑制剂处理。一天后,在大约80%汇合(confluency)时,用pbs洗涤细胞,胰蛋白酶化,再次洗涤并用冰冷的80%乙醇固定。对于细胞周期分析,样品与dna嵌入染料7-氨基放线菌素d(7-aad)一起温育并通过facs分析进行测量。通过软件flowjo对测量数据进行评估。
[0995]
结果如图74所示。
[0996]
从图74可以明显看出,帕博西尼在细胞周期的g1期中诱导了有效的阻滞。jq-1作为单一疗法或与帕博西尼组合使用对细胞周期没有显著影响。值得注意的是,jq-1以相对较低的浓度应用,这仍然足以强烈增强xvir-n-31的溶瘤潜力。在已发表的科学文献中发现了更高剂量的jq-1诱导g1或g2阻滞的不确定数据。然而,低剂量的jq-1不影响细胞周期。
[0997]
作为第二方面,量化了用jq-1和帕博西尼处理后特定细胞靶蛋白的表达水平。
[0998]
将1-2x106个umuc-3或rt-112细胞接种在dmem培养基中的10em平板中,并在接种后24小时用相应的小分子抑制剂处理。在处理后24小时,使用sds缓冲液获取总蛋白质的裂解物。应用bca测定来调整等效蛋白质浓度。然后,用缓冲液补充蛋白质样品,并通过sds-pa凝胶电泳在10%pa-gel上进行分离。使用biorad wet tank system将样品印迹到pvdf膜上。这些膜在室温下用含有5%脱脂奶粉的tbs-吐温缓冲液封闭1小时。在4℃下用一抗温育过夜,在室温下用hrp缀合的二抗温育1小时。使用ecl prime(pierce)和chemidoc成像系统(biorad)检测化学发光。图表在illustrator中设计,并使用imagelab进行评估。
[0999]
结果如图75所示。
[1000]
从图75中可以明显看出,无论是在单一疗法中还是在与帕博西尼的组合中,jq-1在指定浓度下对细胞周期调节剂rb、磷酸化-rb或e2f-1蛋白水平没有任何影响。rna-聚合酶ii阻遏物hexim1在jq-1处理后被下调,但与帕博西尼组合使用得以挽救。因此,细胞周期蛋白rb和e2f-1不负责xvir-n-31在jq-1处理下复制能力的增加。
[1001]
作为第三方面,三联疗法的细胞杀伤效能使用效能测定来确定。
[1002]
将1-3x104细胞接种在dmem或rpmi培养基中的12孔板中,并在第二天进行抑制剂
处理。接种后48小时,用xvir-n-31感染细胞。4天后,使用10%tca固定细胞。使用0.1%srb溶液对板进行染色。除去多余的并用1%乙酸洗涤板。除去乙酸后,将板风干过夜。将srb溶解在1ml的10mm tris碱溶液中,并使用光度计在560nm处测量1∶10的稀释度。
[1003]
结果如图76,77和78所示。
[1004]
从图76、77和78可以明显看出,与低剂量帕博西尼和jq-1一起处理使xvir-n-31,即使在低moi下,也能完全消除体外膀胱癌细胞存活,如在膀胱癌细胞umuc-3、rt112和t24中的每一个或任一个中看到的相应效果。
[1005]
作为第四方面,评估了这种三联疗法对病毒复制的影响。
[1006]
将2-5x104个umuc-3、t24或rt112细胞接种在dmem或rpmi培养基中的12孔板中。第二天,细胞用jq1,帕博西尼(引发)或培养基处理。第二天,用10,20,或50moi的xvir-n-31感染细胞。感染一小时后,将含有jq-1或帕博西尼的培养基添加到细胞上。在4和24小时后,用pbs洗涤细胞一次,并加入200μl sds dna裂解缓冲液。在进行苯酚-氯仿-异戊醇纯化之前,将细胞与蛋白酶k一起温育至少1小时。dna在1xte缓冲液中稀释,并使用nanodrop测定dna的浓度。对于每个样品,制备15ng/μl的溶液,并使用75ng dna和gotaq master mix进行rt-qpcr。使用了特异性尾丝正向和反向引物,并且还使用了特异性肌动蛋白引物来计算δct值。对于每个样品,测量了3个尾丝和3个肌动蛋白值。计算在excel中完成,每24小时值根据其4小时值(初始病毒进入,复制前)计算。
[1007]
结果如图79,80和81所示。
[1008]
从图79、80和81中可以明显看出,用低剂量的帕博西尼和jq-1进行额外处理可将xvir-n-31复制高度加速高达200倍。
[1009]
作为第五方面,评估了这种三联疗法对生产性(productively)感染的肿瘤细胞的影响。
[1010]
通过感染的umuc-3细胞的六邻体蛋白的直接免疫组织化学染色(伪六邻体滴度测试)分析生产性感染的肿瘤细胞的数量。因此,将每孔5x105个umuc-3细胞接种在12孔板中。第二天,细胞用低剂量的jq-1和帕博西尼引发。接种后48小时,然后用xvir-n-31(9moi)感染细胞,并在1小时后用相应的抑制剂并发处理。然后将板在37℃和10%co2下温育40小时,然后检查可检测的细胞病变效应。吸出培养基,将板干燥5-10分钟,然后通过在-20℃下加入冰冷的甲醇10分钟固定细胞。将孔用pbs 1%bsa洗涤两次。加入一抗(山羊抗六邻体,1∶500),将板在37℃下温育1小时,然后用pbs 1%bsa洗涤两次。接下来,加入二抗(兔抗山羊hrp缀合物,1∶1000)并在37℃下温育1小时。再次,在添加dab溶液之前,用含有1%bsa的pbs洗涤孔两次。温育30分钟后,在20倍显微镜物镜下对每孔10个不同的随机视野(f.o.v.)进行计数。
[1011]
结果如图82和83所示。
[1012]
从图82和83可以明显看出,用低剂量的帕博西尼和jq-1进行额外处理会大大加速通过xvir-n-31生产性感染的肿瘤细胞数量。
[1013]
实施例34:不同bet抑制剂和bet降解剂与xvir-n-31组合在umuc3-和rt112细胞系中的作用
[1014]
该研究的目的是确定xvir-n-31与包括降解剂在内的不同bet(布罗莫结构域和额外末端基序)抑制剂组合的功效。bet抑制剂(beti):otx015(单价)、azd5153(二价)竞争性
抑制bet;bet降解剂(betd):dbet6、arv55导致bet降解。(参见,例如,rhyasen gw,等人azd5153a novel bivalent bet bromodomain inhibitor highly active against hematologic malignancies.mol cancer ther.2016nov;15(11):2563-2574;j.kay noel,等人摘要c244 development of the bet bromodomain inhibitor otx015.mol cancer ther 2013年11月12;c244;winter ge,等人:bet bromodomain proteins function as master transcription elongation factors independent of cdk9 recruitment.mol cell.2017年7月6日;67(1):5-18.e19).raina k,等人:protac-induced bet protein degradation as a therapy for castration-resistant prostate cancer.proc natl acad sci u s a 2016年6月28日;113(26):7124-9;其公开内容通过引用并入本文。)
[1015]
在第一方面,通过效能测定分析在xvir-n-31感染与beti和betd处理组合后umuc3和rt112细胞的细胞存活率。
[1016]
将1.3x104个umuc-3细胞和3x104个rt112细胞接种在dmem或rt112培养基中的12孔板中。第二天,用指定浓度的beti和betd预处理细胞。接种后48小时,细胞用溶瘤腺病毒xvir-n-31感染,并用beti和betd处理。5天后,使用10%tca固定细胞。使用0.05%srb溶液对板进行染色。除去多余的并用1%乙酸洗涤板。除去乙酸后,将板风干过夜。将srb溶解在500μl的10mm tris碱溶液中,并使用光度计在562处测量1∶10的稀释度。
[1017]
结果如图84和85所示。
[1018]
从图84和85可以明显看出,beti和betd与xvir-n-31病毒的组合在两种细胞系中具有协同作用,并导致细胞存活率大大降低。
[1019]
在第二方面,通过qpcr分析了beti和betd对umuc-3和rt112细胞系中尾丝dna的病毒复制的影响。
[1020]
将3x104个umuc-3细胞和4x104个rt112细胞接种在dmem或rpmi培养基中的12孔板中。第二天,细胞用beti和betd预处理。接种后48小时,细胞用10moi(对于umuc-3)和50moi(对于rt112)感染,并用指定浓度的beti和betd处理。在每个时间点(4、24小时)后,用pbs洗涤细胞一次,并加入200μlsds dna裂解缓冲液。在进行苯酚-氯仿-异戊醇纯化之前,将细胞与蛋白酶k一起温育。dna在无dnase水中稀释,并使用nanodrop测定dna的浓度。对于每个样品,制备15ng/μl的溶液,并使用75ng dna和gotaq master mix进行rt-qpcr。使用了特异性尾丝正向和反向引物,并且还使用了特异性肌动蛋白引物来计算δct值。对于每个样品,测量了3个尾丝和3个肌动蛋白值。计算在excel中完成,并且每24小时根据其4小时值(初始病毒进入,复制前)计算。
[1021]
结果如图86和87所示。
[1022]
从图86和87可以明显看出,在感染后24小时,用beti和betd处理高度增加了xvir-n-31的复制。在两种细胞系中,病毒复制的增加在与二价beti azd5153组合时最高,表明二价抑制剂通常更适合与xvir-n-31组合。
[1023]
实施例35:cdk 4/6抑制剂瑞博西尼与xvir-n-31在肉瘤异种移植裸鼠模型中的组合
[1024]
方法
[1025]
动物研究
[1026]
对于人肉瘤异种移植模型,在10-20周龄小鼠的右侧皮下(s.c.)注射pbs中的
3x106a673肿瘤细胞。每2-3天测量肿瘤大小,并使用公式体积=0.5x长x宽2计算肿瘤体积。在肿瘤体积超过100-150mm3后,将小鼠随机分为指定的处理组/对照组:pbs(即不含lee011的0.5%甲基纤维素和pbs,瘤内[i.t.]),lee(即含lee011的0.5%甲基纤维素和pbs,i.t.),仅xvir(即不含lee011的0.5%甲基纤维素和xvir-n-31,i.t.)和组合(即含lee011的0.5%甲基纤维素和xvir-n-31,i.t.)。然后,各动物通过口服管饲法在第x天(dx)直到第x 4天(dx 4)接受瑞博西尼琥珀酸盐(lee011)200mg/kg体重(溶解在0.5%甲基纤维素中)或接受模拟对照(不含lee011的0.5%甲基纤维素)。在第x 1天(dx 1)和第x 3天(dx 3)将1x10
11
vp的xvir-n-31或pbs(分别在50μl中)i.t.注射。在第x 5天,处死来自仅xvir处理组和组合处理组的3只代表性动物,用于组织病理学评估和外植肿瘤中病毒复制的量化。测量剩余小鼠的肿瘤大小,直到肿瘤体积超过1000mm3并处死小鼠。
[1027]
动物研究的实验设计如图88所示
[1028]
统计分析
[1029]
使用开放访问网络工具tumgrowth(https://kroemerlab.shinyapps.io/tumgrowth)分析体内肿瘤生长。简而言之,对肿瘤体积的测量数据进行线性混合效应建模,允许纵向肿瘤生长斜率比较以及在所需时间点的治疗反应评估(横断面分析)。p值由软件计算,使用ii型anova和选择的成对比较进行纵向和横截面分析(如果有说明,则进行holm调整)。使用prism 5(graphpad软件,圣地亚哥,ca,usa)生成肿瘤生长曲线。使用平均肿瘤体积和平均值的标准误差(sem)绘制肿瘤生长曲线。p值<0.05被认为统计学显著(*p<0.05;**p<0.005;***p<0.0005)。
[1030]
结果-联合疗法和单一疗法在异种移植裸鼠模型中的效果
[1031]
为了检查所提出的组合策略的生物学相关优势是否也可能转化为可能的治疗益处,在免疫受损的裸鼠中评估了异种移植a673肉瘤细胞的肿瘤控制。应用开放访问网络工具tumgrowth,与用单一疗法(lee或仅xvir)或对照(pbs)处理的动物相比,接受组合处理(组合)的动物的肿瘤生长控制显著增加。在治疗开始后的第12-21天观察到组间处理反应的最大差异。(值得注意的是,与xvir-n-31相比,接受组合的代表性动物的外植肿瘤中病毒复制显著增加。)
[1032]
结果如图89,90和91所示。纵向分析的选择的成对比较如下表所示:
[1033][1034]
图29、30和31中显示的结果清楚地表明,包含xvir-n-31和瑞博西尼的联合疗法比单独的xvir-n-31或瑞博西尼更有效。
[1035]
在前述说明书、权利要求书和附图中公开的本发明的特征对于在本发明的各种实施方案中实现本发明是重要的,其既可以是单独的,也可以是以任何组合的方式。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。