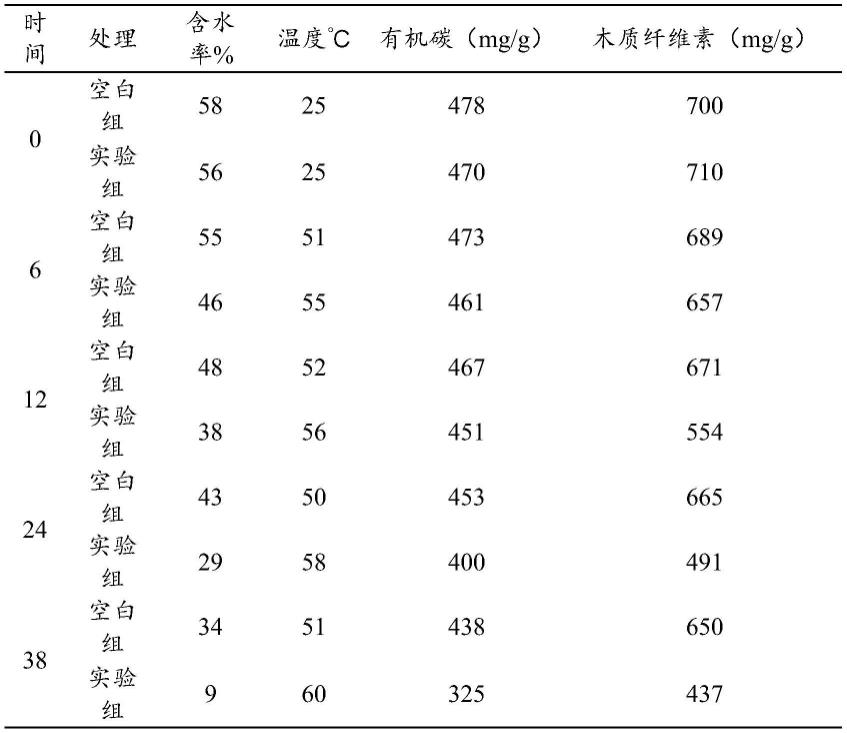
1.本发明属于生物技术领域,具体涉及一种高活性植物凝集素的分离纯化工艺。
背景技术:
2.豆科植物凝集素(phytohemagglutinin,pha)是一种从豆科植物种子中提取的糖基化修饰蛋白,是由两种高同源性而生物活性不同的亚基构成的四聚体糖蛋白,其包括e亚基组成的红细胞凝集素(pha-e),以及l亚基组成的白细胞凝集素(pha-l)。pha-e具有较高的凝血活性,可以促使红细胞凝集,pha-l具有较高的有丝裂原活性。其中,pha多作为高效免疫增强剂在生物医学领域使用,其主要是因为pha-l可与哺乳动物血细胞(如淋巴细胞)上的蛋白糖基结合,产生非特异性刺激活性,促使淋巴细胞分裂增值,具有多种免疫效应,如可作为作为生物免疫反应因子用于评估机体的免疫机能。
3.盐析法纯化蛋白时,具有处理工艺简单,处理量大的、成本低廉、不会破坏蛋白结构的优势。因此在传统的pha的提取工艺中,常采用盐析沉淀作为粗纯方法,离子交换与凝胶过滤层析联用作为进一步的精纯方法,具体为:粉碎,浸泡提取浸提液
→
硫酸铵分级沉淀
→
deae阴离子交换层析
→
凝胶过滤层析。现有的植物凝集素分离纯化工艺主要还是沿用常规的蛋白纯化方法,为了进一步提高纯度,一般会通过多次离子交换层析或凝胶过滤层析后才能获得较高纯度的植物凝集素,并且硫酸铵分级沉淀后需要进行换液透析。如王超等人在《豆类凝集素的提取分离及纯化》中,采用硫酸铵分级沉淀进行凝集素的纯化,deae-52阴离子交换层析柱
→
superdex-200层析柱进行分离纯化。如陈高等人在《菜豆鲜荚中菜豆凝集素的提取与分离纯化工艺研究》中,采用硫酸铵分级沉淀、deae-52阴离子交换层析和superdex-200凝胶过滤层析的组合方法用于分离纯化菜豆凝集素;肖俊琪等人在《赤小豆凝集素的分离纯化及电泳分析》中,采用硫酸铵分级沉淀进行粗纯,q sepharose xl阴离子交换柱
→
疏水层析色谱
→
凝胶过滤层析进行进一步分离纯化。
4.此外,亲和层析法也常用于凝集素的纯化提取,如张柏林等人在《大豆凝集素纯化及凝集活性测定的研究》中采用n-乙酰基-d-半乳糖胺-epoxy-sepharose 6b亲和层析体系进行大豆凝集素的精纯,提纯的大豆凝集素各条带在30kd,凝集素纯度高。虽然亲和层析法能满足高纯度、高得率以及纯化步骤少等要求,但较高的填料成本以及无法在较长色谱柱中或批量分离的局限性,使得亲和层析法的应用目前仅局限于实验室阶段,无法大批量工业化生产。
5.虽然以上方法均是对植物凝集素(pha)的纯化提取方法,但实际得到的pha均是包含了e亚基和l亚基的四聚体混合物,其无法将植物凝集素的e亚基和l亚基进行进一步的分离纯化提取,且未对具有有丝分裂原活性的pha-l的纯度和活性进行进一步检测,将其用于免疫细胞的非特异性刺激剂时,容易导致测试样本的不确定率增加,难以反应免疫细胞的真实状态。cn112707958a公开了一种提取l型和e型植物凝集素的方法,其通过对豆子进行浸泡,破碎、离心、硫酸铵分级沉淀等步骤进行蛋白粗提,然后通过疏水层析和离子交换层析对l型和e型植物凝集素进行分离和纯化,虽然可分别对pha-l和pha-e两种亚型进行分别
分离提取,但其仍然避免不了采用硫酸铵分级沉淀步骤。
6.由于现有工艺的局限,需要一种高效、适合大批量工业生产的高活性高纯度的pha-l天然豆科植物凝集素的提纯工艺。
技术实现要素:
7.本发明的目的在于克服现有技术的至少一个不足,提供一种高活性植物凝集素的分离纯化工艺。
8.发明人研究发现,在pha的提取过程中,盐析处理,特别是硫酸铵盐析处理,对pha的结构有一定的破坏,直接导致后续pha的分离纯化难以制备得到高活性、高纯度的pha。
9.本发明所采取的技术方案是:
10.一种利于得到高活性植物凝集素的分离纯化工艺,包括如下步骤:
11.步骤1:前处理:
12.将豆子使用纯水充分浸泡后,与缓冲液混合,破壁处理,得到浆液;
13.将浆液充分搅拌,使pha充分溶出;
14.调节浆液的ph为4.5~5.5,固液分离,取上清,得到pha粗提液;或固液分离,调节豆浆的ph为4.5~5.5后去除沉淀,取上清,得到pha粗提液;
15.步骤2:sp离子交换色谱纯化:
16.将pha粗提液上样在sp离子交换色谱柱,使用缓冲液梯度洗脱,收集得到pha洗脱液;
17.所述梯度洗脱用的缓冲液选自naac-hac缓冲液、柠檬酸-氢氧化钠缓冲液、磷酸氢二钠-柠檬酸、柠檬酸钠、磷酸氢二钠-磷酸二氢钾缓冲液中的至少一种;
18.步骤3:换液:
19.将pha洗脱液的缓冲体系切换为tris、hepes、mops、tea、磷酸氢二钾或硼酸钠缓冲液体系;
20.步骤4:deae离子交换色谱纯化:
21.使用deae离子交换色谱对换液后的pha洗脱液进行洗脱纯化,得到pha-l蛋白溶液。
22.在一些分离纯化工艺的实例中,步骤1中使用的所述缓冲液的ph=4.5~7.4。
23.在一些分离纯化工艺的实例中,步骤1中使用的所述缓冲液选自naac-hac缓冲液、柠檬酸-氢氧化钠缓冲液、磷酸氢二钠-柠檬酸、柠檬酸钠、磷酸氢二钠-磷酸二氢钾缓冲液中的至少一种。
24.在一些分离纯化工艺的实例中,步骤1中使用的所述缓冲液的浓度不超过50mm。
25.在一些分离纯化工艺的实例中,步骤2中使用的所述缓冲液的ph=4.5~7.4。
26.在一些分离纯化工艺的实例中,步骤2中使用的所述缓冲液的浓度不超过50mm。
27.在一些分离纯化工艺的实例中,步骤3中使用的所述缓冲液的浓度不超过50mm。
28.在一些分离纯化工艺的实例中,所述豆子脱皮后再与缓冲液混合。
29.在一些分离纯化工艺的实例中,经充分搅拌得到的所述浆液先经至少12h冷冻后,并经解冻复融,再调节浆液的ph为4.5~5.5。
30.在一些分离纯化工艺的实例中,所述豆子选自芸豆。
31.在一些分离纯化工艺的实例中,所述芸豆为红芸豆。
32.在一些分离纯化工艺的实例中,所述浆液搅拌的搅拌转速为300~400rpm。
33.在一些分离纯化工艺的实例中,所述浆液搅拌的搅拌时间不低于3h。
34.在一些分离纯化工艺的实例中,所述浆液搅拌的搅拌温度为2~10℃。
35.在一些分离纯化工艺的实例中,所述豆子与缓冲液混合比为1g:(3~10)ml。
36.在一些分离纯化工艺的实例中,步骤2中,洗脱液为nacl的缓冲液溶液,洗脱浓度依次为50mm、150mm两个梯度,每个梯度3~5个柱体积,收集150mm nacl的pha洗脱液;所述缓冲液为20mm的naac-hac缓冲液,ph=5.0。
37.在一些分离纯化工艺的实例中,步骤4中,洗脱液为nacl的缓冲液溶液,所述洗脱液中nacl的浓度为70mm,3~5个柱体积,收集pha-l蛋白溶液;所述缓冲液为20mm的tris缓冲液,ph=8.0。
38.本发明的有益效果是:
39.本发明一些实例的分离纯化工艺,操作简便,可以有效去除杂质,保留植物凝集素的活性,可以得到高纯度、高活性的植物凝集素。
40.本发明一些实例的分离纯化工艺,易于放大生产规模。
附图说明
41.下面结合附图,进一步说明本发明的技术方案。
42.图1是前处理阶段的电泳图;其中泳道1为芸豆浸泡破壁后离心得到的上清液1;泳道2为上清液1经冷冻复融后调至ph5.0,沉淀杂蛋白,离心后的上清液2。
43.图2是sp离子交换色谱纯化阶段的电泳图;其中泳道1为上清液2;泳道2为sp离子交换色谱上样的穿透液;泳道3-5为sp离子交换色谱20mm naac-hac(50mm nacl,ph5.0
±
0.1)的sp洗脱液1;泳道6为sp离子交换色谱20mm naac-hac(150mm nacl,ph5.0
±
0.1)的sp洗脱液2;泳道7为sp离子交换色谱20mm naac-hac(1m nacl,ph5.0
±
0.1)的sp洗脱液3。
44.图3是deae离子交换色谱纯化阶段的电泳图,其中泳道1-2为sp洗脱液2换液后的溶液;泳道3为deae离子交换色谱上样的穿透液;泳道4-6为deae离子交换色谱20mm tris(70mm nacl,ph8.0
±
0.1)的deae洗脱液1;泳道7-8为deae离子交换色谱20mm tris(100mm nacl,ph8.0
±
0.1)的deae洗脱液2;泳道9为deae离子交换色谱20mm tris(1m nacl,ph8.0
±
0.1)的deae洗脱液3。
45.图4是实施例3不同纯化工艺制备得到的pha蛋白成品电泳图,其中,泳道1为本发明制备得到的pha蛋白(上样2ug);泳道2为常规工艺制备得到的pha蛋白(上样2ug)。
46.图5是cm离子交换色谱洗脱液的电泳图,其中泳道1为cm离子交换色谱上样的穿透液;泳道2为cm离子交换色谱20mm naac-hac(50mm nacl,ph5.0
±
0.1)的cm洗脱液;泳道3为cm离子交换色谱20mm naac-hac(150mm nacl,ph5.0
±
0.1)的cm洗脱液;泳道4为cm离子交换色谱20mm naac-hac(1000mm nacl,ph5.0
±
0.1)的cm洗脱液。
具体实施方式
47.一种利于得到高活性植物凝集素的分离纯化工艺,包括如下步骤:
48.步骤1:前处理:
49.将豆子使用纯水充分浸泡后,与缓冲液混合,破壁处理,得到浆液;
50.将浆液充分搅拌,使pha充分溶出;
51.调节浆液的ph为4.5~5.5,固液分离,取上清,得到pha粗提液;或固液分离,调节豆浆的ph为4.5~5.5后去除沉淀,取上清,得到pha粗提液;
52.步骤2:sp离子交换色谱纯化:
53.将pha粗提液上样在sp离子交换色谱柱,使用缓冲液梯度洗脱,收集得到pha洗脱液;
54.所述梯度洗脱用的缓冲液选自naac-hac缓冲液、柠檬酸-氢氧化钠缓冲液、磷酸氢二钠-柠檬酸、柠檬酸钠、磷酸氢二钠-磷酸二氢钾缓冲液中的至少一种;
55.步骤3:换液:
56.将pha洗脱液的缓冲体系切换为tris、hepes、mops、tea、磷酸氢二钾或硼酸钠缓冲液体系;
57.步骤4:deae离子交换色谱纯化:
58.使用deae离子交换色谱对换液后的pha洗脱液进行洗脱纯化,得到pha-l蛋白溶液。
59.在一些分离纯化工艺的实例中,步骤1中使用的所述缓冲液的ph=4.5~7.4。
60.缓冲液对分离纯化的影响不显著。在一些分离纯化工艺的实例中,步骤1中使用的所述缓冲液选自naac-hac缓冲液、柠檬酸-氢氧化钠缓冲液、磷酸氢二钠-柠檬酸、柠檬酸钠、磷酸氢二钠-磷酸二氢钾缓冲液中的至少一种。
61.在一些分离纯化工艺的实例中,步骤1中使用的所述缓冲液的浓度不超过50mm。
62.在一些分离纯化工艺的实例中,步骤2中使用的所述缓冲液的ph=4.5~7.4。
63.在一些分离纯化工艺的实例中,步骤2中使用的所述缓冲液的浓度不超过50mm。
64.在一些分离纯化工艺的实例中,步骤3中使用的所述缓冲液的浓度不超过50mm。
65.在一些分离纯化工艺的实例中,所述豆子脱皮后再与缓冲液混合。这样可以减少后续处理的难度,延长色谱柱的使用寿命。
66.在一些分离纯化工艺的实例中,经充分搅拌得到的所述浆液先经至少12h冷冻后,并经解冻复融,再调节浆液的ph为4.5~5.5。
67.在一些分离纯化工艺的实例中,所述豆子选自芸豆。
68.在一些分离纯化工艺的实例中,所述芸豆为红芸豆。红芸豆中凝集素更多,是更佳的选择。
69.在一些分离纯化工艺的实例中,所述浆液搅拌的搅拌转速为300~400rpm。这样有利于pha的溶出。
70.在一些分离纯化工艺的实例中,所述浆液搅拌的搅拌时间不低于3h。这样有利于保证pha的充分溶出。
71.在一些分离纯化工艺的实例中,所述浆液搅拌的搅拌温度为2~10℃。这样可以减少pha的损失。
72.缓冲液以能够充分溶出pha为宜,可以根据实际情况调整豆子与缓冲液的比。在一些分离纯化工艺的实例中,所述豆子与缓冲液混合比为1g:(3~10)ml。这样既可使pha充分溶出,也可以有效减少缓冲液的用量。
73.在一些分离纯化工艺的实例中,步骤2中,洗脱液为nacl的缓冲液溶液,洗脱浓度依次为50mm、150mm两个梯度,每个梯度3~5个柱体积,收集150mm nacl的pha洗脱液;所述缓冲液为20mm的naac-hac缓冲液,ph=5.0。这样可以更好地对pha分离纯化。
74.在一些分离纯化工艺的实例中,步骤4中,洗脱液为nacl的缓冲液溶液,所述洗脱液中nacl的浓度为70mm,3~5个柱体积,收集pha-l蛋白溶液;所述缓冲液为20mm的tris缓冲液,ph=8.0。这样可以更好地对pha分离纯化。
75.下面结合实验,进一步说明本发明的技术方案。
76.实施例1:pha-l的分离纯化提取
77.前处理:
78.从2-8℃冰箱中取出保存良好的红芸豆进行称重,称量体重约1000
±
20g,加入纯水室温浸泡4-6h,脱皮机脱皮,按照每克红芸豆加入4ml 20mm naac-hac(缓冲液,ph=4.5-7.4),使用破壁机进行破壁,破壁后的溶液放置于2-8℃冰箱内的搅拌器上300-400rpm搅拌4h以上,经充分搅拌得到的所述浆液先经至少12h冷冻后,并经解冻复融,然后使用2m稀盐酸调节溶液ph至4.5-5.5,优选5.0,并将溶液分装至离心管中离心,离心力14000g以上,离心温度4℃条件下离心10-30min,取上清。
79.图1是不同处理后上清的电泳图。从图1中可以看出,浸泡的上清液调整ph值至5.0后,可以显著减少25、50kd的杂质。
80.sp离子交换色谱纯化:
81.按照每5g红芸豆1ml sp的量对柱子填料,静置30~45分钟后,用3~5个柱体积的纯化水清洗sp柱,之后对步骤一得到的上清进行上样纯化,具体为:
82.1)用3~5个柱体积的20mm naac-hac(ph5.0
±
0.1)充分平衡sp柱;
83.2)将步骤一得到的上清进样,进样结束后,继续用20mm naac-hac(ph5.0
±
0.1)平衡sp柱。待出现第一个峰(穿透峰)后,观察uv测定值,直至uv值回落基线水平;
84.3)用5个柱体积的20mm naac-hac(50mm nacl,ph5.0
±
0.1)洗脱纯化柱;
85.4)用5个柱体积的20mm naac-hac(150mm nacl,ph5.0
±
0.1)洗脱纯化柱,收集目的蛋白洗脱液(pha洗脱液),放置于2-8℃冰箱暂存。
86.图2是sp离子交换阶段的电泳图。从图2中可以看出在sp离子交换的纯化步骤中,50mm、150mm的nacl均可洗脱得到较多的pha蛋白(30kd左右)。
87.换液:
88.向pha洗脱液加入等体积的20mm tris(20mm nacl,ph8.0
±
0.1),使用切向流膜换液至少10次,将其换液成20mm tris(20mm nacl,ph8.0
±
0.1),放置2-8℃冰箱暂存。
89.deae离子交换色谱纯化:
90.按照每5g红芸豆1ml deae的量对柱子填料,静置30~45分钟,用3~5个柱体积的纯化水冲deae柱之后对步骤三换液后的溶液上样纯化,具体为:
91.1)用5个柱体积的20mm tris(20mm nacl,ph8.0
±
0.1)平衡deae柱;
92.2)将步骤三换液后的溶液进样,进样结束后,继续用20mm tris(ph8.0
±
0.1)平衡deae柱;待出现第一个峰(穿透峰)后,观察uv测定值,直至uv值回落基线水平;
93.3)用5个柱体积的20mm tris(70mm nacl,ph8.0
±
0.1)洗脱纯化柱,收集pha-l目的蛋白洗脱液,放置于2-8℃冰箱暂存;
94.4)去除内毒素:对pha-l目的蛋白洗脱液进行超滤浓缩,然后加入1%体积的tritonx-114,混匀后4℃静置30min,20000rpm离心,收集上清,即为去除内毒素后的pha-l溶液。
95.图3是deae离子交换阶段的电泳图。从图3中可以看出在deae离子交换的纯化步骤中,50mm、100mm、1m的nacl均可洗脱得到较多的pha蛋白(30kd左右),同时图3中的泳道4-6除了35kd的pha条带外,并无多余的杂蛋白条带,表明其分离得到的pha蛋白洗脱液的纯度>95%以上。
96.实施例2:pbmc细胞刺激活性验证
97.对前处理步骤、sp离子交换色谱(20mm naac-hac,ph5.0
±
0.1,50mm nacl、150mm nacl)两个洗脱梯度和deae离子交换色谱纯化步骤(20mm tris,ph8.0
±
0.1,20mm nacl、70mm nacl、1m nacl)三个洗脱梯度的洗脱液进行活性比较,具体方法为:
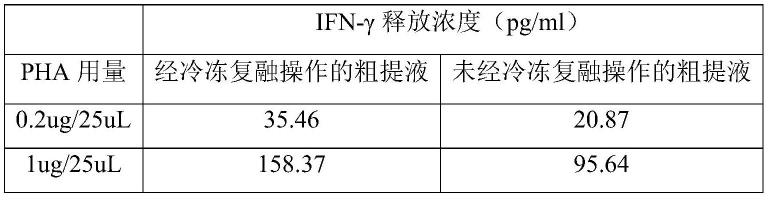
98.分别取前处理步骤的浆液、sp离子交换色谱和deae离子交换色谱纯化步骤中的洗脱液,根据bca测定的蛋白浓度(pha)为起始浓度,用无内毒素pbs稀释至终浓度为1ug/25ul、0.2ug/25ul。
99.在无内毒素的2ml离心管中分别加入25ul上述稀释后的洗脱液。
100.取一管冻存的pbmc细胞进行复苏,制备细胞悬浮液(1m/ml),在上述2ml的离心管中分别加入600ul细胞悬浮液。轻轻上下颠倒混匀,置于孵育器中,设置温度37℃,孵育时间18-22h。
101.参照广州市雷德生物科技有限公司《结核分枝杆菌特异性细胞免疫反应检测试剂盒(酶联免疫法)(国械注准20193400999)说明书操作,定量检测样本的ifn-γ含量。结果如表1所示。
102.表1:前处理步骤浆液活性比较
[0103][0104]
由表1可知,在前处理步骤中,经冷冻复融操作的pha粗提液的活性远高于未经冷冻复融的pha粗提液,表明经冷冻复融操作的pha粗提液中含有的pha-l的活性更高。
[0105]
表2:sp离子交换色谱洗脱液活性比较
[0106][0107]
由表2可知,sp离子交换色谱纯化中,150mm nacl洗脱液的细胞刺激活性更高,表明150mm的nacl洗脱液中分离得到的pha-l比50mm的nacl洗脱液多,含有的pha-l纯度更高,选用150mm nacl洗脱液进一步纯化。
[0108]
表3:deae离子交换色谱洗脱液活性比较
[0109][0110]
由表3可知,deae离子交换色谱中,70mm nacl洗脱液的刺激活性比100mm nacl、1m nacl洗脱液的刺激活性更高。70mm nacl洗脱液中pha-l占主要成分。
[0111]
实施例3:不同制备工艺对pha-l纯度和产量的影响
[0112]
将实施例1的前处理工艺与常规的pha提纯方法(含硫酸铵分级沉淀)进行对比。
[0113]
常规的pha提纯方法如下:
[0114]
步骤一:前处理。
[0115]
同本发明步骤一,芸豆不脱皮,离心获得上清。
[0116]
步骤二:硫酸铵分级沉淀。
[0117]
1)根据上述上清体积,计算需要加入固体硫酸铵至饱和度为40%。并边加入上清边搅拌溶解,溶解后放置室温继续搅拌10min,静置1h,将溶液分装至离心管中平衡,之后采用高速离心机设置离心力10000g,离心温度4℃条件下离心30min,收集上清;
[0118]
2)继续加入固体硫酸铵至饱和度为70%,待硫酸铵充分溶解后室温继续搅拌10min,静置1h,分装至离心管中平衡,之后采用高速离心机设置离心力10000g、离心温度4℃条件下离心30min,离心结束后,去上清,留蛋白沉淀;
[0119]
3)在蛋白沉淀中加入200ml的20mm tris(ph8.0
±
0.1)溶解(每100g芸豆用20ml进行溶解);
[0120]
4)使用20-100倍体积的20mm tris(ph8.0
±
0.1)作为透析液,2~8℃中透析4次,每次2h以上。
[0121]
步骤三:deae离子交换色谱纯化
[0122]
如本发明步骤四,收集20mm tris(50mm nacl,ph8.0
±
0.1)的洗脱液。
[0123]
步骤四:换液
[0124]
将上述收集的洗脱液,根据其体积,加入等体积的20mm naac-hac(ph5.0
±
0.1),使用切向流膜换液至少10将其换液成20mm naac-hac(ph5.0
±
0.1)。
[0125]
步骤五:sp离子交换色谱纯化
[0126]
如本发明步骤二,收集20mm naac-hac(150mm nacl,ph5.0
±
0.1)的洗脱液。
[0127]
步骤六:凝胶过滤
[0128]
1)用1-2个柱体积的缓冲液1
×
pbs(ph7.2
±
0.2)平衡tsk 3000sw预装柱;
[0129]
2)将浓缩后的sp纯化粗提品注入tsk 3000sw预装柱中;
[0130]
3)用1-2个柱体积的缓冲液1
×
pbs(ph7.2
±
0.2)洗脱,收集洗脱液,进行sds-page分析,如图4;
[0131]
4)用1个柱体积的纯化水清洗柱子,清洗结束后2个柱体积的20%乙醇溶液平衡tsk3000sw预装柱。
[0132]
由图4可知,本发明制备的pha上样2ug无肉眼可见杂带,纯度》95%;常规pha提纯工艺的pha在25、15kd附近有杂带,说明无法去除25kd与15kd的杂蛋白,其纯度《95%。
[0133]
表4:本发明制备方法与常规工艺的pha产量比较
[0134] 本发明常规工艺pha产量(mg/g芸豆)1.00.7
[0135]
由表4可知,使用本发明方法制备的pha产量比常规工艺制备的产量高约30%。
[0136]
表5:本发明制备方法与常规工艺的蛋白细胞刺激活性比较
[0137][0138]
由表5可知,使用本发明方法制备的pha产量比常规工艺制备的pha细胞刺激活性高4倍以上,说明本发明方法制备的pha蛋白中pha-l的纯度至少高于常规工艺的4倍以上。
[0139]
本发明的纯化方法摒弃了通用的硫酸铵沉淀法与凝胶过滤层析步骤,简化纯化步骤,适用于大规模放大生产,现有的常规的蛋白质分离方法,难以将pha-e与pha-l进行纯化分离,虽然cn112707958a(一种提取l型和e型植物凝集素的方法)可分离提取l型和e型植物凝集素,但其提取方法的第二步中依然使用的是硫酸铵分级沉淀法沉淀蛋白。另外,本发明的离子交换层析也较于现有技术中先采用阴离子交换层析,后采用阳离子交换层析的纯化方法,本发明先采用阳离子交换层析后采用阴离子交换层析的纯化步骤,不仅极大的提高了分离纯化的pha-l的纯度,而且,只需要两步色谱纯化步骤,不需要后续的再进行凝胶过滤层析。发明人发现芸豆豆皮并无凝集素成分,在前处理步骤中进行浸泡脱皮处理后,极大的减少了色谱纯化的样本量,以减少后续处理的难度,提高了纯化效率,而且,避免了豆皮所带的色素分子沉积于色谱柱,延长了色谱柱的使用寿命。
[0140]
实施例4:sp、cm离子交换色谱法纯化比较
[0141]
参照实施例1“sp离子交换色谱纯化”步骤,使用cm离子交换色谱替换sp离子交换色谱,使用上述步骤一离心后的上清进行上样,并采用sp离子交换色谱同样的条件进行洗脱,cm离子交换色谱洗脱液的电泳图结果如图2和5所示。
[0142]
对比图2和图5可知,使用sp离子交换树脂,穿透液中无明显的pha条带,在cm中,穿透液可见pha条带;sp离子交换色谱中,pha主要在20mm naac-hac(150mm nacl,ph5.0
±
0.1)洗脱,而cm中,pha主要在20mm naac-hac(50mm nacl,ph5.0
±
0.1)洗脱。与cm离子交换色谱相比,sp离子交换色谱可以保留理多的pha,提高pha的产量具有,具有意料之外的效果。
[0143]
以上是对本发明所作的进一步详细说明,不可视为对本发明的具体实施的局限。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的简单推演或替换,都在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。