1.本发明涉及提供诊断癌症受试者对抗癌剂和/或放射线的抗性必要的信息的方法。更具体地,本发明涉及通过由从癌症受试者获得的癌症组织培养癌类器官以选择对抗癌剂和/或放射线具有抗性的癌类器官,从而提供诊断对抗癌剂和/或放射线的抗性必要的信息的方法。
背景技术:
2.类器官(organoid)也称为“器官类似物”或“类器官(organ-like)”,是通过3d培养方法从干细胞或器官起源细胞中分离出来的细胞重新聚集和重组而产生的器官特异性细胞聚集体。类器官包括模型器官的特异性细胞,再现器官的特定功能,并且可以以类似于实际器官的形式在空间上进行组织。据报道,患者来源的肿瘤类器官代表患者的癌细胞和组织的特征,因为它们可以再现患者的癌症组织的遗传变异特征。
3.类器官可用于细胞治疗、生物组织工程、新药开发、毒理学和精准医学等领域。需要大量可比较的定量类器官及其分析方法来提高类器官的利用率。然而,迄今为止还没有定量培养类器官的方法。其原因在于,作为最重要的类器官生长元素的基底胶在底部固化成圆顶状后,类器官就会在其中生长,从而使类器官单独生长。
4.此外,由于在基底胶中如此生长的类器官可以在3d支架中重叠的同时生长,因此限制是明确的。
5.此外,最近,已经开发出结合更稳定和生理患者来源的类器官的高通量筛选技术,用于早期药物发现程序和毒性筛查。
6.韩国专利第10-1756901号(专利文献1)公开了一种能够培养3d组织细胞的细胞培养芯片。在专利文献1的细胞培养芯片中,第1培养部、第2培养部和第3培养部在各层中形成,并且能够在各层确认细胞增殖的进展程度。但是,专利文献1的细胞培养芯片存在不能以高收率获得类器官的问题。
7.此外,存在在进行细胞培养的过程中更换培养液的移液作业的情况,在能够进行3d细胞培养的corning球状体微孔板的情况下,细胞培养中的球状体或类器官会受到影响,使得因为存在在移液作业的过程中球状体或类器官会被吸起或位置发生变化的情况,而存在不利于细胞培养环境的问题。
8.针对靶向实体癌的现有的药物筛选的细胞,已使用其中大多数患者的细胞已分离并制成球状体形式的简单标本。此类球状体类型无法充分模拟患者的状况,也无法反映可能导致药物抗性的结构和生物学特征。此外,虽然已经开始使用类器官进行筛选,但目前筛选仅限于药物,还没有用于放射治疗的体外平台。迄今为止,尚未开发出针对对药物和放射线具有抗性的癌类器官进行分类的平台模型,也没有开发出可以选择抗性类器官的平台。
9.因此,本发明人针对对抗癌剂和/或放射线具有抗性的癌类器官进行了持续研究,从而完成了本发明。
10.[相关技术文献]
[0011]
[专利文献]
[0012]
1.韩国专利第10-1756901号
技术实现要素:
[0013]
技术问题
[0014]
本发明的目的是通过选择对抗癌剂和/或放射线具有抗性的癌类器官,提供诊断癌症受试者对抗癌剂和/或放射线的抗性必要的信息。
[0015]
本发明的另一个目的是通过选择对抗癌剂和/或放射线具有抗性的癌类器官,提供筛选药物的方法。
[0016]
然而,本发明要解决的技术问题不限于上述问题,本领域技术人员可以通过以下描述清楚地理解未提及的其他问题。
[0017]
技术方案
[0018]
为了实现这些目的,本发明提供一种提供诊断癌症受试者对抗癌剂和/或放射线的抗性必要的信息的方法,所述方法包括:
[0019]
从癌症受试者分离癌组织;
[0020]
在3d细胞培养板中将所述癌组织培养成癌类器官:
[0021]
用抗癌剂和/或放射线处理培养的癌类器官;和
[0022]
当用抗癌剂和/或放射线处理的癌类器官具有等于或大于用抗癌剂和/或放射线处理之前的癌类器官的生存率时,选择用抗癌剂和/或放射线处理的癌类器官作为对抗癌剂和/或放射线具有抗性的癌类器官,
[0023]
其中,在所述类器官的培养中,所述3d细胞培养板包含0至2体积%的基于胞外基质的水凝胶,以及
[0024]
其中,3d细胞培养板包括:
[0025]
孔板,所述孔板包括多个主孔和多个子孔(sub well),所述多个子孔形成在主孔的下部以注入细胞培养液并且包括在其底表面上的凹入部;和支持所述孔板的用于大容量和高速高内涵筛选(hcs)的连接件,并且
[0026]
用于高内涵筛选(hcs)的连接件包括配备有固定装置以与所述孔板的下端连接并且从所述孔板的下端分离的底座以及位于所述孔板的上部以连接到所述底座的盖,所述主孔具有形成为在预定位置逐渐变细的台阶,所述台阶相对于主孔的壁具有10
°
至60
°
的倾斜角(θ)。
[0027]
癌症受试者可以是哺乳动物,并且优选地是人。
[0028]“对抗癌剂和/或放射线具有抗性的癌类器官”指即使用抗癌剂和/或放射线处理也难以杀死的类器官,并且包括:i)对抗癌剂具有抗性的癌类器官,ii)对放射线具有抗性的癌类器官,和iii)对抗癌剂和放射线都具有抗性的癌类器官。
[0029]
在选择用抗癌剂和/或放射线处理的癌类器官作为对抗癌剂和/或放射线具有抗性的癌类器官中,“当用抗癌剂和/或放射线处理的癌类器官具有等于或大于用抗癌剂和/或放射线处理之前的癌类器官的生存率时”是指用抗癌剂和/或放射线处理的癌类器官具有与用抗癌剂和/或放射线处理前的类器官相同的生存率或不低于用抗癌剂和/或放射线
处理前的类器官的生存率的情况。具体而言,是指用抗癌剂和/或放射线处理的癌类器官的生存率为用抗癌剂和/或放射线处理前的类器官的生存率的100%至70%的情况。可替代地,它指的是用抗癌剂和/或放射线处理的癌类器官的大小与用抗癌剂和/或放射线处理之前的类器官的大小相比没有减少30%至60%或更多。癌类器官的大小显著减小,意味着有抗癌治疗作用,但是也意味着,如果大小不显著减小,癌类器官就有药物抗性。
[0030]
在选择用抗癌剂和/或放射线处理的癌类器官作为对抗癌剂和/或放射线具有抗性的癌类器官中,根据抗癌剂的浓度和放射线照射的程度,当用抗癌剂和/或放射线处理的癌类器官的大小与用抗癌剂和/或放射线处理前的类器官的大小相比没有减少30%至60%或更多时,可以选择该癌类器官作为对抗癌剂和/或放射线具有抗性的癌类器官。
[0031]
本发明使用制备标准型癌类器官的方法从癌症受试者的癌组织制备标准型癌类器官。接着,当用抗癌剂和/或放射线处理的癌类器官与用抗癌剂和/或放射线处理前的类器官相比大小不减小时,选择该癌类器官作为对抗癌剂和/或放射线具有抗性的癌类器官。并且,将作为以这种方式选择的对抗癌剂和/或放射线具有抗性的癌类器官的主要人物的癌症受试者选择为对抗癌剂和/或放射线具有抗性的受试者。
[0032]
具体地,仅在用抗癌剂处理期间大小未减小的癌类器官是对抗癌剂具有抗性的癌类器官(因此,该癌类器官的受试者被确定为对抗癌剂具有抗性的癌症受试者),仅在用放射线处理期间大小未减小的癌类器官是对放射线具有抗性的癌类器官(因此,该癌类器官的受试者被确定为对放射线具有抗性的癌症受试者),在用抗癌剂和放射线处理中大小均未减小的癌类器官是对抗癌剂和放射线均具有抗性的癌类器官(因此,该类器官的受试者被确定为对抗癌剂和放射线具有抗性的癌症受试者)。
[0033]
在癌类器官的培养中,基于胞外基质的水凝胶可以以0至2体积%添加。
[0034]
基于胞外基质的水凝胶可以是基底胶(产品名)。
[0035]
类器官的大小可以是直径为300至500μm。
[0036]
癌症可以是结肠直肠癌、肺癌、胃癌、皮肤癌、前列腺癌、乳腺癌、宫颈癌、甲状腺癌、纤维肉瘤、子宫肉瘤、卵巢癌、胰腺癌或血液学癌症,但不限于此。
[0037]
抗癌剂可以是选自由细胞毒性抗癌剂、靶向治疗剂、免疫治疗剂和代谢性抗癌剂组成的组中的一种或多种,但不限于此。更具体地,其可以选自5-氟尿嘧啶(5-fu)、多西氟尿苷、奥沙利铂、顺铂、米托蒽醌、阿霉素、多柔比星、伊立替康和紫杉醇,但不限于此,并且可以使用任何抗癌剂,只要它是本领域已知的抗癌剂。
[0038]
如下文将详细描述的,当使用本发明的3d细胞培养板时,可以大量生产标准型癌类器官。
[0039]
3d细胞培养板的子孔可以具有形成为朝向凹入部逐渐变细的倾斜表面,子孔的上端直径可以为3.0至4.5mm,凹入部的上端直径可以为0.45到1.5mm,子孔和凹入部之间的倾斜表面(θ2)可以在40到50
°
的范围内,并且子孔的直径与凹入部的直径的长度比可以为1:0.1至1:0.5。
[0040]
3d细胞培养板的主孔的个体体积可以为100μl至300μl,凹入部的个体体积可以为20μl至50μl,主孔与凹入部的个体体积比可以平均为1:0.1至1:0.5。
[0041]
主孔包括台阶和子孔之间的空间部,空间部的高度(ah)可以平均为2.0至3.0mm,子孔的高度(bh)可以平均为1.0到2.0mm,空间部与子孔的高度比(ah:bh)可以为1:0.3至1:
1。
[0042]
另一方面,本发明提供一种筛选减轻癌细胞的药物抗性的药物的方法,所述方法包括:
[0043]
从癌症受试者分离癌组织;
[0044]
在3d细胞培养板中将所述癌组织培养成癌类器官:
[0045]
用抗癌剂和/或放射线处理培养的癌类器官;
[0046]
当用抗癌剂和/或放射线处理的癌类器官与用抗癌剂和/或放射线处理之前的癌类器官相比生存率为100%至70%时,选择所述用抗癌剂和/或放射线处理的癌类器官作为对抗癌剂和/或放射线具有抗性的癌类器官;
[0047]
用减轻癌细胞的药物抗性的候选材料与癌症抗性药物一起处理被选择为对抗癌剂和/或放射线具有抗性的癌类器官的类器官;
[0048]
将用候选材料处理的组的癌类器官生存率与未用候选材料处理的对照组的癌类器官生存率进行比较;和
[0049]
当用候选材料处理的组的癌类器官生存率低于对照组的生存率时,确定该候选材料作为缓解癌细胞的药物抗性的药物,
[0050]
其中,在所述类器官的培养中,所述3d细胞培养板包含0至2体积%的基于胞外基质的水凝胶,以及
[0051]
其中,3d细胞培养板包括:
[0052]
孔板,所述孔板包括多个主孔和多个子孔(sub well),所述多个子孔形成在主孔的下部以注入细胞培养液并且包括在其底表面上的凹入部;和支持所述孔板的用于大容量和高速高内涵筛选(hcs)的连接件,并且
[0053]
用于高内涵筛选(hcs)的连接件包括配备有固定装置以与所述孔板的下端连接并且从所述孔板的下端分离的底座以及位于所述孔板的上部以连接到所述底座的盖,所述主孔具有形成为在预定位置逐渐变细的台阶,所述台阶相对于主孔的壁具有10
°
至60
°
的倾斜角(θ)。
[0054]
关于癌细胞、类器官培养方法、类器官选择方法和细胞培养板的描述如上所述。
[0055]
在下文中,将详细描述本发明。
[0056]
由于本发明可以以各种形式进行修改并且包括各种示例性实施方式,因此将在附图中示出具体的示例性实施方式并且在具体实施方式中进行详细描述。
[0057]
但是,该描述并不旨在将本发明限制于具体的实施方式,并且应当理解,本发明的构思和技术范围所包含的所有变化、等同物和替代物均包含在本发明中。当确定在描述本发明时对相关公知技术的详细描述可能使本发明的主旨模糊不清时,将省略其详细描述。
[0058]
本技术中使用的术语仅用于描述具体实施方式,并不旨在限制本发明。除非上下文另有明确说明,否则单数表达包括复数表达。
[0059]
在本发明中,术语“包括”或“具有”意在表示说明书中描述的特征、数量、步骤、操作、构成要素、部分或其任意组合的存在,并且应理解为不排除存在或添加一种或多种其他特征或数量、步骤、操作、构成要素、部件或其任意组合的可能性。
[0060]
一般来说,当培养类器官时,使用水凝胶来起到胞外基质的作用。例如,基底胶在细胞培养板底部固化成圆顶状后,类器官生长在其中,而类器官生长的大小和形状不同,功
能发展也不同,因此存在难以使类器官标准化的问题。
[0061]
本发明使用不包括或包括最少量的基于胞外基质的水凝胶的3d细胞培养板生产类器官。下面对本发明的3d细胞培养板进行具体说明。
[0062]
在示例性实施方式中,本发明使用3d细胞培养板,所述3d细胞培养板包括:
[0063]
孔板,所述孔板包括多个主孔和多个子孔,所述多个子孔形成在主孔的下部以注入细胞培养液并且包括在其底表面上的凹入部;和
[0064]
支持所述孔板的用于大容量和高速高内涵筛选(hcs)的连接件,
[0065]
其中,用于高内涵筛选(hcs)的连接件包括配备有固定装置以与所述孔板的下端连接并且从所述孔板的下端分离的底座以及位于所述孔板的上部以连接到所述底座的盖,
[0066]
所述主孔具有形成为在预定位置逐渐变细的台阶,所述台阶相对于主孔的壁具有10
°
至60
°
的倾斜角(θ)。
[0067]
相关技术中的96孔板的问题在于,为了评价高收率药物的功效,需要进行数次或更多的实验和分析,因此花费大量时间和成本。此外,在通常进行的细胞培养过程中更换培养液的移液作业的情况是存在的,在相关技术的corning球状体微孔板的情况下,细胞培养中的球状体或类器官会受到影响,使得因为存在在移液作业的过程中球状体或类器官被吸起或位置发生变化的情况,而存在不利于细胞培养环境的问题。
[0068]
因此,本发明致力于解决上述问题,并提供一种细胞培养板,该细胞培养板通过在孔板的多个主孔中包括多个子孔,从而能够以高收率制造球状体/类器官,并且该细胞培养板通过包含支持孔板的用于大容量和高速高内涵筛选(hcs)的连接件,以减少捕获大容量和高速图像时的容差,从而能够均匀地捕获孔板中的图像。此外,本发明提供一种细胞培养板,该细胞培养板能够将更换培养基期间的移液作业对通过主孔的台阶培养的细胞的影响降至最低。
[0069]
在下文中,将参考附图详细描述本发明的优选示例性实施方式。在描述之前,说明书和权利要求书中使用的术语或词语不应被解释为限于一般或字典含义,而应根据发明人可以适当地定义术语的概念以便以最佳方法描述他/她自己的发明的原则,而解释为符合本发明的技术精神的含义和构思。
[0070]
因此,由于本说明书中描述的示例性实施方式和附图中所示的构造仅是本发明的最优选的示例性实施方式并且不代表本发明的全部技术精神,因此应当理解,在提交本技术时,可以替换示例性实施方式和构造的各种等效物和修改示例是可能的。
[0071]
图1(a)是根据本发明的示例性实施方式的细胞培养板的正视图;图1(b)是根据本发明的示例性实施方式的细胞培养板的截面视图;图2是示出在根据本发明的示例性实施方式的细胞培养板中形成的主孔的视图;图3是示出根据本发明的示例性实施方式的细胞培养板的孔板、底座和盖的视图((a)盖,(b)底座,和(c)微孔板和底座的固定装置)。
[0072]
在下文中,将参照图1至图3详细描述根据本发明的示例性实施方式的细胞培养板。
[0073]
如图1至图3所示,根据本发明的示例性实施方式的细胞培养板10包括:孔板100,孔板100包括多个主孔110和多个子孔120,多个子孔120形成在主孔110的下部以注入细胞培养液并且包括在其底表面上的凹入部121;和支持孔板100的用于大容量和高速高内涵筛选(hcs)的连接件200。
[0074]
首先,将详细描述根据本发明的示例性实施方式的孔板100。
[0075]
孔板100通过模具注塑成型制成板状。为了制造如上所述的用于注塑的模具,主孔110具有作为孔结构的重复图案,从而可以降低生产的单位成本并且可以通过精细加工容易地增加尺寸。因此,细胞容易量产,可以根据用户的要求将细胞转化成各种尺寸并使用。
[0076]
孔板100中形成有多个主孔110,每个主孔110包括台阶101。台阶101在主孔110的预定位置处形成,更具体地,台阶101可以在主孔110总长度的1/3至1/2的位置处形成,台阶101可以在距主孔110下端的总长度的1/3至1/2的位置处形成。
[0077]
在相关技术中,存在在进行的细胞培养过程中更换培养液的移液作业的情况,在这种情况下,细胞培养中的球状体或类器官会受到影响,使得因为存在在移液作业的过程中球状体或类器官被吸起或位置发生变化的情况,而存在不利于细胞培养的问题,但设置台阶101以防止该问题。
[0078]
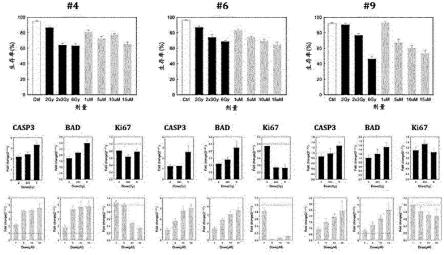
台阶101可以是放置移液器的空间,具体地,可以相对于主孔110的壁具有10
°
至60
°
的倾斜角(θ)。可替代地,台阶101的倾斜角可以在20
°
至50
°
的范围内,优选地在30
°
至45
°
的范围内。当台阶101的倾斜角小于10
°
时,主孔110内的倾斜角太小,以至于可放置移液器的空间不足,结果,当主孔110中的培养液被吸起时,移液器可能在子孔120内滑动,导致球状体或类器官被吸起,或者其位置等发生变化。此外,在倾斜角(θ)超过60
°
的情况下,虽然设置了可放置移液器的空间,但台阶101的倾斜角过大,以致于可能难以充分吸取培养液,并且在子孔120中接种细胞时,可能会出现细胞接种在台阶101上而没有进入所有子孔120的问题。因此,期望具有上述范围内的倾斜角。
[0079]
同时,根据本发明的示例性实施方式的主孔可以包括下文将描述的在台阶101和子孔120之间的空间部130。具体而言,空间部130是注入培养液的空间,是子孔120内的细胞能够共享同一培养液的空间。
[0080]
更具体地,空间部130的高度(ah)可以平均为2.0mm至3.0mm,或2.2mm至2.8mm,或者2.3mm至2.7mm。此外,子孔120的高度(bh)可以平均为1.0mm到2.0mm,或者平均为1.2mm到1.8mm。
[0081]
例如,空间部130的高度(ah)可以平均为2.5mm,并且子孔的高度(ah)可以平均为1.5mm。
[0082]
在这种情况下,空间部与子孔120的高度比(ah:bh)可以为1:0.3到1:1,更具体地,空间部与子孔120的高度比(ah:bh)可以为1:0.4至1:0.9或1:0.5至1:0.8。当空间部的高度与子孔120的高度之比小于1:0.3时,在更换子孔120的培养基过程中,即使用很小的力,培养中的细胞也可能从内部逸出,当空间部的高度与子孔120的高度之比超过1:1时,细胞所需的培养液不能得到充分更换,从而可能导致细胞死亡。因此,
[0083]
空间部130和子孔120优选具有上述范围的高度和高度比。
[0084]
接下来,子孔120在每个主孔110的下部形成并且包括在其底表面上的凹入部121。作为特定方面,子孔120可以包括在主孔110的下部的多个凹入部。
[0085]
包括在主孔110的下部的子孔120具有相同的尺寸和形状,从而能够在均匀的条件下生产类器官。
[0086]
子孔120可以具有形成为朝向凹入部121逐渐变细的倾斜表面。具体地,子孔120的上部的水平面积可以随着其沿垂直方向下降而变小。例如,子孔120的上部可以形成为倒金
字塔形。在图示的示例性实施方式中,子孔120的上部可以形成为诸如金字塔形或漏斗形的形状,其中子孔120的上部的水平面积随着其沿垂直方向下降而变小。
[0087]
特别地,细胞培养板可以通过包括具有相同的尺寸和形状的多个子孔120,而在均匀的条件下生产大量的球状体或类器官。
[0088]
作为特定方面,一个主孔110可以包括4至25个相同尺寸的子孔120,整个微孔板100可以包括96至1,728个子孔120。因此,可以以相同的精确方式控制尺寸。因此,可以大量生产具有均一尺寸和形状的类器官,即标准型癌类器官。
[0089]
此外,子孔120包括凹入部121,并且在凹入部的下部形成空间,使得可以在凹入部121中培养3d球状体或类器官。具体地,凹入部121可以是字母“u”、“v”或“ц”的形式,例如,凹入部121可以是字母“u”的形式。
[0090]
子孔120的上端直径可以为3.0mm至4.5mm,或3.5mm至4.3mm,或平均为4mm。此外,凹入部121的上端直径可以为0.45mm至1.5mm,或0.5mm至1.0mm,或平均为0.5mm。
[0091]
此外,子孔120的直径与凹入部121的直径的长度比可以为1:0.1至1:0.5,优选地,子孔120的直径与凹入部121的直径的长度比可以为1:0.12。
[0092]
当凹入部121的上端直径与子孔120的上端直径1相比小于0.1时,不能充分提供凹入部121的细胞培养空间,这可能引起在更换培养液的过程中,即使用很小的力细胞也会逸出的问题,而当凹入部121的上端直径与子孔120的上端直径1相比超过0.5时,无法更换细胞所需的足量培养液,这可能引起难以稳定培养细胞的问题。
[0093]
同时,子孔120和凹入部121之间的倾斜表面相对于主孔的壁的倾斜角(θ2)可以为40
°
至50
°
、42
°
至48
°
、43
°
至47
°
,或者倾斜角(θ2)平均为45
°
。
[0094]
上述子孔120具有能够以100~1000个细胞/孔以下培养细胞和当以100个细胞/孔接种细胞时能够稳定地控制类器官尺寸的优点。
[0095]
此外,根据本发明的示例性实施方式的主孔110的个体体积可以为100μl至300μl,凹入部121的个体体积可以为20至50μl,以及主孔110与凹入部121的个体体积比可以被表征为平均为1:0.07至1:0.5。优选地,根据示例性实施方式的主孔的个体体积可以为250至300μl,凹入部的个体体积可以为25至35μl,以及主孔110与凹入部121的个体体积比可以平均为1:0.11。
[0096]
具体而言,当主孔110的个体体积小于100μl时,会出现在细胞培养过程中不能容纳足够的培养液的问题,当个体体积超过300μl时,培养效率可能会降低。
[0097]
另外,凹入部121是实质上培养细胞的空间,当体积小于20μl时,细胞培养空间不足,这可能会导致细胞逸出的问题,当体积超过50μl时,可能会出现难以稳定培养细胞等问题。因此,主孔110和凹入部121优选具有在上述范围内的体积。
[0098]
由于本发明的细胞培养板的上述构造,即使不包含水凝胶(基底胶)或包含的水凝胶(基底胶)少于2体积%,也可以很好地形成类器官。
[0099]
根据本发明的示例性实施方式的细胞培养板10包括支持所述孔板100的用于大容量和高速高内涵筛选(hcs)的连接件200。在此,用于大容量和高速高内涵筛选(hcs)的连接件200是指连接到高内涵筛选(hcs)系统的连接件200,具体地,在本发明中,连接件可以指底座210和盖220。
[0100]
更具体地,用于大容量和高速高内涵筛选(hcs)的连接件包括配备有固定装置140
和240以与孔板100的下端连接并且从孔板100的下端分离的底座210以及位于孔板100的上部以连接到底座210的盖220。另外,底座210的上端和孔板100的下端被表征为,包括可以固定的固定装置140和240以使彼此可连接并且分离。
[0101]
在这种情况下,底座包括用于支持孔板100的凸起部240,孔板100可以包括面对底座210的凸起部240的凹陷部140。孔板100可以通过固定装置被固定以在筛选期间均匀地捕获图像。
[0102]
底座可由聚乙烯、聚丙烯、聚苯乙烯、聚对苯二甲酸乙二醇酯、聚酰胺、聚酯、聚氯乙烯、聚氨酯、聚碳酸酯、聚偏二氯乙烯、聚四氟乙烯、聚醚醚酮或聚醚酰亚胺材料形成,但不限于此。
[0103]
孔板可以由聚二甲基硅酮、高脂改性硅酮、甲基氯苯基硅酮、烷基改性硅酮、甲基苯基硅酮、硅酮聚酯或氨基改性硅酮材料形成,但不限于此。
[0104]
有益效果
[0105]
根据本发明选择的对抗癌剂和/或放射线具有抗性的癌类器官可用于预测抗癌治疗对癌症患者的有效效果。
[0106]
通过本发明,在进行大规模的药物筛选时,与常规类器官不同,形成了大小均一、相互可比的类器官,从而使药物和放射线的效果的定量分析成为可能。这使得选择适合每种变异基因特异性的药物成为可能,从而实现更有效的药物治疗。
附图说明
[0107]
图1(a)是根据本发明的示例性实施方式的细胞培养板的正视图;图1(b)是根据本发明的示例性实施方式的细胞培养板的截面视图。
[0108]
图2是详细示出在根据本发明的示例性实施方式的细胞培养板中形成的主孔的视图。
[0109]
图3是示出根据本发明的示例性实施方式的细胞培养板的孔板、底座和盖的视图((a)盖、(b)底座、和(c)微孔板和底座的固定装置)。
[0110]
图4是表示实施例1和比较例1((a)实施例1、(b)比较例1)的高速大量成像结果的图。
[0111]
图5示出了培养根据本发明的示例性实施方式的包含2体积%的基底胶的类器官以及不使用基底胶的类器官的结果。
[0112]
图6示出了根据本发明的示例性实施方式的包含2体积%的基底胶的类器官以及不使用基底胶的类器官的免疫荧光染色结果。
[0113]
图7(a)是示出实施例1的高速大量成像结果的照片,图7(b)是示出实施例1中培养的类器官的面积的图。
[0114]
图8(a)是示出比较例1的高速大量成像结果的照片,图8(b)是示出比较例1中培养的类器官的面积的图。
[0115]
图9示出了当根据本发明的示例性实施方式的结肠直肠癌细胞培养14天时的成像结果(左)和类器官大小分布(右)。
[0116]
图10是根据本发明的示例性实施方式在培养癌类器官之后选择对抗癌剂和放射线具有抗性的癌类器官的一组结果。
[0117]
图11是根据本发明示例性实施方式在用抗癌剂和放射线处理癌类器官之后的一组活/死图像。
[0118]
图12是测量根据本发明的示例性实施方式选择的对抗癌剂和放射线具有抗性的癌类器官的类器官的生存率和基因表达的一组结果。
[0119]
图13显示了根据本发明的放射线和药物处理后类器官的大小变化,并显示了各组与对照组的面积比。
[0120]
图14示意性地示出了在用抗癌剂和放射线处理后确认了每个癌类器官的突变,并且通过分类和分组来预测有效的治疗效果。
具体实施方式
[0121]
由于本发明可以被修改为各种形式并且包括各种示例性实施方式,因此将在附图中示出具体的示例性实施方式并且在具体实施方式中进行详细描述。然而,该描述并不旨在将本发明限制于具体的示例性实施方式,并且应当理解,属于本发明的精神和技术范围的所有变化、等同物和替代物都包含在本发明中。当确定在描述本发明时对相关公知技术的详细描述可能使本发明的主旨模糊不清时,将省略其详细描述。
[0122]
[实施例]
[0123]
实施例a:标准型类器官的生产的确认
[0124]
1.标准型类器官的生产
[0125]
将现有的大肠癌类器官与5ml培养基一起放入15ml试管中,以200rpm离心3分钟,彻底去除上清液,通过用细胞消化酶(accutase)处理7分钟将类器官完全分离为单细胞。将这些单细胞以约100个细胞/孔接种在细胞培养板的子孔中,通过总共培养单细胞14天生产类器官。在这种情况下,培养液是基于dmem/f12的培养液,并且b27、n2、glutamax、青霉素链霉素、烟酰胺、n-乙酰基、胃泌素、a-83-01、egf、noggin、r-spondin1和wnt3a包含在相应的培养液中,并且在不含有基底胶或含有2体积%基底胶的培养条件下生产类器官。
[0126]
通过上述方法制备标准型类器官。在培养液中含有2体积%的基底胶的条件下(实施例1-1)和不含有基底胶的条件下(实施例1-2)生产类器官。
[0127]
以与实施例1-1中相同的方式培养细胞,不同之处在于将细胞以约200个细胞/孔接种在子孔中(实施例2)。
[0128]
以与实施例1-1中相同的方式培养细胞,不同之处在于将细胞以约300个细胞/孔接种在子孔中(实施例3)。
[0129]
以与实施例1-1相同的方式培养细胞,并进行高速大量成像。但是,在比较例中,使用了作为通常使用的细胞培养板的字母“u”形“96孔板”,通过在基底胶中接种细胞来生产类器官(比较例1)。
[0130]
2.类器官的大小和数量的测量
[0131]
imagej程序用于类器官的大小分析。具体来说,通过在相位图像中选择感兴趣区域并在imagej程序中应用阈值,将不需要的部分覆盖,将未正确绘制的部分用黑色绘制。使用外周对应用了阈值的区域进行计算。
[0132]
3.荧光染色方法
[0133]
lgr5是一种类器官干细胞,其通过免疫荧光染色进行染色和确认。首先,将本发明
的标准型类器官在室温下于4%多聚甲醛溶液中保存1小时,然后用pbs染色。然后,将标准型类器官在15%蔗糖中冷藏1天和在30%蔗糖中冷藏1天后,使用液氮制造冷冻块(cryo-block)。使用制造的冷冻块,将块切割成10μm的厚度,并将切下的横截面贴在载玻片上。载玻片用0.1%tritonx处理10分钟,然后用pbs洗涤两次。载玻片在室温下在3%bsa中保存1小时后,用pbs2洗涤两次后使用lgr5进行免疫染色,然后通过向其中添加封固液在荧光显微镜下进行测量。
[0134]
在图10的情况下,取出培养的标准型类器官,进行活/死荧光染色。在荧光染色的情况下,将1mm钙黄绿素和2mm etdh-1分别以2μl/1ml和1μl/1ml在培养箱中保存30至60分钟,然后在荧光显微镜下进行测量。
[0135]
4.类器官图像分析
[0136]
对实施例1-1和比较例1中培养的细胞进行拍照,比较细胞球的大小。通过自动板装置对球状体进行成像,并且在这种情况下,允许该装置通过自动聚焦来进行成像。使用imagej程序的宏程序进行图像大小分析。
[0137]
此外,结果示于图4中。图4是示出实施例1-1和比较例1((a)实施例1-1、(b)比较例1)的高速大量成像结果的图。
[0138]
参考图4,确认了在实施例1-1的情况下,在本发明的细胞培养板上培养的细胞的直径几乎均一。具体而言,当细胞以平均100个细胞/孔接种到每个子孔中时,可以制造出可以进行比较分析的均一的类器官。在这种情况下,类器官大小的误差范围约为20μm。由此可知,使用本发明的类器官培养方法,可以生产标准型类器官。
[0139]
相反,可以确认在使用相关技术的孔板的比较例1的情况下,形成了具有不同大小的细胞球。一个基底胶的圆顶形态中,由于多个细胞生长而生成的类器官的大小的误差范围出现150μm以上的偏差,细胞在生长的同时重叠,因此不可能进行均匀的高速大量成像和实验。
[0140]
本发明的底座和孔板包括分别相互固定的凸起部和凹陷部,凸起部和凹陷部可以相互连接,从而使底座牢固地固定孔板,表明可以均匀地捕获孔板中的图像。
[0141]
相比之下,可以看出比较例1中培养的类器官的大小和形状不均匀。这似乎使图像分析变得困难,因为在没有板底座的情况下,成像的焦点偏差会增加。
[0142]
此外,参考图5,使用本发明的细胞培养板时,即使不含有基底胶,也能良好地形成类器官。
[0143]
图6通过对作为结直肠癌类器官形成的最重要标志物的lgr5染色来确认表达水平,从而确认培养的类器官是否成功形成。此外,通过f-肌动蛋白染色,证实了在低浓度基底胶组或未使用基底胶组的结肠直肠癌类器官中存在结肠特异性结构。
[0144]
6.标准型类器官的生产
[0145]
对实施例1-1和比较例1中培养的细胞进行高速大量成像。
[0146]
将实施例1-1和比较例1中生产的类器官通过自动板装置进行成像,在这种情况下,使该装置通过自动对焦进行成像。使用imagej程序的宏程序进行图像大小分析。
[0147]
此外,结果示于图7和8中。
[0148]
图7(a)是示出实施例1-1的高速大量成像结果的照片,图7(b)是示出实施例1中培养一定时间的类器官的面积的图。图8(a)是示出比较例1的高速大量成像结果的照片,图8
(b)是示出比较例1中培养一定时间的类器官的面积的图。
[0149]
参考图7,可以确认,当对实施例1-1中制备的类器官进行自动成像时,由于成像高度是均一的,可以在没有大误差的情况下进行成像,由于这个事实,测量实际面积时的误差范围非常小。
[0150]
特别地,当使用本发明的细胞培养板培养类器官时,类器官被培养成均一的大小。也就是说,标准化是可能的。作为标准化的结果,在图像测量期间自动确定焦点,并且通过连接器结构将测量高度的偏差最小化。因此,在测量筛选图像时,显示偏差为20μm左右,非常小。
[0151]
参考图8,可以确认在比较例1的情况下,类器官相互重叠地生长,可知类器官的大小和分布位置不同,无法标准化。因此,在测量筛选图像的过程中,显示偏差高达150μm,很大。
[0152]
上述结果是因为当通过相关技术的方法培养类器官时,由于类器官在基底胶中随机生长,难以均匀培养所需的类器官,并且测量的高度也是可变的,因此,存在难以将测量的高度应用于类器官筛选成像的限制。因此,当对培养一定时间的类器官的面积进行分析时,偏差显得非常大。
[0153]
在图9的情况下,在作为整体而生产的标准型类器官中,使用image j程序测量了每个类器官的直径。共对864个孔进行了高速大量成像,通过imagej分析每个图像,证实获得了均一的直径。
[0154]
图9示出了实施例1-1的结肠直肠癌细胞培养14天时的成像结果和类器官的大小。可以看出,可以制造标准类器官,因为类器官的大小均匀在300至50μm之间。
[0155]
实施例b:选择对抗癌剂和放射线具有抗性的癌类器官
[0156]
1.结肠直肠癌类器官的构建
[0157]
如前所述,确认了可以使用本发明的细胞培养板大量生产标准型癌类器官。基于此,从癌症患者中选择对抗癌剂和放射线具有抗性的癌类器官。具体而言,在韩国首尔asan医疗中心机构审查委员会(irb)的批准下获得了人类结肠直肠样本。将该结肠直肠癌组织制成细胞并分离成单细胞,然后使用本发明的细胞培养板通过添加2体积%的基底胶构建10种均一且标准化的结肠直肠癌类器官(1号:f59,2号:m60,3号:f48,4号:f49,5号:f55,6号:f77,7号:m75,8号:m68,9号:m76,10号:m62)。
[0158]
2.癌类器官的免疫荧光染色方法
[0159]
培养的类器官用pbs洗涤一次,用包含2μm钙黄绿素am、2μm ethd-1和2滴/1ml hoechst33342的培养溶液处理,然后在培养箱(37℃,co
2 5%)中处理60到90分钟。处理后,将培养液换成不含染色试剂盒的培养液,然后在荧光显微镜下确认细胞核、活细胞、死细胞的表达。
[0160]
3.癌类器官生存率的测量
[0161]
基于通过图11中的方法测量的细胞核、活细胞和死细胞的表达图像,通过imagej进行测量。在用阈值处理图像之后,测量面积比。使用测量的面积比来计算活细胞与总细胞的比例,获得了类器官的生存率。
[0162]
3:选择对抗癌剂和放射线具有抗性的癌类器官
[0163]
上述10种大肠癌类器官均各自用抗癌剂(5-fu)和放射线进行处理。用浓度分别为
1、5、10和15μm以及浓度分别为2、2 2 2和6gy的抗癌剂和放射线处理结肠直肠癌类器官。未用抗癌剂和放射线处理的组用作对照。结果,如图10所示,初步选择4号、6号、9号。参考图11,4号、6号和9号中的9号癌类器官的大小在用抗癌剂和放射线处理时没有显著减小。因此,选择9号癌类器官作为对抗癌剂和放射线具有抗性的类器官。
[0164]
4.确定对放射线和抗癌剂具有抗性的选择的类器官的抗性特征
[0165]
在图12中,进行pcr以确认在药物处理和放射线照射后类器官的基因单位的变化。将类器官转移到1.5ml管中,用pbs洗涤,然后使用qiagen制造的rna提取试剂盒提取rna。通过nanodrop测量rna的浓度,并在此基础上使用applied biosystems制造的cdna转换试剂盒将rna转换为cdna。为了确认药物和放射线的效果,制造了能够确认与细胞死亡相关的代表性基因caspase3(casp3)和bad的表达以及与细胞增殖相关的ki67的表达的引物(表1),通过基于引物和cdna的pcr方法确认了用药物和放射线处理的类器官的基因表达。由此可以证实,在对药物和放射线表现出抗性的类器官的情况下,细胞死亡的表达相对较低,而细胞增殖的表达相对较高。参考图12可以看出,在9号癌类器官的情况下,细胞增殖基因的表达相对高于细胞死亡基因的表达。
[0166]
[表1]
[0167][0168]
图13定量说明了药物和放射线处理后类器官的大小的变化。基于每个日期的类器官阶段照片,使用imagej测量类器官的大小。对应的图显示了通过将对照的类器官大小标准化为1的方法对整个实验组的类器官大小进行量化的结果。可以确认的是,在9号类器官的情况下,对抗癌剂和放射线的抗性高于4号和6号类器官。由此确认,通过仅培养本发明的标准型癌类器官和测定培养的癌类器官的大小,就能够选择对药物和放射线具有抗性的类器官。
[0169]
通过图13,对放射线和抗癌剂具有抗性的癌类器官可以通过其生存率和大小来选择。
[0170]
具体来说,参考对放射线有抗性的组的9号的数据,对以低浓度和数次以低浓度放射性进行放射线照射的情况(这种情况与一般方案/临床试验类似)和以过量放射线进行照射的情况彼此进行了比较。在9号患者(kras突变患者/对放射线和抗癌剂具有抗性)的情况下,可以看出,当观察到用放射线照射7天的大小变化时,大小保持在几乎70%到100%的水平,生存率本身没有改变,并且可以看出,对于7天处理,细胞的大小改变了约30%的水平。可以确认,7天后细胞在不进行处理的情况下迅速增殖并且大小增大。
[0171]
可以看出,9号患者(kras突变患者/对放射线和抗癌剂具有抗性)是对抗癌剂具有抗性的组,其对低浓度的药物没有表现出任何反应,生存率范围为100%到70%,且细胞形
态没有减小。此外,即使在去除药物后ki67基因也迅速增加,但显示出抑制细胞死亡的表现。这些结果是对抗癌剂具有抗性的患者期望将其生存率维持在70%范围内的典型现象,并且可以确认随着细胞增殖率变得比细胞死亡率更均匀,细胞在未来迅速恢复。此外,确认了当确认药物施用的最初7天期间的大小时即便大小发生改变,大小没有减少60%或更多的情况表明细胞再次得到恢复的模式。
[0172]
通过按每个突变对癌类器官进行分类并通过细胞特征对癌类器官进行分组,图14通过主要突变特征总结了根据本发明生产的标准型癌类器官。
[0173]
作为实验方法,将类器官转移到1.5ml管中,用pbs洗涤,然后使用qiagen制造的rna提取试剂盒提取rna。rna上的遗传信息基于illumina提供的truseq rna access文库进行确认。
[0174]
参考图14,可以证实,作为药物和放射线照射后选择的样本的基因组测试的结果,诸如tp53、apc、pik3ca和kras等复杂的癌靶突变形成在表现出抗性的样本中加剧。特别是可以确认,在9号类器官的情况下,tp53、apc、pik3ca和kras全部表达。由此可知,当使用本发明选择的对抗癌剂和/或放射线具有抗性的癌类器官时,无需单独的基因组测试就可以诊断出对抗癌剂和/或放射线具有抗性的患者。
[0175]
通过用减轻癌细胞的药物抗性的候选材料与抗癌药物一起处理如此选择的对抗癌剂和/或放射线具有抗性的类器官,可以筛选减轻癌细胞的药物抗性的药物。具体地,当减轻癌细胞的药物抗性的候选药物有效时,本发明选择的对抗癌剂和/或放射线具有抗性的类器官的生存率将低于对照(未用减轻癌细胞的药物抗性的候选药物处理的组)的生存率。
[0176]
进一步地,当使用本发明时,从癌症患者中分离出癌组织,并在本发明所述的3d细胞培养板中培养,以产生标准型癌类器官,然后可以很容易地诊断出癌类器官是否对抗癌剂和放射线具有抗性。此外,如果患者被诊断为对抗癌剂和/或放射线具有抗性的癌症患者,则可以通过用减轻癌细胞的药物抗性的材料处理该癌类器官来筛选减轻癌细胞的抗性的药物。也就是说,患者定制药物筛选是可能的。
[0177]
如上所述,通过本发明的标准型类器官制备方法,通过将从癌症患者获得的癌组织培养成类器官,仅通过培养类器官和用抗癌剂和/或药物处理类器官的步骤而无需进行复杂的基因组测试就选择并确认对抗癌剂和/或放射线具有抗性的类器官,由此,可以诊断癌症患者是否对抗癌剂和/或放射线有抗性。
[0178]
尽管已经详细描述了本发明的特定部分,但是对于本领域的技术人员来说显而易见的是,这样的具体描述只是一个优选实施方式,本发明的范围不受此限制。因此,本发明的实质范围将由所附权利要求书及其等同物来定义。
[0179]
附图标记和符号的说明
[0180]
100:孔板
[0181]
101:台阶
[0182]
110:主孔
[0183]
120:子孔
[0184]
121:凹入部
[0185]
130:空间部
[0186]
140:凹陷部
[0187]
220:用于大容量和高速hcs的连接件
[0188]
210:底座
[0189]
220:盖
[0190]
240:凸起部
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。