胃蛋白酶原ii的特异性抗体及其制备方法与应用
技术领域
1.本发明涉及生物技术领域,具体涉及胃蛋白酶原ii的特异性抗体及其制备方法与应用。
背景技术:
2.抗体是一种主要由浆细胞分泌,被免疫系统用来鉴别与中和外来物质如细菌、病毒等外来物的蛋白质,该外来物被称为抗原。抗体和抗原的结合完全依靠非共价键的相互作用,这种特异性的结合机制使得抗体可以捕获外来微生物以及受感染的细胞,进一步诱导其他免疫机制对其进行攻击,或直接中和其目标。抗体及抗体相关产品已经被广泛应用于生命科学与医学等研究领域,基于抗原-抗体特异性结合而衍生的诸多实验技术奠定了科学研究与临床治疗的重要基础,例如免疫诊断、免疫印迹、酶联免疫吸附、流式细胞分析等等。
3.胃蛋白酶原ii(pepsinogen i,简称pgii)是由胃部分泌的参与消化的两种胃蛋白酶的前体之一,主要由胃底腺的胃酶细胞和粘液颈细胞合成并分泌进入胃腔。人pgii是一条由388个氨基酸组成的多肽链,其本身不具有活性,在胃腔可被胃酸或已激活的胃蛋白酶剪切加工成为成熟的胃蛋白酶(pepsin)。pgii与胃底粘膜病变的相关性较大,其升高与胃底腺管萎缩、胃上皮化生或假幽门腺化生、异型增值有关因此,监测血清中pg ii的浓度可以作为监测胃部病变的重要手段:(1)幽门螺杆菌感染筛查:感染患者血液中pgii含量显著增高,康复后含量下降;(2)浅表性胃炎;早期患者血清pgii含量显著增加。此外,在不同的胃部疾病中,临床往往联合pgi和pgii的含量检测结果共同诊断胃部病变。
4.目前,科学研究或临床诊断检测pgii主要是依赖于抗体,市面上已有多种pgii的单克隆抗体公开或销售,制备这些抗体的技术方案是:(1)组织提取或重组表达pgii蛋白质抗原;(2)将抗原注射至鼠、兔、猴等动物体内,依靠动物的免疫系统产生抗体;(3)采集动物的血液并分离、提取出血清,再进一步分离出含有特异性抗体的成分。
5.然而,上述基于鼠等动物的免疫系统产生pgii的抗体并分离提取的技术,有以下缺点:(1)抗体的稳定性较差,需要在低温(4摄氏度)下进行储藏、运输、测试与验证等工作才能维持抗体的浓度、特异性等特征,不利于长途运输和普及检测;(2)规模化批量生产成品高。上述单克隆抗体是全长的免疫球蛋白(igg),需要反复免疫注射动物并从动物体液中欧给分离提纯抗体,或是在哺乳动物细胞等成本较为高昂的表达系统中进行重组表达后进行分离、纯化提取,操作复杂、成本昂贵,不利于规模化批量生产。
技术实现要素:
6.本发明克服现有技术的缺陷,设计并实施有效、可行的抗体筛选与制备技术方案,获得能够特异性识别并结合胃蛋白酶原ii的抗体,进行批量生产制备并对其应用。
7.本发明的上述目的通过以下具体方案实现。
8.第一方面,本发明提供用胃蛋白酶原ii免疫骆驼科动物所得的抗原结合蛋白、抗
体或抗体活性片段。
9.在一些实施方案中,所述骆驼科动物选自单峰驼、双峰驼、美洲驼、骆马、羊驼和小羊驼,优选为羊驼。
10.在一些实施方案中,所述抗体为纳米抗体,所述抗体活性片段为纳米抗体活性片段。
11.在一些实施方案中,所述抗体为单克隆抗体或者多克隆抗体。
12.在一些实施方案中,所述抗原结合蛋白、抗体或抗体活性片段与所述胃蛋白酶原ii结合的kd值在800nm以下,优选在250nm以下,更优选在150nm以下,更优选在50nm以下。
13.在一些实施方案中,所述胃蛋白酶原ii具有如seq id no:1所示的氨基酸序列。进一步优选地,所述胃蛋白酶原ii由包括如下步骤的方法制备而成:将编码所述胃蛋白酶原ii的核苷酸序列构建至载体质粒;将所述载体质粒转染至真核细胞系中表达,纯化。
14.第二方面,本发明提供一种构建抗体文库的方法,所述方法包括如下步骤:
15.(1)将胃蛋白酶原ii作为抗原免疫骆驼科动物,采集被免疫动物的静脉外周血,分离得到淋巴细胞;
16.(2)提取所述淋巴细胞的总mrna,反转录为cdna并进行扩增;
17.(3)将所述扩增得到的dna插入病毒表达载体,转化入细菌,收集菌落,得抗体文库。
18.在一些实施方案中,所述骆驼科动物选自单峰驼、双峰驼、美洲驼、骆马、羊驼和小羊驼,优选为羊驼。
19.在一些实施方案中,步骤(1)所述免疫采用皮下注射方式。所述免疫的次数优选为3~5次。所述静脉外周血优选在最后一次免疫之前和之后分别采集。
20.在一些实施方案中,步骤(3)所述病毒表达载体为噬菌体表达载体。
21.在一些实施方案中,步骤(3)所述细菌为大肠杆菌。
22.第三方面,本发明提供上述构建抗体文库的方法获得的抗体文库,或由所述抗体文库表达产生的多克隆抗体。
23.第四方面,本发明提供一种构建抗原特异性抗体文库的方法,所述方法包括如下步骤:对第三方面所述的抗体文库进行筛选,获得抗原特异性抗体文库。
24.在一些实施方案中,所述构建抗原特异性抗体文库的方法包括如下步骤:
25.(i)对所述抗体文库进行培养,释放病毒;
26.(ii)将所述病毒与抗原进行孵育,去掉与抗原非特异性结合的病毒,保留与抗原特异性结合的病毒;
27.(iii)用所述与抗原特异性结合的病毒侵染细菌,收集菌落,获得抗原特异性抗体文库。
28.在一些实施方案中,步骤(iii)所述细菌为大肠杆菌。
29.第五方面,本发明提供上述构建抗原特异性抗体文库的方法获得的抗原特异性抗体文库,或由所述抗原特异性抗体文库表达产生的与抗原特异性结合的多克隆抗体。
30.第六方面,本发明提供一种制备抗原结合蛋白、抗体或抗体活性片段的方法,所述方法包括如下步骤:对第三方面所述的抗体文库进行筛选,获得与抗原特异性结合的抗原结合蛋白、抗体或抗体活性片段。
31.在一些实施方案中,所述制备抗原结合蛋白、抗体或抗体活性片段的方法包括如下步骤:
32.(a)对所述抗体文库进行培养,释放病毒;
33.(b)将所述病毒与抗原进行孵育,去掉与抗原非特异性结合的病毒,保留与抗原特异性结合的病毒;
34.(c)用所述与抗原特异性结合的病毒侵染细菌,将被侵染的细菌涂抹至平板培养基培养,挑选单一菌落。
35.在一些实施方案中,步骤(c)所述细菌为大肠杆菌。
36.在一些实施方案中,可以对所述单一菌落进行扩大培养,之后进行抗原特异性结合鉴定。
37.在一些实施方案中,可以对所述单一菌落进行扩大培养,然后进行步骤(d):提取dna,转化至宿主细胞并表达,以获得单克隆抗体。
38.第七方面,本发明提供采用上述制备抗原结合蛋白、抗体或抗体活性片段的方法获得的抗原结合蛋白、抗体或抗体活性片段。
39.第八方面,本发明提供特异性识别和/或结合胃蛋白酶原ii的抗原结合蛋白、抗体或抗体活性片段;所述抗原结合蛋白、抗体或抗体活性片段包含至少一个重链可变区;所述重链可变区具有:
40.如seq id no:2、seq id no:3、seq id no:4或seq id no:5所示的cdr1;
41.如seq id no:6、seq id no:7、seq id no:8或seq id no:9所示的cdr2;和
42.如seq id no:10、seq id no:11、seq id no:12或seq id no:13所示的cdr3。
43.在一些实施方案中,所述重链可变区具有:如seq id no:2所示的cdr1、如seq id no:6所示的cdr2和如seq id no:10所示的cdr3。
44.在一些实施方案中,所述重链可变区具有:如seq id no:3所示的cdr1、如seq id no:7所示的cdr2和如seq id no:11所示的cdr3。
45.在一些实施方案中,所述重链可变区具有:如seq id no:4所示的cdr1、如seq id no:8所示的cdr2和如seq id no:12所示的cdr3。
46.在一些实施方案中,所述重链可变区具有:如seq id no:5所示的cdr1、如seq id no:9所示的cdr2和如seq id no:13所示的cdr3。
47.在一些实施方案中,所述重链可变区具有:如seq id no:14所示的氨基酸序列,或seq id no:14所示的氨基酸序列经过一个或多个氨基酸添加、删除、替换或修饰获得的保守性变异体。
48.在一些实施方案中,所述重链可变区具有:如seq id no:15所示的氨基酸序列,或seq id no:15所示的氨基酸序列经过一个或多个氨基酸添加、删除、替换或修饰获得的保守性变异体。
49.在一些实施方案中,所述重链可变区具有:如seq id no:16所示的氨基酸序列,或seq id no:16所示的氨基酸序列经过一个或多个氨基酸添加、删除、替换或修饰获得的保守性变异体。
50.在一些实施方案中,所述重链可变区具有:如seq id no:17所示的氨基酸序列,或seq id no:17所示的氨基酸序列经过一个或多个氨基酸添加、删除、替换或修饰获得的保
守性变异体。
51.在一些实施方案中,所述抗原结合蛋白、抗体或抗体活性片段包含一个所述重链可变区且缺失轻链。
52.在一些实施方案中,所述抗体为纳米抗体,所述抗体活性片段为纳米抗体活性片段。
53.第九方面,本发明提供编码seq id no:2~seq id no:17任意一条序列所示氨基酸序列或上文所述抗原结合蛋白、抗体或抗体活性片段的核苷酸序列。
54.在一些实施方案中,编码所述抗原结合蛋白、抗体或抗体活性片段的核苷酸序列如seq id no:18所示。
55.在一些实施方案中,编码所述抗原结合蛋白、抗体或抗体活性片段的核苷酸序列如seq id no:19所示。
56.在一些实施方案中,编码所述抗原结合蛋白、抗体或抗体活性片段的核苷酸序列如seq id no:20所示。
57.在一些实施方案中,编码所述抗原结合蛋白、抗体或抗体活性片段的核苷酸序列如seq id no:21所示。
58.第十方面,本发明提供含有上文所述核苷酸序列的表达载体。
59.在一些实施方案中,所述表达载体为噬菌体表达载体,优选为噬菌体表面展示筛选载体。
60.在一些实施方案中,所述表达载体中还含有编码噬菌体包膜蛋白piii的核苷酸序列。
61.第十一方面,本发明提供外源转入了上文所述表达载体的病毒。
62.在一些实施方案中,所述病毒为噬菌体。
63.第十二方面,本发明提供外源转入了上文所述表达载体的宿主细胞,或者被上文所述病毒侵染的宿主细胞。
64.在一些实施方案中,所述宿主细胞为大肠杆菌。
65.第十三方面,本发明提供利用上文所述宿主细胞表达抗原结合蛋白、抗体或抗体活性片段的方法。
66.第十四方面,本发明提供利用上文所述宿主细胞表达获得的抗原结合蛋白、抗体或抗体活性片段。
67.第十五方面,本发明提供所述上文所述抗原结合蛋白、抗体或抗体活性片段经人源化后获得的人源化抗原结合蛋白、抗体或抗体活性片段。
68.第十六方面,本发明提供一种蛋白偶联物,其包含上文所述抗原结合蛋白、抗体或抗体活性片段或者上文所述人源化抗原结合蛋白、抗体或抗体活性片段以及配体。
69.在一些实施方案中,所述配体选自放射性同位素、荧光基团和递送载体。
70.第十七方面,本发明提供检测样品中胃蛋白酶原ii含量的试剂盒,其包含上文所述抗原结合蛋白、抗体或抗体活性片段或者上文所述人源化抗原结合蛋白、抗体或抗体活性片段。
71.在一些实施方案中,所述抗原结合蛋白、抗体或抗体活性片段经标记物标记。优选地,所述标记物选自酶、化学发光基团和同位素基团。
72.在一些实施方案中,所述样品为动物血清,优选为人血清。
73.第十八方面,本发明提供上文所述抗原结合蛋白、抗体或抗体活性片段、上文所述人源化抗原结合蛋白、抗体或抗体活性片段、上文所述蛋白偶联物或者上文所述试剂盒在检测样品中胃蛋白酶原ii含量中的应用。
74.在一些实施方案中,所述样品为动物血清,优选为人血清。
75.第十九方面,本发明提供利用上文所述抗原结合蛋白、抗体或抗体活性片段、上文所述人源化抗原结合蛋白、抗体或抗体活性片段、上文所述蛋白偶联物或者上文所述试剂盒检测样品中胃蛋白酶原ii含量的方法。
76.在一些实施方案中,所述样品为动物血清,优选为人血清。
77.与现有技术相比,本发明提供的技术方案具有如下显著优势:本发明提供的抗体可用于检测血清中pgii的含量,进一步用于判断胃部病变,有潜在临床诊断和治疗价值;本发明提供的抗体结构简单,容易进行基因工程改造,具有成熟的优化策略用于增强纳米抗体亲和力、延长体内半衰期以及与其它分子偶联用于药物开发,如连接放射性同位素,偶联传递药物、cart和荧光标记高分辨成像等;本发明提供的抗体序列与人igg的vh区域序列同源性高,少数氨基酸突变即可以实现单域抗体的人源化;且本发明提供的抗体稳定性高,耐酸碱ph,耐高温,能避免常规抗体需要低温储存和运输的要求,有利于大规模普及应用,量产成本较低,易于大规模重组制备。本发明所设计的单克隆纳米抗体在成本低廉的大肠杆菌表达系统就可以很好的重组表达,量产成本低、产量可以高达数十毫克/升大肠杆菌。大肠杆菌重组表达系统技术成熟,质量控制简单,有利于降低生产成本、实现规模化生产。
附图说明
78.图1为单抗pgii_1c5与抗原亲和力检测结果示意图;
79.图2为单抗pgii_5f4与抗原亲和力检测结果示意图;
80.图3为单抗pgii_5f6与抗原亲和力检测结果示意图;
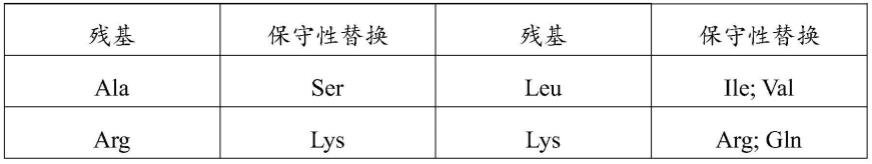
81.图4为单抗pgii_5h2与抗原亲和力检测结果示意图。
具体实施方式
82.以下实施例用于说明本发明,但不用来限制本发明的范围。
83.定义
84.胃蛋白酶原ii:胃蛋白酶原ii(pepsinogen ii,简称pgii)是由胃部分泌的参与消化的两种胃蛋白酶的前体之一,主要由胃底腺的胃酶细胞和粘液颈细胞合成并分泌进入胃腔。人pgii是一条由388个氨基酸组成的多肽链,其本身不具有活性,在胃腔可被胃酸或已激活的胃蛋白酶剪切加工成为成熟的胃蛋白酶(pepsin)。胃蛋白酶能水解食物中的蛋白质,它主要作用于蛋白质及多肽分子中含苯丙氨酸或酪氨酸的肽键上。通常情况下,约有1%的胃蛋白酶原透过胃黏膜毛细血管进入血液循环,进入血液循环的胃蛋白酶原在血液中非常稳定。当胃黏膜发生病理变化时,血清中胃蛋白酶原的含量也随之改变。
85.kd值:解离常数(dissociation constant,kd)是一种特定类型的平衡常数,用于衡量一较大物体与另一较小组分分开(解离)的倾向,是缔合常数的倒数,单位为mol/l(m)或nmol/l(nm)。kd值越小说明两个物质的结合能力越强。
86.纳米抗体:在骆驼科动物外周血液中存在的天然缺失轻链的抗体,该抗体只包含一个重链可变区(vhh)和两个常规的ch2与ch3区,但却不像人工改造的单链抗体片段那样容易相互沾粘,甚至聚集成块;单独克隆并表达出来的vhh结构具有与原重链抗体相当的结构稳定性以及与抗原的结合活性,是已知的可结合目标抗原的最小单位;vhh晶体为2.5nm,长4nm,分子量只有15kda,因此也被称作纳米抗体(nanobody,nb)。相比于传统的鼠、兔等动物仅能识别抗原表面平展的多肽,骆驼科动物体内的免疫系统能够识别抗原表面复杂的空间结构,能够产生高度特异性、高亲和力的纳米抗体。
87.根据本发明的技术方案,在不改变蛋白的活性或功能的情况下,可以对氨基酸序列中的某些氨基酸进行保守取代,参见下表1:
88.表1
89.残基保守性替换残基保守性替换alaserleuile;valarglyslysarg;glnasngln;hismetleu;ileaspgluphemet;leu;tyrglnasnserthr;glycysserthrser;valgluasptrptyrglyprotyrtrp;phehisasn;glnvalile;leuileleu;val
ꢀꢀ
90.此外,因为碱基的简并性,在不改变多核苷酸序列的活性或功能的情况下,可以对多核苷酸序列的碱基进行取代,参见下表2:
91.表2
92.[0093][0094]
实施例1:抗原的制备
[0095]
将编码胃蛋白酶原ii的dna序列构建至pfastbac-hta表达载体,于sf9昆虫细胞中重组表达带有组氨酸标签(6*his-tag)的pgii,再提取、纯化作为抗原。
[0096]
所述抗原如有如seq id no:1所示的氨基酸序列,具体为:
[0097]
mkwmvvvlvclqlleaavvkvplkkfksiretmkekgllgeflrthkydpawkyrfgdlsvtyepmaymdaayfgeisigtppqnflvlfdtgssnlwvpsvycqsqactshsrfnpsesstystngqtfslqygsgsltgffgydtltvqsiqvpnqefglsenepgtnfvyaqfdgimglaypalsvdeattamqgmvqegaltspvfsvylsnqqgssggavvfggvdsslytgqiywapvtqelywqigieefliggqasgwcsegcqaivdtgtslltvpqqymsallqatgaqedeygqflvncnsiqnlpsltfiingvefplppssyilsnngyctvgveptylssqngqplwilgdvflrsyysvydlgnnrvgfataa
[0098]
实施例2:羊驼免疫注射
[0099]
本实施例将实施例1制备得到的抗原免疫羊驼。具体步骤如下:
[0100]
(1)将实施例1中制备好的抗原平均分装成4份,每份约0.25mg;
[0101]
(2)累计对羊驼进行4次免疫,将抗原经皮下注射至动物体内,记第一次免疫为第一天,后续的免疫分别于第10天、第19天、第28天;其中,第28天,于第四次免疫注射前,采集约200ml羊驼静脉外周血液,且第42天,即第四次免疫之后14天,采集约300ml羊驼静脉外周血液。
[0102]
相比于传统鼠、兔等动物抗体的免疫技术方案,本实施例提供的方法采集大量的羊驼静脉外周血液,有利于后续筛选得到高度多样性的纳米抗体。
[0103]
实施例3:抗体文库的构建
[0104]
以实施例2中采集的两批次羊驼静脉外周血液为原料,构建高多样性的纳米抗体文库。两批次羊驼静脉外周血液的处理方法相同,具体为:
[0105]
(1)使用密度梯度离心法,从羊驼静脉外周血液中分离得到淋巴细胞;
[0106]
(2)提取淋巴细胞的总mrna,并反转录为cdna;
[0107]
(3)使用适当的dna引物,以上述cdna为模板,经聚合酶链式反应(pcr)扩增得到羊驼免疫球蛋白igg2和igg3的vhh片段,即纳米抗体的dna片段;
[0108]
(4)将vhh的dna连接至噬菌体表面展示筛选载体,构成vhh-piii融合蛋白表达载体质粒库;其中,piii是存在于噬菌体表面鞭毛上的蛋白质;
[0109]
(5)将dna连接产物经电转化方法,转化至tg1感受态细菌,适当培养后收集全部菌落,即为羊驼的纳米抗体文库。
[0110]
相比于传统的从鼠、兔等动物血清或淋巴细胞中分离得到抗体的方法,本实施例能够获得并长期保存持有羊驼的全部纳米抗体片段(即文库),能够持续地支撑后续不断地进行纳米抗体的筛选与开发。
[0111]
实施例4:噬菌体表面展示筛选特异性纳米抗体
[0112]
本实施例以实施例3得到的纳米抗体文库为来源,经噬菌体表面展示筛选得到抗原特异性的纳米抗体。具体步骤如下:
[0113]
(1)取适量冻存的实施例3获得的纳米抗体文库,接种至细菌培养基,经适当培养后加入适量的辅助噬菌体,继续于适量条件下培养;
[0114]
(2)以peg-nac法提取细菌培养上清中扩增的噬菌体;
[0115]
(3)将实施例1获得的抗原固定于免疫试管,取噬菌体与抗原孵育;
[0116]
(4)淘洗:弃去噬菌体,再用pbs缓冲液润洗抗原适当次数,淘洗、除去与抗原非特异性结合的噬菌体,保留与抗原特异性结合的噬菌体;
[0117]
(5)洗脱:采用酸性甘氨酸溶液处理与抗原特异性结合的噬菌体,使噬菌体与抗原解离并保留。
[0118]
至此,即得到了表达有特异性纳米抗体的噬菌体。
[0119]
实施例5:抗原特异性抗体文库的构建
[0120]
本实施例利用实施例4所得的噬菌体构建抗原特异性纳米抗体文库。具体步骤为:
[0121]
(1)将所述表达有特异性纳米抗体的噬菌体侵染培养至合适状态的大肠杆菌,但不再加入辅助噬菌体;
[0122]
(2)待噬菌体侵染完全后,特异性的纳米抗体即以dna质粒的形式存在于大肠杆菌中,收集这些全部的大肠杆菌,即成为抗原特异性的纳米抗体文库。
[0123]
本实施例所得的文库可以作为原料返回实施例4进行噬菌体表面展示筛选。
[0124]
实施例6:单克隆抗体菌落的获得
[0125]
本实施例利用实施例4所得的噬菌体获得单克隆纳米抗体菌落。具体步骤为:
[0126]
(1)将所述表达有特异性纳米抗体的噬菌体侵染培养至合适状态的大肠杆菌,但不再加入辅助噬菌体;
[0127]
(2)待噬菌体侵染完全后,将这些大肠杆菌均匀涂抹于细菌培养皿培养,即可得到含有纳米抗体dna质粒的单克隆菌落。
[0128]
实施例7:阳性单克隆抗体的鉴定
[0129]
本实施例对实施例6获得的单克隆菌落进行鉴定。具体步骤如下:
[0130]
(1)挑取4组所述单克隆菌落于微孔板分别进行培养;
[0131]
(2)加入iptg诱导vhh-piii(即含有纳米抗体的融合蛋白质)表达;
[0132]
(3)收集含有纳米抗体的细菌培养上清,与抗原孵育;
[0133]
(4)采用酶联免疫吸附分析(elisa)法,检测单克隆纳米抗体是否与胃蛋白酶原ii抗原结合,并依据结合强度检测抗体与抗原的亲和力大小。
[0134]
上述4组单克隆菌落对应抗体与胃蛋白酶原ii抗原的亲和力大小的检测结果如图1~4所示,亲和力数值kd的结果如下表3所示。
[0135]
表3:亲和力测试结果
[0136] kd(nm)pgii_1c5755.10pgii_5f440.19pgii_5f6127.8pgii_5h2211.0
[0137]
由以上结果可知,本实施例挑选得到单克隆菌落所得抗体与所述胃蛋白酶原ii结合的kd值在800nm以下,优选在250nm以下,更优选在150nm以下,更优选在50nm以下。
[0138]
分别对上述4组单克隆菌落进行扩大培养后,提取dna质粒并进行dna测序获得抗体的核苷酸序列,翻译后得到完整氨基酸序列。具体而言,4组单克隆抗体微生物菌落对应的氨基酸序列以及核苷酸序列具体如下表4~表7所示:
[0139]
表4:单抗pgii_1c5的氨基酸序列和核苷酸序列
[0140][0141]
表5:单抗pgii_5f4的氨基酸序列和核苷酸序列
[0142][0143]
表6:单抗pgii_5f6的氨基酸序列和核苷酸序列
[0144][0145][0146]
表7:单抗pgii_5h2的氨基酸序列和核苷酸序列
[0147][0148]
实施例8:小批量抗体生产与制备
[0149]
将实施例7所得纳米抗体的dna质粒转化至bl21(de3)感受态细胞,借助大肠杆菌表达系统小批量表达、纯化单克隆纳米抗体,批产能约数毫克。
[0150]
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。