cxcr7拮抗剂与s1p1受体调节剂的组合
【技术领域】
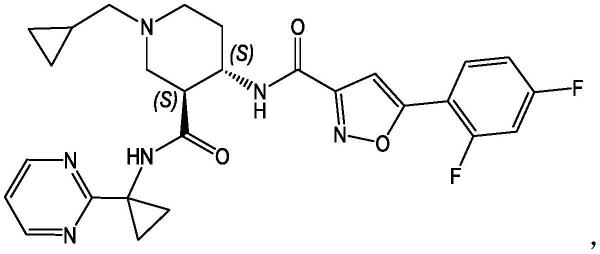
1.本发明系关于化合物(3s,4s)-1-环丙基甲基-4-{[5-(2,4-二氟-苯基)-异恶唑-3-羰基]-胺基}-哌啶-3-羧酸(1-嘧啶-2-基-环丙基)-酰胺(下文中也称为「化合物」):及其作为cxcl11/cxcl12受体cxcr7的调节剂的用途,尤其与包含神经鞘胺醇-1-磷酸受体1调节剂(s1p1受体调节剂)的其他活性成分或治疗剂组合用于预防/防治或治疗其中cxcr7表达或其配体及s1p均发挥作用的疾病及疾患的用途。本发明进一步系关于包含化合物与该(等)其他活性成分或治疗剂的组合的医药组合物。本发明进一步系关于当(例如)每天一次或每天两次施用时可良好耐受且医药有效预防/防治或治疗其中cxcr7表达或其配体发挥作用的疾病及疾患的化合物的每日剂量。
背景技术:
[0002]
自wo2018/019929已知化合物为cxcl11/cxcl12受体cxcr7的调节剂。自wo2019/145460已知化合物的结晶形式。化合物可潜在用于预防/防治或治疗涉及cxcr7受体或其配体的某些疾病及疾患,其等包括:
●
癌症,诸如脑肿瘤,包括恶性神经胶质瘤、多形性神经胶质母细胞瘤;神经母细胞瘤;胰脏癌,包括胰脏腺癌/胰管腺癌;肠胃癌,包括结肠癌、肝细胞癌及胃癌;卡波济肉瘤(kaposi’s sarcoma);白血病,包括成人t细胞白血病;淋巴瘤;肺癌;乳癌;横纹肌肉瘤;前列腺癌;食管鳞癌;口腔鳞状细胞癌;子宫内膜癌;甲状腺癌,包括甲状腺乳头状癌;转移性癌症;肺转移;皮肤癌,包括黑色素瘤及转移性黑色素瘤;膀胱癌;多发性骨髓瘤;骨肉瘤;头颈癌;及肾癌,包括肾透明细胞癌、转移性肾透明细胞癌;
●
炎症性疾病,诸如慢性鼻窦炎、哮喘、慢性阻塞性肺疾患、动脉粥样硬化、心肌炎、急性肺损伤、子宫内膜异位症、葡萄膜炎、糖尿病性视网膜病变及结节病;
●
自体免疫疾患,诸如(炎症性)脱髓鞘疾病;多发性硬化症(ms);格林巴利综合征(guillain barr
éꢀ
syndrome);类风湿性关节炎(ra);炎症性肠病(ibd,尤其包含克罗恩氏病(crohn’s disease)及溃疡性结肠炎);全身性红斑狼疮(sle),包括神经精神全身性红斑狼疮及狼疮性肾炎;间质性膀胱炎;乳糜泻;自体免疫脑脊髓炎;骨关节炎;i型糖尿病;牛皮癣;自体免疫甲状腺炎;舍格伦综合征(syndrome);强直性脊柱炎及白癜风;
●
神经退化性疾患,诸如肌萎缩性侧索硬化;
●
移植排斥(尤其肾同种异体移植排斥、心脏同种异体移植排斥及由造血干细胞
移植引起的移植物抗宿主疾病);
●
纤维化(尤其肝纤维化、肝硬化、肺纤维化、心脏纤维化,尤其特发性肺纤维化;及
●
缺血性损伤,诸如肾缺血或大脑缺血。
[0003]
趋化因子受体系以高亲和力结合肽趋化因子配体的g蛋白偶合受体(gpcr)的组。趋化因子受体的主要功能系在静息状态下及在炎症期间引导白血球运输至淋巴器官及组织,但也已识别某些趋化因子受体对非造血细胞及其等祖细胞的作用。
[0004]
cxcr7(也称ackr3,也称rdc1,也称cmkor1,也称gpr159)具有两个已知的趋化因子配体:cxcl12(也称基质细胞衍生因子1,sdf-1;也称前b细胞生长刺激因子,pbsf)及cxcl11(也称l-tac,也称ifn-g诱导型t细胞化学吸引剂)。cxcl11或cxcl12结合至cxcr7导致cxcr7-配体复合物的内化(burns jm等人,j exp med 2006,203(9):2201-13)及配体的降解(naumann u等人,plos one 2010,5(2):e9175)。此清除活性有助于建立并维持自血管向组织的cxcl11及cxcl12浓度梯度。
[0005]
基质衍生的化学吸引剂cxcl12参与免疫监视及炎症性反应的调节。cxcl12系由骨髓基质细胞、内皮细胞、心脏、骨骼肌、肝、脑、肾、胸腺、淋巴结、实质细胞分泌并在干细胞增生、存活及造血细胞/祖细胞归巢至骨髓中发挥重要作用(rankin sm等人;immunol let.2012,145(1-2):47-54)。cxcl12系在某些病理性疾患(包括缺血、炎症、缺氧、癌症、神经退化性疾病及自体免疫疾病)下诱导(juarez j等人,curr pharm des 2004,10(11):1245-59)。
[0006]
cxcl12也将来源于骨髓的祖细胞募集至脉管系统形成的位点。此外,其在致癌作用中发挥显著作用。cxcl12促进将内皮祖细胞及来源于骨髓的抑制细胞募集至肿瘤位点及来源于骨髓的其他细胞。cxcl12也在炎症期间对细胞迁移、黏附及存活发挥作用(kumar r等人,cell immunol.2012,272(2):230-41)。cxcl12也驱动细胞(诸如寡树突胶细胞祖细胞)的分化、成熟(gottle p等人,ann neurol.2010,68(6):915-24)。
[0007]
cxcl11系主要表现于胰、外周血白血球、胸腺、肝、脾及肺中。此趋化因子系由干扰素诱导并在感染或癌症过程期间上调(cole等人,j exp med.1998,187(12):2009-21)。
[0008]
除cxcr7外,cxcl12结合并活化cxcr4(也称融合素,也称白血球衍生的七跨膜域受体;lestr,也称d2s201e,也称七跨膜片段受体,也称hm89,也称脂多醣相关蛋白3;lap3,也称lps相关蛋白3),而cxcl11结合并活化cxcr3(也称gpr9,也称cd183)。
[0009]
因此,cxcr7与其配体cxcl12及cxcl11(此后称为cxcr7轴)的相互作用涉及将携载受体的细胞引导至体内的特定位置,特别引导至炎症、免疫损伤及免疫功能障碍的位点且也与组织损伤、凋亡的诱导、细胞生长及血管阻滞相关联。cxcr7及其配体系经上调并高度表现于多种病理情况,包括癌症、自体免疫疾患、炎症、感染、移植排斥、纤维化及神经退化中。
[0010]
已揭示cxcr7调节剂具有单独或组合用于以下疾病中的潜在用途,其中已显示cxcr7调节(例如,使用sirna、shrna、microrna、过表现、cxcr7敲除动物、cxcr7激动剂、cxcr7拮抗剂、抗体或纳米抗体)调节白血球迁移(berahovich rd等人;immunology.2014,141(1):111-22)及促进髓磷脂/神经元修复(williams jl等人;j exp med.2014,5;211(5):791-9;gottle p等人;ann neurol.2010,68(6):915-24)、在炎症性、自体免疫及脱髓
ther.2012,133(1):1-18)。发现cxcr7在炎症性肠病(ibd)中在外周血t细胞上上调(werner l等人;j leukoc biol.2011,90(3):583-90)。作者假设「cxcr7在ibd病患的外周血中的增加表现可促进t细胞增加回流至黏膜炎症症位点」(werner l等人;theranostics.2013,3(1):40-6)。在ibd的小鼠模型中,cxcl12途径的调节剂可减少t细胞的浸润及减少组织损伤(mikami s等人;j pharmacol exp ther.2008,327(2):383-92;xia xm等人;plos one.2011,6(11):e27282)。
[0015]
也已在皮损性牛皮廯皮肤中发现cxcl12及cxcl11的高含量(chen sc等人;arch dermatol res.2010,302(2):113-23;zgraggen s等人;plos one.2014,9(4):e93665)。zgraggen等人证实cxcl12的阻断在牛皮癣样皮肤炎症的两种不同模型中改善慢性皮肤炎症的过程。
[0016]
数种其他自体免疫疾患(诸如全身性红斑狼疮(sle))显示改变的cxcr7/cxcr4表现与sle b细胞受损的cxcl12促进的迁移相关(biajoux v等人;j transl med.2012,18;10:251)。另外,在狼疮的多个鼠模型中,cxcl12系在肾病肾中显著上调。wang等人(j immunol.2009,182(7):4448-58)显示在cxcl12轴上发挥作用系狼疮中的良好治疗目标,因为cxcr4拮抗剂显著改善疾病、延长存活并减少肾炎及淋巴组织增生。
[0017]
matin等人(immunology.2002,107(2):222-32)证实用抗体阻断cxcl12在糖尿病的小鼠模型中导致糖尿病发展的减少及胰岛炎的抑制。
[0018]
在来自自体免疫病患的甲状腺中及在动物模型中发现cxcl12及cxcr4系上调(armengol mp等人;j immunol.2003,170(12):6320-8)。liu等人(mol med rep.2016,13(4):3604-12)揭示cxcr4的阻断减小小鼠的自体免疫甲状腺炎的严重性、减少淋巴细胞浸润及自体抗体产生。
[0019]
在来自患有强直性脊柱炎的病患的滑膜组织中发现cxcr4系上调(he c等人;mol med rep.2019,19(4):3237-3246)。cxcr4抑制导致减少的纤维母细胞增生及成骨作用。
[0020]
已显示神经退化性疾患显示经改变的cxcl12/cxcr4表现。此途径涉及自我更新及多能神经祖细胞的募集及分化,其等在组织修复期间发挥关键作用。meizhang等人回顾在动物模型中cxcl12在神经退化性疾病中的作用及cxcl12传讯途径的操作对神经退化性疾患的影响(meizhang等人,trends neurosci.2012,35(10):619-628)。最近,在帕金森氏症(parkinson’s disease)病患的外周血中发现cxcl12及cxcr4的表现系上调(bagheri等人,neuroimmunomodulation.2018,25(4):201-205)。cxcr4/cxcl12途径也已涉及阿兹海默症(alzheimer’s disease)中发生的炎症性过程(hongyan等人,brain circ.2017,3(4):199-203)。rabinovich-nikitin等人教示阻断cxcr4/cxcl12传讯在肌肉萎缩性脊髓侧索硬化症(als)的模型中减少微胶质细胞炎症、降低血脑屏障通透性及增加运动神经元的数量、增加小鼠的存活(rabinovich-nikitin等人,j neuroinflammation.2016,13:123)。
[0021]
cxcr7也称为数种类鸦片肽(尤其脑啡肽及强啡肽)的清除剂受体,调节其等可用率并藉此通过其等经典类鸦片受体调节传讯(meyrath m等人,nat commun.2020;11(1):3033)。因为cxcr7用作类鸦片肽的广谱清除剂,所以施用cxcr7拮抗剂可导致此等类鸦片肽的增加,类似于针对趋化因子配体cxcl11及cxcl12观测到的增加。因此,内源性类鸦片含量的调节可用于临床疼痛管理及伤害性知觉的控制中(holden je等人,aacn clin issues.2005;16(3):291-301)。已显示结合至cxcr7的强啡肽原衍生的肽的脑脊液含量在
杭丁顿氏舞蹈症(huntington’s disease)病患中降低(al shweiki mr等人,mov disord.2020;doi:10.1002/mds.28300),因此藉由施用cxcr7拮抗剂增加此等肽的含量可有利于此疾病。内源性类鸦片肽也涉及情绪障碍,诸如抑郁症(m等人,mol psychiatry.2019;24(4):576-587)。因此,可预期可使用藉由阻断清除受体cxcr7调节内源性肽含量以治疗情绪障碍。沿彼等思路,已显示cxcr7调节剂在临床前模型中具有抗焦虑活性(ikeda y等人,cell.2013;155(6):1323-36)。因此,除涉及上文提及的cxcr7受体或其配体的疾病及疾患外,cxcr7调节剂也可适用于预防/防治或治疗涉及类鸦片受体传讯的某些疾病及疾患,包括神经性疼痛、神经退化性疾病,包括杭丁顿氏舞蹈症、成瘾症、情绪障碍、焦虑症。
[0022]
数种神经鞘胺醇-1-磷酸受体1调节剂(或者也称为s1p1受体调节剂,其包含非选择性s1p1受体调节剂诸如芬戈莫德(fingolimod),及选择性s1p1受体调节剂)系s1p1受体激动剂,其作为功能拮抗剂以药理学方式作用于s1p1受体。已将s1p1受体调节剂描述为适用于预防及/或治疗与经活化的免疫系统相关联的疾病或疾患(juif等人,exp.op.drug metabol.&tox.(2016)12(8),879-895)。s1p1受体调节剂间接拮抗该s1p1受体的功能并隔绝淋巴结中的淋巴细胞(subei等人,cns drugs.2015jul;29(7):565-575)。经证实多种s1p1受体调节剂以相同方式通过s1p1传讯,导致s1p1受体降解(lukas等人,j.biomol.screening(2014)19(3)407-416)。在临床实务中,s1p1受体调节剂(包括非选择性及选择性s1p1受体调节剂)显示缓慢性不整脉及房室传导阻滞(av阻滞)的风险。因此,例如,对于芬戈莫德,建议应在病患开始治疗期间一般监测心率及血压。已提出藉由使用上滴定剂量方案降低风险且此等剂量方案系用于临床实务中(例如,参见,对于芬戈莫德:wo2006/058316、wo2010/075239、wo2011/041145、wo2013/055833;对于庞西莫德(ponesimod):wo2009/115954、wo2016/091996;对于西波莫德(siponimod):wo2010/072703、wo2013/057212、wo2015/155709)。可获得或在研发中的某些s1p1受体调节剂的另一潜在警告系治疗一般导致淋巴细胞减少症,及在某些情况下可导致严重的淋巴细胞减少症,与感染的风险增加相关联。与另一活性成分的组合可导致效用增加及/或存在更高的淋巴细胞计数。此外,与另一活性成分的组合可容许减小s1p1受体调节剂的最小有效剂量。因此,与另一活性成分的此组合可具有优势,尤其在免疫系统可需重新活化的情况下,例如,在紧急情况(诸如急性感染)下。
[0023]
已将s1p1受体调节剂特别描述为在治疗多发性硬化症(ms)中具有独特的作用机制(chaudhry等人,neurotherapeutics(2017)14:859-873)。ms系cns的慢性炎症性及脱髓鞘疾病,其中炎症性过程系与髓磷脂的破坏相关联,导致出现脱髓鞘作用的大病灶病变。由于炎症性脱髓鞘作用,也出现轴突损伤及损失,即使在不同程度下。主动髓鞘再生过程可至少部分修复髓磷脂病变,而轴突损失系永久且不可逆的。主要认为ms系自体免疫神经退化性疾病,即,由对自身抗原的适应性免疫反应引起的疾病。在ms中,经活化的髓磷脂反应性t细胞系自外周募集至cns,导致微胶质细胞的活化及导致循环巨噬细胞的募集(grassi等人,frontiers in pharmacology 2019,doi:10.3389/fphar.2019.00807)。
[0024]
已揭示s1p1受体调节剂在神经退行性疾病中的潜在用途,其中s1p1受体调节剂直接作用于cns驻留细胞诸如微胶质细胞、星状细胞、神经元、寡树突胶细胞祖细胞及寡树突胶细胞(miron等人,j neurol sci.2008,274(1-2):13-7),在神经退化的实验疾病模型中
提供有利影响。
[0025]
具体而言,自参考文献已知s1p对神经退化性疾病的影响。yazdi等人最近讨论支持s1p1受体调节剂直接影响髓鞘形成的实验及临床研究(yazdi等人,j neuro res.2019,00:1-13)。angelopoulou等人最近综述s1p涉及阿兹海默症(ad)发病机理及s1p1受体调节剂在ad模型中的有利影响(angelopoulou等人,neuromolecular med.2019,21(3):227-238)。显示s1p1受体调节剂可减少神经功能缺损并在肌肉萎缩性脊髓侧索硬化症(als)的模型中延长小鼠的存活、调节神经炎症性反应并增加来源于脑的神经营养因子的表现(potenza等人,neurotherapeutics.2016,13(4):918-927)。miguez等人教示s1p1受体调节剂在杭丁顿氏舞蹈症的小鼠模型中改善海马突触可塑性及记忆、减少星状细胞增生及减少局部炎症(miguez等人,hum mol genet.2015,24(17):4958-70)。
[0026]
芬戈莫德(2-胺基-2-[2-(4-辛基苯基)乙基]-丙烷-1,3-二醇,cas reg.no.162359-55-9,例如wo2008/000419、wo2010/055027、wo2010/055028、wo2010/072703)系指示用于治疗多发性硬化症(ms)的复发形式的非选择性s1p1受体调节剂。芬戈莫德0.5mg每天一次在许多国家被批准用于复发的多发性硬化症及在欧盟被批准用于高度活性复发缓解型ms(rrms)的第一经口疗法。在美国,指示芬戈莫德用于治疗多发性硬化症(ms)的复发形式,包括临床孤立综合征、复发缓解型疾病及活性继发性进行性疾病,在10岁及以上的病患中,针对体重超过40kg的成人及儿童病患推荐剂量为0.5mg经口每天一次。在最后剂量的芬戈莫德后长达2个月内,芬戈莫德仍留在血液中且具有药效动力学效应,包括减少的淋巴细胞计数。停止疗法后1至2个月内,淋巴细胞计数一般恢复至正常范围。尽管观测到长冲淡期,但也已显示将芬戈莫德的剂量(例如)减少至0.5mg每隔一天,可在很大比例的病患中导致疾病重新活化(zecca等人,multiple sclerosis journal(2017)24(2),167-174)。
[0027]
庞西莫德[(r)-5-[3-氯-4-(2,3-二羟基-丙氧基)-苯[z]亚甲基]-2-([z]-丙基亚胺基)-3-邻甲苯基-噻唑啶-4-酮,cas reg.no.854107-55-4,例如wo2005/054215、wo2008/062376、wo2010/046835、wo2014/027330]系选择性s1p1受体激动剂及其经口施用导致外周血淋巴细胞的数量一致、持续及剂量依赖性减少。已描述庞西莫德适用于治疗及/或预防与经活化的免疫系统相关联的疾病或疾患(例如,参见wo 2005/054215及wo 2009/115954)。特别地,庞西莫德已在第ii阶段/第iii阶段试验中在患有中度至重度慢性斑块型牛皮癣的病患中及在患有复发缓解型多发性硬化症的病患中显示临床益处。庞西莫德可根据wo 2005/054215、wo 2008/062376及wo 2014/027330中揭示的程序制备。
[0028]
塞那莫德(cenerimod)[(s)-3-[[4-[5-(2-环戊基-6-甲氧基吡啶-4-基)[1,2,4]恶二唑-3-基]-2-乙基-6-甲基苯基]-氧基]-丙烷-1,2-二醇,cas reg.no.1262414-04-9,例如wo2011/007324、wo2013/175397、wo2016/184939、piali等人,pharmacol res perspect.2017;e00370]系选择性s1p1受体激动剂并进入多剂量效用及安全性研究中用于治疗全身性红斑狼疮。塞那莫德似乎无需上滴定剂量方案。
[0029]
西波莫德(1-(4-[1-[(e)-4-环己基-3-三氟甲基-苯甲氧基亚胺基]-乙基]-2-乙基-苯甲基)-氮杂环丁烷-3-羧酸,cas reg.no.1230487-00-9,例如wo2004/103306、wo2010/071794、wo2010/080409、wo2010/080455、wo2019/064184)系s1p1受体调节剂并经研究用于治疗继发性进行性多发性硬化症(spms),其系独立于急性复发发生的多发性硬化
症的进行性神经学衰退。在活性spms中,西波莫德降低残疾及ms复发的风险。在美国,指示西波莫德用于治疗多发性硬化症(ms)的复发形式,包括临床孤立综合征(定义为持续至少24h且由于在中枢神经系统中炎症或脱髓鞘作用引起的神经系统症状的首次发作)、复发缓解型疾病及活性继发性进行性疾病(spms),在成人中建议维持剂量为2mg经口每天一次。停止西波莫德疗法后,西波莫德仍留在血液中长达10天。在此间隔期间开始其他疗法将导致伴随曝露于西波莫德。在90%的病患中,淋巴细胞计数于停止疗法后10天内恢复至正常范围。然而,残留的药效动力学效应(诸如降低对外周淋巴细胞计数的影响)可在最后剂量后持续长达3至4周。于此周期内使用免疫抑制剂可导致对免疫系统的累加效应,且因此在最后剂量的西波莫德后3至4周应谨慎使用。
[0030]
奥扎尼莫德(ozanimod)(5-[3-[(1s)-2,3-二氢-1-[(2-羟乙基)胺基]-1h-茚-4-基]-1,2,4-恶二唑-5-基]-2-(1-甲基乙氧基)-苯甲腈,cas reg.no.1306760-87-1,例如wo2011/060392、wo2015/066515、wo2018/184185、wo2018/208855、wo2018/215807、wo2019/058290、wo2019/094409)系研究中s1p1受体调节剂,其系在第iii阶段临床试验中测试用于多发性硬化症(rms)的复发形式的疗法(nct02047734);并在克罗恩氏病及溃疡性结肠炎(uc)中进一步测试。自2020年以来,在美国,指示奥扎尼莫德用于在成人中治疗多发性硬化症(ms)的复发形式,包括临床孤立综合征、复发缓解型疾病及活性继发性进行性疾病;及在欧洲,用于治疗患有复发缓解型多发性硬化症(rrms)的成人病患,及活性疾病如临床或成像特征定义。
[0031]
依曲西莫特(etrasimod)[(3r)-7-[[4-环戊基-3-(三氟甲基)苯基]甲氧基]-1,2,3,4-四氢环戊[b]吲哚-3-乙酸,cas reg.no.1206123-37-6,例如wo2010/011316、wo2011/094008、wo2016/112075、wo2016/209809、al-shamma等人,j pharmacol exp ther(2019)369:311-317]系研究中s1p1受体调节剂,其当前正在研发中(例如)用于炎症性肠病,包括克罗恩氏病及溃疡性结肠炎(uc)的疗法。
[0032]
其他s1p1受体调节剂已经描述及临床测试,然而,其等研发可能已中止:
[0033]
阿米西莫德(amiselimod)(mt-1303,2-胺基-2-[2-[4-(庚氧基)-3-(三氟甲基)苯基]乙基]-1,3-丙二醇,cas reg.no.942399-20-4,例如wo2007/069712、wo2018/021517;harada等人,br j clin pharmacol(2017)83 1011-1027;sugahara等人,br.j.pharmacol.(2017)174 15-27);
[0034]
萨拉福莫德(ceralifimod)(1-[[3,4-二氢-6-[(2-甲氧基-4-丙基苯基)甲氧基]-1-甲基-2-萘基]甲基]-3-氮杂环丁烷羧酸,cas reg.no.891859-12-4,例如wo2006/064757、kurata等人,jmedchem 60(23)(2017),9508-9530);
[0035]
gsk 2018682(4-[5-[5-氯-6-(1-甲基乙氧基)-3-吡啶基]-1,2,4-恶二唑-3-基]-1h-吲哚-1-丁酸,例如wo2008/074821);
[0036]
cs-0777(1-[5-[(3r)-3-胺基-4-羟基-3-甲基丁基]-1-甲基-1h-吡咯-2-基]-4-(4-甲基苯基)-1-丁酮,cas reg.no.827344-05-8,例如wo2005/079788、nishi等人,med chem lett.2011 2;2(5):368-72);及
[0037]
莫拉韦莫德(mocravimod)(2-胺基-2-[2-(2-氯-4-{[3-(苯基甲氧基)苯基]硫基}苯基)乙基]丙烷-1,3-二醇;kep203,cas reg.no.509092-16-4,例如us 9,920,005、us 6,960,692),其等经揭示进入高风险急性骨髓性白血病的研究中。
技术实现要素:
[0038]
现已发现化合物(在预防/防治及治疗对cxcl12受体及/或cxcl11受体的活化产生反应的疾病及疾患中具有潜力的cxcr7拮抗剂),当与s1p1受体调节剂组合用于治疗具有炎症性自体免疫反应的组分,及/或神经退化性反应的组分的此等疾病及疾患时,可具有互补及甚至协同效应。因此,此组合可尤其适用于预防/防治及/或治疗自体免疫及炎症性疾病及疾患、移植排斥及神经退化性疾病及疾患(尤其具有炎症性组分的自体免疫疾病及疾患,特别地,自体免疫及/或炎症性脱髓鞘疾病及疾患,包括多发性硬化症)。另外,化合物的潜在髓鞘再生药理效应可配补s1p1受体调节剂,其等系针对此等炎症性脱髓鞘疾病的临床上建立的治疗选择。此外,化合物与s1p1受体调节剂的组合可容许减少相应的s1p1受体调节剂的剂量,可能甚至减少至低于此s1p1受体调节剂在单独施用时建立的最佳有效剂量的剂量,因此,潜在减轻已知与某些s1p1受体调节剂相关联的某些安全性责任[例如,对心血管系统(心动过缓)的影响,及/或在严禁曝露于s1p1受体调节剂的情况下,在治疗中止后长期残留的曝露,及/或(潜在严重的)淋巴细胞减少症]。
【附图说明】
[0039]
图1显示如由累积疾病分数评估,化合物对eae疾病的整体程度的剂量依赖性效应。
[0040]
图2显示在小鼠mog诱导的eae模型中,化合物对cxcl12血浆浓度的剂量依赖性效应。
[0041]
图3显示如由累积疾病分数评估,芬戈莫德(0.03mg/kg,q.d.)对eae疾病的整体程度的效应。
[0042]
图4显示在eae小鼠模型中,化合物、芬戈莫德及其组合对平均临床分数的治疗效用。
[0043]
图5显示化合物、芬戈莫德及其组合对小鼠eae疾病的严重性的治疗效应,表示为最大临床分数。
[0044]
图6显示在小鼠eae模型中,化合物、芬戈莫德及其组合对神经丝轻链血浆浓度的治疗效应。
[0045]
图7显示在小鼠eae模型中,化合物、芬戈莫德及其组合对血液淋巴细胞计数的效应。
[0046]
图8显示在小鼠eae模型中,化合物、芬戈莫德及其组合对血浆cxcl12浓度的效应。
[0047]
图9显示如在双环己酮草酰二腙诱导的脱髓鞘作用小鼠模型中确定,化合物对髓鞘形成的直接效应。
[0048]
图10显示在小鼠双环己酮草酰二腙诱导的脱髓鞘作用模型中,化合物对成熟寡树突胶细胞数量的效应。
[0049]
图11显示在小鼠双环己酮草酰二腙诱导的脱髓鞘作用模型中,在双环己酮草酰二腙停药前一周开始的化合物或芬戈莫德对脱髓鞘作用/髓鞘再生的治疗效应。
[0050]
图12显示如由累积疾病分数评估,化合物对疾病的整体程度的剂量依赖性效应。
[0051]
图13显示在小鼠plp诱导的eae模型中,化合物对血浆cxcl12浓度的剂量依赖性效应。
[0052]
图14显示在单一剂量后在人类健康受试者中的峰值cxcl12血浆浓度的剂量-反应关系。
[0053]
图15显示在由剂量分层的稳态下的预测曝露反应关系。【实施方式】
[0054]
1)第一实施例系关于包含化合物或其医药上可接受的盐作为活性成分,与s1p1受体调节剂或其医药上可接受的盐及至少一种医药上可接受的(惰性)赋形剂的组合的医药组合物。
[0055]
根据实施例1)的医药组合物可用作药剂,例如以用于经肠(诸如尤其经口)或非经肠施用(包括局部施用或吸入)的医药组合物的形式。
[0056]
2)另一实施例系关于根据实施例1)的医药组合物,其中该s1p1受体调节剂系芬戈莫德、庞西莫德、西波莫德、奥扎尼莫德、塞那莫德、依曲西莫特、阿米西莫德、萨拉福莫德、gsk 2018682或cs-0777;或另外,莫拉韦莫德(尤其芬戈莫德、庞西莫德、西波莫德或奥扎尼莫德;或另外,塞那莫德);或其医药上可接受的盐。
[0057]
3)另一实施例系关于根据实施例1)的医药组合物,其中该s1p1受体调节剂或其医药上可接受的盐系芬戈莫德、庞西莫德、西波莫德、奥扎尼莫德、塞那莫德或依曲西莫特(尤其芬戈莫德、庞西莫德、西波莫德或奥扎尼莫德)或其医药上可接受的盐。
[0058]
4)另一实施例系关于根据实施例1)的医药组合物,其中该s1p1受体调节剂或其医药上可接受的盐系塞那莫德、依曲西莫特或阿米西莫德(尤其塞那莫德或依曲西莫特)或其医药上可接受的盐。
[0059]
5)另一实施例系关于根据实施例1)的医药组合物,其中该s1p1受体调节剂或其医药上可接受的盐系芬戈莫德或其医药上可接受的盐。
[0060]
6)另一实施例系关于根据实施例1)的医药组合物,其中该s1p1受体调节剂或其医药上可接受的盐系庞西莫德或其医药上可接受的盐。
[0061]
7)另一实施例系关于根据实施例1)的医药组合物,其中该s1p1受体调节剂或其医药上可接受的盐系西波莫德或其医药上可接受的盐。
[0062]
8)另一实施例系关于根据实施例1)的医药组合物,其中该s1p1受体调节剂或其医药上可接受的盐系奥扎尼莫德或其医药上可接受的盐。
[0063]
9)另一实施例系关于根据实施例1)的医药组合物,其中该s1p1受体调节剂或其医药上可接受的盐系塞那莫德或其医药上可接受的盐。
[0064]
10)另一实施例系关于根据实施例1)的医药组合物,其中该s1p1受体调节剂或其医药上可接受的盐系依曲西莫特或其医药上可接受的盐。
[0065]
11)另一实施例系关于根据实施例1)的医药组合物,其中该s1p1受体调节剂或其医药上可接受的盐系阿米西莫德或其医药上可接受的盐。
[0066]
12)另一实施例系关于根据实施例1)至11)中任一项的医药组合物,其中该s1p1受体调节剂或其医药上可接受的盐系包含于适用于经口施用该s1p1受体调节剂的医药剂型中,其中:
●
芬戈莫德或其医药上可接受的盐若存在系包含于该医药剂型中,以适用于经口施用总计每天约0.5mg或更低/的芬戈莫德的单位剂量;
●
西波莫德或其医药上可接受的盐若存在系包含于该医药剂型中,以适用于经口
施用总计每天约2mg或更低的西波莫德的单位剂量;
●
庞西莫德或其医药上可接受的盐若存在系包含于该医药剂型中,以适用于经口施用总计每天约20mg或更低的庞西莫德的单位剂量;及
●
奥扎尼莫德或其医药上可接受的盐若存在系包含于该医药剂型中,以适用于经口施用总计每天约1mg或更低的奥扎尼莫德的单位剂量;
●
塞那莫德或其医药上可接受的盐若存在系包含于该医药剂型中,以适用于经口施用总计每天约4mg或更低的塞那莫德的单位剂量;
●
依曲西莫特或其医药上可接受的盐若存在系包含于该医药剂型中,以适用于经口施用总计每天约2mg或更低的依曲西莫特的单位剂量;及
●
阿米西莫德或其医药上可接受的盐若存在系包含于该医药剂型中,以适用于经口施用总计每天约0.4mg或更低的阿米西莫德的单位剂量。
[0067]
上文剂型尤其意欲用于每天一次(qd)给药该单位剂量。
[0068]
13)另一实施例系关于根据实施例1)至11)中任一项的医药组合物,其中该s1p1受体调节剂或其医药上可接受的盐系包含于适用于经口施用该s1p1受体调节剂的医药剂型中,其中:
●
芬戈莫德或其医药上可接受的盐若存在系包含于该医药剂型中,以适用于经口施用总计每天约0.5mg或更低的芬戈莫德的单位剂量;
●
西波莫德或其医药上可接受的盐若存在系包含于该医药剂型中,以适用于经口施用总计每天约2mg或更低的西波莫德的单位剂量;
●
庞西莫德或其医药上可接受的盐若存在系包含于该医药剂型中,以适用于经口施用总计每天约10mg或更低的庞西莫德的单位剂量;及
●
奥扎尼莫德或其医药上可接受的盐若存在系包含于该医药剂型中,以适用于经口施用总计每天约0.5mg或更低的奥扎尼莫德的单位剂量;
●
塞那莫德或其医药上可接受的盐若存在系包含于该医药剂型中,以适用于经口施用总计每天约2mg或更低的塞那莫德的单位剂量;
●
依曲西莫特或其医药上可接受的盐若存在系包含于该医药剂型中,以适用于经口施用总计每天约1mg或更低的依曲西莫特的单位剂量;及
●
阿米西莫德或其医药上可接受的盐若存在系包含于该医药剂型中,以适用于经口施用总计每天约0.2mg或更低的阿米西莫德的单位剂量。
[0069]
上文剂型系尤其意欲用于每天一次(qd)给药该单位剂量。
[0070]
14)另一实施例系关于根据实施例1)至13)中任一项的医药组合物,其中该s1p1受体调节剂或其医药上可接受的盐系以该s1p1受体调节剂的剂量为该s1p1受体调节剂在作为单一疗法给予时的耐受有效剂量或低于该耐受有效剂量(例如,如核准通知书中针对此s1p1受体调节剂当作为单一疗法给予时用于某一疾病或疾患所指示)来包含。
[0071]
15)另一实施例系关于根据实施例1)至13)中任一项的医药组合物,其中该s1p1受体调节剂或其医药上可接受的盐系以该s1p1受体调节剂的剂量低于该s1p1受体调节剂在作为单一疗法给予时的耐受有效剂量(例如,如核准通知书中针对此s1p1受体调节剂当作为单一疗法给予时用于某一疾病或疾患所指示)来包含。
[0072]
根据实施例1)至15)的此等组合医药组合物尤其适用于预防/防治或治疗其中
thyroiditis);淋巴细胞性甲状腺炎;重症肌无力;巩膜外层炎;巩膜炎;川崎病(kawasaki's disease);葡萄膜视网膜炎;葡萄膜炎,包括后葡萄膜炎及与白塞氏病(behcet's disease)相关联的葡萄膜炎;葡萄膜脑膜炎综合征;过敏性脑脊髓炎;特应性疾病,诸如鼻炎、结膜炎、皮炎;及感染后自体免疫疾病,包括风湿热及感染后肾小球肾炎;拉斯穆森脑炎(rasmussen’s encephalitis)及susac综合征(视网膜静脉脑血管病变);强直性脊柱炎,幼年特发性关节炎、全身性硬化症(全身性硬皮病)、巨细胞动脉炎(gca或颞动脉炎)、原发性胆源性胆管炎(pbc或原发性胆汁性肝硬化);及强病毒感染后细胞介素释放综合征或急性呼吸窘迫综合征(包括covid-19);
●
移植排斥,包括尤其肾同种异体移植排斥、心脏同种异体移植排斥及由造血干细胞移植引起的移植物抗宿主疾病;
●
纤维化,包括尤其肝纤维化、肝硬化、肺纤维化、心脏纤维化;尤其特发性肺纤维化;
●
缺血性损伤,包括尤其肾缺血或大脑缺血;
●
斑秃、嗜酸性食管炎、皮肌炎/多发性肌炎、特应性皮炎及坏疽性脓皮病;
●
神经退化性疾患,包括尤其肌肉萎缩性脊髓侧索硬化症(als)及杭丁顿氏舞蹈症;及阿兹海默症(ad)、帕金森氏症(pd)及肾上腺脑白质失养症;及
●
涉及类鸦片受体传讯的疾病及疾患,包括尤其神经性疼痛;及成瘾症、情绪障碍及焦虑症。
[0076]
应了解其中cxcr7表现或其配体发挥作用的疾病及疾患尤其包含自体免疫及/或炎症性脱髓鞘疾病及疾患,包括自体免疫神经炎的所有形式。
[0077]
应进一步了解神经性疼痛可与其中cxcr7表现或其配体发挥作用的任何其他疾病或疾患相关联。
[0078]
在本发明的另一方面中,现已发现化合物或其医药上可接受的盐在作为单一活性成分施用时可用于预防/防治及治疗如上文定义该等「其中cxcr7表现或其配体发挥作用的疾病及疾患」,其中化合物较佳系在特定药理有效给药方案中使用/施用/待施用。化合物可单独使用(即,作为单一活性成分),尤其在此较佳的特定给药中,用于预防/防治及治疗该等疾病及疾患;或可使用化合物,尤其在此较佳的特定给药方案中,与s1p1受体调节剂组合[例如,以根据实施例1)至15)中任一项的固定剂量组合;或以等效的非固定剂量组合],其中当组合使用时,该等「其中cxcr7表现或其配体发挥作用的疾病及疾患」系使得cxcr7表现或其配体及s1p均发挥作用(如本文定义的此等疾病及疾患)。
[0079]
此特定剂量方案可包括施用化合物或其医药上可接受的盐,以每天约20mg至约300mg的总剂量,其中该总剂量系尤其以一个单位剂量(每天一次=每日一次=qd)或以两个独立的单位剂量(每天两次=每日两次=bid)给予/施用。例如,该总剂量可藉由给药约20mg qd至约300mg qd或约10mg bid至约150mg bid达成。
[0080]
尤其,此剂量方案可包括以约20mg至300mg/天、约20mg至200mg/天、约30mg至150mg/天、约40mg至150mg每天、约50mg至200mg、约50mg至100mg、约100mg至200mg或尤其约75mg至150mg/天的总剂量施用化合物;其中该总剂量系尤其以一个单位剂量(qd)或以两个
独立的单位剂量(bid)给予/施用。此剂量方案的实例包括施用约200mg、约150mg、约100mg、约75mg、约50mg、约30mg或约25mg/天的总剂量,以一个单位剂量(qd)的化合物或以两个独立的单位剂量(bid)的化合物给予,其中此每天两次给药的特定实例将包括(例如)施用约100mg bid、约75mg bid、约50mg bid、约25mg bid或约15mg bid的化合物。
[0081]
为避免疑义,关于本发明,化合物的以mg计的任何量/单位剂量系指适用于以此量/单位剂量施用具有522.56g/mol的分子量的游离碱形式化合物的量/单位剂量。在化合物系以不同于无水游离碱的形式(诸如以医药上可接受的盐;及/或溶剂合物(诸如水合物)的形式)存在于医药组合物中的情况下,此量/单位剂量可需在此组合物中进行调节。在活性成分系(例如)以医药上可接受的盐的形式施用的情况下,应了解医药组合物中活性医药成分(例如,该医药上可接受的盐)的个别量将相应地进行调节。
[0082]
某一剂型/剂量方案在其达成80%至125%的活性成分的最大浓度c
max
的情况下一般认为系等效的(根据fda指导方针生物等效),及活性成分的曝露表示为以给定剂型及剂量方案达成的血浆中个别值的80%至125%的曲线下面积(auc)。
[0083]
i)因此,本发明的一项特定方面系关于化合物或其医药上可接受的盐,用于防治/预防或治疗「其中cxcr7表现或其配体发挥作用的疾病及疾患」(如本文定义),其中化合物系以约20mg至约300mg(尤其约20mg至约200mg;尤其约50mg至约150mg)/天的化合物的总剂量(待)施用。在一子实施例中,该总剂量系尤其以一个单位剂量/天[qd;例如,约20mg qd至约300mg qd(尤其约20mg qd至约200mg qd;尤其约50mg qd至约150mg qd)]或以两个独立的单位剂量/天[bid;例如,约10mg bid至约150mg bid(尤其约10mg bid至约100mg bid;尤其约25mg bid至约75mg bid)]给予/施用。
[0084]
i)(a)在一子实施例中,其中cxcr7表现或其配体发挥作用的此等疾病及疾患尤其包含:
●
自体免疫及/或炎症性疾病及疾患如本文定义;其中该疾病或疾患尤其系自体免疫及/或炎症性脱髓鞘疾病或疾患,包括特别地多发性硬化症(ms)、特发性炎症性脱髓鞘疾病、视神经脊髓炎谱系疾病(包括视神经脊髓炎及(急性)视神经炎)、自体免疫脑脊髓炎(包括急性弥漫性脑脊髓炎(adem)及多相弥漫性脑脊髓炎(mdem))、脊髓炎(包括尤其横贯性脊髓炎谱系障碍,诸如尤其(急性)横贯性脊髓炎及急性弛缓性脊髓炎、脊髓灰质炎、脊髓白质炎及脑膜炎球菌性脊髓炎)、脑干脑炎、抗髓鞘少突胶质细胞醣蛋白(抗mog)相关疾病(包括抗mog脑脊髓炎);格林-巴利综合征、慢性炎症性脱髓鞘多发神经病变(cidp)及抗髓磷脂相关醣蛋白(抗mag)外周神经病变;类风湿性关节炎(ra);炎症性肠病(ibd);特别地,克罗恩氏病或溃疡性结肠炎;全身性红斑狼疮(sle),包括神经精神全身性红斑狼疮及狼疮性肾炎;间质性膀胱炎;乳糜泻;骨关节炎;牛皮癣;i型糖尿病;
bid或约30mg给予/施用约15mg bid/天的化合物;尤其约150mg给予/施用约75mg bid或约100mg给予/施用约50mg bid/天的化合物的总剂量(待)施用。
[0093]
化合物可根据本发明作为单一活性成分(视需要与s1p1受体调节剂组合,即,不与此s1p1受体调节剂组合,或与此s1p1受体调节剂组合)用作药剂,例如以医药组合物的形式,尤其用于经肠或用于非经肠施用。
[0094]
vi)因此,本发明的另一方面系关于包含化合物或其医药上可接受的盐的医药组合物,其中化合物系包含于适用于以如实施例i)至v)中任一项定义的总剂量每天施用化合物的单位剂量中。
[0095]
viii)本发明的另一方面系关于根据实施例i)至v)中任一项使用的化合物或其医药上可接受的盐,其中化合物系用于预防/防治或治疗其中cxcr7表现或其配体及s1p均发挥作用的疾病及疾患;其中本文中下文的实施例16)至35)的特性在细节上做必要的修正后适用。
[0096]
vii)本发明的另一方面系关于根据实施例1)至15)中任一项的,包含化合物或其医药上可接受的盐作为活性成分,与s1p1受体调节剂或其医药上可接受的盐的组合的医药组合物,其中化合物系包含于适用于以如实施例i)至v)中任一项定义的总剂量每天施用化合物的单位剂量中;其中此组合物系尤其用于每天一次(qd)给药/施用。
[0097]
viii)本发明的另一方面系关于根据实施例i)至v)中任一项使用的化合物或其医药上可接受的盐,其中化合物系用于预防/防治或治疗其中cxcr7表现或其配体及s1p均发挥作用的疾病及疾患;其中化合物意欲与s1p1受体调节剂或其医药上可接受的盐组合使用/施用/(意欲)待施用;其中如本文中下文的实施例16)至48)中任一项的特性在细节上做必要的修正后适用。
[0098]
其中cxcr7表现或其配体及s1p均发挥作用的疾病及疾患系其中cxcr7表现或其配体发挥作用的较佳具有炎症性免疫反应的组分的此等疾病及疾患。
[0099]
其中cxcr7表现或其配体及s1p均发挥作用的此等疾病及疾患可特别地定义为包括自体免疫及/或炎症性疾病及疾患、移植排斥及神经退化性疾病及疾患;尤其具有炎症性组分的自体免疫疾病及疾患,特别地,自体免疫及/或炎症性脱髓鞘疾病及疾患。
[0100]
术语「移植排斥」可定义为包含移植器官(诸如肾、肝、心脏、肺、胰、角膜及皮肤)的排斥;由造血干细胞移植引起的移植物抗宿主疾病;慢性同种异体移植排斥及慢性同种异体血管病变。
[0101]
术语「神经退化性疾病及疾患」可定义为包含尤其其中cxcr7表现或其配体及s1p在与此疾病及疾患相关联的神经退化(例如,胶质细胞活化、神经元存活、髓鞘形成)中均发挥作用的神经退化性疾病及疾患。特定实例包括肌肉萎缩性脊髓侧索硬化症(als)、阿兹海默症(ad)、帕金森氏症(pd)、杭丁顿氏舞蹈症及肾上腺脑白质失养症。
[0102]
术语「自体免疫及/或炎症性疾病及疾患」系特别地指其中cxcr7表现或其配体及s1p均发挥作用的任何自体免疫及/或炎症性疾病或疾患,尤其系指具有炎症性组分的自体免疫疾病及疾患。此等自体免疫及/或炎症性疾病及疾患的实例包含自体免疫及/或炎症性脱髓鞘疾病及疾患,包括自体免疫神经炎的所有形式。特别地,自体免疫及/或炎症性脱髓鞘疾病及疾患包括多发性硬化症(ms)、格林巴利综合征、慢性炎症性脱髓鞘多发神经病变(cidp)及其他自体免疫及/或炎症性脱髓鞘疾病及疾患(其等可与上文列举的自体免疫及/
或炎症性脱髓鞘疾病及疾患相关联),诸如视神经脊髓炎谱系障碍(包括视神经脊髓炎(德威克氏病)及(急性)视神经炎)、自体免疫脑脊髓炎(包括急性弥漫性脑脊髓炎(adem)及多相弥漫性脑脊髓炎(mdem))、脊髓炎(包括尤其横贯性脊髓炎谱系障碍,诸如尤其(急性)横贯性脊髓炎及急性弛缓性脊髓炎、脊髓灰质炎、脊髓白质炎及脑膜炎球菌性脊髓炎)、脑干脑炎及抗髓鞘少突胶质细胞醣蛋白(抗mog)相关疾病(包括抗mog脑脊髓炎);类风湿性关节炎(ra);炎症性肠病(ibd,尤其包含克罗恩氏病及溃疡性结肠炎);全身性红斑狼疮(sle)(包括神经精神全身性红斑狼疮及狼疮性肾炎);间质性膀胱炎;乳糜泻;骨关节炎;牛皮癣;及i型糖尿病。另外,自体免疫及炎症性疾病及疾患进一步包含诸如以下的疾患:牛皮癣性关节炎;抗磷脂综合征;甲状腺炎(诸如桥本甲状腺炎);淋巴细胞性甲状腺炎;重症肌无力;巩膜外层炎;巩膜炎;川崎病;葡萄膜视网膜炎;葡萄膜炎,包括后葡萄膜炎及与白塞氏病相关联的葡萄膜炎;葡萄膜脑膜炎综合征;过敏性脑脊髓炎;特应性疾病,诸如鼻炎、结膜炎、皮炎;及感染后自体免疫疾病,包括风湿热及感染后肾小球肾炎。
[0103]
除上文列举者外,其中cxcr7表现或其配体及s1p均发挥作用的其他自体免疫及/或炎症性疾病或疾患包括自体免疫及/或炎症性脱髓鞘疾病及疾患,诸如拉斯穆森脑炎及susac综合征(视网膜静脉脑血管病变);及其他自体免疫及炎症性疾病及疾患,诸如强直性脊柱炎、幼年特发性关节炎、全身性硬化症(全身性硬皮病)、巨细胞动脉炎(gca或颞动脉炎)、原发性胆源性胆管炎(pbc或原发性胆汁性肝硬化);及强病毒感染后细胞介素释放综合征或急性呼吸窘迫综合征(包括covid-19)。
[0104]
自体免疫及/或炎症性疾病及疾患的特定实例系:
●
自体免疫及/或炎症性脱髓鞘疾病及疾患,包括尤其多发性硬化症(ms)、格林巴利综合征、慢性炎症性脱髓鞘多发神经病变(cidp)及其他自体免疫及/或炎症性脱髓鞘疾病及疾患;
●
类风湿性关节炎(ra);
●
炎症性肠病(ibd),包括尤其克罗恩氏病及溃疡性结肠炎;
●
全身性红斑狼疮(sle)(包括神经精神全身性红斑狼疮及狼疮性肾炎);及除上文列举者外,
●
强直性脊柱炎,及
●
强病毒感染后细胞介素释放综合征或急性呼吸窘迫综合征(包括covid-19)。
[0105]
在一第一子实施例中,术语「自体免疫及/或炎症性疾病及疾患」尤其系指自体免疫及/或炎症性脱髓鞘疾病及疾患,包括尤其多发性硬化症(ms)、格林巴利综合征、慢性炎症性脱髓鞘多发神经病变(cidp)及如本文定义的其他自体免疫及/或炎症性脱髓鞘疾病及疾患,诸如尤其自体免疫脑脊髓炎及脊髓炎。
[0106]
在一第二子实施例中,术语「自体免疫及/或炎症性疾病及疾患」系指炎症性肠病,包括尤其克罗恩氏病及溃疡性结肠炎。
[0107]
在一第三子实施例中,术语「自体免疫及/或炎症性疾病及疾患」系指全身性红斑狼疮(sle),包括神经精神全身性红斑狼疮及狼疮性肾炎。
[0108]
在一第四子实施例中,术语「自体免疫及/或炎症性疾病及疾患」系指强直性脊柱炎。
[0109]
在一第五子实施例中,术语「自体免疫及/或炎症性疾病及疾患」系指强病毒感染
后细胞介素释放综合征或急性呼吸窘迫综合征(包括covid-19)。
[0110]
术语「自体免疫及/或炎症性脱髓鞘疾病及疾患」系指中枢神经系统的脱髓鞘疾病及疾患,诸如尤其多发性硬化症(ms)及特发性炎症性脱髓鞘疾病、视神经脊髓炎谱系疾病(包括视神经脊髓炎(德威克氏病)及(急性)视神经炎)、自体免疫脑脊髓炎(包括急性弥漫性脑脊髓炎(adem)及多相弥漫性脑脊髓炎(mdem))、脊髓炎(包括尤其横贯性脊髓炎谱系障碍,诸如尤其(急性)横贯性脊髓炎及急性弛缓性脊髓炎、脊髓灰质炎、脊髓白质炎及脑膜炎球菌性脊髓炎)、脑干脑炎及抗髓鞘少突胶质细胞醣蛋白(抗mog)相关疾病(包括抗mog脑脊髓炎);及外周神经系统的自体免疫及/或炎症性脱髓鞘疾病及疾患,包括尤其格林-巴利综合征及其慢性对应物慢性炎症性脱髓鞘多发神经病变(cidp,或者也称为慢性复发性多发性神经病变(crp))及抗髓磷脂相关醣蛋白(抗mag)外周神经病变。
[0111]
在一第一子实施例中,术语「自体免疫及/或炎症性脱髓鞘疾病及疾患」尤其系指多发性硬化症(ms)、格林巴利综合征、慢性炎症性脱髓鞘多发神经病变(cidp)及如本文定义的其他自体免疫及/或炎症性脱髓鞘疾病及疾患,诸如尤其自体免疫脑脊髓炎及脊髓炎。
[0112]
在一第二子实施例中,术语「自体免疫及/或炎症性脱髓鞘疾病及疾患」尤其系指为横贯性脊髓炎谱系障碍的脊髓炎,诸如尤其(急性)横贯性脊髓炎;其中该横贯性脊髓炎谱系障碍可为:
●
特发性(无已知原因),或
●
由多发性硬化症引起/与多发性硬化症相关联,或
●
由sle、视神经脊髓炎谱系障碍、抗磷脂综合征或如本文定义的其他自体免疫及炎症性疾病及疾患引起/与sle、视神经脊髓炎谱系障碍、抗磷脂综合征或如本文定义的其他自体免疫及炎症性疾病及疾患相关联;
●
或由感染性疾病诸如病毒、细菌、霉菌或寄生虫的感染引起/与感染性疾病诸如病毒、细菌、霉菌或寄生虫的感染相关联[尤其包括细菌感染(例如,肺炎支原体、亨氏巴尔通体、包柔氏螺旋体(莱姆病)、空肠弯曲杆菌、梅毒、肺结核(tb)的感染);及病毒感染(例如,病毒性脑膜脑炎(脑膜炎),或hiv、单纯疱疹、带状疱疹、巨细胞病毒、爱泼斯坦-巴尔病毒、黄病毒科(诸如寨卡病毒及西尼罗河病毒))的感染];
●
或由疫苗接种(包括针对冠状病毒(诸如sars-cov/sars-cov-1)的疫苗接种)引起/与疫苗接种(包括针对冠状病毒(诸如sars-cov/sars-cov-1)的疫苗接种)相关联。
[0113]
在一第三子实施例中,术语「自体免疫及/或炎症性脱髓鞘疾病及疾患」尤其系指视神经脊髓炎谱系障碍诸如尤其(急性)视神经炎,其中该等视神经脊髓炎谱系障碍可为:
●
特发性(无已知原因),
●
或由多发性硬化症引起/与多发性硬化症相关联,或
●
由sle或其他自体免疫及/或炎症性疾病及疾患引起/与sle或其他自体免疫及/或炎症性疾病及疾患相关联;或
●
由感染性疾病(包括尤其莱姆病)引起/与感染性疾病(包括尤其莱姆病)相关联。
[0114]
同样,在一第四子实施例中,术语「自体免疫及/或炎症性脱髓鞘疾病及疾患」尤其系指任何自体免疫及/或炎症性脱髓鞘疾病或疾患,诸如尤其ms,其系与视神经脊髓炎谱系
障碍(诸如尤其(急性)视神经炎)相关联。
[0115]
术语「特发性炎症性脱髓鞘疾病」系指病因不明的炎症性脱髓鞘疾病;尤其系指(例如)就慢性、严重性及临床病程而言不同的多发性硬化症的变体或边界形式。
[0116]
「自体免疫及/或炎症性疾病及疾患」的特定实例系自体免疫脱髓鞘疾病多发性硬化症(ms),其中应了解ms可进一步分类为复发缓解型ms、原发性进行性ms或继发性进行性ms。
[0117]
自体免疫及/或炎症性脱髓鞘疾病及疾患(诸如尤其ms)的特定特征系关于此疾病或疾患存在的脱髓鞘作用方面。因此,本发明的一方面系关于治疗自体免疫及/或炎症性脱髓鞘疾病或疾患(诸如尤其ms),其中降低该疾病或疾患的进展速率,尤其降低脱髓鞘作用的进展速率及/或不可逆神经退化性损伤(诸如轴突损伤)的出现速率。本发明的一额外方面系关于治疗自体免疫及/或炎症性脱髓鞘疾病或疾患(诸如尤其ms),其中该治疗影响/导致髓鞘再生。
[0118]
术语「临床孤立综合征」(cis)系指持续至少24h且由中枢神经系统(cns)中的炎症或脱髓鞘作用引起的神经系统症状的首次发作。该发作一般为自体免疫及/或炎症性脱髓鞘疾病或疾患(特别地,ms)的特性,然而,诊断为已经历cis的病患可或可不后续发展自体免疫及/或炎症性脱髓鞘疾病或疾患(特别地,ms)。当cis伴有(例如)藉由脑mri(磁共振成像)识别的与彼等在ms中可见者类似的病变时,此人极有可能出现神经系统症状的第二次发作且诊断为复发缓解型ms。当cis在脑mri上不伴有ms样病变时,此人发展ms的可能性远远更低。针对ms的诊断标准(例如,参见2018修订指南:https://www.mscare.org/page/mri_protocol)使得其可能在已经历cis的病患中诊断ms,该病患在脑mri上也已具有特定发现,该等发现提供不同位置中损伤的早期发作的证据并指示除引起当前症状的区域外的区域中的活性炎症。患有cis的个体可视为正处于发展ms的高风险下。在美国,此等病患可用已由美国食品及药物管理局(fda)出于该目的批准的疾病修饰疗法治疗。已显示cis的早期治疗延迟自体免疫及/或炎症性脱髓鞘疾病或疾患(特别地,ms)的发作。
[0119]
术语防治/预防自体免疫及/或炎症性脱髓鞘疾病或疾患因此尤其包括延迟此自体免疫及/或炎症性脱髓鞘疾病或疾患的发作[例如,藉由防止脱髓鞘作用及/或藉由防止最初发生的脱髓鞘作用的髓鞘再生(诸如在临床孤立综合征中)]。
[0120]
因此,本发明的另一方面系关于根据实施例1)至15)的医药组合物,其等用于防治/预防自体免疫及/或炎症性脱髓鞘疾病或疾患(特别地ms),其中自体免疫及/或炎症性脱髓鞘疾病或疾患(特别地ms)的该防治/预防包括在已经历cis/已诊断为已经历cis的病患中延迟该自体免疫及/或炎症性脱髓鞘疾病或疾患(特别地ms)的发作。
[0121]
在本发明的一个特定实施例中,根据实施例1)至15)的该等组合医药组合物预防或治疗脱髓鞘作用;其中尤其待治疗的个体已诊断为患有如本文定义的自体免疫及/或炎症性脱髓鞘疾病及疾患。
[0122]
在本发明的另一特定实施例中,根据实施例1)至15)的该等组合医药组合物预防或治疗病患的脱髓鞘作用,其中脱髓鞘作用的该预防或治疗另外包括髓鞘再生效应;其中尤其待治疗的个体已诊断为患有如本文定义的自体免疫及/或炎症性脱髓鞘疾病及疾患。
[0123]
16)本发明的第二方面系关于化合物或其医药上可接受的盐,用于预防/防治或治疗其中cxcr7表现或其配体及s1p均发挥作用的疾病及疾患,尤其用于预防/防治或治疗自
体免疫及炎症性疾病及疾患、移植排斥及神经退化性疾病及疾患(尤其自体免疫及/或炎症性疾病及疾患;尤其具有炎症性组分的自体免疫疾病及疾患,特别地,自体免疫及/或炎症性脱髓鞘疾病及疾患);其中化合物系(意欲)与s1p1受体调节剂或其医药上可接受的盐组合(待)施用。
[0124]
17)另一实施例系关于根据实施例16)使用的化合物或其医药上可接受的盐;其中此用途用于治疗:
●
自体免疫及/或炎症性疾病及疾患;其中该疾病或疾患尤其系:自体免疫及/或炎症性脱髓鞘疾病或疾患,包括特别地多发性硬化症(ms);特发性炎症性脱髓鞘疾病;视神经脊髓炎谱系(包括视神经脊髓炎及(急性)视神经炎);自体免疫脑脊髓炎,包括急性弥漫性脑脊髓炎(adem)及多相弥漫性脑脊髓炎(mdem);脊髓炎,包括尤其横贯性脊髓炎谱系障碍,诸如尤其(急性)横贯性脊髓炎及急性弛缓性脊髓炎、脊髓灰质炎、脊髓白质炎及脑膜炎球菌性脊髓炎;脑干脑炎;抗髓鞘少突胶质细胞醣蛋白(抗mog)相关疾病(包括抗mog脑脊髓炎);格林-巴利综合征;慢性炎症性脱髓鞘多发神经病变(cidp);及抗髓磷脂相关醣蛋白(抗mag)外周神经病变;类风湿性关节炎(ra);炎症性肠病(ibd);特别地,克罗恩氏病或溃疡性结肠炎;全身性红斑狼疮(sle),包括神经精神全身性红斑狼疮及狼疮性肾炎;间质性膀胱炎;乳糜泻;骨关节炎;牛皮癣;i型糖尿病;或除上文列举者外,强直性脊柱炎;或强病毒感染后细胞介素释放综合征或急性呼吸窘迫综合征(包括covid-19);
●
移植排斥;其中该移植排斥尤其系移植器官诸如肾、肝、心脏、肺、胰、角膜或皮肤的排斥;由造血干细胞移植引起的移植物抗宿主疾病;慢性同种异体移植排斥及慢性同种异体血管病变;或
●
神经退化性疾病及疾患;其中该神经退化性疾病及疾患尤其系肌肉萎缩性脊髓侧索硬化症(als)或杭丁顿氏舞蹈症;或另外,阿兹海默症(ad)、帕金森氏症(pd)或肾上腺脑白质失养症。
[0125]
18)另一实施例系关于根据实施例16)使用的化合物或其医药上可接受的盐,其中cxcr7表现或其配体及s1p均发挥作用的该疾病及疾患系选自以下的自体免疫及/或炎症性疾病或疾患:
●
自体免疫及/或炎症性脱髓鞘疾病或疾患,尤其选自多发性硬化症(ms);特发性炎症性脱髓鞘疾病;自体免疫脑脊髓炎,包括急性弥漫性脑脊髓炎(adem)及多相弥漫性脑脊髓炎(mdem);格林-巴利综合征;慢性炎症性脱髓鞘多发神经病变(cidp);抗髓磷脂相关醣蛋白(抗mag)外周神经病变;及髓鞘少突胶质细胞醣蛋白(mog)-抗体相关疾病;及脊髓炎,包括尤其横贯性脊髓炎谱系障碍,诸如尤其(急性)横贯性脊髓炎及急性弛缓性脊髓炎、
脊髓灰质炎、脊髓白质炎及脑膜炎球菌性脊髓炎;
●
炎症性肠病,尤其选自克罗恩氏病及溃疡性结肠炎;或
●
全身性红斑狼疮(sle),包括神经精神全身性红斑狼疮及狼疮性肾炎。
[0126]
术语「预防/防治或治疗」在本文定义的疾病及疾患的内文中,尤其根据实施例16)、17)及18),尤其系指治疗该等疾病及疾患;其中对于慢性进行性疾病及疾患(包括原发性或继发性进行性及复发缓解型),术语「治疗」特别地系指降低该等疾病或疾患的进展速率。进展速率的此降低可(例如)由残疾进展的速率降低;不可逆神经退化性损伤(诸如轴突损伤)的速率降低;脱髓鞘的速率降低表示;或在该疾病或疾患与脑/中枢神经系统相关的情况下,由脑萎缩/大脑萎缩(诸如尤其藉由磁共振成像(mri)诊断)的速率降低表示。
[0127]
在另一方面中,术语「预防/防治或治疗」在本文定义的疾病及疾患的内文中,尤其根据实施例16)、17)及18),尤其也系指预防/防治该等疾病及疾患,特别地系指在处于发展此疾病或疾患的风险下/已诊断为处于发展此疾病或疾患的风险下的个体中延迟该等疾病或疾患的发作;例如已经历临床孤立综合征(cis)/已诊断为已经历cis的个体,此cis一般已知指示此个体可处于风险下。发作的此延迟可(例如)由直至可建立该疾病或疾患的诊断的时间的增加表示;特别地,其可由直至残疾的时间的增加;若适用,由直至首次复发的时间的增加;直至(进展)不可逆神经退化性损伤(诸如轴突损伤)的诊断的时间的增加;直至脱髓鞘作用的诊断的时间的增加;或在该疾病或疾患系与脑/中枢神经系统相关的情况下,直至进展脑萎缩/大脑萎缩(诸如尤其藉由磁共振成像(mri)诊断)的诊断的时间的增加表示。
[0128]
19)另一实施例系关于化合物或其医药上可接受的盐,用于预防/防治或治疗神经退化性疾病或疾患;其中该神经退化性疾病或疾患尤其系肌肉萎缩性脊髓侧索硬化症(als)或杭丁顿氏舞蹈症;或阿兹海默症(ad)、帕金森氏症(pd)或肾上腺脑白质失养症;其中化合物系(意欲)与s1p1受体调节剂或其医药上可接受的盐组合待施用。
[0129]
20)另一实施例系关于根据实施例19)使用的化合物或其医药上可接受的盐,其中此用途系用于治疗经诊断患有该神经退化性疾病或疾患的病患,其中该治疗降低该神经退化性疾病或疾患的进展速率。
[0130]
21)另一实施例系关于根据实施例20)使用的化合物或其医药上可接受的盐;其中该神经退化性疾病或疾患的此降低的进展速率可由脑萎缩/大脑萎缩(诸如尤其藉由磁共振成像(mri)诊断)的速率降低表示。
[0131]
22)另一实施例系关于根据实施例16)至18)中任一项使用的化合物或其医药上可接受的盐,其中化合物系用于预防/防治或治疗自体免疫及/或炎症性脱髓鞘疾病或疾患;其中尤其此自体免疫及/或炎症性脱髓鞘疾病或疾患系:
●
多发性硬化症(ms);
●
特发性炎症性脱髓鞘疾病;
●
视神经脊髓炎谱系疾病(包括视神经脊髓炎及(急性)视神经炎);
●
自体免疫脑脊髓炎(包括急性弥漫性脑脊髓炎(adem)及多相弥漫性脑脊髓炎(mdem));
●
脊髓炎(包括尤其横贯性脊髓炎谱系障碍,诸如尤其(急性)横贯性脊髓炎,及急性弛缓性脊髓炎、脊髓灰质炎、脊髓白质炎及脑膜炎球菌性脊髓炎);
●
脑干脑炎;
●
抗髓鞘少突胶质细胞醣蛋白(抗mog)相关疾病(包括抗mog脑脊髓炎);
●
格林-巴利综合征;
●
慢性炎症性脱髓鞘多发神经病变(cidp);或
●
抗髓磷脂相关醣蛋白(抗mag)外周神经病变。
[0132]
23)另一实施例系关于根据实施例22)使用的化合物或其医药上可接受的盐,其中此用途系用于治疗已诊断患有自体免疫及/或炎症性脱髓鞘疾病或疾患的病患,其中该治疗降低该自体免疫及/或炎症性脱髓鞘疾病或疾患的进展速率;其中尤其此自体免疫及/或炎症性脱髓鞘疾病或疾患系如实施例22)中列举。
[0133]
24)另一实施例系关于根据实施例22)使用的化合物或其医药上可接受的盐,其中此用途系用于预防/防治该自体免疫及/或炎症性脱髓鞘疾病或疾患;其中该自体免疫及/或炎症性脱髓鞘疾病或疾患的发作系在处于发展此疾病或疾患的风险下/已诊断为处于发展此疾病或疾患的风险下的个体中延迟;其中尤其此自体免疫及/或炎症性脱髓鞘疾病或疾患系如实施例22)中列举。
[0134]
25)另一实施例系关于根据实施例23)使用的化合物或其医药上可接受的盐;其中该自体免疫及/或炎症性脱髓鞘疾病或疾患的此降低的进展速率可由脱髓鞘的速率降低及/或不可逆神经退化性损伤(诸如轴突损伤)的速率降低表示。
[0135]
26)另一实施例系关于根据实施例23)或25)使用的化合物或其医药上可接受的盐;其中该自体免疫及/或炎症性脱髓鞘疾病或疾患的此降低的进展速率可尤其由残疾进展的速率降低表示。
[0136]
27)另一实施例系关于根据实施例23)、25)或26)使用的化合物或其医药上可接受的盐;其中该自体免疫及/或炎症性脱髓鞘疾病或疾患的此降低的进展速率可由脑萎缩/大脑萎缩(诸如尤其藉由磁共振成像(mri)诊断)的速率的降低表示;其中应了解该自体免疫及/或炎症性脱髓鞘疾病或疾患系(特别地)ms,尤其复发缓解型多发性硬化症(rrms)、继发性进行性多发性硬化症(spms)或原发性进行性多发性硬化症(ppms)。
[0137]
28)另一实施例系关于根据实施例24)使用的化合物或其医药上可接受的盐,其中该自体免疫及/或炎症性脱髓鞘疾病或疾患的发作的该延迟系由以下表示:
●
直至可建立该疾病或疾患的诊断的时间的增加;
●
直至残疾的时间的增加;
●
在该疾病或疾患系由包含复发的疾病进展表征的情况下,直至首次复发的时间的增加;
●
直至(进行性)(不可逆)神经退化性损伤(诸如轴突损伤)的诊断的时间的增加;
●
直至脱髓鞘作用的诊断的时间的增加;或
●
在该疾病或疾患系与脑/中枢神经系统相关的情况下,直至进行性脑萎缩/大脑萎缩(诸如尤其藉由磁共振成像(mri)诊断)的诊断的时间的增加。
[0138]
29)另一实施例系关于根据实施例22)至28)中任一项使用的化合物或其医药上可接受的盐,其中该预防/防治或治疗诱导髓鞘再生的效应。
[0139]
髓鞘再生的效应可表现(例如)为组织修复(例如,细胞外基质的组织修复)。髓鞘再生的此效应可(例如)藉由熟知的磁共振成像(mri)技术,包括磁化转移成像(mti),及尤
其扩散加权磁共振成像(dwi或dw-mri),尤其扩散张量成像(dti)可视化。
[0140]
30)另一实施例系关于根据实施例22)使用的化合物或其医药上可接受的盐,其中此用途系用于治疗经诊断患有ms的病患;其中特别地该治疗降低ms的进展速率,其中ms的此降低的进展速率可尤其由脱髓鞘的速率降低及/或不可逆神经退化性损伤(诸如轴突损伤)的速率降低表示;其中应了解此ms可尤其系复发缓解型多发性硬化症(rrms)、继发性进行性多发性硬化症(spms)或原发性进行性多发性硬化症(ppms)。
[0141]
31)另一实施例系关于根据实施例22)使用的化合物或其医药上可接受的盐,其中此用途系用于治疗经诊断患有ms的病患;其中特别地该治疗降低ms的进展速率,其中ms的此降低的进展速率可尤其由残疾进展的速率降低表示;其中应了解此ms可尤其系复发缓解型多发性硬化症(rrms)、继发性进行性多发性硬化症(spms)或原发性进行性多发性硬化症(ppms)。
[0142]
32)另一实施例系关于根据实施例22)使用的化合物或其医药上可接受的盐,其中此用途系用于治疗经诊断患有ms的病患;其中特别地该治疗降低ms的进展速率,其中ms的此降低的进展速率可尤其由脑萎缩/大脑萎缩(诸如尤其藉由磁共振成像(mri)诊断)的速率降低表示;其中应了解此ms可尤其系复发缓解型多发性硬化症(rrms)、继发性进行性多发性硬化症(spms)或原发性进行性多发性硬化症(ppms)。33)另一实施例系关于根据实施例22)使用的化合物或其医药上可接受的盐,其中此用途系用于治疗经诊断患有ms的病患;其中该治疗改善ms的症状,其中ms的症状的此改善可尤其由髓鞘再生的效应表示;其中应了解此ms可尤其系复发缓解型多发性硬化症(rrms)、继发性进行性多发性硬化症(spms)或原发性进行性多发性硬化症(ppms)。
[0143]
34)另一实施例系关于根据实施例22)使用的化合物或其医药上可接受的盐,其中此用途系用于防治/预防ms,其中ms的该防治/预防包括延迟ms在已经历cis/已诊断为已经历cis的病患中的发作;其中应了解此ms可尤其系复发缓解型多发性硬化症(rrms)。
[0144]
35)另一实施例系关于根据实施例30)至34)中任一项使用的化合物或其医药上可接受的盐,其中该预防/防治或治疗诱导髓鞘再生的效应。
[0145]
36)另一实施例系关于根据实施例16)至35)中任一项使用的化合物或其医药上可接受的盐,其中该s1p1受体调节剂或其医药上可接受的盐系芬戈莫德、庞西莫德、西波莫德、奥扎尼莫德、塞那莫德、依曲西莫特、阿米西莫德、萨拉福莫德、gsk 2018682或cs-0777;或另外,莫拉韦莫德(尤其芬戈莫德、庞西莫德、西波莫德或奥扎尼莫德;或另外,塞那莫德);或其医药上可接受的盐。
[0146]
37)另一实施例系关于根据实施例16)至35)中任一项使用的化合物或其医药上可接受的盐,其中该s1p1受体调节剂或其医药上可接受的盐系芬戈莫德、庞西莫德、西波莫德、奥扎尼莫德、塞那莫德、依曲西莫特(尤其芬戈莫德、庞西莫德、西波莫德或奥扎尼莫德;或另外,塞那莫德)或其医药上可接受的盐。
[0147]
在一子实施例中,此组合用途系(尤其使用芬戈莫德、庞西莫德、西波莫德或奥扎尼莫德)用于预防或治疗自体免疫及/或炎症性脱髓鞘疾病或疾患(特别地用于多发性硬化症(ms)),或(尤其使用塞那莫德、奥扎尼莫德或依曲西莫特;尤其使用塞那莫德或依曲西莫特)用于预防或治疗炎症性肠病(包括克罗恩氏病及溃疡性结肠炎);或用于预防或治疗全身性红斑狼疮(sle)。
[0148]
38)另一实施例系关于根据实施例16)至35)中任一项使用的化合物或其医药上可接受的盐,其中该s1p1受体调节剂或其医药上可接受的盐系塞那莫德、奥扎尼莫德、依曲西莫特或阿米西莫德(尤其塞那莫德或依曲西莫特)或其医药上可接受的盐。
[0149]
在一子实施例中,此组合用途系尤其用于预防或治疗炎症性肠病,尤其选自克罗恩氏病及溃疡性结肠炎;或用于预防或治疗全身性红斑狼疮(sle)。
[0150]
39)另一实施例系关于根据实施例16)至35)中任一项使用的化合物或其医药上可接受的盐,其中该s1p1受体调节剂或其医药上可接受的盐系芬戈莫德或其医药上可接受的盐。
[0151]
40)另一实施例系关于根据实施例16)至35)中任一项使用的化合物或其医药上可接受的盐,其中该s1p1受体调节剂或其医药上可接受的盐系庞西莫德或其医药上可接受的盐。
[0152]
41)另一实施例系关于根据实施例16)至35)中任一项使用的化合物或其医药上可接受的盐,其中该s1p1受体调节剂或其医药上可接受的盐系西波莫德或其医药上可接受的盐。
[0153]
42)另一实施例系关于根据实施例16)至35)中任一项使用的化合物或其医药上可接受的盐,其中该s1p1受体调节剂或其医药上可接受的盐系奥扎尼莫德或其医药上可接受的盐。
[0154]
43)另一实施例系关于根据实施例16)至35)中任一项使用的化合物或其医药上可接受的盐,其中该s1p1受体调节剂或其医药上可接受的盐系塞那莫德或其医药上可接受的盐。
[0155]
在一子实施例中,此组合用途系尤其用于根据实施例22)至29)中任一项预防/防治或治疗自体免疫及/或炎症性脱髓鞘疾病或疾患;尤其用于根据实施例30)至35)中任一项预防/防治或治疗ms。
[0156]
在另一子实施例中,此组合用途系尤其用于预防/防治或治疗全身性红斑狼疮(sle)。
[0157]
44)另一实施例系关于根据实施例16)至35)中任一项使用的化合物或其医药上可接受的盐,其中该s1p1受体调节剂或其医药上可接受的盐系依曲西莫特或其医药上可接受的盐。
[0158]
45)另一实施例系关于根据实施例16)至44)中任一项使用的化合物或其医药上可接受的盐,其中该s1p1受体调节剂或其医药上可接受的盐系欲以适用于经口施用该s1p1受体调节剂的医药剂型施用,其中:
●
芬戈莫德或其医药上可接受的盐若存在系欲以该医药剂型以适用于经口施用总计每天约0.5mg或更低的芬戈莫德的单位剂量施用;
●
西波莫德或其医药上可接受的盐若存在系欲以该医药剂型以适用于经口施用总计每天约2mg或更低的西波莫德的单位剂量施用;
●
庞西莫德或其医药上可接受的盐若存在系欲以该医药剂型以适用于经口施用总计每天约20mg或更低(尤其约10至20mg/天,特别地,20mg/天或10mg/天)的庞西莫德的单位剂量施用;及
●
奥扎尼莫德或其医药上可接受的盐若存在系欲以该医药剂型以适用于经口施
用总计每天约1mg或更低(尤其约0.5至1mg/天,特别地,1mg/天或0.5mg/天)的奥扎尼莫德的单位剂量施用;
●
塞那莫德或其医药上可接受的盐若存在系欲以该医药剂型以适用于经口施用总计每天约4mg或更低(尤其约2至4mg/天,特别地,4mg/天或2mg/天)的塞那莫德的单位剂量施用;
●
依曲西莫特或其医药上可接受的盐若存在系欲以该医药剂型以适用于经口施用总计每天约2mg或更低(尤其约1至2mg/天,特别地,2mg/天或1mg/天)的依曲西莫特的单位剂量施用;
●
阿米西莫德或其医药上可接受的盐若存在系欲以该医药剂型以适用于经口施用总计每天约0.4mg或更低(尤其约0.2至0.4mg/天,特别地,0.4mg/天或0.2mg/天)的阿米西莫德的单位剂量施用。
[0159]
上文剂型系尤其意欲用于每天一次(qd)给药该单位剂量。
[0160]
46)另一实施例系关于根据实施例16)至45)中任一项使用的化合物或其医药上可接受的盐,其中该s1p1受体调节剂或其医药上可接受的盐系欲以适用于经口施用该s1p1受体调节剂的医药剂型施用,其中:
●
芬戈莫德或其医药上可接受的盐若存在系欲以该医药剂型以适用于经口施用总计每天约0.5mg或更低的芬戈莫德的单位剂量施用;
●
西波莫德或其医药上可接受的盐若存在系欲以该医药剂型以适用于经口施用总计每天约2mg或更低的西波莫德的单位剂量施用;
●
庞西莫德或其医药上可接受的盐若存在系欲以该医药剂型以适用于经口施用总计每天约10mg或更低的庞西莫德的单位剂量施用;及
●
奥扎尼莫德或其医药上可接受的盐若存在系欲以该医药剂型以适用于经口施用总计每天约0.5mg或更低的奥扎尼莫德的单位剂量施用;
●
塞那莫德或其医药上可接受的盐若存在系欲以该医药剂型以适用于经口施用总计每天约2mg或更低的塞那莫德的单位剂量施用;
●
依曲西莫特或其医药上可接受的盐若存在系欲以该医药剂型以适用于经口施用总计每天约1mg或更低的依曲西莫特的单位剂量施用;
●
阿米西莫德或其医药上可接受的盐若存在系欲以该医药剂型以适用于经口施用总计每天约0.2mg或更低的阿米西莫德的单位剂量施用。
[0161]
上文剂型系尤其意欲用于每天一次(qd)给药该单位剂量。
[0162]
47)另一实施例系关于根据实施例16)至46)中任一项使用的化合物或其医药上可接受的盐,其中该s1p1受体调节剂或其医药上可接受的盐系欲以当作为单一疗法给予时的耐受有效剂量(例如,如核准通知书中针对此s1p1受体调节剂当作为单一疗法给予时用于个别疾病或疾患所指示)的剂量,或以低于当作为单一疗法给予时的此耐受有效剂量的剂量施用。
[0163]
48)另一实施例系关于根据实施例16)至46)中任一项使用的化合物或其医药上可接受的盐,其中该s1p1受体调节剂或其医药上可接受的盐系欲以低于当作为单一疗法给予时的耐受有效剂量(例如,如核准通知书中针对此s1p1受体调节剂当作为单一疗法给予时用于个别疾病或疾患所指示)的剂量施用。
[0164]
49)另一实施例系关于根据实施例16)至48)中任一项组合使用的化合物或其医药上可接受的盐,其中化合物系(欲)以约20mg至约300mg(尤其约20mg至约200mg;尤其约50mg至约150mg)/天的化合物的总剂量施用。在一子实施例中,该总剂量系尤其以一个单位剂量/天(qd;例如,约20mg qd至约300mg qd(尤其约20mg qd至约200mg qd;尤其约50mg qd至约150mg qd)),或以两个独立的单位剂量/天(bid;例如,约10mg bid至约150mg bid(尤其约10mg bid至约100mg bid;尤其约25mg bid至约75mg bid))给予/施用。
[0165]
在此实施例49)的子实施例中,本文中上文的实施例ii)至v)的特定特性在细节上做必要的修正后适用。
[0166]
50)另一实施例因此系关于根据实施例16)至48)中任一项组合使用的化合物或其医药上可接受的盐,其中化合物系(欲)以约20mg至200mg/天的化合物;尤其约30mg至150mg/天、约40mg至150mg/天、约50mg至200mg、约50mg至150mg、约50mg至100mg或约100mg至200mg/天的化合物;尤其约75mg至150mg/天的化合物的总剂量施用。在一子实施例中,该总剂量系尤其以一个单位剂量/天(qd),或以两个独立的单位剂量/天(bid)给予/施用。
[0167]
因此,根据本发明的化合物或其医药上可接受的盐系尤其与该等其他医药活性成分组合(或协同治疗)使用。
[0168]
组合治疗(或协同治疗)可同时(以固定剂量或以非固定剂量)、分别或在一段时间内(尤其同时)进行。
[0169]
当涉及施用类型时,「同时」在本技术案中意谓涉及的该施用类型在于几乎同时施用两种或更多种活性成分及/或治疗;其中应了解同时施用将导致个体同时曝露于该等两种或更多种活性成分及/或治疗。在此内文中,术语「同时」尤其系指针对所有活性成分基本上每天的给药方案/周期性,即,该等两种或更多种活性成分及/或治疗的施用在同一天发生,尤其在当天约相同时间至少一次。
[0170]
当同时施用时,该等两种或更多种活性成分可施用:
●
以固定剂量组合,或
●
以与固定剂量组合等效的非固定剂量组合(例如,藉由使用欲施用的两种或更多种不同的医药组合物,较佳藉由相同的施用途径,几乎同时),其中特别地该非固定剂量组合系欲以相同的给药方案/周期性施用(例如,所有活性成分尤其待每天一次(qd)施用,或欲每天两次(bid)或类似物施用),或
●
以非固定剂量组合使用两种或更多种不同的施用途径或给药方案/周期性(例如,该等活性成分中的一或多者系欲每天一次(qd)施用,而至少一种其他活性成分较佳系欲藉由相同的施用途径,以不同的给药方案,诸如每天两次(bid)或每天三次(tid)或每隔一天施用);
[0171]
其中该共施用导致个体基本上同时曝露于医药有效量的两种或更多种活性成分及/或治疗。使用欲施用的两种不同的医药组合物,较佳藉由相同的施用途径,几乎同时的非固定剂量组合的同时施用的实例系其中化合物系(欲)一天一次施用及个别s1p1受体调节剂系(欲)一天一次施用的非固定剂量组合。使用两种不同的施用途径或给药方案/周期性的非固定剂量组合的同时施用的实例系其中化合物系(欲)一天两次施用,及个别s1p1受体调节剂系(欲)一天一次施用的非固定剂量组合。另一实例为其中化合物系(欲)一天一次或一天两次施用,及个别s1p1受体调节剂系(欲)每隔一天施用(其中应了解此共施用将导
致个体永远同时曝露于医药有效量的化合物及该s1p1受体调节剂)。当与s1p1受体调节剂组合使用时,该化合物将尤其「同时」使用。
[0172]
当涉及施用类型时,「固定剂量组合」在本技术案中意谓涉及的该施用类型在于施用一种单一医药组合物,该医药组合物包含两种或更多种活性成分,诸如尤其如实施例1)至15)中任一项的医药组合物。
[0173]
当涉及施用类型时,「分别」在本技术案中意谓涉及的该施用类型在于在不同时间点施用两种或更多种活性成分及/或治疗;其中应了解分别施用将导致其中个体同时曝露于该等两种或更多种活性成分及/或治疗的治疗阶段(例如,至少1h,尤其至少6h,尤其至少12h);但分别施用也可导致其中在一定时间(例如,至少12h,尤其至少一天)内,个体曝露于该等两种或更多种活性成分及/或治疗中的仅一者的治疗阶段。分别施用尤其系指其中该等活性成分及/或治疗中的至少一者系以大体上不同于每天(诸如每天一次或每天两次)施用(例如,其中一种活性成分及/或治疗系(例如)一天一次或一天两次给予,及另一种系(例如)一周一次或甚至间隔更久给予)的周期性给予的状况。
[0174]
「在一段时间内」施用在本技术案中意谓在不同时间后续施用两种或更多种活性成分及/或治疗。该术语特定系指该等活性成分及/或治疗中的一者的全部施用系在开始施用另一者/其他之前完成的施用方法。以此方法可能施用该等活性成分及/或治疗中的一者数月,然后施用其他活性成分及/或治疗。
[0175]
术语「医药有效量(pharmaceutically effective amount/pharmaceutically efficacious amount)」应了解为将在个体中导致药理反应的个别活性成分的至少最小量(最小药理有效量)。药理反应可(例如)在给定活性成分以阻断给定生物靶标的至少20%(尤其至少50%)的浓度(在拮抗剂的情况下)存在(在治疗期间的某一时间点,诸如,例如,在t
max
或在波谷;关于意欲长期施用的活性成分,尤其在整个治疗期间(例如,包括在波谷))的情况下假定。药理反应进一步可在相较于未经治疗的参考(诸如基线或安慰剂),对给定生物靶标的此阻断具反应性的生物标志物(显著)增加/减少的情况下假定;其中此增加/减少可在治疗期间的某一时间点诸如例如在t
max
或在波谷观测到;关于意欲长期施用的活性成分,尤其在整个治疗期间(例如,包括在波谷)。较佳地,医药有效量系于活性成分的治疗剂量范围内,此范围一般由在最小有效剂量(med)与最大耐受剂量(mtd)的间的范围定义。
[0176]
如本文使用的术语「个体」系指哺乳动物,尤其人类;尤其系指病患,尤其人类病患。较佳地,
●
该术语系指处于发展某一疾病或疾患的风险下/已诊断为处于发展某一疾病或疾患的风险下的(人类)个体,且因此需预防/防治此疾病或疾患;
●
或该术语系指已诊断患有某一疾病或疾患/诊断为正患有某一疾病或疾患,且因此需治疗此疾病或疾患的(人类)病患。应了解关于化合物或其医药上可接受的盐用于预防/防治或治疗其中cxcr7表现或其配体及s1p均发挥作用的某一疾病及疾患的任何实施例系如本文明确定义,其中化合物系(意欲)与s1p1受体调节剂(尤其如此实施例中明确定义的s1p1受体调节剂)组合施用,也系关于:
●
此s1p1受体调节剂或其医药上可接受的盐,用于预防/防治或治疗其中cxcr7表现或其配体及s1p均发挥作用的该疾病及疾患;其中该s1p1受体调节剂系(意欲)与化合物
或其医药上可接受的盐组合施用;
●
化合物或其医药上可接受的盐于制造包含化合物或其医药上可接受的盐,及此s1p1受体调节剂或其医药上可接受的盐的药剂/医药组合物的用途,该药剂/医药组合物用于预防/防治或治疗其中cxcr7表现或其配体及s1p均发挥作用的该疾病及疾患;
●
化合物或其医药上可接受的盐于制造包含化合物或其医药上可接受的盐作为活性成分的药剂/医药组合物的用途,该药剂/医药组合物用于预防/防治或治疗其中cxcr7表现或其配体及s1p均发挥作用的该疾病及疾患;其中该药剂/医药组合物系(意欲)与此s1p1受体调节剂组合或其医药上可接受的盐一起使用;
●
此s1p1受体调节剂或其医药上可接受的盐于制造包含该s1p1受体调节剂或其医药上可接受的盐作为活性成分的药剂/医药组合物的用途,该药剂/医药组合物用于预防/防治或治疗其中cxcr7表现或其配体及s1p均发挥作用的该疾病及疾患;其中该药剂/医药组合物系(意欲)与化合物或其医药上可接受的盐组合使用;
●
包含化合物或其医药上可接受的盐及此s1p1受体调节剂或其医药上可接受的盐的医药组合物的用途,其用于预防/防治或治疗其中cxcr7表现或其配体及s1p均发挥作用的该疾病及疾患;
●
用于预防/防治或治疗其中cxcr7表现或其配体及s1p均发挥作用的该疾病及疾患的药剂,该药剂包含化合物或其医药上可接受的盐;其中该药剂系(意欲)与该s1p1受体调节剂或其医药上可接受的盐组合施用;
●
预防/防治或治疗其中cxcr7表现或其配体及s1p均发挥作用的该疾病及疾患的方法,其包括向有需要个体(较佳人类)施用有效量的化合物或其医药上可接受的盐,其中化合物系与有效量的此s1p1受体调节剂或其医药上可接受的盐组合施用;
●
预防/防治或治疗其中cxcr7表现或其配体及s1p均发挥作用的该疾病及疾患的方法,其包括向有需要个体施用有效量的包含化合物或其医药上可接受的盐及此s1p1受体调节剂或其医药上可接受的盐的医药组合物;及
●
预防/防治或治疗其中cxcr7表现或其配体及s1p均发挥作用的该疾病及疾患的方法,其包括向有需要个体(较佳人类)施用有效量的此s1p1受体调节剂或其医药上可接受的盐,其中该s1p1受体调节剂系与有效量的化合物或其医药上可接受的盐组合施用。
[0177]
同样,关于化合物或其医药上可接受的盐用于预防/防治或治疗其中cxcr7表现或其配体发挥作用的某一疾病及疾患的任何实施例应了解为也系指使用化合物或其医药上可接受的盐预防/防治或治疗该某一疾病及疾患;及系关于预防/防治或治疗该某一疾病及疾患的方法,该方法包括向有需要个体施用有效量的包含化合物或其医药上可接受的盐的医药组合物。
[0178]
其中复数形式系用于化合物、盐、医药组合物、疾病及类似物,此意欲也意谓单一化合物、盐或类似物。
[0179]
除非明确阐述的定义提供更广义或狭义的定义,否则在整个说明书及申请专利范围中,本文提供的定义意欲统一适用于如实施例1)至50)中任一项定义的组合物且在细节上做必要的修正后适用。应充分了解术语的定义或较佳定义定义且可替代独立于如本文定义的任何或所有其他术语的任何定义或较佳定义(及与其组合)的个别术语。
[0180]
酌情权宜,对化合物的任何参考应了解为也系指此等化合物的盐(及尤其医药上
可接受的盐)。
[0181]
术语「医药上可接受的盐」系指保留标的化合物的所需生物活性且显示最小非所需的毒理效应的盐。取决于标的化合物中碱性及/或酸性基团的存在,此等盐包括无机或有机酸及/或碱加成盐。为参考,例如,参见「handbook of pharmaceutical salts.properties,selection and use.」,p.heinrich stahl、camille g.wermuth(编),wiley-vch,2008;及「pharmaceutical salts and co-crystals」,johan wouters及luc qu
éré
(编),rsc出版,2012。
[0182]
术语「基本上由
…
构成」在本发明的内文中应了解尤其意谓个别组合物为至少90重量%,尤其至少95重量%,尤其至少99重量%的量,及如个别实施例中明确规定的量,较佳为100重量%的量(即,在「由
…
构成」的意义中)的个别组合物构成。术语「包含」较佳了解为在术语「基本上由
…
构成」的含义中。
[0183]
术语「基本上」在本发明的内文中应了解尤其意谓个别量/纯度/时间等系个别总数的至少90%,尤其至少95%,及尤其至少99%。
[0184]
例如,当用于术语「基本上同时曝露」中时,应了解尤其意谓个别曝露导致医药有效量的所有组合活性成分在至少90,尤其至少95,及尤其至少99%的时间内同时曝露,即,在经考虑长期/稳态曝露于医药活性成分的情况下,一天的至少90,尤其至少95,及尤其至少99%的时间内同时曝露。
[0185]
例如,当用于诸如「基本上纯」的术语中时,在本发明的内文中应了解尤其意谓个别组合物/化合物等为至少95重量%,及尤其至少99重量%的个别纯组合物/化合物/结晶形式等的量构成。
[0186]
术语「对映体富集」在本发明的内文中应了解尤其意谓至少90重量%,较佳至少95重量%,及最佳至少99重量%的化合物系以该化合物的一种对映体的形式存在。应了解化合物系以对映体富集的绝对(3s,4s)-构型,较佳以基本上纯的绝对(3s,4s)-构型存在。
[0187]
为避免任何疑问,应充分了解包含医药有效量化合物的任何医药组合物可另外包含其他习知的赋形剂及/或添加剂,其等可单独使用或组合使用(足量,即,其中该等其他习知成分及/或添加剂的最大量可需减少以构成100的总ww%)。应了解某一组合物以「ww%」表示的总量为100。表达「ww%」(或%(w/w))系指相较于考虑的组合物的总重量的以重量计的百分比。
[0188]
根据本发明的医药组合物的产生可以任何熟习此项技术者熟悉的方式进行(例如,参见r.c.rowe、p.j.seskey、s.c.owen,handbook of pharmaceutical excipients,第5版,pharmaceutical press2006;remington,the science and practice of pharmacy,第21版(2005),第5部分,「pharmaceutical manufacturing」[由lippincott williams&wilkins出版]),藉由将本发明的组合活性成分,视需要与其他有治疗价值的物质组合,连同合适的无毒惰性医药上可接受的固体或液体载剂材料,及视需要,常用医药佐剂一起,制成盖伦制剂施用形式。用于经口施用的医药组合物可(特别地)以胶囊的形式或以锭剂的形式。
[0189]
适用于经肠施用的剂型可为锭剂。或者,适用于经肠施用的剂型可为用包含有效量的化合物的医药组合物填充的胶囊(尤其硬质明胶胶囊)。通常用于含有呈粉末或丸粒的形式的医药组合物的任何类型的胶囊(诸如硬质明胶胶囊、hpmc胶囊等)可用于本发明中。
应了解除化合物或其医药上可接受的盐外,胶囊或锭剂将包含视需要与如本文定义的s1p1受体调节剂或其医药上可接受的盐的组合,及至少一种医药上可接受的惰性赋形剂。如本文使用的术语「医药组合物」可与术语「调配物」、「组合物」或「药剂」互换使用。
[0190]
除非关于温度使用,否则放在数值「x」前的术语「约」在本技术案中系指自x减x的10%延伸至x加x的10%的间隔,及较佳系指自x减x的5%延伸至x加x的5%的间隔。在温度的特定情况下,放在温度「y」前的术语「约」在本技术案中系指自温度y减10℃延伸至y加10℃的间隔,较佳系指自y减5℃延伸至y加5℃的间隔,尤其系指自y减3℃延伸至y加3℃的间隔。室温意谓约25℃的温度。当在本技术案中使用术语n当量时,其中n为数字,其意谓且于本技术案的范围内n系指约该数字n,较佳n系指精确数字n。
[0191]
每当使用词语「的间」或「至」描述数值范围时,应了解为指示范围的端点系明确包括于该范围中。例如:若温度范围描述为在40℃与80℃的间(或40℃至80℃),则此意谓端点40℃及80℃系包括于该范围中;或若变量定义为在1与4的间(或1至4)的整数,则此意谓该变量系整数1、2、3或4。
[0192]
本发明的特定实施例系描述于下列实例中,其等发挥作用以更详细地阐述本发明而不以任何方式限制其范围。
[0193]
实验程序缩写:下列缩写用于整个说明书及实例中:b.i.d. (bis in die):也bid;每天两次cfa
ꢀꢀꢀꢀ
完全弗氏佐剂cpz
ꢀꢀꢀꢀ
双环己酮草酰二腙eae
ꢀꢀꢀꢀ
实验性自体免疫脑脊髓炎fig
ꢀꢀꢀꢀ
图h
ꢀꢀꢀꢀꢀꢀ
小时ibd
ꢀꢀꢀꢀ
炎症性肠病mog
ꢀꢀꢀꢀꢀ
髓鞘少突胶质细胞醣蛋白ms
ꢀꢀꢀꢀꢀꢀ
多发性硬化症nfl
ꢀꢀꢀꢀꢀ
神经丝轻链ns
ꢀꢀꢀꢀꢀꢀ
非显著plp
ꢀꢀꢀꢀꢀ
蛋白脂蛋白q.d.
ꢀꢀꢀꢀ
(quaque die):也qd;每天一次sem
ꢀꢀꢀꢀꢀ
平均值的标准误差
[0194]
化合物作为单一疗法或与s1p1受体调节剂的组合的治疗用途的实例治疗效应可在指示其中cxcr7表现或其配体及s1p均发挥作用的疾病及疾患的多种动物模型中建模。
[0195]
实例a:单独或组合的化合物及芬戈莫德的效用可在(例如)与多发性硬化症(ms)相关的炎症性脱髓鞘疾病的小鼠模型中确定。
[0196]
cxcl12或cxcl11血浆浓度可使用此项技术中熟知的方法,例如免疫分析
(bio-)或来自r&d系统的商业量化因子elisa小鼠cxcl12/sdf1α套组测定。
[0197]
a)未治疗小鼠中的剂量发现实验:在先导实验中,用化合物以30及100mg/kg,每天两次(b.i.d.)对健康雌性c57bl/6小鼠经口给药3天。目标系在此品系小鼠中历时24h评估化合物对血浆中cxcl12升高(其系已建立的生物标志物以监测cxcr7受体拮抗剂的药理活性)的剂量-效应关系。
[0198]
基于此实验,在未治疗c57bl/6小鼠(剂量100mg/kg,b.i.d.)中,仅最高剂量的测试化合物在波谷(最后给药后14小时)提供化合物血浆曝露以维持血浆cxcl12在24h内增加。
[0199]
与化合物的靶接合的量测同时进行第二先导实验。健康雌性c57bl/6以介于0.01至0.3mg/kg的范围的不同剂量,每天一次(q.d.)接受芬戈莫德。目标系在此品系小鼠中历时24h评估芬戈莫德对外周血中淋巴细胞计数(其系已建立的生物标志物以监测s1p1受体调节剂的药理活性)的剂量-效应关系。基于此实验,用于组合实验的选择剂量的芬戈莫德于24h内显示对淋巴细胞计数减少的部分效用(剂量0.03mg/kg,q.d.)。
[0200]
b)髓鞘少突胶质细胞醣蛋白(mog)诱导的实验性自体免疫脑脊髓炎(eae)模型中的单一疗法效用实验:化合物在髓鞘少突胶质细胞醣蛋白(mog)诱导的实验性自体免疫脑脊髓炎(eae)中的效用可在先导实验中确定。目标系在ms的小鼠模型中,评估化合物对效用及对血浆cxcl12增加的剂量-效应关系。
[0201]
用mog于完全弗氏佐剂(cfa)及百日咳毒素中的乳液使雌性c57bl/6小鼠免疫(第0天)。对每只小鼠皮下注射总计150μg mog于腹部的各侧面中的两个位点。对小鼠第二次(首次注射后2天(第2天))腹腔内注射百日咳毒素。于9至14天内,小鼠发展麻痹迹象,其将根据评估尾巴及四肢的0至5的范围分级,定义为:0=无eae的临床迹象,0.5=末端尾巴麻痹或单肢无力,1=尾巴麻痹或两肢无力,1.5=尾巴麻痹及一个后肢无力,2=尾巴麻痹及双侧部分后肢麻痹,2.5=尾巴麻及单侧完全后肢麻痹,2.75=2.5的分数 单侧部分后肢麻痹,3=完全双侧后肢麻痹,3.25=3 单侧部分前肢麻痹,3.5=3 单侧完全前肢麻痹,4=完全麻痹(濒死),及5=死亡或安乐死。
[0202]
疾病进展遵循无缓解的慢性进展过程。
[0203]
9至10只小鼠的组系在疾病诱导当天(第0天)开始经口给药不同剂量的化合物。其由四个治疗组构成:1.媒剂(水)b.i.d.,自第0天2.化合物(10mg/kg)b.i.d.,自第0天3.化合物(30mg/kg)b.i.d.,自第0天4.化合物(100mg/kg)b.i.d.,自第0天每天评估临床分数及在经媒剂治疗的小鼠与接受化合物的小鼠的间比较疾病进展。藉由在29天研究周期内求和所有每天临床分数计算各小鼠的累积疾病分数。该实验在第29天,给药后1至4小时终止。抽取血浆样本用于测定化合物浓度及用于量测cxcr7靶接合(cxcl12含量)的生物标志物。cxcl12血浆浓度系使用来自r&d系统的商业量化因子elisa小鼠cxcl12/sdf1α套组,根据制造商的说明书测定。
[0204]
来自效用实验的结果显示于图1至2中。如由29天研究内平均累积疾病分数的减小
瓦立斯检定,接着邓恩的多重比较检定。
[0214]
图2显示在小鼠mog诱导的eae模型中,化合物对cxcl12血浆浓度的剂量依赖性效应。数据呈现为平均值 sem;n=7至10只/组。****p《0.0001相比于经媒剂治疗的eae小鼠,使用单因素anova检定,接着邓内特的多重比较检定。
[0215]
图3显示如由累积疾病分数评估,芬戈莫德(0.03mg/kg,q.d.)对疾病的整体程度的效应,定义为于27天研究内各小鼠的临床分数的总和。小鼠系自第0天治疗。数据呈现为平均值 sem;n=10只/组,**p《0.01相比于经媒剂治疗的eae小鼠,使用曼惠特尼检定。
[0216]
图4显示在eae小鼠模型中,化合物、芬戈莫德及其组合对平均临床分数的治疗效用。小鼠系自第7天开始治疗直至研究结束。数据呈现为平均值 sem;n=10只/组。*p《0.05,**p《0.01相比于经媒剂治疗的eae小鼠,使用克拉斯卡-瓦立斯检定,接着邓恩的多重比较检定。
[0217]
图5显示化合物、芬戈莫德及其组合对小鼠eae疾病的严重性的治疗效应,表示为于16天研究内达成的最大临床分数。数据呈现为平均值 sem;n=10只/组。*p《0.05,**p《0.01,使用克拉斯卡-瓦立斯检定,接着未修正的邓恩的多重比较检定。
[0218]
图6显示在小鼠eae模型中,化合物、芬戈莫德及其组合对神经丝轻链血浆浓度的治疗效应。数据呈现为平均值 sem;n=8-9只/组。*p《0.05,**p《0.01,使用单因素anova检定,接着未修正的费雪lsd多重比较检定。
[0219]
图7显示在小鼠eae模型中,化合物、芬戈莫德及其组合对血液淋巴细胞计数的影响。数据呈现为平均值 sem;n=8至10只/组。**p《0.01,使用单因素anova检定,接着未修正的费雪lsd多重比较检定相比于经媒剂治疗的eae小鼠。
[0220]
图8显示在小鼠eae模型中,化合物、芬戈莫德及其组合对血浆cxcl12浓度的影响。数据呈现为平均值 sem;n=8至10只/组。****p《0.0001,使用单因素anova检定,接着未修正的费雪lsd多重比较检定。
[0221]
实例b:实验1):化合物对髓鞘形成的直接影响可在双环己酮草酰二腙诱导的脱髓鞘作用小鼠模型中确定,其中原发性脱髓鞘作用不为免疫介导的。
[0222]
使雄性c57bl/6小鼠曝露于双环己酮草酰二腙(cpz;150mg/kg,b.i.d.)(一种导致成熟寡树突胶细胞死亡的斩波螯合剂),藉由经口管饲每天两次历时六周。化合物(100mg/kg,b.i.d.)系以预防性设定给予,即,自第0天与双环己酮草酰二腙共施用(化合物预防性-cpz);或以治疗性设定,即,在双环己酮草酰二腙曝露后3周开始直至该实验结束(化合物治疗性-cpz)。
[0223]
实验系在双环己酮草酰二腙曝露6周后终止。抽取血浆样本用于测定化合物浓度及用于量测cxcr7靶接合(cxcl12含量)的生物标志物。cxcl12血浆浓度系如实例a中先前描述量测。将脑样本分离并固定用于组织病理学及免疫组织化学检查以评估脱髓鞘作用的程度(用于髓磷脂染色的勒克司坚牢蓝(luxol fast blue))及成熟寡树突胶细胞的损失(gstπ染色)。
[0224]
来自此研究的结果系显示于图9至10中。曝露6周后,双环己酮草酰二腙诱导显著的脱髓鞘作用(图9)及成熟寡树突胶细胞的显著损失(图10)。尽管仍施用双环己酮草酰二腙,但化合物治疗方案(预防性:化合物预防性-cpz,及治疗性:化合物治疗性-cpz)显著增
加胼胝体中的髓磷脂染色(图9)及成熟寡树突胶细胞计数(图10)。
[0225]
图9显示在小鼠双环己酮草酰二腙诱导的脱髓鞘作用模型中,与双环己酮草酰二腙共施用的化合物,在相同调配物中,自第0天开始(化合物预防性-cpz)或在双环己酮草酰二腙曝露3周后开始(化合物治疗性-cpz)对脱髓鞘作用的影响。延髓冠状切面系用勒克司坚牢蓝染色及胼胝体中的染色强度系使用轨道影像分析软件定量。结果表示为平均值 sem,n=每组7至8只小鼠。*p《0.05,**p《0.01,****p《0.0001,相比于经媒剂治疗的cpz小鼠(cpz),使用单因素anova,接着未修正的费雪多重比较检定。
[0226]
图10显示在小鼠双环己酮草酰二腙诱导的脱髓鞘作用模型中,与双环己酮草酰二腙共施用的化合物,在相同调配物中,自第0天开始(化合物预防性-cpz)或在双环己酮草酰二腙曝露3周后开始(化合物治疗性-cpz)对成熟寡树突胶细胞数量的影响。延髓冠状切面系用gstπ染色及胼胝体中的定量分析系使用轨道影像分析软件定量。结果表示为藉由以mm2计的受关注的所选区域标准化的细胞的平均数量 sem,n=每组6至8只小鼠。*p《0.05,**p《0.01,****p《0.0001,相比于经媒剂治疗的cpz小鼠(cpz),使用单因素anova,接着未修正的费雪多重比较检定。
[0227]
实验2):在第二实验中,化合物对髓鞘形成的治疗效应系在由双环己酮草酰二腙诱导的毒性脱髓鞘作用的模型中确定,其中自发性髓鞘再生在双环己酮草酰二腙停药后发生。
[0228]
使雄性c57bl/6小鼠曝露于0.2%双环己酮草酰二腙饮食历时六周及然后切换至对照食物历时再一周。8至9只小鼠的组系在双环己酮草酰二腙曝露五周后开始经口给药。其由三个治疗组构成:1.媒剂(0.5%甲基纤维素/0.5%80)b.i.d.,自第5周至第7周2.芬戈莫德(0.3mg/kg)q.d. 媒剂q.d.,自第5周至第7周3.化合物(100mg/kg)b.i.d.,自第5周至第7周实验系在治疗两周后(第7周),意谓在双环己酮草酰二腙停药后一周终止。血液学参数(包括淋巴细胞计数)系在该实验终止时,最后给药后一小时量测。抽取血浆样本用于测定化合物浓度及用于量测cxcr7靶接合(cxcl12含量)的生物标志物。将脑样本分离并固定用于组织病理学及免疫组织化学检查以评估脱髓鞘作用的程度(用于髓磷脂染色的勒克司坚牢蓝)。
[0229]
此实验适用于头对头比较在eae模型及双环己酮草酰二腙模型中显示作为单一疗法在所有时间下的靶接合及效用的化合物剂量与于24小时内对淋巴细胞计数减小完全有效的芬戈莫德剂量(剂量:0.3mg/kg,q.d.)。
[0230]
来自此研究的结果系显示于图11中。在双环己酮草酰二腙曝露6周后,接着一周对照食物,经媒剂治疗的小鼠显示胼胝体中显著的脱髓鞘作用。cpz停药后一周,化合物显著加速自发性髓鞘再生,而芬戈莫德无影响(图11)。
[0231]
图11显示在小鼠双环己酮草酰二腙诱导的脱髓鞘作用模型中,在双环己酮草酰二腙停药前一周开始的化合物及芬戈莫德对脱髓鞘作用/髓鞘再生的治疗效应。延髓冠状切面系用勒克司坚牢蓝染色及胼胝体中的染色强度系使用轨道影像分析软件定量。结果表示为平均值 sem,n=每组7至8只小鼠。*p《0.05,****p《0.0001,相比于经媒剂治疗的cpz小鼠(cpz),使用单因素anova,接着未修正的费雪多重比较检定。
[0232]
实例c:单独或组合的化合物及西波莫德的治疗效用可在炎症性脱髓鞘疾病的小鼠模型中确定。
[0233]
a)健康小鼠中的剂量发现实验:在先导实验中,健康雌性sjl/j小鼠系用西波莫德以介于0.03至1mg/kg范围内的不同剂量,每天一次经口给药2至3天。目标系在此品系小鼠中历时24h评估西波莫德对外周血中淋巴细胞计数(其系已建立的生物标志物以监测s1p1受体调节剂的药理活性)的剂量-效应关系。基于此实验,用于组合实验的所选剂量的西波莫德于24h内显示对淋巴细胞计数减小的完全效用(剂量0.3mg/kg,q.d.)。组合在所选剂量下的西波莫德及在100mg/kg下的化合物,b.i.d.不影响彼此的生物标志物,即分别淋巴细胞减少症及血浆cxcl12增加,也不影响其等个别血浆药物动力学。
[0234]
b)蛋白脂蛋白(plp)诱导的eae模型中的单一疗法效用实验:化合物在plp诱导的eae中的治疗效用可在先导实验中确定。目标系评估化合物对效用及对血浆cxcl11及cxcl12增加的剂量-效应关系。
[0235]
用plp于cfa及百日咳毒素中的乳液使雌性sjl/j小鼠免疫(第0天)。对每只小鼠皮下注射总计100μg plp于腹部的各侧面中的两个位点。对小鼠第二次(首次注射后2天(第2天))腹腔内注射百日咳毒素。于9至16天内,小鼠发展麻痹迹象,其将根据评估尾巴及四肢的0至5的范围分级,定义为:0=无eae的临床迹象,0.5=末端尾巴麻痹或单肢无力,1=尾巴麻痹或两肢无力,1.5=尾巴麻痹及一个后肢无力,2=尾巴麻痹及双侧部分后肢麻痹,2.5=尾巴麻痹及单侧完全后肢麻痹,2.75=2.5的分数 单侧部分后肢麻痹,3=完全双侧后肢麻痹,3.25=3 单侧部分前肢麻痹,3.5=3 单侧完全前肢麻痹,4=完全麻痹(濒死),及5=死亡或安乐死。疾病进展遵循复发缓解型过程,在发作后三至五天出现疾病的第一峰值,接着在eae诱导后20至30天,缓解阶段及该疾病的第二峰值。
[0236]
14至16只小鼠的组系自各小鼠的疾病的首次迹象开始,经口给药不同剂量的化合物。研究由四个治疗组构成:1.媒剂(水)b.i.d.,自各小鼠的疾病发作2.化合物(10mg/kg)b.i.d.,自各小鼠的疾病发作3.化合物(100mg/kg)b.i.d.,自各小鼠的疾病发作4.化合物(150mg/kg)b.i.d.,自各小鼠的疾病发作每天以盲目方式评估临床分数及在经媒剂治疗的小鼠与接受化合物的小鼠的间比较疾病进展。藉由在治疗开始后30天内求和所有每天临床分数计算各小鼠的累积疾病分数。实验系基于小鼠入选日,在化合物治疗的30至33天后,意谓在eae诱导后的42至48天终止。抽取血浆样本用于测定化合物浓度及用于量测cxcr7靶接合(cxcl11及cxcl12含量)的生物标志物。cxcl12血浆浓度系如实例a中先前描述测定。
[0237]
来自效用实验的结果系显示于图12中。如由平均累积疾病分数的显著减小显示,以治疗性设定施用的化合物显示对疾病的整体程度的剂量依赖性效用(图12)。效用系与血浆cxcl11及cxcl12含量的剂量依赖性增加相关联(图13)。
[0238]
图12显示如由累积疾病分数评估,化合物对eae疾病的整体程度的剂量依赖性效应,定义为治疗开始后30天的各小鼠的临床分数的总和。在疾病的首次迹象后开始,个别治
疗小鼠。数据呈现为平均值 sem;n=14至16只/组。*p《0.05相比于经媒剂治疗的eae小鼠,使用克拉斯卡-瓦立斯检定,接着未修正的邓恩的多重比较检定。
[0239]
图13显示在小鼠plp诱导的eae模型中,化合物对血浆cxcl12浓度的剂量依赖性效应。数据呈现为平均值 sem;n=13至14只/组。****p《0.0001,使用单因素anova检定,接着未修正的费雪lsd多重比较检定。
[0240]
基于上文描述的先导实验,选择一个剂量的化合物(剂量:100mg/kg,b.i.d.)用于组合效用实验。在plp诱导的eae模型中,所选剂量在波谷增加cxcl11及cxcl12血浆含量及最大程度减小临床分数。
[0241]
c)plp诱导的eae模型中的组合效用实验:组合效用实验系在与针对先导实验描述相同的小鼠eae模型中进行。
[0242]
10至15只小鼠的组系在各小鼠疾病发作时开始经口给药。研究由四个治疗组构成:1.媒剂(0.5%甲基纤维素/0.5%80)b.i.d.,自eae发作2.西波莫德(0.3mg/kg)q.d. 媒剂q.d.,自eae发作3.化合物(100mg/kg)b.i.d.,自eae发作4.西波莫德(0.3mg/kg)q.d. 化合物(100mg/kg)b.i.d.,自eae发作每天以盲目方式评估临床分数,及在经媒剂治疗的小鼠与接受不同治疗的小鼠的间及在组合与单一疗法治疗的间比较疾病进展。与此同时,每天记录小鼠的体重以遵循一般健康。实验系在针对各小鼠化合物治疗至少30天后终止。s1p1及cxcr7靶接合(即分别淋巴细胞计数及cxcl11及cxcl12血浆含量)系在实验终止时量测。也抽取血浆样本用于化合物及西波莫德浓度测定。
[0243]
实例d:化合物的安全性、耐受性、药物动力学及药效动力学的研究可在单一剂量后在健康男性受试者中确定
[0244]
a研究设计(clinicaltrials.gov:nct03869320)在随机双盲安慰剂对照的首次人类中研究中,研究化合物的六个剂量,即1、3、10、30、100及200mg。在各剂量组中,六个健康男性受试者接受化合物及两个健康男性受试者接受匹配的安慰剂,经口,在禁食条件下在早晨。在各给药后,将该等受试者监测14天以研究(i)耐受性及安全性(不良事件、生命迹象、临床实验室、ecg)、(ii)药物动力学(血浆中的化合物浓度),及(iii)药效动力学(血浆cxcl11及cxcl12)。在30mg剂量组中,食物的影响系藉由在标准化高脂肪早餐后向该等相同受试者施用相同治疗进一步研究。质量平衡及adme系藉由在100mg剂量组中施用经口化合物微示踪剂或匹配的安慰剂结合指定治疗一起进一步研究。绝对生体可用率系藉由在200mg剂量组中施用i.v.化合物微示踪剂或匹配的安慰剂结合指定治疗一起进一步研究。
[0245]
结果:化合物在1至200mg的单一经口剂量的完整范围内系安全且良好耐受的。在剂量≥10mg下,t
max
介于1.3至3.0h的范围内及终点t
1/2
介于17.8至23.6h的范围内。在剂量范围内的曝露增加基本上与剂量成比例且对药物动力学不存在相关的食物影响。在此研究中发现化合物主要由粪便排泄及尿液中少量排泄。绝对生体可用率系约50%。
[0246]
靶接合生物标志物cxcl12的血浆浓度在测试的剂量范围内以相较于基线高约2倍
的程度剂量依赖性增加。在施用100mg及200mg化合物后,血浆cxc12浓度及相较于基线的倍数变化系相似的(图14)。在稳态下预测曝露-反应的间接反应药物动力学/药效动力学模型很好地描述化合物与cxcl12浓度的关系(图15)。在此研究中,在健康志愿者中,cxcl11浓度基本上保持不变。
[0247]
图14显示在研究中,健康受试者中峰值cxcl12血浆浓度的剂量-反应关系。数据呈现为相较于基线的倍数变化,及水平线表示平均值及点表示个别数据点。
[0248]
图15显示由剂量分层的在稳态下预测的曝露反应关系。点表示相较于基线的中位数预测倍数变化,及误差条表示80%预测区间。
[0249]
实例e:化合物的安全性、耐受性、药物动力学及药效动力学的研究可在多个剂量后在健康男性及女性受试者中确定
[0250]
a研究设计(clinicaltrials.gov:nct04286750)在随机双盲安慰剂对照的研究中,研究化合物的不同剂量,例如,30、100及200mg。在各剂量组中,八个健康受试者(4个男性及4个女性)接受化合物及两个健康受试者(1个男性及1个女性)接受匹配的安慰剂,经口,在禁食条件下每天一次历时7天,例如在早晨。在给药的7天及在最后给药后长达8天的期间,监测受试者以研究(i)耐受性及安全性(不良事件、生命迹象、临床实验室、ecg)、(ii)药物动力学(血浆中的化合物浓度),及(iii)药效动力学(包括例如,cxcl11及cxcl12的血浆含量)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。