1.本发明大体涉及一种toll样受体(toll-like receptor)(tlr)激动剂,更明确言之,涉及tlr7与tlr8双重激动剂。
背景技术:
2.toll样受体(tlr)为病原体辨识受体,其在激活先天性及后天性免疫力均扮演关键角色。已在人类及小鼠中判别出几种tlr。已发现有些tlr位于细胞表面(例如,tlr 1、2、4、5与6),有些则出现在胞内体腔室(例如,tlr3、7、8与9)。tlr在不同免疫细胞上表达,尤指单核细胞、树突细胞(dc)与巨噬细胞。激活tlr造成细胞因子分泌(例如,ifn-α、tnf-α与il-12),提高巨噬细胞的吞噬细胞作用,及提高天然杀伤(nk)细胞的溶解细胞活性。激活tlr亦造成加强抗原呈递,因此激活后天性免疫反应,包括抗原特异性cd8
细胞毒性t淋巴细胞。
3.美国专利案案号8728486、9334268、9884866及美国专利公开案案号20190062329已判别出小分子tlr 7及/或tlr 8激动剂。仍然需要发展具有改良效力和/或细胞因子型态的tlr7及/或tlr8激动剂,尤指tlr 7/8激动剂。
技术实现要素:
4.一方面,本发明涉及一种式(i)化合物
[0005][0006]
或其药学上可接受的盐,
[0007]
其中
[0008]
r1为羟基、羟基-c
1-6-烷基、c
1-6-烷氧基、或c
1-6-烷氧基-c
1-6-烷基;
[0009]
r2为c
1-6-烷基、c
1-6-卤代烷基、c
1-6-卤代烷基-o-c
1-6-烷基、c
1-6-卤代烷基-s-c
1-6-烷基、或羟基-c
1-6-烷基;及
[0010]
r3为氢、羟基、卤素、c
1-6-烷基、羟基-c
1-6-烷基、c
1-6-卤代烷基、c
1-6-烷氧基、或c
1-6-烷氧基-c
1-6-烷基;
[0011]
其中c
1-6-烷基、羟基-c
1-6-烷基、c
1-6-烷氧基、c
1-6-烷氧基-c
1-6-烷基、c
1-6-卤代烷基与c
1-6-卤代烷基-s-c
1-6-烷基分别独立为未经取代或经至少一个取代基取代;其中所述取代基分别独立选自下列各项:-nh2、芳基、c
1-6-烷基与c
1-6-烷基-芳基;
[0012]
其限制条件为
[0013]
当r1为2-羟基-2-甲基丙基时,r2不为甲基、乙基、丁基或羟基甲基;及当r1为二甲基-羟基甲基时,r2不为异丁基。
[0014]
另一方面,本发明涉及一种式(ii)化合物
[0015][0016]
或其药学上可接受的盐,其中r1与r2如上述定义。
[0017]
在本发明的一个实施方式中,r1为羟基-c
1-6-烷基、或c
1-6-烷氧基-c
1-6-烷基。
[0018]
另一个实施方式中,r1为羟基甲基、2-羟基乙基、3-羟基丙基、4-羟基丁基、或2-羟基-2-甲基丙基。
[0019]
再另一个实施方式中,r1为甲氧基甲基、2-甲氧基乙基、乙氧基甲基、或2-乙氧基乙基。
[0020]
另一个实施方式中,r2为直链或分支链c
1-6-烷基。
[0021]
另一个实施方式中,r2为甲基、乙基、正丙基、异丙基、正-丁基、异丁基、叔丁基、正戊基、异戊基、1-甲基丁基、叔戊基、新戊基、正己基、3-己基、2-甲基-1-戊基、3-甲基-1-戊基、4-甲基-1-戊基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、2-甲基-3-戊基、3-甲基-3-戊基、2,2-二甲基-1-丁基、2,3-二甲基-1-丁基、3,3-二甲基-1-丁基、2-乙基-1-丁基、2,3-二甲基-2-丁基、或3,3-二甲基-2-丁基。
[0022]
另一个实施方式中,r2为仲丁基、叔丁基、或3,3-二甲基-1-丁基。
[0023]
另一个实施方式中,r2为c
1-6-单卤代烷基、c
1-6-二卤代烷基或c
1-6-三卤代烷基。
[0024]
另一个实施方式中,r2为三氟甲基、2,2,2-三氟乙基、3,3,3-三氟丙基、4,4,4-氟丁基、5,5,5-三氟戊基、6,6,6-三氟己基、3,3,3-三氟-2-甲基丙基、4,4,4-三氟-3-甲基丁基、或5,5,5-三氟-4-甲基戊基。
[0025]
另一个实施方式中,r2为-ch
2-ch
2-o-ch
2-cf3、-ch
2-ch
2-o-ch
2-ch
2-cf3、-ch
2-o-ch
2-cf3、-ch
2-o-ch
2-ch
2-cf3、或-ch
2-o-ch
2-ch
2-ch
2-cf3。另一个实施方式中,r2为c
1-6-卤代烷基-o-c
2-6-烷基。
[0026]
另一个实施方式中,r2为-ch
2-ch
2-s-ch
2-cf3、-ch
2-ch
2-s-ch
2-ch
2-cf3、-ch
2-s-ch
2-cf3、-ch
2-s-ch
2-ch
2-cf3、或-ch
2-s-ch
2-ch
2-ch
2-cf3。
[0027]
另一个实施方式中,r2为2-羟基乙基、3-羟基丙基、或4-羟基丁基。
[0028]
另一个实施方式中,r3为c
1-6-卤代烷基。所述c
1-6-卤烷基可为三氟烷基。
[0029]
另一个实施方式中,r3为h、oh、f、cl、br、i、或三氟甲基。
[0030]
另一个实施方式中,r1为2-羟基-2-甲基丙基,及r2为正丙基、异丁基、正戊基、异戊基、4-甲基戊基、三氟甲基、2,2,2-三氟乙基、3,3,3-三氟丙基、4,4,4-氟丁基、5,5,5-三氟戊基、6,6,6-三氟己基、3,3,3-三氟-2-甲基丙基、4,4,4-三氟-3-甲基丁基、5,5,5-三氟-4-甲基戊基、-ch
2-s-ch
2-cf3、-ch
2-s-ch
2-ch
2-cf3、-ch
2-s-ch
2-ch
2-ch
2-cf3、2-羟基乙基、3-羟基丙基、或4-羟基丁基。
[0031]
另一个实施方式中,r1为2-羟基-2-甲基丙基,及r2为正丙基、异丁基、正戊基、4,4,4-氟丁基、5,5,5-三氟戊基、或3,3,3-三氟-2-甲基丙基。
[0032]
另一个实施方式中,r1为2-羟基-2-甲基丙基,r2为正丙基、异丁基、正戊基、4,4,4-氟丁基、5,5,5-三氟戊基、或3,3,3-三氟-2-甲基丙基,及r3为h。
[0033]
本发明另一个实施方式中,式(i)化合物选自本技术表2所列的化合物。
[0034]
另一个实施方式中,根据本发明式(i)化合物选自下列各项:
[0035]
1-(4-氨基-2-丙基-1h-咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇(化合物1);
[0036]
1-(4-氨基-2-戊基-1h-咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇(化合物2);
[0037]
1-(4-氨基-2-异丁基-1h-咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇(化合物3);
[0038]
1-(4-氨基-2-(4,4,4-三氟丁基)-1h-咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇(化合物9);
[0039]
1-(4-氨基-2-(5,5,5-三氟戊基)-1h-咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇(化合物10);及
[0040]
1-(4-氨基-2-(3,3,3-三氟-2-甲基丙基)-1h-咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇(化合物12)。
[0041]
本发明另一方面为一种制造式(i)化合物的方法。
[0042]
另一方面,本发明涉及一种医药组合物,其包含如上述定义的式(i)化合物或其药学上可接受的盐,及药学上可接受的载剂和/或佐剂。
[0043]
另一方面,本发明涉及一种根据本发明化合物或其药学上可接受的盐在制造用于在有此需要的个体中治疗病毒感染、癌症、过敏性疾病或肝脏疾病的药物中的用途。
[0044]
本发明还涉及一种治疗病毒感染、癌症、过敏性疾病或肝脏疾病的方法,该方法包括对有此需要的个体施用治疗有效量的根据本发明的式(i)化合物或其药学上可接受的盐。
[0045]
本发明还涉及一种根据本发明式(i)化合物或其药学上可接受的盐,用于为有此需要的个体治疗病毒感染、癌症、过敏性疾病或肝脏疾病。
[0046]
另一个实施方式中,所述病毒感染为丙型肝炎病毒(hcv)、乙型肝炎病毒(hbv)、丁型肝炎病毒(hdv)、人类乳突病毒(hpv)、或单纯疱疹病毒1(hsv-1)、单纯疱疹病毒2(hsv-2)的相关感染。
[0047]
在一个实施方式中,所述癌症选自下列各项:食道、胃、结肠、直肠、胰脏、肺、乳房、子宫颈、子宫体、卵巢、膀胱、头与颈、子宫内膜、骨肉瘤、前列腺、和神经母细胞瘤。
[0048]
另一个实施方式中,所述癌症为her2阳性癌症、或pd-1阳性癌症。
[0049]
另一个实施方式中,所述过敏性疾病为过敏性鼻炎(ar)或哮喘。
[0050]
另一个实施方式中,所述肝脏疾病为酒精性脂肪肝疾病或非酒精性脂肪肝疾病(nafld)。nafld选自:脂肪变性、非酒精性脂肪性肝炎(nash)、nash-相关性纤维化、和nash-相关性硬化。
[0051]
再另一方面中,本发明涉及一种根据本发明化合物或其药学上可接受的盐在制造药物中的用途,所述药物用于为有此需要的个体治疗可因tlr7和/或tlr8的活化作用而提供益处的疾病或病症。
[0052]
又另一方面中,本发明涉及一种根据本发明化合物或其药学上可接受的盐在制造药物中的用途,所述药物用于为有此需要的个体激活免疫反应,可以有效对抗病毒感染、肿瘤、过敏性疾病、或肝脏疾病。
[0053]
由下文优选实施方式的说明配合下文图式,即可了解这些及其他方面,但仍可在不偏离本公开新颖观念的精神与范围下,可以进行变化与修饰。
[0054]
附录的图式说明本发明的一个或多个实施方式,并配合文字说明来解释本发明原理。若可能时,会在图式全文中采用相同附图标记来指示实施方式的相同或类似元素。
附图说明
[0055]
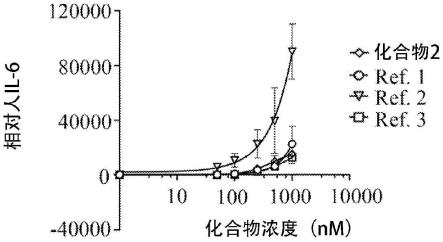
图1a至图1c示出受到各种浓度的试验化合物(化合物2、9与10)及参考化合物(ref.1-3)刺激的人pbmc的相对il-6诱导作用。化合物ref.1为瑞喹莫特(resiquimod)(一种tlr7/8双重激动剂)。化合物ref.2为1-(4-氨基-2-丁基-1h-咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇(一种tlr7/8双重激动剂)。化合物ref.3为vtx2337(一种tlr8激动剂)。
[0056]
图2a至图2c示出受到各种浓度的试验化合物与参考化合物刺激的人pbmc的相对il-12p70诱导作用。试验化合物与参考化合物与图1a至图1c相同。
[0057]
图3a至图3c示出受到各种浓度的试验化合物与参考化合物刺激的人pbmc的相对ip-10诱导作用。试验化合物与参考化合物与图1a至图1c相同。
具体实施方式
[0058]
定义
[0059]
除非另有其他说明,否则本文所采用所有技术与科学术语均具有本发明所属领域的普通技术人员所常规理解的含义相同的含义。此外,下列定义例示及界定用于说明本发明的各种术语的意义与范围。
[0060]
本技术所采用命名法依据iupac系统命名法,除非另有其他说明。
[0061]
本文所采用“一个”或“一种”指一个或超过一个(亦即至少一个)的文章中的语法对象。例如,“一元素”意指一个元素或超过一个元素。此外,术语“包括(including)”亦可采用如“include”、“includes”、和“included”其他形式,没有限制。
[0062]
术语“羟”或“羟基”意指基团-oh。
[0063]
术语“烷基”单独或与其他基团组合时,指1至20个碳原子,特定言之,1至16个碳原子,更特定言之,1至10个碳原子的支链或直链单价饱和脂肪族烃基。术语“烷基”亦涵括如下文说明的低级烷基。
[0064]
术语“低级烷基”或“c
1-6-烷基”单独或组合时,代表具有1至6个碳原子的直链或支链烷基,特定言之,具有1至5个碳原子的直链或支链烷基,及更特定言之,具有1至4个碳原子的直链或支链烷基。直链或支链c
1-6
烷基的实例为甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、异构性戊基(例如,正戊基、异戊基、1-甲基丁基、叔戊基、新戊基)、与异构性己基(例如,正己基、3-己基、2-甲基-1-戊基、3-甲基-1-戊基、4-甲基-1-戊基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、2-甲基-3-戊基、3-甲基-3-戊基、2,2-二甲基-1-丁基、2,3-二甲基-1-丁基、3,3-二甲基-1-丁基、2-乙基-1-丁基、2,3-二甲基-2-丁基或3,3-二甲基-2-丁基)。优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、正己基、4-甲基-1-戊基、与3,3-二甲基-1-丁基。
[0065]
术语“羟基-c
1-6-烷基”指如上述定义的低级烷基,其中所述低级烷基中至少一个氢原子被羟基取代。特别值得注意的羟基-c
1-6-烷基为羟基甲基、2-羟基乙基、3-羟基丙基、4-羟基丁基或2-羟基-2-甲基丙基。一个实施方式中,羟基-c
1-6-烷基为2-羟基-2-甲基丙基。
[0066]
术语“c
1-6-烷氧基”指基团r
’‑
o-,其中r’为如上述定义的低级烷基。c
1-6-烷氧基的实例为甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基、叔丁氧基。优选为甲氧基、乙氧基、或正丙氧基。
[0067]
术语“c
1-6-烷氧基-c
1-6-烷基”指如上述定义的低级烷基,其中低级烷基中至少一个氢原子被如上述定义的c
1-6-烷氧基取代。特别值得注意的c
1-6-烷氧基-c
1-6-烷基为甲氧基甲基、2-甲氧基乙基、乙氧基甲基与2-乙氧基乙基,以乙氧基甲基最特别值得注意。
[0068]
术语“卤”或“卤素”本身或作为另一个取代基的一部分,除非另有其他说明,否则指氟(f)、氯(cl)、溴(br)、或碘(i)原子。更特定言之,卤素指氟或氯。最特定言之,卤素指氟。此外,如“卤代烷基”的术语意指包括单卤代烷基与多卤代烷基。
[0069]
术语“c
1-6-卤代烷基”或“卤素-c
1-6-烷基”指如上述定义的低级烷基,其中所述低级烷基中至少一个氢原子被至少一个卤原子取代。特定言之,c
1-6-卤代烷基为c
1-6-单卤代烷基、c
1-6-二卤代烷基或c
1-6-三卤代烷基。更特定言之,c
1-6-卤代烷基为c
1-6-三卤代烷基。特别值得注意的c
1-6-卤代烷基为三氟甲基、2,2,2-三氟乙基、3,3,3-三氟丙基、4,4,4-氟丁基、5,5,5-三氟戊基、6,6,6-三氟己基、3,3,3-三氟-2-甲基丙基、4,4,4-三氟-3-甲基丁基与5,5,5-三氟-4-甲基戊基,以4,4,4-氟丁基、5,5,5-三氟戊基或3,3,3-三氟-2-甲基丙基更特别值得注意。
[0070]
术语“c
1-6-卤代烷基-o-c
1-6-烷基”或“c
1-6-卤代烷氧基-c
1-6-烷基”意指如上述定义的低级烷基,其中低级烷基中一个氢原子被c
1-6-卤代烷氧基置换。例如,c
1-6-卤代烷基-o-c
1-6-烷基可为-ch
2-ch
2-o-ch
2-cf3、-ch
2-ch
2-o-ch
2-ch
2-cf3、-ch
2-o-ch
2-cf3、-ch
2-o-ch
2-ch
2-cf3、或-ch
2-o-ch
2-ch
2-ch
2-cf3。
[0071]
术语“c
1-6-卤代烷基-s-c
1-6-烷基”或“c
1-6-卤代烷基硫基-c
1-6-烷基”意指如上述定义的低级烷基,其中低级烷基中一个氢原子被c
1-6-卤代烷基硫基基团取代。例如,c
1-6-卤代烷基-s-c
1-6-烷基可为-ch
2-ch
2-s-ch
2-cf3、-ch
2-ch
2-s-ch
2-ch
2-cf3、-ch
2-s-ch
2-cf3、-ch
2-s-ch
2-ch
2-cf3或-ch
2-s-ch
2-ch
2-ch
2-cf3。
[0072]
术语“c
1-6”与“(c
1-c6)”可以交换使用。
[0073]“c
1-6”或“(c
1-c6)”意指1至6范围内的所有整数单位量均明确揭示为本发明的一部分。因此,包括c1、c2、c3、c4、c5、c6;(c
1-c2)、(c
1-c3)、(c
1-c4)、(c
1-c5)、(c
1-c6);(c
2-c3)、(c
2-c4)、(c
2-c5)、(c
2-c6);(c
3-c4)、(c
3-c5)、(c
3-c6);(c
4-c5)、(c
4-c6);与(c
5-c6)单位量均为本发明的实施方式。
[0074]
术语“取代基”意指置换母分子的氢原子的原子或原子基团。
[0075]
术语“芳基”意指多不饱和芳香烃取代基,其可为单环或多环(优选为1至3个环),它们可稠合在一起(亦即稠合环芳基)或共价连接。稠合环芳基指多个环稠合在一起,其中稠合环中至少一个环为芳基环。
[0076]
式(i)化合物可形成药学上可接受之盐。术语“药学上可接受的盐”指保留游离碱或游离酸的生物效力与性质,且不为生物或其他方面不期望的那些盐。药学上可接受的盐包括酸及碱的加成盐。所述盐为例如,式(i)化合物与生理上兼容的矿物酸的酸加成盐,矿物酸例如为盐酸、氢溴酸、硝酸、碳酸、硫酸、亚硫酸、或磷酸;或与有机酸的酸加成盐,所述有机酸如甲磺酸、乙磺酸、对甲苯磺酸、甲酸、乙酸、丙酸、乙醇酸、丙酮酸、草酸、乳酸、三氟乙酸、柠檬酸、富马酸、马来酸、丙二酸、酒石酸、苯甲酸、肉桂酸、扁桃酸、双羟萘酸、琥珀酸、
therapeutics in adult healthy volunteers)”中所公开的“人类等效剂量”可由下列公式计算得到:
[0086]
hed=动物剂量(mg/kg)
×
(动物体重(kg)/人类体重(kg))
0.33
。
[0087]
实施例
[0088]
本发明化合物制法
[0089]
一般合成反应图
[0090]
式(i)化合物可依据下列一般合成方案制造。
[0091][0092][0093]
通常,一种制造根据本发明式(i)化合物的方法包括步骤:
[0094]
(a)式(i-a)化合物
[0095][0096]
与nh
2-r1,在催化剂的存在下反应,得到式(i-b)化合物
[0097][0098]
其中r1与r3如上述定义;
[0099]
(b)式(i-b)化合物在还原剂的存在下还原,得到式(i-c)化合物;
[0100][0101]
其中r1与r3如上述定义;
[0102]
(c)式(i-c)化合物与cl-c(o)-r2反应,得到式(i-d)化合物
[0103][0104]
其中r1、r2与r3如上述定义;及
[0105]
(d)式(i-d)化合物与氨溶液反应,得到所需的式(i)化合物
[0106][0107]
其中r1、r2与r3如上述定义。
[0108]
步骤(a)中,式(i-b)化合物制法可在含三乙基胺(tea)的二氯甲烷(dcm)溶液的存在下,在40℃至60℃之间的温度,优选在50℃至60℃之间,或在50℃下反应至少1小时,优选为1至4小时,更优选为2至3小时。
[0109]
步骤(b)中,式(i-b)化合物可在fe/nh4cl的存在下,在70℃至100℃之间的温度,优选在80℃至90℃之间,或在80℃下还原至少1小时,优选1至4小时,更优选2至3小时。
[0110]
步骤(c)中,式(i-c)化合物可溶于乙腈(acn)中,然后与cl-c(o)-r2于15℃至35℃之间的温度,或于室温反应至少1小时,优选为1至5小时,更优选为2至4小时。
[0111]
步骤(d)中,可在nh3的甲醇溶液的存在下,在120℃至180℃之间的温度,优选130℃至160℃之间,或在150℃下反应至少24小时,优选为30至50小时,更优选为35至40小时,得到所需的式(i)化合物。
[0112]
根据本发明式(i)化合物可采用上述一般合成方案制备。表2列出本发明化合物。为了说明目的,代表性化合物的合成法更详细说明于下文中。
[0113]
中间化合物a的合成法
[0114][0115]
化合物a1溶于含有三乙基胺(tea)的二氯甲烷(dcm)中,然后于50℃,使用伯胺化合物a2选择性置换2小时,产生硝基喹啉化合物a3。然后,由化合物a3与etoh/h2o混合,与fe/nh4cl于80℃进行还原反应2小时,产生中间化合物a(方案a)。所得中间化合物a用于下一个实施例。
[0116]
试验化合物的分析
[0117]
所有反应的完成度均采用薄层层析法(tlc),使用merck 60f
254
硅胶玻璃背板(20x 20cm)监测。所得图谱则在uv照射(254nm)下目视检测。
[0118]
分析试验化合物时,于varian mercury-400光谱仪上记录1h nmr图谱,化学位移以每百万分之一(ppm,δ)记录。多峰性记录为s(单峰)、br s(宽峰)、d(双峰)、t(三峰)、q(四峰)、quin(五峰)、sxt(六峰)、与m(多峰)。偶合常数(j)以赫兹表示。液相层析
–
质谱(lc-ms)中,电喷雾质谱(esms)采用waters质谱仪,以m/z值记录。高效液相层析法(hplc)中,最终化合物的纯度采用waters acquity arc系统,使用于40℃操作的c18柱(waters xselect hss t3柱,5μm,4.6mm x 250mm)测定。使用含有0.1%三氟乙酸的水与甲醇作为移动相进行洗脱。移动相的流速为1ml/min。于210-400nm下检测峰。
[0119]
化合物no.1的合成法
[0120]
1-(4-氨基-2-丙基-1h-咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇(化合物1)依据方案1合成。
[0121][0122]
中间化合物a溶于乙腈(acn),与丁酰氯(化合物no.1a)于室温反应3小时,产生对应胺化合物no.1b。由化合物no.1b与氨溶液(7n甲醇溶液)于150℃反应36小时,结果形成咪唑环,并置换4-氯取代基,产生化合物no.1。粗产物经柱层析法纯化,得到标题化合物的米色固体。1h nmr(400mhz,dmso-d6)δ8.26(d,j=8.0hz,1h),7.57(d,j=8.0hz,1h),7.36(t,j=8.0hz,1h),7.18(t,j=8.0hz,1h),6.40(s,2h),4.78(s,1h),4.58(br s,2h),3.00(t,j=7.5hz,2h),1.82(sxt,j=7.4hz,2h),1.17(s,6h),1.00(t,j=7.4hz,3h).lcms(esi)m/z 299.3[m h]
。hplc纯度:99.65%。
[0123]
化合物no.2的合成法
[0124]
1-(4-氨基-2-戊基-1h-咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇(化合物2)依据方案2合成。
[0125][0126]
中间化合物a溶于乙腈(acn),然后与己酰氯(化合物no.2a)于室温反应3小时,产生对应胺化合物no.2b。由化合物no.2b与氨溶液(7n于甲醇)于150℃反应36小时,结果形成咪唑环,并置换4-氯取代基,产生化合物no.2。粗产物经柱层析法纯化,产生标题化合物的米色粉末。1h nmr(400mhz,dmso-d6)δ8.25(d,j=7.8hz,1h),7.57(d,j=7.8hz,1h),7.36(t,j=7.8hz,1h),7.18(t,j=7.8hz,1h),6.40(s,2h),4.78(s,2h),4.54(br s,2h),3.01
(t,j=7.8hz,2h),1.80(quin,j=7.2hz,2h),1.49-1.28(m,4h),1.17(s.,6h),0.89(t,j=7.2hz,3h).lcms(esi)m/z 327.4[m h]
。hplc纯度:99.42%。
[0127]
化合物no.9的合成法
[0128]
1-(4-氨基-2-(4,4,4-三氟丁基)-1h-咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇(化合物no.9)依据反应图4合成。
[0129][0130]
中间化合物a溶于乙腈(acn),与5,5,5-三氟戊酰氯(化合物no.9a)于室温反应3小时,产生对应胺化合物no.9b。由化合物no.9b与氨溶液(7n于甲醇)于150℃反应36小时,结果形成咪唑环,并置换4-氯取代基,产生化合物no.9。粗产物经柱层析法纯化,得到标题化合物的白色粉末。1h nmr(400mhz,dmso-d6)δ8.26(d,j=7.8hz,1h),7.58(d,j=7.8hz,1h),7.37(t,j=7.8hz,1h),7.19(t,j=7.8hz,1h),6.44(s,2h),4.80(s,1h),4.55(br s,2h),3.12(t,j=7.5hz,2h),2.48-2.34(m,2h),2.06(quin,j=7.5hz,2h),1.17(s.,6h).lcms(esi)m/z 367.4[m h]
。hplc纯度:96.95%。
[0131]
化合物no.10的合成法
[0132]
1-(4-氨基-2-(5,5,5-三氟戊基)-1h-咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇(化合物no.10)依据方案5合成。
[0133][0134]
中间化合物a溶于乙腈(acn),与6,6,6-三氟己酰氯(化合物no.10a),于室温反应3小时,产生对应胺化合物no.10b。由化合物no.10b与氨溶液(7n甲醇溶液)于150℃反应36小时,结果形成咪唑环,并置换4-氯取代基,产生化合物no.10。粗产物经柱层析法纯化,得到标题化合物的白色粉末。1h nmr(600mhz,dmso-d6)δ8.26(d,j=8.4hz,1h),7.57(dd,j=8.4,1.2hz,1h),7.36(ddd,j=8.4,7.0,1.3hz,1h),7.20(ddd,j=8.4,7.0,1.3hz,1h),6.37(s,2h),4.48(s,1h),4.55(br s,2h),3.06(t,j=7.8hz,2h),2.37-2.29(m,2h),1.90(quintet,j=7.8hz,2h),1.64(quintet,j=7.8hz,2h),1.17(br s,6h).lcms(esi)m/z 381.4[m h]
。hplc纯度:99.34%。
[0135]
采用上述类似的合成途径,很容易制备表2所列的其他化合物。例如,化合物no.3可采用类似合成化合物1的程序,但改用3-甲基丁酰氯替代丁酰氯来制备。化合物no.22采
用类似合成化合物no.9的程序,但改用3-氨基-2-氯-4-((2-羟基-2-甲基丙基)氨基)喹啉-7-醇替代中间化合物a来制备。
[0136]
活体外tlr7与tlr8激动活性分析
[0137]
分析htlr7激动活性时,使用经过分泌型胚胎碱性磷酸酶(seap)报导子转染的hek-blue htlr7细胞,接种3
×
104个细胞/孔。使用各种不同浓度的试验化合物(化合物no.1、2、9、10)处理细胞。使用两种参考化合物进行比较:ref.1(瑞喹莫特,一种tlr7/8双重激动剂)与ref.2(1-(4-氨基-2-丁基-1h-咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇)。ref.2为比瑞喹莫特更强效的tlr7/8双重激动剂。参见ganapathi l.等人(2015),plos one,10(8):e0134640)。seap报导子特别设计专用于条件细胞培养基中测定转染细胞的分泌型胎盘ap(碱性磷酸酶)。使用hek-blue htlr7细胞,通过受到nf-κb激活后,被tlr7刺激的seap来测定tlr7的生物活性。
[0138]
分析htlr8激动活性时,使用经过seap报导子转染的hek-blue htlr8细胞,接种3
×
104个细胞/孔。使用各种不同浓度的试验化合物(化合物no.1、2、9、10)处理细胞。使用两种参考化合物ref.1和ref.2进行比较。使用hek-blue htlr8细胞,通过受到nf-κb激活后,被tlr8刺激的seap来测定tlr8的生物活性。
[0139]
如上述seap报导子基因分析法中,使用水作为阴性对照组。于37℃及5%co2培养约16小时后,使用分光光度计,在波长635nm测定seap。使用四参数逻辑曲线(sigmaplot,第9.0版)拟合剂量-效应曲线。计算试验化合物与参考化合物的ec
50-值。表1出示分析tlr7与tlr8激动活性的结果。
[0140]
表1
[0141][0142]
表1显示,所有试验化合物均具有tlr7与tlr8双重激动活性。其中以化合物no.2为最强效的tlr7/8双重激动剂,因为其tlr7与tlr8激动活性具有低的ec
50
。此外,化合物no.2、9、10的tlr8 ec
50
与tlr7 ec
50
的比值低于两种参考化合物,这表示这些化合物在极接近的效力比值下有利于激活tlr7与tlr8,并准确地调控tlr7与tlr8的活化作用。
[0143]
离体细胞因子型态分析
[0144]
采用三种试验化合物(化合物no.2、9、10)评估对诱导细胞因子的效应。采用三种
参考化合物进行比较:ref.1(瑞喹莫特,一种tlr7/8双重激动剂)、ref.2(1-(4-氨基-2-丁基-1h-咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇,一种tlr7/8双重激动剂)与ref.3(美力莫特(motolimod)或vtx2337,一种tlr8激动剂)。
[0145]
来自四位正常成人自愿者的低温保存人pbmc购自来自四位正常成人自愿者的低温保存人pbmc购自取pbmc于37℃解冻10分钟,于室温及300
×
g离心5分钟。颗粒化的pbmc转移至包含10%fbs、1%psa的rpmi-1640培养基中,于37℃及5%co2培养。
[0146]
将试验化合物与参考化合物分别溶于dmso中后,使用pbs稀释25倍,制成0.1mm浓度的母液。收集预培养的pbmc,再度悬浮于包含10%fbs与1%psa的新鲜rpmi-1640培养基中。在96-孔盘的各孔中添加约1
×
105个pbmc,使用0、20或1000nm的试验化合物,在37℃及5%co2潮湿培养箱中刺激24h。培养物上清液保存在-20℃,分析tlr7-与tlr8-介导的细胞因子诱导作用。依据制造商指示,进行procartaplex
tm
免疫分析法(invitrogen)来定量培养物上清液中的人il-6、il-12p70、ip-10。简言之,培养物上清液样本于冰上解冻,转移至微滴定盘上。在样本中添加偶联磁珠的针对靶标细胞因子的抗体,以捕捉分析物。利用接合生物素的抗体特异性检测固定化的靶标细胞因子,然后标记抗生物链菌素-藻红蛋白(streptavidin-phycoerythrin)(pe)。采用luminex
tm 200
tm
分析仪检测及鉴定标记pe的磁珠。使用xponent
tm 3.1软件进行数据获取、处理及分析。靶标细胞因子相对于其基线细胞因子水平标准化,以细胞因子相对值表示。
[0147]
图1a至图1c示出人pbmc受到各种不同浓度的试验化合物(化合物no.2、9与10)及参考化合物(ref.1-3)刺激后的相对il-6诱导作用。化合物no.2、9与10均显示低的il-6诱导活性,其类似ref.1与3。这些结果显示,本发明化合物不过度诱导il-6表达,已知il-6的持续合成失调造成慢性发炎及自体免疫的病理上影响。反之,ref.2在超过100nm浓度,尤其在超过1000nm处理时,诱导高的il-6表达,这表示ref.2因为过度诱导il-6表达的风险而不适合用于开发药物。依据化合物2、9、10与ref.2的结构相似性,并未预期到本发明化合物的低的il-6诱导活性。
[0148]
图2a至图2c示出人pbmc受到各种不同浓度的试验化合物(化合物no.2、9与10)及参考化合物(ref.1-3)刺激后的相对il-12p70诱导作用。化合物no.2、9与10均显示高的il-12p70诱导活性,其中已知细胞因子il-12介导加强nk细胞及cd8
细胞毒性t细胞的细胞毒性活性,及抗血管新生活性。
[0149]
图3a至图3c示出人pbmc受到各种不同浓度的试验化合物(化合物no.2、9与10)及参考化合物(ref.1-3)刺激后的相对ip-10诱导作用。化合物no.2、9与10均显示高的ip-10诱导活性,其中已知细胞因子ip-10涉及抑制血管新生,并与抗肿瘤活性有关。
[0150]
总言之,本发明化合物可以同时激活人tlr7与tlr8,提高il-12与ip-10表达,不过度诱导不期望之il-6表达。
[0151]
表2
[0152]
[0153]
[0154]
[0155]
[0156][0157]
toll样受体(tlr)黏接作用同时激活先天性与后天性免疫系统,在抗病毒及抗肿瘤免疫力上扮演重要角色。tlr激动剂的治疗性潜力包括用作疫苗、化疗、或单方疗法的佐剂。参见engel等人(2011),expert rev clin pharmacol.,4(2):275
–
289。
[0158]
tlr的激动剂已广泛用于适用于哮喘/过敏性鼻炎(ar)患者的治疗或预防制剂。以azd8848(一种tlr7激动剂)与vtx-1463(一种tlr8激动剂)作为单方疗法已显示可以有效解除ar患者的症状。咪喹莫特(imiquimod)或r837(一种tlr7激动剂)为fda核准的药物,用于治疗皮肤基底细胞癌瘤、光化性角化病、及外生殖器疣,及许多建议用于其他疾病(如黑色素瘤)的药品仿单标示外使用的效益。咪喹莫特亦在呼吸道过度反应(ahr)的鼠类与猪两种模型中显示支气管扩张效应。咪喹莫特亦可促进抗病毒防御力,并保护对抗病毒所诱导呼吸道功能障碍。其似乎为针对病毒所诱导哮喘的值得关注的药物。瑞喹莫特(一种tlr7/8双重激动剂)可有效抑制急性哮喘。参见aryan等人(2014),int arch allergy immunol.,164:46-63。
[0159]
认为toll样受体7(tlr7)与肝脏疾病之间可能有关联性。已证实tlr7信号传导在
肝脏纤维化中的角色。咪喹莫特(tlr7配体)减弱由不饱和脂肪酸(ufa)诱导的脂肪累积,并减少被ufa诱导的脂质过氧化产物。使用敲除tlr7的小鼠进行的活体内实验所产生的结果与活体外实验一致。这些结果支持tlr7可藉由诱导自噬作用及从肝脏释放igf-1来预防非酒精性脂肪肝疾病(nafld)进展。这些结果为治疗nafld提供了治疗手段。参见kim等人(2016),scientific reports,6:27849。
[0160]
tlr7激动剂的抗肿瘤活性已出现在以下肿瘤类型中,包括(但不限于):鳞状癌瘤、前列腺癌、膀胱癌、乳癌、黑色素瘤、胶质瘤、急性骨髓性白血病、乳癌、t-细胞淋巴瘤、及胰脏癌。tlr8的抗肿瘤活性已出现在以下肿瘤类型中,包括(但不限于):胶质瘤、急性骨髓性白血病、乳癌、t-细胞淋巴瘤、淋巴瘤、胰脏癌、及结肠癌。参见chi等人(2017)front pharmacol.,8:304。
[0161]
tlr7/8激动剂的治疗潜力/用途靶向不同疾病,包括(但不限于):治疗病毒诱导的病灶(由乳突病毒及单纯疱疹病毒引起)、原发性肿瘤、皮肤转移、抗病毒(hcv)、及慢性淋巴球性白血病。参见luke等人(2009),pharmacol rev.,61(2):177-197。
[0162]
tlr7/8激动剂通过依赖toll样受体(tlr)7与8的途径刺激细胞,造成激活可以有效对抗病毒与肿瘤病灶的免疫反应。瑞喹莫特为一种用于病毒皮肤病灶及皮肤癌(如光化性角化病(ak))的局部用药物。ak亦称为上皮内scc,为早期皮肤癌,有可能发展成皮肤的侵袭性鳞状细胞癌瘤(scc)。meyer等人(2013),expert opin investig drugs,22(1):149-159)。总结本发明化合物为tlr7与tlr8双重激动剂。这些化合物具有诱导il-12与ip-10表达的活性。tlr 7/8双重激动剂有潜力用于免疫反应调节剂的药物。这些化合物可用于治疗患者中可因激活tlr7和/或tlr8而提供效益的疾病或病症,如用于为有此需要的个体治疗病毒感染、癌症、和/或过敏性疾病,或用于激活可有效对抗病毒感染、肿瘤、和/或过敏性疾病的免疫反应。
[0163]
本说明书中所有引用和讨论的参考文献的完整内容已以引用之方式并入本文中,该引用的程度就如同各参考文献已个别地以引用的方式并入一般。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。