治疗肾上腺皮质癌与库欣综合征的口服施用的包含米托坦的药物组合物
1.肾上腺皮质肿瘤或肾上腺皮质癌是一种在肾上腺皮质水平发展的罕见的癌性肿瘤(else t等,endocr rev 2014,35:282-326;fassnacht m等,nat rev endocrinol 2011,7:323-335)。年发病率估计为每年每百万居民0.7至2例新病例(fassnacht m等,j clin endocrinol metab,2013,98:4551-4564),占癌症死亡人数的0.04%至0.2%。
2.肾上腺皮质癌最常发生在40至50岁的成年人中,但也发生在15岁以下的儿童中。这种肿瘤在女性而非男性中更常见,原因不明,但这种疾病的预后差,因为它诊断较晚,并且其药物治疗非常无效,病例的5年生存率低于40%(assie g等,j clin endocrinol metab,2007,92:148-154)。肿瘤的完全手术切除表示完全治愈的最佳机会。除了手术之外,还可以提供辅助治疗。这包括口服施用杀虫剂ddt、o'-ddd、p'-ddd的衍生物(邻或对二氯-二苯基-二氯乙烷或米托坦(mitotane)),它是唯一一种批准用于肾上腺皮质癌的药物,其化学式如下。
3.[化学式1]
[0004][0005]
米托坦的化学结构
[0006]
类似地,在无法手术的病理学晚期形式中,仅提出了米托坦,因为迄今为止它仍然是对于治疗肾上腺皮质肿瘤具有部分细胞毒性功效的唯一分子。在r.h.moy团队于1960年进行第一次临床研究后(dm bergenstal等,chemotherapy of adrenocortical cancer第53卷,4,1960),药物特制品(specialty)自2004年以来一直是欧洲ma的主题,并且自1970年以来一直是美国的ma,官方说明“治疗无法手术患者的晚期形式、转移形式或复发形式的肾上腺癌”并作为晚期疾病的姑息治疗。
[0007]
库欣病(cushing’s disease)是由分泌促肾上腺皮质激素(acth)的垂体瘤引起的,并且其为内源性皮质醇分泌过多的最常见原因(lacroix a等,lancet.2015;386(9996):913-927.doi:10.1016/s0140-6736(14)61375-1;biller bmk等,j clin endocrinol metab.2008;93(7):2454-2462.doi:10.1210/jc.2007-2734;pivonello r等,endocr rev.2015;36(4):385-486.doi:10.1210/er.2013-1048)。与一般人群相比,皮质醇过多症可以导致显著的致病率和早逝(pivonello r等,endocrinol metab clin n am.2008;37(1):135-149.doi:10.1016/j.ecl.2007.10.010)。库欣病治疗的主要目标为使皮质醇水平正常化并且逆转皮质醇过多症的体征和症状(biller bmk等,j clin endocrinol metab.2008;93(7):2454-2462.doi:10.1210/jc.2007-2734.;pivonello r等,endocr rev.2015;36(4):385-486.doi:10.1210/er.2013-1048)。一线治疗为经蝶窦手术(biller bmk等,j clin endocrinol metab.2008;93(7):2454-2462.doi:10.1210/
jc.2007-2734),尽管这并不总是成功的(tritos na等,nat rev endocrinol.2011;7(5):279-289.doi:10.1038/nrendo.2011.12),而且患者在表面上成功的手术后几年可能会复发(dimopoulou c等,eur j endocrinol.2013;170(2):283-292.doi:10.1530/eje-13-0634)。
[0008]
目前在临床实践中使用了许多医学疗法以治疗库欣病。这些包括米托坦(抗肾上腺素剂)、帕瑞肽(pasireotide,生长激素抑制素类似物)、卡麦角林(cabergoline,多巴胺受体激动剂)、美替拉酮(metyrapone)和酮康唑(ketoconazole,肾上腺类固醇生成抑制剂)以及米非司酮(mifepristone,糖皮质激素受体拮抗剂)。由于并非所有库欣病患者都从可用的治疗中获得足够的益处,因此总是需要新的制剂。
[0009]
当米托坦以常规片剂的形式在人类中施用时,其口服生物利用度较差,施用3个月后口服生物利用度的值为35%至40%,也就是说,由于其水溶性非常差(溶解度:25℃时为1.29
×
10-7
mol/l),该产品的60%以未代谢的形式存在于粪便中(hahner s&fassnacht m.,curr.opinion.investig.drugs 2005,6:386-394;igaz p.等,med chem 2008,15:2734-2747)。
[0010]
为了有效,这种活性分子必须达到至少14mg/l的血药浓度(terzolo m等,j clin endocrinol metab 2000,85:2234-2238;terzolo m等,curr opin endocrinol diabetes obes 2014,21:159-165)。这只有在平均3个月的治疗后才能实现,在此期间对患者没有治疗益处。这种延迟时间至少部分是由于这样的事实:米托坦以可能为血药浓度的200倍的浓度优先在脂肪中积累,从而降低了其生物利用度与其治疗效果。这种在脂肪中的积累,结合低的生物利用度,使得有必要将对患者施用的剂量增加到显著水平(每天10至15片)。因此当米托坦超过20mg/l时,已经鉴定了严重的副作用,其中最常见的是与分子吸收不良和神经障碍(共济失调、抑郁综合征
……
)直接相关的消化障碍(恶心、呕吐和腹泻)。最近,还报道了口腔与外阴阴道苔藓样反应以及脑病(schmouchkovitch a.等,medicine(baltimore)2017;96(2):e5057;betty y.lung等,j.clin oncol 33,2015(增刊:abst 4105);e.pare等,the oncologiste 2017,22:1-2)。
[0011]
脂质制剂的使用是一种重新配制米托坦的策略,例如由表面活性剂、助溶剂和油组成的自乳化系统(ses)。它们本身不是乳液,但在胃的水性介质中,在温和搅拌下,它们容易形成稳定的亚微米级乳液。这些盖仑制剂具有特定的性质。它们可以改变胃肠内容物的组成,与膜转运蛋白相互作用和/或刺激活性成分通过淋巴途径的转运。口服施用后,这些制剂的吸收可以通过淋巴系统进行,从而避免肝脏首过效应。淋巴流速比血液流速慢,这可以延长活性成分的吸收(singh等,crit rev ther drug carrier syst,2009,26,427-521)。
[0012]
因此,基于米托坦的ses提供了改善米托坦的口服生物利用度的可能性,允许减少具有治疗益处的治疗时间并且限制每天施用的片剂的数量。
[0013]
因此,基于这种配制策略,市场上已经出现了若干种此类药品,施用平均剂量的药物,如(环孢菌素a)和(洛匹那韦(lopinavir)和利托那韦(ritonavir))特制品,或较低剂量的药物,如(骨化三醇)和(度他雄胺)。但是,迄今为止,ses仅以软胶囊的形式上市销售,虽然制备简单,但具有几个缺点。例如,由于生产率低而导致高的制造成本,在高填充率时胶囊中滞留空气,以及ses组分可能与胶囊外壳不
相容,这可能会降低产品的使用寿命(cole,et等,adv.drug delivery.rev.2008,60,747-756)。
[0014]
已经进行了三种尝试来解决与基于米托坦的自乳化系统(ses)的制剂相关的问题。
[0015]-attivi与合作者(attivi等,drug dev ind pharm.2010年4月,36(4):421-7)开发了第一个米托坦自乳化系统(ses),其包含溶解在由90、20和cremophor(1/3:1/3:1/3)的均匀混合物组成的基质中的米托坦。
[0016]
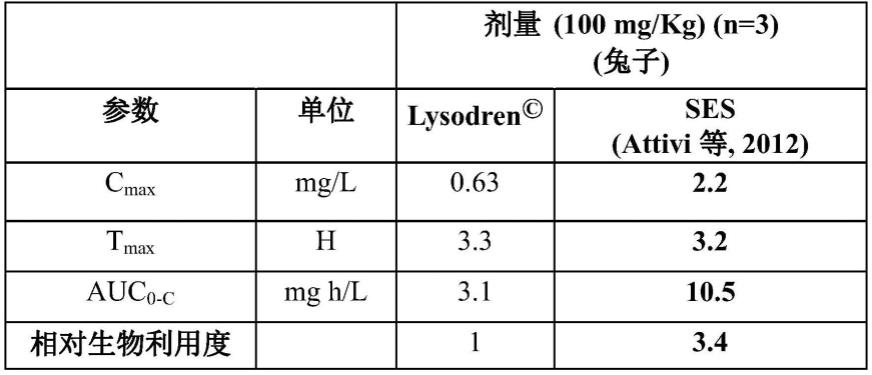
兔子中进行的药代动力学研究已显示,与特制品相比,生物利用度提高了3倍,见(表1)和[图1a]。
[0017]
[表1]
[0018][0019]
[表1]根据attivi等人的药代动力学参数(在兔子中)
[0020]-第二,专利ep2435022 b1涉及一项发明,该发明描述了一种软胶囊形式的米托坦ses,其包含溶解在基质中的米托坦,该基质包含:
[0021]-丙二醇单辛酸酯;
[0022]-丙二醇二癸酸酯;
[0023]-聚氧乙烯脱水山梨醇单油酸酯。
[0024]
在狗中实施的生物利用度研究也已显示,与特制品相比,其改善程度提高了3倍[图1b]。为了减少3个月的治疗等待期并减少每天的药物摄入量,生物利用度乘以3倍的提高仍然非常低。
[0025]-以及最后,专利wo2012/071043a1,该发明描述了基于ses概念的另一种米托坦制剂,其具有超过70%的表面活性剂,并且以软胶囊形式存在。
[0026]
未进行生物利用度研究。
[0027]
因此,挑战在于开发一种新的米托坦制剂,其与ses相比,获得更好的生物利用度,以减少治疗等待期(这无疑是米托坦最大的问题)、血浆水平的个体间和个体内部变化以及每天的药物摄入量。
[0028]
开发固体剂型的脂质系统(干乳剂(de,dry emulsion))是另一种制剂策略,包括提高生物利用度在内,与液体或半固体系统相比,它还提供了其它优点。此类系统涉及主要将液体脂质固化成若干个单元,如粉剂、颗粒剂、片剂、迷你片剂以及来自该粉末的丸剂。因
control release,2009,140,86-94)、海藻糖、甘露糖醇(hansen等,int j pharm,2004,287,55-66)和蔗糖(christensen等,eur j pharm biopharm,2002,53,147-153)))。
[0041]
干乳剂也可以通过从初级水包油乳剂中去除游离水、通过喷雾干燥(zhang等,int j pharm,2011,414,186-192)、通过冷冻干燥(ahmed等,eur j pharm sci,2008,35,219-225)或通过在真空下蒸发水相(zhang等,int j pharm,2011,415,293-300)来获得。喷雾干燥和冷冻干燥工艺是最广泛使用的。如此获得的粉末可直接用于填充胶囊,或进行处理,例如在非水介质中湿法制粒、压实或甚至压缩得到片剂的步骤(hansen等,int j pharm,2005,293,203-211)。当乳剂被再水化时,油滴被释放以再次形成水包油乳液。
[0042]
然而,并不容易实施de的配制;干燥仍然是非常关键的步骤。冷冻干燥是一个漫长、复杂、要求高且成本高(投资和能量消耗)的过程。因此,de具有一些缺点:乳剂干燥后得到的粉末通常体积大、有粘性、流动性差、易吸湿,这使得它们难以在没有额外处理的情况下操作(christensen等,int j pharm,2001,212,195-202)。
[0043]
本发明的一个目的是干乳剂(粉末)形式的米托坦新制剂的制备方法与用途以及其用于口服途径的用途。
[0044]
相当令人惊讶的是,本发明人已发现了一种制备方法,用于获得含有米托坦的干乳剂,同时避免通过吸附、冷冻干燥或雾化去除初级乳剂中所含的液相。
[0045]
发明人的工作已表明,可以配制干乳剂(esm)形式的米托坦的新制剂,其由油性物质和环糊精组成;所述油相为植物油或其混合物、动物油或其混合物和/或海产油(marine oil)或其混合物,并且它以低于50重量%的含量存在。所述药物的和兽用的组合物包含米托坦干乳剂的制剂,这种新的米托坦的制剂可以原样使用或用于填充胶囊、小袋(sachet)或棒(stick),也可以在有或没有制粒步骤的情况下,通过压片将其压制成片剂,并且允许通过滚圆挤出获得丸剂。
[0046]
因此,本发明的目的在于提供一种新的米托坦制剂,其以干乳剂(mde)的形式、可分散于水或生物介质中的粉末的形式存在,不含表面活性剂且不含有机溶剂,并且基于环糊精,所述环糊精选自α-环糊精、β-环糊精和γ-环糊精,并且环糊精衍生物,其选自:α-环糊精、β-环糊精和γ-环糊精的羟丙基化、甲基化、乙基化、磺丁基醚(sulphobutyl ether)或乙酰化衍生物,以及所述环糊精和所述环糊精衍生物的二元或三元混合物,并且它以高于45重量%的含量存在,以避免米托坦的重结晶和沉淀的现象。
[0047]
根据本发明的米托坦干乳剂(mde)的特征在于:它们由负载有米托坦的油性物质和环糊精或其混合物制成,含有或不含助溶剂,因此含有或不含吸收促进剂,所述吸收促进剂例如选自以下化合物:辛酸/癸酸甘油酯、聚乙二醇甘油羟基硬脂酸酯(macrogolglycerol hydroxystearate)、聚乙二醇甘油蓖麻酸酯(macrogolglycerol ricinoleate)(cremophor)、聚氧乙烯脱水山梨醇单油酸酯、二甘醇单乙醚、丙二醇单辛酸酯、无水乙醇和聚乙二醇800至300,并且它们以10-20重量%的含量存在;并且在添加水相后形成油包水(w/o)初级乳液,基本上是粉末形式的固体。
[0048]
一种制备适用于形成米托坦递送系统的米托坦干乳剂的方法,其包括:在含有或不含助溶剂的油相中溶解米托坦,在含有或不含吸收促进剂的所述油相中添加环糊精,添加水相以得到o/w初级乳剂,然后基于米托坦的干乳剂,干燥和分级含有比例分别低于50%、低于60%和高于6%的油、环糊精和米托坦的颗粒。
[0049]
实施例1:含有米托坦的w/o干乳剂(mde)的制备
[0050]
在一个步骤中,将负载有5g米托坦的25ml玉米油混合物和作为助溶剂的3ml乙醇引入行星式混合器(hobart型)中,以提高米托坦在油相中的溶解度。在搅拌下(1号变速器)和室温(25℃)添加42.5g分散在油相中的α-环糊精。在搅拌下(2号变速器)添加水相(5ml水)后形成w/o米托坦干乳剂。然后,将湿颗粒在振荡制粒机中校准(1μm网),然后在45℃的烘箱中干燥15分钟,直至水分含量为5%-6%并去除乙醇。获得了负载有6.8%米托坦的平均尺寸为800μm的颗粒。
[0051]
实施例2:具有吸收促进剂的含有米托坦的w/o干乳剂(mde)的制备
[0052]
如实施例1所述进行操作,但使用10-20%的cremophor或聚山梨醇酯80作为米托坦吸收促进剂。获得了负载有6.8%米托坦的平均尺寸为800μm的颗粒。
[0053]
实施例3:含有米托坦的w/o干乳剂(mde)的制备和生物医药评估-临床前研究
[0054]
已经在平均体重为350g的六只大鼠(charles)中评估了根据实施例1制备的干乳剂形式的米托坦(mde)的口服施用。创新配方的口服施用剂量为100mg/kg,并已与特制品(市售的对照药物)进行了比较。在固定时间采集了样品:0、1h、2h、3h、4h、5h、7h和9h。使用在干燥的肝素化管上采集的血液样品实施米托坦的血浆剂量。将这些样品离心并将上清液储存在温度为-20℃的玻璃溶血管中。通过用甲醇沉淀来纯化血浆。色谱分析(hplc)采用lichrospherc8色谱柱,直径为5μm,恒温40℃,采用等度(isocratic)流动相,其由乙腈和乙酸缓冲液(ph 3.2)的混合物(75:25)组成。流速为1.2ml/min。在234nm的波长处检测米托坦。对于9分钟的样品分析时间,保留时间为6分钟。
[0055]
与对照特制品相比,干乳剂形式的米托坦(mde)(根据本发明)的血药浓度见表2和[图2]中示出。
[0056]
[表2]
[0057]
[0058]
[表2]本发明的药代动力学参数(在大鼠中)
[0059]
得到的主要结果如下:
[0060]-曲线下面积(auc)是的28倍;
[0061]-与相比,最大时间(t
max
)减少了一半。
[0062]
相对于特制品,根据d.attivi发表的作品(attivi等,drug dev ind pharm.2010年4月;36(4):421-7)的米托坦干乳剂(mde)和专利ep2435022b1的米托坦干乳剂(mde)之间的结果分析在[图1]中显示:
[0063]-关于auc 0-inf:attivi(attivi等,drug dev ind pharm.2010年4月;36(4):421-7)开发的米托坦自乳化系统(ses)显示出接近3.4倍的提高,专利ep 2435022允许提高3.15倍,并且本发明允许获得接近19倍增加的auc 0-inf。
[0064]-关于auc 0t:根据专利ep 2435022开发的米托坦自乳化系统(ses)显示出2.75倍的提高,并且本发明允许获得接近4.9倍增加的auc 0-inf。
[0065]-关于相对生物利用度:attivi等人开发的米托坦自乳化系统(ses)显示出3.4倍的提高,并且本发明允许获得18倍增加的相对生物利用度。
[0066]-关于cmax:attivi等人开发的米托坦自乳化系统(ses)显示出3.5倍的提高,专利ep 2435022允许2.2倍的提高,并且本发明允许获得接近4.5倍增加的cmax。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。